Method Article
Murine Endoskopie für
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Kleintierbildgebung Techniken ermöglichen Serien diagnostische Untersuchungen und therapeutische Interventionen in vivo. Vor kurzem hat der Umfang der Anwendungen erheblich erweitert und umfasst gegenwärtig Beurteilung Colontumorentwicklung, Wundheilung und Kontrolle von Entzündungen. Dieses Protokoll zeigt diese verschiedenen Anwendungsmöglichkeiten der murinen Endoskopie.
Zusammenfassung
Mausmodelle werden häufig verwendet, um die Pathogenese von Erkrankungen des Menschen zu untersuchen und Diagnoseverfahren sowie therapeutische Interventionen präklinisch bewerten. Jedoch gilt Beurteilung von pathologischen Veränderungen erfordert oft die histologische Analyse, und wenn ex vivo durchgeführt, erfordert zum Tod des Tieres. Daher in konventionellen experimentellen Einstellungen sind intra-individuelle Follow-up-Untersuchungen nur selten möglich. Somit ist die Entwicklung von Maus-Endoskopie in lebenden Mäusen ermöglicht Ermittler zum ersten Mal sowohl direkt visualisieren die Magen-Darm-Schleimhaut und auch wiederholen Sie den Vorgang, um Änderungen zu überwachen. Zahlreiche Anwendungen für die in vivo murine Endoskopie bestehen, einschließlich des Studiums Darmentzündung oder Wundheilung, Erhalt Schleimhautbiopsien wiederholt, und lokal zu verabreichen diagnostische oder therapeutische Mittel mit Miniinjektionskatheter. In jüngster Zeit hat der molekularen Bildgebung erweitert die diagnostische Bildgebung modalities ermöglicht den spezifischen Nachweis von unterschiedlichen Zielmoleküle mit spezifischen Photosonden. Im Ergebnis hat murinen Endoskopie als neue Spitzentechnologie für diagnostische experimentelle in-vivo-Bildgebung entstanden und können wesentlich von der präklinischen Forschung in verschiedenen Bereichen auswirken.
Einleitung
Tiermodelle haben unser Verständnis der zahlreichen Darmerkrankungen bereichert. Die Labormaus (Mus musculus) wurde als bester Tiermodell in der biomedizinischen Forschung aufgrund seiner reichlich vorhandenen genetischen und genomischen Informationen entwickelt und ist in transgenen und Knockout-Stämme zur Verfügung stehen. Zusätzlich zum besseren Verständnis der Krankheitsentstehung, Tiermodelle sind auch wichtig für die Prüfung Wirkstoffkandidaten sowie der präklinischen diagnostische oder therapeutische Eingriffe. Trotz der Vielzahl von Mausmodellen Simulation menschlicher Krankheiten, viele diagnostische und interventionelle Optionen, die routinemäßig in der Patientenpflege eingesetzt werden, sind jedoch nicht für Mäuse vorhanden. Dementsprechend Überwachungsstrategien, den Verlauf der Krankheit Maus oder die Wirkung von therapeutischen Interventionen zu überwachen sind oft auf indirekte Beobachtungen beschränkt oder post mortem-Analysen. Während nicht-invasive Verfahren existieren für die Überwachung Mäuse Vitalität wie Krankheitsaktivität Indizes, quantification der Gewichtsabnahme oder Gewichtszunahme, Blut, Urin und Kot analysiert, das sind nur indirekte Indikatoren und werden durch interindividuelle Variabilität vorgespannt ist. Zusätzlich post mortem-Analysen verhindern Längs Beobachtungen an sich wiederholenden Zeitpunkten. Anspruchsvolle bildgebenden Verfahren zur Überwachung der Krankheitsaktivität bei Mäusen wurden erst vor kurzem eingeführt 1,2. Obwohl diese bildgebenden Verfahren ermöglichen das wiederholte Analysen, sie bieten nur einen beschreibenden und oft ungenau Blick auf den Darm, nicht ermöglichen den direkten Schleimhaut Visualisierung oder erlauben diagnostische oder therapeutische Eingriffe wie Biopsien Erwerb oder aktuelle und intramukosalen Anwendung der Wirkstoffkandidaten.
Vor kurzem hochauflösenden endoskopischen Systemen zur Verwendung in lebenden Mäusen entwickelt worden 3,4. Zum ersten Mal diese endoskopischen Techniken ermöglichen die direkte Visualisierung der endoluminalen Dickdarmerkrankung Erkrankungen wie Wundheilung oder Darmentzündung Bereitstellung objektierende, Echtzeit-Status ermöglicht Längsschnittstudien im gleichen Tier bei sich wiederholenden Zeitpunkten. Abgesehen davon ermöglicht wiederholte Biopsien in einem einzelnen Maus, können endoskopische Systeme ebenfalls verwendet werden, um therapeutisch zu beeinflussen eine deutliche Tumor oder lokalisierte Entzündung, die durch eine direkte Anwendung eines Stoffes in den Bereich von Interesse. Weiterhin als therapeutische und Steuerstoffe können direkt in den Bereich von Interesse geliefert werden, kann dies in der gleichen Maus durchgeführt werden, ohne die interindividuelle Variabilität. Diese Systeme sind nun für die Beurteilung der Kolon-Entzündung, Wundheilung, laparoskopische Leberbiopsien und orthotopen Induktion von Lebertumoren 8 und Tumor-Entwicklung unter Verwendung von verschiedenen Scoring-Systemen wie dem murinen endoskopischen Index Schwere der Colitis (MEICS) 5-7 eingesetzt. MEICS besteht aus fünf Parameter, um Entzündungen zu bewerten: Verdickung der Darmwand, Veränderungen der Gefäßmuster, die Anwesenheit von Fibrin, Granularität der mucosAl-Oberfläche und Stuhlkonsistenz.
In diesem Protokoll beschreiben wir die Verwendung von starren Endoskopie in murinen Modellen von intestinalen Wundheilung, Entzündung und Darmkrebs. Zunächst zeigen wir die endoskopischen Untersuchung der Wundheilung und Kolonentzündung sowie Längs Beurteilung ulcerosa Aktivität und die Untersuchung der Kanzerogenese in murinen Colon. Über die beschreibende Verwendung von Maus-Endoskopie, bieten wir detaillierte Anweisungen zur Verwendung der endoskopischen Instrumentierung Biopsien erhalten, und der aktuelle und intramukosalen Anwendung der verschiedenen Komponenten von Interesse (zB Medikamentenkandidaten oder Tumorzellen). Schließlich zeigen wir die Verwendung von Maus-Fluoreszenz-Endoskopie, die anspruchsvolle molekularen Bildgebung beschäftigt, bei der Einstellung von kolorektalen Tumoren.
Protokoll
Alle Tierversuche wurden von der Landesamt für Natur, Umwelt und Verbraucherschutz (LANUV) nach deutschem Tierschutzgesetz genehmigt.
1. Materialien und Versuchsaufbau
- Tierpflege
- Verwenden Sie weiblich oder männlich Mäuse jeder Stamm mit einem Gewicht von 20 bis 25 g und Haus sie nach den örtlichen Tierpflege-Gesetzgebung.
- Mäuse füttern mit Spezialfutter für Nager und gelten Luzerne frei Chow mindestens drei Tage vor der Untersuchung Fluoreszenz endoluminale Autofluoreszenz zu minimieren.
- Geben Sie autoklaviertem Trinkwasser ad libitum.
- Induktion von akuter DSS-induzierter Kolitis
- Vorbereiten einer 3% (w / v) Dextransulfat-Natrium (DSS, Molekulargewicht: 36,000-50,000 Da) durch Auflösen von 3 g DSS in 100 ml Wasser autoklaviert. Bieten diese Lösung als die ausschließliche Trinkwasser an Mäuse ad libitum und berechnen 5 ml DSS-Lösung pro Maus / Tag. Feed Fortsetzungrol Mäuse mit autoklaviertem Wasser ohne DSS ad libitum 9.
- Induktion von Darmkrebs
- Auflösen mutagene Azoxymethan (AOM) (VORSICHT! Kann Krebs und genetische Schäden verursachen!) In steriler isotonischer Kochsalzlösung, um eine endgültige Konzentration von 1 mg / ml zu erhalten. Anwenden einer Einzeldosis von 10 mg pro kg Körpergewicht AOM intraperitoneal unter Verwendung einer 1 ml Spritze (30 G) 10.
- Challenge-Mäusen (ohne Kontrollmäuse) mit sich wiederholenden Zyklen von 3% (w / v) DSS von Tag 0 bis 7, Tag 14 bis 21 Tage 28 bis 35 und 42 bis 49 Tage nach Entzündungs angetrieben kolorektalen Karzinogenese bewirken. Mäuse füttern mit autoklaviertem Wasser nur zwischen diesen Herausforderungen (siehe Abbildung 4A für einen detaillierten Zeitplan). Futtermittelkontrolle Mäuse mit autoklaviertem Wasser während des gesamten Experiments.
- Herstellung von Fluoreszenzendoskopie (FE)
- Verwendung Fluorescein-Isothiocyanat (FITC) - Dextran (Molekulargewicht 70.000 Da; FITC: Glucose = 1: 250), Detektion von Dickdarm-Adenom durch visuelle Verbesserung der Dysplasie Gefäßmuster.
- Verwalten 60 mg FITC-konjugierten Dextran in 100 ul PBS intravenös 5 min vor Fluoreszenz endoskopische Untersuchung verdünnt.
- Anästhesie
- Eine kontinuierliche Versorgung für Isofluran Anästhesie (1,5 LO 2 / min; 1,5-2 Vol% Isofluran [2-Chlor-2-(difluormethoxy) -1,1,1-trifluor-ethan]). Verwenden Sie spezielle Tieranästhesiegeräte mit einer Gesichtsmaske, um genau steuern Anästhesie.
- Vorbereitung der Einlauf
- Einzuflößen 2 ml Flüssigkeit Einlauf (Inhalt: Dinatriumhydrogenphosphat 1,5% (w / v) und Natriumdihydrogenphosphat 11% (w / v)) in den Dickdarm, wenn erhebliche fäkale Belastung vermutet wird, die die Sicht beeinträchtigen können.
2. Technische Anlagen
- Verwenden Sie ein Tier endoskopischen Arbeitsstation, die entwickelt und für den Einsatz von Kleintier Endoskopie genehmigt. Verbinden Sie die WOrkstation zu einer Kameraeinheit, einer Xenon-Lichtquelle, einer Luftpumpe und einem herkömmlichen PC-Monitor für Weißlicht-Endoskopie. Dann verbinden Sie die Kamera und das Miniatur starren Teleskop (1,9 mm Außendurchmesser, 10 cm Länge, Abbildung 5).
- Verwenden Endoskophülle mit Arbeitskanal (5D) für die Anwendung der Biopsiezange oder Injektionsrohr. Verwenden Sie die Hülle ohne Arbeitskanal für diagnostische Darmspiegelung.
- Konfigurieren Sie die Einstellungen der Lichtquelle zur Fluoreszenz-Endoskopie verwendeten Tracer zu erregen (zB 490 nm für FITC-konjugierten Dextran). Zusätzlich integrieren einen geeigneten Bandpassfilter zwischen dem Teleskop und der Kamera (beispielsweise 525 nm für FITC-konjugiertem Dextran).
- Legen flexible Biopsiezange (3 Charr., 28 cm) durch den Arbeitskanal des Endoskops zu Biopsien erhalten.
- Einführung flexible Injektionsrohr (0,96 mm) durch den Arbeitskanal für die topische, intramukosalen oder eine endoluminaledministration von diagnostischen oder therapeutischen Mitteln.
- Verwenden Sie einen beheizbaren Untersuchungstisch mit einer Temperatur von 42 ° C. Dies verhindert, dass Mäuse immer während der Prüfung Hypothermie.
3. Anästhesie der Tiere
- Platzieren der Maus in einer kleinen, aber dichten Kasten und verwalten Isofluran (100% (v / v), 5 Vol%, 3 L / min). Warten Sie, bis die Maus das Bewusstsein verliert.
- Übertragen Sie die Maus auf den Untersuchungstisch für die Endoskopie. Weiter Isofluran Inhalation über Gesichtsmaske mit einer Dosis von 100% v / v, 1,5 Vol%, 1,5 L / min. Gelten immer Augensalbe, Augen Trockenheit zu verhindern, während sie unter Narkose.
- Bewerten Wirksamkeit der Anästhesie durch Überprüfung der Reflexe. Überprüfen Sie den 'turn around reflex': wenn ausreichend betäubt, sollte eine Maus mit auf dem Rücken nicht um. Überprüfen Sie die Zehen reflex ': Wenn Narkose ausreichend, weich Kneifen zwischen den Zehen der Tiere sollte nicht bis zum Entzug der Schenkel (Stufe führenchirurgische Toleranz).
4. Koloskopie
- Legen narkotisierten Maus Liegend / auf dem Rücken auf dem Untersuchungstisch.
- Verabreichen 2 ml Einlauf über knöpft Kanüle in den Dickdarm, wenn erhebliche fäkale Belastung wird vermutet, dass die Sicht verdecken kann. Warten Sie, Mäusen nach Verabreichung der Einlauf verrichten. Legen Sie das Endoskop sehr sorgfältig, um eine Perforation zu vermeiden.
- Öffnen beide Ventile der Hülle mit einem von ihnen mit der Luftpumpe verbunden ist. Dichten Sie das andere Ventil mit dem Zeigefinger in die Luft abzugeben. Aufblasen Doppelpunkt mit Luft, langsam und vorsichtig, insbesondere bei der Biopsie oder Injektion.
- Voran Endoskop nur so weit wie die rechte Flexur zu einer Perforation (4-5 cm vom Anus) zu vermeiden.
- Diagnose Koloskopie
- Überprüfen Sie die Schleimhaut für entzündliche oder bösartige Veränderungen, während das Zurückziehen des Endoskops. Langsam nach hinten, um den gesamten Umfang des Darmes zu beurteilen. Beurteilen intraluminale pathologies mit geeigneten etablierten Scoring-Systeme nach Bedarf.
- Identisch endoskopische Position für die Bildaufnahme bei wiederholten Visualisierungen von Wundflächen rechtfertigen, beachten Sie den Abstand zwischen dem murinen Anus und der Schleimhautveränderung. Darüber hinaus verwenden die Spitze der Biopsiezange als Abstandshalter zu gleichen Abstand zwischen dem Endoskop und den Wundbereich während der Bildaufnahme zu erreichen. Die Wundgröße an die Größe des Endoskophülle, die 3 mm aufweist stehen.
HINWEIS: Platz Endoskop in gleicher Position mit optischen Vergleich mit Fotodokumentation der bisherigen Untersuchungen. Maßnahme Läsionen im gleichen Winkel und Abstand, bei jeder Folge endoskopische Untersuchung.
- Biopsie
- Nehmen Biopsien mit Hilfe von zwei Forschern. Einführung der Biopsiezange vorsichtig durch den Arbeitskanal, bis die Spitze der Zange auf dem Monitor mit dem zweiten Prüfer sichtbar ist. Öffnen und schließen Pinzette vorsichtig zu einerLeere Perforation.
- Bewegen Zange an den Ort der Pathologie.
- Injektionsverfahren
- Führen Pritzverfahren mit Hilfe von zwei Forschern. Pre-fill flexiblen Einspritzrohr (0,96 mm) komplett mit dem Mittel verabreicht werden. Schubrohr durch den Arbeitskanal, bis die Kanüle (30 G) auf dem Monitor an den zweiten Prüfer zu sehen ist. Bereiten Sie die feinen Spritze verabreichen und sanft den geforderten Betrag von diagnostischen oder therapeutischen Mittel. Injektionsvolumina sollten 50 ul maximal sein.
- Legen Sie die Nadel in die submocosa in einem Winkel von 15-30 Grad. Stehen vor der Kegel in Richtung der Schleimhaut. Die Schleimhaut zeigt eine charakteristische Hebe Zeichen nach erfolgreicher Injektion.
- Fluoreszenzendoskopie-(FE)
- Verwalten 60 mg FITC-konjugierten Dextran in 100 ul PBS intravenös vor der endoskopischen Untersuchung Fluoreszenz.
- Überprüfen Sie den optimalen Zeitpunkt zwischen Injektion vonIhre Fluoreszenz-markierten Tracers und der bildgebenden Verfahren, die abhängig von Tracer Pharmakologie ist. Konfigurieren von Einstellungen der Bandpassfiltersystem gemäß den Anregungs-und Emissionswellenlänge der Tracer verwendet. Fluoreszenzendoskopie durchführen unspezifischen Blutvolumen Tracer (zB FITC) unmittelbar nach der intravenösen Injektion des fluoreszierenden Farbstoffs zu dem Gefäßmuster der Schleimhautoberfläche zu beurteilen.
- Betrachten Sie die Abbildung mehrere Stunden nach Tracer Anwendung im Falle von gezielten Tracer oder "Smart Probes", um eine bessere Ziel-Hintergrund-Verhältnis bieten.
- Führen Fotografie und Video-Dokumentation der Ergebnisse.
5. Post-Koloskopie
- Trennen Sie die Maus in einem leeren Käfig und legen Sie sie auf ein Papiertuch, um die Maus aus Ansaugen der Wurf zu schützen. Erwärmen Sie die Maus mit einer Rotlichtlampe zu Unterkühlung zu verhindern. Beachten Sie die Maus und nicht unbeaufsichtigt zu lassen, bis es ausreichend, hat wiederBewusstsein auf Brustlage zu halten. Einmal ganz bewusst, die Maus wieder in die jeweiligen Käfig.
- Am Ende des Experiments statt Maus in einer kleinen, aber dichten Kasten und verwalten CO 2 (100% (v / v), 100 Vol%, 3 L / min). Warten Sie, bis die Maus verliert komplette Bewusstseins und stoppt die Atmung. Versand Maus durch Halsbruch. Führen Bauch Laparotomie und Explantation des Dickdarms. Öffnen Sie den Doppelpunkt in Längsrichtung und waschen Sie es für die weitere histologische oder molekular Auswertung.
Ergebnisse
In-vivo-Überwachung von Darm-Wundheilung
(; 1A entspricht 1 mm) bei Routine Endoskopie, Schleimhautwunden mechanisch Miniaturbiopsiezange mit einem Durchmesser von 3 Französisch induziert. Anschließend wurde die Wundheilung durch tägliche endoskopischen Untersuchungen überwacht und durch Messung des Restwundbereich unter Verwendung von Bildbearbeitungssoftware, beispielsweise quantifiziert ImageJ (1B). Die einzelnen Wundverschluss über die Zeit wird durch den Quotienten aus Ist-Wundbereich / anfängliche Wundfläche ausgedrückt. Beispielsweise am Tag 3 nach der Wund Generation, 41% ± 4,1% der Wundfläche wurde gewonnen, während am 7. Tag war die Wunde vollständig verheilt Regel (Abbildung 1C). Zusätzlich am Ende des Experiments, Wunden für histologische Bewertung ex vivo reseziert werden. Dargestellt sind repräsentative Bilder von Hämatoxylin und Eosin (H & E) aufgewickelt -gefärbten Betten day 0 und Tag 5 (1D).
Endoskopie-geführte intramukosalen Injektionstherapie
Für intramukosale Anwendung pharmakologischer Mittel wurde ein flexibles Rohr (Durchmesser 0,96 mm) mit einer Kanüle an dem Ende (30 G) befestigt ist, um den Arbeitskanal des Endoskops (2A) eingeleitet. Nach intramukosale Platzierung der Nadel wurde ein Maximum von 50 ul sorgfältig injiziert. Richt erfolgreicher intramukosale Anwendung kann Anheben der Colonschleimhaut leicht makroskopisch beobachtet werden (Abbildung 2B, C).
In-vivo-Beurteilung der experimentellen Kolitis
Nach Induktion der Colitis, zeigte Mäuse Gewichtsverlust von Tag 3 mit maximaler Verlust von Körpergewicht von 19% auftritt am Tag 7 (3A). Neben der täglichen Messung des Körpergewichts, wurde der Krankheitsaktivität durch wiederholte Endoskopien und makroskopischen überwacht Quantifizierung der Entzündung von der murinen endoskopischen Index Schwere der Colitis (MEICS). In Übereinstimmung mit dem Verlust von Körpergewicht, wurde MEICS Punktzahl am Tag 7 nach der DSS Start die eine massive Entzündungs Beschädigung der Darmschleimhaut, die an Tag 13 (3B) verbessert wurde erhöht. Für Ex-vivo-Korrelation von histologischen Schäden wurden entzündliche Veränderungen der Darm H & E-gefärbten Schnitten nach der Dieleman Punktzahl 11 quantifiziert. Im Vergleich zu den Kontrollen, wie durch epitheliale Denudation reflektiert am Tag 7 nach der DSS Beginn wurde eine histologische Schädigung signifikant höher in DSS-behandelten Mäusen wurde Schleimhautulzerationen sowie erhöhte neutrophile Infiltration und deutlich am Tag 13 (3C, E) verbessert. Darüber hinaus histologische Beurteilung der Schleimhaut-Biopsien, routinemäßig während endoskopischen Untersuchungen erhalten, bestätigte die fortgeschrittenen Stadium der Colitis am Tag 7 (3F-H).
Etwa 80 Tage nach der Tumorinduktion durch AOM und drei Zyklen von DSS (4A), mehreren Kolontumoren (4C) sowie makroskopischen Anzeichen chronischer Entzündung wie granuliert Schleimhaut (4B) 10 wurden endoskopisch beobachtet. Histologische Beurteilung von kolorektalen Tumoren durch H & E-Färbung ergab Adenome mit und ohne hochgradige intraepitheliale Neoplasie. Daher ist die AOM-DSS-Modell ähnelt einem perfekten Modell der molekularen Prozesse der Krebsentstehung zu studieren 12, sowie neue diagnostische Geräte 13 zu bewerten. Fluoreszenz-Bildgebung für bestimmte Moleküle in vivo ermöglicht die molekulare Bildgebung mit fotografischen Methoden '14,15. Machbarkeit von FE zu demonstrieren, haben wir FITC, eine weit verbreitete Fluorochrom. Für spezifische Nachweis FITC, einem Bandpassfiltersystem mit der kombinierten light Quelle spezifischen Anregungswellenlänge benötigt (490 nm; 4D). Für eine genaue Detektion von FITC-spezifischen Emissionswellenlänge (525 nm) wurde ein zweites Bandpassfilter zwischen dem Kamerakopf und dem Endoskop (4E) angeordnet ist. FE ohne Tracer Anwendung fanden keine spezifische Signal und keine Wechselwirkung mit Dickdarmgewebe oder Stuhlautofluoreszenz (4F, G) zu erkennen. Dagegen sofort nach intravenöser Applikation von FITC-Dextran, das Fluorochrom kann an der Darmschleimhaut beobachtet werden und für die Beurteilung der erhöhten Durchblutung in Bereichen chronischer Entzündung (4H) sowie malignen Schleimhaut (4I) verwendet werden. Dementsprechend zeigte die Quantifizierung der Fluoreszenzintensität durch eine Bildbearbeitungssoftware signifikant im malignen Gewebe erhöhte Aufnahme des Fluorochroms im Vergleich zu nicht betroffenen Darmschleimhaut (Figur 4K).
"Jove_content" fo: keep-together.within-page = "always"> 
Abbildung 1. Endoskopische Überwachung von epithelialen Wundheilung in vivo als auch quantitative und histologische Beurteilung der Wundheilung. Nach der Erzeugung von Kolon Wunden, Wund Grenze und Wundverschluss kann leicht festgestellt werden. Die Wundfläche (weiße Pfeile) wird während der täglichen Follow-up-Endoskopien bewertet quantitativ folgen epithelialen Wundheilung (A - C) Ex vivo wurden Wunden reseziert und für die histologische Analyse der Wundheilung (D) H & E-gefärbt.. Skalen werden durch dargestellt Maßstab definiert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
RE 2 "fo: content-width =" 5in "src =" / files / ftp_upload / 51875 / 51875fig2highres.jpg "width =" 500 "/>
Intramukosale Injektionstherapie Figur 2. Endoskopie-geführt. Unter Sichtkontrolle, ist die Spitze der Nadel (A) leicht in die Darmschleimhaut gegeben und 50 ul Substanzen injiziert (B). Anschließend können markiert Schleimhauthebe (Sternchen) ohne Anzeichen einer akuten Blutung (C) erkannt werden. Skalen werden durch dargestellt Maßstab definiert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3. Endoskopische Beurteilung der Verlauf der experimentellen DSS Colitis. Der Verlauf der Colitis war zu bewertend durch Veränderungen des Körpergewichts, endoskopische Untersuchungen sowie histologische Analyse der entzündeten Darmabschnitten und endoskopische Biopsien. Im Einklang mit massiven Verlust von Körpergewicht und erweiterte histologische Schäden an Tag 7 (A, C, E, Vergrößerung 10x), endoskopische Untersuchungen und histologische Beurteilung der dargestellten Zeichen einer schweren Entzündung (B, D, G, H erhalten Biopsien, Vergrößerung 5x und 10X), während an Tag 13 nach der DSS beginnen entzündliche Veränderungen wurden deutlich verbessert. Skalen werden durch dargestellt Maßstab definiert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
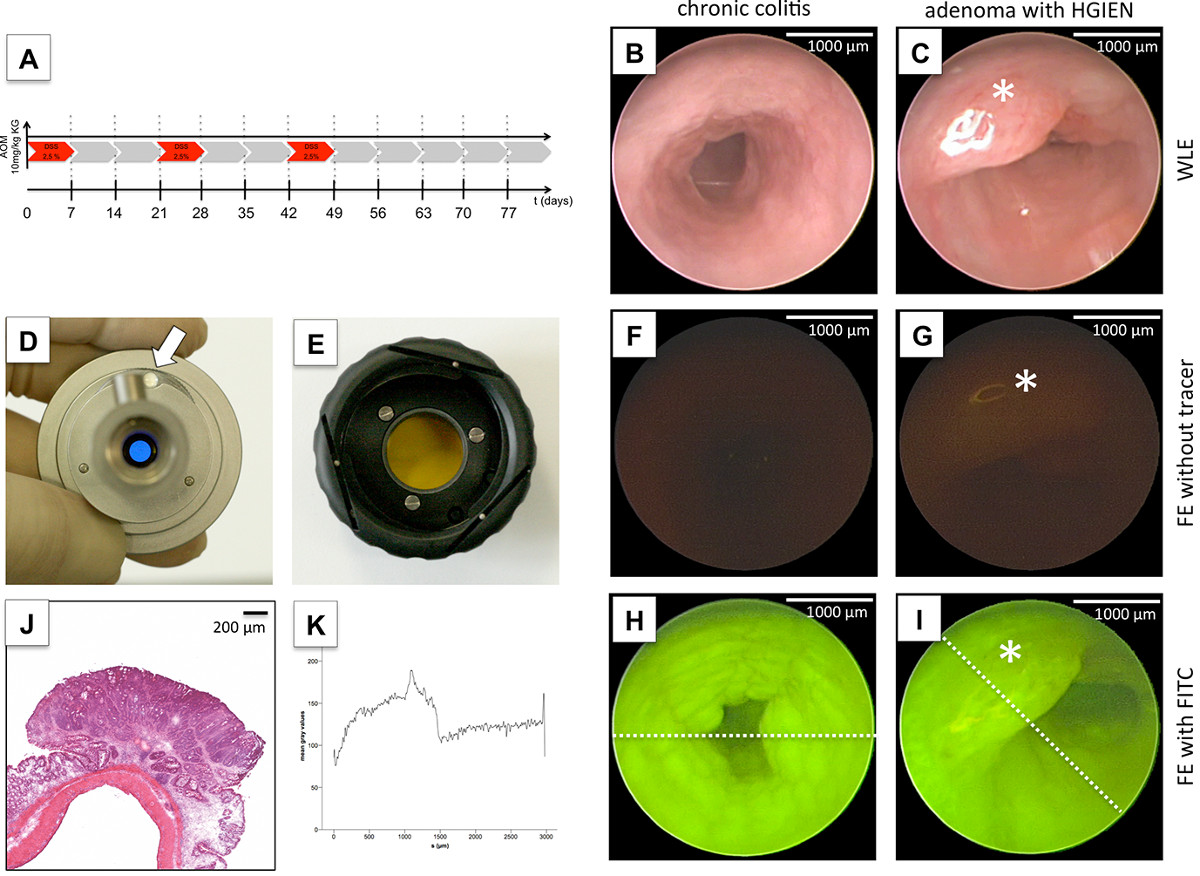
Figurieren 4. FE von kolorektalen Tumoren. Nach Einleitung der kolorektalen Karzinogenese von AOM und zyklische DSS Verwaltung 11 Wochen (A), Weißlicht-Endoskopie erkannt granuliert Schleimhaut Hinweis auf chronische Kolitis (B) und zahlreiche endoluminalen Läsionen (C), die als diagnostiziert wurden Adenome mit hochgradigen intraepitheliale Neoplasie von H & E-Färbung ex vivo (G). Während Visualisierung der chronischen Entzündung (H) und Tumoren (I) leicht möglich war, mit FE gezielte FITC, FE ohne Tracer Anwendung nicht definitive Tumordetektion (F, G) zu ermöglichen. Dementsprechend wurde die Quantifizierung der Fluoreszenzintensität deutlich in malignem Gewebe erhöht, im Vergleich zu nicht betroffenen Darmschleimhaut von Graustufenprofile (E, F) gezeigt. Während weißes Licht colonoscop der Fluoreszenz-Modus zu wechselny eine spezifische Bandpassfilter zusätzlich in die Kaltlichtquelle angeschlossen ist, um den spezifischen Anregungswellenlänge bereitzustellen (zB 490 nm für FITC, D). Dieser Filter ermöglicht Schalt (weißer Pfeil) zwischen Weißlicht-und Fluoreszenzmodus (D). Um die spezifische Emissionswellenlänge zu erfassen (zB 525 nm für FITC), eine zweite Bandpassfilter zwischen Endoskop und Kamerakopf mit einem Bajonettverschluss (E) angeordnet ist. Skalen werden durch dargestellt Maßstab definiert. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5. Versuchsaufbau der endoskopischen Arbeitsstation. Die endoskopische Arbeitsstation ( A) besteht aus den folgenden Komponenten: einfach Teleskop (0 °, Durchmesser: 1,9 mm, Länge: 10 cm, B), Endoskopschaft (9 Charr) ohne (C) und mit Arbeitskanal (D), Kamera (. E) und Biopsiezange (F). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Epithelialen Wundheilung ist ein laufender Prozess. Kontinuierlichen physiologischen Exfoliation der Oberflächenzellen im Magen-Darm-Schleimhaut tritt eine häufige Regeneration von Epithelzellen 16. Folglich hat Wundheilungsstörungen eine immense Auswirkungen auf mehrere Krankheiten wie Magen-Darm-Geschwüren und 17 Anastomoseninsuffizienz 18. Auswertung der molekularen Hintergrund sowie potenzielle Wirkstoffkandidaten zu Epithelheilung stimulieren kann nur unvollständig in Zellkultursystemen in vitro 19,20 durchgeführt werden. So werden anspruchsvollere Versuchsaufbauten, wie Maus-Koloskopie mit der Erzeugung von definierten Schleimhautwunden von einer Biopsiezange benötigt, um In-vivo-Evaluierung von Magen-Darm-Wundheilung zu ermöglichen und um mögliche Wechselwirkungen zwischen Darmentzündungen und Wundheilungsprozessen zu bewerten.
Zusätzlich kann eine Injektionsnadel für L verwendet werdenocal intramukosalen Verwaltung von Diagnose Farbstoffe oder potenziellen Wirkstoffkandidaten. Dies kann mit einem flexiblen Schlauch (Durchmesser 0,96 mm) mit einer Nadel an dem Ende befestigt ist, durch den Arbeitskanal eingeführt werden, erreicht werden. Da ein Testmittel als auch die Placebokontrolle in getrennten entzündlichen oder neoplastischen Läsionen im gleichen Tier geliefert wird, stellt dieser Ansatz den Vorteil, Zuverlässigkeit im Vergleich zu herkömmlichen Versuchseinstellungen. Eine weitere Anwendung der lokalen Injektionen ist die Implantation von humanen oder murinen Tumorzellen orthotopen Tumoren im Maus-Dickdarm 21 zu erzeugen.
Mausmodellen von Colitis sind erforderlich, um die Pathophysiologie erläutern sowie potentielle therapeutische Mittel präklinisch bewerten. Daher ist von großer Bedeutung genaue Überwachung des Krankheitsverlaufs. Herkömmlicherweise wird die Schwere der Erkrankung in der Regel durch indirekte Parameter wie Körpergewicht, Haemoccult Tests sowie Analyse bestimmtvon Blut und Kot. Im Gegensatz dazu ist die direkte Bestimmung von Colitis Schwere oft histologische Analyse post mortem, die den Tod des Tieres erfordert beschränkt. Allerdings bietet murinen Koloskopie eine direkte Visualisierung der Darmschleimhaut von lebenden Mäusen. Weiterhin ist die direkte und wiederholte Überwachung Merkmale ulcerosa möglich, was eine Voraussetzung in experimentellen Modellen mit inhomogener Ausbruch der Krankheit, zB IL-10 defiziente Mäuse oder in dem Modell transfercolitis in RAG-defizienten Mäusen ist. Folglich ist eine Maus-endoskopischen Index der Colitis wurde festgestellt, 6, objektive Quantifizierung der Schleimhautentzündung und Serien Follow-up-Untersuchungen des gleichen Tieres ermöglicht.
Im Rahmen der kolorektalen Karzinogenese, bietet Koloskopie verschiedene vorteilhafte Möglichkeiten. Beispielsweise im Gegensatz zu nicht-invasiven Methoden ist die Endoskopie der erste Ansatz zur in vivo Bestimmung der Tumorgröße erlaubenund Tumor-Zahlen. Weiterhin ist die Verwendung von Fluoreszenzphotosonden für bestimmte Moleküle ermöglicht die Visualisierung und Quantifizierung der molekularen Prozesse. In einer Studie von Translations Foersch et al. spezifisches Targeting von VEGF-Expression in malignen Dickdarmschleimhaut wurde gezeigt, möglich zu sein, und kann für Läsion Charakterisierung und Vorhersage von Behandlungserfolg bei menschlichen Patienten mit kolorektalem Karzinom 22 verwendet werden. Darüber hinaus können Informationen aus diesem Ansatz resultierende molekulare Bildgebung in der Lage, für den Einsatz bei menschlichen Patienten umgesetzt werden können. Dies würde Live-Charakterisierung von Läsionen während der Endoskopie Verdächtigen zu ermöglichen. Schließlich sogenannte "intelligente Sonden" Erhöhung Spezifität dieser Tracer durch Aktivierung der Fluorophore durch enzymatische Prozesse an der Seite der Zielläsion 23.
Bei der Durchführung von murinen Endoskopie, sind bestimmte Schritte des gegebenen Protokoll besonders kritisch. Zum Beispiel können verschiedene moVerwendung Stämme unterscheiden sich in ihrer Empfindlichkeit gegenüber der Anästhesie und DSS-Konzentrationen. Daher kann dieses Protokoll benötigt, um die lokalen Einstellungen angepasst werden. Außerdem wird Erfahrung in der Durchführung endoskopische Untersuchungen und genaue Kenntnis der Anatomie Maus benötigt, um optimale Maus-Endoskopie, die sicher und zielorientiert ist durchzuführen. Im Hinblick auf mögliche Einschränkungen dieser Technik, zeigen wir, dass das Endoskopsystem verwendet wird, ist starr, also so weit wie die rechte Biegungsbegrenzungs das Verfahren auf den Dickdarm. Außerdem sind die meisten gelten für FE Fluorochrome werden derzeit hinsichtlich ihrer Sicherheitsprofile ausgewertet und daher während für Maus-Studien verfügbar sind, werden noch nicht für den Einsatz im menschlichen Patienten zugelassen.
Die folgenden sind wichtige Schritte in Bezug auf die Modalitäten des Verfahrens: (1) seit Anfälligkeit für induzierte Colitis kann zwischen verschiedenen Stämmen variieren DSS kann die Induktion der akuten DSS Kolitis Tod der Tiere zu riskieren, wenn es advwogene Schwere der Colitis. Deshalb halte Evaluierung mehrerer DSS-Konzentrationen für einen einzelnen Stamm und die spezifische DSS Ansatz verwendet die geeignetsten. Endoskopische Untersuchung könnte sich als schwierig in der Gegenwart von großen intrakolische Hocker Massen. Induzieren Stuhlgang vor dem Eingriff mit rektale Applikation von 2 ml Einlauf Flüssigkeit über knöpft Kanüle wird die Sichtbarkeit zu verbessern, wenn erhebliche fäkale Belastung wird vermutet, dass die Sicht verdecken kann. Wenn hohe Perforation Raten während Biopsie auftreten, verringern Luftzufuhr in den Dickdarm vor dem Erhalt Schleimhaut-Biopsien und den Druck der Biopsiezange auf der Schleimhautoberfläche zu verringern, bevor das Schließen der Filialen.
Zur Bewertung der Krankheitsaktivität von experimentellen Kolitis oder Kanzerogenese durch indirekte Parameter, wie das Körpergewicht, das Auftreten von fäkalen Blutanalyse von peripheren Blut oder post mortem histologischen Analyse Ende zusammen, im Gegensatz zu herkömmlichen Methodenosk opie-basierte Techniken ermöglichen die Live-Überwachung der Krankheitsverlauf mit der Möglichkeit, Biopsien unter Sichtkontrolle durchzuführen. Zusätzlich Wundheilung und therapeutische Wirkung von topisch applizierten Wirkstoffkandidaten in vivo beurteilt werden.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken Sonja Dufentester und Elke Weber für kompetente technische Unterstützung. Wir danken Faekah Gohar für das Korrekturlesen und Stefan Brückner für Medizinische Informatik Support. Diese Arbeit wurde von einem interdisziplinären Zuschuss von der Else-Kröner-Fresenius-Stiftung (2012_A94) unterstützt. D. Bettenworth wurde von einem Forschungsstipendium der Medizinischen Fakultät der Westfälischen Wilhelms-Universität Münster unterstützt. M. Brückner wurde von einem "Gerok" Drehstellung der Deutschen Forschungsgemeinschaft (DFG SFB1009B8) unterstützt. Wir danken Heike Blum zur Illustration der Maus-Cartoon.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alfalfa-free diet | Harlan Laboritories, Madison, USA | 2014 | |
| Azoxymethane (AOM) | Sigma-Aldrich, Deisenhofen, Germany | A5486 | |
| Bepanthen eye ointment | Bayer, Leverkusen, Germany | 80469764 | |
| Dextran sulphate sodium (DSS) | TdB Consulatancy, Uppsala, Sweden | DB001 | |
| Eosin | Sigma-Aldrich, Deisenhofen, Germany | E 4382 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich, Deisenhofen, Germany | E 9884 | |
| Falcon Tube 50 ml | BD Biosciences, Erembodegem, Belgium | 352070 | |
| Florene 100 V/V | Abbott, Wiesbaden, Germany | B506 | |
| Haematoxylin | Sigma-Aldrich, Deisenhofen, Germany | HHS32-1L | |
| Isopentane (2-Methylbutane) | Sigma-Aldrich, Deisenhofen, Germany | M32631-1L | |
| Methylene blue | Merck, Darmstadt, Germany | 1159430025 | |
| O.C.T. Tissue Tek compound | Sakura, Zoeterwonde, Netherlands | 4583 | |
| Omnican F - canula | Braun, Melsungen, Germany | 9161502 | |
| Phosphate buffered saline, PBS | Lonza, Verviers, Belgium | 4629 | |
| Sodium Chloride 0.9% | Braun, Melsungen, Germany | 5/12211095/0411 | |
| Standard diet | Altromin, Lage, Germany | 1320 | |
| Tissue-Tek Cryomold | Sakura, Leiden, Netherlands | 4566 | |
| Vitro – Clud | R. Langenbrinck, Teningen, Germany | 04-0002 | |
| Equipment | |||
| AIDA Control | Karl Storz - Endoskope, Tuttlingen, Germany | 20 096020 | |
| Bandpass filter | Semrock, Rochester, USA | HC 716/40 | |
| Bandpass filter | Semrock, Rochester, USA | HC 809/81 | |
| Biopsy Forceps, 3 Fr., 28 cm | Karl Storz - Endoskope, Tuttlingen, Germany | 61071ZJ | |
| Dell Monitor | Dell, Frankfurt am Main, Germany | U2412Mb | |
| Examination Sheath, 9 Fr. | Karl Storz - Endoskope, Tuttlingen, Germany | 61029D | |
| Examination Sheath, 9 Fr. | Karl Storz - Endoskope, Tuttlingen, Germany | 61029C | |
| Fiber Optic Light Cable, 3.5 mm | Karl Storz - Endoskope, Tuttlingen, Germany | 69495NL | |
| Fluorescein Blue Filter System | Karl Storz - Endoskope, Tuttlingen, Germany | 20100032 | |
| Fluorescein Barrier Filter | Karl Storz - Endoskope, Tuttlingen, Germany | 20100033 | |
| Foot switch | Karl Storz - Endoskope, Tuttlingen, Germany | 20010430 | |
| HOPKINS Telescope, 1.9 mm, Length 10 cm | Karl Storz - Endoskope, Tuttlingen, Germany | 1830231 | |
| SCB D-light P | Karl Storz - Endoskope, Tuttlingen, Germany | 20 133720 | |
| SCB tricam SL II | Karl Storz - Endoskope, Tuttlingen, Germany | 20 2230 20 | |
| Tubing set instruments VETPUMP II | Karl Storz - Endoskope, Tuttlingen, Germany | 69811 | |
| Tricam PDD PAL | Karl Storz - Endoskope, Tuttlingen, Germany | 20221037 | |
| UniVet Porta | Groppler Medizintechnik, Deggendorf, Germany | BKGM 0451 | |
| Vetpump 2 | Karl Storz - Endoskope, Tuttlingen, Germany | 69321620 | |
Referenzen
- Bettenworth, D., et al. Translational 18F-FDG PET/CT imaging to monitor lesion activity in intestinal inflammation. Journal of nuclear medicine : official publication, Society of Nuclear Medicine. 54, 748-755 (2013).
- Lewis, J. S., Achilefu, S., Garbow, J. R., Laforest, R., Welch, M. J. Small animal imaging. current technology and perspectives for oncological imaging. European journal of cancer. 38, 2173-2188 (2002).
- Huang, E. H., et al. Colonoscopy in mice. Surgical endoscopy. 16, 22-24 (2002).
- Becker, C., et al. In vivo imaging of colitis and colon cancer development in mice using high resolution chromoendoscopy. Gut. 54, 950-954 (2005).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nature protocols. 1, 2900-2904 (2006).
- Neurath, M. F., et al. Assessment of tumor development and wound healing using endoscopic techniques in mice. Gastroenterology. 139, 1837-1843 (2010).
- Pickert, G., et al. STAT3 links IL-22 signaling in intestinal epithelial cells to mucosal wound healing. The Journal of experimental medicine. 206, 1465-1472 (2009).
- Shapira, Y., et al. Utilization of murine laparoscopy for continuous in-vivo assessment of the liver in multiple disease models. Plos one. 4, e4776(2009).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature protocols. 2, 541-546 (2007).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nature protocols. 2, 1998-2004 (2007).
- Dieleman, L. A., et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clinical and experimental immunology. 114, 385-391 (1998).
- Gao, Y., et al. Colitis-accelerated colorectal cancer and metabolic dysregulation in a mouse model. Carcinogenesis. 34, 1861-1869 (2013).
- Foersch, S., Neufert, C., Neurath, M. F., Waldner, M. J. Endomicroscopic Imaging of COX-2 Activity in Murine Sporadic and Colitis-Associated Colorectal Cancer. Diagnostic and therapeutic endoscopy. 2013, 250641(2013).
- Bremer, C., Ntziachristos, V., Weissleder, R. Optical-based molecular imaging: contrast agents and potential medical applications. European radiology. 13, 231-243 (2003).
- Keller, R., Winde, G., Terpe, H. J., Foerster, E. C., Domschke, W. Fluorescence endoscopy using a fluorescein-labeled monoclonal antibody against carcinoembryonic antigen in patients with colorectal carcinoma and adenoma. Endoscopy. 34, 801-807 (2002).
- Jones, M. K., Tomikawa, M., Mohajer, B., Tarnawski, A. S. Gastrointestinal mucosal regeneration: role of growth factors. Frontiers in bioscience : a journal and virtual library. 4, 303-309 (1999).
- Mertz, H. R., Walsh, J. H. Peptic ulcer pathophysiology. The Medical clinics of North America. 75, 799-814 (1991).
- Pantelis, D., et al. The effect of sealing with a fixed combination of collagen matrix-bound coagulation factors on the healing of colonic anastomoses in experimental high-risk mice models. Langenbeck's archives of surgery / Deutsche Gesellschaft fur Chirurgie. 395, 1039-1048 (2010).
- Burk, R. R. A factor from a transformed cell line that affects cell migration. Proceedings of the National Academy of Sciences of the United States of America. 70, 369-372 (1973).
- Msaki, A., et al. The role of RelA (p65) threonine 505 phosphorylation in the regulation of cell growth, survival, and migration. Molecular biology of the cell. 22, 3032-3040 (2011).
- Zigmond, E., et al. Utilization of murine colonoscopy for orthotopic implantation of colorectal cancer. PloS one. 6, e28858(2011).
- Foersch, S., et al. Molecular imaging of VEGF in gastrointestinal cancer in vivo using confocal laser endomicroscopy. Gut. 59, 1046-1055 (2010).
- Mitsunaga, M., et al. Fluorescence endoscopic detection of murine colitis-associated colon cancer by topically applied enzymatically rapid-activatable probe. Gut. 62, 1179-1186 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten