Method Article
マウス内視鏡検査のため
要約
小動物イメージング技術は、シリアル診断検査およびインビボでの治療介入を行うことができる。最近では、適用範囲が大幅に拡大している、現在は大腸腫瘍発生の評価、創傷治癒および炎症の監視が含まれています。このプロトコルは、マウス内視鏡検査のこれらの多様な潜在的な用途を示している。
要約
マウスモデルが広くヒト疾患の病因を研究し、前臨床的に診断手順、ならびに治療的介入を評価するために使用される。しかし、病理学的変化の有効性評価は、多くの場合、組織学的分析を必要とし、ex vivoでを実行したときに、動物の死は必要となる。そのため、従来の実験的な設定で、個体内のフォローアップ検査はほとんど不可能である。このように、 生きたマウスにおけるマウス内視鏡検査の開発が直接消化管粘膜を視覚化し、また変化について監視する手順を繰り返して両方に初めて研究者を可能にします。 in vivoでのマウスの内視鏡検査のための多数のアプリケーションには、繰り返し粘膜の生検を取得し、腸の炎症または創傷治癒を研究するなど、存在し、ローカルでミニチュア注入カテーテルを用いた診断または治療薬を投与する。最近では、分子イメージングは、画像診断カ月を拡張しました特定の光プローブを用いて異なる標的分子の特異的検出を可能にするdalities。結論として、マウスの内視鏡検査は、in vivoイメージングで診断の実験のための新規な最先端の技術として浮上していると大幅にさまざまな分野での前臨床研究に影響を与える可能性がある。
概要
動物モデルは大幅に数多くの腸の異常の理解を豊かにしてきた。実験用マウス( ハツカネズミ ) は 、その豊富な遺伝的およびゲノム情報に生物医学研究の一等地動物モデルとして登場し、トランスジェニックおよびノックアウト株で容易に入手可能であるしている。理解疾患の病因を高めることに加えて、動物モデルはまた、重要な薬物候補、ならびに前臨床診断または治療的介入を試験するために使用される。しかし、ヒト疾患を模倣するマウスモデルのさまざまなにもかかわらず、日常的に患者のケアに使用されている多くの診断とインターベンションのオプションは、マウスでは使用できません。したがって、マウス疾患または治療的介入の効果の経過を監視するための監視戦略は、多くの場合、間接的な観測や死後の分析に限定されている。非侵襲的処置は、疾患活動性指数のようなマウスの生命力を監視するためのキノリンが存在するが体重の減少または増加、血液、尿と便のantificationは、これらが唯一の間接的な指標であり、個体間変動によってバイアスされて、分析します。さらに、 死後、繰り返しの時点で縦の観測を妨げる分析する。高度なイメージング技術は、ごく最近1,2導入されたマウスにおいて疾患活性をモニターする。これらのイメージング技術は、反復的な分析を可能にするが、彼らは唯一の直接粘膜の可視化を有効にするか、そのような生検取得又は薬剤候補の局所及び粘膜内アプリケーションなどの診断や治療的介入を許さない、腸での記述と、しばしば不正確なビューを提供します。
最近では、生きたマウスで使用するための高解像度の内視鏡システムは、3,4開発されてきた。初めてこれらの内視鏡技術は、OBJを提供し、創傷治癒や腸の炎症のような管腔内結腸疾患の病状の直接的な可視化を可能にする反復の時点で、同じ動物での長期的な研究を可能ective、リアルタイムのステータス。別に個別のマウスで繰り返し生検を可能にするから、内視鏡システムはまた、治療的に関心のある領域への物質の直接的な適用を可能にすることによって別個の腫瘍又は局所的な炎症に影響を与えるために使用することができる。治療および対照物質は、関心のある領域に直接送達することができるように、また、これは個体間変動を除く、同じマウスで行うことができる。これらのシステムは、現在では、大腸炎の重症度(MEICS)5-7のマウスの内視鏡指標として大腸の炎症、創傷治癒、腹腔鏡下肝生検や各種スコアリングシステムを使用して肝腫瘍8および腫瘍発達の同所性の誘発を評価するために使用されてきた。 MEICSは、炎症を評価するために5つのパラメータで構成されています:結腸壁の肥厚、血管パターンの変化、フィブリンの存在、mucosの粒度Al表面、および便一貫性。
このプロトコルでは、腸の創傷治癒、炎症および結腸癌のマウスモデルにおける剛性内視鏡の使用を記載している。まず、創傷治癒および大腸の炎症だけでなく、縦大腸炎活性の評価およびマウスの結腸における発癌の研究の内視鏡的評価を証明している。マウス内視鏡検査の説明的利用を超えて、私たちは生検を取得するために、内視鏡器具の使用方法の詳細は、目的の異なる成分( 例えば、薬剤候補または腫瘍細胞)の局所及び粘膜内のアプリケーションを提供しています。最後に、結腸直腸腫瘍の設定において、高度な分子イメージング技術を用いるマウスの蛍光内視鏡検査の使用を実証する。
プロトコル
全ての動物実験は、ドイツの動物保護法に基づくLandesamtエリーゼナチュール、UMWELTウントVerbraucherschutz(LANUV)により承認された。
1材料および実験セットアップ
- 動物のケア
- 女性または20〜25グラムの重さの任意の系統の雄マウスを使用し、現地の動物保護の法律に従ってそれらを収容する。
- 管腔内の自家蛍光を最小限にするために検査を蛍光の前に少なくとも3日間、げっ歯類のために特別な餌をマウスに飼料とアルファルファのない餌を適用します。
- オートクレーブの飲料水を自由に提供します。
- 急性DSS誘発性大腸炎の誘導
- 水をオートクレーブし100mlのDSSの3グラムを溶解して溶液:3%(w / v)のデキストラン硫酸ナトリウム(36,000-50,000ダルトンDSS、分子量)を準備します。マウスを自由に摂取への排他的な飲料水としてこのソリューションを提供し、マウス/日あたりDSS-溶液5mlを計算します。続きフィードDSS を自由摂取 9なしでオートクレーブに水をマウスにROL。
- 大腸癌の誘導
- 1ミリグラム/ mlの最終濃度を得るために、滅菌等張食塩水に変異原性アゾキシメタン(AOM)溶かす(注意!がんや遺伝子損傷を引き起こすことがある!)。 1mlシリンジ(30 G)10を使用して、kg体重の腹腔内あたり10mgのAOMの単回投与を適用します。
- 21 3%〜7 0日から(w / v)のDSS、14日目の反復サイクル、一日28から35日42から49で(対照マウスを除く)チャレンジマウスは、炎症性の大腸ドリブン発癌を誘導した。 (詳細なタイムスケジュールについては、図4(a)参照 )のみ、これらの課題の間にオートクレーブ水をマウスにフィード。実験を通してオートクレーブ水で対照マウスフィード。
- 蛍光内視鏡検査の準備(FE)
- 利用フルオレセインIsothiocyanat(FITC) - デキストラン(分子量7万ダ; FITC:グルコース= 1:250)DETE用異形成に関連した血管パターンの視覚改善による大腸腺腫のction。
- 蛍光内視鏡検査の前に静脈内に5分間、100μlのPBSで希釈した60ミリグラムFITC結合デキストランを管理します。
- 麻酔
- 麻酔のための継続的なイソフルラン供給(; 1.5〜2体積%イソフルラン[2 -クロロ-2-(ジフルオロメトキシ)-1,1,1 -トリフルオロエタン] 1.5 LO 2 /分)を提供します。しっかり麻酔を制御するためにフェイスマスクで特別な獣医麻酔装置を使用してください。
- 浣腸の準備
- かなりの糞ロードはビューのみを明瞭にすることが疑われる場合結腸に:流体浣腸の2ミリリットル(リン酸水素二ナトリウム1.5%(w / v)のおよびリン酸二水素ナトリウム11%()w / vの内容)を植え付ける。
2技術設備
- 開発され、小動物内視鏡検査の使用が承認されている獣医内視鏡ワークステーションを使用してください。接続ヲカメラユニット、キセノン光源、空気ポンプおよび白色光内視鏡検査のための従来のPCモニタにrkstation。その後、カメラとミニチュア剛性望遠鏡(; 図5 1.9ミリメートル、外径、長さ10cm)を接続します。
- 生検鉗子や注射筒の適用のための作業チャネル( 図5D)を持つ内視鏡シースを使用してください。診断大腸内視鏡検査のためのチャネルを作業することなく、シースを使用してください。
- 使用済みのトレーサー(FITC結合デキストラン用など、490 nm)を励起するために、蛍光内視鏡検査のための光源の設定を行います。また、望遠鏡とカメラ(FITC結合デキストラン用など、525 nm)の間に適切なバンドパスフィルタを内蔵しています。
- 生検を取得するために、内視鏡の作業チャネルを通して柔軟な生検鉗子(3イワナ。28センチ)を挿入します。
- 局所、粘膜内に勤務チャネルを通して柔軟な注入チューブ(0.96ミリメートル)を導入または管腔内診断薬または治療薬のdministration。
- 42℃の温度で加熱可能な検査テーブルを使用してください。これは検査中に低体温になってマウスを防ぐことができます。
動物の3。麻酔
- 小さいが漏れボックスにマウスを置き、イソフルランを投与し(100%(v / v)で、5体積%、3L /分)。マウスが意識を失うまで待ってください。
- 内視鏡検査のために診察台の上にマウスを転送します。 1.5体積%、1.5リットル/分、投与量100%v / vのにフェイスマスクを介してイソフルラン吸入を続けます。常に麻酔下ながら、目の乾燥を防ぐために、眼軟膏を適用します。
- 反射神経をチェックすることにより、麻酔の効果を評価する。 「反射ターンアラウンド」をチェックします。十分に麻酔をかけた場合に、その背中に敷設マウスが好転しないでください。 「つま先反射を[チェック:麻酔が十分である場合には、柔らかい動物の足の指の間に挟むと、(脚の撤退の段階に導くべきではありません外科的寛容)。
4。大腸内視鏡検査
- 診察台に背に/がち麻酔をかけたマウスを置きます。
- かなりの糞ロードはビューのみ を明瞭にすることが疑われる場合結腸にケリをカニューレを介して浣腸の2ミリリットルを管理します。マウスは浣腸を投与した後に排便するのを待ちます。穿孔を避けるために、非常に慎重に、内視鏡を挿入します。
- 空気ポンプに接続され、それらのいずれかとシースの両方のバルブを開きます。空気を分配するために、あなたの人差し指で他のバルブを密封。特に生検または注射の場合には、ゆっくりと慎重に、空気でコロンを入れます。
- 穿孔(肛門から4〜5センチメートル)を回避するために、右結腸たわみとしてまでしか内視鏡を進める。
- 診断大腸内視鏡検査
- 内視鏡を後ろに引きながら、炎症性または悪性の変更のための粘膜を調べます。腸の全周を評価するために戻ってゆっくりと引きます。腔内PAを評価必要に応じて適切な確立されたスコアリングシステムを使用してthologies。
- 巻かれた領域の反復的な視覚化の際に画像取得のための同一の内視鏡の位置を保証する、ネズミ肛門粘膜病変との距離に注意してください。また、画像取得中に内視鏡と、創傷領域の間で同一の距離を達成するためのスペーサーとして、生検鉗子の先端を使用する。創傷の大きさは、3mmを備える内視鏡用シースのサイズに関連している。
注:前の検査の写真資料と光学的に比較して、同一の位置に配置した内視鏡。各内視鏡検査のフォローアップ時に同じ角度と距離で病変を測定します。
- 生検方法
- 2研究者の助けを借りて生検を取る。鉗子の先端が第二の研究者へのモニター上に表示されるまで、作業チャネルを通して慎重に生検鉗子を紹介。に慎重に開閉鉗子空洞穿孔。
- 病理部位に鉗子を移動します。
- 注入手順
- 2研究者の助けを借りて注入手順を実行します。完全に、投与される薬剤と柔軟な注入チューブ(0.96ミリメートル)の事前記入してください。カニューレ(30 G)は第二研究者へのモニターに表示されるまで、作業チャネルを通してチューブを押し込みます。細かいシリンジを準備し、ゆっくりと診断薬または治療薬の要求された量を投与。注入量は50μlで最大であるべきである。
- 15-30度の角度でsubmocosaに針を挿入します。粘膜の方向にベベルに直面している。粘膜は成功し、注射後の特性リフティング印が表示されます。
- 蛍光内視鏡検査(FE)
- 静脈内に前に内視鏡検査を蛍光に100μlのPBSで希釈した60ミリグラムFITC結合デキストランを管理します。
- の注入間の最適な時点を確認してくださいあなたの蛍光標識トレーサーとトレーサー薬理学に依存している撮像法。使用トレーサーの励起および発光波長に応じて、バンドパスフィルタシステムの設定を行います。粘膜表面の血管パターンを評価するために、直ちに蛍光色素を静脈内注射した後、非特異的血液量のトレーサー( 例えば、FITC)のための蛍光内視鏡検査を行う。
- ターゲットを絞ったトレーサーまたはバックグラウンド比に優れたターゲットを提供するための「スマートプローブ」の場合にはトレーサー適用後の数時間を画像化することを検討してください。
- 結果の写真やビデオ、ドキュメントを実行します。
5。ポスト大腸内視鏡検査
- 空いているケージにマウスを分離し、ゴミを吸引することからマウスを保護するために、ペーパータオルの上にのせます。低体温症を防ぐために、レッドライトランプを用いて、マウスを温める。マウスを観察し、それが十分で取り戻したまでは無人のままにしないでください胸骨横臥位を維持するための意識。完全に意識したら、戻って、そのそれぞれのケージにマウスを置きます。
- そして小さいが漏れボックスに実験場所のマウスの終了時には、CO 2(100%(v / v)で、100容量%、3 L /分)を投与する。マウスは、完全な意識を失い、呼吸を停止するまで待ちます。頚部骨折での発送マウス。腹部の開腹を行い、コロンを植。縦方向にコロンを開いて、さらに組織学的または分子的評価のためにそれを洗う。
結果
腸の創傷治癒のin vivoモニタリングで
ルーチン内視鏡検査時には、粘膜の傷は3フレンチ(; 図1A 1ミリメートルに等しい)の直径を持つミニチュア生検鉗子により機械的に誘導された。その後、創傷治癒は、ImageJの( 図1B)は、例えば 、毎日の内視鏡検査によりモニターし、画像編集ソフトウェアを使用して残留創傷領域の測定によって定量した。経時的な個別の創傷閉鎖は、実際の創傷面積/初期創傷面積の商で表される。 7日目に創傷は通常、完全に( 図1C)に治癒したのに対し、例えば、創傷発生後3日目に、創傷面積の41%±4.1%が回収された。さらに、実験の終了時に、創傷は、ex vivoでの組織学的評価のために切除することができる。ヘマトキシリンとエオシンの描かれている代表的な画像(H&E)はダで巻かベッドが-stainedyは0と5日目( 図1D)。
内視鏡ガイド下粘膜内注入療法
薬理学的薬剤の粘膜内適用 のためには、最後(30 G)に固定カニューレとフレキシブルチューブ(0.96ミリメートルの直径)は、内視鏡( 図2A)の作業チャネルに導入された。針の粘膜内に配置した後、50μlと最大を慎重に注入した。成功した粘膜内のアプリケーション、結腸粘膜の上昇の指標は、容易に肉眼で( 図2B、C)を観察することができる。
実験的大腸炎のin vivoでの評価では
大腸炎の誘導後、マウスは、19%が7日目( 図3A)で発生するの体重の最大損失と3日目からの体重減少を示した。体重を毎日測定に加えて、疾患活動性は、反復内視鏡検査によりモニターした巨視的大腸炎の重症度(MEICS)のマウスの内視鏡指数による炎症の定量化。体重の減少に応じて、MEICSスコアは、13日目( 図3B)で改善された結腸粘膜、の大規模な炎症性の損傷を示すDSSの開始後7日目で増加した。組織学的損傷のex vivoの相関については、結腸のH&E染色切片の炎症性変化は、11のスコアを Dielemanに従って定量した。 DSSの開始後7日目に、組織学的損傷は、上皮削剥によって反映されるように、対照と比較して、DSS処置マウスにおいて有意に高かった、粘膜潰瘍だけでなく、増加した好中球の浸潤とは大幅に13日目( 図3C、E)で改善された。また、粘膜生検の組織学的評価は、定期的に内視鏡検査中に得られた( 図3F-H)7日目に大腸炎の進行期を裏付け。
約80日後、AOMおよびDSS( 図4A)の3サイクルによる腫瘍誘導後、複数の結腸腫瘍( 図4C)ならびに、グラニュー粘膜の慢性炎症の巨視的徴候が( 図4B)10 は、内視鏡的に観察された。 H&E染色による結腸直腸腫瘍の組織学的評価は、ハイグレード上皮内腫瘍ととせずに腺腫を明らかにした。したがって、AOM-DSSモデルは、発癌12の分子プロセスを研究するだけでなく、新たな診断装置13を評価するために最適なモデルに似ています。特定の分子を標的蛍光イメージングは、「写真のメソッド」14,15と生体内分子イメージングにできます。 FEの実現可能性を実証するために、FITC、広く使用されている蛍光色素を使用した。特定のFITC検出のために、バンドパスフィルタシステムは、lの組み合わせIGHT源が必要とされる特定の励起波長(; 図4Dは490nm)を得た。 FITC固有の発光波長(525 nm)での正確な検出のために、第2のバンドパスフィルタは、カメラヘッドと内視鏡( 図4E)との間に介在させた。トレーサー適用することなく、FEは、特定の信号および結腸組織や糞便自家蛍光( 図4F、G)との相互作用を検出しませんでした。対照的に、すぐにFITC-デキストランの静脈内適用 後に、蛍光色素は、結腸粘膜で観察することができ、慢性炎症( 図4H)の領域における増加した血管分布の評価、ならびに悪性の粘膜( 図4I)を用いてもよい。従って、画像編集ソフトウェアによって蛍光強度の定量化は、非患部結腸粘膜( 図4K)と比較して、悪性組織内の蛍光色素の有意に増加した取り込みを示した。
= "常に"キープtogether.within-ページ>:FO "jove_content」 
in vivoでの上皮創傷治癒だけでなく、創傷治癒の定量的および組織学的評価の図1に内視鏡的モニタリングが行われます。大腸の傷の発生後、境界線を巻き付けて創傷の閉鎖を容易に検出することができる。 。創傷領域( 白矢印 ) を定量的に上皮創傷治癒(A - C)従うべき毎日のフォローアップ内視鏡検査中に評価されるex vivoでの創傷治癒(D)の組織学的分析のために、創傷を切除したし、H&E染色した。スケールが描かスケールバーによって定義されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
2「FO:コンテンツ幅=「再5インチ "SRC =" /ファイル/ ftp_upload / 51875 / 51875fig2highres.jpg "幅=" 500 "/>
図2の内視鏡ガイド下粘膜内注入療法。視覚制御下で、針(A)の先端は柔らかく結腸粘膜に入れ、溶解した物質の50μlの(B)に注入される。続いて、マークされた粘膜リフティングは(C)を 、出血、急性の徴候なしで( アスタリスク ) を認識することができる。スケールが描かスケールバーによって定義されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。

実験的なDSS大腸炎の経過の図3。内視鏡評価。大腸炎の経過を評価した体重の変化によるdの内視鏡検査だけでなく、炎症を起こした結腸のセクションと、内視鏡生検の組織学的分析。 7日目の体重と高度な組織学的損傷の大規模な損失(A、C、E、倍率10倍)に沿って、倍率5倍、内視鏡検査、得られた生検の組織学的評価は、重度の炎症の徴候(B、D、G、Hを描いたおよびDSSの後13日目のに対し、10倍)は、炎症性変化が大幅に改善された開始。スケールが描かスケールバーによって定義されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
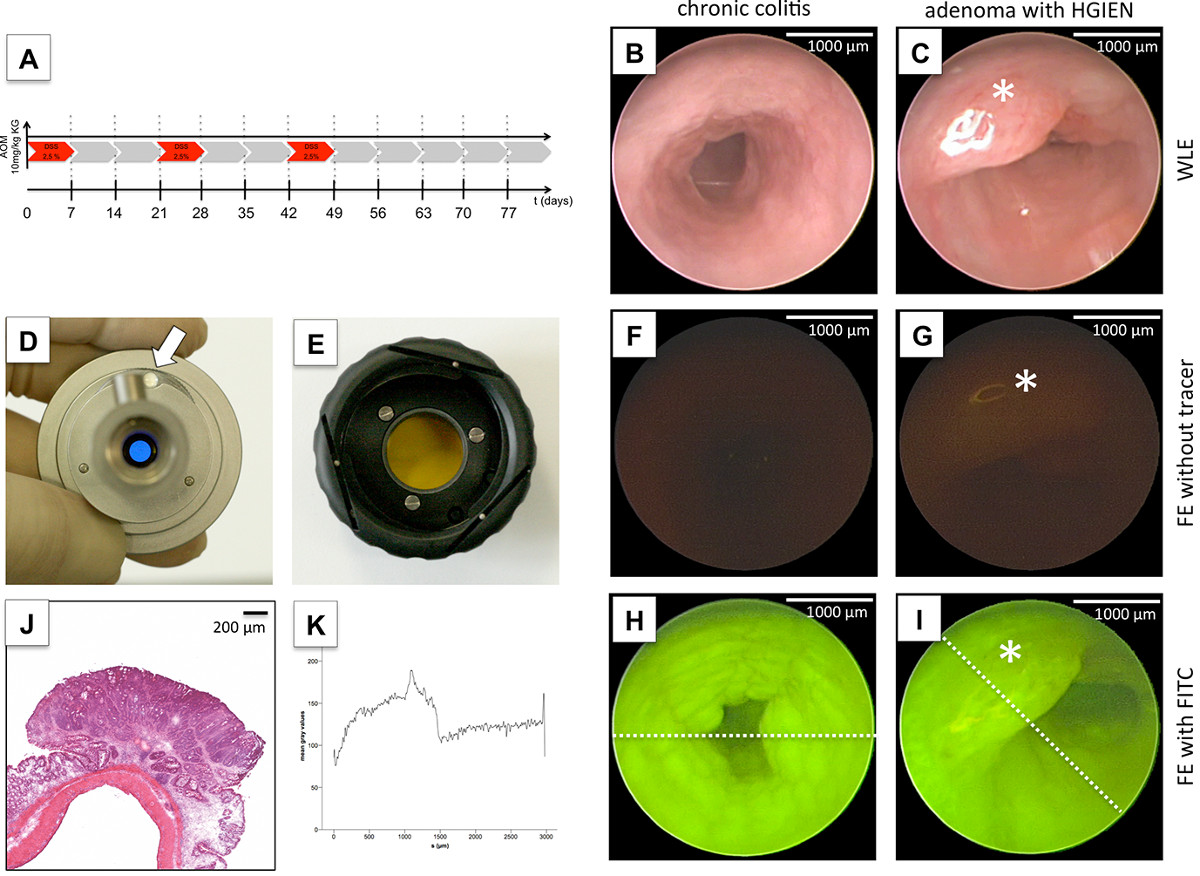
Fiの結腸直腸腫瘍のグレ4 FE。11週目(A)用AOMおよび環状のDSS投与による結腸直腸癌発生の誘導後、白色光内視鏡検査は、慢性大腸炎(B)を示す顆粒化粘膜と診断された多数の管腔内の病変(C)を検出したex vivoでのH&E染色による高品位上皮内腫瘍(G)との腺腫。慢性炎症(H)の可視化および腫瘍(I)は容易に可能であったが、FEはトレーサー適用せずに、FITC、FEをターゲットに用いて、決定的な腫瘍の検出(F、G)を許可していませんでした。非患部結腸粘膜と比べて、それに応じて、蛍光強度の定量化は、有意にグレースケールプロファイル(E、F)で示される、悪性組織内で増加した。白色光colonoscop中に蛍光モードに切り替えるにはyは、特定の帯域通過フィルタは、さらに、特定の励起波長を提供するために、冷光源に差し込まれている( 例えば、FITC用の490nm、D)。このフィルタは、白色光と蛍光モード間( 白矢印 )(D)に切り替えが容易になる。特定の発光波長を捕捉するために( 例えば、FITC 525 nm)を、第2のバンドパスフィルタは、バヨネットジョイント(E)を用いた内視鏡とカメラヘッドとの間に介在されている。スケールが描かスケールバーによって定義されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。

内視鏡作業ステーションの図5の実験のセットアップ。内視鏡作業ステーション( A)は、次のコンポーネントで構成されています。簡単な望遠鏡を(0°、直径:1.9ミリメートル、長さ10センチメートル、B)、内視鏡用シース(9イワナ)C(なし)とワーキングチャネル(D)、カメラ(付き。 E)及び生検鉗子(F)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
上皮創傷治癒は継続的なプロセスです。消化管粘膜内の表面細胞の連続生理学的剥離は上皮細胞16の頻繁な再生を必要と発生します。その結果、創傷治癒障害は、胃腸潰瘍および17吻合漏れ18を含むいくつかの疾患に対して計り知れない影響を与えます。上皮の治癒を刺激するための分子背景ならびに潜在的な薬物候補の評価は不完全にしか19,20 インビトロでの細胞培養系で行ってもよい。したがって、このような生検鉗子で定義された粘膜の傷の発生にネズミ大腸内視鏡検査など、より洗練された実験装置は、胃腸創傷治癒の信頼できるin vivoでの評価を可能にし、腸の炎症および創傷治癒プロセス間の相互作用の可能性を評価するために必要とされている。
また、注射針はリットルを用いてもよい診断染料または潜在的な薬剤候補のOCAL粘膜内投与を含む。これは、作業チャネルを通して導入することができる端部に固定された針を可撓性チューブ(0.96ミリメートルの直径)を用いて達成することができる。試験薬剤ならびにプラセボ対照は、同じ動物内の別個の炎症性または腫瘍性病変に送達することができることを考えると、このアプローチは、従来の実験的な設定に比べて信頼性の利点を提供する。局所注射のさらなる適用は、マウス結腸21内に同所性腫瘍を生成するために、ヒトまたはマウスの腫瘍細胞の移植である。
大腸炎のマウスモデルは、病態生理を解明するだけでなく、前臨床潜在的な治療薬を評価するために必要とされている。したがって、疾患経過の正確なモニタリングが極めて重要である。従来は、疾患の重症度は、通常、体重、haemoccult試験ならびに分析などの間接的なパラメータによって評価される血液および糞便の。これとは対照的に、大腸炎の重症度を直接測定は、多くの場合、動物の死を必要とする組織学的分析の死後 、これらに限定されている。しかし、マウスの大腸内視鏡検査は、 生きたマウスの結腸粘膜の直接可視化を提供しています。さらに、大腸炎の特徴のための直接的かつ反復的な監視が不均一な疾患の発症、 例えば、IL-10欠損マウスまたはRAG欠損マウスにおけるtransfercolitisのモデルでの実験モデルにおいて必須であることが可能である。その結果、大腸炎のマウスの内視鏡インデックスは、粘膜炎症および同じ動物のシリアル追跡検査の客観的な定量化を可能にする6は確立されている。
結腸直腸発癌との関連では、大腸内視鏡検査は、さまざまな有益な機会を提供しています。例えば、非侵襲的な方法とは対照的に、内視鏡検査は、腫瘍の大きさをin vivoで決定できるようにする最初のアプローチであるおよび腫瘍の番号。さらに、特定の分子を標的とする蛍光光プローブを使用すると、分子プロセスの可視化および定量化を可能にします。 Foersch らによって行われ、翻訳の研究では。悪性結腸粘膜内でVEGF発現の特異的標的化が実現可能であることが示された病変の特徴付けおよび結腸直腸癌の22人の患者における治療反応の予測のために使用することができる。さらに、この分子イメージング手法から得られる情報は、ヒト患者での使用のために翻訳することができる可能性がある。これは内視鏡検査中に疑わしい病変の生の特徴付けを可能にするであろう。最後に、これをターゲット病変23側の酵素プロセスによる蛍光体の活性化によってこれらのトレーサーの「スマートプローブの増加特異性と呼ばれる。
マウス内視鏡検査を行う場合には、特定のプロトコルのいくつかのステップは、特に重要である。例えば、別のカ使用菌株は、麻酔およびDSS濃度に対する感受性が異なる。したがって、このプロトコルは、ローカル設定に適合させるために必要とされてもよい。さらに、内視鏡検査およびマウス解剖学の正確な知識を行う上での経験は、安全で、目標指向で最適なマウス内視鏡検査を行う必要がある。この技術の可能性の限界につきましては、したがってとして右端たわみなどの結腸に手続きを制限すること、使用される内視鏡システムが剛性であることを強調している。さらに、FEに適用可能な最も蛍光色素は、現在、そのため、ネズミの研究のために利用できるが、まだヒト患者での使用が承認されていない、彼らの安全性プロファイルについて評価している。
手順の実用性に関する重要なステップは次のとおりです。ADVがあった場合、(1)異なる系統の間で変化し得る誘導性大腸炎をDSSに対する感受性以来、急性DSS大腸炎の誘導は、動物の死を危険にさらす可能性大腸炎の重症度のとれた。したがって、個別の株および使用される特定のDSSバッチに最も適しを識別するために、いくつかのDSS濃度を評価検討する。内視鏡検査では、大結腸内便の塊の存在下で困難な場合があります。かなりの糞ロードはビューのみ を明瞭にすることが疑われる場合の視認性を向上させるケリカニューレ浣腸液の2ミリリットルの直腸アプリケーションを使用して、前の手順に排便を誘発。生検中に高い穿孔率が発生した場合は、粘膜の生検を取得する前に結腸に空気の供給を減少させ、枝を閉じる前に、粘膜表面上の生検鉗子の圧力を低下させる。
そのような体重、糞便、血液の発生、末梢血または死後組織学的分析の分析などの間接的なパラメータによって実験的大腸炎または発癌の疾患活動性を評価するための従来の方法とは対照的に、一緒になって、端oscopyベースの技術は、視覚的な制御の下で生検を行う機会と疾患経過のライブ監視を可能にする。また、治癒および局所的に適用薬物候補の治療的影響は、インビボで評価することができる創傷。
開示事項
著者らは、開示することは何もない。
謝辞
私たちは、専門的な技術支援をソーニャDufentesterとエルケ·ウェーバーに感謝します。私たちは、医療情報をサポートするための原稿やステファンブルックナーの校正のためのFaekah Goharに感謝します。この作品は、エルス·クローネ - フレゼニウス·財団(2012_A94)から学際的な助成金によってサポートされていました。 D. Bettenworthは医学部、WestfälischeWilhelms-工科大学ミュンスターから研究フェローシップによってサポートされていました。 M·ブルックナーはドイツ学術振興(DFG SFB1009B8)の「ゲロク」の回転位置によってサポートされていました。 私たちは、マウスの漫画の図については、平家ブルムに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alfalfa-free diet | Harlan Laboritories, Madison, USA | 2014 | |
| Azoxymethane (AOM) | Sigma-Aldrich, Deisenhofen, Germany | A5486 | |
| Bepanthen eye ointment | Bayer, Leverkusen, Germany | 80469764 | |
| Dextran sulphate sodium (DSS) | TdB Consulatancy, Uppsala, Sweden | DB001 | |
| Eosin | Sigma-Aldrich, Deisenhofen, Germany | E 4382 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich, Deisenhofen, Germany | E 9884 | |
| Falcon Tube 50 ml | BD Biosciences, Erembodegem, Belgium | 352070 | |
| Florene 100 V/V | Abbott, Wiesbaden, Germany | B506 | |
| Haematoxylin | Sigma-Aldrich, Deisenhofen, Germany | HHS32-1L | |
| Isopentane (2-Methylbutane) | Sigma-Aldrich, Deisenhofen, Germany | M32631-1L | |
| Methylene blue | Merck, Darmstadt, Germany | 1159430025 | |
| O.C.T. Tissue Tek compound | Sakura, Zoeterwonde, Netherlands | 4583 | |
| Omnican F - canula | Braun, Melsungen, Germany | 9161502 | |
| Phosphate buffered saline, PBS | Lonza, Verviers, Belgium | 4629 | |
| Sodium Chloride 0.9% | Braun, Melsungen, Germany | 5/12211095/0411 | |
| Standard diet | Altromin, Lage, Germany | 1320 | |
| Tissue-Tek Cryomold | Sakura, Leiden, Netherlands | 4566 | |
| Vitro – Clud | R. Langenbrinck, Teningen, Germany | 04-0002 | |
| Equipment | |||
| AIDA Control | Karl Storz - Endoskope, Tuttlingen, Germany | 20 096020 | |
| Bandpass filter | Semrock, Rochester, USA | HC 716/40 | |
| Bandpass filter | Semrock, Rochester, USA | HC 809/81 | |
| Biopsy Forceps, 3 Fr., 28 cm | Karl Storz - Endoskope, Tuttlingen, Germany | 61071ZJ | |
| Dell Monitor | Dell, Frankfurt am Main, Germany | U2412Mb | |
| Examination Sheath, 9 Fr. | Karl Storz - Endoskope, Tuttlingen, Germany | 61029D | |
| Examination Sheath, 9 Fr. | Karl Storz - Endoskope, Tuttlingen, Germany | 61029C | |
| Fiber Optic Light Cable, 3.5 mm | Karl Storz - Endoskope, Tuttlingen, Germany | 69495NL | |
| Fluorescein Blue Filter System | Karl Storz - Endoskope, Tuttlingen, Germany | 20100032 | |
| Fluorescein Barrier Filter | Karl Storz - Endoskope, Tuttlingen, Germany | 20100033 | |
| Foot switch | Karl Storz - Endoskope, Tuttlingen, Germany | 20010430 | |
| HOPKINS Telescope, 1.9 mm, Length 10 cm | Karl Storz - Endoskope, Tuttlingen, Germany | 1830231 | |
| SCB D-light P | Karl Storz - Endoskope, Tuttlingen, Germany | 20 133720 | |
| SCB tricam SL II | Karl Storz - Endoskope, Tuttlingen, Germany | 20 2230 20 | |
| Tubing set instruments VETPUMP II | Karl Storz - Endoskope, Tuttlingen, Germany | 69811 | |
| Tricam PDD PAL | Karl Storz - Endoskope, Tuttlingen, Germany | 20221037 | |
| UniVet Porta | Groppler Medizintechnik, Deggendorf, Germany | BKGM 0451 | |
| Vetpump 2 | Karl Storz - Endoskope, Tuttlingen, Germany | 69321620 | |
参考文献
- Bettenworth, D., et al. Translational 18F-FDG PET/CT imaging to monitor lesion activity in intestinal inflammation. Journal of nuclear medicine : official publication, Society of Nuclear Medicine. 54, 748-755 (2013).
- Lewis, J. S., Achilefu, S., Garbow, J. R., Laforest, R., Welch, M. J. Small animal imaging. current technology and perspectives for oncological imaging. European journal of cancer. 38, 2173-2188 (2002).
- Huang, E. H., et al. Colonoscopy in mice. Surgical endoscopy. 16, 22-24 (2002).
- Becker, C., et al. In vivo imaging of colitis and colon cancer development in mice using high resolution chromoendoscopy. Gut. 54, 950-954 (2005).
- Becker, C., Fantini, M. C., Neurath, M. F. High resolution colonoscopy in live mice. Nature protocols. 1, 2900-2904 (2006).
- Neurath, M. F., et al. Assessment of tumor development and wound healing using endoscopic techniques in mice. Gastroenterology. 139, 1837-1843 (2010).
- Pickert, G., et al. STAT3 links IL-22 signaling in intestinal epithelial cells to mucosal wound healing. The Journal of experimental medicine. 206, 1465-1472 (2009).
- Shapira, Y., et al. Utilization of murine laparoscopy for continuous in-vivo assessment of the liver in multiple disease models. Plos one. 4, e4776(2009).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nature protocols. 2, 541-546 (2007).
- Neufert, C., Becker, C., Neurath, M. F. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nature protocols. 2, 1998-2004 (2007).
- Dieleman, L. A., et al. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clinical and experimental immunology. 114, 385-391 (1998).
- Gao, Y., et al. Colitis-accelerated colorectal cancer and metabolic dysregulation in a mouse model. Carcinogenesis. 34, 1861-1869 (2013).
- Foersch, S., Neufert, C., Neurath, M. F., Waldner, M. J. Endomicroscopic Imaging of COX-2 Activity in Murine Sporadic and Colitis-Associated Colorectal Cancer. Diagnostic and therapeutic endoscopy. 2013, 250641(2013).
- Bremer, C., Ntziachristos, V., Weissleder, R. Optical-based molecular imaging: contrast agents and potential medical applications. European radiology. 13, 231-243 (2003).
- Keller, R., Winde, G., Terpe, H. J., Foerster, E. C., Domschke, W. Fluorescence endoscopy using a fluorescein-labeled monoclonal antibody against carcinoembryonic antigen in patients with colorectal carcinoma and adenoma. Endoscopy. 34, 801-807 (2002).
- Jones, M. K., Tomikawa, M., Mohajer, B., Tarnawski, A. S. Gastrointestinal mucosal regeneration: role of growth factors. Frontiers in bioscience : a journal and virtual library. 4, 303-309 (1999).
- Mertz, H. R., Walsh, J. H. Peptic ulcer pathophysiology. The Medical clinics of North America. 75, 799-814 (1991).
- Pantelis, D., et al. The effect of sealing with a fixed combination of collagen matrix-bound coagulation factors on the healing of colonic anastomoses in experimental high-risk mice models. Langenbeck's archives of surgery / Deutsche Gesellschaft fur Chirurgie. 395, 1039-1048 (2010).
- Burk, R. R. A factor from a transformed cell line that affects cell migration. Proceedings of the National Academy of Sciences of the United States of America. 70, 369-372 (1973).
- Msaki, A., et al. The role of RelA (p65) threonine 505 phosphorylation in the regulation of cell growth, survival, and migration. Molecular biology of the cell. 22, 3032-3040 (2011).
- Zigmond, E., et al. Utilization of murine colonoscopy for orthotopic implantation of colorectal cancer. PloS one. 6, e28858(2011).
- Foersch, S., et al. Molecular imaging of VEGF in gastrointestinal cancer in vivo using confocal laser endomicroscopy. Gut. 59, 1046-1055 (2010).
- Mitsunaga, M., et al. Fluorescence endoscopic detection of murine colitis-associated colon cancer by topically applied enzymatically rapid-activatable probe. Gut. 62, 1179-1186 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved