Method Article
Medir a função respiratória em ratos usando Unrestrained pletismografia de corpo inteiro
Neste Artigo
Resumo
A avaliação da fisiologia respiratória, tradicionalmente invocado técnicas, que exigem contenção ou sedação do animal. Unrestrained pletismografia de corpo inteiro, no entanto, fornece uma análise precisa, não-invasivo, quantitativo de fisiologia respiratória em modelos animais. Além disso, a técnica permite a avaliação repetida respiratório de ratos permitindo estudos longitudinais.
Resumo
A disfunção respiratória é uma das principais causas de morbidade e mortalidade no mundo e as taxas de mortalidade continuam a subir. A avaliação quantitativa da função pulmonar em modelos de roedores é uma ferramenta importante para o desenvolvimento de futuras terapias. Comumente utilizadas técnicas de avaliação da função respiratória, incluindo pletismografia invasivo e de oscilações forçadas. Embora essas técnicas fornecem informações valiosas, a coleta de dados pode ser repleta de artefatos e variabilidade experimental, devido à necessidade de anestesia e / ou instrumentação invasiva do animal. Em contraste, a desenfreada pletismografia de corpo inteiro (UWBP) oferece uma maneira precisa, não-invasivo, quantitativo por que analisar parâmetros respiratórios. Esta técnica evita o uso de anestesia e apoios, o que é comum para as técnicas tradicionais de pletismografia. Este vídeo vai demonstrar o procedimento UWBP incluindo o equipamento configurado, calibração e pulmão gravação função. Eleirá explicar como analisar os dados recolhidos, bem como identificar os outliers experimentais e artefatos que resulta da circulação de animais. Os parâmetros respiratórios obtidos utilizando esta técnica incluem o volume corrente, volume minuto, ciclo inspiratório, fluxo inspiratório ea relação entre tempo de inspiração para tempo de expiração. Não UWBP não dependem de habilidades especializadas e é barato para executar. Uma característica fundamental do UWBP, e mais atraente para os potenciais utilizadores, é a capacidade de executar medidas repetidas da função pulmonar no mesmo animal.
Introdução
A disfunção pulmonar é uma das principais causas de morbidade e mortalidade no mundo. A condição é caracterizada por troca de oxigênio inadequada, sinônimo de tosse, dores no peito e dispnéia. Contas de doença respiratória para ~ 10% de mortalidade em todo o mundo 1. Segundo a Organização Mundial de Saúde, as taxas de mortalidade são definidos a subir devido à persistência do tabagismo, poluição e irritantes ocupacionais. UWBP é uma adição útil para o estudo da fisiologia pulmonar, que complementa fortemente bioquímicos tradicionais e análises histológicas 2. Outros procedimentos utilizados para a avaliação de pulmão não oferecem as mesmas vantagens que UWBP. Pletismografia invasiva é uma técnica comumente utilizada, que exige que o animal seja anestesiado 3,4 e, portanto, as medidas respiratórias decorrentes não são necessariamente reflexo de um estado natural. Além disso, a exigência de desafios de ventilação mecânica e química impede futuras medições 3,4.Outro método de coleta de dados respiratória é de oscilações forçadas, o que é mais sensível às mais refinadas alterações nos parâmetros respiratórios em comparação com UWBP 5. Oscilação forçada é, no entanto, uma técnica invasiva e requer terminação dos animais para coleta de dados 5-7.
UWBP envolve a colocação de um animal dentro de uma câmara especializada. Durante a inspiração, o ar é aquecido de maré e humidificado dentro dos pulmões aumento da pressão do vapor de água e faz com que a expansão térmica do gás 8. Este efeito provoca uma alteração líquida no volume de ar criando um aumento da pressão no interior da câmara 8 pletismógrafo. O oposto ocorre durante a expiração criar uma forma de onda respiratória do animal. Análise de forma de onda é, então, usado para medir a partir do traço respiratória: freqüência respiratória (respirações / min), tempo total do ciclo respiratório (seg), inspiração / expiração tempo (Ti / Te, sec) e alterações na pressão devido a cada volume corrente (P T). A figura 1 ilustra cada origem medições de um rastreio respiratório. Estas medições são simples de calcular e vários parâmetros respiratórios podem ser derivadas a partir destas medições. Estes parâmetros incluem: O volume corrente (o volume de ar deslocado entre a inalação e exalação normal), volume minuto (volume de gás inalado pelos pulmões por minuto), ciclo inspiratório (a percentagem de tempo de inspiração para a duração total do ciclo de respiração) e taxa de fluxo inspiratório (a quantidade de ar inspirado em um dado momento).
UWBP fornece uma análise precisa, não-invasiva, quantitativa da fisiologia respiratória em modelos animais e pode ser utilizada para medir a progressão da doença respiratória e função pulmonar 6,9. Ao contrário de outras técnicas de pletismografia, UWBP evita o uso de anestesia, restrições e manipulações invasivas que produzem artefatos e experimental 6,9 variabilidade. A anestesia pode suprimir a respiração,alterar a freqüência cardíaca e pode ser um desafio para regular 10. Restrições induzir um aumento na respiração devido ao estresse adicional via corticosterona e adrenalina liberar 11,13. A principal característica do UWBP é repetido avaliação fisiológica tornando-se passíveis de estudos longitudinais. UWBP é altamente recomendável para a avaliação longitudinal de fisiologia pulmonar e oferece uma valiosa habilidade para futura avaliação do medicamento respiratório.
Bleomicina, ovalbumina, e hipoxia têm sido utilizados para induzir desafios respiratórias em diversos estudos e UWBP mediu sucesso pulmão precisas avaliação fisiológica 7,9,13-16. O protocolo descrito foi concebido para ratos de laboratório normais de adultos. No entanto, UWBP foi adaptado a outros animais tais como ratos, cobaias, e primatas não-humanos 17-20. UWBP não se restringe apenas à avaliação da disfunção pulmonar, mas também tem sido utilizada para a avaliação da maturação pulmonar 3.A versatilidade, simplicidade e reprodutibilidade dos UWBP estabeleceram uma excelente técnica para avaliar a função pulmonar em animais. Software Vários (ver materiais e equipamentos de mesa) serão obrigados a seguir este procedimento. Um cientista experiente seria capaz de realizar este protocolo com um rato dentro de 1 hora.
Protocolo
NOTA: O seguinte procedimento experimental foi aprovado pelo Comitê de Ética Animal da Universidade de Monash e conduzida de acordo com o Código brasileiro de Prática para o Cuidado e Utilização de Animais para Fins Científicos (2006). Fêmea Adulta C57BL / 6 utilizados para gerar os resultados representativos foram obtidos a partir dos Serviços Animais Monash. Os ratinhos foram alojados em um agente patogénico livre, a temperatura e humidade ambiente específico controlado com um ciclo de luz-escuro de 12 h. Estes ratos tiveram livre acesso a comida e água.
1 Configuração inicial
- Conecte o laptop / desktop para a máquina de aquisição de dados para a gravação através de um cabo USB.
- Ligue o amplificador de Ponte de 'saída de 1 "a" entrada 1 "da máquina de aquisição de dados através de um cabo BNC.
- Insira o transdutor de pressão em "Canal 1" da Octal Ponte Amp. Desligue a máquina de aquisição de dados e abra o software de análise. O software deve autocamente detectar a configuração do equipamento (ver tabela de materiais e equipamentos).
- Configurações de canal aberto encontrados na barra de ferramenta de configuração do software. Alterar o número de canais que estão sendo gravados para um.
- Configure o barómetro para medir a pressão do quarto e do aparelho de coluna de água para calibrar o amplificador Bridge. O aparelho de coluna de água inclui duas pipetas de seringa de 5 ml serológicos ligados por um tubo de plástico.
- Preencha as colunas com água e garantir os níveis de água são equilibradas com uma régua. Conectar um pedaço de tubo de plástico de topo de cada pipeta. Figura 2 mostra a coluna de água definida acima.
2. Calibração Amplificador Ponte
Nota: Para calibrar o amplificador de ponte de uma injecção de ar para dentro da coluna de água é necessária para criar a 1 cm de H 2 O de deflexão. Isto irá ocorrer sob um único conjunto de condições e é dependente do aparelho do utilizador. Para esclarecimento destes passos demonstrate como este laboratório seria realizar a calibração.
- Retirar uma seringa de 1 ml para 300 ul; fixar a seringa para a torneira de passagem no final do tubo, do lado direito da coluna de água. NOTA: Verifique se a torneira está aberta para a seringa e da coluna de água e fechado para o ar ambiente. Se o nível de água não está em equilíbrio, neste ponto, virar a torneira para que ele seja aberto ao ar ambiente, e a coluna de água, isso vai reequilibrar a água. A tubagem do lado esquerdo da coluna de água deve ser ligada ao transdutor de pressão para medir a alteração da pressão induzida pela queda da seringa.
- Conecte o tubo da coluna de água, no lado esquerdo para o conector do transdutor de pressão (anel superior do transdutor).
- Selecione o menu de rolagem para baixo encontrado próximo ao canal 1 para a tela principal, no lado direito do software e selecione "amp Bridge" (ver tabela de materiais e equipamentos).
- Digiteas configurações a 5 mV, 20 Hz passa-baixa, marque a caixa 'invertido' e clique em "zero". Clique em "zero" para definir o traço em ~ 0 mV. Reduzir o tamanho da janela para 4: 1 para facilitar a visualização.
- Com tudo configurado, pressione a seringa de 1 ml, deixando-o por 3 s. Isto irá mostrar um aumento repentino no software, porque a pressão mudou. Quando os 300 ul é pressionado, a pressão vai passar a água na coluna de água de 1 cm. Este valor conhecido vai ajudar a calibrar o amplificador Bridge.
NOTA: O aumento da pressão na câmara devido à depressão 300 ul corresponde ao valor P K usado para cálculos posteriores. - Escolha das unidades de entrada 'encontrado no canto inferior esquerdo da janela do Bridge Amp.
- Realce o "traço fundo" antes do pico também conhecido como o 'Zero Região ".
- Clique na seta ao lado de "ponto 1" e isso vai produzir o background sinal no intervalo de -0,002 0,002 mV-mV (o valor nunca será exactamente a 0 mV).
- Tipo "0" na janela adjacente à janela de sinal de fundo.
- Destaque a "região pressão aumentou de gráfico" a partir de quando a seringa é deprimido. Clique na seta ao lado do ponto 2 eo valor deve estar no intervalo de 0,9-1,2 mV.
- Tipo "1" na janela ao lado da janela "aumento da pressão". Para um esclarecimento visual passos 2.7 e 2.8, consulte a Figura 3. Valores encontrados fora dos limites especificados pode indicar danos ao Octal Ponte Amp.
- Ir para "definir as unidades 'encontrado no canto superior direito da janela e selecione" cmH 2 O ". Se esta opção não estiver disponível, podem ser introduzidos manualmente. Clique em OK.
- Voltar para o menu do 'Ponte Amp "(vide 2.1). Selecione 1 mV e definir amplificador para "zero";. Isto irá completar a calibração e da coluna de água pode ser removido com segurança.
Função 3 Gravação Lung
- Pesa-se o rato (g). NOTA: Uma semana antes da avaliação fisiológica introduzir o mouse para o ambiente de câmara pletismografia. Isso vai ajudar na aclimatação e reduzir o estresse ao realizar este procedimento em uma data posterior. Para um esquema geral que demonstra a configuração UWBP, por favor, consulte a Figura 4.
- Medir a temperatura do corpo com um termômetro retal. Lubrifique o termômetro com vaselina antes da inserção. Gravar a leitura da temperatura do lubrificante e limpar-se com 80% (v / v) de etanol. Se usar muito pequenos animais, como filhotes de rato recém-nascidos, o valor médio da temperatura corporal pode ser determinada com um termômetro infra-vermelho em seu lugar.
- Coloque a sonda de umidade / temperatura relativa no final de um buraco da câmara de pletismografia. Registre a temperatura, umidade e barometric pressão dentro da câmara de pletismografia, antes de colocar o rato dentro.
- Posicione o mouse na câmara de pletismografia, cobrir a extremidade aberta ligeiramente. Isso permite que o mouse para aclimatar. Feche a câmara.
- Com a sonda de temperatura / humidade inserido na parte lateral da câmara de pletismografia com um furo, agora introduzir a seringa no transdutor e do outro lado com os dois orifícios.
- Pressione 'Start' no programa de software e registro de aproximadamente 15-45 seg. Recorde 5-10 seg de dados onde o animal não estiver em movimento. Movimento de vai alterar basal fisiologia respiratória do animal e fornecer maus resultados. A respiração deve oscilar num movimento linear no programa. Estes dados são utilizáveis. Nota: urinar ou defecar pode levar a um aumento da temperatura e humidade no interior da câmara de pletismografia. Isto irá obscurecer resultados durante a análise. Em caso de urinar ou defecar, parar a gravação imediatamente e limpar o plethysmography câmara com 80% (v / v) de etanol. Consulte a Figura 6 para uma representação visual de resultados abaixo do ideal, onde os dados devem ser rejeitados.
- Após a gravação de 45 segundos, pressione "Stop" no software (ver tabela de materiais e equipamentos) programa. Remover o rato da câmara de pletismografia e gravar imediatamente a temperatura ea umidade câmara. Não gravar continuamente por mais de 45 segundos, pois isso pode estressar o animal.
- Retorne o mouse para sua gaiola, spray e limpe a câmara com 80% (v / v) de etanol.
- Permitir que a câmara para secar e voltar à temperatura e humidade de linha de base, antes de prosseguir para o próximo rato. Repita os passos de 3,1-3,9 para animais subsequentes. Nota: Se vários animais estão sendo estudados, garantir que a temperatura da câmara e retorno aos valores basais umidade perto antes de cada novo animal é colocado na câmara.
4 Análise pletismografia
Nãote: Para calcular os parâmetros respiratórios, como volume corrente (V T) e volume minuto as seguintes variáveis precisam ser mensurados: freqüência respiratória (respirações / min), a respiração total de tempo de ciclo (seg), inspiração / expiração tempo (Ti / Te, segundos) e alteração na pressão devido a cada volume corrente (P T). figura 1 ilustra as variáveis que podem ser medidos a partir de um traço. Os passos seguintes utilizam um software (ver materiais e equipamentos de mesa) para medir essas variáveis. Ao analisar, evite regiões do traço contendo cheirar ou movimento. Para obter resultados reproduzíveis, pelo menos, 5 segundos de boa traço respiração é necessária. Para um exemplo de diferentes traços de respiração consulte a Figura 5 e 6.
- Abra a tela para tela cheia, defina vista a 1: 1 e selecionar 5 seg de dados utilizáveis. Um instantâneo representativo disto é mostrado na Figura 5.
- Abra a janela de mini-pad dados encontrado na parte superior do programa na aba Datapad. Escolha o canal 1 e selecione 'medições de ciclo' na coluna da esquerda e 'height cíclica média' na coluna da direita.
- Selecione 'Opção' e definir a escala para a detecção de pico mínima de 1 (ms). Isto irá permitir a detecção de todos os valores de pico e torna-se extremamente importante na utilização de pequenos animais que produzem pequenas oscilações.
- Clique em 'OK'. Isto irá apresentar «deformação Pressão devido a cada volume corrente" medida (P T).
- No bloco de dados mini, selecione 'medições de ciclo "seguido de" contagem de eventos' e clique em 'OK'. Isto irá apresentar o «frequência» (f) medição.
- Frequência precisa de ser convertido em respirações / min. Isto é feito através da multiplicação do valor por 60 seg e dividindo a resposta pelo tempo total de gravação (min).
- No bloco de dados mini, selecione 'cymedições cle 'seguido de' período 'e clique em' Ok '. Isto irá apresentar o "tempo total do ciclo de respiração '(T tot, sec) de medição.
- Os próximos passos são usados para criar um macroinstruction para gerar inspiração e expiração valores de tempo de pico. Verifique se o cursor estiver diretamente sobre o máximo do pico / cocho e adicionar um comentário em 9 picos seqüenciais e depressões. Comece com o pico da oscilação, como mostrado na Figura 5.
- Posteriormente, selecione janela: Almofada de dados e coluna 1 Na janela que aparecer, clique em "informações de seleção" na coluna da esquerda, "duração" na coluna da direita e clique em 'OK'.
- Selecione macro encontrada na parte superior do programa e, em seguida, iniciar a gravação. Agora selecione comandos: 'Encontrar', 'Go', 'Start of File "e clique em' Pesquisar '.
- Selecione os comandos: 'Find' e 'Find comentários'. Digite a mesma frase digitada para a caixa de comentário na caixa 'contendo' fornecido. Escolha o 'Selecione a ponto anterior' guia e 'Pesquisar'.
- Selecione os comandos: "Adicionar ao bloco de dados". Em seguida, selecione macro: comandos de macro e começar a repetir. A janela de contagem de repetição que aparece deve ser fixado em 9.
- Selecione o comando: 'Encontrar próximo'. Escolha um comando: "Adicionar ao bloco de dados". Finalmente, selecione comandos de macro e final da repetição.
- Agora, selecione a macro e parar a gravação. Salve e nomeie a macro depois que o número de animais. NOTA: A configuração do macro para cada animal permite que a macro a ser utilizado para estudos longitudinais e economiza tempo.
- A macro agora pode ser executado para obter o Inspiration (T i) e expiração (T e) tempo entre cada comentário. Os dados serão exibidos em canal 1 da datapad. Expiração e inspiração ocorre consecutivamente e os dados aparecerão nesta ordem.
- Os dados precisam ser divididas manualmente em valores de inspiração e expiração. Calcule a média dos quatro valores de dados de cada parâmetro para se obter a média i o t e t e.
- Uma vez que os valores primários foram derivados do volume corrente (V T, ml) pode ser calculado. Para obter o volume corrente a equação de Drorbaugh Fenn e 8 é usado:
V T (ml) = (P T / P K) x (V K) x ((temperatura central (P B - P C)) / (temperatura central (P B - P C) - T C (P B - P CORE)))
Onde
V T: Volume Tidal
P k: desvio de pressão devido a cada injeção de 1 ml (Consulte o passo 2.5)
T core: temperatura do núcleo de cada animal
P C: pressão de vapor de água na câmara de temperatura X Umidade relativa em chamber
T C: temperatura na câmara de animais
P central: Pressão à temperatura do corpo (pressão do vapor de água à temperatura do corpo x 1.0)
P t: desvio de pressão devido a cada volume corrente
V k: Volume de injeção para a calibração
P B: pressão barométrica - Uma vez que o volume corrente tem sido calculados os seguintes parâmetros também podem ser determinados:
- Volume minuto (ml / min) = V T xf
- Volume minuto (ml / min / kg) = (V xf T) / Peso corporal (kg)
- V T (ml / kg) = V T (ml) / peso do corpo (kg)
- Ciclo inspiratória (%) = T i / T tot
- Inspiratória Vazão (ml / seg) = V T / T i
- Proporção de tempo de inspiração para tempo de expiração = T i / T e
- O tempo total do ciclo (sec) = tempo de Inspiração (s) + tempo de expiração (seg)
Resultados
Quando este procedimento foi seguido corretamente, um traço oscilante consistente é criado no software de análise de dados. O procedimento prevê um traço respiratória em poucos minutos após a configuração com cálculos simples de computação para determinar parâmetros respiratórios indicados. Figura 5 representa um traço respiratória adequada de um controle (saudável) do mouse. Dados oscilante adequado é produzido quando o animal não está em movimento activamente.
UWBP é uma avaliação extremamente útil e fiável da função do pulmão entre o controlo e coorte fibrose pulmonar. Figura 7 demonstra a função do pulmão de um rato de fibrose pulmonar induzida por bleomicina no dia 14 em comparação com o controlo de gráfico, a Figura 7 ilustra uma diferença visual consistente com a administração de bleomicina 7. Como discutido anteriormente, o procedimento pode ser repetido o que nos permite observar as mudanças no paramete respiratóriars ao longo do tempo entre os dois grupos.
Os resultados obtidos devem ser expressos como média ± SEM. Recomenda-se copiar e colar os dados coletados em uma planilha do Excel simples. Isso irá tornar-se útil para a realização de cálculos discutidos nas etapas 4,13 e 4,14. A função respiratória pode ser comparado visualmente entre dois grupos, como demonstrado na Figura 8.

Figura 1: Componentes diferentes do ciclo de respiração ilustrado utilizando a pletismografia barométrica. Este gráfico ilustra a) a mudança na pressão devido à inspiração (ΔPi), b) a mudança na pressão devido a cada volume corrente (PT), c) o mudança na pressão devido à expiração (ΔPe), d) o tempo de ciclo de respiração total (Ttot), e) tempo de inspiração (Ti) e f) tempo de expiração (Te). Clique aqui para ver a imagem ampliada.
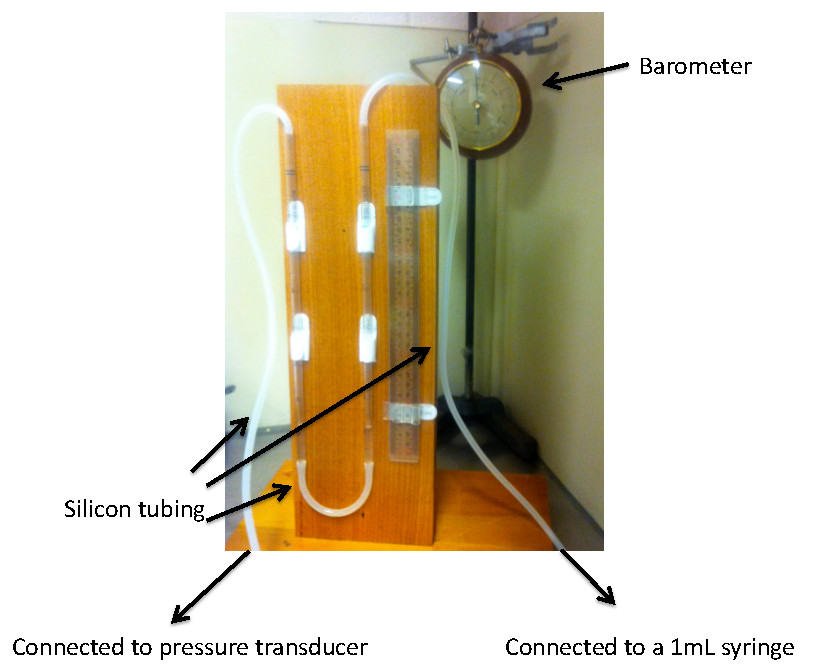
Figura 2 Representação visual da configuração do barômetro e água coluna. A figura é projetado para auxiliar o leitor na criação da coluna barômetro e água para o processo de calibração. Observe a água é o nível dentro das duas colunas com o auxílio de régua. As duas colunas estão ligadas através de 15 cm de tubagem de plástico. O tubo da direita (65 cm) está ligado a uma seringa de 1 ml e para a esquerda (75 cm) do transdutor de pressão ligado à máquina de aquisição de dados. Nota:. Da extensão de tubagem determina o volume (300 mL) necessária para mover um centímetro de água clique aqui para visualizarAmpliar Imagem.

Figura 3 executando os passos 2.4 e 2.5 de Calibração Amp Bridge. Esta figura ilustra as etapas 2.7 e 2.8 para a calibração do equipamento. É fundamental para corrigir a Ponte Amp para obter resultados precisos. Clique aqui para ver a imagem ampliada.

Figura 4 um esquema geral da instalação UWBP. Para a esquerda é a sonda de humidade / temperatura ligado a um lado da câmara de pletismografia contendo o animal. Para a direita é a seringa de calibração e transdutor de pressão líderda câmara de pletismografia para o sistema de aquisição de dados produzindo um traço respiratória no computador. Clique aqui para ver a imagem ampliada.
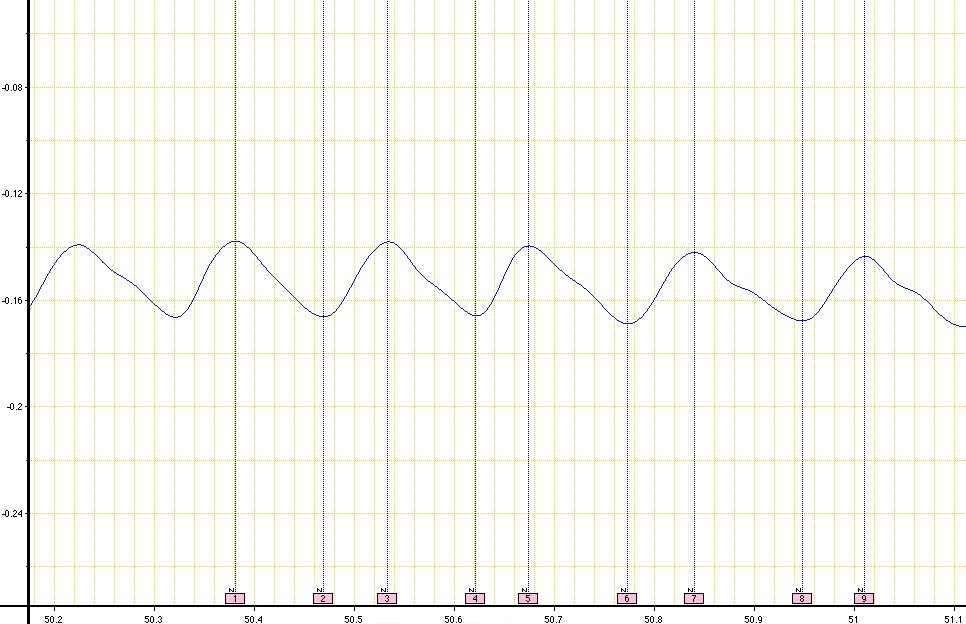
Figura 5 Um exemplo de um rastreio de respiração respiratório de um ratinho C57BL / 6 de controlo obtido quando se usa UWBP. Esse rastreio respiração ilustra disso, dados consistentes a partir de um animal de controlo. Nove Comentários consecutivos são adicionados nos altos e baixos das oscilações para obter os parâmetros respiratórios indicados respirando seguindo os passos 4,1-4,13. O tempo é representado ao longo do eixo x-(seg) e as alterações de pressão ao longo do eixo-y (cm.H 2 O). Clique aqui para view imagem maior.
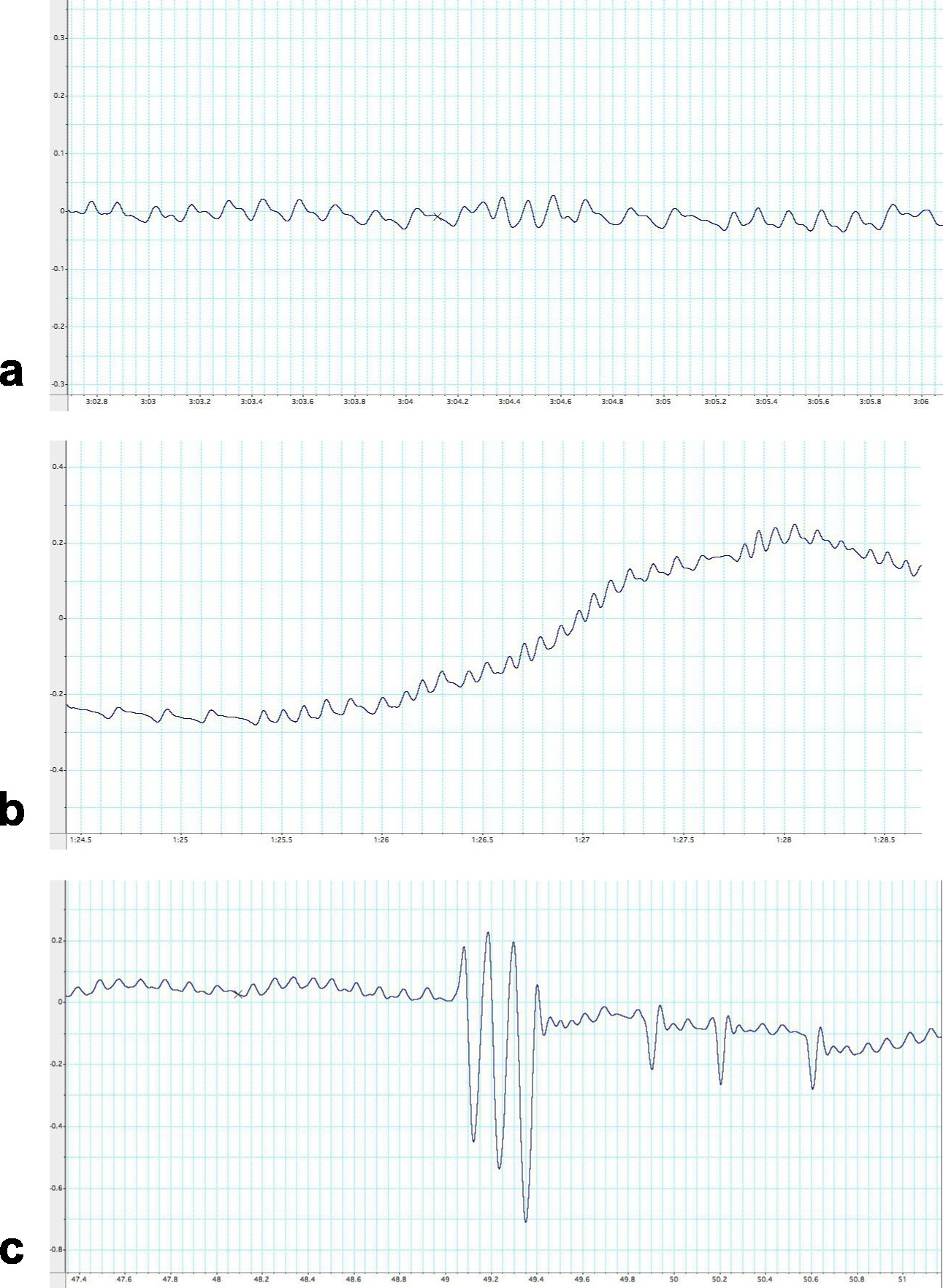
Figura 6 Exemplos de diferentes traços sub-ótimos obtidos a partir de um camundongo C57Bl / 6, quando usando UWBP. Resultado sub-ótimo pode ser confundido como dados apropriados e é a fonte mais comum de análise pobres. Esta figura ilustra os traços abaixo do ideal mais comuns que nunca devem ser utilizados para a análise. Esses traços de respiração demonstrar a) Um traço respiração gravado enquanto o animal está cheirando e movendo alterando basal fisiologia respiratória do animal. B) Um traço gravado resultando oscilações aumentando gradualmente ao longo do tempo é geralmente causada por condensação e humidade construir. No entanto, o traço pode ser corrigida por limpar a câmara de pletismografia com etanol ou repetindo os passos de calibração. C) Um traçoregistrados durante o movimento da câmara pletismografia quando o animal ou pesquisador está envolvido com o equipamento. O tempo é representado ao longo do eixo x-(seg) e as alterações de pressão ao longo do eixo-y (cm.H 2 O). Clique aqui para ver a imagem ampliada.

A Figura 7 um exemplo de um traçado de respiração obtidas de um / 6 rato C57BL com fibrose pulmonar induzida pelo uso UWBP. Esse rastreio respiração ilustra disso, dados consistentes a partir de um animal com pulmonar induzida obtido quando se utiliza o procedimento UWBP descrito neste artigo. Nove Comentários consecutivos são adicionados nos altos e baixos das oscilações para obter os parâmetros respiratórios indicados respirando seguindo os passos 4,1-4,13. Horário repretados ao longo do eixo x-(seg) e as alterações de pressão ao longo do eixo-y (cm.H 2 O). Clique aqui para ver a imagem ampliada.

Figura 8 A função respiratória em comparação entre o controle e bleomicina desafiou C57BL / 6. Realizar análise pletismografia após usar UWBP permitirá ao usuário a resultados semelhantes ao que está representado aqui. Esta figura demonstra as diferenças fisiológicas entre bleomicina desafiou animais (linha cinza pontilhada) e os animais controle (linha sólida preta). Estes gráficos mostram comparações a) tempo de expiração (seg), b) tempo Inspiration (SEC), c) ciclo de Inspiração (%), d) taxa de fluxo inspiratório (ml / seg)e) A taxa respiratória (respirações / min), f) o volume minuto (ml / min / kg), g) O volume corrente (ml / kg) e h) do tempo total do ciclo (s). Dados de função pulmonar foram coletados longitudinalmente no mesmo grupo de animais nos dias 0, 7 e 14 após o desafio com bleomicina. Dados Representante foi adaptado a partir Murphy et al. (2012) 16. Clique aqui para ver a imagem ampliada.
Discussão
A técnica descrita aqui é um método não-invasivo para avaliação de parâmetros respiratórios de ratos sem restrições e não anestesiados. Os pontos fortes deste protocolo incluem sua simplicidade e precisão para medir a função pulmonar longitudinalmente com artefatos mínimos. Existem, no entanto, algumas limitações e passos críticos para ser notado sobre o procedimento. Em primeiro lugar e mais importante, o mouse deve manter a calma dentro da câmara por um período mínimo de cinco segundos. Adicionado estresse pode atrapalhar o padrão de respiração do mouse e, portanto, fornecer resultados variáveis (Figura 6A). Este inconveniente provavelmente permanecerá e é de se esperar, às vezes. No entanto, substituir o mouse em sua gaiola de casa e permitindo-lhe tempo para reassentar facilmente corrigir isso. É fundamental que o animal se sente confortável no ambiente de câmara para obter cinco segundos de apropriados / dados utilizáveis. Uma análise mais aprofundada é necessária em relação ao ambiente de câmara. O ambiente, unrelated a mecânica respiratória, pode afetar significativamente os resultados. Como a duração dos aumentos de avaliação, a umidade ea temperatura da câmara aumenta, bem como a diminuição do oxigênio disponível, impactando significativamente em ventilação. O momento de ventilação aumenta a umidade e temperatura da câmara, bem como diminuir o oxigênio disponível 21. Um pequeno vazamento na câmara pode ajudar na redução de desvios térmicos criados a partir da produção de calor 22,23. O protocolo discutidos é específico para o equipamento e instrumentação listados. A calibração do amplificador de ponte na seção dois dependerá equipamentos do leitor. Se fatores como o comprimento da tubulação são diferentes uma injeção de 300 l de ar não pode causar um 1 cm.H 2 O deflexão.
Há também diferenças fisiológicas, dependendo do tempo de análise. Roedores são criaturas naturalmente noturnos e ciclos circadianos, o que acabará por gerar mudanças narespiração, deve ser levado em conta quando cronometrando os experimentos 24. Assim, é necessário tempo e planejar as experiências de tal forma que os dados experimentais podem ser comparados com precisão entre coortes. Também é importante tomar nota do movimento de rastreamento. Se as oscilações não estão em execução em um padrão linear, geralmente é devido a uma acumulação de condensação ou umidade dentro da câmara (Figura 6b), ou selo ineficaz na câmara. Em última instância, essas limitações podem ser contabilizados eo processo UWBP realizada de forma adequada para fornecer uma medição respiratória precisa. Também é importante notar que este método exige a modificação (tamanho menor câmara) para medição de alterações respiratórias em ratos de laboratório normais neonatal (por exemplo, <2 semanas C57Bl / 6), a fim de detectar as alterações de pressão na respiração dos animais de que o tamanho .
Embora UWBP demonstra vantagens consideráveis também traz controvérsias.Os investigadores devem familiarizar-se com o debate e tomar uma decisão informada se esta técnica é apropriada para a questão de pesquisa. Inicialmente, Drorbaugh e Fenn (1955) 8 acreditava que um aumento na pressão da câmara é causado pelo ar inspirado sendo aquecido e humidificado para valores pulmonares; o oposto ocorreu na expiração. Isto permitiu o cálculo do volume corrente. Pesquisas posteriores considerou que as alterações de pressão foram causadas por alteração da pressão alveolar durante a geração de fluxo de ar 25. Este trabalho indicou o uso da pletismografia para cálculo da resistência das vias aéreas. Enhorning et al. (1998) 26 forneceram evidências de que o volume corrente, a freqüência respiratória ea resistência das vias aéreas todas as flutuações de pressão influência dentro da câmara de pletismografia. Quando o ar na câmara é aquecido e umidificado com as condições do corpo as flutuações de pressão são reduzidas em dois terços e são amplificados através do aumento das resistências 21. Como todos esses componentes refletem flutuações de pressão há controvérsias se as medidas de uma parâmetros respiratórios específicos são precisos. Como resultado, concluiu-se que o volume corrente obtida a partir de pletismografia é uma mais qualitativa do que quantitativa de avaliação 26. Ambas as resistências das vias aéreas superiores e inferiores são componentes do sistema de pletismografia criando incerteza na medição broncoespasmo 27. É da opinião do autor que UWBP deve ser usado reciprocamente com análises invasivas. Ele é, de fato, a política de certas revistas que manuscritos unicamente com base em dados UWBP não serão aceitos. Esta será uma outra consideração para o leitor.
Em resumo, UWBP é um método útil para medir mudanças nos parâmetros respiratórios em roedores de laboratório e, particularmente passíveis de estudos longitudinais. As principais vantagens desta técnica são a prevenção de procedimentos invasivos, químicadesafios e necessidade de anestesia. Isso permite que os pesquisadores para coletar dados fisiológicos que representam mais de perto os acontecimentos que ocorrem naturalmente e reduzir a variabilidade experimental.
Divulgações
The authors declare that they have no competing interests. The authors have no conflicts to disclose.
Agradecimentos
We would like to thank Prof David Walker for his technical advice and provision of equipment in the development of this technique. This work is supported by the Victorian Government’s Operational Infrastructure Support Program. This work was partly supported by the Victorian Government’s Operational Infrastructure Support Program.
Materiais
| Name | Company | Catalog Number | Comments |
| LabChart 7 software (for Macintosh) | ADINSTRUMENTS | MLU60/7 | used in protocol step 4 |
| PowerLab 8/30 (model ML870) | ADINSTRUMENTS | PL3508 | |
| Octal Bridge Amp (model ML228) | ADINSTRUMENTS | FE228 | |
| Black BNC to BNC cable (1 m) | ADINSTRUMENTS | MLAC01 | |
| Macintosh OS | Apple Inc. | Mac OS X 10.4 or later | |
| Surgipack Digital Rectal Thermometer | Vega Technologies | MT-918 | |
| Grass volumeteric pressure transducer PT5A | Grass Instruments Co. | Model number PT5A; serial No. L302P4. | |
| 1 ml Syringe | Becton Dickinson (BD) | 309628 | |
| 5 ml Serological syringe pipettes | Greiner Bio One | 606160 | Connected via plastic tubing |
| Balance/Scales | VWR International, Pty Ltd | SHIMAUW220D | Any weighing balance with of 0.1 gram resolution |
| HM40 Humidity & temperature meter | Vaisala | HM40A1AB | |
| Barometer | Barometer World | 1586 | |
| Laboratory tubing | Dow Corning | 508-101 | Used to connect water column to the syringe and pressure transducer |
| Cylindrical Perspex Chamber | Dynalab Corp. | Custom built cylindrical chamber with internal dimensions as follows: 50 mm(w) x 1,500 mm(l). There are two lids for each side, with dimensions 80 mm(l) x 80 mm(w). Each lid has a 60 mm wide circular hole cut on the face of the lid 50 mm deep. This allows the chamber to fit into the lid. A rubber ring is fitted around each hole of the lid where the chamber will fit. For attachment of syringe and pressure transducer, the openings are 5 mm in diameter. For attachment of humidity probe, the openings are 25 mm in diameter. | |
| 80% Ethanol (4 L) | VWR International, Pty Ltd | BDH1162-4LP |
Referências
- . . World Health Organization, World Health Statistics. , (2008).
- Jones, C. V., et al. M2 macrophage polarization is associated with alveolar formation during postnatal lung development. Respir. Res. 14 (41), 14-41 (2013).
- Campbell, E., et al. Stem cell factor-induced airway hyperreactivity in allergic and normal mice. Am. J. Pathol. 154 (4), 1259-1265 (1999).
- Card, J. W., et al. Cyclooxygenase-2 deficiency exacerbates bleomycin-induced lung dysfunction but not fibrosis. Am. J. Respir. Cell. Mol. Biol. 37 (3), 300-308 (2007).
- Berndt, A., et al. Comparison of unrestrained plethysmography and forced oscillation for identifying genetic variability of airway responsiveness in inbred mice. Physiol. Genomics. 43 (1), 1-11 (2011).
- Flandre, T., et al. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94 (3), 1129-1136 (2003).
- Petak, F., et al. Hyperoxia-induced changes in mouse lung mechanics: forced oscillations vs. barometric plethysmography. J. Appl. Physiol. 90 (6), 2221-2230 (2001).
- Drorbaugh, J. E., Fenn, W. O. A barometric method for measuring ventilation in newborn infants. Pediatrics. 16 (1), 81-87 (1955).
- Milton, P. L., Dickinson, H., Jenkin, G., Lim, R. Assessment of respiratory physiology of C57BL/6 mice following bleomycin administration using barometric plethysmography. Respiration. 83 (3), 253-266 (2012).
- Gargiulo, S., et al. Mice anesthesia, analgesia, and care, part I: anesthetic considerations in preclinical research. ILAR J. 53 (1), 55-69 (2012).
- Hildebrandt, I., et al. Anesthesia and other considerations for in vivo imaging of small animals. ILAR J. 49 (1), 17-26 (2008).
- Meijer, M. K., et al. Effect of restraint and injection methods on heart rate and body temperature in mice. Lab Anim. 40, 382-391 (2006).
- Hamelmann, E., et al. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156 (3), 766-775 (1997).
- Lim, R., et al. Human mesenchymal stem cells reduce lung injury in immunocompromised mice but not in immunocompetent mice. Respiration. 85 (4), 332-341 (2013).
- Murphy, S., et al. Human amnion epithelial cells prevent Bleomycin-induced lung injury and preserve lung function. Cell Transplant. 20, 909-923 (2011).
- Murphy, S., et al. Human amnion epithelial cells do not abrogate pulmonary fibrosis in mice with impaired macrophage function. Cell Transplant. 21 (7), 1477-1492 (2012).
- Wichers, L. B., et al. A method for exposing rodents to resuspended particles using whole-body plethysmography. Part. Fibre Toxicol. 13 (12), (2006).
- Chong, B. T. Y., et al. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39 (3), 163-168 (1998).
- Lizuka, H., et al. Measurement of respiratory function using whole-body plethysmography in unanesthetized and unrestrained nonhuman primates. J. Toxicol. Sci. 35 (6), 863-870 (2010).
- McGregor, H., et al. The effect of prenatal exposure to carbon monoxide on breathing and growth of the newborn guinea pig. Pediatr. Res. 43, 126-131 (1998).
- Lundblad, L., et al. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Bartlett, D., Tenney, S. M. Control of breathing in experimental anemia. Respir. Physiol. 10 (3), 384-395 (1970).
- Malan, A. Ventilation measured by body plethysmography in hibernating mammals and in poiiulotherms. Respir. Physiol. 17 (1), 32-44 (1973).
- Seifert, E. L., Mortola, J. P. The circadian pattern of breathing in conscious adult rats. Respir. Physiol. 129 (3), 297-305 (2002).
- DuBois, A. B., et al. A new method for measuring airway resistance in man using a body plethysmograph: Values in normal subject and in patients with respiratory disease. J. Clin. Invest. 35 (3), 327-335 (1956).
- Enhorning, G., et al. Whole-body plethysmography, does it measure tidal volume of small animals. Can. J. Physiol. Pharmacol. 76 (10-11), 945-951 (1998).
- Zhang, Q., et al. Does unrestrained single-chamber plethysmography provide a valid assessment of airway responsiveness in allergic BALB/c mice. Respir. Res. 10 (61), (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados