Method Article
Medición de la función respiratoria en ratones usando irrestricta pletismografía corporal total
En este artículo
Resumen
La evaluación de la fisiología respiratoria se ha basado tradicionalmente en las técnicas, que requieran inmovilización o sedación de los animales. Unrestrained pletismografía de cuerpo entero, sin embargo, proporciona un análisis cuantitativo preciso, no invasivo, de la fisiología respiratoria en modelos animales. Además, la técnica permite repitió evaluación respiratorio de los ratones que permiten estudios longitudinales.
Resumen
La disfunción respiratoria es una de las principales causas de morbilidad y mortalidad en el mundo y las tasas de mortalidad siguen aumentando. La evaluación cuantitativa de la función pulmonar en modelos de roedores es una herramienta importante en el desarrollo de futuras terapias. Comúnmente utilizado técnicas para la evaluación de la función respiratoria incluyendo pletismografía invasiva y oscilación forzada. Si bien estas técnicas proporcionan información valiosa, la recopilación de datos puede estar lleno de artefactos y la variabilidad experimental debido a la necesidad de anestesia y / o instrumentación invasiva del animal. En contraste, sin restricciones pletismografía de cuerpo entero (UWBP) ofrece una manera precisa, no invasiva, por el cual cuantitativa para analizar los parámetros respiratorios. Esta técnica evita el uso de anestesia y restricciones, que es común a las técnicas tradicionales de pletismografía. Este video demostrará el procedimiento UWBP incluido el equipo instalado, calibrado y pulmón grabación función. Esexplicará la forma de analizar los datos recogidos, así como identificar valores atípicos experimentales y artefactos que resulta de la circulación de animales. Los parámetros respiratorios obtenidos utilizando esta técnica incluyen el volumen corriente, el volumen minuto, ciclo de trabajo inspiratorio, velocidad de flujo inspiratorio y la proporción de tiempo de inspiración a tiempo de caducidad. UWBP no se basa en conocimientos especializados y es de bajo costo para llevar a cabo. Una característica clave de UWBP, y más atractivo para los usuarios potenciales, es la capacidad de realizar mediciones repetidas de la función pulmonar en el mismo animal.
Introducción
Disfunción de pulmón es una de las principales causas de morbilidad y mortalidad en el mundo. La condición se caracteriza por el intercambio de oxígeno insuficiente, sinónimo de tos, dolores en el pecho y la disnea. La enfermedad respiratoria para ~ 10% de la mortalidad en todo el mundo 1. Según la Organización Mundial de la Salud, las tasas de mortalidad se prevé un aumento a causa del tabaquismo persistente, la contaminación y los irritantes ocupacionales. UWBP es una adición útil para el estudio de la fisiología pulmonar, que complementa fuertemente bioquímica tradicional y análisis histológicos 2. Otros procedimientos utilizados para la evaluación de pulmón no ofrecen las mismas ventajas que UWBP. Pletismografía invasiva es una técnica de uso común que requiere que el animal sea anestesiado 3,4 y por lo tanto, las mediciones respiratorias resultantes no son necesariamente un reflejo de un estado natural. Además, el requisito de ventilación y químicas desafíos mecánicos excluye futuras mediciones 3,4.Otro método de recogida de datos respiratoria es por oscilación forzada, que es más sensible a cambios en los parámetros más finas respiratorias en comparación con UWBP 5. Oscilación forzada es, sin embargo, una técnica invasiva y requiere la terminación de animales para la recogida de datos 5-7.
UWBP consiste en colocar un animal dentro de una cámara especializada. Durante la inspiración, el aire se calienta de marea y humidificado dentro de los pulmones aumento de presión de vapor de agua y provoca la expansión térmica de gas 8. Este efecto provoca un cambio neto en el volumen de aire de la creación de un aumento de la presión dentro de la cámara 8 pletismógrafo. Lo contrario ocurre durante la espiración la creación de una forma de onda respiratoria del animal. Análisis de forma de onda se utiliza para medir desde la traza respiratoria: frecuencia respiratoria (respiraciones / min), el tiempo total del ciclo respiratorio (seg), la inspiración / tiempo de expiración (Ti / Te, seg) y cambios en la presión debido a cada volumen corriente (P T). Figura 1 ilustra cada origen mediciones de una traza respiratorio. Estas mediciones son simples y múltiples para calcular los parámetros respiratorios se pueden derivar de estas mediciones. Estos parámetros incluyen: El volumen corriente (volumen de aire movido entre la inhalación y la exhalación normales), el volumen minuto (volumen de gas inhalado desde los pulmones por minuto), ciclo de trabajo de inspiración (el porcentaje de tiempo de inspiración a la duración total del ciclo de respiración) y velocidad de flujo inspiratorio (la cantidad de aire inspirado en un tiempo dado).
UWBP proporciona un análisis cuantitativo preciso, no invasivo, de la fisiología respiratoria en modelos animales y se puede utilizar para medir la progresión de la enfermedad respiratoria y la función pulmonar 6,9. Contrariamente a otras técnicas de pletismografía, UWBP evita el uso de la anestesia, las restricciones y las manipulaciones invasivas que producen artefactos y la variabilidad experimental 6,9. La anestesia puede suprimir la respiración,alterar el ritmo cardíaco y puede ser un reto para regular 10. Las restricciones inducen un aumento en la respiración debido a la tensión adicional a través de la corticosterona y la epinefrina liberan 11,13. La característica clave de UWBP se repite evaluación fisiológica por lo que es susceptible de estudios longitudinales. UWBP es muy recomendable para la evaluación longitudinal de la fisiología pulmonar y ofrece una habilidad valiosa para la futura evaluación de drogas respiratoria.
Bleomicina, ovoalbúmina, y la hipoxia se han utilizado para inducir desafíos respiratorios en varios estudios y UWBP ha medido correctamente pulmón precisa evaluación fisiológica 7,9,13-16. El protocolo descrito está diseñado para ratones de laboratorio estándar adulto. Sin embargo, UWBP ha sido adaptado a otros animales tales como ratas, cobayas, y primates no humanos 17-20. UWBP no se limita únicamente a la evaluación de la disfunción pulmonar, pero también se ha utilizado para la evaluación de la maduración pulmonar 3.La versatilidad, la sencillez y reproducibilidad de UWBP han establecido una técnica excelente para la evaluación de la función pulmonar en los animales. Varios software (ver materiales y equipos de la tabla) se requerirá seguir este procedimiento. Un científico experimentado sería capaz de realizar este protocolo con un ratón dentro de 1 hr.
Protocolo
NOTA: El siguiente procedimiento experimental es aprobado por el Comité de Ética Animal de la Universidad de Monash y llevó a cabo de conformidad con el Código Australiano de Prácticas para el Cuidado y Uso de Animales con Fines Científicos (2006). HEMBRA ADULTA C57BL / 6 ratones utilizados para generar los resultados representativos se obtuvieron de los Servicios de Animales de Monash. Los ratones fueron alojados en una habitación específica libre de patógenos, temperatura y humedad controlada con un ciclo de luz-oscuridad de 12 h. Estos ratones tenían acceso libre a comida y agua.
1. Configuración inicial
- Conecte el ordenador portátil / escritorio de la máquina de adquisición de datos para el registro a través de un cable USB.
- Conecte el amplificador de puente de 'salida de 1 "a la" entrada 1' de la máquina de adquisición de datos a través de un cable BNC.
- Inserte el transductor de presión en "canal 1" del Octal Bridge Amp. Encienda la máquina de adquisición de datos y abra el software de análisis. El software debe autodetectar automáticamente la configuración del equipo (ver materiales y tabla de equipos).
- Ajustes de canal abierto que se encuentran en la barra de herramientas de configuración del software. Cambiar el número de canales que se registró a 1.
- Configure el barómetro para medir la presión de la sala y el aparato de la columna de agua para calibrar el amplificador de puente. El aparato de la columna de agua incluye dos pipetas de jeringa 5 ml serológicas conectados por un tubo de plástico.
- Llenar las columnas con agua y asegúrese de que los niveles de agua están en equilibrio con una regla. Conecte un trozo de tubo de plástico a la parte superior de cada pipeta. Figura 2 muestra la columna de agua creada.
2. Puente Amplificador Calibración
Nota: Para calibrar el amplificador de puente de una inyección de aire en la columna de agua se requiere para crear un 1 cm H 2 O de deflexión. Esto ocurrirá bajo un solo conjunto de condiciones y depende de aparato del usuario. Para aclarar estos pasos demonstrate cómo este laboratorio sería realizar la calibración.
- Retirar una jeringa de 1 ml a 300 l; conectar la jeringa a la llave de paso en el extremo de la tubería en el lado derecho de la columna de agua. NOTA: Asegúrese de que la llave de paso está abierto a la jeringa y la columna de agua, y cerrado al aire de la habitación. Si los niveles de agua no están equilibrados en este punto, gire la llave de paso de modo que está abierto al aire ambiente y la columna de agua, esto reequilibrar el agua. El tubo en el lado izquierdo de la columna de agua debe ser conectado al transductor de presión para medir el cambio en la presión inducida por el desplome de la jeringa.
- Una el tubo de la columna de agua en el lado de mano izquierda para el conector en el transductor de presión (anillo superior del transductor).
- Seleccione el menú de desplazamiento hacia abajo se encuentra junto al canal 1 en la pantalla principal en el lado derecho del software y seleccione "amp Bridge" (ver materiales y tabla de equipos).
- Ingreselos ajustes a 5 mV, 20 Hz de paso bajo, marque la casilla 'invertido' y haga clic en "cero". Haga clic en 'cero' para establecer la traza a ~ 0 mV. Reducir el tamaño de la ventana a 4: 1 para facilitar la visualización.
- Con todo listo, presione la jeringa de 1 ml, dejándolo durante 3 segundos. Esto mostrará un aumento repentino en el software debido a que la presión ha cambiado. Cuando los 300 l se deprimieron la presión se moverá el agua en la columna de agua por 1 cm. Este valor conocido ayudará a calibrar el amplificador de puente.
NOTA: El aumento de presión en la cámara debido a la depresión 300 l corresponde al valor P K usado para los cálculos posteriores. - Selecciona "unidades de entrada" que se encuentran en la esquina inferior izquierda de la ventana de Bridge Amp.
- Resalta el "rastro de fondo" antes del pico conocido como la 'Región Cero'.
- Haga clic en la flecha al lado de "punto 1" y esto producirá el background señal dentro del rango de -0,002 mV 0.002 mV (el valor nunca será exactamente a 0 mV).
- Tipo "0" en la ventana al lado de la ventana de la señal de fondo.
- Resalta el "aumento de la zona de presión de la gráfica" desde que se presiona la jeringa. Haga clic en la flecha situada junto al punto 2 y el valor debe estar en el rango de 0,9 a 1,2 mV.
- Tipo "1" en la ventana al lado de la ventana "aumento de la presión". Para una aclaración visual sobre las medidas 2.7 y 2.8 se refieren a la figura 3. Valores que se encuentran fuera de los rangos especificados puede indicar daño al Octal Bridge Amp.
- Ir a "definir las unidades 'que se encuentra en la esquina superior derecha de la ventana y seleccione" cmH 2 O ". Si esta opción no está disponible, se puede introducir manualmente. Haga clic en Aceptar.
- Volver al menú de la 'Bridge Amp' (véase el apartado 2.1). Seleccione 1 mV y establecer amplificador a 'cero';. Esto completará la calibración y la columna de agua de forma segura se puede eliminar.
Función 3. grabación de pulmón
- Pesar el ratón (g). NOTA: Una semana antes de la evaluación fisiológica introducir el ratón para el ambiente de la cámara pletismografía. Esto ayudará en la aclimatación y reducir el estrés cuando se lleva a cabo este procedimiento en una fecha posterior. Para un esquema general que demuestra la configuración UWBP, por favor refiérase a la Figura 4.
- Medir la temperatura corporal con un termómetro rectal. Lubricar el termómetro con vaselina antes de la inserción. Registre la lectura de la temperatura y limpiar el lubricante con 80% (v / v) de etanol. Si el uso de animales muy pequeños, tales como crías de ratón neonatales, el valor medio de la temperatura corporal se puede determinar con un termómetro de infrarrojos en su lugar.
- Coloque la sonda de humedad / temperatura relativa en el extremo de un agujero de la cámara de pletismografía. Registre la temperatura, la humedad y barometric presión dentro de la cámara pletismografía antes de colocar el ratón dentro.
- Coloque el ratón en la cámara de pletismografía, tapar el extremo abierto ligeramente. Esto permite que el ratón para aclimatarse. Cerrar la cámara.
- Con la sonda de temperatura / humedad insertado en el lado de la cámara de pletismografía con un agujero, ahora insertar el transductor y la jeringa en el otro lado con los dos agujeros.
- Pulse 'Start' en el programa de software y récord de aproximadamente 15 a 45 seg. Record 5.10 seg de datos donde el animal no se mueve. Movimiento alterará la fisiología respiratoria basal del animal y proporcionar resultados pobres. La respiración debe oscilar en un trayecto lineal en el programa. Estos son datos utilizables. Nota: la micción o la defecación puede conducir a un aumento en la temperatura y la humedad dentro de la cámara de pletismografía. Esto oscurecer los resultados durante el análisis. En el caso de la micción o la defecación, detenga la grabación inmediatamente y limpiar la plethysmography cámara con 80% (v / v) de etanol. Consulte la Figura 6 para una representación visual de los resultados subóptimos, donde deben ser rechazadas de datos.
- Después de grabar durante 45 segundos, pulse "Stop" en el software (ver tabla de materiales y equipos) del programa. Retire el ratón desde la cámara de pletismografía y registrar inmediatamente la temperatura de la cámara y de la humedad. No grabe continuamente durante más de 45 segundos, ya que esto puede estresar al animal.
- Devuelva el ratón a su jaula, spray y limpie la cámara con un 80% (v / v) de etanol.
- Permitir que la cámara se seque y vuelva a la temperatura de referencia y la humedad antes de proceder a la siguiente ratón. Repita los pasos 3.1 a 3.9 para los animales posteriores. Nota: Si se están estudiando varios animales, asegúrese de que la temperatura de la cámara y el retorno a los valores basales de humedad cerca antes de cada nuevo animal se pone en la cámara.
4. Análisis pletismografía
Note: Para calcular los parámetros respiratorios tales como el volumen corriente (V T) y el volumen de minutos las siguientes variables deben ser medidos: la frecuencia respiratoria (respiraciones / min), el tiempo total de ciclo de respiración (seg), la inspiración / tiempo de expiración (Ti / Te, segundos) y el cambio de presión debido a cada volumen corriente (P T). Figura 1 ilustra las variables que se pueden medir de una traza. Los siguientes pasos utilizan un software (ver materiales y equipos de la tabla) para medir estas variables. Al analizar, evitar las regiones de la traza que contiene la inhalación o el movimiento. Para obtener resultados reproducibles, se requiere por lo menos de 5 segundos de buena traza respiración. Para un ejemplo de diferentes huellas de respiración consulte la Figura 5 y 6.
- Abra la pantalla a pantalla completa, vista establecido en 1: 1 y seleccione 5 seg de datos utilizables. Una instantánea representativa de esto se muestra en la Figura 5.
- Abra la ventana de mini pad de datos que se encuentra en la parte superior de la programo en la pestaña cuaderno de datos. Seleccione el canal 1 y seleccione 'mediciones de ciclo "en la columna de la izquierda y" altura cíclica media' en la columna de la derecha.
- Seleccione "Opción" y establecer la escala para la detección de pico mínimo de 1 (ms). Esto permitirá la detección de todos los valores de pico y se vuelve muy importante cuando se utilizan pequeños animales que producen pequeñas oscilaciones.
- Haga clic en 'Aceptar'. Esto presentará «deformación de presión debida a cada volumen corriente '(P T) de medición.
- En el mini cojín de datos, seleccione «mediciones del ciclo 'seguido de' recuento de eventos 'y haga clic en' Aceptar '. Esto presentará la "frecuencia" (f) la medición.
- Frecuencia necesita ser convertida a respiraciones / min. Esto se hace multiplicando el valor por 60 seg y dividiendo el resultado por el tiempo total de la grabación (min).
- En el mini cojín de datos, seleccione cy 'mediciones cle 'seguido de' periodo 'y haga clic en "Aceptar". Esto presentará el 'tiempo total de ciclo de la respiración' (T tot, sec) de medición.
- Los siguientes pasos se utilizan para crear una macroinstrucción para generar valores de tiempo de inspiración y espiración pico. Asegúrese de que el cursor se encuentra directamente sobre el máximo del pico / valle y añadir un comentario en 9 picos secuenciales y valles. Comience con el pico de la oscilación, como se muestra en la Figura 5.
- Posteriormente, seleccione la ventana: pista y la columna 1 En la ventana que aparece, haga clic en 'información de selección "en la columna de la izquierda,' duración 'en la columna de la derecha y haga clic en' OK 'de datos.
- Seleccione la macro que se encuentra en la parte superior del programa y luego inicie la grabación. Ahora seleccione comandos: 'Encontrar', 'Go', 'inicio del archivo "y haga clic en' Buscar '.
- Seleccionar comandos: 'Buscar' y 'Encuentra comentarios'. Escriba la misma frase escrita en el cuadro de comentario en el cuadro 'contiene' proporcionado. Seleccione la pestaña 'Seleccionar al punto anterior' y 'Buscar'.
- Seleccionar comandos: 'Añadir a la tableta de datos'. A continuación, seleccione macro: comandos de macro y comenzar a repetir. La ventana cuenta de repetición que aparece debe fijarse en 9.
- Comando Seleccionar: 'Buscar siguiente'. Seleccione el comando: 'Añadir a la tableta de datos'. Finalmente seleccionar comandos de macro y repetir final.
- Ahora seleccione la macro y detener la grabación. Guardar y nombrar la macro después de que el número de animales. NOTA: La creación de la macro para cada animal permite que la macro se utiliza para los estudios longitudinales y ahorra tiempo.
- La macro se puede ejecutar para obtener la inspiración (Ti) y vencimiento (T e) tiempo entre cada comentario. Los datos aparecerán en el canal 1 del cuaderno de datos. Expiración y la inspiración se produce consecutivamente y aparecerán los datos en este orden.
- Los datos deben ser dividir manualmente en valores de inspiración y espiración. La media de los cuatro valores de datos de cada parámetro para obtener la media T i y T e.
- Una vez que los valores primarios se han derivado el volumen tidal (V T, ml) se puede calcular. Para obtener el volumen tidal se utiliza la ecuación de Drorbaugh y Fenn 8:
V T (ml) = (P T / P K) x (V K) x ((T SUBYACENTE (P B - P C)) / (T SUBYACENTE (P B - P C) - T C (P B - P CORE)))
Dónde
V T: Volumen corriente
P k: la desviación de presión debida a cada inyección de 1 ml (Consulte el paso 2.5)
Camiseta básica: La temperatura central de cada animal
P C: presión de vapor de agua en la cámara de temperatura X Humedad relativa en chambre
T C: la temperatura en la cámara de animales
P núcleo: Presión a temperatura corporal (presión de vapor del agua a la temperatura corporal x 1,0)
P t: desviación de presión debida a cada volumen corriente
V k: la inyección de volumen para la calibración
P B: presión barométrica - Una vez que el volumen tidal se ha calculado los siguientes parámetros también se pueden determinar:
- Volumen por minuto (ml / min) = V T xf
- Volumen por minuto (ml / min / kg) = (V T xf) / peso corporal (kg)
- V T (ml / kg) = V T (ml) / peso corporal (kg)
- Ciclo de trabajo inspiratorio (%) = T i / T tot
- Inspiratoria Caudal (ml / seg) = V T / T i
- Proporción de tiempo de inspiración a tiempo de expiración = T i / T e
- Tiempo total de ciclo (sec) = Tiempo de inspiración (s) + tiempo de expiración (seg)
Resultados
Cuando este procedimiento se ha seguido correctamente, un rastro de oscilación constante se crea en el software de análisis de datos. El procedimiento proporciona una traza respiratoria dentro de unos pocos minutos después de la configuración con los cálculos informáticos sencillos para determinar los parámetros respiratorios enumerados. Figura 5 representa una traza de respiración adecuado a partir de un ratón de control (sanos). Datos oscilante adecuado se produce cuando el animal no se mueve activamente.
UWBP es una evaluación muy útil y fiable de la función pulmonar entre el control y la cohorte de la fibrosis pulmonar. Figura 7 demuestra la función pulmonar de un ratón con la fibrosis pulmonar inducida por bleomicina en el día 14 En comparación con el gráfico de control, la Figura 7 ilustra una diferencia visual coherente con la administración de bleomicina 7. Como se discutió previamente, el procedimiento se puede repetir lo que nos permite observar los cambios en Paramete respiratoriars en el tiempo entre estos dos grupos.
Los resultados obtenidos deben ser expresados como medias ± SEM. Se recomienda copiar y pegar los datos recogidos en una simple hoja de cálculo Excel. Esto se convertirá en útil para llevar a cabo los cálculos en los pasos discutidos 4,13 y 4,14. La función respiratoria se puede comparar visualmente entre dos grupos como se muestra en la Figura 8.

Figura 1. Diferentes componentes del ciclo de respiración ilustran usando la pletismografía barométrica. Este gráfico ilustra a) el cambio de presión debido a la inspiración (ΔPi), b) el cambio de presión debido a cada volumen tidal (PT), c) la cambio en la presión debido a la expiración (ΔPe), d) tiempo de ciclo total de la respiración (Ttot), e) tiempo de inspiración (Ti) y f) tiempo de expiración (Te). Haga clic aquí para ver la imagen más grande.
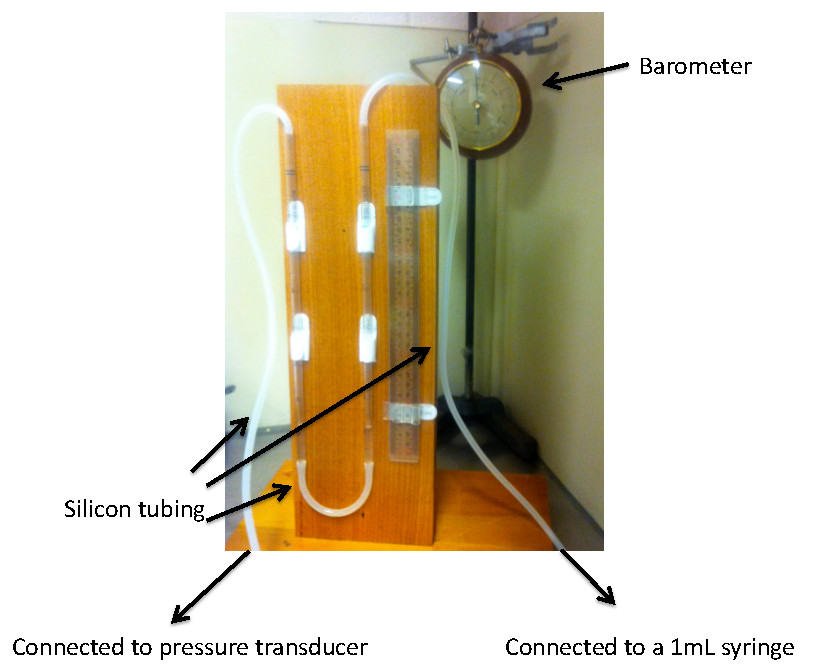
Figura 2 Representación visual de la configuración de la columna barómetro y agua. La cifra está diseñado para ayudar al lector en la creación de la columna del barómetro y el agua para el proceso de calibración. Observe que el agua es de nivel dentro de las dos columnas ayudados por el gobernante. Las dos columnas están conectadas a través de 15 cm de tubo de plástico. El tubo de la derecha (65 cm) está conectado a una jeringa de 1 ml y a la izquierda (75 cm) del transductor de presión vinculada a la máquina de adquisición de datos. Nota:. La longitud del tubo determina el volumen (300 l) requerida para mover 1 cm de agua Haga clic aquí para ver laAmpliar imagen.

Figura 3. realizar los pasos 2.4 y 2.5 de calibración Bridge Amp. Esta figura ilustra los pasos 2.7 y 2.8 para la calibración de los equipos. Es crucial para corregir el puente de amplificador para obtener resultados precisos. Haz clic aquí para ver la imagen más grande.

Figura 4. un esquema general de la configuración UWBP. A la izquierda está la sonda de humedad / temperatura conectado a un lado de la cámara de pletismografía que contiene el animal. A la derecha está la jeringa de calibración y transductor de presión principalde la cámara de pletismografía para el sistema de adquisición de datos de producción de un rastro respiratoria en el equipo. Haga clic aquí para ver la imagen más grande.
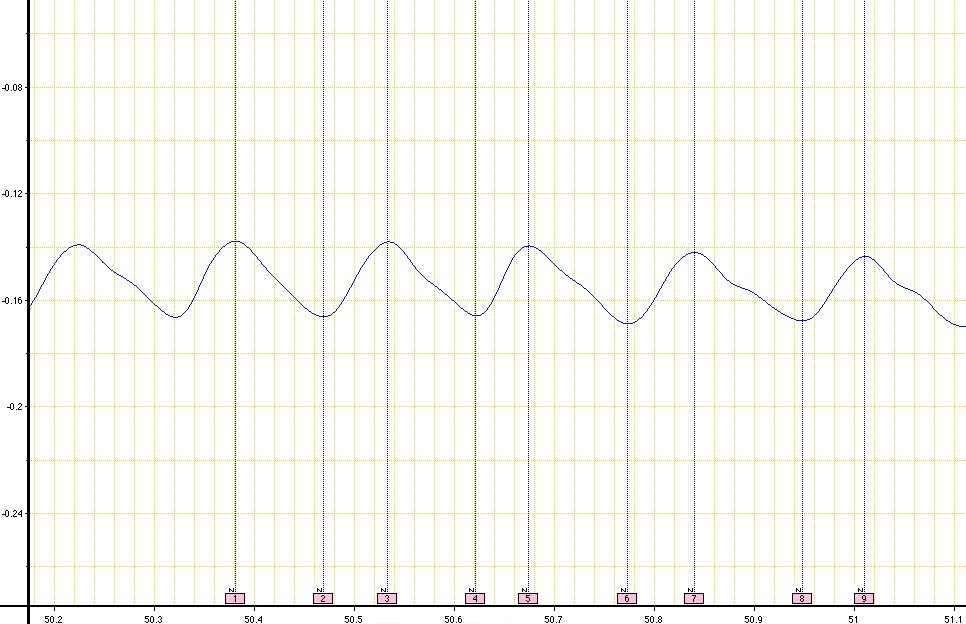
Figura 5. Un ejemplo de una traza de respiración respiratorio de un ratón de control C57BL / 6 obtenida cuando se utiliza UWBP. Esta traza de respiración ilustra, datos consistentes apropiadas de un animal control. Nueve comentarios consecutivos se añaden a los picos y valles de oscilaciones para obtener los parámetros respiratorios figuran respirar siguiendo los pasos 4.1 a 4.13. El tiempo se representa a lo largo del eje x (SEC) y los cambios de presión a lo largo del eje y (cm.h 2 O). Haga clic aquí a view imagen más grande.
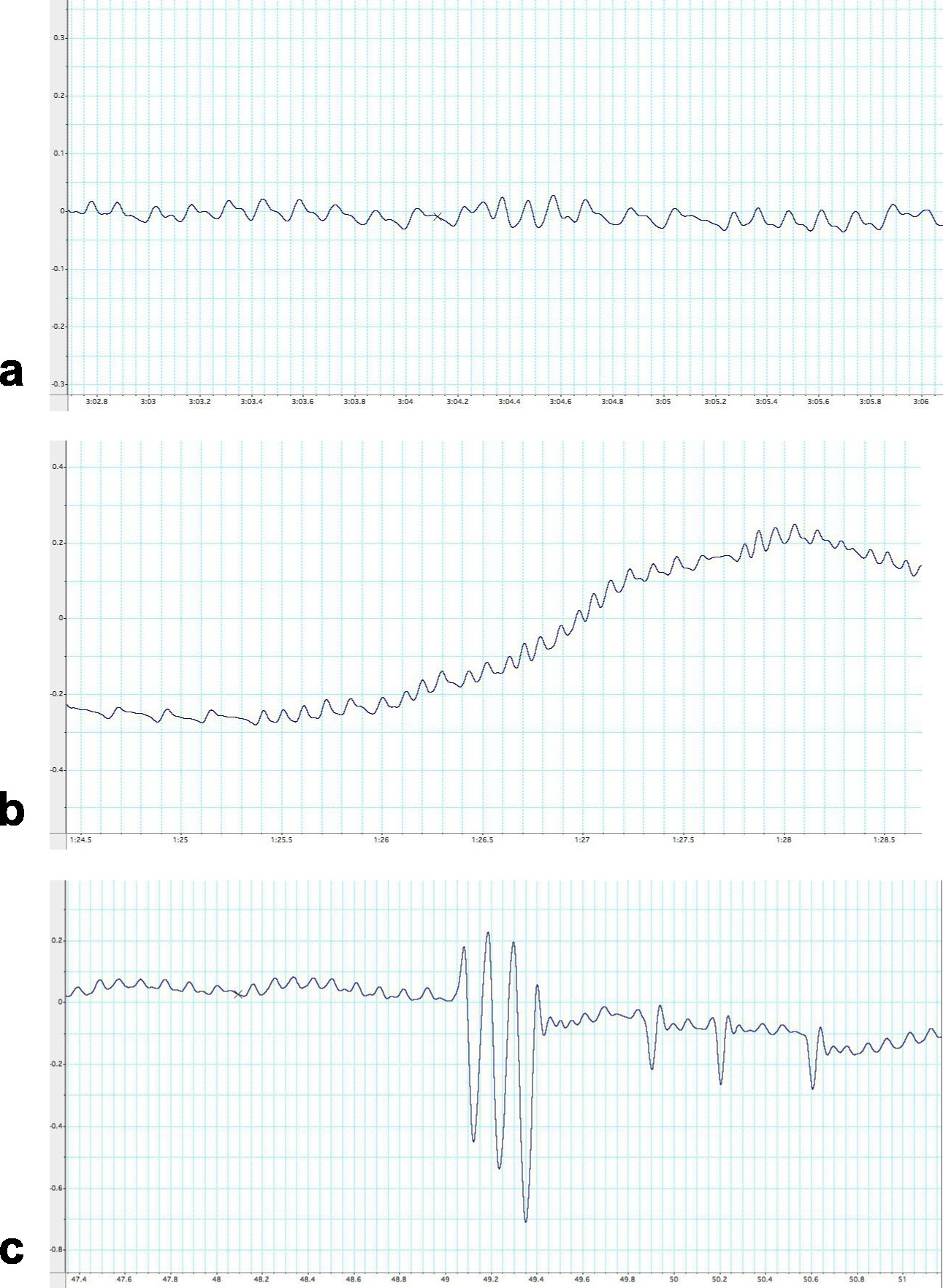
Figura 6. Ejemplos de diferentes trazas subóptimos obtenidos de un ratón C57BL / 6 cuando se utiliza UWBP. Resultados subóptimos puede confundirse como datos apropiados y es la fuente más común para pobres análisis. Esta figura ilustra las huellas subóptimas más comunes que nunca deben ser utilizados para el análisis. Estos rastros de respiración demuestran a) Un rastro respiración registró mientras el animal está oliendo y moviendo alterar la fisiología respiratoria basal del animal. B) La huella grabados resultantes oscilaciones aumentando gradualmente con el tiempo es generalmente causada por la condensación y la humedad se acumule. Sin embargo, la traza puede corregirse limpiando la cámara de pletismografía con etanol o repitiendo los pasos de calibración. C) Una trazaregistrado durante el movimiento de cámara pletismografía mientras el animal o investigador está participando con el equipo. El tiempo se representa en el eje x (s) y los cambios de presión a lo largo del eje y (cm.h 2 O). Haga clic aquí para ver la imagen más grande.

Figura 7. Un ejemplo de una traza de respiración obtenida de un ratón C57BL / 6 con fibrosis pulmonar inducida cuando se utiliza UWBP. Esta traza de respiración ilustra, datos consistentes apropiadas de un animal con pulmonar inducida obtenida cuando se utiliza el procedimiento de UWBP descrito en este artículo. Nueve comentarios consecutivos se añaden a los picos y valles de oscilaciones para obtener los parámetros respiratorios figuran respirar siguiendo los pasos 4.1 a 4.13. El tiempo es repreSENTED lo largo del eje x (s) y los cambios de presión a lo largo del eje y (cm.h 2 O). Haga clic aquí para ver la imagen más grande.

Figura 8. función respiratoria comparación entre el control y bleomicina desafió ratones C57BL / 6. Realización de análisis pletismografía después de usar UWBP permitirá al usuario a resultados similares a lo que se representa aquí. Esta cifra demuestra las diferencias fisiológicas entre bleomicina desafiado animales (línea gris punteada) y animales de control (línea de color negro sólido). Estos gráficos muestran las comparaciones en a) el tiempo de expiración (seg), b) Tiempo de inspiración (seg), c) ciclo de trabajo Inspiration (%), d) tasa de flujo inspiratorio (ml / seg)e) La frecuencia respiratoria (respiraciones / min), f) El volumen minuto (ml / min / kg), g) Volumen corriente (ml / kg) y h) el tiempo total del ciclo (seg). Datos de función pulmonar fueron recogidos longitudinalmente en la misma cohorte de animales en los días 0, 7 y 14 después de la exposición bleomicina. Datos Representante ha sido adaptado de Murphy et al. (2012) 16. Haga clic aquí para ver la imagen más grande.
Discusión
La técnica descrita aquí es un método no invasivo para la evaluación de los parámetros respiratorios de ratones sin restricciones y sin anestesiar. Los puntos fuertes de este protocolo son su simplicidad y precisión para medir la función pulmonar longitudinalmente con artefactos mínimos. Hay, sin embargo, algunas limitaciones y pasos críticos que se observaron sobre el procedimiento. En primer lugar y lo más importante, el ratón debe mantener la calma dentro de la cámara durante un mínimo de cinco segundos. Alta tensión interrumpirá el patrón de respiración del ratón y, por tanto, proporcionar resultados variables (Figura 6a). Este inconveniente es probable que permanezca y es de esperar, a veces. Sin embargo, en sustitución del ratón en su casa-jaula y lo que le permite tiempo para reasentar será fácil corregir esto. Es crucial que el animal se sienta cómodo en el ambiente de la cámara para obtener cinco segundos de datos apropiados / utilizables. Se requieren más consideración sobre el medio ambiente de cámara. El medio ambiente, unrelated a la mecánica respiratoria, puede afectar significativamente los resultados. A medida que la duración de los aumentos de evaluación, la humedad y la temperatura de los aumentos de la cámara, así como la disminución de oxígeno disponible, impactar significativamente en la ventilación. El momento de la ventilación aumenta la humedad y la temperatura de la cámara así como la disminución de oxígeno disponible 21. Una pequeña fuga en la cámara puede ayudar en la reducción de derivas térmicas creadas a partir de la producción de calor 22,23. El protocolo discutido es específico para el equipo y la instrumentación de la lista. Calibración del amplificador de puente en la sección dos dependerá de los equipos del lector. Si los factores tales como la longitud de los tubos son diferentes una inyección de 300 l de aire puede no causa un 1 cm.h 2 O deflexión.
También hay diferencias fisiológicas, dependiendo de la hora del análisis. Los roedores son criaturas naturalmente nocturnos y los ciclos circadianos, que en última instancia generar cambios enrespiración, debe tenerse en cuenta cuando se miden los experimentos 24. Por tanto, es necesario tiempo y planear los experimentos de tal manera que los datos experimentales se pueden comparar con precisión entre las cohortes. También es importante tomar nota del seguimiento de movimiento. Si las oscilaciones no se están ejecutando en un patrón lineal, es por lo general debido a una acumulación de condensación o humedad dentro de la cámara (Figura 6b), o el sello ineficaz en la cámara. En última instancia, estas limitaciones pueden ser tenidos en cuenta y el proceso UWBP realizan adecuadamente para proporcionar una medición precisa respiratoria. También es importante señalar que este método requerirá la modificación (tamaño de la cámara más pequeña) para medir los cambios respiratorios en ratones de laboratorio estándar neonatal (por ejemplo, <2 semanas C57BL / 6) a fin de detectar cambios de presión en la respiración de los animales de ese tamaño .
Aunque UWBP demuestra ventajas considerables también conlleva controversia.Los investigadores deben familiarizarse con el debate y tomar una decisión informada si esta técnica es apropiada para la pregunta de investigación. Inicialmente, Drorbaugh y Fenn (1955) 8 cree que un aumento en la presión de la cámara es causada por el aire inspirado siendo calentado y humidificado a los valores pulmonares; ocurrió lo contrario en la espiración. Esto permitió el cálculo del volumen corriente. La investigación posterior consideró que los cambios de presión fueron causados por el cambio de presión alveolar durante la generación del flujo de aire 25. Este trabajo indica el uso de pletismografía para el cálculo de la resistencia de la vía aérea. Enhorning et al. (1998) 26 proporcionado pruebas de que el volumen tidal, la frecuencia respiratoria y la resistencia de las vías respiratorias todas las fluctuaciones de presión dentro de la cámara influencia pletismografía. Cuando el aire de la cámara se calienta y humidifica a las condiciones corporales fluctuaciones de presión se reducen en dos tercios y se amplifican a través de mayores resistencias 21. Como todos estos componentes reflejan las fluctuaciones de presión hay controversia si las mediciones de un parámetros respiratorios particulares son exactas. Como resultado se ha llegado a la conclusión de que el volumen corriente obtenida de la pletismografía es una más cualitativa que cuantitativa evaluación 26. Ambas resistencias de las vías respiratorias superiores e inferiores son componentes del sistema de pletismografía crear incertidumbre en la medición de la broncoconstricción 27. Es de la opinión del autor de que UWBP debe utilizar recíprocamente con los análisis invasivos. Es, de hecho, no se aceptará la política de ciertas revistas que los manuscritos basa únicamente en datos UWBP. Esta será otra consideración para el lector.
En resumen, UWBP es un método útil para medir los cambios en los parámetros respiratorios en roedores de laboratorio estándar, particularmente susceptibles de estudios longitudinales. Las principales ventajas de esta técnica son la evitación de procedimientos invasivos, químicaretos y exigencia de la anestesia. Esto permite a los investigadores para recolectar datos fisiológicos que representan más de cerca los acontecimientos que ocurren de forma natural y reducir la variabilidad experimental.
Divulgaciones
The authors declare that they have no competing interests. The authors have no conflicts to disclose.
Agradecimientos
We would like to thank Prof David Walker for his technical advice and provision of equipment in the development of this technique. This work is supported by the Victorian Government’s Operational Infrastructure Support Program. This work was partly supported by the Victorian Government’s Operational Infrastructure Support Program.
Materiales
| Name | Company | Catalog Number | Comments |
| LabChart 7 software (for Macintosh) | ADINSTRUMENTS | MLU60/7 | used in protocol step 4 |
| PowerLab 8/30 (model ML870) | ADINSTRUMENTS | PL3508 | |
| Octal Bridge Amp (model ML228) | ADINSTRUMENTS | FE228 | |
| Black BNC to BNC cable (1 m) | ADINSTRUMENTS | MLAC01 | |
| Macintosh OS | Apple Inc. | Mac OS X 10.4 or later | |
| Surgipack Digital Rectal Thermometer | Vega Technologies | MT-918 | |
| Grass volumeteric pressure transducer PT5A | Grass Instruments Co. | Model number PT5A; serial No. L302P4. | |
| 1 ml Syringe | Becton Dickinson (BD) | 309628 | |
| 5 ml Serological syringe pipettes | Greiner Bio One | 606160 | Connected via plastic tubing |
| Balance/Scales | VWR International, Pty Ltd | SHIMAUW220D | Any weighing balance with of 0.1 gram resolution |
| HM40 Humidity & temperature meter | Vaisala | HM40A1AB | |
| Barometer | Barometer World | 1586 | |
| Laboratory tubing | Dow Corning | 508-101 | Used to connect water column to the syringe and pressure transducer |
| Cylindrical Perspex Chamber | Dynalab Corp. | Custom built cylindrical chamber with internal dimensions as follows: 50 mm(w) x 1,500 mm(l). There are two lids for each side, with dimensions 80 mm(l) x 80 mm(w). Each lid has a 60 mm wide circular hole cut on the face of the lid 50 mm deep. This allows the chamber to fit into the lid. A rubber ring is fitted around each hole of the lid where the chamber will fit. For attachment of syringe and pressure transducer, the openings are 5 mm in diameter. For attachment of humidity probe, the openings are 25 mm in diameter. | |
| 80% Ethanol (4 L) | VWR International, Pty Ltd | BDH1162-4LP |
Referencias
- . . World Health Organization, World Health Statistics. , (2008).
- Jones, C. V., et al. M2 macrophage polarization is associated with alveolar formation during postnatal lung development. Respir. Res. 14 (41), 14-41 (2013).
- Campbell, E., et al. Stem cell factor-induced airway hyperreactivity in allergic and normal mice. Am. J. Pathol. 154 (4), 1259-1265 (1999).
- Card, J. W., et al. Cyclooxygenase-2 deficiency exacerbates bleomycin-induced lung dysfunction but not fibrosis. Am. J. Respir. Cell. Mol. Biol. 37 (3), 300-308 (2007).
- Berndt, A., et al. Comparison of unrestrained plethysmography and forced oscillation for identifying genetic variability of airway responsiveness in inbred mice. Physiol. Genomics. 43 (1), 1-11 (2011).
- Flandre, T., et al. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94 (3), 1129-1136 (2003).
- Petak, F., et al. Hyperoxia-induced changes in mouse lung mechanics: forced oscillations vs. barometric plethysmography. J. Appl. Physiol. 90 (6), 2221-2230 (2001).
- Drorbaugh, J. E., Fenn, W. O. A barometric method for measuring ventilation in newborn infants. Pediatrics. 16 (1), 81-87 (1955).
- Milton, P. L., Dickinson, H., Jenkin, G., Lim, R. Assessment of respiratory physiology of C57BL/6 mice following bleomycin administration using barometric plethysmography. Respiration. 83 (3), 253-266 (2012).
- Gargiulo, S., et al. Mice anesthesia, analgesia, and care, part I: anesthetic considerations in preclinical research. ILAR J. 53 (1), 55-69 (2012).
- Hildebrandt, I., et al. Anesthesia and other considerations for in vivo imaging of small animals. ILAR J. 49 (1), 17-26 (2008).
- Meijer, M. K., et al. Effect of restraint and injection methods on heart rate and body temperature in mice. Lab Anim. 40, 382-391 (2006).
- Hamelmann, E., et al. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156 (3), 766-775 (1997).
- Lim, R., et al. Human mesenchymal stem cells reduce lung injury in immunocompromised mice but not in immunocompetent mice. Respiration. 85 (4), 332-341 (2013).
- Murphy, S., et al. Human amnion epithelial cells prevent Bleomycin-induced lung injury and preserve lung function. Cell Transplant. 20, 909-923 (2011).
- Murphy, S., et al. Human amnion epithelial cells do not abrogate pulmonary fibrosis in mice with impaired macrophage function. Cell Transplant. 21 (7), 1477-1492 (2012).
- Wichers, L. B., et al. A method for exposing rodents to resuspended particles using whole-body plethysmography. Part. Fibre Toxicol. 13 (12), (2006).
- Chong, B. T. Y., et al. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39 (3), 163-168 (1998).
- Lizuka, H., et al. Measurement of respiratory function using whole-body plethysmography in unanesthetized and unrestrained nonhuman primates. J. Toxicol. Sci. 35 (6), 863-870 (2010).
- McGregor, H., et al. The effect of prenatal exposure to carbon monoxide on breathing and growth of the newborn guinea pig. Pediatr. Res. 43, 126-131 (1998).
- Lundblad, L., et al. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Bartlett, D., Tenney, S. M. Control of breathing in experimental anemia. Respir. Physiol. 10 (3), 384-395 (1970).
- Malan, A. Ventilation measured by body plethysmography in hibernating mammals and in poiiulotherms. Respir. Physiol. 17 (1), 32-44 (1973).
- Seifert, E. L., Mortola, J. P. The circadian pattern of breathing in conscious adult rats. Respir. Physiol. 129 (3), 297-305 (2002).
- DuBois, A. B., et al. A new method for measuring airway resistance in man using a body plethysmograph: Values in normal subject and in patients with respiratory disease. J. Clin. Invest. 35 (3), 327-335 (1956).
- Enhorning, G., et al. Whole-body plethysmography, does it measure tidal volume of small animals. Can. J. Physiol. Pharmacol. 76 (10-11), 945-951 (1998).
- Zhang, Q., et al. Does unrestrained single-chamber plethysmography provide a valid assessment of airway responsiveness in allergic BALB/c mice. Respir. Res. 10 (61), (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados