Method Article
Um Método para o cultivo embrionário
Neste Artigo
Resumo
Descrevemos aqui um protocolo revisto para a cultura em grande escala de embrionário C. elegans células. Embryonic C. elegans células cultivadas in vitro utilizando este método, parece diferenciar e recapitular a expressão de genes de uma forma específica de célula. As técnicas que necessitem de acesso directo para as células ou o isolamento de tipos específicos de células a partir de outros tecidos podem ser aplicadas em C. elegans células cultivadas.
Resumo
C. elegans é um poderoso sistema de modelo, em que as técnicas genéticas e moleculares são facilmente aplicáveis. Até há pouco tempo, porém, as técnicas que requerem o acesso directo às células e o isolamento de tipos de células específicos, não pôde ser aplicada em C. elegans. Esta limitação foi devido ao facto de que os tecidos estão confinados dentro de uma cutícula pressurizado que não é facilmente digerida por tratamento com enzimas e / ou detergentes. Baseado no trabalho pioneiro por Laird Bloom, Christensen e seus colegas desenvolveram um método robusto para a cultura C. elegans células embrionárias em larga escala. Os ovos são isolados a partir de adultos grávidas por tratamento com lixívia / NaOH e subsequentemente tratado com quitinase para remover as cascas. As células embrionárias são, em seguida, dissociados por pipetagem manual e plaqueadas sobre substrato de vidro coberto, em meio enriquecido com soro. Dentro de 24 horas de celas de isolamento começam a diferenciar alterando a morfologia e expressando marke específico de célulars. C. elegans células cultivadas usando este método para sobreviver até duas semanas in vitro, e foram utilizados para electrofisiológico, imunoquímicos e de imagem, bem como as análises terem sido escolhidas e utilizadas para microsséries de perfilamento.
Introdução
Caenorhabditis elegans (C. elegans) é um poderoso organismo modelo para investigar as bases moleculares da função celular, diferenciação e comportamento. Embora o seu genoma, metabólica e vias biossintéticas são semelhantes aos vertebrados ', a sua tratabilidade genética e molecular são muito maiores 2. Entre as suas vantagens são o seu tamanho e a anatomia simples, o seu ciclo de vida rápida (3 dias a 25 ° C), tempo de vida curto (2 semanas) e um grande número de descendentes (> 200). Devido à sua natureza hermafrodita e ciclo de vida curto, manipulações moleculares e genéticos são simples em C. elegans, incluindo a geração de animais transgênicos 3,4 ea aplicação de técnicas genéticas knock-down, como interferência de RNA 5. C. elegans corpo e casca de ovo são transparentes. Portanto, as células podem ser facilmente visualizadas tanto no adulto e o embrião usando microscopia padrão. Nos últimos 40 anos, a C. elegans comunidade criou recursos inestimáveis para C. pesquisa elegans incluindo uma grande coleção de mutantes, nocautes e transgênicos, uma descrição detalhada da anatomia e desenvolvimento 6,7, incluindo a reconstrução completa do sistema nervoso 8, e um genoma completamente seqüenciado, que é bem anotado e disponível para toda a comunidade ( www.wormbase.com ).
Apesar das inúmeras vantagens, algumas abordagens experimentais têm sido um desafio em C. elegans. Estes incluem os que exigem a acessibilidade à membrana plasmática das células e isolamento de tecidos ou tipos celulares. Na verdade C. tecidos elegans estão confinados dentro do seu esqueleto hidrostática pressurizado, o qual não é facilmente digerida por tratamento enzimático ou detergentes. No final da década de 1990 Miriam Goodman e Janet Richmond pioneira métodos para registros eletrofisiológicos de C. elegansneurônios e células musculares em situ 9,10. Embora estes métodos nos deu importantes insights sobre neuronal e na função muscular in vivo, eles são um desafio e baixo rendimento. Métodos alternativos para estudar a função das células in vivo foram desenvolvidos, principalmente nomeadamente imagiologia cálcio vivo utilizando sensores de cálcio geneticamente codificado como GCamP e cameleon 11-13. Estes métodos, porém, não permite a utilização de ferramentas farmacológicas, porque eles são aplicados em animais vivos intactos.
A primeira tentativa de cultivo C. elegans células in vitro em larga escala foi feita por Laird Bloom durante a preparação da sua tese de doutoramento 14. Infelizmente, as dificuldades encontradas com fraca adesão das células ao substrato, diferenciação celular pobres e sobrevivência impediu o estabelecimento deste protocolo no início como um método de cultura celular robusto. Em 1995, Edgar e colegas publicaram um procedimentopara investigar a divisão celular e morfogénese de isolamento e cultura de uma única C. elegans embriões 15. As células embrionárias obtidos por digestão das cascas de ovo com uma combinação de tratamento enzimático e dissociação manual, continuou a proliferar, produzindo-se ~ 500 células para 15. Posteriormente, Leung e colegas cultivaram um pequeno número de blastômeros para estudar a morfogênese intestinal. Eles mostraram que um em vitro isolado E blastômeros produziu células intestinais polarizadas que criaram uma estrutura análoga à do lúmen intestinal, interagindo uns com os outros através de aderentes apicais junções 16. Buechner e seus colegas também relataram um método semelhante para cultura C. elegans células embrionárias in vitro 17.
Com base neste trabalho precoce, Christensen e seus colegas desenvolveram um protocolo robusto para a cultura C embrionário. elegans células in vitro 1. Elesmostrou que isolado C. elegans células podem diferenciar-se em vários tipos de células e manter as características que possuem in vivo, incluindo a expressão de marcadores específicos de células. Várias técnicas que são um desafio in vivo, pode ser aplicado em isolado C. elegans células embrionárias. Estes incluem electrofisiológico 1,18 19, de imagem e de técnicas imunoquímicas 20,21, bem como o isolamento de tipos de células específicas de célula fluorescente-Activated (FACS) para a construção de células específicas de bibliotecas de cDNA 22,23. Gene knockdown técnicas, tais como interferência de RNA (RNAi) pode ser aplicado em cultura C. elegans células 1 e um método de marcação metabólica novo usando azido-açúcar como uma ferramenta para a descoberta de glicoproteína, foi recentemente desenvolvido para cultivados in vitro C. elegans células 24.
Em conclusão, o método de cultura de células se expande a matriz of técnicas que podem ser aplicadas para a C. modelo elegans num esforço para decifrar a função do gene no contexto de um organismo vivo. Descrevemos aqui o protocolo para o cultivo C. elegans células embrionárias in vitro, que é em grande parte baseado no protocolo descrito primeiramente por Christiansen e colegas 1.
Protocolo
Os asteriscos (*) indicam passos novos ou modificados, quando comparados com Christensen et al. 1
1. Configuração de materiais
- O procedimento de cultura celular requer grandes quantidades de ovos isolados de adultos grávidas. Crescer C. elegans em 8P placas de agar semeadas com NA22 (disponível através da C. elegans genética Consórcio - CGC) bactérias para isolar grandes quantidades de ovos. Nestas placas de a quantidade de peptona utilizado é de 8 vezes a quantidade que é normalmente utilizada para placas NGM. A concentração mais elevada de peptona sustenta o crescimento das bactérias NA22 mais eficiente, o que ao contrário do OP50-, crescem em camadas espessas.
8P placas receita:
Dissolve-se 3 g de NaCl, 20 g de Bacto-peptona, 25 g de agar em 1 litro de água destilada estéril e autoclavagem durante 30 minutos. Deixe o meio fresco a 55 ° C e, em seguida, adicionar estéril-filtrada 1 ml de colesterol (5 mg / ml em EtOH), 1 ml de uma MgCl2, 1 mL de MgSO4 e 25 ml de tampão de KP (estoque de 500 ml 5 g de K 2 HPO 4, 30 g de KH 2 PO 4, pH 6,00). Despeje meio de agar líquido em placas de Petri de 10 centímetros (25 ml / placa).
- No dia seguinte espalhar toda a superfície de cada placa de agar de peptona enriquecida com 1 ml de NA22 E. coli cultivadas durante a noite em meio 2 x YT (16 g de triptona, 10 g de extracto de levedura, 5 g de NaCl em 1 litro de água estéril, pH 7,0) a 37 ° C. Estas bactérias constituem uma fonte de alimento abundante que irá formar uma camada grossa de suporte do crescimento de grandes quantidades de adultos grávidos. Deixar as placas semeadas durante a noite à temperatura ambiente para permitir o crescimento das bactérias. O processo pode ser acelerado por incubação a 37 ° C durante 4-5 horas.
- Transferir animais sedentos para semeados 8P placas. Lavar os animais fora uma placa NGM esfomeados usando 5-6 ml de tampão M9 ou água e adicionar 1-2 mL desta suspensão a cada placa 8P.
- Permitir o crescimento e a multiplicação dos animais until das placas são preenchidos em confluência por adultos grávidas.
- Isolar os ovos necessários para a preparação de C. elegans células embrionárias, a partir de adultos grávidas que usam 5-6 ml de solução de lise.
Solução de Lise receita
5 ml de fresco Bleach, 1,25 ml de NaOH 10 N e 18,5 ml de H 2 O. estéril Esta mistura deve ser renovada antes de cada utilização.
- Lave os ovos isolados de adultos grávidas utilizando tampão de ovo:
Receita tampão Egg
NaCl 118 mM, KCl 48 mM, CaCl2 2 mM, MgCl2 2 mM, Hepes 25 mM, pH 7,3, osmolalidade 340 mOsm.
- Retirar a casca do ovo, que envolve os ovos por tratamento com quitinase. A chitinase é uma enzima com a actividade mais elevada a pH ácido 25. Dissolver quitinase (Sigma, catálogo n °. C6137) em tampão de ovo a pH 6,5 a uma concentração final de 2 mg / ml. Guarde o estoque chitinasesolução a -20 ° C em aliquotas de 1 mL em tubos de 15 ml estéreis cónicos. As aliquotas podem ser guardadas a -20 ° C até alguns meses.
- Crescer C. células cultivadas sobre lamínulas elegans autoclavados (12 mm de diâmetro) cobertos com amendoim lectina. Dissolver amendoim lectina em água estéril (0,5 mg / ml). Solução lectina de amendoim não deve ser filtrada ou autoclavado. Ela também não precisa de ser tratada com luz UV. Loja 2 mL alíquotas a -20 ° C por até 6 meses.
- Meio de cultura celular completo (500 ml) contém 500 ml de meio L-15 de cultura de Gibco, 50 ml de soro fetal de bovino (inactivado pelo calor), 7,7 g de sacarose (45 mOsm), 5 mL de 100 U / ml de penicilina e de 100 ug / ml de estreptomicina (2%). O meio completo é, então, filtrado usando um filtro de poro de 0,20 um.
Note-se que o tampão de ovo e o meio de cultura tem a osmolaridade de 340 e 345 mOsm, respectivamente. Com efeito, contrariamente às células de mamíferos, C. células elegans tem uma relativamente alta osmolaridadeque tem de ser tido em conta quando se preparam soluções que entram em contacto directo com a membrana plasmática das células. As receitas destes reagentes foram ajustados para atingir a osmolaridade desejada, que foi medido usando um osmómetro 1. Não é necessário o uso de um osmómetro se estas receitas são seguidos exactamente e cuidado é usado na preparação destes reagentes. No entanto, deve-se usar um Osmoter se outras soluções precisam estar preparados, cujas receitas não são relatados aqui ou em qualquer uma das publicações que usam C. elegans células cultivadas.
2. Ovo de isolamento
- É recomendável começar com pelo menos quatro placas 8P para recolher ovos suficiente para 12 poços de cultura de células (em placas de 24 poços).
- Antes de iniciar o procedimento descongelar um tubo da solução de lectina de amendoim. Coloque lamelas autoclavados no fundo das cavidades numa placa de 24 poços e adicionar 200 mL de lectina de amendoim para as lamelas. Incubar durante 1 h ou uté as células estão prontas a ser revestida. Remover completamente a lectina de amendoim e lavar os poços uma vez com 1 ml de água autoclavada estéril. A remoção completa da lectina de amendoim das lamelas é essencial para evitar a aglomeração de células.
- Lave os adultos grávidas fora das placas de ágar com água autoclavada estéril. Coletar a suspensão em duas estéril tubo cônico de 50 ml. Deixar os tubos em gelo durante até 5 minutos para permitir a precipitação dos vermes, na parte inferior dos tubos (*). Retire a água com uma pipeta de plástico e substituí-lo com água estéril fresco autoclavado. Granulado de vermes por tampo de mesa de centrifugação a 200 x g (~ 1200 rpm) durante 10 minutos (*). Repetir este último passo, pelo menos, 3.
- Transferir vermes em um tubo de 15 ml estéril, cónico e sedimentar-los a 200 xg (~ 1200 rpm) durante 10 minutos (*). Não usar maior velocidade de centrifugação para evitar a recolha das bactérias na parte inferior do tubo, bem. Às vezes, depois centrifugações os vermes não são completamente peletizada. After cada lavagem e antes da remoção do sobrenadante, colocar os tubos durante 5 min em gelo. Em refrigerados vermes água precipitar para o fundo do tubo.
- Retire a água e adicionar 5-6 ml de solução de lise (ver material configurado). Balance a suspensão suavemente durante 5-10 min e, em seguida, começar a monitorar verme lise sob a lupa a cada 2-3 min. Uma gota de suspensão pode também ser colocado sobre uma lamela de inspecção mais fácil. O tempo de incubação varia de acordo com o frescor da água sanitária; comprar pequenas garrafas de água sanitária e abrir uma nova garrafa a cada mês.
- Quando ~ 70-80% dos vermes são lisadas (10 minutos a partir do início do período de incubação), parar a reacção de lise pela adição de 9 ml de tampão pH 7,3 de ovo (ver Materiais definido acima). Centrifugar a suspensão a 200 x g (~ 1200 rpm) durante 10 min. Deste ponto em diante tem um bico de Bunsen em diante, no banco para evitar a re-contaminação dos ovos (*).
- Remova cuidadosamente o sobrenadante usando uma pipeta de transferência estéril de plástico e lavar o pellet 3-4x com tampão de ovo até que a solução é límpida. Certifique-se de misturar o bem pellet no buffer óvulo durante cada lavagem.
- Os ovos são separadas das carcaças dos animais, utilizando uma solução de sacarose a 30%. Ressuspender o sedimento em 2 ml de tampão de ovo estéril e adicionar a solução de sacarose de 2 ml de 60% (material em tampão de ovo esterilizada). Misturar bem e centrifuga-se durante 20 min a 200 x g (~ 1200 rpm) (*).
- Remova cuidadosamente os tubos da centrífuga. Os ovos são flutua à superfície da solução. Usando uma pipeta P1000 e dicas estéreis, transferir todos os ovos em uma frescos 15 ml estéreis tubo cônico.
- Adicionar 10 ml de tampão de ovo esterilizada aos tubos e centrifugar a 200 xg (~ 1200 rpm) durante 10 min. Repita a lavagem 3 x. Certifique-se que os ovos são completamente ressuspenso no tampão óvulo durante cada lavagem.
3. As células embrionárias de dissociação
Realizar os próximos passos do processo em condições estéreis, utilizando uma câmara de fluxo laminar. Enquanto os animais sãovestido em placas de bactérias, as lavagens e o tratamento com a solução de lise contendo lixívia deve eliminar a maior parte, se não todas as bactérias. Assim, usando uma capa laminar, neste ponto do processo evita a contaminação de novo a suspensão do ovo.
- Ressuspender ovos peletizadas em 1 ml de 2 mg / ml quitinase (estoque em tampão ovo pH 6,5 (*)) e transferi-los para um novo 15 ml estéril tubo cônico. Rock do tubo para 10-30 min à temperatura ambiente. O tempo exato de incubação muda de acordo com o frescor da enzima e da temperatura da sala e, portanto, deve ser determinado para cada preparação. Recomenda-se iniciar o monitoramento dos ovos sob um microscópio invertido de cultura celular após 10 min de incubação. Nota: em nossa experiência, baixo pH aumenta a atividade enzimática de quitinase. Por esta razão, utilizam ovo tampão a pH 6,5 para dissolver quitinase (receita mencionada acima, onde o pH é ajustado para 6,5 utilizando NaOH).
- Quando ~ 80% dos ovos são digeridos pelatratamento de quitinase (Figuras 1 AB), sedimentar os ovos por centrifugação a 900 x g (~ 2500 rpm) durante 3 min (*). Usando uma pipeta P1000 e dicas estéreis, retire cuidadosamente o sobrenadante e adicionar 3 ml de L-15 médio (*).
- Transferir os ovos para uma placa de diâmetro de 6 cm, e suavemente dissociar as células utilizando uma seringa de 10 ml estéril equipado com uma agulha G 18. Controlar o grau de dissociação, colocando uma gota de suspensão em uma placa de Petri de plástico fresco e exibindo sob o microscópio. Não aspirar o ar para dentro da seringa, durante este procedimento, para evitar danificar as células. Continuar a dissociação até ~ 80% das células são dissociadas.
- Filtrar a suspensão através de um filtro estéril 5 um Millipore. As suspensões de células deve ser filtrada a fim de remover aglomerados de células, ovos não digeridos e larvas chocadas. Filtrar adicionais 4-5 ml de fresco meio L-15 através do filtro para recuperar as células. Não use força excessiva durante a etapa de filtração para evitar damaging o filtro e / ou as células.
4. A cultura de células
- Agregar as células dissociadas por centrifugação a 900 x g (~ 2500 rpm) durante 3 min (*). Usando uma pipeta P1000 e dicas estéreis retire cuidadosamente todo o sobrenadante. Ressuspender as células peletizadas em completa meio L-15 e a placa 1 ml / poço. A quantidade de meio adicionado depende do número de placas 8P utilizado, a confluência dos vermes nas placas, e do tipo de experiências que vão ser realizadas sobre as células. A densidade celular pode ser determinado utilizando um hemocitómetro. Para gravações de patch-clamp chapeamento densidade de ~ 230 mil células / cm 2 é o ideal.
- Mantenha a placa de 24 poços em um recipiente Tupperware de plástico com papel-toalha molhada para evitar a evaporação do meio de cultura. Guardar o recipiente numa incubadora humidificada a 20 ° C e ar ambiente.
- As células são normalmente preparados para os testes dentro de 24 horas, quando a diferenciação morfológica e expressaíon de marcadores GFP estão completos. As células podem ser mantidas em cultura durante até 2 semanas, mas são geralmente mais saudável até 7-9 dias após o plaqueamento. O meio deve ser substituído uma vez por dia para manter as células saudáveis.
Resultados
C. elegans células em cultura e diferenciar células expressam marcadores específicos
Christensen e colegas usando a coloração azul de tripan demonstrou que> 99% dos embrionário C. elegans células sobrevivem ao procedimento de isolamento. No dia 9, e 22 após o plaqueamento, 85% e 65%, respectivamente, estão ainda vivos 1. Isolada embrionário C. células elegans devem aderir a um substrato, a fim de se diferenciar. As células que não conseguem aderir pedaços de forma e não é claro se eles sobrevivem. A diferenciação das células começa 2-3 horas após o plaqueamento e continua durante ~ 24 horas. Dentro de 24 horas, as células assumem morfologias específicas. Assim, os neurônios enviam processos 1,18-20, as células musculares forma alongada estruturas semelhantes a dedos, semelhantes às observadas in vivo 1 e células canal formar um lúmen 17. As características morfológicas in vitro são muito semelhantes aos da vivo. Por exemplo, in vitro em cultura de neurônios sensíveis ao toque ALM e PLM (identificados pela expressão de PMEC-4 :: GFP) desenvolver apenas dois processos neuronais com um mais do que o outro, como eles fazem in vivo 1,20 (Figura 2A). Isto sugere que pelo menos alguns dos mecanismos moleculares que dirigem a diferenciação de C. elegans células são células-autônoma e, portanto, pode ser reproduzido in vitro.
Na década de 1990, Chalfie pioneira no uso da proteína verde fluorescente (GFP) em C. elegans para etiquetar os tipos de células em que um gene de interesse é expressa 26. O trabalho feito até agora sobre culta C. elegans células embrionárias que suporta a expressão de GFP em tipos específicos de células pode ser reproduzido in vitro 1,18-20,27 (Figura 2A). Além disso, a proporção de células que expressam a GFP in vitro é semelhante ao rácio observado in vivo. Por exemplo, unc-4 homeodomínio repórtergene é expresso em 13 neurônios motores embrião maduro (13 de 550 células 2,3%) 28,29. Fox e colaboradores, contados :: GFP células unc-4 em cultura e descobriu que eles são de 2% do número total de células 23. Da mesma forma, UNC-119, uma proteína necessária para a proteína G tráfico 30, é expresso em mais C. elegans neurónios e algumas células musculares (76% das células em que a larva L1 31). Christensen e colegas relataram que, em cultura de unc-119 :: expressão GFP foi observada em 74-76% das células que se assemelham a neurónios e células musculares 1. Finalmente, MEC-4, um mechanosensitive Na + / Ca 2 + subunidade canal necessário para toque suave 32 é expressa em 6 neurônios sensíveis ao toque no adulto C. elegans. Destes seis neurônios sensíveis ao toque, quatro (esmolas e PLMs) são embrionariamente derivada. Assim, de 4 550 (0,7%), as células embrionárias deve expressar GFP sob o controle do promotor mec-4. Na verdade, os neurônios em culture que expressam PMEC-4 :: GFP constituem ~ 0,5% do número total de células 18,20.
E marcadores de proteína modificações pós-traducionais que são específicos de células também pode ser observado in vitro. Por exemplo, alfa tubulina é acetilado apenas nos neurônios sensíveis ao toque em C. elegans 33. In vitro, os processos de neurónios toque mancha com um anticorpo criado contra acetilada-alfa-tubulina de 20 (Figura 2B). Neurônios sensíveis ao toque cultivadas também expressam o tóxico canal mutante MEC-4 (d), que causa a morte dos neurônios sensíveis ao toque in vivo 34. Com efeito, expressando GFP neurónios preparados a partir de um mec-4 (d); PMEC-4 :: GFP estirpe estão inicialmente presentes na cultura mas, em seguida, degenerar 20. É importante ressaltar que tocar neurônios preparados a partir de mec-4 (d); PMEC-4 :: GFP comportar in vitro da mesma forma como eles se comportam em vivo. Por exemplo, eles podem ser resgatados da morte, por tratamento com ummiloride e dantrolene, que poupa mec-4 (d) os neurônios sensíveis ao toque da degeneração in vivo 20,35. Para concluir, não apenas C. elegans células embrionárias morfologicamente se assemelham a células in vivo, mas também expressar marcadores específicos de células e estão presentes na mesma proporção em que estão presentes in vivo. Tomados em conjunto, apoiar estes dados que culta C. elegans células constituem um sistema bem geral para estudar os processos biológicos tanto em nível celular e molecular.
Patch-clamp análise eletrofisiológica da cultura C. elegans células
A técnica de patch-clamp, que foi introduzido por Sakmann e Neher nos anos setenta para o estudo da atividade canais iônicos das células isoladamente ou em tecidos pode ser aplicado a culta C. elegans células 36. Christensen e seus colegas foram os primeiros a estudar canais iônicos em culta C. células elegans utilizandopatch-clamp 1. Desde então, K +, aniónicos, catiónicos e os canais não selectivos (Figuras 2 CE), bem como os transportadores de dopamina-dependentes canais têm sido descritos em cultivadas C. elegans 1,18,19,37. Estes estudos avançado nossa compreensão do papel de condutâncias iônicas em função do C. elegans neurônios. Existem algumas modificações que precisam ser considerados quando se utiliza a técnica de patch clamp para gravar a atividade do canal iônico culta C. elegans células. Estas modificações são principalmente relevantes para gravações de células inteiras. Primeiro, C. elegans células são pequenos, por exemplo, os neurónios têm um diâmetro de 1-2 um. Assim, pipetas de vidro precisa ter uma ponta pequena (0,5 mm). As pequenas pontas de pipeta aumentar a resistência de entrada, resultando em erros de estimulação e gravação. Para aliviar este problema, pipetas pode ser construído de modo a ter uma ponta pequena, mas uma grande cone. Goodman e Lockery desenvolvido um método employing um polidor de fogo equipada com uma bomba de ar de alta pressão para pipetas de moldagem a esta forma 38. Em segundo lugar, devido ao pequeno tamanho das células, o acesso de células inteiras usando sucção geralmente resulta em danos para a célula. Muito maior sucesso é geralmente conseguida através da aplicação de um impulso de alta tensão (zapping eléctrica) para o pedaço de membrana sob a ponta da pipeta. As outras configurações da técnica de patch-clamp (célula anexa, de dentro para fora e de fora para fora) são fáceis de aplicar-se a C. elegans células em cultura, com a única diferença de que a ponta da pipeta deve ser pequeno para ter em conta o pequeno tamanho de C. elegans células. A técnica de patch perfurada é notoriamente mais trabalhoso e demorado do que outras técnicas de fixação de membranas. No entanto, tem sido aplicado com êxito em C. elegans células in situ 39, 40 e, portanto, deve ser aplicado na cultura também.
Imagem de cálciotécnicas aplicadas a C. células cultivadas elegans
O papel funcional de 2 + canais de Ca voltagem-dependentes (VGCC) em neurônios e células gliais foi investigado em culta C. elegans células por imagiologia de cálcio 20, 21, 41. A aplicação de imagiologia de cálcio em cultura permitiu o uso de soluções contendo concentrações elevadas de KCl para induzir a despolarização das células e dos bloqueadores dos canais de cálcio para discernir a contribuição de diferentes tipos de canais para o influxo de cálcio. Por exemplo, a contribuição de Na + / Ca2 + permeável MEC-4 (d) do canal para a concentração de cálcio intracelular foi determinado por imagiologia de cálcio usando cameleon YC2.12 na presença e ausência do DEG / ENaC bloqueador do canal de amilorida. Estas experiências demonstraram que o influxo de cálcio sensíveis a amilorida está presente em neurónios que expressam toque MEC-4 (d), mas não na de tipo selvagem neurónios sensíveis ao toque. Usando ionóforo para permeabilizar a membrana datocar os neurônios e para calibrar cameleon (Figuras 3A e B), Bianchi e seus colegas também determinou que a concentração média de cálcio livre em contato neurônio é de 200 nM 20 (Figuras 3C e D). Da mesma forma, Frokjaer-Jensen e colegas investigaram o papel de VGCCs EGL-19 e UNC-36 na regulação do fluxo de cálcio induzida por despolarização em C. elegans cultivadas neurônios mecanosensorial expressando cameleon 21. Eles verificaram que a despolarização dos neurónios induzidos por toque K + extracelular num intervalo entre 20 mM e 100 mM, resultou em aumento de cálcio intracelular revelado por YFP / PCP mudança de relação entre 17% e 70%. Além disso, os transientes de cálcio foram reduzidos por unc-36 mutações de função perda egl-19 e não foram detectados e, na ausência de Ca2 + extra-sugerindo que VGCCs desempenhar um papel-chave na excitabilidade de C. elegans tocar neurônios 21.
Stout e Parpura examinou o papel do Ca 2 + canais dependentes da voltagem EGL-19, CCA-1 e UNC-2 em CEPSH bainha glia do sensilla cefálica em contribuir para o influxo de cálcio 41. Dinâmica de cálcio intracelulares foram analisados em CEPSH células gliais cultivadas a partir de animais transgénicos que co-expressam o marcador fluorescente mCherry vermelho fluorescente e o Ca2 + citosólico indicador GcaMP2.0 verde. Na maioria das células da glia CEPSH, a despolarização da membrana induzida por concentrações elevadas extracelulares de KCl aumento induzido de Ca 2 + intracelular, como relatado por aumento da GcaMP2.0 fluorescência. Além disso, o tratamento com bloqueadores de canais de cálcio Cd 2 + e NEMA (nemadipine-A) reduziu significativamente os transientes de cálcio. Estes dados sustentam que a tensão aumento dependente do cálcio intracelular nas células da glia CEPSH depende, pelo menos em parte, nos canais de cálcio dependentes da voltagem. Os autores, analisou mais alterações de cálcio intracelular em L-tipo EGL-19RF (diminuição da função), T-CCA tipo-1 e N, P / Q, R-tipo de canal unc-2 animais knockout e concluiu que todos os três tipos de Ca 2 + canais de contribuir significativamente para a dinâmica de cálcio intracelular nestas células gliais . Assim, desde macroglia mamíferos imaturos responder à despolarização via mudanças VGCC-dependentes em Ca 2 + intracelular concentrações, os autores concluem que C. células gliais elegans CEPSH pode assemelhar-se funcionalmente macroglia mamíferos, astrócitos, oligodendrócitos e as células precursoras de oligodendrócitos.
Outras técnicas aplicáveis ao culto C. elegans células embrionárias
Células activadas por fluorescência (FACS) foi aplicado com sucesso a C. elegans células cultivadas para enriquecer culturas com tipos específicos de células e / ou para isolar as células para análise microarray 23,4243. A principal modificação que foi necessário introduzirao método de cultura de células foi o tipo de substrato utilizado. Colegas estranhas e testaram-se diferentes substratos incluindo colagénio IV, poli-L-lisina, fibronectina e laminina e estabeleceu que a poli-L-lisina é o melhor substrato 37. Poli-L-lisina promove a diferenciação das células apenas, assim como a lectina de amendoim, mas ao contrário do amendoim lectina permite descolamento das células a partir do substrato 36 sem danos. Vários tipos diferentes de C. células elegans foram classificadas por FACS, incluindo TERMOSENSORIAL, olfativo, motor e neurônios mecanosensorial e glia 23,42 - 45. Rotulagem celular foi realizada por expressão de GFP e repórteres em geral, a eficiência de triagem é elevado com o isolamento de até 90% de células marcadas com GFP 23.
O silenciamento de gene por interferência de RNA (RNAi) pode ser conseguida em cultura. Christensen e colegas mostraram que a incubação de expressando GFP cultivadasC. elegans neurónios com ARNcd contra GFP resultou em redução significativa do nível de expressão de GFP com um efeito máximo de 4 dias após a adição de ARN de cadeia dupla para a cultura 1. Da mesma forma, Shih e colegas utilizaram RNAi em cultura para demonstrar que o C. elegans SID-1 é necessário para mediar o efeito do dsRNA e é provável que seja necessária in vivo para mediar RNAi difusão sistémica de 46. Em conclusão, RNAi, que é um dos métodos mais utilizados e eficazes para silenciamento de genes em C. elegans pode ser aplicado em cultura. Este método poderia ser utilizado para o silenciamento de genes cujos knockout é letal ou interfere com C. elegans desenvolvimento normal.

Figura 1. C. elegans embriões antes e após o tratamento quitinase. (A) A fotografia de ovos antes da exposição ao quitinase. A seta aponta para a casca de ovo transparentes e íntegros que cercam um embrião. (B) Ovos tratados com quitinase por 10 min. Os ovos foram digeridos e não são mais visíveis em torno dos embriões. As setas apontam para embriões de três dobras liberados da casca de ovo. A caixa azul rodeia um grupo de células que ainda estão ligados uns aos outros.
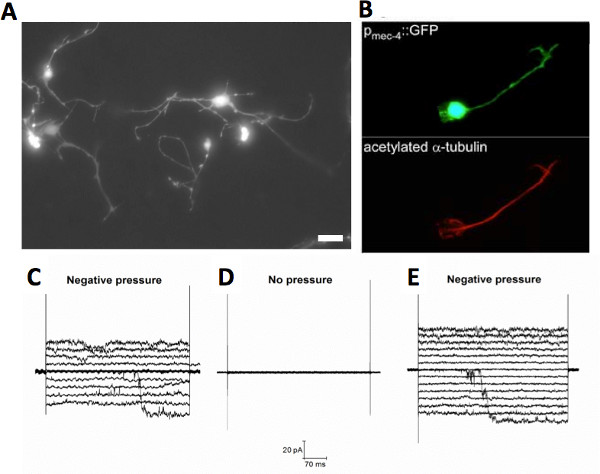
Figura 2. Cultivadas C. elegans tocar neurônios. (A) micrografia fluorescente de cultura C. elegans tocar neurônios expressando GFP sob o toque promotor específico mec-4 (P mec-4 :: GFP), barra de escala 5 mm. (B) micrografias fluorescentes de um neurônio toque expressar P mec-4 :: GFP (painel superior), que foi corado com um anticorpo monoclonal contra a tubulina alfa acetilado (Sigma), uma posttranslational modificação de alfa tubulina que ocorre nos neurônios sensíveis ao toque apenas 33. Adaptado a partir de 20. (CE) Exemplo de canais mechanosensitive registrados no tipo selvagem cultivadas neurônios sensíveis ao toque na configuração anexado à célula da técnica de patch clamp. O canal tem uma condutividade de 100 pS ~ e está presente em neurónios isolados a partir de toque mec-4 animais knockout (mec-4 (u253)), bem. Estes dados sugerem que este canal não é o canal MEC 20. Clique aqui para ver maior figura .

Figura 3. Estimativa da concentração de cálcio intracelular livre nos neurônios sensíveis ao toque cultivadas utilizando cameleon. (A) a pseudo imagens de neurônios sensíveis ao toque cultivadas expressando cameleon YC2.12 em 0 mM Ca 2 + (+ EGTA, à esquerda) e em 10 mM Ca 2 + (direita). A escala de pseudo é mostrado à direita. (B) cameleon Representante mudanças fluorescentes associados a alterações na concentração de cálcio intracelular em um toque neurônio permeabilizadas. Antes de gravar, as células foram incubadas durante 30 minutos em uma solução contendo o ionóforo do cálcio A23187-Br (10 mM) e uma concentração definida de cálcio livre (250 nM, neste caso). Rotenona (10 mM) e 2-desoxi-D-glucose (1,8 mM) foram também adicionados à solução para bloquear as bombas activas. O neurónio foi então perfundido com uma solução contendo 0 mM (EGTA 5 mM) de Ca2 + e 10 mM de Ca2 + para determinar a fluorescência mudanças de relação máxima e mínima. (C) Cameleon curva de calibração que mostra os resultados obtidos 4-7 células cuja fluorescência alterações foram avaliadas em 11 diferentes soluções de cálcio livre. Cada alteração na proporção foi normalizado com a mudança proporção máxima para a célula individual. (D) Estimativa da concentração de cálcio livre em neurônios cultivados. Neurónios toque cultivadas foram fotografadas por 3 minutos em uma solução salina padrão extracelular. Cameleon mudanças de relação mínimo e máximo foram estabelecidos como descrito no painel (B). O rácio cameleon descansando em neurónios em cultura de toque foi de 22% ± 7 (n = 2, 18) de células de mudança de relação máxima. Com base na curva de calibração mostrado em (C), este índice corresponde a uma concentração de cálcio livre de ~ 200 nM. Adaptado a partir de 20. Clique aqui para ver maior figura .
Discussão
C. elegans é um poderoso organismo modelo para decifrar os caminhos genéticos envolvidos no desenvolvimento, comportamento e envelhecimento. A sua conveniência provém principalmente da facilidade com que ele pode ser manipulado geneticamente e do seu ciclo de vida curto. Apesar da sua conveniência, C. elegans tem suas limitações. C. elegans células são pequenas e confinado dentro de uma cutícula pressurizado que limita a aplicação de métodos que requerem o acesso directo às células, tais como as técnicas electrofisiológicas e farmacológicas, ou o isolamento de tipos de células específicos, tais como o perfil de expressão genética por meio de análise de microarray. O C. elegans método de cultura de células tem sido uma solução para muitas das limitações deste organismo modelo.
Neste artigo descrevemos um método atualizada para isolar e cultivar embrionário C. elegans células em grande escala colegas 1 com base no trabalho precoce por Christensen e. Nós also relatório de resultados publicados representativos obtidos usando uma variedade de técnicas, incluindo imunocitoquímica, eletrofisiologia e de imagem de cálcio, que têm avançado nossa compreensão dos processos fisiológicos e requisitos genéticos função célula subjacente em C. elegans. O trabalho feito até agora sobre culta C. elegans células suporta que se diferenciam in vitro como em vivo recapitulando a expressão de marcadores específicos de células 1,18-20,22,23,27,44. Embora nem todos os tipos de células têm sido caracterizados em cultura, este corpo de trabalho sugere que o método de cultura celular permite que o estudo de C. células elegans em isolamento, sem comprometer a sua identidade.
O protocolo é simples e facilmente aplicável em qualquer laboratório. Coisas que precisam ser mantidos em mente para cultivar com sucesso C. células embrionárias elegans são os seguintes: 1) Os animais devem ser sincronizados de modo a que a maioria deles will ser gravid adultos no momento do procedimento de cultura de células. Iniciando a cultura verme de um prato de fome é uma boa opção. 2) As bactérias usadas para crescer C. elegans precisam de ser eliminados antes da lise sem-fim de evitar a contaminação da cultura de células. Recomenda-se que grandes volumes de água estéril, que são utilizados para as lavagens e que os animais são centrifugadas à sugerido (não superior a) da velocidade para evitar a precipitação da bactéria bem. Com efeito, enquanto que o tratamento com o tampão de lise contendo lixívia deve eliminar bactérias, a partir de uma suspensão de animais relativamente livre de bactérias é recomendada. 3) Os animais devem ser tratados com água sanitária / NaOH até ~ 80% deles têm lançado seus ovos. Tempos menores e mais longos de incubação reduzir a eficiência de recuperação de ovos e danificar os ovos, respectivamente. 4) a digestão da casca de ovo por chitinase devem ser cuidadosamente monitorizados. Dissociação manual deve ser iniciado quando ~ 80% dos ovos foram digeridos. Mais longo e mais curto incubattempos de iões, tanto em resultado de dano celular, devido à perda directa da membrana do plasma pela enzima e danos causados pela dissociação Manual prolongada e mais dura, na tentativa de isolar as células, respectivamente. 5) filtração celular através do filtro de 5 mm não deve ser forçada. Se o filtro ficar obstruído, ele deve ser mudado com um frescos para evitar danos nas células.
Apesar do fato de que as células embrionárias cultivadas revolucionaram o campo, em muitos aspectos, eles não são a resposta para cada questão científica e ainda tem limitações. Por exemplo, os genes expressos em cultura são principalmente embrionário uma vez que as células são isoladas a partir de embriões. Compartimentos subcelulares pode não se desenvolver corretamente na cultura. Por exemplo, o desenvolvimento e manutenção dos cílios de certos neurônios sensoriais amphid como AWA e AWC dependem da interação com glia amphid, que se perde na cultura 44. As células perdem seus vizinhos naturais e não fazem fisiologicamente relEvant célula-célula contatos. Por exemplo, não se sabe se as células formam junções apertadas, elétricos ou sinapses químicas e se o fazem, estes não são susceptíveis de ser com seus parceiros fisiológicas. Além disso, as células são semeadas em um único substrato, a lectina de amendoim. A matriz extracelular in vivo tende a ser uma mistura complexa e difícil de reproduzir de muitas moléculas, incluindo a lectina de amendoim, laminina, colagénio, fibronectina e. Além disso, a matriz extracelular especializada talvez necessário para certos tipos de funções celulares. Por exemplo, o canal mechanosensitive expresso em neurónios toque corpo e formada pelo MEC MEC-4 e-10 subunidades não pode ser fechado em cultura 18, mas pode ser facilmente fechado in vivo 47. Isto provavelmente deriva do facto de que o colagénio extracelular MEC-5 normalmente produzido por células vizinhas costura in vivo, não está presente na cultura de 48. MEC-5, juntamente com proteínas da matriz extracelular MEC-1 (a 1.999 aa longoproteína com um domínio de tipo Kunitz e dois domínios EGF) e MEC-9 (uma proteína de 834 aa de comprimento, que contém vários domínios do tipo Kunitz, repetições de EGF e um domínio rico em ácido glutâmico) são necessários para a sensação táctil e são pensados para se ligarem para os domínios extracelulares do complexo canal MEC e exercer gating tensão no complexo durante a estimulação mecânica.
Para concluir, C. células embrionárias elegans podem ser cultivadas in vitro e parecem diferenciar recapitulando a expressão de genes específicos de células. O protocolo para o isolamento e cultura de células é simples e pode ser aplicada em qualquer laboratório com um mínimo de experiência em técnicas de cultura de células. Tendo em conta as limitações desta técnica, o método de cultura de células pode ser e tem provado ser uma técnica poderosa quando as células diretos acessar e / ou isolamento de tipos de células específicas são necessárias. Um protocolo para o isolamento de células a partir de larvas foi também recentemente desenvolvido (not descrito aqui) 49. Grande interesse no desenvolvimento de métodos complementares está fazendo C. elegans um sistema ainda mais poderoso para, em última análise compreender a ligação entre a função dos genes e comportamento, desenvolvimento ou envelhecimento.
Materiais
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Bacto Peptone | VWR International Inc. | 90000-382 | |
| Difco Agar Granulated | VWR International Inc. | 90000-784 | |
| Bacto Tryptone | VWR International Inc. | 90000-284 | |
| Bacto Yeast Extract | VWR International Inc. | 90000-724 | |
| Leibovitz's L-15 Medium (1x) Liquid | Invitrogen | 11415-064 | |
| Fetal Bovine Serum | Invitrogen | 16140-063 | |
| Penicillin-streptomycin | Sigma | P4333-100ML | |
| Chitinase from Streptomyces Griseus | Sigma | C6137-25UN | |
| NA22 Escherichia coli | Caenorhabditis Genetics Center | ||
| Peanut Lectin | Sigma | L0881-10MG | |
| Sucrose | Sigma | 57903-1KG | |
| D-(+)Glucose | Sigma | 67528-1KG | |
| Ethylene glycol-bis (2-amin–thylether), N,N,N',N'- tetraacidic acid (EGTA) | Sigma | E0396-25G | |
| Hepes | Sigma | H3375-500G | |
| Cholesterol | |||
| NaCl | Sigma | 57653-1KG | |
| KCl | Sigma | P9333-500G | |
| CaCl2 | Sigma | C1016-500G | |
| MgCl2 | Sigma | M8266-100G | |
| MgSO4 | Sigma | M2643-500 g | |
| K2HPO4 | Sigma | P2222-500G | |
| KH2PO4 | Sigma | P9791-500G | |
| NaOH | Sigma | S8045-500G | |
| KOH | Sigma | P1767-500G | |
| Ethanol | |||
| Autoclaved distilled H2O | |||
| Bleach | |||
| EQUIPMENT | |||
| 101-1000 μl Blue Graduated Pipet Tips | USA Scentific | 1111-2821 | |
| 10 ml Sterilized Pipet Individually Wrapped | USA Scentific | 1071-0810 | |
| Ergonomic Variable Volume (100-1000 μl) Pipettor with tip ejector | VWR International Inc. | 89079-974 | |
| Portable Pipet Aid, Drummond | VWR International Inc. | 53498-103 | |
| Transfer Plastic Pipet Sterile | VWR International Inc. | 14670-114 | |
| 15 ml Conical Tube | USA Scentific | 1475-1611 | |
| 50 ml Conical Tube | USA Scentific | 1500-1811 | |
| Sterile 18 gauge Needles | Becton, Dickinson and Co. | 305196 | |
| Sterile 10 ml Syringes | Becton, Dickinson and Co. | 305482 | |
| Plastic Syringe Filters Corning 0,20 μm pore size | Corning | 431224 | |
| Acrodic 25 mm Syringe filter w/5 μm versapor Membrane | VWR International Inc. | 28144-095 | |
| 60x15 mm Petri Dish Sterile | VWR International Inc. | 82050-548 | |
| 100x15 mm Petri Dish Sterile | VWR International Inc. | 82050-912 | |
| 12 mm Diameter Glass Coverslips | VWR International Inc. | 48300-560 | |
| Clear Cell Culture Plates 24 Well Flat Bottom w/lid | Thomas scientific | 6902A09 | |
| Dumont #5- Fine Forceps | Fine Science Tools | 11254-20 | |
| Centrifuge 5702 | Eppendorf | 022629883 | |
| Laminar Flow Hood | |||
| Inverted Microscope with x10 objective | |||
| Ambient air humidified Incubator | |||
Referências
- Christensen, M., et al. A primary culture system for functional analysis of C. elegans neurons and muscle cells. Neuron. 33, 503-514 (2002).
- Riddle, D. L., Blumenthal, T., Meyer, B. J., Priess, J. R., Riddle, D. L., Blumenthal, T., Meyer, B. J., Priess, J. R. . C. elegans II. , (1997).
- Stinchcomb, D. T., Shaw, J. E., Carr, S. H., Hirsh, D. Extrachromosomal DNA transformation of Caenorhabditis elegans. Molecular and cellular biology. 5, 3484-3496 (1985).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. The EMBO journal. 10, 3959-3970 (1991).
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Sulston, J. E., White, J. G. Regulation and cell autonomy during postembryonic development of Caenorhabditis elegans. Developmental biology. 78, 577-597 (1980).
- Chalfie, M. Caenorhabditis elegans development. Current opinion in cell biology. 1, 1122-1126 (1989).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological sciences. 314, 1-340 (1986).
- Goodman, M. B., Hall, D. H., Avery, L., Lockery, S. R. Active currents regulate sensitivity and dynamic range in C. elegans neurons. Neuron. 20, 763-772 (1998).
- Richmond, J. E., Jorgensen, E. M. One GABA and two acetylcholine receptors function at the C. elegans neuromuscular junction. Nature. 2, 791-797 (1038).
- Miyawaki, A., Griesbeck, O., Heim, R., Tsien, R. Y. Dynamic and quantitative Ca2+ measurements using improved cameleons. Proceedings of the National Academy of Sciences of the United States of America. 96, 2135-2140 (1999).
- Kerr, R., et al. Optical imaging of calcium transients in neurons and pharyngeal muscle of C. elegans. Neuron. 26, 583-594 (2000).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature. 19, 137-141 (2001).
- Bloom, L. . Genetic and molecular analysis of genes required for axon outgrowth in Caenorhabditis elegans. , (1993).
- Edgar, L. G. Blastomere culture and analysis. Methods in cell biology. 48, 303-321 (1995).
- Leung, B., Hermann, G. J., Priess, J. R. Organogenesis of the Caenorhabditis elegans intestine. Developmental biology. 216, 114-134 (1999).
- Buechner, M., Hall, D. H., Bhatt, H., Hedgecock, E. M. Cystic canal mutants in Caenorhabditis elegans are defective in the apical membrane domain of the renal (excretory) cell. Developmental biology. 214, 227-241 (1999).
- Suzuki, H., et al. In vivo imaging of C. elegans mechanosensory neurons demonstrates a specific role for the MEC-4 channel in the process of gentle touch sensation. Neuron. 39, 1005-1017 (2003).
- Carvelli, L., McDonald, P. W., Blakely, R. D., Defelice, L. J. Dopamine transporters depolarize neurons by a channel mechanism. Proceedings of the National Academy of Sciences of the United States of America. 101, 16046-16051 (2004).
- Bianchi, L., et al. The neurotoxic MEC-4(d) DEG/ENaC sodium channel conducts calcium: implications for necrosis initiation. Nature. 7, 1337-1344 (2004).
- Frokjaer-Jensen, C., et al. Effects of voltage-gated calcium channel subunit genes on calcium influx in cultured C. elegans mechanosensory neurons. Journal of neurobiology. 66, 1125-1139 (2006).
- Von Stetina, S. E., et al. Cell-specific microarray profiling experiments reveal a comprehensive picture of gene expression in the C. elegans nervous system. Genome biology. 8, R135 (2007).
- Fox, R. M., et al. A gene expression fingerprint of C. elegans embryonic motor neurons. BMC genomics. 6, 42 (2005).
- Burnham-Marusich, A. R., et al. Metabolic Labeling of Caenorhabditis elegans Primary Embryonic Cells with Azido-Sugars as a Tool for Glycoprotein Discovery. PloS one. 7, e49020 (2012).
- Kim, K. J., Yang, Y. J., Kim, J. G. Purification and characterization of chitinase from Streptomyces sp. M-20. Journal of biochemistry and molecular biology. 36, 185-189 (2003).
- Chalfie, M., Wolinsky, E. The identification and suppression of inherited neurodegeneration in Caenorhabditis elegans. Nature. 345, 410-416 (1990).
- Parpura, V. Voltage-gated calcium channel types in cultured C. elegans CEPsh glial cells. Cell calcium. 50, 98-108 (2011).
- Miller, D. M., Niemeyer, C. J. Expression of the unc-4 homeoprotein in Caenorhabditis elegans motor neurons specifies presynaptic input. Development. 121, 2877-2886 (1995).
- Lickteig, K. M., et al. Regulation of neurotransmitter vesicles by the homeodomain protein UNC-4 and its transcriptional corepressor UNC-37/groucho in Caenorhabditis elegans cholinergic motor neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience. 21, 2001-2014 (2001).
- Zhang, H., et al. UNC119 is required for G protein trafficking in sensory neurons. Nature. 14 (7), (2011).
- Maduro, M., Pilgrim, D. Identification and cloning of unc-119, a gene expressed in the Caenorhabditis elegans nervous system. Genetics. 141, 977-988 (1995).
- Chalfie, M., Sulston, J. Developmental genetics of the mechanosensory neurons of Caenorhabditis elegans. Developmental biology. 82, 358-370 (1981).
- Fukushige, T., et al. MEC-12, an alpha-tubulin required for touch sensitivity in C. elegans. Journal of cell science. 112 (Pt. 3), 395-403 (1999).
- Driscoll, M., Chalfie, M. The mec-4 gene is a member of a family of Caenorhabditis elegans genes that can mutate to induce neuronal degeneration. Nature. 349, 588-593 (1991).
- Xu, K., Tavernarakis, N., Driscoll, M. Necrotic cell death in C. elegans requires the function of calreticulin and regulators of Ca(2+) release from the endoplasmic reticulum. Neuron. 31, 957-971 (2001).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual review of physiology. 46, 455-472 (1984).
- Strange, K., Christensen, M., Morrison, R. Primary culture of Caenorhabditis elegans developing embryo cells for electrophysiological, cell biological and molecular studies. Nature protocols. 2, 1003-1012 (2007).
- Goodman, M. B., Lockery, S. R. Pressure polishing: a method for re-shaping patch pipettes during fire polishing. Journal of neuroscience. 100, 13-15 (2000).
- Nickell, W. T., Pun, R. Y., Bargmann, C. I., Kleene, S. J. Single ionic channels of two Caenorhabditis elegans chemosensory neurons in native membrane. The Journal of membrane biology. 189, 55-66 (2002).
- Ward, A., Liu, J., Feng, Z., Xu, X. Z. Light-sensitive neurons and channels mediate phototaxis in C. elegans. Nature neuroscience. 11, 916-922 (2008).
- Parpura, V. Cell culturing of Caenorhabditis elegans glial cells for the assessment of cytosolic Ca(2)(+) dynamics. Methods Mol. Biol. 814 (2), 153-174 (2012).
- Zhang, Y., et al. Identification of genes expressed in C. elegans touch receptor neurons. Nature. 418, 331-335 (2002).
- Cinar, H., Keles, S., Jin, Y. Expression profiling of GABAergic motor neurons in Caenorhabditis elegans. Current biology : CB. 15, 340-346 (2005).
- Bacaj, T., Tevlin, M., Lu, Y., Shaham, S. Glia are essential for sensory organ function in C. elegans. Science. 322, 744-747 (2008).
- Colosimo, M. E., et al. Identification of thermosensory and olfactory neuron-specific genes via expression profiling of single neuron types. Current biology : CB. 14, 2245-2251 (1016).
- Shih, J. D., Fitzgerald, M. C., Sutherlin, M., Hunter, C. P. The SID-1 double-stranded RNA transporter is not selective for dsRNA length. RNA. 15, 384-390 (2009).
- O'Hagan, R., Chalfie, M., Goodman, M. B. The MEC-4 DEG/ENaC channel of Caenorhabditis elegans touch receptor neurons transduces mechanical signals. Nature. 8, 43-50 (2005).
- Du, H., Gu, G., William, C. M., Chalfie, M. Extracellular proteins needed for C. elegans mechanosensation. Neuron. 16, 183-194 (1996).
- Zhang, S., Banerjee, D., Kuhn, J. R. Isolation and culture of larval cells from C. elegans. PloS one. 6, e19505 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados