Method Article
一种用于培养胚胎
摘要
我们在这里描述的修订协议,用于胚胎C.大型文化线虫的细胞。 C.胚胎线虫使用这种方法的细胞在体外培养时,出现分化和概括的基因的表达在细胞中的具体方式。需要直接访问到细胞中,或从其它组织中的特定细胞类型的分离技术可以对C.施加线虫培养细胞。
摘要
线虫是一种强大的模型系统中,其中的遗传和分子生物学技术是很容易适用的。直到最近,虽然,需要直接访问到细胞和特定的细胞类型的隔离技术,无法在C应用线虫 。这种限制是由于这一事实,即组织内被加压的角质层这是不容易通过与酶和/或洗涤剂处理消化的局限。基于早期的先驱工作,莱尔德布鲁姆,克里斯滕森和同事1开发出一个强大的方法培养C.线虫胚胎干细胞在大规模。鸡蛋是从妊娠成人分离与漂白/ NaOH处理,随后用壳多糖酶处理以除去蛋壳。胚胎细胞,然后通过手动移液解离,并铺板于血清中丰富的介质基片覆盖的玻璃。在隔离牢房的24小时开始改变形态和表达细胞特异性马克分化RS。C.线虫细胞用这种方法培养的存活最多2周体外和已用于电生理,免疫和成像分析以及它们已被分类并用于微阵列分析。
引言
秀丽隐杆线虫 ( 线虫 )是一款功能强大的模式生物研究细胞功能,分化和行为的分子基础。虽然它的基因组,代谢和生物合成途径类似于脊椎动物“,它的遗传和分子可追踪性都远远大于2。在它的优点是它的外形和简洁的解剖,其快速的生命周期(3天在25°C),短寿命(2周)和大量的后代(> 200)。由于其雌雄同体的性质和生命周期短,分子和基因操作是直接在C。线虫 ,包括转基因动物3,4和诸如RNA干扰5基因敲低技术的应用的生成。C.线虫体和蛋壳是透明的。因此,细胞可以容易地可视化在成人和使用标准显微镜的胚胎。在过去的40年里,C。线虫 的社区已经为下创建的宝贵资源线虫的研究,包括收集了大量的突变体,基因敲除和转基因,解剖和发展6,7的详细说明,包括完整的重建神经系统8,和一个完全测序的基因组这是很好的说明,并将提供给整个社会( www.wormbase.com )。
尽管有许多优点,一些实验方法已在C挑战线虫 。这些包括需要访问到组织或细胞类型的细胞和分离的质膜的那些。事实上Ç。线虫组织都在其加压流体静骨架,这是不容易通过酶处理或洗涤剂消化密闭。在20世纪90年代末仪Goodman和珍妮特里士满率先为C的电生理记录的方法线虫神经元和肌肉细胞中原位 9,10。虽然这些方法给了我们重要的见解和神经元在体内的肌肉功能,它们是具有挑战性和低吞吐量。替代的方法来研究细胞功能的体内已经制定了,大多尤其是在使用基因编码的钙传感器,如GCamP和卡默莱昂11-13 体内钙成像。这些方法虽然不允许使用的药理学工具,因为它们是应用在完整的活的动物。
在培养C.第一次尝试线虫细胞在体外大规模被他的博士论文14的制备过程中由莱尔德布卢姆。不幸的是,难以与细胞到衬底的粘附性差遇到,不良细胞的分化和存活无法建立此早期协议作为一个强大的细胞培养方法。 1995年,埃德加和他的同事发表的程序由孤立的单个C和文化来研究细胞分化和形态发生。线虫胚胎15。通过用酶处理和手动解离的组合蛋壳的消化获得的胚胎干细胞,继续增殖,产生高达〜500个细胞15。随后,梁先生和同事培养一个小数字卵裂球的研究肠道形态。它们表明,1 体外分离ë卵裂球产生由通过心尖粘着连接16彼此进行交互创建了一个结构类似于肠腔偏振肠细胞。布氏及其同事还报道了培养℃的类似的方法。线虫胚胎细胞在体外 17。
在此基础上的早期作品,克里斯滕森和同事开发出一种强大的协议培养胚胎Ç。线虫细胞在体外 1。他们表明分离出来的C。线虫细胞可以分化成各种细胞类型和保持它们在体内具有的功能,包括细胞特异性标志物的表达。那些在体内具有挑战性的几种技术,可以在隔离C.应用线虫胚胎细胞。这些包括电1,18 19,成像和免疫化学技术20,21,以及通过荧光激活细胞的特定细胞类型分选(FACS)对细胞特异性cDNA文库22,23的结构的隔离。如RNA干扰(RNAi)的基因敲除技术可以对培养C.施加线虫细胞1,用叠氮基糖作为糖蛋白发现的一个工具了一种新的代谢标记方法最近已在体外培养的C.开发线虫细胞24。
总之,细胞培养方法扩展数组Ø可应用到的C. f技术线虫模型,以努力破译基因功能的生物体的情况下。我们在这里描述的协议C.培养线虫在体外 ,这在很大程度上是基于最早由克里斯蒂安森和他的同事1中所述的协议胚胎细胞。
研究方案
星号(*)表示新的或修改的步骤相比,Christensen 等人 1
1。材质设置
- 在细胞培养过程需要大量的鸡蛋从妊娠的成年人中分离的。 C.成长线虫对8P琼脂平板NA22(可通过线虫遗传协会-长城电脑)接种细菌分离大量鸡蛋。在这些板用蛋白胨的量为8倍,通常是用于NGM板的量。较高的蛋白胨浓度更有效地维系着NA22细菌的生长,这出乎OP50-,生长在厚层。
8P板的配方:
将3克氯化钠,20g的细菌用胰蛋白胨,1升无菌蒸馏水和高压釜30分钟25克琼脂。让介质凉爽,在55℃,然后加入无菌过滤的1毫升胆固醇(5毫克/毫升的EtOH),将1ml 1的MgCl 2的1毫升硫酸镁和25毫升KP缓冲液(500毫升储:5克K 2 HPO 4,30克KH 2 PO 4,pH值6.00)。倒液琼脂培养基中成10毫米培养皿中(25毫升/盘)。
- 第二天散布各富含蛋白胨琼脂板的整个表面上用1毫升NA22 E的在2XYT培养基(16克胰蛋白胨,10克酵母提取物,5克NaCl的1升的无菌水,pH 7.0)中于37℃培养的大肠杆菌过夜这些细菌构成了丰富的食物来源,会形成一层厚厚的支持大量妊娠成人的生长。离开种子板在室温下过夜,使细菌的生长。该过程可以通过在37℃下进行4-5小时来加速。
- 饿死的动物转移到播种8P板。清洗过的动物用5-6毫升M9的缓冲区或水的匮乏NGM板加1-2毫升此悬液,以每8P板。
- 允许生长的动物和乘法UNT金正日板是由妊娠成人人口在汇合。
- 隔离要求下编制的蛋线虫用5-6的裂解溶液胚胎细胞,从妊娠的成年人。
裂解液配方
5毫升新鲜的漂白剂1.25毫升10 N的NaOH和18.5毫升的无菌H 2 O的该混合物必须准备每次使用前新鲜。
- 从洗净用鸡蛋缓冲妊娠成人孤立的蛋:
鸡蛋缓冲配方
118 mM氯化钠,48毫米氯化钾,2毫米氯化钙2,2毫米氯化镁2,25毫米HEPES,pH值7.3,渗透压340毫渗量。
- 删除与几丁质酶处理周围的鸡蛋蛋壳。几丁质酶是在酸性pH值25最高活性的酶。在蛋缓冲液pH 6.5溶解几丁质酶(Sigma公司,目录号C6137)在2毫克/毫升的最终浓度。存储几丁质酶股票溶液在-20℃下在1ml等份在无菌的15毫升锥形管中。等分试样可被储存在-20℃至几个月。
- C.成长线虫培养细胞上覆盖着花生凝集素灭菌盖玻片(直径12 mm)。溶解花生植物血凝素在无菌水(0.5毫克/毫升)。花生凝集素溶液不应该过滤或高压灭菌。它也并不需要被用UV光处理。存储2毫升分装在-20°C可保存6个月。
- 完整的细胞培养液(500毫升)中包含500个ML L-15培养基购自Gibco,将50ml胎牛血清(热灭活),7.7克蔗糖(45毫渗量),5毫升100微克100 U / mL青霉素和/毫升链霉素(2%)。在完全培养基中,然后用0.20微米的微孔过滤器过滤。
注意的是,蛋缓冲器和培养基分别具有340摩尔渗透压浓度和345毫渗透摩尔浓度。事实上,相反的哺乳动物细胞,C。线虫细胞中有相对高的渗透压需要准备的解决方案,在将要与所述细胞的细胞膜直接接触时,必须考虑到计数。这些试剂的配方进行了调整,以达到所需的渗透压,这是用一个渗压计1测量。这是没有必要使用一个渗透压力计如果这些配方是完全按照与护理用于制备这些试剂。然而,人们应该使用osmoter如果其他解决方案需要做好准备,他们的食谱这里不报,或在任何使用C的出版物线虫培养细胞。
2。鸡蛋隔离
- 我们建议开始与至少四个8P板收集到足够的鸡蛋12井培养细胞(24孔板)。
- 开始在手术前解冻的花生凝集素原液一管。置于高压灭菌的盖玻片在孔的底部的24孔板,加入200μl的花生凝集素的盖玻片。孵育1小时或uNTIL细胞准备进行电镀。完全取出花生凝集素和用1毫升无菌水灭菌一次洗井。彻底去除盖玻片花生凝集素是避免细胞聚集是必不可少的。
- 洗妊娠关闭成人用无菌水高压灭菌的琼脂平板。收集悬浮成两个无菌锥形50ml管中。留在冰上的管中长达5分钟,以允许蠕虫沉淀在管(*)的底部。与转印塑料吸管除去水,并将其与新鲜无菌水高压灭菌取代。通过台式离心分离,在200×g离心(〜1200 rpm)离心10分钟(*)沉淀蠕虫。重复该最后步骤至少为3。
- 传送蠕虫到无菌的15毫升锥形管中,沉淀它们在200×g离心(〜1200 rpm)离心10分钟(*)。不使用更高的离心速度,以避免收集细菌在管的底部,以及。有时候,离心后的虫还没有完全沉淀。 AF三每一清洗和去除之前上清液,将管5分钟冰上。在冷却水的蠕虫沉淀到管的底部。
- 去除水中加5-6毫升裂解液(见材料设置)。摇动该悬浮液轻轻地5-10分钟,然后开始监控虫溶胞体视显微镜下,每2-3分钟。一滴悬浮液也可以放置在盖玻片,以方便检查。孵化时间取决于漂白剂的新鲜度;买小瓶装的漂白剂,每月开新瓶。
- 当〜蠕虫的70-80%被溶解(从孵化开始10分钟),停止裂解反应中加入9mL的蛋缓冲液pH 7.3(见材料设置)。离心该悬浮液在200×g离心(〜1200 rpm)离心10分钟。从这点上有一个本生灯上,在板凳上,以防止再次污染的鸡蛋(*)的。
- 小心取出用无菌塑料移液上清,洗涤沉淀3-4x,其中蛋缓冲区中,直到溶液澄清。确保每次洗涤过程中混合颗粒以及在蛋缓冲区。
- 鸡蛋是从用30%蔗糖溶液的动物尸体分离。重悬浮颗粒在2毫升无菌鸡蛋缓冲和加入2ml 60%的蔗糖溶液(股票在无菌鸡蛋缓冲区)。拌匀,离心20分钟在200 XG(〜1200转)(*)。
- 小心地从离心分离机取出试管。将卵悬浮在溶液的上方。使用P1000移液器和无菌针头,转移所有鸡蛋放入一个新的无菌的15 mL锥形管。
- 加入10毫升无菌蛋缓冲到管和离心机在200×g离心(〜1200 rpm)离心10分钟。重复洗涤3×。请确保在鸡蛋缓冲区每次清洗时将鸡蛋完全悬浮。
3。胚胎干细胞解离
进行下一步骤的程序使用的是层流罩的无菌条件下进行。虽然动物袍菌上板,将洗涤液并用含漂白剂的裂解溶液处理,如果不是所有的细菌应消除大部分。因此,使用在层流罩在这一点上的程序可以防止新的卵悬浮液的污染。
- 重悬沉淀鸡蛋1毫升2毫克/毫升的几丁质酶(股票鸡蛋缓冲液pH 6.5(*)),并将它们转移到一个新的无菌的15 mL锥形管。摇动该管,在室温下10-30分钟。根据酶和房间的温度的新鲜度的精确的温育时间的变化,因此应为每个准备确定。建议在开始监视孵育10分钟后倒置细胞培养显微镜下的蛋。注:根据我们的经验,低pH值增加几丁质酶活性。为此,我们使用蛋缓冲液,pH 6.5以溶解几丁质酶(配方上面的报道,其中pH用NaOH调整至6.5)。
- 时〜80%的蛋壳是由消化几丁质酶处理( 图1 AB),通过离心分离沉淀的鸡蛋,在900×g离心(〜2500 rpm)离心3分钟(*)。使用P1000移液器和无菌针头,小心取出上清液,加3毫升的L-15培养基(*)。
- 传送鸡蛋成直径6厘米的板,并用10毫升无菌注射器配备有18号针头轻轻地解离的细胞。将一滴悬浮液到一个新的塑料培养皿中,并通过在显微镜下观察监测解离度。在此过程中不要吸入空气进入注射器,以避免损坏电池。继续解离,直到〜80%的细胞解离。
- 使用无菌5微米的微孔过滤器过滤悬浮液。细胞悬浮液必须经过过滤,以除去细胞团块,未消化的卵和孵出的幼虫。通过过滤器过滤额外4-5毫升新鲜的L-15介质恢复所有的细胞。不要使用在过滤步骤用力过猛,以免达maging过滤器和/或细胞。
4。细胞培养
- 通过离心分离沉淀的分离的细胞在900×g离心(〜2500 rpm)离心3分钟(*)。使用P1000移液器和无菌针头小心地取出所有上清。重悬细胞沉淀在完整的L-15培养基和板1毫升/。加入培养基中的量依赖于所用的8P板的数量,在平板上蠕虫的汇合处,以及将要在细胞上进行的实验的类型。细胞密度可以使用血细胞计数器确定。对于膜片钳记录电镀〜230000个细胞/ cm 2为最佳浓度。
- 保持24孔板中含有湿纸巾,避免培养基蒸发特百惠塑料容器。存储容器,在湿润的培养箱中在20℃和环境空气。
- 这些细胞通常是准备在24小时内试验时的形态分化和快递的绿色荧光蛋白标记物的离子是完整的。细胞可以保存在文化长达2周,但它们通常是最健康的长达7-9天电镀后。介质需要更换,每天一次,以保持健康的细胞。
结果
线虫培养的细胞分化并表达细胞特异性标志物
Christensen和使用台盼蓝染色的同事证明,> 99%的胚胎C的线虫细胞存活的分离过程。在9日和镀后22,分别为85%和65%,仍健在1。孤立的胚胎C.线虫的细胞必须坚持的衬底,以区分。细胞没有附着形成团块和它是否生存是不明确的。细胞的分化开始2-3小时电镀后并持续至24小时。 24小时内,细胞承担的具体形态。因此,神经元发出的进程1,18-20,肌细胞形成手指状的长形结构相似,看到那些在体内 1和运河细胞形成管腔17。 在体外的形态特征非常相似的那些体内 。例如,的体外培养的资产负债管理和PLM触摸神经元(确定的PMEC-4 :: GFP表达)发 展只有两个神经元的过程比另外一个更长的时间,因为他们在体内 1,20( 图2A)。这表明,至少一些该驱动器C的分化的分子机制线虫细胞是细胞自主性,因此可以在体外扼要重述。
在1990年,Chalfie的率先C.利用绿色荧光蛋白(GFP) 线虫来标记,其中感兴趣的基因的表达26的细胞类型。工作对培养C.迄今所做线虫胚胎细胞支持GFP在特定细胞类型中表达,可以在体外 1,18-20,27( 图2A)来概括。此外细胞表达GFP的体外的比例是相似的体内发现的比率。例如,UNC-4同源记者基因的表达在13运动神经元的成熟胚(550的13细胞,2.3%)28,29。福克斯和他的同事,算起来UNC-4 :: GFP的细胞培养,发现他们都是23细胞的总数的2%。同样,UNC-119,需要的G蛋白拐卖30的蛋白,表达于大多数C。线虫的神经元和一些肌细胞(该细胞在L1幼虫31的76%)。 Christensen和同事报道,在培养UNC-119 :: GFP的表达中观察到的细胞类似的神经元和肌肉细胞1的74-76%。最后,MEC-4,需要温柔的触摸32机械敏感性的Na + / Ca 2 +通道亚基的表达在成人C.在6个神经元的联系线虫 。这六个触摸神经元,四(ALMS和周期性肢体运动障碍)是embryonically得出。因此,4 550(0.7%)胚胎细胞应表达MEC-4基因启动子的控制下的GFP。的确,在文化视角神经元Ë表达PMEC-4:绿色荧光蛋白构成细胞18,20总数的约0.5%。
蛋白质标志物,并且是细胞特异性的翻译后修饰也可以观察到体外 。例如,α-微管蛋白乙酰化仅在触摸C.神经元线虫 33。 在体外 ,触摸神经元染色过程与针对乙酰化-α-微管蛋白20( 图2B)的抗体。触摸培养神经元也表达了有毒的突变通道MEC-4(D),从而导致体内 34触摸神经元的死亡。事实上,GFP表达来自一个MEC-图4(d)中制备的神经元; PMEC-4 :: GFP菌株是最初存在于培养但随后变质20。重要的是,从触摸MEC-4(四)编制的神经元; PMEC-4 :: GFP的行为在体外类似于他们的言行举止在体内 。例如,它们可以从死亡与治疗救出miloride和丹曲林,那备件MEC-4(d)碰着神经元的变性体内 20,35。总括而言,不仅C.线虫胚胎干细胞形态相似的细胞在体内 ,但它们也表达细胞特异性标志物和存在于相同的比例,他们是存在于生物体内 。总而言之,这些数据支持下培养线虫的细胞构成的整体系统良好无论是在细胞和分子水平研究生物过程。
C.培养的膜片钳电生理分析线虫细胞
膜片钳技术,这是由索克曼和内尔在七十年代从细胞中分离或组织中的离子通道活性的研究引入了可应用于培养C。线虫细胞36。克里斯滕森和同事们首先研究离子通道的影响C。利用线虫细胞膜片钳1。从那时起,K +,阴离子,阳离子和非选择性信道( 图2 CE),以及多巴胺转运蛋白依赖性通道已在培养的C中所述线虫 1,18,19,37。这些研究先进的离子电导在C的函数的作用我们的理解线虫的神经元。有迹象表明,需要考虑采用膜片钳技术,从培养C.记录离子通道活性的时候进行一些修改线虫的细胞。这些修改大多是有关全细胞记录。首先,C。线虫细胞是小的,例如,神经细胞的直径为1-2微米。因此,玻璃吸管需要有一个小技巧(0.5微米)。小移液器吸头增加输入电阻,造成刺激和记录错误。为了缓解这个问题,移液管可以构造有一个小技巧,但广泛的圆锥体。 Goodman和Lockery开发出一种方法EMPloying火抛光机配备有高压空气泵,用于成型移液器这种形状38。第二,由于该单元的尺寸小,获得利用吸力整个小区接入通常会导致损坏的细胞。高得多的成功通常是通过施加高电压脉冲(电跳越),以膜的贴剂的吸管尖下实现的。膜片钳技术的其他配置(连接细胞,由内向外和由外向内出)是直接适用于C。线虫培养的细胞,条件是所述吸液管的尖端应该很小考虑到C的小尺寸的唯一修改线虫的细胞。穿孔修补术是出了名的比其他膜片钳技术更费时费力。然而,它已成功地应用于C。线虫细胞原位 39,40,因此应适用于文化。
钙成像技术应用到C。线虫培养细胞
电压门控钙通道 (VGCC)在神经元和神经胶质细胞的功能作用于培养的C.被查处线虫细胞钙成像20,21,41。在文化钙成像的应用,允许使用含有高浓度的KCl诱导细胞去极化的解决方案和钙通道阻滞剂辨别不同类型的信道,以钙离子内流的贡献。例如Na + / Ca 2 +的可渗透MEC-4(D)信道,以细胞内钙浓度的贡献通过使用卡默莱昂YC2.12中的DEG / ENaC的通道阻滞剂氨氯吡咪的存在和不存在钙成像测定。这些实验表明,一个阿米洛利敏感的钙内流中存在表示MEC-图4(d),但在野生型触摸触摸神经元的神经元。用离子载体通透的膜触神经元和校准卡默莱昂( 图3A和B),比安奇和同事也确定在触摸神经元的平均游离钙离子浓度是200nM的20( 图3C和D)。同样,Frokjaer-Jensen和同事研究了在C调节去极化引起的钙离子内流VGCCs EGL-19和UNC-36的作用线虫培养mechanosensory神经元表达卡默莱昂21。他们发现,在20mM和100mM之间的范围内由细胞外K +诱导的触摸神经元的去极化,导致升高胞内钙的通过之间的17%和70%的比率YFP / CFP变化揭示。此外,钙瞬变分别减少了EGL-19和UNC-36丢失功能的突变和在没有细胞外Ca 2未检出+表明VGCCs C中的兴奋性中发挥关键作用线虫神经元接触21。
粗壮和Parpura研究了电压门控钙离子通道 EGL-19,CCA-1和UNC-2在促进钙离子内流41头侧感器CEPsh鞘神经胶质细胞的作用。细胞内钙动力学是在CEPsh胶质细胞培养从转基因动物共表达红色荧光标记的mCherry和绿色荧光体胞质的Ca 2 +指示剂GcaMP2.0分析。在大多数CEPsh胶质细胞,膜去极化诱导的高胞外浓度的细胞内Ca的KCl诱导增加2 +所报告的上升GcaMP2.0荧光。此外,与钙离子通道阻断剂Cd 2 +和NEMA(nemadipine-A)治疗显著降低了钙瞬变。这些数据支持电压依赖性升高细胞内钙离子在CEPsh胶质细胞依赖于至少部分地基于电压 - 门控钙通道。作者进一步分析了L型EGL-1细胞内钙的变化9RF(还原功能),T型CCA-1和N,P / Q,R型通道UNC-2基因敲除动物,并认为所有这三种类型的Ca 2 +通道的显著细胞内钙动力学在这些神经胶质细胞有助于。因此,由于不成熟的哺乳动物胶质细胞通过胞内Ca 2 +浓度VGCC依赖性变化去极化反应,作者的结论是C。线虫 CEPsh胶质细胞在功能上类似于哺乳动物胶质细胞,星形胶质细胞,少突胶质细胞和少突胶质细胞前体细胞。
适用于培养C.其他技术线虫胚胎干细胞
荧光激活细胞分选术(FACS)已被成功地应用到C。线虫的培养细胞,以丰富的文化与特定的细胞类型和/或分离的细胞用于微阵列分析23,4243。需要被引入的主要修改如果细胞培养方法是使用基片的类型。奇怪和同事测试不同的基材,包括IV型胶原蛋白,聚-L-赖氨酸,纤连蛋白和层粘连蛋白和确定,聚-L-赖氨酸是最好的衬底37。聚-L-赖氨酸促进细胞分化良好,就像花生凝集素,但相反的花生植物血凝素使细胞剥离从基材无损坏36。几种不同类型的C的线虫细胞已排序流式细胞仪,包括thermosensory,嗅觉,运动和mechanosensory神经元和神经胶质23,42 - 45。细胞标记已经完成了GFP记者的表达和整体,分拣效率是高的以高达90%的GFP标记的细胞23的隔离。
通过RNA干扰(RNAi)的基因沉默可以在培养来实现也是如此。克里斯滕森和同事表明,表达GFP的培养孵化线虫的神经细胞与针对GFP的dsRNA导致GFP的表达与另外的双链RNA在培养1 4天之后的最大效果显著降低的水平。同样,施和他的同事用RNAi技术在文化,以证明C。线虫 SID-1是必要的介导dsRNA的效果,这是有可能根据需要在体内介导RNAi 46的全身性扩散。总之,RNA干扰,这是最常用的和有效的方法,用于基因沉默在C 1 线虫可以在培养中应用。可用于沉默基因的敲除是致死或干扰C.这种方法线虫发育正常。

图1。C.线虫胚胎前,几丁质酶处理后。 (一)在暴露于卡照片鸡蛋tinase。箭头指向用壳多糖酶处理10分钟的透明和完整的蛋壳周围的胚胎(B)蛋。 蛋壳已被消化,并不再围绕胚胎可见。箭头指向从蛋壳释放三倍胚胎。蓝色方框包围一组细胞仍附加到对方。
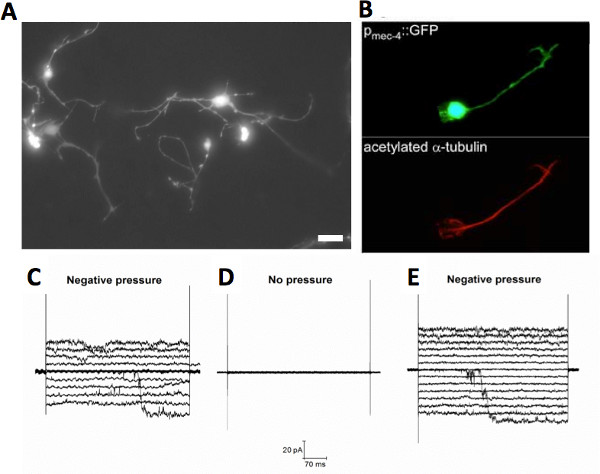
图2。 C.培养线虫神经元接触。 C.培养(一)荧光显微镜线虫触摸神经元表达GFP下的触摸特异性启动子MEC-4(P MEC-4 :: GFP),比例尺为5μm(B)的触摸神经元的荧光显微照片表示P MEC-4 :: GFP(上图),这是用针对乙酰化α-微管蛋白(Sigma公司)的单克隆抗体,posttranslationa发生联系的神经元只有33个字母微管蛋白的L修改。记录在膜片钳技术的细胞贴附配置野生型培养的神经元接触机械敏感性离子通道的20改编。(CE)的例子。该信道具有的〜100ps的电导,它是存在于神经元的触摸从MEC-4敲除动物(MEC-4(U253)),以及隔离。这些数据表明该通道不是MEC通道20。 点击这里查看大图 。

图3。细胞内游离钙离子浓度的使用卡默莱昂培养的神经元接触估计。培养神经元接触(一)表达卡默莱昂YC2.12在0毫米的Ca 2 +(伪彩色图像+ EGTA,左)和在10mM的Ca 2 +(右)。该伪刻度显示在右边(B)在一个透化触摸改变神经元细胞内钙离子浓度有关代表卡默莱昂荧光的变化。在记录之前,将细胞培养在含有钙离子载体BR-A23187(10μM)和一个定义的游离钙(250 nM的在这种情况下)的浓度的溶液30分钟。鱼藤酮(10毫摩尔)和2 - 脱氧-D-葡萄糖(1.8毫米)也被加入到溶液中,以阻断活性的泵。的神经元,然后灌注含0毫米(5 mM的EGTA)的Ca 2 +和10mM的Ca 2 +来确定最小和最大荧光比值变化的溶液(C)嘉美露校准曲线示出了从4-7中获得的结果细胞的荧光变化的11个不同的游离钙离子的溶液进行评估。每个比率变化归一化到最大比变化为单个细胞(D) 游离钙在培养神经元浓度的估计。培养的触摸神经元在一个标准的细胞外盐水成像3分钟。最小和最大卡默莱昂比例的变化,因为面板(B)中,然后建立。在培养的神经元接触的静止卡默莱昂比率为22%±7(n = 2时,18个细胞)的最大比率的变化。基于在(C)中所示的校正曲线上这比对应于〜200纳米的游离钙离子浓度。从20调整。 点击这里查看大图 。
讨论
线虫是一种功能强大的模式生物破译参与发展,行为和衰老的遗传途径。其方便茎主要从难易程度可以遗传操作,并从它的循环寿命短。尽管它的便利性,C.线虫有其局限性。C.线虫细胞是微小的,在加压的角质层,限制了需要直接访问的细胞,例如电生理和药理学技术,或特定类型的细胞的分离,如通过微阵列分析的基因表达图谱方法的应用局限。该三线虫的细胞培养方法已经解决了许多这样的模式生物的局限性。
在这个手稿中,我们描述了一个更新的方法分离和培养胚胎C。线虫细胞在大规模的基础上早期工作由克里斯滕森和同事1。我们阿尔斯Ø报告采用多种技术,包括免疫细胞化学,电生理和钙成像已经推进了我们在C的生理过程和遗传的要求基本细胞功能的认识得到代表公布结果线虫 。工作对培养C.迄今所做线虫细胞的支持,他们在体外分化为他们做扼要体内细胞特异性标志物1,18-20,22,23,27,44的表达。虽然不是所有的细胞类型中已经表征中培养,这个机构的工作表明,细胞培养方法允许C的研究线虫细胞中分离而不影响他们的身份。
该协议是简单,易于适用于任何实验室。事情需要牢记成功地培养C.线虫胚胎细胞有以下几种:1)动物必须同步,使他们中的绝大多数西港岛线升在细胞培养过程的时间妊娠成年人。从饿死板启动蠕虫文化是一个不错的选择。 2)细菌用来种植C.线虫需要事先对蠕虫的裂解被消除,以避免细胞培养物的污染。建议大量的无菌水被用于洗涤和动物在所建议的离心分离(未在更高)的速度,以避免细菌的沉淀为好。事实上,在与含漂白剂的裂解液治疗应消除细菌,从一个相对无菌的动物悬挂起建议。 3)动物应该用漂白剂/氢氧化钠进行处理,直到〜80%的人已经发布了他们的鸡蛋。较短和较长的孵育时间减少鸡蛋回收效率分别破坏鸡蛋。 4)蛋壳消化几丁质酶应密切监测。时〜80%,蛋壳都被消化的手动分解应该开始。更长和更短incubat离子倍都产生细胞损伤,由于质膜通过在分离的单元,分别尝试引起的长时间和更严厉的手动分解酶和损伤的直接损伤。 5)通过5微米过滤器过滤单元不应强迫。如果过滤器被堵塞时,应当用新的改变,以避免电池的损坏。
尽管培养的胚胎干细胞已在许多方面彻底改变了现场,他们不是为每一个科学问题的答案,还是有局限性。例如,表达在培养的基因大多是因为胚胎细胞是从胚胎中分离出。亚细胞器可能无法在正确的文化发展。例如,某些化学传感器的感觉神经元,如AWA和AWC的纤毛的发展和维持依赖于相互作用与化学传感器的神经胶质细胞,其是失去了在培养44。细胞失去其自然的邻居,不要让生理REL埃文特的细胞 - 细胞接触。例如,它不知道电池是否形成紧密连接,电或化学突触并且如果他们这样做,这是不太可能与他们的生理伙伴。此外,将细胞接种在单一基板上,花生凝集素。细胞外基质在体内可能是许多分子,包括花生凝集素,层粘连蛋白,胶原蛋白,纤连蛋白和一个复杂和难以复制混合物。此外,专门的细胞外基质,也许需要对某些类型的细胞的功能。例如,机械敏感性通道在身体接触的神经元表达和MEC-4形成和MEC-10亚单位不能在培养18被选通,但可在体内 47可以容易地进行门控。这最有可能源于一个事实,即胞外胶原MEC-5通常是由体内邻近接缝细胞产生的,是不存在于培养48。 MEC-5,以及细胞外基质蛋白MEC-1(一个1999氨基酸长需要对触摸感觉蛋白具有Kunitz型结构域和两个EGF结构域)和MEC-9(一个834氨基酸长的蛋白质,它包含几个Kunitz型结构域,EGF重复序列和一个富含谷氨酸结构域),并且被认为绑定到蒙古能源通道复合体的胞外结构域,并在施加机械刺激浇注紧张局势复杂。
最后,C。线虫胚胎干细胞可以在体外培养和它们出现分化扼要的细胞特异性基因的表达。该协议隔离的细胞,文化是简单,可与细胞培养技术经验最少的任何实验室应用。牢记这种技术的局限性,该细胞培养方法可以与已经被证明是一个功能强大的技术,当细胞直接访问和/或所需的特定细胞类型的隔离。一种协议,用于从幼虫中分离细胞已经被最近还开发(正OT这里描述)49。在开发互补的方法广泛关注,正在下线虫一个更强大的系统,最终理解基因功能和行为,发展或老化之间的联系。
材料
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Bacto Peptone | VWR International Inc. | 90000-382 | |
| Difco Agar Granulated | VWR International Inc. | 90000-784 | |
| Bacto Tryptone | VWR International Inc. | 90000-284 | |
| Bacto Yeast Extract | VWR International Inc. | 90000-724 | |
| Leibovitz's L-15 Medium (1x) Liquid | Invitrogen | 11415-064 | |
| Fetal Bovine Serum | Invitrogen | 16140-063 | |
| Penicillin-streptomycin | Sigma | P4333-100ML | |
| Chitinase from Streptomyces Griseus | Sigma | C6137-25UN | |
| NA22 Escherichia coli | Caenorhabditis Genetics Center | ||
| Peanut Lectin | Sigma | L0881-10MG | |
| Sucrose | Sigma | 57903-1KG | |
| D-(+)Glucose | Sigma | 67528-1KG | |
| Ethylene glycol-bis (2-amin–thylether), N,N,N',N'- tetraacidic acid (EGTA) | Sigma | E0396-25G | |
| Hepes | Sigma | H3375-500G | |
| Cholesterol | |||
| NaCl | Sigma | 57653-1KG | |
| KCl | Sigma | P9333-500G | |
| CaCl2 | Sigma | C1016-500G | |
| MgCl2 | Sigma | M8266-100G | |
| MgSO4 | Sigma | M2643-500 g | |
| K2HPO4 | Sigma | P2222-500G | |
| KH2PO4 | Sigma | P9791-500G | |
| NaOH | Sigma | S8045-500G | |
| KOH | Sigma | P1767-500G | |
| Ethanol | |||
| Autoclaved distilled H2O | |||
| Bleach | |||
| EQUIPMENT | |||
| 101-1000 μl Blue Graduated Pipet Tips | USA Scentific | 1111-2821 | |
| 10 ml Sterilized Pipet Individually Wrapped | USA Scentific | 1071-0810 | |
| Ergonomic Variable Volume (100-1000 μl) Pipettor with tip ejector | VWR International Inc. | 89079-974 | |
| Portable Pipet Aid, Drummond | VWR International Inc. | 53498-103 | |
| Transfer Plastic Pipet Sterile | VWR International Inc. | 14670-114 | |
| 15 ml Conical Tube | USA Scentific | 1475-1611 | |
| 50 ml Conical Tube | USA Scentific | 1500-1811 | |
| Sterile 18 gauge Needles | Becton, Dickinson and Co. | 305196 | |
| Sterile 10 ml Syringes | Becton, Dickinson and Co. | 305482 | |
| Plastic Syringe Filters Corning 0,20 μm pore size | Corning | 431224 | |
| Acrodic 25 mm Syringe filter w/5 μm versapor Membrane | VWR International Inc. | 28144-095 | |
| 60x15 mm Petri Dish Sterile | VWR International Inc. | 82050-548 | |
| 100x15 mm Petri Dish Sterile | VWR International Inc. | 82050-912 | |
| 12 mm Diameter Glass Coverslips | VWR International Inc. | 48300-560 | |
| Clear Cell Culture Plates 24 Well Flat Bottom w/lid | Thomas scientific | 6902A09 | |
| Dumont #5- Fine Forceps | Fine Science Tools | 11254-20 | |
| Centrifuge 5702 | Eppendorf | 022629883 | |
| Laminar Flow Hood | |||
| Inverted Microscope with x10 objective | |||
| Ambient air humidified Incubator | |||
参考文献
- Christensen, M., et al. A primary culture system for functional analysis of C. elegans neurons and muscle cells. Neuron. 33, 503-514 (2002).
- Riddle, D. L., Blumenthal, T., Meyer, B. J., Priess, J. R., Riddle, D. L., Blumenthal, T., Meyer, B. J., Priess, J. R. . C. elegans II. , (1997).
- Stinchcomb, D. T., Shaw, J. E., Carr, S. H., Hirsh, D. Extrachromosomal DNA transformation of Caenorhabditis elegans. Molecular and cellular biology. 5, 3484-3496 (1985).
- Mello, C. C., Kramer, J. M., Stinchcomb, D., Ambros, V. Efficient gene transfer in C. elegans: extrachromosomal maintenance and integration of transforming sequences. The EMBO journal. 10, 3959-3970 (1991).
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Sulston, J. E., White, J. G. Regulation and cell autonomy during postembryonic development of Caenorhabditis elegans. Developmental biology. 78, 577-597 (1980).
- Chalfie, M. Caenorhabditis elegans development. Current opinion in cell biology. 1, 1122-1126 (1989).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical transactions of the Royal Society of London. Series B, Biological sciences. 314, 1-340 (1986).
- Goodman, M. B., Hall, D. H., Avery, L., Lockery, S. R. Active currents regulate sensitivity and dynamic range in C. elegans neurons. Neuron. 20, 763-772 (1998).
- Richmond, J. E., Jorgensen, E. M. One GABA and two acetylcholine receptors function at the C. elegans neuromuscular junction. Nature. 2, 791-797 (1038).
- Miyawaki, A., Griesbeck, O., Heim, R., Tsien, R. Y. Dynamic and quantitative Ca2+ measurements using improved cameleons. Proceedings of the National Academy of Sciences of the United States of America. 96, 2135-2140 (1999).
- Kerr, R., et al. Optical imaging of calcium transients in neurons and pharyngeal muscle of C. elegans. Neuron. 26, 583-594 (2000).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature. 19, 137-141 (2001).
- Bloom, L. . Genetic and molecular analysis of genes required for axon outgrowth in Caenorhabditis elegans. , (1993).
- Edgar, L. G. Blastomere culture and analysis. Methods in cell biology. 48, 303-321 (1995).
- Leung, B., Hermann, G. J., Priess, J. R. Organogenesis of the Caenorhabditis elegans intestine. Developmental biology. 216, 114-134 (1999).
- Buechner, M., Hall, D. H., Bhatt, H., Hedgecock, E. M. Cystic canal mutants in Caenorhabditis elegans are defective in the apical membrane domain of the renal (excretory) cell. Developmental biology. 214, 227-241 (1999).
- Suzuki, H., et al. In vivo imaging of C. elegans mechanosensory neurons demonstrates a specific role for the MEC-4 channel in the process of gentle touch sensation. Neuron. 39, 1005-1017 (2003).
- Carvelli, L., McDonald, P. W., Blakely, R. D., Defelice, L. J. Dopamine transporters depolarize neurons by a channel mechanism. Proceedings of the National Academy of Sciences of the United States of America. 101, 16046-16051 (2004).
- Bianchi, L., et al. The neurotoxic MEC-4(d) DEG/ENaC sodium channel conducts calcium: implications for necrosis initiation. Nature. 7, 1337-1344 (2004).
- Frokjaer-Jensen, C., et al. Effects of voltage-gated calcium channel subunit genes on calcium influx in cultured C. elegans mechanosensory neurons. Journal of neurobiology. 66, 1125-1139 (2006).
- Von Stetina, S. E., et al. Cell-specific microarray profiling experiments reveal a comprehensive picture of gene expression in the C. elegans nervous system. Genome biology. 8, R135 (2007).
- Fox, R. M., et al. A gene expression fingerprint of C. elegans embryonic motor neurons. BMC genomics. 6, 42 (2005).
- Burnham-Marusich, A. R., et al. Metabolic Labeling of Caenorhabditis elegans Primary Embryonic Cells with Azido-Sugars as a Tool for Glycoprotein Discovery. PloS one. 7, e49020 (2012).
- Kim, K. J., Yang, Y. J., Kim, J. G. Purification and characterization of chitinase from Streptomyces sp. M-20. Journal of biochemistry and molecular biology. 36, 185-189 (2003).
- Chalfie, M., Wolinsky, E. The identification and suppression of inherited neurodegeneration in Caenorhabditis elegans. Nature. 345, 410-416 (1990).
- Parpura, V. Voltage-gated calcium channel types in cultured C. elegans CEPsh glial cells. Cell calcium. 50, 98-108 (2011).
- Miller, D. M., Niemeyer, C. J. Expression of the unc-4 homeoprotein in Caenorhabditis elegans motor neurons specifies presynaptic input. Development. 121, 2877-2886 (1995).
- Lickteig, K. M., et al. Regulation of neurotransmitter vesicles by the homeodomain protein UNC-4 and its transcriptional corepressor UNC-37/groucho in Caenorhabditis elegans cholinergic motor neurons. The Journal of neuroscience : the official journal of the Society for Neuroscience. 21, 2001-2014 (2001).
- Zhang, H., et al. UNC119 is required for G protein trafficking in sensory neurons. Nature. 14 (7), (2011).
- Maduro, M., Pilgrim, D. Identification and cloning of unc-119, a gene expressed in the Caenorhabditis elegans nervous system. Genetics. 141, 977-988 (1995).
- Chalfie, M., Sulston, J. Developmental genetics of the mechanosensory neurons of Caenorhabditis elegans. Developmental biology. 82, 358-370 (1981).
- Fukushige, T., et al. MEC-12, an alpha-tubulin required for touch sensitivity in C. elegans. Journal of cell science. 112 (Pt. 3), 395-403 (1999).
- Driscoll, M., Chalfie, M. The mec-4 gene is a member of a family of Caenorhabditis elegans genes that can mutate to induce neuronal degeneration. Nature. 349, 588-593 (1991).
- Xu, K., Tavernarakis, N., Driscoll, M. Necrotic cell death in C. elegans requires the function of calreticulin and regulators of Ca(2+) release from the endoplasmic reticulum. Neuron. 31, 957-971 (2001).
- Sakmann, B., Neher, E. Patch clamp techniques for studying ionic channels in excitable membranes. Annual review of physiology. 46, 455-472 (1984).
- Strange, K., Christensen, M., Morrison, R. Primary culture of Caenorhabditis elegans developing embryo cells for electrophysiological, cell biological and molecular studies. Nature protocols. 2, 1003-1012 (2007).
- Goodman, M. B., Lockery, S. R. Pressure polishing: a method for re-shaping patch pipettes during fire polishing. Journal of neuroscience. 100, 13-15 (2000).
- Nickell, W. T., Pun, R. Y., Bargmann, C. I., Kleene, S. J. Single ionic channels of two Caenorhabditis elegans chemosensory neurons in native membrane. The Journal of membrane biology. 189, 55-66 (2002).
- Ward, A., Liu, J., Feng, Z., Xu, X. Z. Light-sensitive neurons and channels mediate phototaxis in C. elegans. Nature neuroscience. 11, 916-922 (2008).
- Parpura, V. Cell culturing of Caenorhabditis elegans glial cells for the assessment of cytosolic Ca(2)(+) dynamics. Methods Mol. Biol. 814 (2), 153-174 (2012).
- Zhang, Y., et al. Identification of genes expressed in C. elegans touch receptor neurons. Nature. 418, 331-335 (2002).
- Cinar, H., Keles, S., Jin, Y. Expression profiling of GABAergic motor neurons in Caenorhabditis elegans. Current biology : CB. 15, 340-346 (2005).
- Bacaj, T., Tevlin, M., Lu, Y., Shaham, S. Glia are essential for sensory organ function in C. elegans. Science. 322, 744-747 (2008).
- Colosimo, M. E., et al. Identification of thermosensory and olfactory neuron-specific genes via expression profiling of single neuron types. Current biology : CB. 14, 2245-2251 (1016).
- Shih, J. D., Fitzgerald, M. C., Sutherlin, M., Hunter, C. P. The SID-1 double-stranded RNA transporter is not selective for dsRNA length. RNA. 15, 384-390 (2009).
- O'Hagan, R., Chalfie, M., Goodman, M. B. The MEC-4 DEG/ENaC channel of Caenorhabditis elegans touch receptor neurons transduces mechanical signals. Nature. 8, 43-50 (2005).
- Du, H., Gu, G., William, C. M., Chalfie, M. Extracellular proteins needed for C. elegans mechanosensation. Neuron. 16, 183-194 (1996).
- Zhang, S., Banerjee, D., Kuhn, J. R. Isolation and culture of larval cells from C. elegans. PloS one. 6, e19505 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。