Method Article
GST-Sua purificação: A Two-step Affinity Purification Protocolo Cedendo Full-length proteínas purificadas
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
No presente protocolo, demonstramos um método altamente eficiente e de baixo custo purificação de proteínas em pequena escala, que permite a purificação de proteínas recombinantes, combinando de forma única um GST-tag quebrável e uma pequena His-tag.
Resumo
Ensaios de chave em enzimologia para a caracterização bioquímica de proteínas in vitro, necessitam de elevadas concentrações de proteína purificada de interesse. Protocolos de purificação de proteína deve combinar eficiência, simplicidade e eficácia de custo 1. Aqui, nós descrevemos a GST-His método como um novo sistema de purificação por afinidade em pequena escala para as proteínas recombinantes, com base em um N-terminal de etiqueta de glutationa-Sepharose (GST) de 2,3 e uma marcação 10xHis C-terminal de 4, que são ambos fundida para a proteína de interesse. A última construção é usado para gerar baculovírus, para a infecção de células Sf9 infectadas para a expressão da proteína 5. GST é uma marca bastante longo (29 kDa), que serve para garantir a eficiência da purificação. No entanto, pode influenciar as propriedades fisiológicas da proteína. Por isso, é subsequentemente clivado da proteína usando a enzima PreScission 6. A fim de assegurar a máxima pureza e para remover a GST clivada, nósadicionou-se uma segunda etapa de purificação por afinidade com base na comparativamente pequena de His. Mais importante, a nossa técnica é baseada em duas etiquetas diferentes flanqueiam as duas extremidades da proteína, que é uma ferramenta eficaz para remover as proteínas degradadas e, portanto, enriquece proteínas de comprimento total. O método aqui apresentado não requer uma configuração instrumental caros, tais como FPLC. Além disso, incorporamos MgCl2 e lavagens de ATP para remover impurezas da proteína de choque térmico e tratamento nuclease abolir contaminando ácidos nucléicos. Em resumo, a combinação de duas marcas diferentes flanqueiam o N-e C-terminal e a capacidade para clivar um dos marcadores, garante a recuperação de uma proteína altamente purificada e de comprimento completo de interesse.
Introdução
A purificação de proteínas recombinantes é crucial para tratar de questões fundamentais em bioquímica. As formas convencionais de purificação de proteínas, como a cromatografia de permuta iónica e cromatografia de exclusão de tamanho dependem de propriedades físicas da proteína-alvo, tais como o seu ponto isoeléctrico e carga ou tamanho, respectivamente. As características da proteína últimos são partilhados por uma variedade de proteínas, o que aumenta consideravelmente a probabilidade de as proteínas contaminantes, em estratégias de purificação de proteínas convencionais. Este problema pode ser contornado com o uso de várias colunas de purificação, o que é demorado. Ao mesmo tempo, os últimos métodos de cromatografia de exigir configuração experimental caro. A purificação por afinidade-tag aumenta fortemente a especificidade do alvo, tal como na maioria dos casos, a marcação será único para a proteína de interesse. Em estudos recentes, com Flag ou HA-purificação de afinidade tem sido amplamente usado.
Em contraste com rec existenteprotocolos de purificação de proteínas ombinant em que tags simples são utilizados, foi estabelecida a combinação única de duas tags. O nosso método envolve a fusão de uma etiqueta de GST na extremidade N-terminal e uma cauda de His no terminal C da proteína de interesse, para uma óptima relação entre a quantidade e pureza da proteína desejada. A GST é uma marca longa (29 kDa), que é altamente eficiente para a purificação sobre Sepharose de glutationa. Além disso, utilizando GST garante boa relação custo-eficácia de nosso método 1. A possibilidade de se clivar a GST com o enzima PreScission (com a sequência de reconhecimento LeuGluValLeuPheGln / GlyPro, resultando na adição de apenas dois aminoácidos) tem muitas vantagens, por exemplo, esta estratégia evita a alteração das funções fisiológicas de proteínas devido a impedimento alostérico. O pequeno His-tag fundido com o outro extremo da proteína serve num segundo passo de purificação para aumentar a pureza da proteína por lavando a GST clivada, bem como proteínas degradadas e outros contaminantes. Além disso, o protocolo não requer um passo de diálise quando se muda de GST para a coluna passo His-purificação (resina TALON). Contaminantes comuns em tais processos de purificação são proteínas de choque térmico (HSP). A adição de um passo de incubação com MgCl2 e ATP permite a remoção desses contaminantes (Figura 1).
Fast Protein Liquid Chromatography (FPLC) e cromatografia líquida de alta performance (HPLC) são técnicas comuns que dependem instrumentação dispendiosa para gerar um rendimento elevado de proteína purificada de interesse. O protocolo de purificação de lote apresentamos aqui, em contraste, é manual e não necessita de uma instalação instrumental caro. Um rendimento elevado de proteína pode ser alcançado com a expansão do protocolo. Ao mesmo tempo, com o protocolo de purificação do lote, o volume de eluição pode ser ajustada, a fim de aumentar a concentração de proteína, o que não é dada com FPLC ou HPLC.
ntent "> Além disso, com a GST-His protocolo de purificação do lote, proteínas com uma gama de dimensões de ~ 10-300 kDa pode ser purificada. Uma das maiores vantagens é dada pelo facto de que se pode purificar várias proteínas ao mesmo tempo , por exemplo, tanto um de tipo selvagem e a sua proteína mutante. O sucesso do protocolo apresentado apenas depende do nível de expressão e a solubilidade da proteína de interesse.Protocolo
1. Produção de recombinante de baculovírus
Os baculovírus são gerados utilizando o Sistema de Expressão de Baculovirus Bac-to-Bac de Invitrogen, principalmente de acordo com o protocolo do fabricante, com apenas ligeiras modificações:
- Um vetor pFastBac1 modificado (Gibco, a vida) foi criado contendo o GST e Seus-tags (Figura 2). O local de clonagem múltipla (MCS) de pET-52b (+) vector (Novagen), que contém uma etiqueta 10xHis, foi inserido no mcs de um vector pFastBac1 para gerar pFastBac1-Strep-10xHis. A sequência de MCS pET-52b (+) foi amplificado por PCR entre os locais de restrição Xbal e BlpI, a adição de um local de restrição de BglII no terminal 5 'da extremidade e um local de restrição Hind III na extremidade 3'. O produto de PCR foi então clonado entre BamHI e HindIII sítio de restrição de pFastBac1, usando a compatibilidade de sequências de restrição de BamHI e BglII. Uma vez que o objetivo era gerar um pFastBac1 permitindo a expressão deproteína recombinante com estreptavidina-e 10xHis-tags, o sítio de restrição BamHI de pET-52b (+) sequência de MCS não foi utilizado. Além disso, o sítio de restrição XbaI não foi usado para evitar a redundância de sítios de restrição que ocorrem entre os sites que já estão no MCS de pFastBac1 e estes inserido com o MCS de pET-52b (+). A sequência de codificação de GST com o local de reconhecimento PreScission Protease (LeuGluValLeuPheGln / GlyPro) foi então inserido no pFastBac1-Strep-10xHis. A sequência de cDNA a partir de GST pGEX-6P-2 (GE Healthcare) foi amplificado por PCR com iniciadores que contêm sítios de restrição Ncol e Kpnl na extremidade 5 'e 3' das extremidades, respectivamente. O local Ncol permite a adição de um codão de iniciação, mas também uma alanina para o GST. O produto de PCR foi então clonado no pFastBac1-Strep-10xHis entre os sítios de restrição Ncol e Kpnl, resultando na deleção da etiqueta de estreptavidina. O novo vetor de fusão assim obtido foi denominado pFastBac1-GST-10xHis.
- Clonar o cDNA codificante para a protein de interesse no vector pFastBac-GST-10xHis entre a GST (N-terminal) e a cauda de His (C-terminal). Ter cuidado para remover o codão de terminação para permitir que o cDNA de fusão com o His-tag no terminal C.
- Transforme E. coli DH10Bac com o pFastBac recombinante (obtida no passo 1.2) para gerar o bacmid. Permitir que as colónias crescer durante a noite a 37 ° C e várias horas a 30 ° C em placas de selecção contendo Bluo-gal e IPTG (10 mg / ml de tetraciclina, 50 ug / ml de canamicina, 7 ug / ml de gentamicina, 100 ug / ml de Bluo- Gal, 40 ug / ml de IPTG).
- Escolha e restreak duas colônias brancas (a partir do passo 1.3) em placas de seleção para confirmar o fenótipo branco.
- Inocular 2 ml de LB contendo 10 ug / ml de tetraciclina, 50 ug / ml de canamicina, 10 mg / ml de gentamicina, com as duas colónias brancas a partir do passo 1.4 e deixá-los crescer durante a noite, sob agitação (250 rpm) a 37 ° C.
- A fim de purificar o ADN de bacmid, sedimentar as bactérias do passo 1.5,ressuspender as células em 300 uL de solução I e adicionar 300 mL de solução II (kit Maxiprep da Qiagen). Incubar durante 5 min à temperatura ambiente, adicionar 300 mL de 3 M KOAc, pH 5,5 e incubação durante 10 min em gelo. Centrifugar as amostras a 4 ° C, a velocidade máxima durante 10 min. Adicionar 800 mL de isopropanol para os sobrenadantes e incubar por 10 min em gelo. Centrifugar as amostras durante 15 min a 4 ° C e lava-se o sedimento com 500 ul de etanol a 70%. Deixar o sedimento secar e ressuspender o sob condições estéreis, em 40 ul de Tris-EDTA a pH 8,0. O ADN de bacmid deve ser armazenada a 4 ° C.
- Gerar baculovírus, conforme descrito no protocolo do fabricante. Os baculovírus pode ser armazenado a 4 ° C protegidos da luz.
2. Recombinant Protein Expression
- De modo a escolher o baculovírus mais eficiente para a purificação e para controlar o tempo do pico da expressão da proteína é alcançada, execute um mini-ensaio de uma infecçãos seguintes: Infect 2 x 10 7 de Sf9 infectadas células cultivadas a 27 ° C em meio de Grace (complementado com SBF a 10% e 1% P / S) com 133 ul (1/150) de baculovírus. Recolhe alíquotas de 1,5 ml a 0, 24, 48, e 72 horas pós-infecção. Sedimentar as células e analisar o nível da proteína de interesse por western blotting utilizando anticorpos anti-tag de expressão.
- Use o baculovírus mais eficiente a partir do passo 2.1 para infectar um spinner contendo 1,0 x 10 6 células Sf9 por ml em 500 ml de mídia com uma proporção de 1/150 entre o vírus e meios de comunicação. Permitir que as células infectadas crescer em suspensão a 27 ° C e colheita das células, quando a expressão máxima de proteína (como determinado no passo 2.1 acima) é alcançado. As células sedimentadas podem ser armazenadas a -80 ° C até posterior utilização.
3. Preparação de Lisado celular solúvel
Todos os seguintes passos de incubação são realizados a 4 ° C sob rotação suave.
- Lyse SAs células que expressam f9 sua proteína de interesse, em ~ 20 ml de tampão de ligação de GST (NaCl 150 mM, EDTA 1 mM, 0,05% de Triton-X-100, DTT 1 mM em PBS1X para uma concentração final de NaCl de 250 mM, e inibidores da protease cocktail (Roche). Num banho de água gelada, a solução 20x Dounce com um homogeneizador de Dounce, sonicado 3x 30 segundos cada (produção de 70%), e novamente Dounce 20x.
- (Opcional). Incubar o ligado total de células com 1 mM de MgCl 2 e 7 nuclease Benzonase (2,5 U / ml) durante 30 min a 4 ° C para remover o ADN de contaminação ou de ARN.
- Centrifugar a 18.000 rpm durante 30 min a 4 ° C. Manter o sobrenadante.
- (Opcional). Centrífuga-se o sobrenadante de novo durante 30 min a 18.000 rpm a 4 ° C para obter um lisado solúvel claro. Passar o sobrenadante através de um filtro de 0,2 ou 0,45 mM para evitar o entupimento.
4. Ligação da proteína em GST Beads
- Incubar o ligado celular solúvel com 1 ml de pérolas de GST (pré-lavado duas vezes com10 ml de tampão GST) de ligação, durante 1 hora a 4 ° C, sob suave rotação.
Comentário: O tempo de incubação deve ser optimizado de acordo com a estabilidade da proteína e eficiência de ligação.
- Rotação rápida a 700 rpm e remover o sobrenadante contendo as proteínas não ligadas (o que pode ser mantido para uma análise mais aprofundada). Lavar as proteínas ligadas a GST (Figura 3B, pista 1) com tampão de lavagem de GST (GST com tampão de ligação NaCl 350 mM final).
- Repita o passo 4.2 2x. Na última lavagem, remover tanto sobrenadante quanto possível.
- Incubar os grânulos com 5 mM de ATP e 15 mM de MgCl 2 (em 10 ml de tampão de ligação a GST) durante 1 hora a 4 ° C para evitar ligação não específica de proteínas de choque de calor 8. Lavar as pérolas três vezes com tampão de lavagem de GST.
5. PreScission clivagem do GST
- Centrifugar as esferas de GST, remover o sobrenadante e lavar as contas de GST com P5 buffer (50 NaHPO 4 mM pH 7,0, NaCl 500 mM, 10% de glicerol, 0,05% de Triton-X-100, 5 mM de imidazole).
- Incubar as GST-esferas com enzimas PreScission, em tampão P5 a partir de 3 horas a durante a noite a 4 ° C. (Dividir as esferas de GST em fracções de 100 mL e adicionar 4-8 unidades (2-4 ul) de enzima diluído em 100 ul de tampão de P5).
Comentário: O tempo de incubação do passo PreScission precisa ser optimizada de acordo com o peso molecular, assim como a estabilidade da proteína. Se se observar degradação, este tempo de incubação pode ser reduzido até um mínimo de 2 horas em vez de durante a noite.
- Rotação rápida e recolher o sobrenadante. Repita esta etapa duas vezes depois de adicionar 100 ml de P5 de tampão aos grânulos e reunir todas as fracções (Figura 3B, pista 2).
Comentário: Os restantes grânulos pode ser usada para a análise de eficácia de clivagem (Figura 3B , pista 3). Normalmente, 70-80% da proteína é clivada.
6. Para TALON metal Affinity Resin-A ligação às proteínas
- Divide-se a eluição a partir de cima em 3 fracções de 1 ml e incubar cada uma com 100 de resina de afinidade com metal Talon grânulos secos ul (pré-lavado duas vezes com tampão de P5) durante 1 hora sob rotação.
Comentário: Dividindo a eluição em várias frações aumenta a eficiência de ligação / lavagens.
- Lava-se a resina 5 min com tampão de P30 (P5 tampão com uma concentração final de 30 mM de imidazol).
- Repita o passo 6.2 2x e reunir as contas em um único tubo. Antes da última lavagem, remover tanto sobrenadante quanto possível.
Comentário: Isto corresponde à amostra ligado GARRA (Figura 3B, pista 4).
7. A eluição da proteína purificada
- Incubar a resina TALON proteína ligada por 5 min sob rotação com P500 tampão (tampão P5 com uma concentração final de 500 mM de imidazol). Use uma proporção entre o buffer e gotas de 1:1 v / v (Por exemplo, se você tivesse tomado 200 mL de contas secas, você terá que adicionar 200 mL de P500). Repetir este passo duas vezes e manter cada fracção eluída separadamente (chamado de eluição 1 (E1), eluição 2 (E2) e eluição 3 (E3) e a figura 3B, pistas 5-7).
Comentário: Os grânulos restantes podem ser utilizados para análise de eficiência de eluição (Figura 3B, pista 8). Tipicamente, 60-80% da proteína é eluída no total.
- Analisar a quantidade e qualidade da sua proteína purificada por carregar aproximadamente 20-40 ul de cada fracção com uma concentração padrão de BSA em SDS-PAGE e mancha com azul de Coomassie (Figura 3B) ou SYPRO mancha de proteína para visualização.
Comentário: A proteína de interesse pode também ser detectado throughout o procedimento de purificação utilizando anticorpo anti-GST e anti-Seus anticorpos (figura 3C).
8. Armazenamento da Proteína Purificada
- Dializar a proteína purificada contra um tampão de armazenamento adequado (por exemplo, 20 mM de Tris-Acetato, pH 8,0, KAc 200 mM, Glicerol a 10%, EDTA 1 mM, DTT 0,5 mM) a 4 ° C. É importante verificar a precipitação de proteína purificada durante a diálise. Nós normalmente dialisar 2x durante 1 hora a 4 ° C, sob agitação de rotação.
- Fazer pequenas aliquotas de proteína purificada (10-20 mL) e congelam-se em gelo seco durante 30 min. Armazenar as alíquotas a -80 ° C e evitar muitos ciclos de congelamento / descongelamento.
Resultados
A fim de ilustrar a eficácia da GST-His protocolo de purificação, que purificado Rec14, um S. pombe proteína de 32,9 kDa. O Rec14 cDNA foi clonada no nosso vector pFastBac1 modificado permitindo a adição de GST-e Seus-tags no N-e C-terminais, respectivamente, (Figura 1A). Baculovírus recombinantes foram então preparados e utilizados para infectar células SF9 infectadas para a expressão da proteína. Os lisados celulares solúveis foram incubados com contas de GST e proteínas ligadas foram eluídas por clivagem da GST com protease PreScission. O resultante Rec14-His proteína foi purificada por afinidade em resina TALON e ligados a proteínas foram eluídas com tampão de TALON contendo 500 mM de imidazole. Purificada Rec14-His foi dialisada em tampão de armazenamento, e armazenado a -80 ° C (Figura 1B).
Os lisados de células totais e solúveis a partir de células SF9 infectadas com o baculovírus recombinante Rec14, ou falsamente infectadas como controlo, foram analisadas por Coomcoloração azul Assie, permitindo-nos para confirmar a expressão de GST-Rec14-Sua proteína (Figura 3A). Durante o processo de purificação, muitas amostras foram analisadas para seguir a eficácia do método. A análise destas amostras por coloração com azul de Coomassie (Figura 3B) demonstra que, durante o primeiro passo de purificação, o GST-Rec14 foi correctamente ligada a esferas de GST, com um peso molecular aparente de ~ 60 kDa, devido à fusão de Rec14 (32,9 kDa) com GST (29 kDa) (pista 1). Após PreScission clivagem da GST, GST-livre Rec14-His migra cerca de 37 kDa (pista 2), enquanto a GST clivada pode ser visualizado nas esferas de GST (faixas 3, cerca de 25 kDa). Apesar de uma parte do Rec14 isentos de GST que ainda permaneceu ligada às esferas de GST (faixa 3), o enriquecimento notável em Rec14-His foi conseguido (pista 2, sem contaminantes visíveis na coloração com azul de Coomassie). Este passo pode ser melhorada aumentando o tempo de incubação da proteína com PreScission. Análise de Rec14-Seu limite para TALONgrânulos (após a etapa 7.1, pista 4) em comparação com as proteínas eluídas após purificação de GST passo (pista 2), mostra que uma grande fracção de Rec14-His está ligada a esferas TALON. Após várias lavagens, Rec14-His foi eluída e recolhido. Três eluições havia sido realizada. A análise revelou um elevado grau de pureza de Rec14-His (não contaminante visível por coloração com Coomassie, pistas 5 e 7), e maior concentração de Rec14-His na primeira eluição. Comparação das fracções eluídas (faixas 5 a 7) para os grânulos TALON após eluição (pista 8) ilustra a eficiência da eluição, uma vez que apenas alguns Rec14-His pode ser detectado como ligado em grânulos.
As amostras usadas na Figura 3B foram submetidas a análise de Western blot com anticorpos anti-GST e anti-Seus anticorpos, a fim de seguir Rec14 durante o procedimento (Figura 3C). O blot anti-GST mostra que alguns GST-Rec14 e GST sozinho, estavam presentes nas proteínas eluídas a partir da etapa de purificação de GST (faixa 2), e them contaminantes foram removidos por a etapa de purificação por afinidade His-tag. Este blot permite também monitorar GST que tinha sido removido eficientemente Rec14 pelo tratamento PreScission e o passo de purificação His (pistas 4-8). O anti-Sua blot visa detectar Rec14. Podemos assim confirmar que a GST-Rec14-His e Rec14-His foram completamente não clivado e removido a partir das esferas de GST (pista 11). Além disso, a uma alta concentração, Rec14 parece agregar (pista 13). Em resumo, os resultados apresentados demonstram a eficácia de GST-His de purificação para a purificação de S. pombe Rec14.

Figura 1. Esboço esquemático da GST-His e dois passo do método de purificação por afinidade. A. GST-Rec14-His construto clonados em pFastBac (Baculovir. nós vetor de expressão) B. duas etapas purificação por afinidade de GST-Rec14-Sua Sf9 de lisado celular solúvel., seguido por PreScission clivagem da GST de ligação GST, e eluição com imidazol vinculativo TALON Clique aqui para ver maior figura .
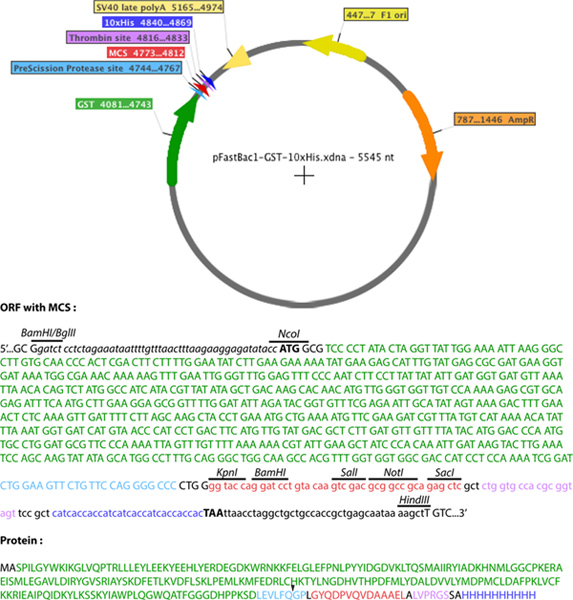
Figura 2. Representação esquemática do pFastBac1-GST-10xHis. GST (verde), local protease PreScission (azul claro), o local de multiclonagem (vermelho), e os 10-Sua tag (azul escuro) são mostrados. No caso de menores são as seqüências de nucleotídeos provenientes pET-52b (+). Clique aqui para ver maior figura .
together.within-page = "always"> 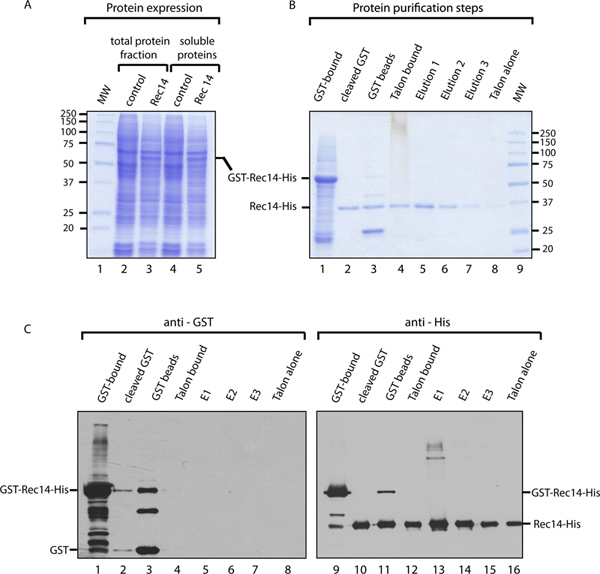
Figura 3. Resultado exemplar de GST-Sua purificação de Rec14. Uma. Coloração com Coomassie de fracção de proteína total (pista 2 e 3) e ligado celular solúvel (pistas 4 & 5) a partir de células Sf9 tratados simuladamente (pista 2 e 4) ou infectadas com GST-Rec14-Seus baculovírus (faixa 3 e 5). Rec14-His e GST possuem um peso molecular de aproximadamente 32,9 kDa e 29 kDa, respectivamente, e a-Rec14-His GST da proteína de fusão tem um peso molecular de cerca de 61,9 kDa. B. coloração com Coomassie mostrando cada passo do método de purificação de proteínas (por Ver o procedimento explicação detalhada) C. Western blot das fracções de acordo com o procedimento de purificação com anti-GST (pista 1-8) e anti-His (pistas 9 a 16) anticorpos."target =" _blank upload/50320/50320fig3large.jpg "> Clique aqui para ver maior figura.
Discussão
A GST-His protocolo de purificação aqui apresentada é adequada para a purificação de uma ampla gama de tamanhos de proteínas recombinantes: Foram purificados com sucesso Li RAD51 (41kDa), piBRCA2 (120kDa), PALB2 (130kDa), e um alto teor de proteína de peso molecular de instável Leishmania infantum: Li BRCA2 (125kDa) 6,9. Além disso, as proteínas purificadas com este protocolo foram bioquimicamente ativo 6. O sucesso deste método depende unicamente da expressão, solubilidade e estabilidade da proteína desejada.
Vectores de biologia molecular para a expressão em outros hospedeiros, tais como E. coli ou de levedura, podem ser facilmente modificadas utilizando o GST amplamente disponível e His. Isso destaca a aplicabilidade e relação custo-eficácia da técnica atual para a maioria dos laboratórios de biologia molecular. Uma variedade de vantagens influenciou nossa decisão de escolher células infectadas sobre as células bacterianas ou de mamíferos para recombinana expressão da proteína T e purificação. Por exemplo, as modificações pós-translacionais, tais como a metilação, fosforilação e ubiquitinação pode influenciar fortemente a função enzimática de uma proteína de 10. Assim, para estudar as propriedades fisiológicas de uma proteína, que é favorável a utilização de um sistema que permite a modificação pós-tradução, tais como as células de Sf9 infectadas. Outra vantagem do uso de Sf9 sobre células de mamíferos, por exemplo, é de natureza económica, como o sistema de células infectadas requer consideravelmente menos células e nenhum método de transfecção caros em comparação com o sistema de mamífero.
A simplicidade do método apresentado vai ajudar os investigadores a obtenção de uma proteína ou complexo de proteína numa forma altamente purificada, com equipamento de laboratório padrão, o que é vantajoso para um laboratório com um equipamento mínimo.
Agradecimentos
Agradecemos a Anne-Marie Dion-Cote para discussões que levaram ao desenvolvimento do método. JK e RB são FQNRT estudiosos de doutorado, M.-MG é um estudioso Vanier CIHR e J.-YM é pesquisador sênior FRSQ. Este trabalho foi apoiado por fundos de Ciências Naturais e do Conselho de Pesquisa de Engenharia de JY. M.
Materiais
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| E.Coli DH10Bac (competent) | Invitrogen | ||
| Bac-to-Bac Baculovirus Expression System | Invitrogen | ||
| Maxi Prep Kit | Qiagen | 12163 | Solution I and II |
| Ultra Pure Bluo-Gal | Gibco (Life) | 15519028 | |
| IPTG | Gibco (Life) | 15529019 | |
| Sf9 infected cells | ATCC | CRL-1711 | |
| PreScission enzyme | GE Healthcare | 27084301 | |
| Grace's infected medium supplemented | Gibco (Life) | 11605-094 | |
| Fetal Bovine Serum characterized | Hyclone | SH30396.03 | |
| P/S (Penicillin-Streptomycin) | Gibco (Life) | 15070-063 | |
| Glutathione Sepharose resin | GE bioscience | 17075605 | |
| Protease inhibitor cocktail | Roche | 11873580001 | |
| Talon resin | Clontech | 635504 | |
| Imidazole | BioShop | 288324 | |
| Gentamicin | Gibco (Life) | 15710064 | |
| Polyclonal GST-antibody | Production in house | ||
| Monoclonal 6X-His-antibody | Clontech | 631212 | |
| EQUIPMENT | |||
| Dounce homogenizer (tight) | Wheaton | 357546 | |
| Sonicator (Fisher dismembrator) | Fisher | Model 150 | |
| Dialysis bag (50 mm) | Fisher Scientific | 2115217 | |
Referências
- Lichty, J. J., Malecki, J. L., Agnew, H. D., Michelson-Horowitz, D. J., Tan, S. Comparison of affinity tags for protein purification. Protein Expr. Purif. 41, 98-105 (2005).
- Thain, A., Gaston, K., Jenkins, O., Clarke, A. R. A method for the separation of GST fusion proteins from co-purifying GroEL. Trends Genet. 12, 209-210 (1996).
- Carr, S., et al. Expression of a recombinant form of the V antigen of Yersinia pestis, using three different expression systems. Vaccine. 18, 153-159 (1999).
- Armisen, P., et al. Selective adsorption of poly-His tagged glutaryl acylase on tailor-made metal chelate supports. J. Chromatogr. A. 848, 61-70 (1999).
- Kuhn, S., Zipfel, P. F. The baculovirus expression vector pBSV-8His directs secretion of histidine-tagged proteins. Gene. 162, 225-229 (1995).
- Buisson, R., et al. Cooperation of breast cancer proteins PALB2 and piccolo BRCA2 in stimulating homologous recombination. Nat. Struct. Mol. Biol. 17, 1247-1254 (2010).
- Filimonova, M. N., et al. Isoforms of Serratia marcescens nuclease. The role of Mg2+ in the hydrolysis mechanism. Biochemistry. 62, 983-988 (1997).
- Thorslund, T., et al. The breast cancer tumor suppressor BRCA2 promotes the specific targeting of RAD51 to single-stranded DNA. Nat. Struct. Mol. Biol. 17, 1263-1265 (2010).
- Genois, M. M., et al. Interactions between BRCA2 and RAD51 for promoting homologous recombination in Leishmania infantum. Nucleic Acids Res. 40, 6570-6584 (2012).
- Shrestha, B., Smee, C., Gileadi, O. Baculovirus expression vector system: an emerging host for high-throughput eukaryotic protein expression. Methods Mol. Biol. 439, 269-289 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados