Method Article
GST-Hisの精製:全長精製タンパク質を降伏二段階アフィニティー精製プロトコル
要約
本プロトコルでは、一意に切断可能なGST-タグおよび小Hisタグを組み合わせることにより組換えタンパク質の精製を可能にする非常に効率的で費用対効果の高い小規模タンパク質精製方法を実証する。
要約
インビトロにおけるタンパク質の生化学的特徴付けのための酵素学における重要なアッセイは、関心対象の精製されたタンパク質の高濃度を必要とする。タンパク質精製プロトコルは、効率性、単純性、および費用対効果1を結合する必要があります。ここでは、N-末端グルタチオンセファロースタグ(GST)2,3両融合されるC-末端10xHisタグ4に基づいて、組換えタンパク質のための新たな小規模アフィニティー精製システムとしてGST-Hisの方法を記載目的のタンパク質に。後者の構築物は、タンパク質発現のために5感染したSf9細胞の感染のために、バキュロウイルスを生成するために使用される。 GSTは、浄化効率を確保するのに役立つかなり長いタグ(29 kDa)のである。しかしながら、タンパク質の生理学的特性に影響を与えるかもしれない。従って、それは、その後、プレシジョン酵素6を用いてタンパク質から切断される。最大の純度を保証し、切断されたGSTを除去するために、我々比較的小さいHisタグに基づいて、第二のアフィニティー精製工程を追加した。重要なことには、我々の技術が劣化したタンパク質を除去し、従って、完全長タンパク質を豊かにするための効率的なツールであるタンパク質の両端に隣接する2つの異なるタグに基づいている。ここで紹介する方法は、FPLC等の高価な楽器のセットアップを必要としない。さらに、我々は、夾雑核酸廃止する熱ショックタンパク質不純物およびヌクレアーゼ処理を除去するためにMgCl 2およびATPの洗浄を組み込んだ。要約すると、隣接する2つの異なるタグの組合せN-およびC-末端とタグのいずれかを切断する能力が、興味のある高度に精製された全長タンパク質の回収で評価する。
概要
組換えタンパク質の精製は、生化学の基本的な質問に対処することが重要である。イオン交換クロマトグラフィーおよびサイズ排除クロマトグラフィーのようなタンパク質精製の従来の方法は、それぞれ、例えば、その等電点、電荷またはサイズなどの標的タンパク質の物理的性質に依存する。後者のタンパク質特性が大幅に従来のタンパク質精製方法でタンパク質を汚染する可能性を増大させる種々のタンパク質が共有されています。この問題は、時間がかかり、複数の精製カラムの使用により回避することができる。同時に、後者のクロマトグラフィー法は、高価な実験装置を要求する。ほとんどの場合、タグは、目的のタンパク質に固有であるように、アフィニティータグ精製が強く、標的特異性を増加させる。最近の研究では、違反またはHA-アフィニティー精製が広く用いられている。
既存rec視聴とは対照的に単一のタグが使用されるombinantタンパク質精製プロトコルは、2つのタグのユニークな組み合わせを確立した。我々の方法は、所望のタンパク質の量と純度との間の最適な比率のために、目的のタンパク質のC末端にN-末端およびHisタグにおけるGST-タグの融合を含む。 GSTはグルタチオンセファロースビーズでの精製のための非常に効率的で、長いタグ(29 kDa)の、ある。さらに、GSTを使用すると、本手法1の費用対効果を保証します。 (わずか2つのアミノ酸の付加、その結果、認識配列LeuGluValLeuPheGln / GlyProで)プレシジョン酵素GSTを切断する可能性は多くの利点を有し、例えば、この戦略は、アロステリック障害のために、生理学的タンパク質の機能の変化を回避する。他のタンパク質に融合した小端Hisタグは、切断されたGSTを洗い流し、ならびにタンパク質および他の分解によるタンパク質の純度を高めるために第二の精製工程において機能する汚染物質。彼の精製工程カラム(TALON樹脂)にGSTの切り替えとさらに、プロトコルは、透析工程を必要としない。このような精製プロセスにおける一般的な汚染物質は、熱ショックタンパク質(HSP)である。 MgCl 2およびATPとのインキュベーション工程の追加は、これらの汚染物質を除去する( 図1)を可能にする。
高速タンパク質液体クロマトグラフィー(FPLC)、および高速液体クロマトグラフィー(HPLC)は、関心対象の精製されたタンパク質を高収率で生成するために高価な器具類に依存する一般的な技術である。我々はここで紹介するバッチ精製プロトコールは、対照的に、手動で、高価な楽器のセットアップを必要としません。タンパク質の高収量は、プロトコルをスケールアップして行くことができます。これと同時に、バッチ精製プロトコルで、溶出体積はFPLCまたはHPLCで指定されていないタンパク質濃度を向上させるために調整することができる。
ntent ">また、バッチGST-Hisの精製プロトコルで、〜10〜300 kDaの範囲のサイズを有するタンパク質を精製することができる。最大の利点の一つは、一つは、同時にいくつかのタンパク質を精製することができるという事実によって与えられる。例えば、野生型及びその変異タンパク質の両方が提示されたプロトコルの成功は、単独で目的のタンパク質の発現レベルおよび溶解度に依存する。プロトコル
1。組換えバキュロウイルスの作製
バキュロウイルスは、主に、わずかな修正を加えた製造業者のプロトコルに従って、Invitrogen社のBac-to-Bacバキュロウイルス発現系を用いて生成されます。
- 修正するpFastBac1ベクター(Gibco社、生命)は、GSTおよびHis-タグ( 図2)を含む作成されました。をpET-52bの(+)ベクター(Novagen)のマルチクローニングサイト(MCS)は、10xHisタグを含有するpFastBac1-ストレプト-10xHisを生成するようにするpFastBac1ベクターのMCSに挿入した。をpET-52bの(+)MCS配列が5 '端および3にHindIII制限部位'端におけるBglII制限部位を付加する、XbaIおよびBlpIを制限部位の間に増幅されたPCRであった。 PCR産物は、次いで、BamHIおよびBglII制限配列の相溶性を使用して、pFastBac1のBamHIおよびHindIIIの制限部位間にクローニングした。目的は、の発現を可能にするpFastBac1を生成することであったのでストレプトアビジンと10xHisタグを用いる組換えタンパク質、ペット-52B(+)のBamHI制限部位がMCSの配列が使用されませんでした。また、XbaI制限部位が既にするpFastBac1のMCSとをpET-52bのMCSに挿入し、これらの(+)内のサイト間で生じる制限部位の重複を避けるために使用されなかった。プレシジョンプロテアーゼ認識部位(LeuGluValLeuPheGln / GlyPro)とのGSTコード配列を、次いで、pFastBac1の - ストレプトマイシン-10xHisに挿入した。をpGEX-6P-2(GEヘルスケア)からGST cDNA配列は、PCR、それぞれ5にNcoIおよびKpnI制限部位を含むプライマー 'および3'の末端を増幅した。 NcoI部位は、開始コドンの追加だけでなく、GSTにアラニンを可能にします。 PCR産物を、次いで、ストレプトアビジン-タグの欠失をもたらす、NcoIおよびKpnI制限部位の間にpFastBac1の - ストレプトマイシン-10xHisにクローニングした。このようにして得られた新たな融合ベクターは、pFastBac1の-GST-10xHis命名された。
- PRをコードするcDNAクローンを作成GST(N末端)およびHisタグ(C末端)の間をpFastBac-GST-10xHisベクターへの関心のotein。 C末端Hisタグとの融合を可能にするためのcDNAの終止コドンを除去するように注意してください。
- Eを変換(ステップ1.2)で得られた組換えたpFastBacとの大腸菌 DH10Bacコンピバクミドを生成する。コロニーがBluo-galおよびIPTG(10μg/ mlのテトラサイクリン、50μg/ mlのカナマイシン、7μg/ mlのゲンタマイシン、100μg/ mlのBluoを含有選択プレート上で30℃、37℃、数時間で一晩成長させるギャル、40μg/ mlのIPTG)。
- 白の表現型を確認するために、選択プレート上で(ステップ1.3から)2個の白色コロニーを選択し、restreak。
- ステップ1.4から2白いコロニーをLBの2ミリリットル10μg/ mlのテトラサイクリンを含む、50μg/ mlのカナマイシン、10μg/ mlのゲンタマイシンを接種し、それらを37℃で撹拌(250回転)の下で一晩増殖させ
- バクミドDNAを精製するために、ステップ1.5からの細菌をペレット溶液を300μlの私は細胞を再懸濁し、溶液IIを300μl(キアゲンからマキシプレップキット)を追加します。 、室温で5分間インキュベートし、3MのKOAcのpH 5.5を300μlを加え、氷上で10分間インキュベートする。 4°C、10分間最大速度でサンプルを遠心分離する。上清にイソプロパノールを800μl加え、氷上で10分間インキュベートする。 4℃で15分間サンプルを遠心分離し、70%エタノール500μlでペレットを洗浄する。ペレットを乾燥させトリス-EDTA pH8.0の40μlの滅菌条件下でそれを懸濁します。バクミドDNAは、4℃で保存する必要があります
- 製造業者のプロトコルに記載のようにバキュロウイルスを生成する。バキュロウイルスは、光から保護して4℃で保存することができる。
2。組換えタンパク質発現
- 精製のための最も効率的なバキュロウイルスを選択すると、タンパク質発現のピークに到達する何時監視するために、ミニ感染アッセイaを実行するSは、以下のとおりのSf9の2×10 7に感染バキュロウイルスの133μL(1/150)と(10%FBSおよび1%P / Sで補完)グレースメディアに27℃で培養した細胞を感染させた。 0、24、48で1.5ミリリットルのアリコートを収集し、72時間後に感染。細胞をペレット化し、抗タグ抗体を用いたウエスタンブロッティングにより目的のタンパク質の発現レベルを分析する。
- ウイルスとメディアの間で1/150の割合で、メディアの500ミリリットル1ml当たり1.0×10 6 Sf9細胞を含むスピナーを感染させるためにステップ2.1から最も効率的なバキュロウイルスを使用してください。感染細胞は27℃で、懸濁液中で増殖し、最大のタンパク質発現(上記ステップ2.1で決定される)に達したときに細胞を回収しましょう。ペレット化した細胞は、さらに使用するまで-80℃で保存することができる。
3。可溶性細胞溶解物の調製
以下のインキュベーションステップは全て、軽度の回転下で4℃で行われる。
- 溶解SGST結合バッファー(150mMのNaCl、1mMのEDTA、0.05%トリトン-X-100、1mMの250mMのNaClの終濃度についてのPBS1XでDTT、およびプロテアーゼ阻害剤の約20 mlの目的タンパク質を発現するF9細胞カクテル(Roche)を氷水浴中で、ダウンスホモジナイザーでソリューション20Xをダウンス、超音波処理3X 30秒ごと(70%出力)し、再び20Xをダウンス。
- (省略可能)。 1mMのMgCl 2を有する全細胞溶解物をインキュベートし、DNAまたはRNAの混入を除去するために4℃で30分間7ヌクレアーゼ(2.5 U / ml)をベンゾナーゼ。
- 4℃で30分間18,000 rpmで遠心分離上清を保管してください。
- (省略可能)。遠心分離機明確な可溶性溶解を得るために4℃、18,000 rpmで30分間、再び上清。目詰まりを回避するために、0.2または0.45μmのフィルターで上澄みを渡します。
4。 GSTビーズ上のタンパク質の結合
- GSTビーズを1mlの可溶性細胞溶解物をインキュベートする(で2回予備洗浄GST 10mlを穏やかに回転させながら4℃で1時間、緩衝液)に結合する。
コメント:インキュベーション時間は、タンパク質の安定性及び結合効率に応じて最適化する必要がある。
- クイック700 rpmでスピンし、非結合タンパク質を含む上清を除去し(これは、さらなる分析のために保持することができる)。 GST洗浄緩衝液(350mMのNaClを有する最終的なGST結合緩衝液)を用いてGST-結合タンパク質( 図3B、レーン1)洗浄する。
- 手順を繰り返し4.2倍。最後の洗浄では、できるだけ多くの上清を除去します。
- 熱ショックタンパク質8の非特異的結合を回避するために、4℃で1時間(10ミリリットルGST結合緩衝液中)、5mMのATPおよび15mMのMgCl 2を有するビーズをインキュベートする。 GST洗浄バッファーでビーズを3回洗浄します。
5。 GSTのプレシジョン切断
- GSTビーズを遠心し、上清を除去し、P5のBUFとのGSTビーズを洗浄FER(50mMのpH7.0でのNaHPO 4、500mMのNaCl、10%グリセロール、0.05%トリトン-X-100、5mMイミダゾール)。
- 4℃で一晩に3時間からP5バッファにプレシジョン酵素で、GST-ビーズをインキュベート(100μLの分画に、GSTビーズを分割し、P5の緩衝液100μlに希釈した酵素の4-8単位(2-4μl)を追加します)。
コメント:プレシジョン工程のインキュベーション時間は、分子量ならびにタンパク質の安定性に応じて最適化する必要がある。分解が観察される場合には、このインキュベーション時間は一晩、2時間の最小値の代わりにまで減少させることができる。
- クイックスピンし、上清を集める。 P5の100μlのを追加した後、この手順を2回繰り返す ビーズにバッファリングし、全ての画分( 図3B、レーン2)プール。
コメント:残りのビーズは切断効率の分析のために使用することができる( 図3B 、レーン3)。通常、タンパク質の70〜80%が切断される。
6。タンパク質結合TALON金属アフィニティー樹脂に
- 1ミリリットルの3画分に、上からの溶出を分割し、回転下で1時間、100μlのタロン金属アフィニティー樹脂乾燥ビーズ(P5緩衝液で2回予洗)と、それぞれインキュベートする。
コメント:いくつかの画分に溶出を割ると、結合/洗浄の効率を向上させます。
- P30バッファー(30 mMイミダゾールの最終濃度でP5バッファー)で樹脂5分を洗ってください。
- ステップ6.2倍を繰り返して、単一のチューブ内でビーズをプールする。最後の洗浄の前に、できるだけ多くの上清を除去します。
コメント:これはTALONバインドのサンプル( 図3B、レーン4)に対応している。
7。精製タンパク質の溶出
- P5で回転下で5分間蛋白結合するTALON樹脂をインキュベート00緩衝液(500 mMイミダゾールの最終濃度を有するバッファーP5)。バッファ1:1 V / Vのビーズとの比率を使用してください(あなたは乾燥ビーズを200μlを取っていた場合、あなたはP500を200μlを追加する必要があります)。 2回にこの手順を繰り返し、別々にそれぞれの溶出画分を保つ(; 図3B、レーン5-7という名前の溶出1(E1)、溶出2(E2)および溶出3(E3))。
コメント:残りのビーズを溶出効率( 図3B、レーン8)の分析のために使用することができる。典型的に、タンパク質の60〜80%が合計で溶出する。
- クマシーブルー( 図3B)、または可視化のためのSYPROタンパク質染色でSDS-PAGEおよび染色の標準BSA濃度で各分画の約20〜40μLをロードすることによって、あなたの精製タンパク質の量と質を分析します。
コメント:目的のタンパク質もthroを検出することが可能抗GSTおよび抗His抗体( 図3C)を使用して精製操作ughout。
8。精製タンパク質の貯蔵
- 4℃で、適切な保存緩衝液に対して精製タンパク質( 例えば、20mMトリス酢酸塩pH8.0で、200mMののKAc、10%グリセロール、1mMのEDTA、0.5mMのDTT)で透析これは、透析中に精製されたタンパク質の沈殿のために確認することが重要です。私たちは通常、攪拌回転下で4℃で1時間、2X透析。
- 精製したタンパク質(10-20μL)の小分けを作り、30分間ドライアイス上で凍結する。 -80℃で一定分量を保存し、多くの融解/凍結サイクルを避ける。
結果
GST-Hisの精製プロトコールの効率を例証するために、我々はRec14、S.精製 32.9 kDaでpombeのタンパク質。 Rec14 cDNAは、N-およびC-末端GST-およびHis-タグの付加を可能にする我々の修飾するpFastBac1ベクターであった( 図1A)にクローニングした。組換えバキュロウイルスを調製し、次いで、タンパク質発現のためにSF9に感染した細胞に感染させた。可溶性細胞溶解物をGSTビーズと共にインキュベートし、結合したタンパク質を、PreScissionプロテアーゼとGSTを切断することにより溶出した。得られたRec14は-Hisタンパク質はアフィニティーTALON樹脂上で精製し、結合したタンパク質を500mMのイミダゾールを含むTALON緩衝液で溶出したであった。精製されたRec14-Hisを、記憶バッファに透析し、-80℃( 図1B)で保存した。
Rec14組換えバキュロウイルス、または対照として偽感染に感染したSF9細胞からの可溶性および全細胞溶解物を、COOMで分析した私たちは、GST-Rec14-Hisタンパク質( 図3A)の発現を確認することができassieブルー染色、。精製過程で、多数のサンプルは、方法の効率をたどるために分析した。クーマシーブルー染色( 図3B)によって、これらの試料の分析は、精製の 第一段階の間に、GST-Rec14が正しくによるRec14(32.9 kDa)のの融合物に約60 kDaの見かけの分子量を有する、GSTビーズに結合させたことを示しているGSTと(29 kDa)の(レーン1)。 GSTのプレシジョン切断後、GSTフリーRec14 - 彼の37 kDaの(レーン2)の周りに移動する、切断されたGSTはGSTビーズ(25 kDaの周りのレーン3)上で可視化することができますが。それでも、GSTビーズ(レーン3)に結合したまま、GSTフリーRec14の部分にもかかわらず、Rec14 - 彼の顕著な濃縮は(クマシーブルー染色に見える汚染物質がないとのレーン2)を達成した。このステップは、プレシジョンを有するタンパク質のインキュベーション時間を増加させることによって改善することができる。 TALONへRec14 - 彼の束縛の分析ビーズは(ステップ7.1の後、レーン4)GST精製工程(レーン2)の後に溶出されたタンパク質と比較して、Rec14-Hisの大部分は、TALONビーズに結合していることを示している。数回の洗浄の後に、抗His Rec14を溶出し回収した。三つの溶出が行われていた。分析はRec14-彼(7クマシー染色、レーン5によって可視なし汚染物質)の高純度、かつ最初の溶出におけるRec14 - 彼の最大の濃度を明らかにした。ビーズに結合したように、少数のRec14-Hisは検出することができるので、TALONビーズの溶出画分(レーン5〜7)の比較は、溶出後(レーン8)は、溶出の効率を示す。
図3Bにおいて使用される試料は、手順( 図3C)を通してRec14を追跡するために、抗GSTおよび抗His抗体を用いたウェスタンブロット分析に供した。抗GSTブロットは、いくつかのGST-Rec14単独GSTは、GST精製工程(レーン2)から溶出したタンパク質中に存在したことを示しており、第汚染物質でHisタグアフィニティ精製工程により除去した。このブロットは、私たちはまた、GSTが効率プレシジョン処理とHisタグ精製工程(レーン4から8)によりRec14から削除されたことを監視することができます。抗HisブロットRec14を検出することを目指しています。我々は、このように、GST-Rec14-HisおよびRec14 - 彼が完全に切断され、GSTビーズ(レーン11)から削除されていないことを確認することができます。また、高濃度で、Rec14(レーン13)を集約すると思われる。要約すれば、提示された結果は、S.の精製の ためのGST-Hisの精製効率を実証シゾサッカロミセス Rec14。

図1。 GST-Hisの2段階のアフィニティー精製方法の概略外形たpFastBacにクローン化した。A. GST-Rec14 -彼の構築物(Baculovir。GST-Rec14 -彼の私達の発現ベクター)B.二段階アフィニティ精製のSf9可溶性細胞溶解物から:GST-結合GSTのプレシジョン切断し、続いて、TALON結合、イミダゾールで溶出すると、 大きな画像を見るにはここをクリックしてください 。
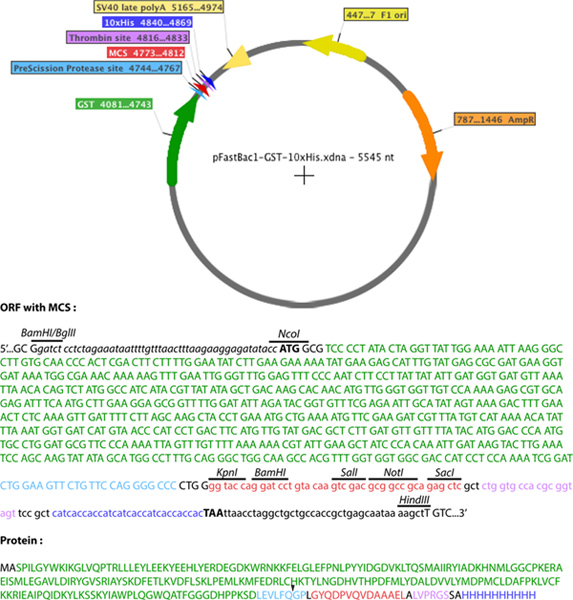
図2。 pFastBac1の-GST-10xHisの模式図 。 GST(緑)、PreScissionプロテアーゼ部位(水色)、マルチクローニング部位(赤)、および10-Hisタグ(ダークブルー)が示されている。下部ケースのペット52B(+)に起因するヌクレオチド配列である。 大きな画像を見るにはここをクリックしてください 。
together.withinページ= "常に"> 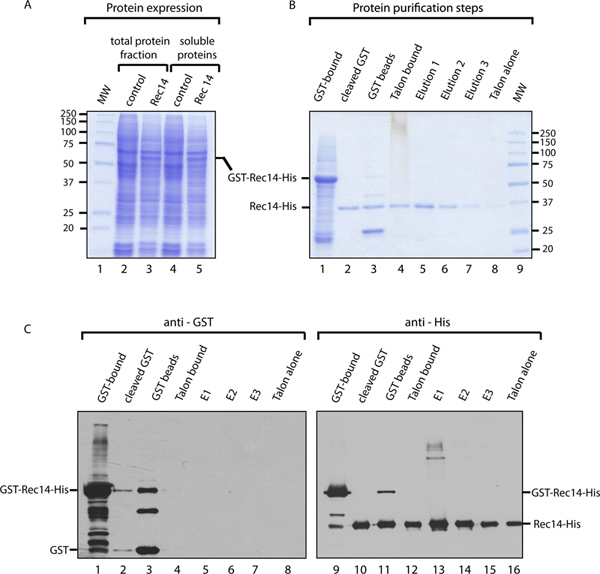
図3。 Rec14。AのGST-Hisの精製結果の一例 。総タンパク質画分モック処理Sf9細胞から(レーン2および3)および可溶性細胞溶解物(レーン4および5)のクマシー染色(レーン2および4)またはGST-Rec14-Hisをバキュロウイルス(レーン3および5)で感染させる。 Rec14-HisおよびGSTは、それぞれ約32.9および29kDaの分子量を有し、そしてGST-Rec14-His融合タンパク質は、約61.9 kDaの分子量を有する。B.クマシーために(タンパク質精製方法の各工程を示す染色8個の抗GST(レーン1)および抗His(レーン9〜16)抗体による精製手順以下の画分についての詳細な説明シースルーのPROCEDURE)C.ウェスタンブロット。upload/50320/50320fig3large.jpg "ターゲット=" _blank ">大きな画像を見るにはここをクリックしてください。
ディスカッション
ここで紹介する、GST-Hisの精製プロトコルは、組換えタンパク質の大きさの広い範囲の精製に適している:我々は成功して李 RAD51(41kDa)、piBRCA2(120kDa)、PALB2(130kDa)、および不安定な高分子量のタンパク質の精製リーシュマニア幼児 : 李 BRCA2(125kDa)6,9。また、このプロトコルを使用して精製したタンパク質は、6生化学的に活性であった。この方法の成功は、単に所望のタンパク質の発現、溶解度および安定性に依存する。
例えば大腸菌のような他のホストでの発現のための分子生物学的ベクトル、 大腸菌や酵母は、簡単に、広く利用可能な、GSTやHisタグを使用して変更できます。これは、ほとんどの分子生物学の実験室のための本技術の適用可能性と費用対効果を強調しています。様々な利点がrecombinan細菌または哺乳動物細胞上で、感染した細胞を選択する我々の決定に影響を与えたトンタンパク質の発現および精製。例えば、このようなメチル化、リン酸化およびユビキチン化などの翻訳後修飾は、タンパク質に強く10の酵素機能に影響を与えることができる。従って、タンパク質の生理学的特性を研究するために、そのような感染したSf9細胞のような翻訳後修飾を可能にするシステムを用いることが好ましい。感染細胞系は、哺乳動物系に比べて大幅に少ない細胞なし高価なトランスフェクション法を必要とする哺乳動物細胞上でのSf9を使用することの別の利点は、例えば、経済的な性質のものである。
提示された方法の簡単さは、研究者が、最小限の機器とラボのために有利である、標準的な実験室の機器と高度に精製された形でタンパク質またはタンパク質複合体を得るのに役立ちます。
謝辞
我々は法の開発につながる議論アンヌ=マリー·ディオン·コートに感謝します。 JKとRBはFQNRT博士学者、M.-MGはバニエCIHR学者であり、J.-YMはFRSQ上級研究員である。この作品は、自然科学と工学研究評議会からJYへの資金によってサポートされていました。 M.
資料
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| E.Coli DH10Bac (competent) | Invitrogen | ||
| Bac-to-Bac Baculovirus Expression System | Invitrogen | ||
| Maxi Prep Kit | Qiagen | 12163 | Solution I and II |
| Ultra Pure Bluo-Gal | Gibco (Life) | 15519028 | |
| IPTG | Gibco (Life) | 15529019 | |
| Sf9 infected cells | ATCC | CRL-1711 | |
| PreScission enzyme | GE Healthcare | 27084301 | |
| Grace's infected medium supplemented | Gibco (Life) | 11605-094 | |
| Fetal Bovine Serum characterized | Hyclone | SH30396.03 | |
| P/S (Penicillin-Streptomycin) | Gibco (Life) | 15070-063 | |
| Glutathione Sepharose resin | GE bioscience | 17075605 | |
| Protease inhibitor cocktail | Roche | 11873580001 | |
| Talon resin | Clontech | 635504 | |
| Imidazole | BioShop | 288324 | |
| Gentamicin | Gibco (Life) | 15710064 | |
| Polyclonal GST-antibody | Production in house | ||
| Monoclonal 6X-His-antibody | Clontech | 631212 | |
| EQUIPMENT | |||
| Dounce homogenizer (tight) | Wheaton | 357546 | |
| Sonicator (Fisher dismembrator) | Fisher | Model 150 | |
| Dialysis bag (50 mm) | Fisher Scientific | 2115217 | |
参考文献
- Lichty, J. J., Malecki, J. L., Agnew, H. D., Michelson-Horowitz, D. J., Tan, S. Comparison of affinity tags for protein purification. Protein Expr. Purif. 41, 98-105 (2005).
- Thain, A., Gaston, K., Jenkins, O., Clarke, A. R. A method for the separation of GST fusion proteins from co-purifying GroEL. Trends Genet. 12, 209-210 (1996).
- Carr, S., et al. Expression of a recombinant form of the V antigen of Yersinia pestis, using three different expression systems. Vaccine. 18, 153-159 (1999).
- Armisen, P., et al. Selective adsorption of poly-His tagged glutaryl acylase on tailor-made metal chelate supports. J. Chromatogr. A. 848, 61-70 (1999).
- Kuhn, S., Zipfel, P. F. The baculovirus expression vector pBSV-8His directs secretion of histidine-tagged proteins. Gene. 162, 225-229 (1995).
- Buisson, R., et al. Cooperation of breast cancer proteins PALB2 and piccolo BRCA2 in stimulating homologous recombination. Nat. Struct. Mol. Biol. 17, 1247-1254 (2010).
- Filimonova, M. N., et al. Isoforms of Serratia marcescens nuclease. The role of Mg2+ in the hydrolysis mechanism. Biochemistry. 62, 983-988 (1997).
- Thorslund, T., et al. The breast cancer tumor suppressor BRCA2 promotes the specific targeting of RAD51 to single-stranded DNA. Nat. Struct. Mol. Biol. 17, 1263-1265 (2010).
- Genois, M. M., et al. Interactions between BRCA2 and RAD51 for promoting homologous recombination in Leishmania infantum. Nucleic Acids Res. 40, 6570-6584 (2012).
- Shrestha, B., Smee, C., Gileadi, O. Baculovirus expression vector system: an emerging host for high-throughput eukaryotic protein expression. Methods Mol. Biol. 439, 269-289 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。