Method Article
GST-la sua purificazione: A Two-step Affinity Purification protocollo Cedendo Full-length proteine purificate
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Nel presente protocollo, si dimostra un metodo altamente efficiente e conveniente purificazione di proteine su piccola scala, che permette la purificazione di proteine ricombinanti, combinando in modo univoco un scindibile GST-tag e un piccolo His-tag.
Abstract
Saggi chiave enzimologia per la caratterizzazione biochimica delle proteine in vitro richiedono alte concentrazioni di proteina purificata di interesse. Protocolli di purificazione di proteine dovrebbero coniugare efficienza, semplicità ed economicità 1. Qui, descriviamo la GST-His metodo come un nuovo sistema di purificazione per affinità su piccola scala per le proteine ricombinanti, basato su un N-terminale Tag glutatione Sepharose (GST) 2,3 e un tag 10xHis C-terminale 4, che sono entrambi fusa per la proteina di interesse. Quest'ultimo costrutto viene utilizzato per generare baculovirus, per infezione di Sf9 cellule infette per l'espressione proteica 5. GST è piuttosto lunga tag (29 kDa) che serve a garantire l'efficienza di depurazione. Tuttavia, potrebbe influenzare le proprietà fisiologiche della proteina. Quindi, viene successivamente tagliato fuori la proteina usando l'enzima prescissione 6. Al fine di garantire la massima purezza e per rimuovere la GST spaccati, abbiamoaggiunta una seconda fase di purificazione di affinità basata sul relativamente piccolo His-tag. È importante sottolineare che la nostra tecnica si basa su due diversi tag che fiancheggiano le due estremità della proteina, che è uno strumento efficace per rimuovere le proteine degradate e, quindi, arricchisce proteine integrali. Il metodo qui presentato non richiede una configurazione strumentale costoso, come FPLC. Inoltre, abbiamo incorporato MgCl 2 e lava ATP per rimuovere le impurità di calore proteina da shock e il trattamento nucleasi per abolire contaminanti acidi nucleici. In sintesi, la combinazione di due diversi tag che fiancheggiano la N-e C-terminale e la capacità di scindere fuori uno dei tag, garantisce il recupero di una proteina altamente purificata e full-length di interesse.
Introduzione
La purificazione di proteine ricombinanti è fondamentale per affrontare le questioni fondamentali in biochimica. Modi convenzionali di purificazione delle proteine come cromatografia a scambio ionico e cromatografia ad esclusione dimensionale basano sulle proprietà fisiche della proteina bersaglio come suo punto isoelettrico e carica o dimensione, rispettivamente. Le caratteristiche proteiche ultimi sono condivisi da una varietà di proteine, che aumenta notevolmente la possibilità di proteine contaminanti in strategie di purificazione delle proteine convenzionali. Questo problema può essere aggirato con l'utilizzo di più colonne di purificazione, che richiede molto tempo. Allo stesso tempo, questi ultimi metodi cromatografici richiedono costosi setup sperimentale. Affinità-tag purificazione aumenta fortemente bersaglio specificità, come nella maggior parte dei casi il tag sarà unico per la proteina di interesse. In studi recenti, purificazione-Flag o HA-affinità è stato ampiamente utilizzato.
In contrasto con rec esistenteprotocolli di purificazione di proteine ombinant in cui vengono utilizzati singoli tag, abbiamo stabilito la combinazione unica di due tag. Il nostro metodo prevede la fusione di GST-tag al N-terminale e un His-tag al C-terminale della proteina di interesse, per un rapporto ottimale tra quantità e la purezza della proteina desiderata. Il GST è molto variabile (29 kDa), che è molto efficace per la purificazione su glutatione Sepharose perline. Inoltre, utilizzando GST garantisce costo-efficacia del nostro metodo 1. La possibilità di fendere largo della GST con l'enzima prescissione (con sequenza di riconoscimento LeuGluValLeuPheGln / GlyPro, conseguente aggiunta di soli due amminoacidi) ha molti vantaggi, per esempio, questa strategia evita alterazioni delle funzioni fisiologiche proteina causa ostacolo allosterico. Il piccolo His-tag fusa alla proteina altra estremità serve in una seconda fase di purificazione per aumentare proteina purezza lavando via il GST spaccati, così come proteine degradate e altre contaminanti. Inoltre, il protocollo non richiede una fase di dialisi quando si passa dalla GST alla colonna passo His-purificazione (resina TALON). Contaminanti comuni in tali processi di purificazione sono proteine da shock termico (HSP). L'aggiunta di una fase di incubazione con MgCl 2 e ATP permette la rimozione di questi contaminanti (Figura 1).
Proteina rapidi Liquid Chromatography (FPLC) e High Performance Liquid Chromatography (HPLC) sono tecniche comuni che dipendono strumentazione costosa per generare alta resa della proteina purificata di interesse. Il protocollo di purificazione lotto presentiamo qui, al contrario, è manuale e non richiede una configurazione strumentale costoso. Un elevato rendimento di proteina può essere raggiunto scalando il protocollo. Allo stesso tempo, con il protocollo di purificazione batch, il volume di eluizione può essere regolato in modo da aumentare la concentrazione di proteine, che non è dato con FPLC o HPLC.
S copi "> Inoltre, con la GST-His protocollo di purificazione batch, proteine con un intervallo di dimensioni di circa 10-300 kDa possono essere purificati. Uno dei maggiori vantaggi è dato dal fatto che si può purificare diverse proteine allo stesso tempo , per esempio, sia di tipo selvatico e la sua proteina mutante. Il successo del protocollo presentato dipende unicamente il livello di espressione e la solubilità della proteina di interesse.Protocollo
1. Produzione di ricombinante Baculovirus
Baculoviruses vengono generati utilizzando il Baculovirus Expression System Bac-to-Bac di Invitrogen prevalentemente secondo il protocollo del produttore con solo lievi modifiche:
- Un pFastBac1 vettore modificato (Gibco, vita) è stato creato, contenente la GST e suo-tag (Figura 2). Il MultiCloning Site (MCS) di una PET-52b (+) vettore (Novagen), contenente un 10xHis-tag, è stato inserito nel MCS di un vettore pFastBac1 per generare pFastBac1-Strep-10xHis. La sequenza MCS pET-52b (+) è stato amplificato mediante PCR tra i siti di restrizione XbaI e BlpI, l'aggiunta di un sito di restrizione BglII all'estremità 5 'estremità e un sito di restrizione HindIII al 3' estremità. Il prodotto di PCR è stato poi clonato tra BamHI e HindIII sito di restrizione di pFastBac1, utilizzando la compatibilità di BamHI e BglII sequenze di restrizione. Poiché l'obiettivo era di generare una pFastBac1 permettendo l'espressione diproteina ricombinante con streptavidina-e 10xHis-tag, il sito di restrizione BamHI della PET-52b (+) la sequenza MCS non è stato utilizzato. Inoltre, il sito di restrizione XbaI non è stato utilizzato per evitare la ridondanza dei siti di restrizione che si verificano tra i siti già presenti nel MCS di pFastBac1 e questi inserite con la MCS di PET-52b (+). La sequenza codificante GST con il sito prescissione proteasi di riconoscimento (LeuGluValLeuPheGln / GlyPro) è stato poi inserito nel pFastBac1-Strep-10xHis. La sequenza di cDNA da GST-pGEX 6P-2 (GE Healthcare) è stato amplificato mediante PCR con primer contenenti NcoI e KpnI siti di restrizione al 5 'e 3' estremità, rispettivamente. Il sito NcoI permette l'aggiunta di un codone di inizio, ma anche una alanina al GST. Il prodotto di PCR è stato poi clonato in pFastBac1-Strep-10xHis tra i siti di restrizione NcoI e KpnI, con la conseguente soppressione della streptavidina-tag. Il nuovo vettore di fusione così ottenuto è stato nominato pFastBac1-GST-10xHis.
- Clonare la codifica cDNA per il protein di interesse nel vettore pFastBac-GST-10xHis tra la GST (N-terminale) e la His-tag (C-terminale). Fate attenzione a rimuovere il fermo cDNA codone per consentire la fusione con la C-terminale His-tag.
- Trasforma E. coli DH10Bac con il ricombinante pFastBac (ottenuta nella fase 1.2) per generare il bacmid. Consentire colonie di crescere durante la notte a 37 ° C e diverse ore a 30 ° C su piastre di selezione contenenti Bluo-gal e IPTG (10 mcg / ml tetraciclina, 50 pg / ml kanamicina, 7 mg / ml di gentamicina, 100 pg / ml Bluo- Gal, 40 mcg / ml IPTG).
- Pick and restreak 2 colonie bianche (a partire dal punto 1.3) su piastre di selezione per confermare il fenotipo bianco.
- Inoculare 2 ml di LB contenenti 10 ug / ml tetraciclina, 50 pg / ml kanamicina, 10 mg / ml di gentamicina con le due colonie bianche dal punto 1.4 e farli crescere per una notte sotto agitazione (250 rpm) a 37 ° C.
- Al fine di purificare il DNA bacmid, pellet i batteri dal punto 1.5,sospendere nuovamente le cellule in 300 ml di soluzione di I e aggiungere 300 ml di soluzione II (kit Maxiprep da Qiagen). Incubare per 5 min a temperatura ambiente, aggiungere 300 ml di 3 M KOAc pH 5.5 e incubare per 10 min in ghiaccio. Centrifugare i campioni a 4 ° C, velocità massima per 10 min. Aggiungere 800 ml di isopropanolo per surnatanti e incubare per 10 min in ghiaccio. Centrifugare i campioni per 15 min a 4 ° C e lavare il precipitato con 500 ml di etanolo al 70%. Lasciare il pellet asciutto e risospendere in condizioni sterili in 40 ml di Tris-EDTA pH 8,0. Il DNA bacmid deve essere conservato a 4 ° C.
- Generare baculovirus come descritto nel protocollo del produttore. Baculoviruses possono essere conservati a 4 ° C al riparo dalla luce.
2. Ricombinante Protein Expression
- Per scegliere il baculovirus più efficiente per la purificazione e di monitorare ciò che il tempo si raggiunge il picco di espressione della proteina, eseguire un mini-infezione test uns segue: Infect 2 x 10 7 cellule infette Sf9 coltivate a 27 ° C in mezzi di Grace (integrato con 10% FBS e 1% P / S) con 133 microlitri (1/150) di baculovirus. Raccogliere aliquote di 1,5 ml a 0, 24, 48, e 72 ore dopo l'infezione. Agglomerare le cellule e analizzare il livello di espressione della proteina di interesse mediante western blotting utilizzando anticorpi anti-tag.
- Utilizzare il baculovirus più efficiente dal punto 2.1 per infettare un filatore contenente 1,0 x 10 6 cellule Sf9 per ml in 500 ml di media con un rapporto di 1/150 di tra virus e media. Lasciare che le cellule infettate crescere in sospensione a 27 ° C e raccogliere le cellule quando viene raggiunta la massima espressione della proteina (come determinato nella fase precedente punto 2.1). Cellule pellet possono essere conservati a -80 ° C sino al successivo utilizzo.
3. Preparazione del lisato cellulare Solubile
Tutte le seguenti fasi di incubazione vengono effettuati a 4 ° C sotto lieve rotazione.
- Lyse SF9 cellule esprimenti la vostra proteina di interesse in ~ 20 ml di tampone di legame GST (NaCl 150 mM, EDTA 1 mM, 0,05% Triton-X-100, 1 mM DTT in PBS1X per una concentrazione finale di NaCl di 250 mM, e inibitore della proteasi cocktail (Roche). In un bagno di acqua ghiacciata, Dounce la soluzione 20x con un omogeneizzatore Dounce, ultrasuoni 3x 30 secondi ciascuno (in uscita il 70%), e Dounce nuovo 20x.
- (Facoltativo). Incubare il lisato cellulare totale con 1 mM MgCl 2 e benzonasi 7 nucleasi (2,5 U / ml) per 30 min a 4 ° C per rimuovere il DNA o RNA contaminazione.
- Centrifugare a 18.000 rpm per 30 min a 4 ° C. Conservare il surnatante.
- (Facoltativo). Centrifugare il surnatante nuovamente per 30 min a 18.000 rpm a 4 ° C per ottenere un lisato solubile chiaro. Passare il surnatante con un filtro da 0,2 o 0,45 micron per evitare intasamenti.
4. Il legame di proteine su Beads GST
- Incubare il lisato cellulare solubile con 1 ml di perline GST (lavata due volte con10 ml di tampone GST) vincolante per 1 ora a 4 ° C sotto lieve rotazione.
Commento: Il tempo di incubazione deve essere ottimizzato secondo la stabilità della proteina e l'efficienza di legame.
- Giro veloce a 700 rpm e rimuovere il surnatante contenente proteine non legate (questo può essere conservato per ulteriori analisi). Lavare le proteine GST-bound (Figura 3B, corsia 1) con tampone di lavaggio GST (GST binding buffer con 350 mM NaCl finale).
- Ripetere il punto 4.2 2x. All'ultimo lavaggio, rimuovere il più possibile surnatante.
- Incubare le perline con 5 mM ATP e 15 mM MgCl 2 (in 10 ml di tampone di legame GST) per 1 ora a 4 ° C per evitare legami aspecifici di proteine da shock termico 8. Lavare le perline tre volte con tampone di lavaggio GST.
5. Prescissione scissione del GST
- Centrifugare le perline GST, rimuovere il surnatante e lavare le perline GST con P5 buffer (50 NaHPO 4 mM pH 7,0, NaCl 500 mM, glicerolo 10%, 0,05% Triton-X-100, imidazolo 5 mM).
- Incubare le GST-perline con prescissione enzima nel buffer P5 da 3 ore a notte a 4 ° C. (Dividete le perle GST in frazioni di 100 ml e aggiungere 4-8 unità (2-4 microlitri) di enzima diluito in 100 ml di tampone P5).
Commento: Il tempo di incubazione del passo prescissione deve essere ottimizzato in funzione del peso molecolare e la stabilità della proteina. Se la degradazione viene osservata, questo tempo di incubazione può essere ridotto fino ad un minimo di 2 ore anziché overnight.
- Giro veloce e raccogliere il surnatante. Ripetere questa operazione per due volte dopo l'aggiunta di 100 ml di P5 tampone ai talloni e piscina tutte le frazioni (Figura 3B, corsia 2).
Commento: I restanti sfere possono essere utilizzate per l'analisi di efficienza clivaggio (Figura 3B , corsia 3). Solitamente, il 70-80% delle proteine viene aperto.
6. -Proteina di legame per TALON metallo Affinity Resin
- Dividere l'eluizione dall'alto in 3 frazioni da 1 ml e incubare ciascuno con 100 microlitri Talon resina di affinità metallo perline secco (lavata due volte con tampone P5) per 1 ora in rotazione.
Commento: Dividendo il eluizione in diverse frazioni aumenta l'efficienza di legame / lavaggi.
- Lavare la resina 5 min con tampone P30 (tampone P5 con una concentrazione finale di 30 mM imidazolo).
- Ripetere passo 6.2 2x e in comune le perline in un unico tubo. Prima l'ultimo lavaggio, rimuovere il più possibile surnatante.
Commento: Questo corrisponde al TALON vincolato campione (figura 3B, corsia 4).
7. Eluizione della proteina purificata
- Incubare la proteina legata resina TALON per 5 min in rotazione con P500 tampone (buffer P5 con una concentrazione finale di 500 mM imidazolo). Utilizzare un rapporto tra buffer e perle di 1:01 v / v (Ad esempio, se tu avessi preso 200 ml di perline secco, dovrete aggiungere 200 ml di P500). Ripetere questa operazione due volte e mantenere ogni frazione eluita separatamente (denominato eluizione 1 (E1), eluizione 2 (E2) e eluizione 3 (E3), figura 3B, corsie 5-7).
Commento: I restanti sfere possono essere utilizzate per l'analisi di efficienza di eluizione (Figura 3B, corsia 8). Tipicamente, 60-80% della proteina viene eluita in totale.
- Analizzare la quantità e la qualità della proteina purificata caricando circa 20-40 microlitri di ogni frazione con una concentrazione standard BSA su SDS-PAGE e colorazione con Coomassie blue (Figura 3B) o SYPRO macchia proteina per la visualizzazione.
Commento: La proteina di interesse può essere rilevata anche throughout la procedura di purificazione utilizzando anti-GST e anti-His anticorpi (Figura 3C).
8. Conservazione della proteina purificata
- Dializzare la proteina purificata contro un tampone di conservazione appropriata (ad esempio 20 mM Tris acetato pH 8,0, KAC 200 mM, glicerolo 10%, EDTA 1 mM, DTT 0,5 mM) a 4 ° C. È importante controllare la precipitazione della proteina purificata durante la dialisi. Di solito Dializzare 2x per 1 ora a 4 ° C sotto agitazione rotazione.
- Effettuare piccole aliquote della proteina purificata (10-20 ml) e congelare in ghiaccio secco per 30 min. Conservare le aliquote a -80 ° C ed evitare molte disgelo / cicli di congelamento.
Risultati
Al fine di illustrare l'efficacia del-His GST protocollo di purificazione, si purificati Rec14, un S. proteine pombe del 32,9 kDa. La Rec14 cDNA è stato clonato nel nostro vettore pFastBac1 modificata permettendo le aggiunte di GST-e le Sue-tag presso la N-e C-terminali, rispettivamente (Figura 1A). Baculovirus ricombinanti sono stati poi preparati e usati per infettare le cellule infettate SF9 per l'espressione della proteina. I lisati cellulari solubili sono stati incubati con perline GST e-proteine legate sono state eluite con l'adesione della GST con prescissione proteasi. La risultante Rec14-His proteina era purificato per affinità su resina TALON e rilegati-proteine sono stati eluita con tampone di TALON contenente imidazolo mm 500. Purificato Rec14-His è stata dializzata in tampone di conservazione e conservate a -80 ° C (Figura 1B).
I lisati solubili totali e cellulari da cellule SF9 infettate con il baculovirus ricombinante Rec14, o mock-infettate come controllo, sono stati analizzati da CoomASSIE colorazione blu, che ci permette di confermare l'espressione di GST-Rec14-His proteina (Figura 3A). Durante il processo di purificazione, molti campioni sono stati analizzati per seguire l'efficacia del metodo. L'analisi di questi campioni di colorazione Coomassie blue (Figura 3B) mostra che durante la prima fase di purificazione, GST-Rec14 stato associato correttamente perline GST, con un peso molecolare apparente di circa 60 kDa dovuto alla fusione di Rec14 (32,9 kDa) con GST (29 kDa) (corsia 1). Dopo prescissione scissione del GST, libero-GST Rec14-I suoi migra circa 37 kDa (corsia 2), mentre il GST spaccati possono essere visualizzati sulle perline GST (corsia 3, circa 25 kDa). Nonostante una porzione di Rec14 libero-GST che ancora rimaneva legata alle perle di GST (corsia 3), notevole arricchimento in Rec14-His è stato raggiunto (corsia 2, senza alcun contaminante visibile sul Coomassie colorazione blu). Questo passaggio potrebbe essere migliorata aumentando il tempo di incubazione della proteina con prescissione. Analisi del Rec14-His vincolato al TALONperline (dopo il passo 7.1, corsia 4) rispetto alle proteine eluite dopo purificazione GST fase (corsia 2), mostra che una grande frazione di Rec14-His è destinato a perline TALON. Dopo diversi lavaggi, Rec14-His è stata eluita e raccolti. Erano stati eseguiti tre eluizioni. L'analisi ha rivelato una elevata purezza di Rec14-His (senza contaminante visibile da colorazione con Coomassie, corsie da 5 a 7), e la maggiore concentrazione di Rec14-His nella prima eluizione. Confronto di frazioni eluite (corsie 5-7) per le perle TALON dopo eluizione (corsia 8) illustra l'efficienza della eluizione, dal momento che solo poche Rec14-His può essere rilevato come legato in perline.
Campioni usati in Figura 3B stati sottoposti ad analisi Western blot con anti-GST e anti-His anticorpi per seguire Rec14 tutta la procedura (Figura 3C). Il blot anti-GST mostra che alcuni GST-Rec14 e solo GST, erano presenti nelle proteine eluite dalla fase di purificazione GST (corsia 2), e THa contaminanti sono stati rimossi dal His-tag di affinità di purificazione passo. Questa macchia ci permette inoltre di monitorare che il GST era stata eliminata in modo efficace dal Rec14 dal trattamento prescissione e la depurazione passo His-tag (corsie 4-8). L'anti-His blot mira a rilevare Rec14. Possiamo quindi confermare che GST-Rec14-His e Rec14-His non sono stati completamente spaccati e rimosso dalle perline GST (corsia 11). Inoltre, ad una concentrazione elevata, Rec14 sembra aggregare (corsia 13). In sintesi, i risultati presentati dimostrano l'efficacia del GST-His purificazione per la purificazione di S. pombe Rec14.

Figura 1. Sagoma schematica della-sua GST due fasi metodo di purificazione di affinità. A. GST-Rec14-Il suo costrutto clonato in pFastBac (Baculovir. noi vettore di espressione) B. Due fasi affinità purificazione di GST-Rec14-His dal Sf9 lisato solubile:.-GST vincolante, seguita da prescissione scissione del GST,-Talon vincolanti e eluizione con imidazolo Clicca qui per ingrandire la figura .
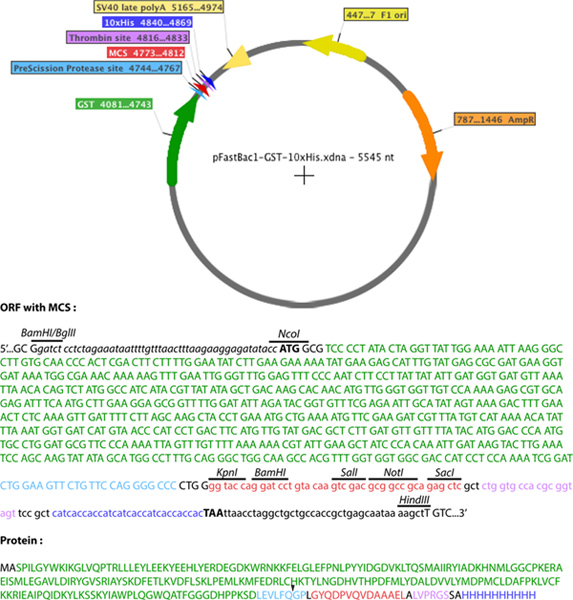
Figura 2. Rappresentazione schematica di pFastBac1-GST-10xHis. GST (verde), sito proteasi prescissione (azzurro), il sito multicloning (rosso), e il 10-His tag (blu scuro) vengono visualizzati. In caso inferiore sono le sequenze nucleotidiche provenienti da PET-52b (+). Clicca qui per ingrandire la figura .
together.within-page = "always"> 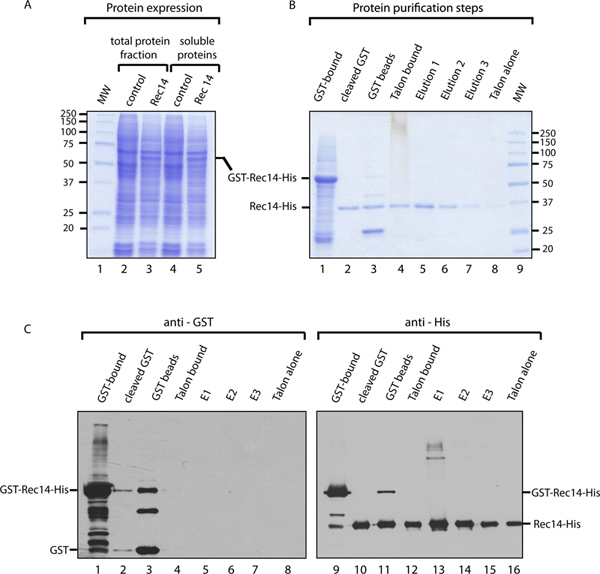
Figura 3. Risultato esemplare di GST-His purificazione di Rec14. A. Coomassie colorazione della frazione proteine totali (corsia 2 e 3) e lisato cellulare solubile (corsia 4 e 5) a partire da cellule Sf9 mock-trattati (corsia 2 e 4) o infettato con GST-Rec14-I suoi baculovirus (corsia 3 e 5). Rec14-His e GST possedere un peso molecolare di circa 32,9 kDa e 29 kDa, rispettivamente, e la-Rec14-His GST proteina di fusione ha un peso molecolare di circa 61,9 kDa. B. colorazione Coomassie dimostrando ogni passo del metodo di purificazione della proteina (per dettagliate vedere la procedura spiegazione) C. Western Blot delle frazioni seguendo la procedura di purificazione con l'anti-GST (corsia 1 a 8) e anti-suoi anticorpi (corsia 9 a 16).upload/50320/50320fig3large.jpg "target =" _blank "> Clicca qui per ingrandire la figura.
Discussione
Il GST-His protocollo di purificazione qui presentato è adatto per la purificazione di una vasta gamma di dimensioni di proteine ricombinanti: Abbiamo purificati successo Li RAD51 (41kDa), piBRCA2 (120kDa), PALB2 (130kDa), e un alto contenuto di proteine di peso molecolare instabile Leishmania infantum: Li BRCA2 (125kDa) 6,9. Inoltre, le proteine purificate con questo protocollo erano biochimicamente attiva 6. Il successo di questo metodo dipende unicamente dalla espressione, solubilità e stabilità della proteina desiderata.
Vettori di biologia molecolare per l'espressione in altri host, come E. coli o lievito, possono essere facilmente modificati utilizzando il GST ampiamente disponibile e le sue etichette. Questo evidenzia l'applicabilità e la costo-efficacia della presente tecnica per la maggior parte dei laboratori di biologia molecolare. Una serie di vantaggi influenzato la nostra decisione di scegliere cellule infette su cellule batteriche o di mammiferi per recombinant espressione e purificazione di proteine. Ad esempio, le modifiche post-traduzionali come metilazione, fosforilazione e ubiquitinazione possono influenzare fortemente la funzione enzimatica di una proteina 10. Quindi, per studiare le proprietà fisiologiche di una proteina, è favorevole utilizzare un sistema che permette di modificazione post-traslazionale, come le cellule Sf9 infettate. Un altro vantaggio di usare Sf9 su cellule di mammifero, ad esempio, è di natura economica, come il sistema cellula infetta richiede molto meno cellule e nessun metodo di trasfezione costoso rispetto al sistema mammiferi.
La semplicità del metodo presentato consentirà ai ricercatori di ottenere una proteina o complesso proteina in una forma altamente purificata con apparecchiature di laboratorio standard, che è vantaggioso per un laboratorio con attrezzatura minima.
Riconoscimenti
Ringraziamo Anne-Marie Dion-Costa per le discussioni che portano allo sviluppo del metodo. JK e RB sono FQNRT studiosi di dottorato, M.-MG è uno studioso Vanier CIHR, e J.-YM è un ricercatore senior FRSQ. Questo lavoro è stato sostenuto da fondi dalle scienze naturali e ingegneria Research Council di JY. M.
Materiali
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| E.Coli DH10Bac (competent) | Invitrogen | ||
| Bac-to-Bac Baculovirus Expression System | Invitrogen | ||
| Maxi Prep Kit | Qiagen | 12163 | Solution I and II |
| Ultra Pure Bluo-Gal | Gibco (Life) | 15519028 | |
| IPTG | Gibco (Life) | 15529019 | |
| Sf9 infected cells | ATCC | CRL-1711 | |
| PreScission enzyme | GE Healthcare | 27084301 | |
| Grace's infected medium supplemented | Gibco (Life) | 11605-094 | |
| Fetal Bovine Serum characterized | Hyclone | SH30396.03 | |
| P/S (Penicillin-Streptomycin) | Gibco (Life) | 15070-063 | |
| Glutathione Sepharose resin | GE bioscience | 17075605 | |
| Protease inhibitor cocktail | Roche | 11873580001 | |
| Talon resin | Clontech | 635504 | |
| Imidazole | BioShop | 288324 | |
| Gentamicin | Gibco (Life) | 15710064 | |
| Polyclonal GST-antibody | Production in house | ||
| Monoclonal 6X-His-antibody | Clontech | 631212 | |
| EQUIPMENT | |||
| Dounce homogenizer (tight) | Wheaton | 357546 | |
| Sonicator (Fisher dismembrator) | Fisher | Model 150 | |
| Dialysis bag (50 mm) | Fisher Scientific | 2115217 | |
Riferimenti
- Lichty, J. J., Malecki, J. L., Agnew, H. D., Michelson-Horowitz, D. J., Tan, S. Comparison of affinity tags for protein purification. Protein Expr. Purif. 41, 98-105 (2005).
- Thain, A., Gaston, K., Jenkins, O., Clarke, A. R. A method for the separation of GST fusion proteins from co-purifying GroEL. Trends Genet. 12, 209-210 (1996).
- Carr, S., et al. Expression of a recombinant form of the V antigen of Yersinia pestis, using three different expression systems. Vaccine. 18, 153-159 (1999).
- Armisen, P., et al. Selective adsorption of poly-His tagged glutaryl acylase on tailor-made metal chelate supports. J. Chromatogr. A. 848, 61-70 (1999).
- Kuhn, S., Zipfel, P. F. The baculovirus expression vector pBSV-8His directs secretion of histidine-tagged proteins. Gene. 162, 225-229 (1995).
- Buisson, R., et al. Cooperation of breast cancer proteins PALB2 and piccolo BRCA2 in stimulating homologous recombination. Nat. Struct. Mol. Biol. 17, 1247-1254 (2010).
- Filimonova, M. N., et al. Isoforms of Serratia marcescens nuclease. The role of Mg2+ in the hydrolysis mechanism. Biochemistry. 62, 983-988 (1997).
- Thorslund, T., et al. The breast cancer tumor suppressor BRCA2 promotes the specific targeting of RAD51 to single-stranded DNA. Nat. Struct. Mol. Biol. 17, 1263-1265 (2010).
- Genois, M. M., et al. Interactions between BRCA2 and RAD51 for promoting homologous recombination in Leishmania infantum. Nucleic Acids Res. 40, 6570-6584 (2012).
- Shrestha, B., Smee, C., Gileadi, O. Baculovirus expression vector system: an emerging host for high-throughput eukaryotic protein expression. Methods Mol. Biol. 439, 269-289 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon