Method Article
Visualizando bactérias em nematóides por microscopia de fluorescência
Neste Artigo
Resumo
Para estudar o mutualismo entre Xenorhabdus Bactérias e Steinernema Nemátodos, foram desenvolvidos métodos para monitorizar a presença de bactérias e localização no interior de nemátodos. A abordagem experimental, a qual pode ser aplicada a outros sistemas, implica bactérias engenharia para expressar a proteína fluorescente verde e visualização, por meio de bactérias de microscopia de fluorescência dentro do nemátodo transparente.
Resumo
Simbioses, a convivência de dois ou mais organismos, são comuns em todos os reinos da vida. Como dois dos organismos mais ubíquos na Terra, nemátodos e bactérias formam uma grande variedade de associações simbióticas que vão desde benéfico para patogénico 1-3. Uma associação como é o relacionamento mutuamente benéfico entre as bactérias e nematóides Steinernema Xenorhabdus, que emergiu como um sistema modelo de simbiose 4. Nematóides entomopatogênicos Steinernema são, usando seu simbionte bacteriano para matar insetos 5. Para a transmissão entre os hospedeiros de insetos, as bactérias colonizam o intestino do nematóide juvenil fase infecciosa 6-8. Recentemente, várias outras espécies de nematóides foram mostrados para utilizar as bactérias para matar insectos 9-13, e começaram investigações examinar as interacções entre os nemátodos e bactérias nestes sistemas <sup> 9.
Descreve-se um método para a visualização de um simbionte bacteriano dentro ou sobre um hospedeiro de nematóides, tirando partido da transparência óptica de nemátodos, quando vistas através de microscopia. As bactérias são manipuladas para expressar uma proteína fluorescente, permitindo a sua visualização por microscopia de fluorescência. Estão disponíveis muitos plasmídeos que transportam genes que codificam proteínas que fluorescem a diferentes comprimentos de onda (ou seja, verde ou vermelha), e de conjugação de plasmídeos a partir de uma estirpe de Escherichia coli doador em um receptor symbiont bacteriana é bem sucedida para uma ampla gama de bactérias. Os métodos descritos foram desenvolvidos para investigar a associação entre Steinernema carpocapsae e nematophila Xenorhabdus 14. Métodos semelhantes têm sido utilizados para investigar outros nematóides bactéria associações de 9, 15-18 e, portanto, o método é geralmente aplicável.
O Method permite a caracterização da presença de bactérias e de localização dentro de nemátodos em diferentes fases de desenvolvimento, proporcionando insights sobre a natureza da associação e do processo de colonização 14, 16, 19. A análise microscópica revela tanto a frequência dentro de uma população de colonização e localização de bactérias aos tecidos do hospedeiro 14, 16, 19-21. Esta é uma vantagem sobre os outros métodos de monitorização de bactérias dentro das populações de nematóides, tais como a sonicação ou a trituração 22 23, o qual pode fornecer níveis médios de colonização, mas não pode, por exemplo, discriminar populações com uma alta frequência de baixa carga simbióticas de populações com uma baixa freqüência de cargas simbióticas elevados. Discriminando a freqüência ea carga de bactérias colonizadoras pode ser especialmente importante quando a seleção ou caracterização de bactérias mutantes para os fenótipos de colonização 21, 24. Com efeito, a microscopia de fluorescência tem sido utilizada na pesquisa de alto rendimento de mutantes bacterianos para defeitos de colonização 17, 18, e é menos trabalhosa do que outros métodos, incluindo a sonicação 22, 25-27 e dissecção de nemátodos individuais 28, 29.
Protocolo
1. Construção de uma estirpe bacteriana fluorescente via Conjugação
- Crescer a estirpe receptora (symbiont a ser examinada), e estirpe dadora durante a noite. A estirpe dadora, Escherichia coli, geralmente, deve ser capaz de doar DNA através de conjugação e deve ser transformada com uma. Plasmídeo (Tabela 2), que transporta um gene que codifica uma proteína fluorescente Dependendo do plasmídeo, de uma estirpe ajudante de conjugação também podem ser necessários. Se for assim, esta estirpe deve também ser cultivadas durante a noite. A estirpe dadora e tensão auxiliar devem ser cultivadas com antibióticos para seleccionar para a manutenção do plasmídeo.
- Subcultura do doador, ajudante e estirpes receptoras em nutrientes ricos meios de crescimento que faltam antibióticos em uma proporção de 1:100 da cultura para médio.
- Crescer as culturas à temperatura adequada para cada estirpe, até que eles atinjam mid-log de crescimento fase (OD 600 ~ 0,6). Para Xenorhabdus e E. coli nesta fase de crescimentoth é atingido cerca de 3-4 horas após a repicagem. Isto pode variar dependendo da estirpe, ou em alguns casos o plasmídeo, utilizado.
- Misturar as estirpes num tubo de microcentrifugação e centrifugar durante 2 minutos a 17900 xg (13000 rpm, na maioria dos microfuges). A proporção do dador e do receptor que produz melhores resultados irão variar para diferentes combinações, e pode ter que ser determinadas empiricamente. Para um destinatário Xenorhabdus e E. doador coli, usamos um 3:1 ou 1:1. Se uma tensão auxiliar é necessária (por exemplo, E. coli), que deve ser adicionada na mesma proporção que o doador.
- Decantar o sobrenadante.
- Re-suspender o sedimento celular em 30 ul de meio fresco.
- Detectar a suspensão sobre uma placa de meio nutriente rico sem quaisquer antibióticos, e permitir que o local para secar.
- Incubar a placa, invertido, durante a noite a uma temperatura óptima para a bactéria receptora e admissível do doador (e auxiliar, se for o caso). A placa deveser incubado, pelo menos, 18 horas.
- Raspe a mancha e raia para colónias isoladas em uma placa seletivo antibiótico. Os antibióticos devem seleccionar contra o dador e para o receptor contendo o plasmídeo. Uma ou duas faixas de isolamento adicional pode ser necessário isolar uma cultura pura.
- Assegurar as colónias resultantes são simbiontes do destinatário, e não a estirpe doadora, por rastreio quanto à presença de fenótipos receptores específicos, tais como morfologia das colónias, ou detecção de PCR de genes específicos de receptor. Rastrear as colónias para a presença do plasmídeo por reacção de polimerização em cadeia de uma sequência conhecida do plasmídeo e de fluorescência. As colónias devem fluorescência sob o comprimento de onda correcto correspondente à proteína fluorescente.
2. Produção de ovos de nematóides axênicas
- Crescer 5 ml do simbionte bacteriano natural durante a noite. Para iniciar uma cultura, as bactérias podem ser inoculadas em lisogenia Broth (LB) ou cu outrosLTURE mídia diretamente de um estoque congelador ou de uma placa de raia.
- Espalhar 600 ul da cultura bacteriana para 10 milímetros Lipid Agar (LA) placas 29. Oito a dez placas produzirá nemátodos suficiente para a maioria das espécies.
- Incubar no escuro, sem humidade, a 25 ° C durante dois dias.
- Adicionar 5000 nemátodos infective juvenil, ou outras fases, dependendo do nemátodo ser utilizado, em 500 ul de meios de comunicação para os relvados bacterianas. Incubar as placas a 25 ° C durante 3 dias.
- Verifique se o seu placas para a presença de nematóides adultos e ovos. Colocar 20 uL de água sobre uma lâmina de microscópio. Usando uma vara estéril scrape-se uma pequena quantidade de nemátodos a partir da camada bacteriana. Coloque a vara para a água e permitem que os nemátodes para nadar. Olhe para o seu slide em pequeno aumento. Para mais informações sobre a aparência ver a discussão e Figura 2.
- Se os ovos e as fêmeas são visíveis, continuar, caso contrário, incubar as placas a 25 & dpor exemplo, C e verificar para o desenvolvimento adequado a cada hora 6-12. Quando as fêmeas contêm ovos, colocar alguns ml de água sobre a superfície das placas. Agite cuidadosamente as placas e despeje a água em um tubo de 50 ml cônico. Nematóides deve soltar-se das placas e deixa de estar visível na superfície da placa. Várias lavagens podem ser necessárias.
- Permitir que os nemátodos se depositem no fundo do tubo.
- Enxaguar nematóides. Pipetar o excesso de água a partir da parte superior do tubo. Encher com água limpa e deixar nematóides adultos para resolver. Pipetar o excesso de água.
- Encha os tubos cônicos com solução ovo. Assim solução ovo é adicionado o tempo de todas as etapas com a solução ovo deve proceder exatamente como descrito para produção de ovos máximo. Incubar os tubos enquanto agitando por exatamente 10 minutos. A maioria dos nematóides deve ser dissolvida no final da incubação.
- Imediatamente centrifugar os tubos cónicos a 1250 xg, durante exactamente 10 min (o que inclui o trazer até a velocidade de centrifugaçãomas não para baixo como 0 x g. Use o freio).
- Decantar o sobrenadante.
- Imediatamente re-suspender o sedimento com uma solução de ovo por pipetagem.
- Imediatamente preencher tubo cônico com solução de ovo e misture bem, invertendo 3-5 vezes. Então, imediatamente, girar como em 2.10.
- Decantar o sobrenadante.
- Re-suspender o sedimento em LB por pipetagem, transferir para um tubo cónico de 15 ml de granulação melhorada durante as etapas de lavagem. LB é um padrão para Steinernema spp. Outros tampões (por exemplo, um meio de sais mínimo) pode ser utilizado, dependendo do nemátodo e bactéria, tendo em mente o tampão não deve prejudicar tanto o nemátodo ou uma bactéria.
- Encha o tubo com LB e rotação como em 2.10.
- Decantar o sobrenadante e re-suspensão em LB.
- Enxaguar os nemátodos com um total de 3 vezes, repetindo 2.14 e 2.15.
- Diluir os ovos re-suspensão de nemátodes para um volume apropriado. Deve haver, pelo menos, 10 ovos por microlitro. Por exemplogs podem ser armazenadas numa caixa de Petri de 6 cm em 5 ml de LB durante pelo menos quatro dias por adição de antibióticos que inibem o crescimento de bactérias colonizadoras e envolvendo o prato em parafilme. Os ovos terá de ser lavado uma vez em 15 ml de LB (como em 2.13 e 2.14) antes da inoculação em relvados bacterianas. Note-se que os ovos eclodem durante este tempo e não podem ser sincronizados developmentally quando utilizados em ensaios de colonização.
3. Ensaio de co-cultivo com bactérias fluorescentes
- Crescer bactérias fluorescentes durante a noite, a selecção para o plasmídeo, se necessário.
- Espalhar 600 ul da cultura bacteriana para 10 milímetros placas de Ágar de lípidos com uma vara estéril. Incubar a 25 ° C durante 2 dias.
- Lugar 500-5,000 ovos de nematóides axênicas em um total de 100 a 400 ul (2,000 optimamente nematóides em 200 ul) em cada placa de agar de lípidos.
- Incubar no escuro, sem umidade a 25 ° C até JIs, ou outras etapas do formulário de interesse. JIs será visível como uma fuanel branco zzy na borda do prato. Olhar para outras fases da vida, ver o Protocolo 4.
- Colocar as placas em uma armadilha branco modificado 30. Remover a tampa da placa de agar de lípidos e colocar a parte inferior para a parte inferior de um vazio 100 milímetros x 20 mm de prato de Petri. Encher a caixa de Petri grande, com água, ou outro tampão apropriado para o seu nemátodo, a rodear a pequena placa. O nível de água deve ser de cerca de metade da altura da pequena placa.
- Incubar a armadilha de água até JIs progênie surgiram no buffer.
- Nemátodos juvenis infecciosos podem ser armazenadas em água, num balão de cultura de tecidos.
4. Recolha de fases iniciais de vida para Triagem
- Use os passos 3.1 a 3.4 para configurar o ensaio.
- Incubar as placas até que as fases de vida desejados estão presentes. Inspecção visual diária pode ser necessário determinar o timing. Para inspecionar as placas, utilize o procedimento descrito no protocolo 2.5. Para S. carpocapsae eggsgrown com X. nematophila em placas de LA, fêmeas grávidas estará presente em 4-5 dias, juvenis estará presente em 7 dias, e juvenis infectantes vai começar a ser produzida por 15-17 dias.
- Quando as fases da vida desejadas estão presentes, recolher a sua amostra. Encher um poço de uma placa de 96 poços com 200 ul de PBS ou outro tampão apropriado. Raspe fora algum do gramado bacteriana que contém nematóides. A quantidade do tamanho de ervilha (~ 50 mg) irá fornecer, pelo menos, várias centenas de nemátodos vez descendência F1 são produzidos, mas pode ser necessário mais para momentos anteriores. Coloque a vareta no buffer assim que o contém.
- Incubar por 30 segundos a um minuto. Retire o pau e raspe o resíduo restante. Use a vara para remover qualquer agar a partir do poço. Os nematodes deve ser visível no interior do tampão. Movimentar a mistura de tampão para um tubo de microcentrífuga limpo.
- Trate os nematóides com levamisol ou outro agente paralisante. Dissolver alguns grãos de levamisol em 30 & mu; L de água. Adicionar 1-2 ul desta mistura para cada um 50 ul de amostra. Após o tratamento com levamisole os nemátodos serão não-viáveis.
- Se as amostras será visto posteriormente, fixar, tal como descrito neste passo. Se não, pule para o passo 4.6. Adicionar 200 ul de solução fixadora contendo 1X tampão e paraformaldeído a 4%. Misture delicadamente, pipetagem pode causar fases da vida delicados para lisar. Cubra com folha e incube à temperatura ambiente num agitador de baixo, pelo menos, 18 horas.
- Colocar os tubos num suporte de tubos, e permitir que os nemátodos se depositem no fundo do tubo.
- Enxaguar nemátodos para remover o fundo. Pipetar fora o excesso de líquido e adicione 200-500 ul de tampão e misturar suavemente. Repetir. Isto pode ser repetido várias vezes para remover mais fundo, se desejado.
- Permitir que os nemátodos se depositem no fundo do tubo e suspender novamente no volume desejado.
- Se os nemátodes não são fixos tela, imediatamente. Nematóides fixas podem ser armazenadas no frigorífico durantea duas semanas. Armazenar no escuro.
5. Nematóides de triagem para Associação bacteriana por Microscopia
- Seleccionar alguns nematóides para ver sob o microscópio através da remoção de uma pequena amostra de sua mistura.
- Para garantir que os nemátodos são ainda para a imagem, tratar com um agente paralisante, conforme descrito no protocolo 4.5. Se você não estiver tirando uma foto ou os nematóides já estão corrigidos, este passo pode ser ignorado.
- Adicionar 20-30 ul de nematóides em água para a sua lâmina de microscópio e uma lamela por cima.
- Ver nematóides inteiros, utilizando microscopia de luz para garantir os nemátodos estão no campo de visão.
- Ver nemátodos usando a configuração no microscópio de fluorescência, que corresponde à fluorescência expressa pelas bactérias.
- Para identificar a localização bacteriana, tirar fotos do nematóide, em configuração fluorescente e um cenário de microscopia de luz, e em seguida sobrepor as imagens. As fotos precisam ser do mesmo field de vista. Pode ser necessário tentar várias ampliações e vistas do nemátodo de encontrar as bactérias.
- A distribuição de colonização nemátodo pode ser quantificada por meio da contagem de uma população de nematóides, para marcar a presença ou ausência de bactérias, e calculando a percentagem colonizado. Recomendamos a contagem até que pelo menos 30 nemátodos dentro da população são contados em cada uma das categorias (com ou sem a colonização), para obter um valor de confiança.
- Quando apenas uns poucos nemátodos na população são colonizados, pode ser necessário dispor vários milhares de nemátodos Antes de 30 são observados. Para alto rendimento contagem utilize os seguintes passos.
- Em vez de contar os nemátodes individualmente aliquota, a população em uma placa de multi-poços (por exemplo, uma placa de 24 cavidades). Após os nematóides foram para o fundo do prato, cada cavidade podem ser digitalizados no microscópio e o número de nemátodos colonizadas podem ser marcados.
- O número total de nemátodos ind população pode ser identificado por diluições em série de nematóides no poço. Por exemplo, 1 ml de nemátodos podem ser adicionados a um poço, misturou-se bem, por agitação com uma ponta de pipeta, e 3 ul podem ser retirados e contados para a quantificação da população total no poço.
- A percentagem de nemátodos colonizadas podem ser obtidos através da divisão do número colonizado pelo número total de nemátodos no poço.
6. Resultados representativos
Exemplo, imagens de microscopia de nemátodos Steinernema associados com bactérias Xenorhabdus são mostrados na Figura 3. Para criar a imagem composta visto na Figura 3A, uma imagem de contraste de fase foi sobreposto com uma imagem de fluorescência. A seta na Figura 3A indica as bactérias presentes no interior do nemátodo infective juvenile (barra = 100 um). Figura 3B foi construído de uma forma semelhante e descreve um nematóide juvenil wiTH Green bactérias proteínas fluorescentes marcados (barras verdes) localizadas ao longo do lúmen nematóides intestinais (barra = 20 um). Uma população de nematóides de dois meios foram contados e marcados para a colonização por bactérias simbiontes (Tabela 1). Para dados estatísticos robustos, é melhor para contar pelo menos 100 nematóides por exemplo com pelo menos 30 a cair em cada categoria. Como pode ser visto na Tabela 1, estes nemátodos são colonizados a um nível de cerca de 14,6%, quando cultivada em agar de lípidos e de 68,6% quando cultivadas em agar de rim fígado. Nematóides e outras espécies bacterianas têm sido demonstrado que têm diferentes níveis de colonização. Por exemplo X. nematophila coloniza 99% de S. carpocapsae juvenis infectantes (Martens, 2003) e P. luminescens coloniza 26% de H. juvenis infectantes bacteriophora Ciche (2003).
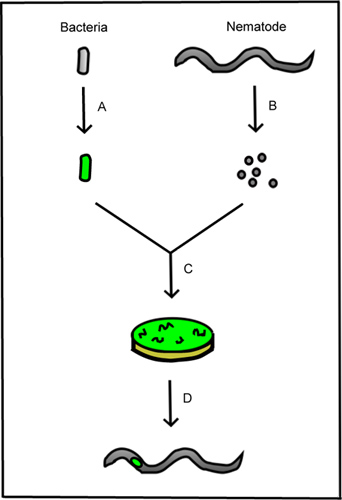
Figura 1. Esboço esquemático do método. A. A bactéria é manipulada para expressar uma proteína fluorescente. Ovos de nematóides B. são isoladas a partir de nemátodos adultos para produzir nemátodos esterilizados. C. Os nemátodos esterilizados são co-cultivadas com as bactérias fluorescentes. D. Os estágios de vida resultantes são vistas sob um microscópio para avaliação da presença de bactérias no interior do nematóide.

Figura 2. Representação de mulheres adultas que contenham ovos. A. O esquema mostra a aparência geral de fêmeas Steinernema. Detalhe: imagem DIC de um S. feltiae gravid fêmea. A seta preta indica a vulva. As setas brancas mostram ovos visíveis. A imagem está com ampliação de 20x, ea barra de escala representa 100 mm. B. imagem DIC de um S. desenvolvido, mas unhatchedfeltiae ovo nematóide. Imagem é a ampliação de 40 vezes, ea barra de escala representa 50 mm. C. imagem DIC de ovos isolados de S. feltiae nematóides com a ampliação de 10X. Barra de escala é 100 mm.

Figura 3. Exemplo imagens de microscopia de nematóide-bacteriana associação. A. S. nematóides puntauvense foram associados com a sua symbiont bacteriana, X. bovienii GFP, expressar. A imagem é uma imagem composta produzida através da sobreposição de uma imagem de contraste de fase com uma imagem fluorescente a partir do mesmo campo de visão. A seta indica o simbionte fluorescente dentro do hospedeiro bacteriano nematóide. Barra de escala representa 100 mm. B. Esta imagem mostra um S. carpocapsae nemátodos juvenis com GFP-expressando X. nematophila localizadas no interior do intestino nematóide.Esta imagem foi construída através da sobreposição de uma imagem sobre uma imagem de fluorescência de contraste de interferência diferencial. A barra de escala representa 20 m.
| Tensão | Número de Nematóides Com acteria | Nematóides total contado | Por cento dos nemátodos olonized |
| S. Agar Lipid puntauvense | 30 | 205 | 14,60% |
| S. puntauvense Agar Fígado Rim | 72 | 105 | 68,60% |
Tabela 1. Scoring exemplo de uma população de nemátodos para presença bacteriana. Nesta experiência, axénica S. nemátodos foram cultivados com puntauvense seu simbionte expressando GFP-em diferentes meios de cultura (agar agar lipídico e fígado, rim 32) para testar quanto a defeitos de colonização. Um total de pelo menos um hundred nematóides por amostra foram contados e marcados para detectar a presença de bactérias. Para poder estatístico, três réplicas experimental deve ser contado com pelo menos 30 nematóides correspondentes a cada categoria.

Tabela 2. Os plasmídeos contendo a proteína fluorescente. Uma lista de potenciais plasmídeos para a inserção de uma proteína fluorescente na symbiont bacteriana é dado listado pelo nome de plasmídeo. Outras informações incluídas são a proteína fluorescente cassete, codificado antibiótico utilizado para a manutenção do plasmídeo, as outras instruções de utilização, a origem do plasmídeo. A concentração indicado entre parênteses é a concentração do antibiótico utilizado para X. nematophila. Cada um destes plasmídeos foi utilizada com sucesso em ambos Xenorhabdus ou Photorhabdus. Informações adicionais podem ser obtidas a partir de citações anotadas. Dependendosobre a bactéria a ser testado, alguns plasmídeos podem não funcionar com base na proteína fluorescente, a selecção de antibiótico, do local de inserção, ou de origem de replicação. Os plasmídeos acima mencionados contêm características diferentes que podem permitir a utilização na bactéria de interesse. Por exemplo, os mini-Tn7-KSGFP insere no sítio attTn7 do cromossoma, enquanto pECM20 insere no X. nematophila cromossoma por recombinação homóloga. Alternativamente, os plasmídeos são mantidos extracromossomicamente pPROBE, e cada pPROBE plasmídeo tem a mesma espinha dorsal e fluoróforo mas têm diferentes marcadores seleccionáveis e origens de replicação que permitem a sua utilização numa variedade de origens taxonómico ou mutantes.
Discussão
O protocolo aqui descrito proporciona um método para a detecção óptica de bactérias dentro de um hospedeiro de nemátodos (Figura 1). Este método tira vantagem da transparência óptica dos nemátodos e a capacidade de bactérias fluorescentes de etiquetas, permitindo a análise in vivo das bactérias dentro do hospedeiro nematóide (Figura 3). Especificamente, esta abordagem identifica a localização de bactérias dentro de seu hospedeiro. Ao contar uma população de nemátodos e pontuação quanto à presença de bactérias, a frequência de colonização bacteriana em toda a população de nemátodos podem ser determinados (Tabela 1). Este método é uma das muitas técnicas possíveis que podem ser utilizados para o estudo das interacções entre os hospedeiros de nematóides e simbiontes bacterianos. Métodos relacionados foram descritos anteriormente para isolar o simbionte bacteriana, nematóides axenically crescer e manipular ambos os parceiros 25-27.
O protocolo descrito here foi desenvolvido no nematophila-Steinernema carpocapsae Xenorhabdus sistema modelo 14, e abordagens semelhantes têm sido utilizados em outros nematóides entomopatogênicos-bacterianas associações 9,15,17,18. Várias condições devem ser atendidas a fim de aplicar este método para outros nematóide-bacterianas sistemas. Em primeiro lugar, o simbionte bacteriana deve ser capaz de ser isolado a partir do hospedeiro e cultivados em cultura de forma independente. Em segundo lugar, o simbionte deve ser capaz de tomar o ADN por meio da transformação ou por conjugação, a fim de introduzir a proteína fluorescente. Em terceiro lugar, para os melhores resultados, o nemátodo deve ter uma fase que pode ser feita axênico e reintroduzida a bactérias. No entanto, mesmo que o nemátodo não podem ser isolados a partir de bactérias, pode ainda ser possível visualizar a associação: em vez de adicionar os ovos axênicas a camada de bactérias fluorescentes, adicionar uma etapa da vida convencionalmente levantada e prosseguir com o protocolo tal como descrito. Qualquer resultado vai sofrer a partir do dia ressalvaa bactérias que não expressam GFP irá competir com as bactérias que expressam GFP-para a localização de tecidos específicos de nematóides, e devido a isso, a colonização não deve ser medida por contagem microscópica. No entanto, a menos que as bactérias que não expressam GFP drasticamente outcompete expressando GFP-bactérias, que expressam GFP bactérias deve localizar a tecidos de nematóides em pelo menos alguns animais na população e sugerir locais de tecidos importantes para a colonização de bactérias. Uma advertência de longa data da utilização de proteínas fluorescentes estirpes que expressam é que eles podem colonizar um hospedeiro com eficácia diferente de uma estirpe que não expressam proteínas fluorescentes (por exemplo, 12).
Passos descritos neste protocolo pode requerer optimização de acordo com o nemátodo e espécies de bactérias que estão a ser utilizados. Para a conjugação da bactéria algumas condições que podem ser alteradas são o comprimento e a temperatura de crescimento, a relação entre o dador até ao receptor e plasmID usado. Exemplos de plasmídeos relevantes estão listados no Quadro 2. Todos estes plasmídeos foram utilizados com sucesso tanto em bactérias ou Xenorhabdus Photorhabdus em associação com o hospedeiro 14,17,20,24,33-35 nematóide. A fim de assegurar a manutenção estável da proteína fluorescente durante a colonização nematóide é melhor utilizar um plasmídeo que será inserido no cromossoma da bactéria alvo. Além disso, algumas bactérias podem não pegar estes plasmídeos. Por exemplo, pECM20 só foi usado em X. nemtaophila e está estreitamente relacionada estirpes bacterianas 14 porque este insere plasmídeo no cromossoma usando uma região homóloga entre o plasmídeo e o cromossoma; plasmídeo não pode ser inserido, se a bactéria alvo não tem essa região. Para usar este plasmídeo por outras bactérias, o X. nematophila específica região deve ser substituído por uma região do genoma da bactéria alvo. Alguns esquemas de transformação de plasmídeo também vai require certas alterações do Protocolo 1. Por exemplo, mini-Tn 7-KSGFP e pBK-miniTn 7-ΩGm-DsRed exigem um plasmídeo ajudante genes de transposição contendo (tsnABCDE) 33,35,36 para inserir no cromossomo bacteriano. A conjugação é mais eficiente com estes Tn 7 baseado plasmídeos, quando duas horas, as culturas (~ 0,3-0,4 OD 600) são misturados em proporções iguais.
Após a conjugação bem sucedida, é importante utilizar correctos correspondentes placas selectivas para o plasmídeo utilizado. As placas selectivas deve conter o antibiótico codificada no plasmídeo para seleccionar para a presença do plasmídeo no receptor e um contador-selecção contra as estirpes dadoras e auxiliar. Por exemplo, quando a conjugação pECM20 em X. nematophila o contador de selecção de ampicilina é usado porque X. nematophila é resistente à ampicilina e a estirpe dadora é sensível a ampicilina. Se a seleção de contra-antibiótico não está disponível em yo nosso sistema, um ácido diaminopimélico (DAP) requerendo doador podem ser usadas. Para crescer DAP-exigindo cepas, o DAP é adicionado ao meio de cultura sólidos e líquidos durante as etapas de conjugação de pré-e conjugação, e omitiu durante contra-selecção etapas. Quando DAP está ausente da estirpe doadora não irão crescer e é eficaz contra-seleccionado.
Para assegurar o isolamento de ovos de sucesso, é essencial para verificar com precisão para a produção de ovos (Figura 2). Na época de isolamento, nematóides femininos deve estar cheio de ovos e ovos devem ser visíveis na mídia (Figura 2A). Se os nemátodos fêmea estão a produzir ovos fertilizados pelo menos alguns ovos sobrenadante terá visivelmente desenvolvido como nemátodos não eclodidos (Figura 2B). Para S. carpocapsae, os ovos irá mudar de esférico para oblongo ligeiramente antes do desenvolvimento de nemátodos e incubação. O momento ou as condições de crescimento nematóide também pode precisar de ser alterada para maximizar óvulo fertilizadorendimento, incluindo encurtar ou alongar o período de tempo antes da colheita de ovos, ou usando meios alternativos adequados para as espécies de nemátodes específicos. No final do isolamento, os ovos devem ser facilmente visíveis dentro da memória tampão (Figura 2C). Parâmetros no protocolo de isolamento de ovos que podem requerer optimização incluem branqueadores e KOH concentrações na solução, o tempo de incubação do ovo em solução de ovo, ou a velocidade de centrifugação. Se o isolamento de ovos de ovos, mas não produz os nemátodos desenvolvem-se durante a co-cultura, é possível que os ovos são isolados não-viáveis. Para verificar a viabilidade, deixar os ovos isolados em tampão e esperar por nematóides para eclodir. Os ovos eclodem deve dentro de um ou dois dias de isolamento e, em seguida, os nemátodos juvenis podem ser utilizados no ensaio de co-cultura. Se os ovos eclodem, mas não desenvolvem durante o ensaio de co-cultivo, pode ser necessário modificar as condições de crescimento ou meio utilizado para a co-cultura. Notamos que Studie anteriors isolaram bactérias livres de nemátodos embebendo os nemátodos em um cocktail de antibióticos (por exemplo, 3,37). A abordagem aqui descrita é livre de algumas das ressalvas de imersão com antibióticos, incluindo as complicações relacionadas com o uso de antibióticos bacteriostáticos, resistentes aos antibióticos bactérias contaminantes, e efeitos antibióticos sobre os nematóides. Certos estágios de nemátodos podem também ser resistentes a antibióticos e mantêm os seus simbiontes bacterianos 3. Finalmente, observa-se que para a microscopia, a concentração de levamisol necessário para a imobilização de nemátodos pode variar com diferentes clades nematóides.
Uma vez que este método tenha sido estabelecido no sistema de interesse, é possível alterar a técnica para obter mais informações. Ao olhar para momentos anteriores do ciclo de vida de nematóides (Protocolo 4), pode ser capaz de identificar como a bactéria e nematóide iniciar sua associação 14,16. Além disso, esta abordagem pode ser usada tó realizar uma alta taxa de transferência telas mutantes para identificar os fatores bacterianos envolvidos na simbiose, usando fluorescência para detectar a colonização 17,18. Outros métodos tais como mutagénese de assinatura com etiquetas exigem o uso de sondas marcadas radioactivamente e é mais demorado 22,28. Portanto, a utilização de microscopia de fluorescência para visualização symbiont bacteriana em nemátodos é uma ferramenta de rastreio eficaz e eficiente para a investigação das interacções bacterianas com um host de nemátodos.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores agradecem a Eugenio Vivas, Kurt Heungens, Eric Martens, Charles Cowles, Darby Açúcar, Eric Stabb, e Todd Ciche por suas contribuições para o desenvolvimento deste protocolo e as ferramentas utilizadas. KEM e JMC foram apoiados pelo National Institutes of Health (NIH) Prêmio Nacional de Serviço de Pesquisa T32 (AI55397 "Micróbios na saúde e na doença"). JMC foi apoiado pela National Science Foundation (NSF) graduação Bolsa de Investigação. Este trabalho foi suportado por concessões do National Science Foundation (IOS-0920631 e IOS-0950873).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| Agar lipídico (Estéril) | 8 gramas de caldo nutriente, 15 gramas de agar de extracto de levedura, 5 gramas de água, 890 ml, 10 ml 0,2 g / ml de MgCl2. 6H 2 0, 96 ml de solução de xarope de milho *, 4 ml de óleo de milho * Mexa mídia ao derramar placas * Adicionar ingrediente estéril após a autoclavagem | ||
| Solução Xarope de milho (Estéril) | 7 ml de xarope de milho, 89 ml de água mistura e autoclave | ||
| Solução ovo | 16,6 ml de hipoclorito de sódio a 12%, 5 ml de KOH 5M, 80 ml de água | ||
| Lisogenia Caldo (Estéril) | 5 gramas de extrato de levedura, triptona 10 gramas, 5 gramas de sal, 1 L de água mistura e autoclave | ||
| Microcentrifugue | Pescador | 13-100-675 | Qualquer microcentrífuga que contém tubos de microcentrífuga funcionará |
| Centrifugador | Beckman | 366802 | Centrífuga de topo grande tabela que contém 15 ml e 50 ml, tubos cónicos |
| Estéril 60 mm x 15 milímetros prato de Petri | Pescador | 0875713 | |
| 50 ml tubos de centrífuga | Pescador | 05-539-6 | |
| 15 ml tubos de centrífuga | Pescador | 05-531-6 | |
| Estéril 100 mm x 20 milímetros prato de Petri | Pescador | 0875711Z | Mais profundo do padrão pratos de Petri |
| Placa de 24 poços | Greiner Bio-One | 662000-06 | |
| Microscópio | O microscópio fluorescente necessita de capacidades compatíveis com o fluoróforo | ||
| Paraformaldeído | Electron Microscopy Sciences | 15710 | |
| PBS (Estéril) | 8 g de NaCl 0,2 g de KCL 1,44 g de Na 2 HPO 4 0,24 g de KH 2 PO 4 1 L de água Ajustar a um pH de 7,4 e 1 L de água a autoclave e | ||
| Tubos de microcentrífuga | Pescador | 05-408-138 | 2 ml ou 1,5 ml tubos |
| Sacudidor | Qualquer agitador que faz com que o líquido se mova suavemente vai trabalhar | ||
| Ácido Diaminopimélico | Sigma | D-1377 | Se for necessário, meios de comunicação para completar uma concentração de 1 mM ou |
Referências
- Holterman, M., van der Wurff, A. Phylum-wide analysis of SSU rDNA reveals deep phylogenetic relationships among nematodes and accelerated evolution toward crown clades. Mol. Biol. Evol. 23, 1792-1800 (2006).
- Lambshead, P. J. D., Boucher, G. Marine nematode deep-sea biodiversity - hyperdiverse or hype. J. Biogeogr. 30, 475-485 (2003).
- Poinar, G. O. J., Thomas, G. M. Significance of Achromobacter nematophilus Poinar and Thomas (Achromobacteraceae: Eubacteriales) in the development of the nematode, DD-136 (Neoaplectana sp. Steinernematidae). Parasitol. 56, 385-390 (1966).
- Herbert, E. E., Goodrich-Blair, H. Friend and foe: the two faces of Xenorhabdus nematophila. Nat. Rev. Microbiol. 5, 634-646 (2007).
- Kaya, H. K., Gaugler, R. Entomopathogenic nematodes. Annu. Rev. Entomol. 38, 181-206 (1993).
- Bird, A. F., Akhurst, R. J. The nature of the intestinal vesicle in nematodes of the family Steinernematidae. Int. J. Parasitol. 13, 599-606 (1983).
- Martens, E. C., Goodrich-Blair, H. The Steinernema carpocapsae intestinal vesicle contains a subcellular structure with which Xenorhabdus nematophila associates during colonization initiation. Cell. Microbiol. 7, 1723-1735 (2005).
- Snyder, H. A., Stock, S. P., Kim, S. K., Flores-Lara, Y., Forst, S. New insights into the colonization and release process of Xenorhabdus nematophila and the morphology and ultrastructure of the bacterial receptacle of its nematode host, Steinernema carpocapsae. Appl. Environ. Microbiol. 73, 5338-5346 (2007).
- Abebe, E., Abebe-Akele, F., Morrison, J., Cooper, V., Thomas, W. K. An insect pathogenic symbiosis between a Caenorhabditis and Serratia. Virulence. 2, 158-161 (2011).
- Abebe, E., Jumba, M. An entomopathogenic Caenorhabditis briggsae. J. Exp. Biol. 213, 3223-3229 (2010).
- Torres-Barragan, A., Suazo, A., Buhler, W. G., Cardoza, Y. J. Studies on the entomopathogenicity and bacterial associates of the nematode Oscheius carolinensis. Biol. Control. 59, 123-129 (2011).
- Ye, W. M., Torres-Barragan, A., Cardoza, Y. Oscheius carolinensis n. sp (Nematoda: Rhabditidae), a potential entomopathogenic nematode from vermicompost. Nematology. 12, 121-135 (2010).
- Zhang, C., Liu, J. Heterorhabditidoides chongmingensis gen. nov., sp. nov. (Rhabditida: Rhabditidae), a novel member of the entomopathogenic nematodes. J. Invertebr. Pathol. 98, 153-168 (2008).
- Martens, E. C., Heungens, K., Goodrich-Blair, H. Early colonization events in the mutualistic association between Steinernema carpocapsae nematodes and Xenorhabdus nematophila bacteria. J. Bacteriol. 185, 3147-3154 (2003).
- Ciche, T. A., Ensign, J. C. For the insect pathogen, Photorhabdus luminescens, which end of a nematode is out. Appl. Environ. Microbiol. 69, 1890-1897 (2003).
- Ciche, T. A., Kim, K. S., Kaufmann-Daszczuk, B., Nguyen, K. C., Hall, D. H. Cell invasion and matricide during Photorhabdus luminescens transmission by Heterorhabditis bacteriophora nematodes. Appl. Environ. Microbiol. 74, 2275-2287 (2008).
- Easom, C. A., Joyce, S. A., Clarke, D. J. Identification of genes involved in the mutualistic colonization of the nematode Heterorhabditis bacteriophora by the bacterium Photorhabdus luminescens. BMC Microbiol. 10, 45(2010).
- Somvanshi, V. S., Kaufmann-Daszczuk, B., Kim, K. S., Mallon, S., Ciche, T. A. Photorhabdus phase variants express a novel fimbrial locus, mad, essential for symbiosis. Mol. Microbiol. 77, 1021-1038 (2010).
- Martens, E. C., Russell, F. M., Goodrich-Blair, H. Analysis of Xenorhabdus nematophila metabolic mutants yields insight into stages of Steinernema carpocapsae nematode intestinal colonization. Mol. Microbiol. 51, 28-45 (2005).
- Sugar, D. R., Murfin, K. E. Phenotypic variation and host interactions of Xenorhabdus bovienii SS-2004, the entomopathogenic symbiont of Steinernema jollieti nematodes. Env. Microbiol. 14, 924-939 (2012).
- Cowles, C. E., Goodrich-Blair, H. The Xenorhabdus nematophila nilABC genes confer the ability of Xenorhabdus spp. to colonize Steinernema carpocapsae nematodes. J. Bacteriol. 190, 4121-4128 (2008).
- Heungens, K., Cowles, C. E., Goodrich-Blair, H. Identification of Xenorhabdus nematophila genes required for mutualistic colonization of Steinernema carpocapsae nematodes. Mol. Microbiol. 45, 1337-1353 (2002).
- Goetsch, M., Owen, H., Goldman, B., Forst, S. Analysis of the PixA inclusion body protein of Xenorhabdus nematophila. J. Bacteriol. 188, 2706-2710 (2006).
- Bhasin, A., Chaston, J. M., Goodrich-Blair, H. Mutational Analyses Reveal Overall Topology and Functional Regions of NilB, a Bacterial Outer Membrane Protein Required for Host Association in a Model of Animal-Microbe Mutualism. J. Bacteriol. 194, 1763-1776 (2012).
- Ciche, T. A., Goffredi, S. K. Methods in General and Molecular Microbiology. Reddy, C. A. , ASM Press. 394-419 (2007).
- Goodrich-Blair, H., Clarke, D., Grewal, P. S., Ciche, T. A. Insect Pathogens, Molecular Approaches and Techniques. Stock, S. P., Boemare, N., Vandenberg, J., Glazar, I. , CABI Publishing. 239-269 (2009).
- Stock, S. P., Goodrich-Blair, H. Manual of Techniques in Invertebrate Pathology. Lacey, L. A. , Elsevier Press. 375-425 (2012).
- Martens, E. C., Gawronski-Salerno, J. Xenorhabdus nematophila requires an intact iscRSUA-hscBA-fdx locus to colonize Steinernema carpocapsae nematodes. J. Bacteriol. 185, 3678-3682 (2003).
- Vivas, E. I., Goodrich-Blair, H. Xenorhabdus nematophilus as a model for host-bacterium interactions: rpoS is necessary for mutualism with nematodes. J. Bacteriol. 183, 4687-4693 (2001).
- White, G. F. A method for obtaining infective nematode larvae from cultures. Science. 66, 302-303 (1927).
- Ciche, T. A., Ensign, J. C. For the insect pathogen Photorhabdus luminescens, which end of a nematode is out. Appl. Environ. Microbiol. 69, 1890-1897 (2003).
- Sicard, M., Brun, N. L. e Effect of native Xenorhabdus on the fitness of their Steinernema hosts: contrasting types of interaction. Parasitol. Res. 91, 520-524 (2003).
- Lambertsen, L., Sternberg, C., Molin, S. Mini-Tn7 transposons for site-specific tagging of bacteria with fluorescent proteins. Environ. Microbiol. 6, 726-732 (2004).
- Miller, W. G., Leveau, J. H., Lindow, S. E. Improved gfp and inaZ broad-host-range promoter-probe vectors. Mol. Plant Microbe Int. 13, 1243-1250 (2000).
- Teal, T. K., Lies, D. P., Wold, B. J., Newman, D. K. Spatiometabolic stratification of Shewanella oneidensis biofilms. Appl. Environ. Microbiol. 72, 7324-7330 (2006).
- Bao, Y., Lies, D. P., Fu, H., Roberts, G. P. An improved Tn7-based system for the single-copy insertion of cloned genes into chromosomes of Gram-negative bacteria. Gene. 109, 167-168 (1991).
- Woodring, J. L., Kaya, H. K. Steinernematid and Heterorhabditid Nematodes: A Handbook of Biology and Techniques. Southern Cooperative Series Bulletin 331. , Arkansas Agricultural Experiment Station. (1988).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados