Method Article
Visualización de las bacterias en los nematodos mediante microscopía de fluorescencia
En este artículo
Resumen
Para estudiar el mutualismo entre Xenorhabdus Bacterias y Steinernema, se han desarrollado métodos para monitorizar la presencia bacteriana y la ubicación dentro de los nematodos. El enfoque experimental, que se puede aplicar a otros sistemas, implica bacterias de ingeniería para expresar la proteína verde fluorescente y la visualización, utilizando bacterias de microscopía de fluorescencia dentro del nematodo transparente.
Resumen
Simbiosis, la convivencia de dos o más organismos, se han generalizado en todos los reinos de la vida. Como dos de los organismos más ubicuos en la tierra, nematodos y bacterias formar una amplia variedad de asociaciones simbióticas que van desde beneficioso para patógena 1-3. Una de estas asociaciones es la relación de beneficio mutuo entre las bacterias y nematodos Steinernema Xenorhabdus, que ha surgido como un sistema modelo de simbiosis 4. Nematodos entomopatógenos Steinernema son, con su simbionte bacteriano para matar insectos 5. Para la transmisión entre huéspedes de insectos, las bacterias colonizan el intestino de la etapa del nemátodo infectivo juvenil 6-8. Recientemente, varias otras especies de nematodos se ha demostrado que las bacterias utilizan para matar insectos 9-13, y las investigaciones han comenzado a examinar las interacciones entre los nematodos y bacterias en estos sistemas <sup> 9.
Se describe un método para la visualización de un simbionte bacteriano dentro de o en un host nematodo, tomando ventaja de la transparencia óptica de los nematodos cuando se vieron por microscopía. Las bacterias se han diseñado para expresar una proteína fluorescente, lo que permite su visualización por microscopía de fluorescencia. Se dispone de muchos plásmidos que llevan los genes que codifican proteínas que presentan fluorescencia a longitudes de onda diferentes (es decir, verde o rojo), y la conjugación de los plásmidos procedentes de una cepa de Escherichia coli donante en un receptor simbionte bacteriano tiene éxito para una amplia gama de bacterias. Los métodos descritos se han desarrollado para investigar la asociación entre Steinernema carpocapsae y Xenorhabdus nematophila 14. Métodos similares se han utilizado para investigar otros bacteria nematodos asociaciones 9, 15-18 y por lo tanto, el enfoque es en general aplicable.
El METhod permite la caracterización de la presencia bacteriana y la localización dentro de los nematodos en diferentes etapas de desarrollo, y proporciona información sobre la naturaleza de la asociación y el proceso de colonización 14, 16, 19. El análisis microscópico revela tanto la frecuencia de colonización dentro de una población y la localización de las bacterias a los tejidos del huésped 14, 16, 19-21. Esto es una ventaja sobre otros métodos de seguimiento de las bacterias dentro de las poblaciones de nematodos, tales como sonicación 22 o molienda 23, que puede proporcionar los niveles medios de la colonización, pero no puede, por ejemplo, discriminar poblaciones con una alta frecuencia de bajas cargas simbiontes de poblaciones con una baja frecuencia de las cargas simbiontes altas. La discriminación de la frecuencia y de la carga de bacterias colonizadoras puede ser especialmente importante en el cribado o la caracterización de mutantes bacterianos para fenotipos colonización 21, 24. En efecto, la microscopía de fluorescencia se ha utilizado en el cribado de alto rendimiento de mutantes bacterianos de los defectos de colonización 17, 18, y es menos laborioso que otros métodos, incluyendo la sonicación 22, 25-27 y disección nematodos individuales 28, 29.
Protocolo
1. Construcción de una cepa bacteriana fluorescente mediante conjugación
- Crece la cepa receptora (simbionte para ser examinadas) y la cepa donante durante la noche. La cepa donante, generalmente Escherichia coli, debe ser capaz de donar ADN a través de la conjugación y deben transformarse con un. Plásmido (Tabla 2) que lleva un gen que codifica una proteína fluorescente Dependiendo del plásmido, una cepa auxiliar conjugación también puede ser necesaria. Si es así, esta cepa también se cultivaron durante la noche. La cepa donante y la tensión auxiliar debería ser cultivadas con antibióticos para seleccionar para el mantenimiento del plásmido.
- Subcultivar el donante, ayudante, y cepas receptoras en nutrientes ricos en medios de cultivo que carecen de antibióticos en una proporción de 1:100 de la cultura al medio.
- Crecer los cultivos a la temperatura apropiada para cada cepa hasta que llegan a mediados de registro de la etapa de crecimiento (OD 600 ~ 0,6). Para Xenorhabdus y E. coli esta etapa de crecimientoth se alcanza aproximadamente de 3 a 4 horas después de subcultivo. Esto puede variar dependiendo de la cepa, o en algunos casos el plásmido utilizado,.
- Mezclar las cepas en un tubo de microcentrífuga y se centrifuga durante 2 min a 17.900 xg (13.000 rpm en la mayoría de microfuges). La proporción de donante y el receptor que produce los mejores resultados pueden variar para diferentes combinaciones, y pueden tener que ser determinado empíricamente. Para que un destinatario Xenorhabdus y E. donante coli, se utiliza un ratio de 3:1 o 1:1. Si una cepa auxiliar que se necesita (por ejemplo, E. coli), se debe añadir en la misma proporción que el donante.
- Decantar el sobrenadante.
- Se resuspende el sedimento celular en 30 l de medio fresco.
- Detectar la suspensión en un plato nutritivo multimedia sin ningún tipo de antibióticos, y permitir que la mancha se seque.
- Incubar la placa, invertida, durante la noche a una temperatura óptima para la bacteria receptora y permisible para el donante (y ayudante, si es aplicable). La placa deberíase incubaron al menos 18 h.
- Raspar el punto y raya de colonias individuales en una placa antibiótico selectivo. Los antibióticos se deben seleccionar contra el donante y para el receptor que contiene el plásmido. Uno o dos rayas adicionales de aislamiento puede ser necesario aislar un cultivo puro.
- Asegúrese de que las colonias resultantes son el simbionte receptor, y no la cepa donante, por la detección de la presencia de receptores fenotipos específicos, tales como morfología de la colonia, o reacción en cadena de polimerasa detección de genes específicos-receptor. Cribar las colonias para la presencia del plásmido mediante la reacción en cadena de polimerasa de una secuencia conocida plásmido y fluorescencia. Las colonias deben fluorescencia bajo la longitud de onda correcta correspondiente a la proteína fluorescente.
2. La producción de huevos de nematodos axénicos
- Crecer 5 ml del simbionte bacteriano natural durante la noche. Para iniciar un cultivo, las bacterias pueden ser inoculadas en Lisogenia Broth (LB) o Cu otrasmedios de comunicación lture directamente de una acción o de un congelador de placa racha.
- Corre 600 l del cultivo bacteriano en 10 mm de lípidos Agar (LA) placas 29. De ocho a diez placas dará nematodos suficientes para la mayoría de las especies.
- Incubar en la oscuridad sin humedad a 25 ° C durante dos días.
- Añadir 5.000 nematodos infectivos juveniles, u otras etapas en función del nematodo se utiliza, en 500 l de medios de comunicación a los céspedes bacterianos. Incubar las placas a 25 ° C durante 3 días.
- Revise sus placas para determinar la presencia de nematodos adultos y huevos. Colocar 20 l de agua en un portaobjetos de microscopio. Usando un palillo estéril rascado-up una pequeña cantidad de nematodos desde el césped bacteriano. Coloque la barra en el agua y permitir que los nematodos a nadar fuera. Mira a tu diapositiva con una lupa bajo. Para obtener más información sobre la aparición ver la discusión y la Figura 2.
- Si los huevos y las hembras son visibles, continuar, de lo contrario, incubar las placas a 25 & dpor ejemplo, C y comprobar para el desarrollo adecuado cada hora 6-12. Cuando las hembras contienen huevos, colocar unos pocos ml de agua en la superficie de las placas. Agite suavemente las placas y vierta el agua en un tubo cónico de 50 ml. Los nematodos debe salir de las placas y ya no será visible en la superficie de la placa. Varios enjuagues puede ser necesario.
- Permitir que los nematodos se depositen en el fondo del tubo.
- Enjuague nematodos. Pipetear el exceso de agua desde la parte superior del tubo. Vuelva a llenar con agua limpia y dejar nematodos adultos se asiente. Pipetear el exceso de agua.
- Llenar los tubos cónicos con solución de huevo. Una vez que la solución de huevo se añade la sincronización de todos los pasos con solución huevo debe continuar exactamente como se describe para el rendimiento máximo de huevo. Incubar los tubos mientras agitando suavemente durante exactamente 10 min. La mayoría de los nematodos debe ser disuelto por el final de la incubación.
- Inmediatamente centrifugue los tubos cónicos a 1250 xg durante exactamente 10 minutos (esto incluye traer la centrífuga a la velocidadpero no a 0 x g. Utilice el freno).
- Inmediatamente decantar el sobrenadante.
- Inmediatamente vuelva a suspender el pellet con solución huevo al vaso.
- Inmediatamente llenar tubo cónico con una solución de huevo y mezclar bien mediante la inversión de 3-5 veces. Inmediatamente después, girar como en 2.10.
- Inmediatamente decantar el sobrenadante.
- Se resuspende el precipitado en LB pipeteando, transferir a un tubo cónico de 15 ml por granulación mejorada durante los pasos de lavado. LB es estándar para Steinernema spp. Otros tampones (por ejemplo, un medio mínimo de sales) se pueden utilizar dependiendo de la bacteria y nematodos, teniendo en cuenta el tampón no debe dañar ya sea el nematodo o bacteria.
- Llenar el tubo con LB y vuelta como en 2.10.
- Decantar el sobrenadante y volver a suspender en LB.
- Enjuagar los nematodos un total de 3 veces mediante la repetición de 2,14 y 2,15.
- Diluir los huevos de nematodo re-suspendido a un volumen apropiado. Debe haber al menos 10 huevos por microlitro. Por ejemplo:gs se pueden almacenar en un plato de Petri de 6 cm en 5 ml de LB durante al menos cuatro días mediante la adición de antibióticos que inhiben el crecimiento de bacterias colonizadoras y envolver la placa en parafilm. Los huevos deben ser lavados una vez en 15 ml de LB (como en 2,13 y 2,14) antes de inocular en los céspedes bacterianos. Tenga en cuenta que los huevos se incuban durante este tiempo y no se pueden sincronizar de desarrollo cuando se utiliza en ensayos de colonización.
3. Co-cultivo de ensayo con bacterias fluorescentes
- Crecer bacterias fluorescentes durante la noche, la selección para el plásmido si es necesario.
- Corre 600 l del cultivo bacteriano en placas de agar 10 mm de lípidos con un palillo estéril. Incubar a 25 ° C durante 2 días.
- Place 500-5.000 huevos de nematodos axénicos en un total de 100 a 400 l (óptimamente 2.000 nematodos en 200 l) a cada placa de agar de lípidos.
- Incubar en la oscuridad, sin humedad a 25 ° C hasta IJs, o etapas de interés, la forma. IJs será visible como una fuZZY anillo blanco en el borde de la placa. Para ver otras etapas de la vida, véase el Protocolo 4.
- Colocar las placas en una trampa modificada Blanco 30. Retirar la tapa de la placa de agar de lípidos y coloque la parte inferior en la parte inferior de un vacío 100 mm x 20 mm placa de Petri. Llene la gran placa de Petri con agua, u otro tampón apropiado para su nematodo, para rodear el plato pequeño. El nivel de agua debe ser aproximadamente la mitad de la altura de la placa pequeña.
- Incubar la trampa de agua hasta IJs progenie han surgido en el búfer.
- Nematodos juveniles infecciosos se pueden almacenar en agua en un matraz de cultivo de tejidos.
4. Colección de los estados tempranos de detección
- Utilice los pasos 3.1 a 3.4 para establecer el ensayo.
- Se incuban las placas hasta que las etapas de la vida deseados están presentes. Inspección visual diaria puede ser necesario para determinar el tiempo. Para inspeccionar las placas, utilizar el procedimiento descrito en el Protocolo de 2,5. Para S. carpocapsae eggsgrown con X. nematophila en placas LA, hembras grávidas estará presente en 4-5 días, los menores estarán presentes en 7 días, y juveniles infectivos comenzará a ser producido por 15-17 días.
- Cuando las etapas de la vida deseados están presentes, recoger la muestra. Llenar un pocillo de una placa de 96 pocillos con 200 ul de PBS o tampón apropiado. Suavemente raspe un poco del césped bacteriano que contiene los nematodos. Una cantidad pequeña (~ 50 mg) se proporcionan al menos varios cientos de nematodos una vez progenie F1 se producen, pero más puede ser necesario para los puntos de tiempo anteriores. Coloque la barra en el búfer, así que lo contiene.
- Incubar durante 30 segundos a un minuto. Remueva la varilla y raspe el residuo restante. Utilizar el palo para remover cualquier agar del pozo. Los nematodos debe ser visible dentro de la memoria intermedia. Mover la mezcla de tampón a un tubo de microcentrífuga limpio.
- Tratar a los nematodos con levamisol u otro agente paralizante. Disolver unos granos de levamisol en 30 y mu; L de agua. Añadir 1-2 l de esta mezcla para cada 50 l de muestra. Después del tratamiento levamisol los nematodos será no viable.
- Si las muestras se vieron en una fecha posterior, fijar como se describe en este paso. Si no es así, vaya al paso 4.6. Añadir 200 l de solución fijadora que contiene tampón 1X y 4% de paraformaldehído. Mezclar suavemente, pipeteo puede causar etapas delicadas vida para lisar. Cubrir con papel de aluminio, y se incuba a temperatura ambiente en un agitador a temperatura baja durante al menos 18 h.
- Colocar los tubos en una gradilla de tubos, y permitir que los nematodos se depositen en el fondo del tubo.
- Enjuague los nematodos para eliminar el fondo. Pipetear el exceso de líquido y añadir 200 a 500 l de tampón y mezcle suavemente. Repetir. Esto puede repetirse varias veces para eliminar más fondo si se desea.
- Permitir que los nematodos se depositen en el fondo del tubo y volver a suspender en el volumen deseado.
- Si los nematodos no son fijos, pantalla inmediatamente. Nematodos fijos se pueden almacenar en el refrigerador hastaa dos semanas. Almacenar en la oscuridad.
5. Los nematodos de cribado para Asociación bacteriana por Microscopía
- Seleccione algunos nematodos para ver bajo el microscopio mediante la eliminación de una pequeña muestra de la mezcla.
- Para asegurarse de que los nematodos son todavía de la imagen, se trata con un agente paralizante, como se describe en el Protocolo 4.5. Si no va a tomar una foto o los nematodos son fijos ya, este paso puede ser omitido.
- Añadir 20-30 l de nematodos en el agua a su portaobjetos y colocar un cubreobjetos encima.
- Ver nematodos enteros usando microscopía de luz para asegurar los nematodos están en el campo de visión.
- Ver nematodos utilizando el ajuste en el microscopio fluorescente que corresponde a la fluorescencia expresada por la bacteria.
- Para identificar la localización bacteriana, tome fotos del nematodo bajo valor fluorescente y un ajuste de microscopía de luz, y luego superponer las imágenes. Las fotos tienen que ser de la misma field de vista. Puede ser necesario tratar varias ampliaciones y vistas al nematodo de encontrar la bacteria.
- La distribución de la colonización nematodo se puede cuantificar mediante recuento de una población de nematodos, anotando la presencia o ausencia de bacterias, y calculando el porcentaje colonizado. Se recomienda contar hasta al menos 30 nematodos dentro de la población se cuentan en cada categoría (con o sin colonización) para obtener un valor fiable.
- Cuando sólo unos pocos nematodos en la población son colonizados, puede ser necesario contar con varios miles de nematodos antes de 30 se observó. Para alto rendimiento de cómputo utilice los pasos siguientes.
- En lugar de contar los nematodos individualmente, alícuota de la población en una placa de múltiples pocillos (por ejemplo, una placa de 24 pocillos). Después de que los nematodos han depositado en el fondo del plato, cada pocillo se pueden escanear en el microscopio y el número de nematodos colonizados puede ser anotado.
- El número total de nematodos ina población puede ser identificado por diluciones en serie de nematodos en el pozo. Por ejemplo, 1 ml de los nematodos puede ser añadido a un pozo, se mezcló bien por agitación con una punta de pipeta, y 3 l se puede quitar y se contaron para la cuantificación de la población total en el pozo.
- El porcentaje de nematodos colonizados se puede obtener dividiendo el número colonizados por el número total de nematodos en el pozo.
6. Los resultados representativos
Ejemplo, imágenes de microscopio de nematodos Steinernema asociadas a bacterias Xenorhabdus se muestra en la Figura 3. Para crear la imagen compuesta se ve en la figura 3A, una imagen de contraste de fase se superpone con una imagen fluorescente. La flecha en la Figura 3A indica las bacterias presentes en el nematodo infectivo juvenil (barra = 100 mm). Figura 3B se construyó de una manera similar y muestra un menor nematodo wiTH Green bacterias proteínas fluorescentes etiquetados (barras verdes), situados a lo largo de los nematodos intestinales lumen (barra = 20 micras). Una población de los nematodos de los dos medios se contaron y se obtuvo para la colonización por el simbionte bacteriano (Tabla 1). Para la estadística robusta, lo mejor es contar al menos 100 nematodos por muestra con al menos 30 cae en cada categoría. Como se ve en la Tabla 1, estos nemátodos son colonizados a un nivel de aproximadamente 14,6% cuando se cultiva en agar de lípidos y 68,6% cuando se cultiva en agar hígado riñón. Nematodos y otras especies bacterianas han demostrado tener diferentes niveles de colonización. Por ejemplo X. nematophila coloniza el 99% de S. carpocapsae juveniles infectivos (Martens 2003), y P. luminescens coloniza el 26% de H. bacteriophora juveniles infectivos (Ciche 2003).
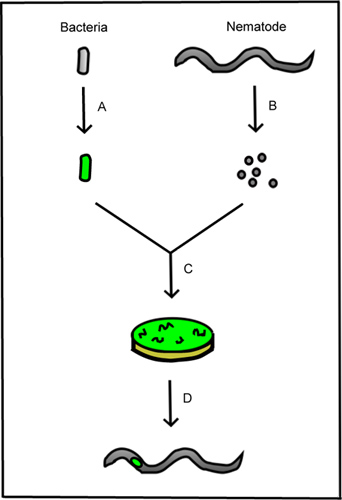
Figura 1. Plan esquemático del método. A. La bacteria está diseñado para expresar una proteína fluorescente. Huevos de nematodos B. están aislados de los nematodos adultos para producir nematodos estériles. C. Los nematodos estériles se co-cultivan con bacterias fluorescentes. D. Las etapas de la vida resultantes se observan bajo un microscopio para evaluar la presencia de bacterias en el nematodo.

Figura 2. Representación de las mujeres adultas que contienen huevos. A. El esquema muestra el aspecto general de las hembras Steinernema. DIC imagen de un S.: Inset feltiae hembras grávidas. La flecha de color negro indica la vulva. Las flechas blancas muestran huevos visibles. La imagen es de 20 aumentos, y la barra de escala representa 100 m. B. DIC imagen de un país desarrollado, pero sin eclosionar S.feltiae huevos de nematodos. La imagen es un aumento de 40X, y la barra de escala representa 50 micras. C. DIC imagen de huevos aislados de S. feltiae nematodos bajo ampliación de 10X. Barra de escala es de 100 m.

Figura 3. Ejemplo de imágenes de microscopio de nematodos-bacterial asociación. A. S. nematodos puntauvense se asociaron con su simbionte bacteriano, X. bovienii, GFP expresando. La imagen es una imagen compuesta producida mediante la superposición de una imagen de contraste de fase con una imagen fluorescente del mismo campo de vista. La flecha indica el simbionte bacteriano fluorescente dentro del huésped nematodos. La barra de escala representa 100 m. B. Esta imagen muestra una S. carpocapsae juvenil nematodos con GFP-expresando X. nematophila localizados en el intestino de nematodos.Esta imagen fue construida a través de la superposición de una imagen fluorescente sobre una imagen de contraste de interferencia diferencial. La barra de escala representa a 20 micras.
| Tensión | Número de nematodos con acteria | Los nematodos totales Contado | El porcentaje de nematodos olonized |
| S. puntauvense Agar lípidos | 30 | 205 | 14,60% |
| S. Hígado Riñón puntauvense Agar | 72 | 105 | 68.60% |
Tabla 1. Ejemplo de puntuación de una población de nematodos para la presencia de bacterias. En este experimento, axénico S. nematodos puntauvense se cultivaron con su simbionte que expresan GFP en diferentes medios de cultivo (agar agar y lípidos del hígado riñón 32) para la prueba de defectos de colonización. Un total de al menos un hundred nematodos por muestra se contaron y se anotó la presencia de bacterias. Para poder estadístico, experimental tres repeticiones se deben contar por lo menos con 30 nematodos que caen en cada categoría.

Tabla 2. Plásmidos que contienen proteína fluorescente. Una lista de los posibles plásmidos para la inserción de una proteína fluorescente en el simbionte bacteriano se da enumeran por nombre de plásmido. Otra información incluida son la proteína fluorescente casete codificado, antibiótico que se usa para el mantenimiento del plásmido, otras instrucciones para el uso, la fuente del plásmido. La concentración se indica en paréntesis es la concentración del antibiótico usado para X. nematophila. Cada uno de estos plásmidos se ha utilizado con éxito en cualquiera de Xenorhabdus o Photorhabdus. Información adicional se puede obtener a partir de las citas indicadas. Dependienteen la bacteria que se prueba, algunos plásmidos pueden no funcionar en base a la proteína fluorescente, selección de antibióticos, sitio de inserción, o el origen de la replicación. Los plásmidos mencionados anteriormente contienen diferentes características que pueden permitir su uso en la bacteria de interés. Por ejemplo, mini-Tn7-KSGFP se inserta en el sitio attTn7 del cromosoma, mientras que pECM20 inserta en la X. nematophila cromosoma por recombinación homóloga. Alternativamente, los plásmidos se mantienen extracromosómicamente pPROBE, y cada pPROBE plásmido tiene el mismo esqueleto y el fluoróforo, pero tienen diferentes marcadores seleccionables o los orígenes de replicación para permitir su uso en una variedad de taxonómica o mutantes antecedentes.
Discusión
El protocolo aquí descrito proporciona un método para la detección óptica de las bacterias dentro de un huésped nematodo (Figura 1). Este método tiene la ventaja de la transparencia óptica de los nematodos y la capacidad de las bacterias de etiquetas fluorescentemente, lo que permite el análisis in vivo de las bacterias dentro del huésped nemátodo (Figura 3). En concreto, este enfoque identifica la localización de bacterias dentro de su huésped. Al contar una población de nematodos y de puntuación para la presencia de bacterias, la frecuencia de colonización bacteriana a través de la población de nematodos se puede determinar (Tabla 1). Este método es uno de las muchas técnicas posibles que se pueden utilizar para el estudio de las interacciones entre los hosts de nematodos y simbiontes bacterianos. Métodos relacionados se han descrito anteriormente para aislar el simbionte bacteriano, nematodos crecer axénicamente, y manipular ambos socios 25-27.
El protocolo descrito here se desarrolló en el sistema de Xenorhabdus nematophila-Steinernema carpocapsae modelo 14, y enfoques similares se han utilizado en otros entomopatógenos bacterianas nematodos asociaciones 9,15,17,18. Varias condiciones deben cumplirse para poder aplicar este método a otras bacterias nematodos sistemas. En primer lugar, el simbionte bacteriano debe ser capaz de ser aislado del huésped y cultivarse en cultivo de forma independiente. En segundo lugar, el simbionte debe ser capaz de captar ADN a través de la transformación o conjugación con el fin de introducir la proteína fluorescente. En tercer lugar, para los mejores resultados, el nematodo debe tener una etapa que se puede hacer axénico y reintroducido en bacterias. Sin embargo, incluso si el nematodo no puede ser aislado de la bacteria que aún podría ser posible visualizar la asociación: en lugar de añadir los huevos axénicas para el césped de bacterias fluorescentes, añadir una etapa de la vida convencionalmente elevado y proceder con el protocolo tal como se describe. Los resultados se verán afectados a partir del día advertenciaen las bacterias que no expresan GFP competirán con las bacterias que expresan GFP-para la localización de los tejidos específicos de nematodos, y debido a esto, la colonización no se debe medir por recuento microscópico. Sin embargo, a menos que las bacterias que no expresan GFP drásticamente outcompete bacterias que expresan GFP, GFP-expresando bacterias debe localizar a los tejidos de nematodos en al menos algunos animales en la población y sugerir sitios importantes para la colonización bacteriana del tejido. Una advertencia de larga data del uso de proteínas fluorescentes cepas que expresan es que pueden colonizar un huésped con una eficacia diferente de una cepa que no expresa las proteínas fluorescentes (por ejemplo, 12).
Los pasos descritos en este protocolo puede requerir optimización en función del nematodo y especies de bacterias que se están utilizando. Para la conjugación de la bacteria algunas condiciones que pueden ser alterados son la longitud y la temperatura de crecimiento, la relación de donante al receptor, y plasmaIdentificación del usado. Ejemplos de plásmidos pertinentes se enumeran en la Tabla 2. Todos estos plásmidos se han utilizado con éxito en tanto de bacterias Xenorhabdus o Photorhabdus en asociación con su anfitrión nematodo 14,17,20,24,33-35. Para garantizar el mantenimiento estable de la proteína fluorescente durante la colonización nematodo lo mejor es utilizar un plásmido que se inserta en el cromosoma de la bacteria diana. Además, algunas bacterias no pueden tomar estos plásmidos. Por ejemplo, pECM20 sólo se ha utilizado en X. nemtaophila y muy estrechamente relacionado con cepas bacterianas 14 porque esto inserta plásmido en el cromosoma utilizando una región homóloga entre el plásmido y el cromosoma, el plásmido no se insertará si la bacteria diana carece de esta región. Para utilizar este plásmido para otras bacterias, la X. nematophila específico de región debe ser sustituido con una región genómica de la bacteria diana. Algunos esquemas de plásmidos de transformación también se rEquire ciertas alteraciones del Protocolo 1. Por ejemplo, mini-Tn 7-KSGFP y pBK miniTn-7-ΩGm-DsRed requieren un plásmido auxiliar que contienen genes de transposición (tsnABCDE) 33,35,36 para insertar en el cromosoma bacteriano. La conjugación es más eficiente con estos plásmidos Tn 7 basada, cuando 2-hora cultivos (OD 600 ~ 0,3 a 0,4) se mezclan en proporciones iguales.
Después de conjugación con éxito, es importante que se utilice correctas placas selectivas correspondientes al plásmido utilizado. Las placas selectivas debe contener el antibiótico codificada en el plásmido para seleccionar para la presencia del plásmido en el receptor y una selección contra-contra las cepas donantes y ayudante. Por ejemplo, al conjugar pECM20 en X. nematophila la contra-selección utilizado es la ampicilina debido X. nematophila es resistente a la ampicilina y la cepa donante es sensibles a la ampicilina. Si antibiótico contra-selección no está disponible en ynuestro sistema, un ácido diaminopimélico (DAP) que requiere donante se pueden utilizar. Para crecer DAP-que requieren cepas, DAP se añade al medio de cultivo sólidos y líquidos durante las etapas de pre-conjugación y conjugación, y se omite durante las etapas de selección de venta libre. Cuando DAP está ausente la cepa donante no va a crecer y es eficaz contra el seleccionado.
Para garantizar el aislamiento huevo éxito es esencial para comprobar con precisión la producción de huevos (Figura 2). En el momento de aislamiento, los nematodos hembra debe estar lleno de huevos y unos huevos deben ser visibles en los medios (Figura 2A). Si los nematodos hembra están produciendo huevos fertilizados por lo menos algunos huevos sobrenadante se han desarrollado visiblemente como nematodos no eclosionados (Figura 2B). Para S. carpocapsae, los huevos cambiará de esférica a oblonga ligeramente antes del desarrollo de los nematodos y de eclosión. El momento o condiciones de crecimiento de nematodos también pueden necesitar ser modificados para maximizar huevo fertilizadorendimiento, incluyendo acortando o alargando el período de tiempo antes de la recolección de huevos, o utilizando medios alternativos apropiados para las especies de nematodos específicos. Al final del aislamiento, los huevos deben ser fácilmente visible dentro de la memoria intermedia (Figura 2C). Los parámetros en el protocolo de aislamiento de huevo que puede requerir optimización incluyen cloro y KOH concentraciones en la solución de huevo, tiempo de incubación en solución de huevo, o la velocidad de centrifugación. Si el aislamiento huevo produce huevos pero no nematodos se desarrollan durante el co-cultivo, es posible que los huevos aislados no son viables. Para comprobar la viabilidad, dejar los huevos aislados en el buffer y esperar a que los nematodos para salir del cascarón. Los huevos deben eclosionan en uno o dos días de aislamiento y luego los nematodos juveniles se puede utilizar en el ensayo de co-cultivo. Si los huevos se rompen, pero no desarrollan durante el ensayo de co-cultivo, puede ser necesario modificar las condiciones de crecimiento o medio utilizado para el co-cultivo. Tomamos nota de que studie anteriors han aislado bacterias libres de nematodos por remojo de los nematodos en un cóctel de antibióticos (por ejemplo, 3,37). El enfoque se describe aquí está libre de algunas de las advertencias de remojo antibiótico, incluyendo complicaciones con el uso de antibióticos bacteriostáticos, resistentes a los antibióticos de bacterias contaminantes, y los efectos antibióticos en los nematodos. Ciertas etapas de nematodos también pueden ser resistentes a los antibióticos y retener sus simbiontes bacterianos 3. Por último, se observa que para la microscopía, la concentración de levamisol necesario para la inmovilización de nematodos puede variar con diferentes clados de nematodos.
Una vez que este método se ha establecido en el sistema de interés, es posible alterar la técnica para obtener más información. Al mirar a puntos de tiempo anteriores en el ciclo de vida del nematodo (Protocolo 4), uno puede ser capaz de identificar la forma en la bacteria y el nematodo iniciar su asociación 14,16. Además, este enfoque puede ser utilizado to Realizar un alto rendimiento pantallas mutantes para identificar los factores bacterianos implicados en la simbiosis, utilizando fluorescencia para detectar colonización 17,18. Otros métodos tales como la mutagénesis firma etiquetados requieren el uso de sondas marcadas radiactivamente y consumen más tiempo 22,28. Por lo tanto, el uso de microscopía de fluorescencia para la visualización simbionte bacteriano en los nematodos es una herramienta efectiva y eficiente para la investigación de interacciones bacterianas con un anfitrión de nematodos.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a Eugenio Vivas, Heungens Kurt, Eric Martens, Charles Cowles, Sugar Darby, Stabb Eric, y Ciche Todd por sus contribuciones al desarrollo de este protocolo y las herramientas utilizadas. KEM y JMC fueron apoyados por los Institutos Nacionales de Salud (NIH) Premio Nacional de Servicio de Investigación T32 (AI55397 "Los microbios en Salud y Enfermedad"). JMC fue apoyado por la Fundación Nacional de Ciencia (NSF) de Becas de Postgrado de Investigación. Este trabajo fue apoyado por becas de la Fundación Nacional de Ciencia (IOS-0920631-0950873 y IOS).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Lípidos Agar (Estéril) | 8 gramos de caldo nutriente, 15 gramos de agar de extracto de levadura, 5 gramos, 890 ml de agua, 10 ml de 0,2 g / ml de MgCl 2. 6 H 2 0, 96 ml de jarabe de maíz solución *, 4 ml de aceite de maíz * Revuelva los medios de comunicación mientras se vierte placas * Añadir ingrediente estéril después del autoclavado | ||
| Solución de jarabe de maíz (Estéril) | 7 ml de jarabe de maíz, 89 ml de agua mezcla y autoclave | ||
| Huevo Solution | 16,6 ml de sodio 12% de hipoclorito, 5 ml de KOH 5 M, 80 ml de agua | ||
| Lisogenia Caldo (Estéril) | 5 gramos de extracto de levadura, 10 g de triptona, 5 gramos de sal, 1 l de agua mezcla y autoclave | ||
| Microcentrifugue | Pescador | 13-100-675 | Cualquier microcentrífuga que contiene tubos de microcentrífuga funcionará |
| Centrífugo | Beckman | 366802 | Gran mesa centrífuga superior que posee el 15 ml y 50 ml tubos cónicos |
| Estéril 60 mm X 15 mm Petri Dish | Pescador | 0875713 | |
| 50 ml tubos de centrífuga | Pescador | 05-539-6 | |
| 15 ml tubos de centrífuga | Pescador | 05-531-6 | |
| Estéril 100 mm X 20 mm Petri Dish | Pescador | 0875711Z | Más profundo que el estándar de placas de Petri |
| 24-así placa | Greiner Bio-One | 662000-06 | |
| Microscopio | El microscopio tiene capacidad fluorescentes compatibles con el fluoróforo | ||
| Paraformaldehído | Microscopía Electrónica de Ciencias | 15710 | |
| PBS (Estéril) | 8 g de NaCl 0,2 g de KCl 1,44 g de Na 2 HPO 4 0,24 g de KH 2 PO 4 1 L de agua Ajuste a un pH de 7,4 y agua a 1 L y autoclave | ||
| Tubos de microcentrífuga | Pescador | 05-408-138 | 2 ml o 1,5 ml tubos |
| Shaker | Cualquier agitador que hace que el líquido se mueva suavemente funcionará | ||
| Ácido diaminopimélico | Sigma | D-1377 | Si es necesario, suplementar medios a una concentración de 1 mM o |
Referencias
- Holterman, M., van der Wurff, A. Phylum-wide analysis of SSU rDNA reveals deep phylogenetic relationships among nematodes and accelerated evolution toward crown clades. Mol. Biol. Evol. 23, 1792-1800 (2006).
- Lambshead, P. J. D., Boucher, G. Marine nematode deep-sea biodiversity - hyperdiverse or hype. J. Biogeogr. 30, 475-485 (2003).
- Poinar, G. O. J., Thomas, G. M. Significance of Achromobacter nematophilus Poinar and Thomas (Achromobacteraceae: Eubacteriales) in the development of the nematode, DD-136 (Neoaplectana sp. Steinernematidae). Parasitol. 56, 385-390 (1966).
- Herbert, E. E., Goodrich-Blair, H. Friend and foe: the two faces of Xenorhabdus nematophila. Nat. Rev. Microbiol. 5, 634-646 (2007).
- Kaya, H. K., Gaugler, R. Entomopathogenic nematodes. Annu. Rev. Entomol. 38, 181-206 (1993).
- Bird, A. F., Akhurst, R. J. The nature of the intestinal vesicle in nematodes of the family Steinernematidae. Int. J. Parasitol. 13, 599-606 (1983).
- Martens, E. C., Goodrich-Blair, H. The Steinernema carpocapsae intestinal vesicle contains a subcellular structure with which Xenorhabdus nematophila associates during colonization initiation. Cell. Microbiol. 7, 1723-1735 (2005).
- Snyder, H. A., Stock, S. P., Kim, S. K., Flores-Lara, Y., Forst, S. New insights into the colonization and release process of Xenorhabdus nematophila and the morphology and ultrastructure of the bacterial receptacle of its nematode host, Steinernema carpocapsae. Appl. Environ. Microbiol. 73, 5338-5346 (2007).
- Abebe, E., Abebe-Akele, F., Morrison, J., Cooper, V., Thomas, W. K. An insect pathogenic symbiosis between a Caenorhabditis and Serratia. Virulence. 2, 158-161 (2011).
- Abebe, E., Jumba, M. An entomopathogenic Caenorhabditis briggsae. J. Exp. Biol. 213, 3223-3229 (2010).
- Torres-Barragan, A., Suazo, A., Buhler, W. G., Cardoza, Y. J. Studies on the entomopathogenicity and bacterial associates of the nematode Oscheius carolinensis. Biol. Control. 59, 123-129 (2011).
- Ye, W. M., Torres-Barragan, A., Cardoza, Y. Oscheius carolinensis n. sp (Nematoda: Rhabditidae), a potential entomopathogenic nematode from vermicompost. Nematology. 12, 121-135 (2010).
- Zhang, C., Liu, J. Heterorhabditidoides chongmingensis gen. nov., sp. nov. (Rhabditida: Rhabditidae), a novel member of the entomopathogenic nematodes. J. Invertebr. Pathol. 98, 153-168 (2008).
- Martens, E. C., Heungens, K., Goodrich-Blair, H. Early colonization events in the mutualistic association between Steinernema carpocapsae nematodes and Xenorhabdus nematophila bacteria. J. Bacteriol. 185, 3147-3154 (2003).
- Ciche, T. A., Ensign, J. C. For the insect pathogen, Photorhabdus luminescens, which end of a nematode is out. Appl. Environ. Microbiol. 69, 1890-1897 (2003).
- Ciche, T. A., Kim, K. S., Kaufmann-Daszczuk, B., Nguyen, K. C., Hall, D. H. Cell invasion and matricide during Photorhabdus luminescens transmission by Heterorhabditis bacteriophora nematodes. Appl. Environ. Microbiol. 74, 2275-2287 (2008).
- Easom, C. A., Joyce, S. A., Clarke, D. J. Identification of genes involved in the mutualistic colonization of the nematode Heterorhabditis bacteriophora by the bacterium Photorhabdus luminescens. BMC Microbiol. 10, 45(2010).
- Somvanshi, V. S., Kaufmann-Daszczuk, B., Kim, K. S., Mallon, S., Ciche, T. A. Photorhabdus phase variants express a novel fimbrial locus, mad, essential for symbiosis. Mol. Microbiol. 77, 1021-1038 (2010).
- Martens, E. C., Russell, F. M., Goodrich-Blair, H. Analysis of Xenorhabdus nematophila metabolic mutants yields insight into stages of Steinernema carpocapsae nematode intestinal colonization. Mol. Microbiol. 51, 28-45 (2005).
- Sugar, D. R., Murfin, K. E. Phenotypic variation and host interactions of Xenorhabdus bovienii SS-2004, the entomopathogenic symbiont of Steinernema jollieti nematodes. Env. Microbiol. 14, 924-939 (2012).
- Cowles, C. E., Goodrich-Blair, H. The Xenorhabdus nematophila nilABC genes confer the ability of Xenorhabdus spp. to colonize Steinernema carpocapsae nematodes. J. Bacteriol. 190, 4121-4128 (2008).
- Heungens, K., Cowles, C. E., Goodrich-Blair, H. Identification of Xenorhabdus nematophila genes required for mutualistic colonization of Steinernema carpocapsae nematodes. Mol. Microbiol. 45, 1337-1353 (2002).
- Goetsch, M., Owen, H., Goldman, B., Forst, S. Analysis of the PixA inclusion body protein of Xenorhabdus nematophila. J. Bacteriol. 188, 2706-2710 (2006).
- Bhasin, A., Chaston, J. M., Goodrich-Blair, H. Mutational Analyses Reveal Overall Topology and Functional Regions of NilB, a Bacterial Outer Membrane Protein Required for Host Association in a Model of Animal-Microbe Mutualism. J. Bacteriol. 194, 1763-1776 (2012).
- Ciche, T. A., Goffredi, S. K. Methods in General and Molecular Microbiology. Reddy, C. A. , ASM Press. 394-419 (2007).
- Goodrich-Blair, H., Clarke, D., Grewal, P. S., Ciche, T. A. Insect Pathogens, Molecular Approaches and Techniques. Stock, S. P., Boemare, N., Vandenberg, J., Glazar, I. , CABI Publishing. 239-269 (2009).
- Stock, S. P., Goodrich-Blair, H. Manual of Techniques in Invertebrate Pathology. Lacey, L. A. , Elsevier Press. 375-425 (2012).
- Martens, E. C., Gawronski-Salerno, J. Xenorhabdus nematophila requires an intact iscRSUA-hscBA-fdx locus to colonize Steinernema carpocapsae nematodes. J. Bacteriol. 185, 3678-3682 (2003).
- Vivas, E. I., Goodrich-Blair, H. Xenorhabdus nematophilus as a model for host-bacterium interactions: rpoS is necessary for mutualism with nematodes. J. Bacteriol. 183, 4687-4693 (2001).
- White, G. F. A method for obtaining infective nematode larvae from cultures. Science. 66, 302-303 (1927).
- Ciche, T. A., Ensign, J. C. For the insect pathogen Photorhabdus luminescens, which end of a nematode is out. Appl. Environ. Microbiol. 69, 1890-1897 (2003).
- Sicard, M., Brun, N. L. e Effect of native Xenorhabdus on the fitness of their Steinernema hosts: contrasting types of interaction. Parasitol. Res. 91, 520-524 (2003).
- Lambertsen, L., Sternberg, C., Molin, S. Mini-Tn7 transposons for site-specific tagging of bacteria with fluorescent proteins. Environ. Microbiol. 6, 726-732 (2004).
- Miller, W. G., Leveau, J. H., Lindow, S. E. Improved gfp and inaZ broad-host-range promoter-probe vectors. Mol. Plant Microbe Int. 13, 1243-1250 (2000).
- Teal, T. K., Lies, D. P., Wold, B. J., Newman, D. K. Spatiometabolic stratification of Shewanella oneidensis biofilms. Appl. Environ. Microbiol. 72, 7324-7330 (2006).
- Bao, Y., Lies, D. P., Fu, H., Roberts, G. P. An improved Tn7-based system for the single-copy insertion of cloned genes into chromosomes of Gram-negative bacteria. Gene. 109, 167-168 (1991).
- Woodring, J. L., Kaya, H. K. Steinernematid and Heterorhabditid Nematodes: A Handbook of Biology and Techniques. Southern Cooperative Series Bulletin 331. , Arkansas Agricultural Experiment Station. (1988).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados