Method Article
تصور البكتيريا في نيماتودا باستخدام المجهر الفلورسنت
In This Article
Summary
تبادل المنافع والمصالح لدراسة بين Xenorhabdus البكتيريا و Steinernema الديدان الخيطية، وأساليب لرصد وجود البكتيريا والديدان الخيطية موقع داخل. المنهج التجريبي، والتي يمكن تطبيقها على النظم الأخرى، ينطوي على البكتيريا الهندسة للتعبير عن بروتين الفلورية الخضراء وتصور، وذلك باستخدام البكتيريا المجهري مضان داخل الديدان الخيطية شفافة.
Abstract
Symbioses، والذين يعيشون معا من اثنين أو أكثر من الكائنات الحية، على نطاق واسع في جميع ممالك الحياة. عن اثنين من أكثر الكائنات في كل مكان على وجه الأرض، والديدان الخيطية البكتيريا تشكل مجموعة واسعة من الجمعيات التكافلية التي تتراوح من المفيد الممرضة 1-3. واحد هذه الجمعيات هي العلاقة متبادل المنفعة بين البكتيريا والديدان الخيطية Xenorhabdus Steinernema، التي برزت بوصفها نظاما من طراز التعايش 4. النيماتودا الممرضة للحشرات هي Steinernema، وذلك باستخدام المتكافل البكتيرية بهم لقتل الحشرات 5. لنقل بين المضيفين الحشرات، والبكتيريا استعمار الامعاء من الديدان الخيطية في المرحلة المعدية الأحداث 6-8. في الآونة الأخيرة، وقد ثبت عدة أنواع النيماتودا الأخرى للاستفادة من البكتيريا لقتل الحشرات 9-13، والتحقيقات بدأت دراسة التفاعلات بين النيماتودا والبكتريا في هذه النظم <سوب> 9.
وصفنا طريقة لرؤية المتكافل البكتيرية داخل أو على مضيف الديدان الخيطية، والاستفادة من الشفافية البصرية من الديدان الخيطية عند عرضها بواسطة المجهر. صممت هذه البكتيريا في التعبير عن بروتين فلوري، مما يسمح التصور من خلال الفحص المجهري مضان. وتتوفر العديد من البلازميدات التي تحمل الجينات ترميز البروتينات التي يتألق عند أطوال موجية مختلفة (أي أخضر أو أحمر)، والاقتران من البلازميدات من الإشريكية القولونية سلالة المانحة إلى المتلقية المتكافل البكتيرية ناجحة لمجموعة واسعة من البكتيريا. تم تطوير الأساليب المذكورة للتحقيق في العلاقة بين carpocapsae Steinernema وXenorhabdus nematophila 14. وقد استخدمت أساليب مماثلة للتحقيق في غيرها من الديدان الخيطية-بكتيريا الجمعيات 9، 15-18، وفي النهج وبالتالي ينطبق عموما.
والتقىهود يسمح توصيف جود البكتيريا والديدان الخيطية التوطين داخل في مراحل مختلفة من التنمية، وتوفير نظرة ثاقبة لطبيعة تكوين الجمعيات وعملية الاستعمار 14 و 16 و 19. التحليل المجهري يكشف كل من تواتر الاستعمار بين السكان وتوطين البكتيريا لاستضافة الأنسجة 14، 16، 19-21. هذا هو ميزة على غيرها من أساليب رصد البكتيريا داخل السكان الديدان الخيطية، مثل صوتنة 22 أو طحن 23، التي يمكن أن توفر مستويات متوسط الاستعمار، ولكن قد لا، على سبيل المثال، تميز السكان مع ارتفاع وتيرة منخفضة الأحمال المتكافل من السكان مع تردد انخفاض الأحمال المتكافل عالية. يمكن تمييز وتيرة وحمولة من البكتيريا استعمار أهمية خاصة عند فحص الجرثومي أو وصف المسوخ للاستعمار الظواهر 21، 24. في الواقع، وقد استخدم المجهر مضان في فحص إنتاجية عالية من المسوخ البكتيرية لعيوب في الاستعمار 17 و 18، وأقل شاقة من الأساليب الأخرى، بما في ذلك صوتنة 22، 25-27 و الفردية تشريح الديدان الخيطية 28 و 29.
Protocol
1. بناء على الإجهاد الجرثومي نيون عبر اقتران
- تنمو سلالة المتلقي (للفحص المتكافل) وسلالة المانحة ليلة وضحاها. ينبغي أن سلالة المانحة، وعادة ما كولاي، تكون قادرة على التبرع من خلال اقتران DNA، وينبغي أن تتحول مع. بلازميد (الجدول 2) الذي يحمل الجين ترميز بروتين فلوري اعتمادا على البلازميد، يمكن أيضا سلالة المساعد الاقتران تكون مطلوبة. إذا كان الأمر كذلك، ينبغي أيضا أن تنمو هذه السلالة بين عشية وضحاها. يجب أن تزرع سلالة سلالة المانحة والمساعدة مع المضادات الحيوية لتحديد لصيانة بلازميد.
- ثقافة فرعية الجهة المانحة، المساعد، وسلالات المتلقي إلى المغذيات الغنية وسائل الإعلام التي تفتقر إلى النمو المضادات الحيوية في نسبة 1:100 للثقافة والمتوسطة.
- تنمو الثقافات في درجة الحرارة المناسبة لكل سلالة حتى تصل منتصف سجل النمو المرحلة (OD 600 ~ 0.6). لXenorhabdus وE. القولونية هذه المرحلة من النموال يتم التوصل إلى ما بين 3 و 4 ساعات بعد subculturing. وهذا قد تختلف تبعا للسلالة، أو في بعض الحالات استخدام البلازميد.
- خلط السلالات في أنبوب microcentrifuge وأجهزة الطرد المركزي لمدة 2 دقيقة في XG 17900 (13،000 دورة في الدقيقة في معظم microfuges). فإن نسبة المانحة والمتلقية أن ينتج أفضل النتائج تختلف عن تركيبات مختلفة، ويمكن أن تحدد تجريبيا. لمستلم Xenorhabdus وE. المانحة القولونية، ونحن استخدام نسبة 1:1 أو 3:01. إذا كانت هناك حاجة سلالة المساعد (مثل كولاي)، ينبغي أن يضاف إلى ذلك في نسبة نفس الجهة المانحة.
- صب طاف.
- إعادة تعليق بيليه الخلية في 30 ميكرولتر من وسائل الإعلام الجديدة.
- بقعة التعليق على لوحة الوسائط الغنية بالمغذيات دون أي المضادات الحيوية، والسماح للبقعة لتجف.
- احتضان لوحة، المقلوب، بين عشية وضحاها في درجة حرارة مثلى للبكتيريا المتلقية والمانحة يجوز لل(والمساعد، إن وجدت). ينبغي لوحةحضنت أن لا يقل عن 18 ساعة.
- حتى تتخلص الفور وخط واحد للمستعمرات على لوحة مضاد حيوي انتقائية. وينبغي تحديد المضادات الحيوية ضد المانحة والمتلقية لليحتوي على البلازميد. قد احد أو اثنين من الشرائط العزلة إضافية تكون ضرورية لعزل ثقافة نقية.
- ضمان المستعمرات الناتجة هي المستفيدة المتكافل، وليس سلالة المانحة، من خلال الكشف عن وجود الظواهر مستلم معين، مثل مستعمرة التشكل، أو الكشف عن تفاعل البلمرة سلسلة من المتلقي محددة الجينات. فحص المستعمرات لحضور البلازميد بواسطة تفاعل البلمرة المتسلسل من تسلسل البلازميد المعروفة ومضان. يجب المستعمرات يتألق تحت الطول الموجي الصحيح المطابق للبروتين فلوري.
2. إنتاج بيض النيماتودا ممحوضة
- تنمو 5 مل من المتكافل البكتيرية الطبيعية بين عشية وضحاها. لبدء ثقافة، قد يتم تلقيح البكتيريا إلى مرق استذابة (LB) أو غيرها من مكعبوسائل الإعلام lture مباشرة من الفريزر الأسهم أو من لوحة خط.
- نشر 600 ميكرولتر من ثقافة البكتيرية على 10 لوحات الدهون مم (LA) آجار 29. سوف ثمانية إلى عشرة لوحات تسفر الديدان الخيطية كافية لمعظم الأنواع.
- احتضان في الظلام دون الرطوبة في C ° 25 لمدة يومين.
- إضافة النيماتودا المعدية 5000 الأحداث، أو غيرها من مراحل اعتمادا على الديدان الخيطية المستخدمة، في 500 ميكرولتر من وسائل الإعلام إلى مروج البكتيرية. احتضان لوحات في C ° 25 لمدة 3 أيام.
- تحقق لوحات للحصول على وجود الديدان الخيطية الكبار والبيض. وضع 20 ميكرولتر من الماء على شريحة المجهر. باستخدام عصا معقمة كشط متابعة كمية صغيرة من الديدان الخيطية من العشب البكتيرية. وضع العصا في الماء والسماح للالديدان الخيطية على السباحة قبالة. ننظر إلى الشريحة تحت تضخم منخفضة. لمزيد من المعلومات حول مظهر انظر مناقشة والشكل 2.
- إذا البيض والإناث واضحة، لا تزال، وإلا احتضان لوحات في 25 و دعلى سبيل المثال؛ C والتحقق من التنمية السليمة للموارد البشرية كل 6-12. عندما تحتوي الإناث البيض، ضع قليل من الماء مل على سطح لوحات. دوامة بلطف لوحات وصب الماء في أنبوب 50 مل المخروطية. يجب أن تأتي من الديدان الخيطية من لوحات والتي لم تعد مرئية على سطح اللوحة. قد يكون من الضروري يشطف عدة.
- السماح للالديدان الخيطية لتستقر في قاع الأنبوب.
- شطف الديدان الخيطية. ماصة قبالة المياه الزائدة من الجزء العلوي من الأنبوب. إعادة ملء مع الماء النظيف والسماح الديدان الخيطية الكبار لتسوية. ماصة قبالة المياه الزائدة.
- ملء أنابيب مخروطية مع حل البيض. مرة واحدة يتم إضافة البيض يجب حل توقيت حل جميع الخطوات مع البيض تماما كما هو موضح المضي قدما لمحصول البيض كحد أقصى. احتضان الأنابيب في حين تهز برفق لمدة 10 دقيقة بالضبط. يجب ان يحل معظم الديدان الخيطية من نهاية الحضانة.
- أجهزة الطرد المركزي على الفور أنابيب مخروطية في 1250 x ج لمدة 10 دقيقة بالضبط (وهذا يشمل بذلك يصل الى سرعة أجهزة الطرد المركزيولكن ليس الى X 0 ز. استخدام الفرامل).
- صب على الفور طاف.
- على الفور إعادة تعليق بيليه مع البيض حل بواسطة pipetting.
- ملء أنبوب مخروطي مباشرة مع حل البيض وتخلط جيدا من قبل مرات 3-5 قلب. ثم تدور على الفور كما في 2.10.
- صب على الفور طاف.
- إعادة تعليق بيليه في LB بواسطة pipetting، ونقل إلى أنبوب مخروطي 15 مل لتحسين التكوير خلال خطوات الغسيل. LB هو المعيار لSPP Steinernema. ويمكن استخدام مخازن أخرى (مثل أملاح وسيلة الحد الأدنى) اعتمادا على الديدان الخيطية والبكتيريا، مع الأخذ في الاعتبار العازلة يجب ألا تضر إما الديدان الخيطية أو بكتيريا.
- ملء الأنبوب مع LB وتدور كما في 2.10.
- صب طاف، وإعادة تعليق في LB.
- شطف الديدان الخيطية ما مجموعه 3 مرات عن طريق تكرار و2.14 2.15.
- يخفف من البيض الديدان الخيطية إعادة علقت إلى وحدة تخزين مناسبة. يجب أن يكون هناك على الأقل 10 بيضة في ميكروليتر. على سبيل المثالويمكن تخزين ع في طبق بتري 6 سم في LB 5 مل لمدة لا تقل عن أربعة أيام وذلك بإضافة المضادات الحيوية التي تمنع نمو البكتيريا استعمار والتغليف في لوحة parafilm. فإن البيض تحتاج إلى غسلها مرة واحدة في LB مل 15 (كما هو الحال في 2.13 و 2.14) قبل بتلقيح على المروج البكتيرية. لاحظ أن البيض يفقس وخلال هذا الوقت، وربما لا تكون متزامنة تنمويا عند استخدامها في فحوصات الاستعمار.
3. شارك في زراعة البكتيريا الفحص مع نيون
- تنمو البكتيريا بين عشية وضحاها الفلورسنت، واختيار لبلازميد إذا لزم الأمر.
- نشر 600 ميكرولتر من ثقافة البكتيرية على 10 لوحات أجار مم الدهون بعصا العقيمة. احتضان في C ° 25 ل 2 أيام.
- مكان 500-5،000 البيض الديدان الخيطية ممحوضة في ما مجموعه 100 حتي 400 ميكرولتر (2000 النيماتودا على النحو الأمثل في 200 ميكرولتر) على كل لوحة أجار الدهون.
- احتضان في الظلام دون الرطوبة عند 25 حتى نقابة الصحفيين العراقيين، أو المراحل الأخرى من حيث الشكل والفائدة C °. نقابة الصحفيين العراقيين سوف يكون مرئيا كمحرك فوالأبيض خاتم ZZY على حافة اللوحة. للبحث في مراحل الحياة الأخرى، انظر بروتوكول 4.
- وضع لوحات في فخ الابيض تعديل 30. إزالة الغطاء من الدهون وحة أجار ووضع الجزء السفلي في الجزء السفلي من 100 ملم × 20 فارغة طبق بتري ملم. ملء طبق بتري كبير مع الماء، أو عازلة مناسبة أخرى لالديدان الخيطية الخاصة بك، لتطويق لوحة صغيرة. يجب أن يكون مستوى المياه ما يقرب من نصف ارتفاع لوحة صغيرة.
- احتضان في فخ الماء حتى ظهرت سلالة نقابة الصحفيين العراقيين في المخزن المؤقت.
- ويمكن تخزين النيماتودا المعدية الأحداث في الماء في الأنسجة قارورة الثقافة.
4. مجموعة من مراحل الحياة الأولى للفحص
- استخدام خطوات 3.1 خلال 3.4 إلى إعداد مقايسة.
- احتضان لوحات حتى مراحل حياة المطلوب موجودة. قد الفحص البصري اليومي يكون من الضروري تحديد التوقيت. لتفقد لوحات، استخدم الإجراء الموضح في بروتوكول 2.5. لS. carpocapsae eggsgrown مع X. nematophila على لوحات LA، حامل الإناث سوف تكون موجودة في 4-5 أيام، وسوف يكون موجودا في الأحداث 7 أيام، والأحداث المعدية ستبدأ إلى أن يتم إنتاجها من قبل 15-17 يوم.
- عندما مراحل الحياة المرجوة موجودة، وجمع عينتك. ملء جيدا لوحة 96 أيضا مع 200 ميكرولتر من العازلة PBS أو مناسبة أخرى. كشط بلطف بعض من العشب الذي يحتوي على بكتيريا الديدان الخيطية. وهناك كمية بحجم حبة البازلاء (~ 50 ملغ) توفير ما لا يقل عن عدة مئات من الديدان الخيطية مرة واحدة ويتم إنتاج ذرية F1، ولكن قد يكون من الضروري أكثر للحصول على نقاط وقت سابق. وضع العصا في المخزن المؤقت تحتوي أيضا.
- احتضان لمدة 30 ثانية إلى دقيقة. إزالة العصا وكشط بقايا المتبقية. استخدام العصا لإزالة أي أجار من البئر. يجب أن تكون مرئية داخل الديدان الخيطية المخزن المؤقت. نقل الخليط عازلة لأنبوب microfuge نظيفة.
- علاج الديدان الخيطية مع وكيل ليفاميزول أو غيرها من شل. حل بضع حبات من الليفاميزول في 30 و مو؛ لتر من المياه. إضافة 1-2 ميكرولتر من هذا المزيج لكل ميكرولتر 50 من العينة. بعد العلاج الليفاميزول فإن النيماتودا تكون غير قابلة للحياة.
- إذا كان سيتم عرض عينات في وقت لاحق، كما هو موضح في إصلاح هذه الخطوة. إذا لم يكن كذلك، انتقل إلى الخطوة 4.6. أضف 200 ميكرولتر من 1X التي تحتوي على مثبت حل العازلة وبارافورمالدهيد 4٪. المزيج بلطف، قد تسبب pipetting مراحل الحياة حساسة لليز. مع تغطية احباط، واحتضان في درجة حرارة الغرفة على شاكر على انخفاض لمدة لا تقل عن 18 ساعة.
- وضع أنابيب في رفوف أنبوب، والسماح للالديدان الخيطية لتستقر في قاع الأنبوب.
- شطف لإزالة الديدان الخيطية الخلفية. ماصة من السائل الزائد وإضافة 200 حتي 500 ميكرولتر من العازلة والمزيج بلطف. تكرار. يمكن تكرار ذلك عدة مرات لإزالة خلفية أكثر إذا لزم الأمر.
- السماح للالديدان الخيطية لتستقر في قاع الأنبوب في حجم والمطلوب إعادة تعليق.
- إذا لم يتم إصلاح الديدان الخيطية، وشاشة الفور. قد يتم تخزين الديدان الخيطية الثابتة في الثلاجة لمدة تصلإلى أسبوعين. تخزين في الظلام.
5. نيماتودا الكشف عن البكتيريا عن طريق المجهر جمعية
- حدد بعض الديدان الخيطية لعرض تحت المجهر عن طريق إزالة عينة صغيرة من خليط الخاص بك.
- للتأكد من أن النيماتودا لا تزال للصورة، علاج مع وكيل مشلول كما هو موضح في البروتوكول 4.5. إذا كنت لا التقاط صورة أو يتم إصلاحها بالفعل الديدان الخيطية، قد يتم تخطي هذه الخطوة.
- إضافة 20-30 ميكرولتر من الديدان الخيطية في الماء لشريحة المجهر الخاص بك ووضع على رأس ساترة.
- عرض الديدان الخيطية باستخدام المجهر الضوئي كامل لضمان الديدان الخيطية في مجال الرؤية.
- عرض الديدان الخيطية باستخدام الإعداد الفلورسنت على المجهر الذي يتوافق مع مضان التي أعرب عنها البكتيريا.
- لتحديد توطين البكتيرية، التقاط صور من الديدان الخيطية تحت الإعداد الفلورسنت وإعداد المجهر الضوئي، ثم ركب الصور. الصور يجب أن تكون من نفس ارض الملعبد النظر. قد يكون من الضروري لمحاولة تكبير عدة وجهات نظر الديدان الخيطية للعثور على البكتيريا.
- يمكن كميا توزيع الاستعمار الديدان الخيطية عن طريق عد عدد سكانها الديدان الخيطية، سجل لوجود أو عدم وجود البكتيريا، واحتساب المئة المستعمر. نوصي العد حتى يتم عد لا يقل عن 30 النيماتودا بين السكان في كل فئة (مع أو بدون الاستعمار) للحصول على قيمة يمكن الاعتماد عليها.
- عندما استعمرت فقط النيماتودا القليلة في عدد السكان، قد يكون من الضروري الاعتماد عدة آلاف من الديدان الخيطية قبل 30 وحظ و. لعالية الإنتاجية العد اتبع الخطوات التالية.
- بدلا من عد النيماتودا بشكل فردي، قسامة السكان إلى لوحة متعددة جيدا (مثل لوحة 24 أيضا). بعد النيماتودا قد استقروا في الجزء السفلي من الطبق، يمكن تفحص كل بئر على المجهر ويمكن سجل عدد من الديدان الخيطية المستعمر.
- إجمالي عدد الديدان الخيطية طويمكن تحديد NA السكان حسب التخفيفات المسلسل من الديدان الخيطية في البئر. على سبيل المثال، يمكن إضافة 1 مل من الديدان الخيطية إلى جانب ذلك، يمكن إزالة مختلطة بشكل جيد من قبل التحريك مع طرف الماصة، وميكرولتر 3 و يحسب بالنسبة الكمي من مجموع السكان في البئر.
- ويمكن الحصول على نسبة من الديدان الخيطية المستعمر عن طريق قسمة عدد مستعمرة من قبل عدد من الديدان الخيطية في البئر.
6. ممثل النتائج
وتظهر الصور المجهر سبيل المثال من الديدان الخيطية Steinernema المرتبطة البكتيريا Xenorhabdus في الشكل 3. لخلق صورة مركب ينظر في الشكل 3A، ومضافين صورة النقيض المرحلة مع صورة الفلورسنت. السهم في الشكل 3A يدل على البكتيريا الموجودة داخل الديدان الخيطية المعدية الأحداث (شريط = 100 ميكرون). 3B الشكل شيد بطريقة مماثلة، ويصور الأحداث واي الديدان الخيطيةال البكتيريا الخضراء بروتين فلوري المسمى (قضبان الأخضر) ترجمة جميع أنحاء التجويف الديدان الخيطية المعوية (شريط = 20 ميكرون). تم إحصاء عدد السكان من الديدان الخيطية من اثنين وسائل الاعلام وسجل للاستعمار من قبل المتكافل البكتيرية (الجدول 1). لإحصاءات قوية، فمن الأفضل لحساب لا يقل عن 100 النيماتودا مع كل عينة لا يقل عن 30 الوقوع في كل فئة. كما رأينا في الجدول 1، واستعمرت هذه الديدان الخيطية على مستوى ما يقرب من 14.6٪ عندما نمت على أجار والدهون 68.6٪ عندما نمت على أجار الكلى الكبد. وقد ثبت الديدان الخيطية وغيرها من الأنواع البكتيرية لديهم مستويات مختلفة من الاستعمار. على سبيل المثال X. nematophila يستعمر 99٪ من S. الأحداث المعدية carpocapsae (مارتنز 2003)، وP. luminescens يستعمر 26٪ من H. الأحداث المعدية bacteriophora (Ciche 2003).
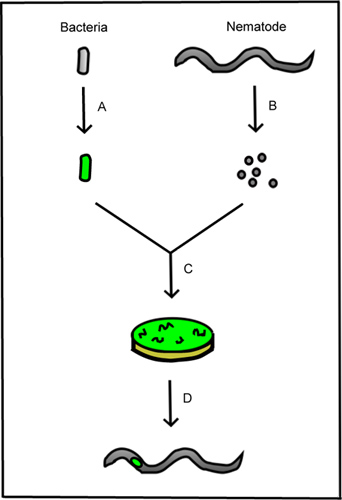
الشكل 1. الملخص التخطيطي للأسلوب. تم تصميم A. الجرثومة المسببة للمرض في التعبير عن بروتين الفلورية. يتم عزل البيض النيماتودا B. من الديدان الخيطية الديدان الخيطية الكبار لإنتاج معقمة. C. والديدان الخيطية ومعقمة شارك في زراعة البكتيريا مع الفلورسنت. D. يتم النظر إلى مراحل الحياة الناتجة بموجب المجهر لتقييم وجود البكتيريا داخل الديدان الخيطية.

الشكل 2. تصوير الإناث البالغات يحتوي على البيض. A. والتخطيطي يظهر المظهر العام من الإناث Steinernema. DIC صورة S.: أقحم حامل feltiae الإناث. ويشير السهم الأسود الفرج. الأسهم البيضاء تظهر البيض مرئية. الصورة في 20X التكبير، وحجم شريط يمثل 100 ميكرون. B. DIC صورة S. المتقدمة ولكن لم يفقسfeltiae البيض الديدان الخيطية. الصورة التكبير 40X، وحجم شريط يمثل 50 ميكرومتر. C. الصورة DIC من البيض المعزولة من S. الديدان الخيطية تحت feltiae التكبير 10X. شريط النطاق هو 100 ميكرون.

الرقم المجهر مثال 3. صور الديدان الخيطية للبكتيريا تكوين الجمعيات. A. S. وارتبطت مع الديدان الخيطية puntauvense المتكافل البكتيرية بهم، X. bovienii، معربا عن GFP. الصورة هي صورة مركبة تنتجها تتراكب صورة النقيض المرحلة مع صورة الفلورسنت من نفس الحقل للعرض. السهم يشير إلى المتكافل البكتيرية الفلورسنت داخل المضيف الديدان الخيطية. شريط النطاق يمثل 100 ميكرون. B. هذه الصورة يظهر S. carpocapsae الديدان الخيطية مع الأحداث، معربا عن GFP X. nematophila المترجمة داخل الأمعاء الديدان الخيطية.شيد هذه الصورة من خلال تتراكب صورة الفلورسنت أكثر من تباين الصورة الفرق تدخل. شريط النطاق تمثل 20 ميكرومتر.
| توتر | عدد من الديدان الخيطية مع acteria | عد نيماتودا مجموع | olonized في المئة من الديدان الخيطية |
| S. آجار puntauvense الدهون | 30 | 205 | 14.60٪ |
| S. الكلى الكبد puntauvense آجار | 72 | 105 | 68،60٪ |
الجدول 1. التسجيل مثال على السكان الديدان الخيطية لوجود البكتيريا. في هذه التجربة، ممحوضة S. كانت تزرع الديدان الخيطية puntauvense مع المتكافل، معربا عن GFP على وسائل الاعلام النمو المختلفة (أجار أجار الدهون والكبد الكلى 32) لاختبار عيوب الاستعمار. ما مجموعه واحد على الأقل hundreتم إحصاء د النيماتودا في عينة وسجل وجود البكتيريا. على السلطة الإحصائية، وثلاثة مكررات التجريبية ينبغي أن يحسب مع لا يقل عن 30 النيماتودا التي تقع في كل فئة.

الجدول 2. البلازميدات تحتوي على بروتين فلوري. وترد قائمة من البلازميدات إمكانية إدخال بروتين فلوري في المتكافل البكتيرية المدرجة أسماؤها من البلازميد. المعلومات الأخرى المدرجة هي البروتين المشفرة الفلورسنت، راديو كاسيت المضادات الحيوية المستخدمة لصيانة بلازميد، تعليمات أخرى للاستخدام، مصدر البلازميد. تركيز أشار بين قوسين هو تركيز المضادات الحيوية المستخدمة لX. وقد استخدم nematophila. كل من هذه البلازميدات بنجاح في أي Xenorhabdus أو Photorhabdus. ويمكن الحصول على معلومات إضافية من الاستشهادات لاحظت. اعتماداعلى البكتيريا التي يجري اختبارها، قد يكون بعض البلازميدات لا تعمل على أساس بروتين فلوري، واختيار المضاد الحيوي، موقع الإدراج، أو الأصل من النسخ المتماثل. والبلازميدات المذكورة أعلاه تحتوي على ميزات مختلفة قد تمكن في استخدام بكتيريا من الفائدة. على سبيل المثال، ميني Tn7-KSGFP إدراج في موقع attTn7 من الكروموزوم، في حين يدرج في pECM20 X. nematophila كروموسوم من إعادة التركيب مثلي. بدلا من ذلك، يتم الاحتفاظ البلازميدات pPROBE extrachromosomally، وكل pPROBE بلازميد لديها نفس العمود الفقري ولكن لها علامات fluorophore اختيار مختلفة أو أصول النسخ المتماثل لتمكين استخدامها في مجموعة متنوعة من الخلفيات التصنيفية أو متحولة.
Discussion
بروتوكول الموصوفة هنا يوفر طريقة للكشف البصري من البكتيريا داخل مجموعة الديدان الخيطية (الشكل 1). هذه الطريقة يستفيد من الشفافية البصرية من الديدان الخيطية والقدرة على تسمية fluorescently البكتيريا، مما يتيح تحليل في الجسم الحي من البكتيريا داخل المضيف الديدان الخيطية (الشكل 3). على وجه التحديد، فإن هذا النهج يحدد توطين البكتيرية داخل مضيفه. عن طريق عد السكان الديدان الخيطية والتسجيل لحضور البكتيرية، يمكن تحديد وتيرة الاستعمار الجرثومي عبر السكان الديدان الخيطية (الجدول 1). هذه الطريقة هي واحدة من العديد من التقنيات المحتملة التي يمكن استخدامها لدراسة التفاعلات بين المضيفين الديدان الخيطية والمتكافلة البكتيرية. وقد وصفت وسائل ذات صلة سابقا لعزل المتكافل البكتيرية، وتنمو الديدان الخيطية axenically، والتلاعب كلا الشريكين 25-27.
وصف بروتوكول حوقد وضعت يحرث في nematophila-Steinernema Xenorhabdus النظام النموذجي carpocapsae 14، واستخدمت أساليب مماثلة في غيرها من الجمعيات النيماتودا الممرضة للحشرات 9،15،17،18 للبكتيريا. يجب أن تتحقق عدة شروط من أجل تطبيق هذا الأسلوب لنظم الديدان الخيطية للبكتيريا أخرى. أولا، يجب أن المتكافل البكتيرية تكون قادرة على أن تكون معزولة عن المضيف ونمت بشكل مستقل في الثقافة. الثانية، يجب أن تكون قادرة على المتكافل تناول DNA من خلال التحول أو الاقتران من أجل إدخال بروتين فلوري. الثالث، للحصول على أفضل النتائج، يجب أن يكون مرحلة الديدان الخيطية التي يمكن إجراؤها ممحوضة ويعيد للبكتيريا. ومع ذلك، حتى لو لا يمكن أن تكون معزولة الديدان الخيطية من البكتيريا قد يكون لا يزال من الممكن تصور الرابطة: بدلا من إضافة البيض ممحوضة إلى الحديقة من البكتيريا الفلورية، إضافة مرحلة الحياة التي أثيرت التقليدية والمضي قدما في البروتوكول كما هو موضح. فإن أي نتائج تعاني من ال التحذيرفي البكتيريا التي لا تعبر عن GFP سوف تتنافس مع GFP، معربا عن البكتيريا لتوطين لأنسجة الديدان الخيطية محددة، وبسبب هذا، لا ينبغي أن يقاس الاستعمار العد المجهري. ومع ذلك، ما لم البكتيريا التي لا تعبر عن GFP بشكل كبير، معربا عن GFP تكومبيتي البكتيريا، البكتيريا، معربا عن GFP توطين ينبغي لأنسجة الديدان الخيطية في بعض الحيوانات على الأقل في عدد السكان واقتراح مواقع مهمة للنسيج الاستعمار الجرثومي. A التحذير منذ فترة طويلة من استخدام البروتين الفلوري سلالات هو أنها تعبير عن استعمار قد مجموعة مختلفة من الكفاءة مع سلالة التي لا تعبر عن البروتينات الفلورية (مثل 12).
قد الخطوات المذكورة في هذا البروتوكول تتطلب التحسين اعتمادا على الديدان الخيطية والأنواع البكتيرية التي يتم استخدامها. لاقتران للبكتيريا بعض الظروف التي يمكن تغييرها هي الطول ودرجة حرارة النمو، ونسبة المانحة إلى المتلقية، وبلازماتستخدم معرف. يتم سرد أمثلة من البلازميدات ذات الصلة في الجدول 2. وكانت كل من هذه البلازميدات استخدمت بنجاح في أي من البكتيريا أو Xenorhabdus Photorhabdus بالتعاون مع المضيف الديدان الخيطية على 14،17،20،24،33-35. لضمان صيانة المستقرة للبروتين فلوري خلال الاستعمار الديدان الخيطية فمن الأفضل لاستخدام البلازميد التي سوف تضاف الى الكروموسوم للبكتيريا المستهدفة. علاوة على ذلك، قد لا تأخذ بعض أنواع البكتيريا تصل هذه البلازميدات. على سبيل المثال، تم فقط pECM20 المستخدمة في X. nemtaophila وثيق الصلة سلالات بكتيرية 14 لأن هذا يدخل البلازميد في الكروموسوم باستخدام المنطقة مثلي بين البلازميد وكروموسوم، والبلازميد لن إدراج إذا كانت البكتيريا المستهدفة تفتقر هذه المنطقة. لاستخدام هذا البلازميد للبكتيريا أخرى، X. يجب أن تكون بديلا nematophila محددة المنطقة مع منطقة الجينومية من البكتيريا المستهدفة. فإن بعض مخططات البلازميد-R التحول أيضاequire بعض التعديلات من البروتوكول 1. على سبيل المثال، ميني-TN 7-KSGFP وPBK miniTn-7-ΩGm-DsRed تتطلب مساعد البلازميد التي تحتوي على الجينات تبديل (tsnABCDE) 33،35،36 إدراج في كروموسوم البكتيريا. اقتران هو الأكثر فعالية مع هذه تينيسي 7-مقرها البلازميدات، عندما يتم خلط 2-الثقافات ساعة (OD 600 ~ 0،3-0،4) في نسب متساوية.
بعد نجاح الاقتران من المهم الاستفادة من لوحات انتقائية الصحيح المطابق للبلازميد المستخدمة. يجب أن تحتوي على لوحات انتقائية المضادات الحيوية المشفرة على البلازميد لتحديد وجود البلازميد في المتلقي وعداد الاختيار ضد سلالات المانحة والمساعد. على سبيل المثال، عندما التصريف في pECM20 X. nematophila المضادة اختيار المستخدم هو الأمبيسلين لX. nematophila هو الأمبيسلين ومقاومة سلالة المانحة هو الأمبيسلين الحساسة. إذا المضادات الحيوية لمكافحة اختيار غير متوفر في ذويمكن استخدام نظامنا، وهو حمض diaminopimelic (DAP) تتطلب من الجهات المانحة. DAP-في النمو تتطلب سلالات، DAP إضافة إلى وسائل الإعلام نمو الصلبة والسائلة خلال خطوات ما قبل الاقتران والاقتران، وحذفت خلال مكافحة اختيار مراحل. عندما تغيب DAP سلالة المانحة سوف تنمو بشكل فعال وليس مكافحة المحددة.
لضمان نجاح العزلة البيض من الضروري للتحقق بدقة من أجل إنتاج البيض (الشكل 2). في وقت العزلة، ينبغي الديدان الخيطية الإناث تكون كاملة من البيض وبعض البيض يجب أن يكون مرئيا في وسائل الإعلام (الشكل 2A). إذا النيماتودا الإناث تنتج البيض المخصب سيكون قد وضعت على الأقل بعض البيض الطافي واضح كما لم يفقس الديدان الخيطية (الشكل 2B). لS. carpocapsae، فإن البيض من تغيير كروية لمستطيل قليلا قبل وضع الديدان الخيطية والفقس. والحقيقة أن توقيت أو شروط النمو تحتاج أيضا إلى الديدان الخيطية يمكن تعديلها لتحقيق أقصى قدر من البويضة المخصبةالعائد، بما في ذلك تقصير أو إطالة الفترة الزمنية قبل الحصاد البيض، أو باستخدام وسائل الإعلام البديلة المناسبة لهذه الأنواع الخيطية محددة. في نهاية العزلة، وينبغي أن تكون مرئية بسهولة البيض داخل المخزن المؤقت (الشكل 2C). المعلمات في البيض بروتوكول العزلة التي قد تتطلب التحسين تشمل التبييض وKOH التركيزات في حل البيض، فترة حضانة البيض في حل، أو سرعة الطرد المركزي. إذا عزل البيض تنتج البيض ولكن لا النيماتودا تطوير خلال زراعة المشترك، فمن الممكن أن البيض المعزولة هي غير قابلة للحياة. للتحقق من جدوى، وترك البيض المعزولة في المخزن المؤقت والانتظار لالديدان الخيطية ليفقس. يجب أن يفقس البيض خلال يوم أو يومين من العزلة ومن ثم يمكن استخدام الديدان الخيطية الأحداث في مقايسة شارك في زراعة. إذا كان يفقس البيض ولكن لا تتطور خلال الفحص شارك في زراعة، قد يكون من الضروري تغيير ظروف النمو أو الوسيلة المستخدمة لزراعة المشترك. نلاحظ أن studie السابقةعزلت البكتيريا ليالي خالية من الديدان الخيطية الديدان الخيطية تمرغ في بخليط من المضادات الحيوية (مثل 3،37). النهج وصفنا هنا مجانية وبعض المحاذير من تمرغ المضادات الحيوية، بما في ذلك استخدام المضادات الحيوية مع مضاعفات جراثيم، بكتيريا المقاومة للمضادات الحيوية تلويث، وآثار المضادات الحيوية على النيماتودا. قد مراحل معينة من الديدان الخيطية أيضا أن تكون مقاومة للمضادات الحيوية والاحتفاظ بهم المتكافلة البكتيرية 3. وأخيرا، نلاحظ أن للفحص المجهري، وتركيز الليفاميزول اللازمة لتجميد الديدان الخيطية قد تختلف مع الديدان الخيطية بالمنظومة مختلفة.
مرة واحدة وقد أنشئت هذه الطريقة في نظام الفائدة، فمن الممكن لتغيير أسلوب لجني مزيد من المعلومات. من خلال النظر في نقاط وقت سابق في دورة حياة الديدان الخيطية (البروتوكول 4)، يمكن للمرء أن يكون قادرا على تحديد كيفية البكتيريا والديدان الخيطية بدء ارتباطهم 14،16. وبالإضافة إلى ذلك، يمكن استخدام هذا النهج رس إجراء شاشات عالية الإنتاجية متحولة إلى تحديد العوامل البكتيرية المشتركة في التعايش، وذلك باستخدام مضان للكشف عن الاستعمار 17،18. أساليب أخرى مثل الطفرات التوقيع الموسومة تتطلب استخدام تحقيقات المسمى بالإشعاع وأكثر استهلاكا للوقت 22،28. ولذلك، فإن استخدام المجهر مضان لرؤية المتكافل البكتيرية في النيماتودا هو أداة فحص فعالية وكفاءة للتحقيق في التفاعلات البكتيرية مع مجموعة الديدان الخيطية.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
الكتاب أود أن أشكر أوجينيو فيفاس، Heungens كورت، مارتنز اريك، كولز تشارلز، سكر داربي، Stabb اريك، وتود Ciche لما قدموه من مساهمات في تطوير هذا البروتوكول والأدوات المستخدمة. وقدم الدعم KEM وJMC من المعاهد الوطنية للصحة (NIH) الجائزة الوطنية خدمة أبحاث T32 (AI55397 "الميكروبات في الصحة والمرض"). وأيد من قبل JMC مؤسسة العلوم الوطنية (NSF) زمالة دراسات عليا أبحاث. وأيد هذا العمل من المنح المقدمة من المؤسسة الوطنية للعلوم (IOS-0920631 0950873 وIOS).
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | كتالوج رقم | التعليقات (اختياري) |
| الدهون آجار (العقيمة) | 8 غرامات المرق المغذي، 15 غراما أجار، 5 خلاصة الخميرة غرام، 890 مل ماء، 10 مل 0.2 جم / مل MgCl 2. 6H 2 0، 96 مل شراب الذرة * حل، 4 مل زيت الذرة * اثارة وسائل الاعلام بينما تتدفق لوحات * إضافة مادة معقمة التعقيم بعد | ||
| شراب الذرة الحل (العقيمة) | 7 مل شراب الذرة، و 89 مل ماء ومزيج الأوتوكلاف | ||
| البيض الحل | 16،6 مل هيبوكلوريت الصوديوم 12٪، 5 مل KOH 5M، 80 مل ماء | ||
| استذابة مرق (العقيمة) | 5 خلاصة الخميرة غراما و 10 غراما تريبتون، 5 غرامات ملح، 1 L المياه ومزيج الأوتوكلاف | ||
| Microfuge | الصياد | 13-100-675 | فإن أي microfuge التي تحمل أنابيب microfuge العمل |
| نبذ | بيكمان | 366802 | كبير الطرد المركزي التي تحمل قمة الجدول 15 مل و 50 مل المخروطية أنابيب |
| معقمة 60 مم X 15 مم طبق بتري | الصياد | 0875713 | |
| 50 مل أنابيب الطرد المركزي | الصياد | 05-539-6 | |
| 15 مل أنابيب الطرد المركزي | الصياد | 05-531-6 | |
| العقيمة 100 مم X 20 مم طبق بتري | الصياد | 0875711Z | أعمق من أطباق بتري القياسية |
| 24 لوحة جيدا | غرينر بيو واحد | 662000-06 | |
| مجهر | المجهر الفلورسنت يحتاج قدرات متوافق مع fluorophore الخاص | ||
| بارافورمالدهيد | علوم المجهر الإلكتروني | 15710 | |
| PBS (العقيمة) | 8 ز كلوريد الصوديوم 0.2 غرام KCL 1،44 ز نا 2 HPO 4 0،24 ز KH 2 PO 4 1 L المياه ضبط الرقم الهيدروجيني إلى 7.4 في المياه وإلى 1 L والأوتوكلاف | ||
| Microfuge أنابيب | الصياد | 05-408-138 | 2 مل أو 1.5 مل أنابيب |
| الرجاجة | فإن أي شاكر الذي يتسبب في السائل لتحريك بلطف العمل | ||
| Diaminopimelic حمض | سيجما | D-1377 | إذا لزم الأمر، استكمال وسائل الإعلام إلى التركيز أو مم 1 |
References
- Holterman, M., van der Wurff, A. Phylum-wide analysis of SSU rDNA reveals deep phylogenetic relationships among nematodes and accelerated evolution toward crown clades. Mol. Biol. Evol. 23, 1792-1800 (2006).
- Lambshead, P. J. D., Boucher, G. Marine nematode deep-sea biodiversity - hyperdiverse or hype. J. Biogeogr. 30, 475-485 (2003).
- Poinar, G. O. J., Thomas, G. M. Significance of Achromobacter nematophilus Poinar and Thomas (Achromobacteraceae: Eubacteriales) in the development of the nematode, DD-136 (Neoaplectana sp. Steinernematidae). Parasitol. 56, 385-390 (1966).
- Herbert, E. E., Goodrich-Blair, H. Friend and foe: the two faces of Xenorhabdus nematophila. Nat. Rev. Microbiol. 5, 634-646 (2007).
- Kaya, H. K., Gaugler, R. Entomopathogenic nematodes. Annu. Rev. Entomol. 38, 181-206 (1993).
- Bird, A. F., Akhurst, R. J. The nature of the intestinal vesicle in nematodes of the family Steinernematidae. Int. J. Parasitol. 13, 599-606 (1983).
- Martens, E. C., Goodrich-Blair, H. The Steinernema carpocapsae intestinal vesicle contains a subcellular structure with which Xenorhabdus nematophila associates during colonization initiation. Cell. Microbiol. 7, 1723-1735 (2005).
- Snyder, H. A., Stock, S. P., Kim, S. K., Flores-Lara, Y., Forst, S. New insights into the colonization and release process of Xenorhabdus nematophila and the morphology and ultrastructure of the bacterial receptacle of its nematode host, Steinernema carpocapsae. Appl. Environ. Microbiol. 73, 5338-5346 (2007).
- Abebe, E., Abebe-Akele, F., Morrison, J., Cooper, V., Thomas, W. K. An insect pathogenic symbiosis between a Caenorhabditis and Serratia. Virulence. 2, 158-161 (2011).
- Abebe, E., Jumba, M. An entomopathogenic Caenorhabditis briggsae. J. Exp. Biol. 213, 3223-3229 (2010).
- Torres-Barragan, A., Suazo, A., Buhler, W. G., Cardoza, Y. J. Studies on the entomopathogenicity and bacterial associates of the nematode Oscheius carolinensis. Biol. Control. 59, 123-129 (2011).
- Ye, W. M., Torres-Barragan, A., Cardoza, Y. Oscheius carolinensis n. sp (Nematoda: Rhabditidae), a potential entomopathogenic nematode from vermicompost. Nematology. 12, 121-135 (2010).
- Zhang, C., Liu, J. Heterorhabditidoides chongmingensis gen. nov., sp. nov. (Rhabditida: Rhabditidae), a novel member of the entomopathogenic nematodes. J. Invertebr. Pathol. 98, 153-168 (2008).
- Martens, E. C., Heungens, K., Goodrich-Blair, H. Early colonization events in the mutualistic association between Steinernema carpocapsae nematodes and Xenorhabdus nematophila bacteria. J. Bacteriol. 185, 3147-3154 (2003).
- Ciche, T. A., Ensign, J. C. For the insect pathogen, Photorhabdus luminescens, which end of a nematode is out. Appl. Environ. Microbiol. 69, 1890-1897 (2003).
- Ciche, T. A., Kim, K. S., Kaufmann-Daszczuk, B., Nguyen, K. C., Hall, D. H. Cell invasion and matricide during Photorhabdus luminescens transmission by Heterorhabditis bacteriophora nematodes. Appl. Environ. Microbiol. 74, 2275-2287 (2008).
- Easom, C. A., Joyce, S. A., Clarke, D. J. Identification of genes involved in the mutualistic colonization of the nematode Heterorhabditis bacteriophora by the bacterium Photorhabdus luminescens. BMC Microbiol. 10, 45(2010).
- Somvanshi, V. S., Kaufmann-Daszczuk, B., Kim, K. S., Mallon, S., Ciche, T. A. Photorhabdus phase variants express a novel fimbrial locus, mad, essential for symbiosis. Mol. Microbiol. 77, 1021-1038 (2010).
- Martens, E. C., Russell, F. M., Goodrich-Blair, H. Analysis of Xenorhabdus nematophila metabolic mutants yields insight into stages of Steinernema carpocapsae nematode intestinal colonization. Mol. Microbiol. 51, 28-45 (2005).
- Sugar, D. R., Murfin, K. E. Phenotypic variation and host interactions of Xenorhabdus bovienii SS-2004, the entomopathogenic symbiont of Steinernema jollieti nematodes. Env. Microbiol. 14, 924-939 (2012).
- Cowles, C. E., Goodrich-Blair, H. The Xenorhabdus nematophila nilABC genes confer the ability of Xenorhabdus spp. to colonize Steinernema carpocapsae nematodes. J. Bacteriol. 190, 4121-4128 (2008).
- Heungens, K., Cowles, C. E., Goodrich-Blair, H. Identification of Xenorhabdus nematophila genes required for mutualistic colonization of Steinernema carpocapsae nematodes. Mol. Microbiol. 45, 1337-1353 (2002).
- Goetsch, M., Owen, H., Goldman, B., Forst, S. Analysis of the PixA inclusion body protein of Xenorhabdus nematophila. J. Bacteriol. 188, 2706-2710 (2006).
- Bhasin, A., Chaston, J. M., Goodrich-Blair, H. Mutational Analyses Reveal Overall Topology and Functional Regions of NilB, a Bacterial Outer Membrane Protein Required for Host Association in a Model of Animal-Microbe Mutualism. J. Bacteriol. 194, 1763-1776 (2012).
- Ciche, T. A., Goffredi, S. K. Methods in General and Molecular Microbiology. Reddy, C. A. , ASM Press. 394-419 (2007).
- Goodrich-Blair, H., Clarke, D., Grewal, P. S., Ciche, T. A. Insect Pathogens, Molecular Approaches and Techniques. Stock, S. P., Boemare, N., Vandenberg, J., Glazar, I. , CABI Publishing. 239-269 (2009).
- Stock, S. P., Goodrich-Blair, H. Manual of Techniques in Invertebrate Pathology. Lacey, L. A. , Elsevier Press. 375-425 (2012).
- Martens, E. C., Gawronski-Salerno, J. Xenorhabdus nematophila requires an intact iscRSUA-hscBA-fdx locus to colonize Steinernema carpocapsae nematodes. J. Bacteriol. 185, 3678-3682 (2003).
- Vivas, E. I., Goodrich-Blair, H. Xenorhabdus nematophilus as a model for host-bacterium interactions: rpoS is necessary for mutualism with nematodes. J. Bacteriol. 183, 4687-4693 (2001).
- White, G. F. A method for obtaining infective nematode larvae from cultures. Science. 66, 302-303 (1927).
- Ciche, T. A., Ensign, J. C. For the insect pathogen Photorhabdus luminescens, which end of a nematode is out. Appl. Environ. Microbiol. 69, 1890-1897 (2003).
- Sicard, M., Brun, N. L. e Effect of native Xenorhabdus on the fitness of their Steinernema hosts: contrasting types of interaction. Parasitol. Res. 91, 520-524 (2003).
- Lambertsen, L., Sternberg, C., Molin, S. Mini-Tn7 transposons for site-specific tagging of bacteria with fluorescent proteins. Environ. Microbiol. 6, 726-732 (2004).
- Miller, W. G., Leveau, J. H., Lindow, S. E. Improved gfp and inaZ broad-host-range promoter-probe vectors. Mol. Plant Microbe Int. 13, 1243-1250 (2000).
- Teal, T. K., Lies, D. P., Wold, B. J., Newman, D. K. Spatiometabolic stratification of Shewanella oneidensis biofilms. Appl. Environ. Microbiol. 72, 7324-7330 (2006).
- Bao, Y., Lies, D. P., Fu, H., Roberts, G. P. An improved Tn7-based system for the single-copy insertion of cloned genes into chromosomes of Gram-negative bacteria. Gene. 109, 167-168 (1991).
- Woodring, J. L., Kaya, H. K. Steinernematid and Heterorhabditid Nematodes: A Handbook of Biology and Techniques. Southern Cooperative Series Bulletin 331. , Arkansas Agricultural Experiment Station. (1988).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved