Method Article
Medindo a progressão do ciclo celular Cinética com marcação metabólica e Citometria de Fluxo
Neste Artigo
Resumo
Controlando mudanças subtis na progressão e cinética de fases do ciclo celular pode ser conseguida pelo uso de uma combinação de marcação metabólica de ácidos nucleicos com BrdU e coloração do ADN genómico total de via iodeto de propídio. Este método evita a necessidade de sincronização química de células de bicicleta, impedindo assim que a introdução de não-específica danos no ADN, que por sua vez afecta a progressão do ciclo celular.
Resumo
O controle preciso do início e progressão subseqüente através das diversas fases do ciclo celular são de suma importância na proliferação das células. Divisão do ciclo celular é uma parte integrante do crescimento ea reprodução e desregulação de componentes de ciclo-chave de células têm sido implicados nos eventos precipitantes de 1,2 carcinogénese. Agentes moleculares em terapias anti-câncer freqüentemente alvo vias biológicas responsáveis pela regulação e coordenação da divisão celular ciclo 3. Embora cinética do ciclo celular tendem a variar de acordo com o tipo de célula, a distribuição das células entre as quatro fases do ciclo celular é bastante consistentes dentro de uma linha de células particular devido ao padrão consistente de mitogénio e expressão do factor de crescimento. Eventos genotóxicos e outros estressores celulares pode resultar em um bloqueio temporário de progressão do ciclo celular, resultando em prisão ou uma pausa temporária em uma fase particular do ciclo celular para permitir a instituiçãogação de o mecanismo de resposta apropriada.
A capacidade de experimentalmente observar o comportamento de uma população de células com referência à sua fase de progressão do ciclo celular é um avanço importante na biologia celular. Procedimentos comuns, tais como mitótico sacudir, centrifugação diferencial ou a triagem de citometria de fluxo com base são usadas para isolar células em fases específicas do ciclo celular 4-6. Estes fraccionado, do ciclo celular fase enriquecidas populações são então submetidas a tratamentos experimentais. Pureza, o rendimento ea viabilidade das fracções separadas podem muitas vezes ser comprometida usando estes métodos de separação física. Como assim, o lapso de tempo entre a separação das populações de células e do início do tratamento experimental, no qual as células fraccionadas pode progredir a partir da fase seleccionado do ciclo celular, pode representar desafios significativos na aplicação bem sucedida e interpretação destas experiências.
Outras abordagens para stestágios do ciclo de UDy celulares incluem o uso de produtos químicos para sincronizar as células. O tratamento de células com inibidores químicos de chave processos metabólicos para cada fase do ciclo celular são úteis no bloqueio da progressão do ciclo celular para a fase seguinte. Por exemplo, os ribonucleótidos redutase células hidroxiureia suspende na conjuntura G1 / S através da limitação do fornecimento de desoxinucleótidos, os blocos de construção de DNA. Outros produtos químicos notáveis incluem o tratamento com afidicolina, um inibidor da alfa-polimerase para detenção G1, o tratamento com colchicina e Nocodazole, ambos os quais interferem com a formação do fuso mitótico para suspender as células em fase M e finalmente, o tratamento com o DNA de cadeia terminador 5-fluorodeoxyridine para iniciar S prisão fase 7-9. O tratamento com estas substâncias químicas é um meio eficaz de sincronização uma população inteira de células a uma fase particular. Com a remoção do produto químico, as células se juntar o ciclo celular em uníssono. Tratamento da liberação seguinte teste agentea partir da química do ciclo celular de bloqueio assegura que a resposta à droga eliciada é de um uniforme, do ciclo celular população fase-específica. No entanto, uma vez que muitos dos sincronizadores químicos são conhecidos compostos genotóxicos, provocando além da participação das vias de resposta diferentes (aos sincronizadores contra os agentes de teste) é um desafio.
Aqui nós descrevemos um método de marcação metabólica para seguir uma subpopulação de células ativamente de bicicleta através da sua progressão desde a fase de replicação do DNA, através da divisão e separação de suas células filhas. Juntamente com a quantificação de citometria de fluxo, este protocolo permite para a medição da progressão cinética do ciclo celular na ausência de qualquer mecanicamente ou quimicamente induzida celular salienta geralmente associado com outras células metodologias de ciclo de sincronização 10. Nas seções seguintes vamos discutir a metodologia, bem como algumas de suas aplicações em pesquisa biomédica.
Protocolo
1. Preparação de células
- Células da placa para alcançar uma densidade de aproximadamente 60% de confluência. As células devem estar em fase log, no momento da recolha. Para células MCF7, isto é conseguido por sementeira menos 5 x 10 5 células / placa 10 centímetros nos meios apropriados. HT29 e LS180 células são semeadas a 6 x 10 5 células / placa 6 cm. Utilizou-se meio DMEM suplementado com 10% de FBS, penicilina e 1x / estreptomicina. Certifique-se de placas de sementes para os controles corretos positivos e negativos emAlém de amostras de teste. Eles incluem o seguinte:
| Eu | controlo positivo | BrdU apenas |
| ii | controlo positivo | PI só |
| iii | controle negativo | BrdU negativo, PI negativo |
(Deve ser notado que uma experiência preliminar com pontos temporais múltiplas, tais como o descrito na presente protocolo pode ser utilizado para diminuir o período de tempo durante o qual a efectuar colecções futuras.)
- As células plaqueadas são incubadas a 37 ° C, 5% de CO2 durante 24-48 h, permitindo assim que as células para recuperar e juntar.
- Para pulsar as células de etiquetas com bromodeoxiuridina (BrdU), DMEM é substituído with meio fresco contendo 10 mM de BrdU. As células são incubadas durante 1 h, a 37 ° C, 5% de CO 2 para permitir a incorporação de BrdU no DNA. Certifique-se de deixar um prato cru para atuar como controle negativo.
- Os meios de impulso de rotulagem é removido e as células são lavadas brevemente com PBS 1X.
- Meios de crescimento fresco é adicionado (menos o BrdU) e as células são permitidos para continuar a incubar a 37 ° C, 5% de CO 2 até que o instante apropriado para a colheita é atingido.
2. Colheita e Fixação
- Células não tratadas a partir do passo 1,3 são considerados o instante zero. Esta amostra pode ser colhido em conjunto com o 1 h timepoint o qual é recolhido imediatamente após o tratamento BrdU.
- Para a colheita das células, meio é removido e as placas são lavadas uma vez com PBS 1X.
- As células são tripsinizadas, recolhido em meios de cultura e subsequentemente sedimentadas por centrifugação a 1500 rpm durante 5 min Supernatant é descartado.
- Lavar 1-10 x 10 6 células em 5 ml de gelo frio 1X PBS. Centrifugar a 1500 rpm durante 5 min O sobrenadante é descartado.
- O sedimento celular é então ressuspenso em 100 ul de PBS gelado / 1% de FBS. A adição de FBS a 1% em PBS auxilia na prevenção de agregação celular.
- Adicionar gota estes células por gota a 5 ml de -20 ° C, etanol a 70% para fixar as células.
- Incubar em gelo durante 30 min ou armazenar a 4 ° C durante a noite. Este é um passo no qual ideal para parar a recolha de amostras a partir dos pontos temporais diferentes. As amostras podem ser deixados em etanol durante vários dias, o que lhes permite ser processados simultaneamente através do resto do protocolo.
3. Coloração BrdU e PI
- Células de pelotas por centrifugação durante 5 min a 1500 rpm.
- Remover o fixador, mas deixam ~ 50 ul em que a afrouxar o sedimento em vórtice.
- Para desnaturar o DNA, adicionar lentamente 1 ml de HCl 2N / Triton X-100gota a gota enquanto vortex. Incubar as amostras à temperatura ambiente durante 30 min.
- Células de pelotas por centrifugação amostras durante 5 min a 1500 rpm. Aspirar e desprezar o sobrenadante.
- Ressuspender o sedimento de células em 1 ml de tetraborato de sódio 0,1 M, pH 8,5, para neutralizar o passo de desnaturação.
- Centrifugar células durante 5 min a 1500 rpm. Aspirar e desprezar o sobrenadante.
- Ressuspender o sedimento de células em 75 ul de BrdU mistura de coloração (50 ul 0,5% de Tween 20/1% de BSA / PBS + 20 uL conjugado com FITC anti-BrdU + 5 ul de 10 mg / ml de RNase).
- Incubar a temperatura ambiente durante 45 min protegida da luz.
- Para células de pelotas, centrifugar as amostras durante 5 min a 1500 rpm. Aspirar e desprezar o sobrenadante.
- Ressuspender o sedimento de células em 1 ml de PBS contendo 5 ug / ml de iodeto de propídio.
4. Citometria de Fluxo
- Para analisar as células, um citómetro de fluxo equipado com um laser de 488 nm eafiltros adequados é necessário. Software de análise, tais como CellQuest é necessário para criar as parcelas descritas abaixo.
- Ao executar a amostra através do citómetro de fluxo, criar uma dispersão para a frente (SSC-H) vs lado de dispersão (FSC-H) trama para assegurar a distribuição de tamanho apropriado de células (Figura 1A). Ambos estes parâmetros são traçados em escala linear.
- Ao mesmo tempo ver um pedaço de FL3-H (PI mancha) versus FL2-W (Figura 1B). Este lote é usado para criar um portão (R3) para isolar a fracção de células que estão dentro do padrão de distribuição normal do ciclo celular. Em geral, este padrão de distribuição é caracterizado por dois grupos de células a partir do conteúdo de DNA 2N e 4N de PI que representa a coloração G1 e G2 fases do ciclo celular, respectivamente. Uma série de células localizadas entre estes 2 aglomerados é representativa de replicação do ADN em curso que ocorre na fase S do ciclo celular.
- Criar um displayi enredong as células gated (R3) a partir do passo 4.3, com FL1-H (FITC, gráfico log) sobre o eixo y e PI (gráfico linear) sobre o eixo X (Figura 1C). Este lote será utilizada para definir os parâmetros restantes usando os vários controlos descritos em 1,1, bem como para recolher dados para análise.
- Coloque o PI apenas uma amostra manchado para o citômetro. Ajustar o ganho G1 para colocar a ~ 200 sobre o eixo x. Este será mais fácil de visualizar em um histograma do PI mancha.
- Um segundo controlo envolve a execução de uma amostra de BrdU-somente no citómetro de fluxo. Ajuste o ganho de modo que as 2 populações de células (BrdU positivo versus negativo BrdU) aparecem na trama. Idealmente, as células BrdU negativos são posicionados para aparecer logo abaixo 10 -1.
- O controlo final é a amostra BrdU / PI negativo. Executar este controlo negativo para assegurar que as células não aparecer em qualquer um dos quadrantes mão superior ou para a direita.
- Uma vez que os parâmetros dos diversos terrenos terem sido definidos, ocitómetro de fluxo é calibrado e pronto para o processamento de BrdU e PI células coradas. Um mínimo de 10.000 células que estão fechado na fração PI correta (veja passo 4.3) deve ser lido por coleção.
- Para analisar os dados coletados, software, tais como FlowJo ou FacsDiva são utilizados. Cada uma das parcelas acima mencionadas podem ser recriados nestes programas e análise quantitativa e estatística realizada.
- O ponto final da análise, envolve várias etapas sucessivas. Criar um gráfico de FITC vs PI com células fechadas como PI positivo do enredo PI versus FL2-W permite distinguir a população andar de bicicleta. Uma segunda porta é criado a partir deste gráfico, isolando a população BrdU positivo. Expressando esta população distintivo num lote histograma com PI sobre o eixo x permite uma para controlar o curso de tempo da progressão do ciclo celular. Isto pode ser ainda mais visualizados através da representação gráfica do número de células positivas para BrdU-com G1 ou G2 conteúdo como uma função do tempo.
5. Os resultados representativos
Normalmente, as células de ciclismo coradas com iodeto de propídio têm picos distintos no G1 e G2, que correspondem a células que contêm o conteúdo de DNA 2N e 4N, respectivamente (Figura 2). Pulso marcação com BrdU permite rotulagem selectiva de uma sub-população de células que são activamente síntese de DNA (ou seja, fase S). Pouco tempo depois da remoção do reagente BrdU, todas as células marcadas são em fase S (Figura 3). Ao restringir rotulagem a um pulso curto uma é capaz de seguir esta agora distinta sub-população de células ao longo pontos de tempo numerosos à medida que passam através das fases subsequentes do ciclo celular. Isto pode ser visualizado no ponto de tempo de 1 h na Figura 3 como uma falta distinta de G1 e G2 picos.
Informações adicionais podem ser derivadas a partir do passo de rotulagem BrdU. Não só a proporção de células que se dividem activamente ser medido, mas uma estimate de célula de distribuição fase do ciclo entre duas amostras pode ser determinada também. Através da recolha de células em intervalos igualmente espaçados após a remoção do reagente BrdU, as células podem ser rastreados quanto elas continuam a progredir ciclo, para G2 e, finalmente, mover-se através da divisão celular das células originais, finalmente a emergir como células BrdU-positivas filha com G1 O conteúdo de DNA (Figura 4). Um exemplo de célula quantificação fase do ciclo e análise cinética é fornecida na Figura 5.
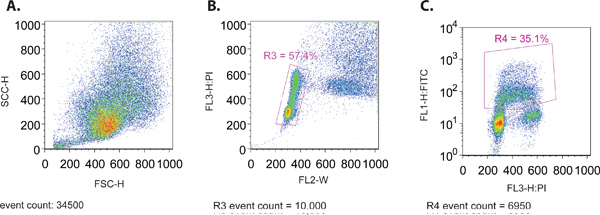
Figura 1. (A) Forward Scatter contra Dispersão lateral de uma população de células representante MCF7. (B) em relação PI largura da parcela (FL-W) de uma população de células MCF7 representativa. Gating é mostrado para excluir dupletos de células na análise final (R3). Dupletos célula terá largura maior do pulso do que uma única célula, uma vez que levam mais tempo para passar através do feixe de laser e Therefminério pode ser excluídos da análise. (C) contra PI FITC Lote (BrdU) de uma população de células MCF7 representativa. Gating é mostrado para incluir apenas os FITC (BrdU), as células positivas (R4).
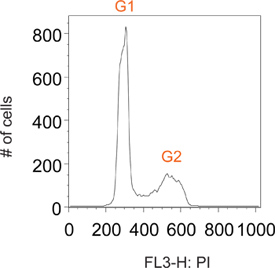
Figura 2. Parcela representativa do histograma de uma população total de células normalmente ciclismo.

Figura 3. Histograma de células que tenham sido recolhidos 1h após a remoção do pulso BrdU, após gating para FITC (BrdU)-células positivas. BrdU células positivas em um instante precoce após a remoção do rótulo apresentam perfis de PI que correspondem a amostras visualizar o conteúdo de DNA de acordo com células que estão na fase S do ciclo celular, confirmando a rotulagem bem sucedida de células apenas durante a síntese de ADN.
 lt = "Figura 4" />
lt = "Figura 4" />
Figura 4. Comparação da cinética de progressão do ciclo celular entre as linhas celulares de cancro da, cancros colorrectais HT29 (A) e LS180 (B), bem como o cancro da mama MCF7 (C). As células foram recolhidas a cada hora durante 8 horas, após a remoção do pulso BrdU. Nesta experiência, observou-se um perfil de clara de progressão do ciclo celular acelerado através da fase G2 do ciclo celular na LS180 colorectal linha celular. Comparando a cinética entre os dois perfis de células cancerosas colorectal, o aparecimento de um pico de G1 é evidente a T = 4h de pós-BrdU nas células LS180, em comparação com o ponto de tempo correspondente para a linha de células HT-29 que não possui este pico. Comparado com qualquer uma das duas linhas de células colorrectais, MCF7 células são bicicleta, a uma taxa significativamente reduzida. para ver figura maior .
re 5 "/>
Figura 5. (A) Quantitativa célula análise fase do ciclo de células BrdU-etiquetados cancerosas. O algoritmo de Dean / Jett / Fox foi aplicado a HT29, LS180 e MCF7 (ilustrado em verde). As células resultantes distribuições ciclo de fase de cada amostra são expressos como% total de células positivas para BrdU para cada fase. Apenas seleccionar pontos de tempo para cada linha de células são apresentados, como as análises para alguns dos pontos de tempo anteriores produzido resultados inválidos. Nestes pontos de tempo anteriores, todas as células BrdU-positivas estão em fase S e, por conseguinte, não têm G1 distinta e picos G2, que são necessárias para a aplicação do algoritmo. (B) Os histogramas de células cancerosas mostrando a cinética da progressão através G2 / M fases do ciclo celular. A progressão G2 / M fases é mais rápido para LS180 células, seguido por HT29 e MCF7. Clique aqui para ver maior figura .
"alt =" jpg Figura S1 "/>
Figura S1. Controles de citometria de fluxo. células MCF7 são mostrados como (A) controlo negativo, onde as células não são nem PI nem manchado BrdU. (B) apenas manchada PI. (C) BrdU-FITC amostras.
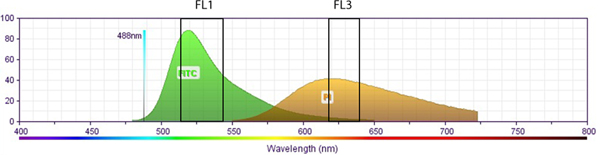
Figura ilustração. Esquemática S2 mostrando a relação entre espectro de emissão fluorescente de PI contra FITC (BrdU). As janelas de recolha espectrais para o canal fluorescente 1 (FL1, para FITC) e no canal fluorescente 3 (FL3, por PI) são mostrados em caixas correspondentes. Não há sobreposição de espectros fluoróforo entre FL1 e FL3 detecção. Evidentemente, a compensação de fluorescência não é necessário, quando os dados experimentais de PI e FITC-BrdU co-marcadas células são recolhidas nos canais FL1/FL3 respectivamente. Espectros de fluorescência foram obtidos a partir de BD site BioSciences:target = "_blank"> http://www.bdbiosciences.com/research/multicolor/spectrum_viewer. Clique aqui para ver maior figura .
Discussão
Através da combinação de citometria de fluxo com incorporação de BrdU, temos as ferramentas necessárias para estudar a cinética do ciclo celular. A propriedade distintiva de BrdU para funcionar como um análogo da timidina é o que permite a quantificação de ADN conteúdo de uma célula de ciclismo. A incorporação de BrdU em uma fita crescente filha ADN durante a fase de síntese do ciclo celular é o que permite uma a seguir uma subpopulação de células de ciclismo através da replicação de ADN em fase S, para um período de crescimento em G2 e, finalmente, para a divisão celular . Filha BrdU células positivas pode ser continuamente seguido até que ponto no tempo o rótulo BrdU é diluída por divisão celular com o grau em que o sinal é reduzido a níveis de fundo.
Usando iodeto de propídio para determinar o conteúdo de DNA total, somos capazes de acompanhar a progressão do ciclo celular da S → G2 / M → G1. A capacidade de controlar a taxa de ciclagem de células é importante e útil em muitas aplicações, especialmente for estudos pré-clínicos que envolvem ciclo celular específicos de DNA drogas danos indutores ou durante o processo de desenvolvimento de fármacos para determinar a sensibilidade de células fase do ciclo de novos compostos 11. A vantagem mais óbvia da utilização de uma técnica de marcação metabólica é a eliminação de sincronização química das células. Como a maioria dos tratamentos químicos que induzem paragem do ciclo celular são, eles próprios genotóxico, dissecando os efeitos do ciclo de células de sensibilidade de novos compostos na presença destes produtos químicos pode não ser viável.
Nós demonstramos a versatilidade desta técnica marcação metabólica com BrdU PI co-coloração. Usando este protocolo, conseguimos demonstraram que o aumento na progressão do ciclo celular através da fase G2 / M do ciclo celular pode ser observado na telomerase-negativas células humanas que foram transformadas ter forçado a expressão da enzima 10. Embora este método é poderosa em medir a cinética da célula em que os ciclos de through fases múltiplas, uma limitação é a perda de informação de temporização durante as transições, bem como dentro das fases G2 e M. Como as células prosseguir através G2 para M, somos incapazes de distinguir não apenas as duas fases, mas também a população G1 sub-, baseado unicamente em teor de ADN. Em aplicações onde esta diferenciação é necessária, é potencialmente possível para as células co-mancha BrdU marcadas com anticorpos contra ciclinas ou outras proteínas celulares, cuja expressões são específicos para a fase desejada do ciclo celular 12,13. Optimização adicional será necessário para assegurar que os anticorpos de ciclina são compatíveis com o rótulo BrdU e imuno-coloração de protocolo. Idealmente, para diferenciar adequadamente as várias fases do ciclo celular, os anticorpos ciclina vários pode ser necessário para a co-label uma única amostra simultaneamente. O nosso laboratório está a trabalhar na pós-rotulagem de BrdU-pulso células marcadas com ciclina B e histona fosfo 3 anticorpos para diferenciar entre célulasem G2 contra fase M do ciclo celular. Co-rotulagem com anticorpos de ciclina, para além de coloração PI e FITC-BrdU aumenta substancialmente a complicação de citometria de fluxo a partir de hardware um e análise de dados (questões de compensação de fluorescência) perspectiva. Com o advento da nova geração de citómetros de fluxo, os avanços em sua capacidade e funcionalidade deve aliviar estas preocupações técnicas.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Agradecemos a Andy Johnson, do Centro de Pesquisa Biomédica da UBC para a assistência com a análise FACS. Financiamento de Pesquisa do Câncer no Laboratório de Wong é fornecido pelo Canadian Cancer Society Research Institute (subvenção de funcionamento # 019250) e de fundos de pesquisa de reinvestimento da Faculdade de Ciências Farmacêuticas, UBC. JMYW é apoiado pelos presidentes de Pesquisa do Canadá ea Fundação Michael Smith para Pesquisa em Saúde programas de desenvolvimento de carreira.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente | Companhia | Número de Catálogo | Comentários |
| bromodeoxiuridina | Becton Dickinson | 55089 | |
| iodeto de propídio | Sigma | 287075 | 1mg/ml estoque |
| FITC anti-BrdU | Becton Dickinson | 347583 | |
| tetraborato de sódio | Pescador | S80172 | 0,1 M, pH 8,5 |
| Caliber FACS | Becton Dickinson |
Referências
- Musgrove, E. A., Caldon, C. E., Barraclough, J., Stone, A., Sutherland, R. L. Cyclin D as a therapeutic target in cancer. Nat. Rev. Cancer. 11, 558-572 (2011).
- Molchadsky, A., Rivlin, N., Brosh, R., Rotter, V., Sarig, R. p53 is balancing development, differentiation and de-differentiation to assure cancer prevention. Carcinogenesis. 31, 1501-1508 (2010).
- Dickson, M. A., Schwartz, G. K. Development of cell-cycle inhibitors for cancer therapy. Curr. Oncol. 16, 36-43 (2009).
- Banfalvi, G. Cell cycle synchronization of animal cells and nuclei by centrifugal elutriation. Nat. Protoc. 3, 663-673 (2008).
- van Opstal, A., Boonstra, J. Inhibitors of phosphatidylinositol 3-kinase activity prevent cell cycle progression and induce apoptosis at the M/G1 transition in CHO cells. Cell Mol. Life Sci. 63, 220-228 (2006).
- Gasnereau, I. Flow cytometry to sort mammalian cells in cytokinesis. Cytometry. A. 71, 1-7 (2007).
- Harper, J. V. Synchronization of cell populations in G1/S and G2/M phases of the cell cycle. Methods Mol. Biol. 296, 157-166 (2005).
- Pedrali-Noy, G. Synchronization of HeLa cell cultures by inhibition of DNA polymerase alpha with aphidicolin. Nucleic Acids Res. 8, 377-387 (1980).
- Merrill, G. F. Cell synchronization. Methods Cell Biol. 57, 229-249 (1998).
- Fleisig, H. B., Wong, J. M. Telomerase promotes efficient cell cycle kinetics and confers growth advantage to telomerase-negative transformed human cells. Oncogene. , (2011).
- Cai, D., Byth, K. F., Shapiro, G. I. AZ703, an imidazo[1,2-a]pyridine inhibitor of cyclin-dependent kinases 1 and 2, induces E2F-1-dependent apoptosis enhanced by depletion of cyclin-dependent kinase 9. Cancer Res. 66, 435-444 (2006).
- Pozarowski, P., Darzynkiewicz, Z. Analysis of cell cycle by flow cytometry. Methods Mol. Biol. 281, 301-311 (2004).
- Sherwood, S. W., Rush, D. F., Kung, A. L., Schimke, R. T. Cyclin B1 expression in HeLa S3 cells studied by flow cytometry. Exp. Cell Res. 211, 275-281 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados