Method Article
قياس حركية تقدم دورة الخلية مع وصفها الأيض والتدفق الخلوي
In This Article
Summary
ويمكن تحقيق بعض التغييرات الطفيفة في تتبع تطور وحركية من مراحل دورة الخلية عن طريق استخدام مزيج من العلامات الأيضية من الأحماض النووية مع BrdU ومجموع تلطيخ الحمض النووي الجيني عن طريق يوديد Propidium. هذا الأسلوب يتجنب الحاجة لتزامن الكيميائية من الخلايا ركوب الدراجات، وبالتالي منع إدخال الحمض النووي من التلف غير محددة، وهذا بدوره يؤثر على تقدم دورة الخلية.
Abstract
Precise control of the initiation and subsequent progression through the various phases of the cell cycle are of paramount importance in proliferating cells. Cell cycle division is an integral part of growth and reproduction and deregulation of key cell cycle components have been implicated in the precipitating events of carcinogenesis 1,2. Molecular agents in anti-cancer therapies frequently target biological pathways responsible for the regulation and coordination of cell cycle division 3. Although cell cycle kinetics tend to vary according to cell type, the distribution of cells amongst the four stages of the cell cycle is rather consistent within a particular cell line due to the consistent pattern of mitogen and growth factor expression. Genotoxic events and other cellular stressors can result in a temporary block of cell cycle progression, resulting in arrest or a temporary pause in a particular cell cycle phase to allow for instigation of the appropriate response mechanism.
The ability to experimentally observe the behavior of a cell population with reference to their cell cycle progression stage is an important advance in cell biology. Common procedures such as mitotic shake off, differential centrifugation or flow cytometry-based sorting are used to isolate cells at specific stages of the cell cycle 4-6. These fractionated, cell cycle phase-enriched populations are then subjected to experimental treatments. Yield, purity and viability of the separated fractions can often be compromised using these physical separation methods. As well, the time lapse between separation of the cell populations and the start of experimental treatment, whereby the fractionated cells can progress from the selected cell cycle stage, can pose significant challenges in the successful implementation and interpretation of these experiments.
Other approaches to study cell cycle stages include the use of chemicals to synchronize cells. Treatment of cells with chemical inhibitors of key metabolic processes for each cell cycle stage are useful in blocking the progression of the cell cycle to the next stage. For example, the ribonucleotide reductase inhibitor hydroxyurea halts cells at the G1/S juncture by limiting the supply of deoxynucleotides, the building blocks of DNA. Other notable chemicals include treatment with aphidicolin, a polymerase alpha inhibitor for G1 arrest, treatment with colchicine and nocodazole, both of which interfere with mitotic spindle formation to halt cells in M phase and finally, treatment with the DNA chain terminator 5-fluorodeoxyridine to initiate S phase arrest 7-9. Treatment with these chemicals is an effective means of synchronizing an entire population of cells at a particular phase. With removal of the chemical, cells rejoin the cell cycle in unison. Treatment of the test agent following release from the cell cycle blocking chemical ensures that the drug response elicited is from a uniform, cell cycle stage-specific population. However, since many of the chemical synchronizers are known genotoxic compounds, teasing apart the participation of various response pathways (to the synchronizers vs. the test agents) is challenging.
Here we describe a metabolic labeling method for following a subpopulation of actively cycling cells through their progression from the DNA replication phase, through to the division and separation of their daughter cells. Coupled with flow cytometry quantification, this protocol enables for measurement of kinetic progression of the cell cycle in the absence of either mechanically- or chemically- induced cellular stresses commonly associated with other cell cycle synchronization methodologies 10. In the following sections we will discuss the methodology, as well as some of its applications in biomedical research.
Protocol
1. خلية التحضير
- خلايا لوحة لتحقيق كثافة ما يقرب من 60٪ confluency. يجب أن تكون الخلايا في مرحلة سجل في وقت جمع. لmcf7 الخلايا، ويتم ذلك عن طريق زرع البذور في 5 خلايا × 5 10/10 لوحة سم في وسائل الإعلام المناسبة. وبذرت HT29 وLS180 الخلايا في الخلايا 6 × 5 10/6 لوحة سم. استخدمنا وسائل الاعلام DMEM تستكمل مع FBS 10٪ و1X البنسلين / الستربتومايسين عقار. تأكد من لوحات البذور لعناصر الصحيحة الموجبة والسالبة فيبالإضافة إلى عينات الاختبار. وهي تشمل ما يلي:
| أنا | إيجابي مراقبة | BrdU فقط |
| الثاني | إيجابي مراقبة | بي فقط |
| ثالثا | السلبية السيطرة | BrdU سلبي، PI سلبي |
(وتجدر الإشارة إلى أنه يمكن استخدام تجربة أولية مع timepoints متعددة مثل تلك المبينة في هذا البروتوكول لتقليص الفترة الزمنية خلالها لتنفيذ المجموعات في المستقبل.)
- يتم تحضين الخلايا مطلي ب 37 درجة مئوية، ونسبة 5٪ CO 2 لمدة 24-48 ساعة، مما يتيح لاستعادة خلايا ونعلق.
- إلى نبض الخلايا التسمية مع bromodeoxyuridine (BrdU)، يتم استبدال DMEM وايالطازجة وسائل الاعلام عشر التي تحتوي على 10 BrdU ميكرومتر. يتم تحضين الخلايا لمدة 1 ساعة عند 37 درجة مئوية، وأول أكسيد الكربون بنسبة 5٪ 2 للسماح لدمج BrdU الى الحمض النووي. مما لا شك فيه أن يترك لوحة واحدة غير المعالجة لتكون بمثابة مراقبة سلبية.
- تتم إزالة وسائل الإعلام نبض وضع العلامات وتشطف الخلايا لفترة وجيزة مع PBS 1X.
- يضاف سائط النمو الطازجة (ناقص BrdU)، ويسمح للخلايا على مواصلة احتضان عند 37 درجة مئوية، ونسبة 5٪ CO 2 حتى يتم التوصل الى timepoint المناسب للحصاد.
2. حصاد والتثبيت
- وتعتبر الخلايا غير المعالجة من الخطوة 1.3 في timepoint صفر. ويمكن حصاد هذه العينة مع timepoint ح (1) التي يتم جمعها فورا بعد العلاج BrdU.
- لحصاد الخلايا، تتم إزالة وسائل الاعلام وتشطف لوحات ذات مرة في برنامج تلفزيوني مع 1X.
- وtrypsinized الخلايا، التي تم جمعها في وسائل الاعلام والتثقيف مكعبات في وقت لاحق عن طريق الطرد المركزي في 1500 دورة في الدقيقة لمدة 5 دقائق سوبيتم تجاهل ernatant.
- شطف 1-10 × 10 6 خلايا في 5 مل PBS الجليد 1X الباردة. يتم تجاهل الطرد المركزي في 1500 دورة في الدقيقة لالطافي (Supernatant) 5 دقائق.
- ومعلق ثم بيليه الخلية في 100 ميكروليتر من الجليد الباردة PBS FBS٪ 1 /. بالإضافة إلى ذلك من FBS 1٪ في برنامج تلفزيوني الإيدز في منع تكتل الخلية.
- إضافة هذه الخلايا قطرة قطرة إلى 5 مل من -20 درجة مئوية، والإيثانول بنسبة 70٪ لإصلاح الخلايا.
- احتضان على الجليد لمدة 30 دقيقة أو متجر عند 4 درجات مئوية خلال الليل. هذا هو خطوة مثالية في أي لوقف جمع عينات من مختلف timepoints. ويمكن ترك هذه العينات في الايثانول لعدة أيام، مما يسمح لتتم معالجتها في وقت واحد خلال الفترة المتبقية من هذا البروتوكول.
3. BrdU وPI تلطيخ
- بيليه الخلايا بواسطة الطرد المركزي لمدة 5 دقائق عند 1500 دورة في الدقيقة.
- إزالة مثبت، ولكن ترك ~ 50 ميكرولتر التي لتخفيف بيليه بواسطة vortexing.
- لتفسد على الحمض النووي، وإضافة ببطء 1 مل من HCL 2N / تريتون X-100قطرة قطرة في حين vortexing. احتضان العينات في درجة حرارة الغرفة لمدة 30 دقيقة.
- خلايا بيليه بواسطة الطرد المركزي عينات لمدة 5 دقائق عند 1500 دورة في الدقيقة. نضح وتجاهل طاف.
- Resuspend وبيليه خلية في 1 مل من 0.1M tetraborate الصوديوم، ودرجة الحموضة 8.5، لتحييد خطوة تمسخ.
- منبذة الخلايا لمدة 5 دقائق عند 1500 دورة في الدقيقة. نضح وتجاهل طاف.
- Resuspend وبيليه الخلية في 75 ميكرولتر من مزيج تلطيخ BrdU (50 ميكرولتر 0.5٪ توين 20/1٪ جيش صرب البوسنة / PBS + 20 FITC مترافق ميكرولتر مكافحة BrdU + 5 ميكرولتر ريبونوكلياز 10 ملغ / مل).
- احتضان في درجة حرارة الغرفة لمدة 45 دقيقة محمية من الضوء.
- إلى خلايا بيليه، منبذة العينات لمدة 5 دقائق عند 1500 دورة في الدقيقة. نضح وتجاهل طاف.
- Resuspend وبيليه خلية في 1 مل من برنامج تلفزيوني يحتوي على 5 ميكروغرام / مل يوديد propidium.
4. تدفق الخلوي
- لتحليل الخلايا، وتدفق عداد الكريات مجهزة ليزر 488 نانومتر والمرشحات المناسبة أمر ضروري. برامج التحليل مثل CellQuest هو ضروري لخلق المساحات المبينة أدناه.
- عند تشغيل نموذج من خلال تدفق عداد الكريات، إنشاء المبعثر إلى الأمام (SSC-H) في مقابل الجانب مبعثر (FSC-H) مؤامرة لضمان التوزيع المناسب لحجم الخلايا (الشكل 1A). يتم رسم كل من هذه المعايير على نطاق والخطية.
- عرض في وقت واحد قطعة من FL3-H (PI صمة عار) في مقابل FL2-W (الشكل 1B). وتستخدم هذه مؤامرة لإنشاء بوابة (R3) لعزل جزء من الخلايا التي تقع ضمن نمط التوزيع العادي للدورة الخلية. بشكل عام، ويتميز هذا النمط التوزيع من قبل اثنين من مجموعات من الخلايا من محتوى الحمض النووي 2N و4N من تلطيخ PI تمثل G1 و G2 مراحل من دورة الخلية، على التوالي. سلسلة من الخلايا التي تقع بين هذه المجموعات 2 هو ممثل تكرار الحمض النووي الجارية التي تحدث في مرحلة من مراحل دورة الخلية.
- إنشاء displayi مؤامرةنانوغرام الخلايا المغلقة (R3) من الخطوة 4.3، مع FL1-H (FITC، سجل مؤامرة) على محور y و PI (مؤامرة خطي) على محور س (الشكل 1C). وسوف تستخدم هذه المؤامرة لتعيين المعلمات المتبقية باستخدام عناصر التحكم المختلفة المبينة في 1.1، وكذلك لجمع البيانات لتحليلها.
- وضع الباحث عينة فقط الملون على لعداد الكريات. ضبط مكسب لوضع G1 في ~ 200 على المحور س. هذا سوف يكون من الأسهل تصور في مؤامرة الرسم البياني للPI وصمة عار.
- والثانية تشمل مراقبة تشغيل عينة BrdU فقط على تدفق عداد الكريات. ضبط الربح بحيث السكان 2 من الخلايا (BrdU إيجابي مقابل BrdU السلبية) تظهر في هذه المؤامرة. من الناحية المثالية، يتم وضع الخلايا BrdU السلبية لتظهر فقط أقل من 10 -1.
- التحكم النهائي هو عينة BrdU / PI سلبي. تشغيل هذا الشاهد السلبي للتأكد من أن الخلايا لا تظهر في أي من الأرباع اليد العليا أو اليمين.
- بمجرد أن يتم تعيين المعلمات من المؤامرات المختلفة،يتم معايرة عداد الكريات تدفق وعلى استعداد لمعالجة الخلايا BrdU وPI الملون. يجب أن تقرأ ما لا يقل عن 10000 الخلايا التي هي بوابات في جزء PI الصحيح (الرجوع إلى الخطوة 4.3) لكل مجموعة.
- لتحليل البيانات التي تم جمعها، ويتم استخدام البرمجيات مثل FlowJo أو FacsDiva. ويمكن أن يعاد كل من المؤامرات المذكورة في هذه البرامج وإجراء التحليل الكمي والإحصائي.
- نقطة النهاية لتحليل ينطوي على عدة خطوات متتالية. خلق قطعة FITC مقابل PI مع الخلايا المغلقة كما PI إيجابية من مؤامرة PI مقابل FL2 W-يسمح احد لتمييز السكان ركوب الدراجات. يتم إنشاء بوابة ثانية من هذه المؤامرة من خلال عزل السكان BrdU إيجابي. معربا عن هذه الفئة من السكان مميزة على قطعة أرض المدرج مع PI على المحور س يسمح احد لتتبع مسار الوقت للتقدم دورة الخلية. وهذا يمكن أن يكون أبعد تصور من قبل المتهم بالتآمر في عدد من BrdU إيجابية الخلايا مع G1 أو محتوى G2 بوصفها وظيفة من الزمن.
5. ممثل النتائج
عادة خلايا الدراجات ملطخة يوديد propidium لها قمم متميزة في G1 و G2، الموافق الخلايا التي تحتوي على 2N و4N محتوى الحمض النووي، وعلى التوالي (الشكل 2). نبض الوسم مع BrdU يسمح لوضع العلامات الانتقائية للسكان شبه من الخلايا التي يتم تجميع بنشاط الحمض النووي (أي مرحلة S). بعد وقت قصير من إزالة كاشف BrdU، كل الخلايا وصفت في مرحلة S (الشكل 3). عن طريق تقييد وضع العلامات على نبض قصير واحد قادر على متابعة هذه متميزة الآن شبه السكان من الخلايا طوال الوقت نقاط عديدة لأنها تمر من خلال مراحل لاحقة من دورة الخلية. يمكن أن يكون هذا التصور عند نقطة ح 1 مرة في الشكل (3) ونقص واضح في G1 و G2 القمم.
يمكن الحصول على معلومات إضافية من خطوة ووضع العلامات BrdU. لا يمكن إلا أن يكون قياس نسبة الخلايا بنشاط الفاصل، وإنما هو بتوقيت شرق الولايات المتحدةويمكن تحديد imate من دورة الخلية مرحلة التوزيع بين عينتين كذلك. من خلال جمع الخلايا على فترات زمنية متساوية بعد إزالة كاشف BrdU، يمكن تتبع الخلايا لأنها لا تزال تقدم، دورة لG2 والانتقال في نهاية المطاف من خلال لانقسام الخلايا من الخلايا الأصلية، الناشئة أخيرا كما الخلايا الوليدة BrdU إيجابية مع G1 محتوى الحمض النووي (الشكل 4). وتقدم مثالا للدورة الخلية الكمي مرحلة والتحليل الحركي في الشكل 5.
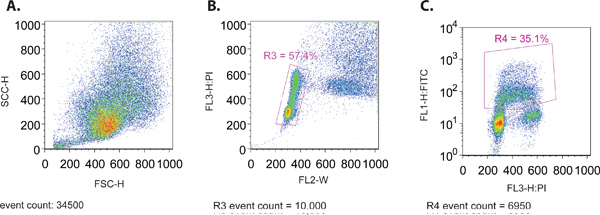
الشكل 1. (A) مبعثر الأمام مقابل الجانب مؤامرة مبعثر من السكان ممثل خلية mcf7. (ب) PI مقابل العرض (FL-W) قطعة من مجموعة من السكان ممثل خلية mcf7. ويرد النابضة لاستبعاد الحلل خلية في التحليل النهائي (R3). والحلل خلية لديها أكبر عرض النبضة من خلية واحدة، لأنها تأخذ وقتا أطول لتمر من خلال شعاع الليزر وtherefويمكن استبعاد خام من التحليل. (C) PI مقابل FITC (BrdU) مؤامرة خلية سكان ممثل mcf7. ويرد النابضة لتشمل فقط (BrdU) الخلايا FITC إيجابي (R4).
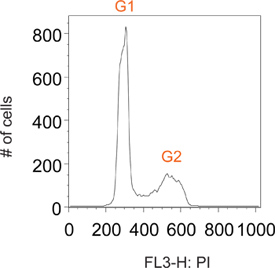
الشكل 2. الممثل مؤامرة الرسم البياني من إجمالي عدد السكان من الخلايا عادة ركوب الدراجات.

الشكل 3. مؤامرة الرسم البياني للخلايا التي تم جمعها 1H بعد إزالة نبض BrdU، بعد النابضة للخلايا (BrdU) إيجابية FITC. BrdU إيجابية في الخلايا 1 timepoint في وقت مبكر بعد إزالة التسمية تظهر ملامح PI التي تتوافق مع عينات من عرض محتوى الحمض النووي بما يتفق مع الخلايا التي هي في S-مرحلة من مراحل دورة الخلية، مؤكدا على وضع العلامات الناجحة من الخلايا فقط خلال تركيب الحمض النووي.
 LT = "الشكل 4" />
LT = "الشكل 4" />
الشكل 4. مقارنة بين حركية تقدم دورة الخلية بين خطوط الخلايا السرطانية، سرطانات القولون والمستقيم HT29 (أ) و LS180 (B)، فضلا عن سرطان الثدي mcf7 (C). وقد تم جمع الخلايا في كل ساعة لمدة 8 ساعات، وبعد زوال نبض BrdU. في هذه التجربة، لاحظنا صورة واضحة من تسارع تقدم دورة الخلية من خلال المرحلة G2 من دورة الخلية في LS180 خلية خط القولون والمستقيم. مقارنة بين حركية ملامح اثنين من خلايا سرطان القولون والمستقيم، وظهور ذروة G1 هو واضح في = T 4H بعد BrdU في الخلايا LS180، بالمقارنة مع نقطة وقت المقابلة للخلية HT-29 خط الذي يفتقر الى هذه الذروة. بالمقارنة مع أي واحد من هذين الخطين خلية القولون والمستقيم، mcf7 الخلايا وركوب الدراجات بمعدل انخفاض كبير. انقر هنا لعرض أكبر شخصية .
إعادة 5 "/>
الشكل 5. (A) دورة الخلية مرحلة التحليل الكمي للخلايا السرطانية BrdU المسمى. تم تطبيق خوارزمية العميد / جيت / فوكس إلى LS180، HT29 وmcf7 (موضح باللون الأخضر). وأعرب عن دورة الخلية توزيعات المرحلة الناتجة عن كل عينة مثل خلايا٪ BrdU إيجابية الإجمالي لكل مرحلة. يتم عرض فقط تحديد نقاط الوقت لكل خط الخلية، كما في تحليلات لبعض النقاط وقت سابق أسفرت عن نتائج غير صحيحة. في هذه النقاط وقت سابق، كل الخلايا BrdU إيجابية هي في مرحلة-S ولذا فهي تفتقر G1 متميزة وقمم G2، التي هي ضرورية لتطبيق الخوارزمية. (ب) المدرج الإحصائي من الخلايا السرطانية تظهر من خلال حركية تقدم G2 / M مراحل دورة الخلية. تقدم من خلال G2 / M مراحل هي أسرع لLS180 الخلايا، تليها HT29 وmcf7. انقر هنا لعرض أكبر شخصية .
JPG "ALT =" S1 الشكل "/>
S1 شخصية. ضوابط التدفق الخلوي. وتظهر الخلايا كما mcf7 (أ) مراقبة سلبية حيث الخلايا ليست ملطخة بي ولا BrdU. (ب) PI ملطخة فقط. (C) وصفت BrdU-FITC العينات.
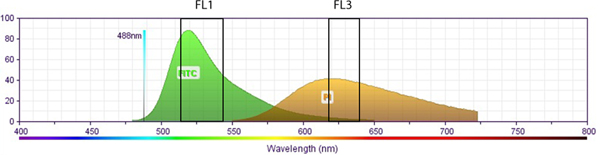
الرقم S2. التوضيح تخطيطي يبين العلاقة بين طيف الانبعاث فلوري من PI مقابل FITC (BrdU). وتظهر مجموعة من النوافذ الطيفية لقناة فلوري 1 (FL1، لFITC) وقناة فلوري 3 (FL3، لPI) في المربعات المقابلة. لا يوجد تداخل بين أطياف fluorophore FL1 وكشف FL3. من الواضح، مضان التعويض ليس من الضروري عندما البيانات التجريبية من PI وFITC BrdU، يتم جمع المشترك المسمى الخلايا في قنوات FL1/FL3 على التوالي. وقد تم الحصول على أطياف مضان من موقع العلوم البيولوجية دينار بحريني:الهدف = "_blank"> http://www.bdbiosciences.com/research/multicolor/spectrum_viewer. انقر هنا لعرض أكبر شخصية .
Discussion
من خلال الجمع بين التدفق الخلوي مع دمج BrdU، لدينا الأدوات اللازمة لدراسة حركية دورة الخلية. الخاصية المميزة للBrdU في أداء وظيفته التماثلية ثيميدين هو ما يسمح لتقدير محتوى الحمض النووي للخلية وركوب الدراجات. إدماج BrdU إلى حبلا ابنة الحمض النووي للنمو خلال مرحلة التوليف من دورة الخلية هو ما يسمح احد لمتابعة جزء من السكان من الخلايا ركوب الدراجات من خلال تكرار الحمض النووي في مرحلة S، إلى فترة من النمو في G2، وفي نهاية المطاف إلى انقسام الخلايا . ويمكن ابنة BrdU إيجابية الخلايا يتبع بشكل مستمر حتى هذه النقطة في الوقت الذي تضعف التسمية BrdU بواسطة انقسام الخلية إلى درجة حيث يتم تقليل إشارة إلى مستويات الخلفية.
تستخدم يوديد propidium لتحديد إجمالي محتوى الحمض النووي، ونحن قادرون على متابعة تقدم دورة الخلية من → → S G1 G2 / M. القدرة على تتبع معدل ركوب الدراجات من الخلايا مهم ومفيد في العديد من التطبيقات، لا سيما FOص ما قبل السريرية دراسة شملت خلية دورة ضرر المخدرات الحمض النووي حمل معين أو المخدرات خلال عملية التنمية لتحديد حساسية الخلية مرحلة دورة من المركبات رواية 11. الميزة الأكثر وضوحا من ذلك باستخدام تقنية وضع العلامات الأيضية هو القضاء على تزامن الكيميائية للخلايا. كما أكثر العلاجات الكيميائية التي تحفز الخلية اعتقال دورة هي في حد ذاتها سمية جينية، قد تشريح آثار حساسية الخلية دورة من مركبات جديدة في ظل وجود هذه المواد الكيميائية لا يكون ممكنا.
أثبتنا براعة هذا الوسم BrdU تقنية التمثيل الغذائي مع PI شارك في تلطيخ. باستخدام هذا البروتوكول، وقد برهنا بنجاح التي يمكن ملاحظتها في زيادة تقدم دورة الخلية من خلال المرحلة G2 / M من دورة الخلية في الخلايا البشرية التيلوميراز السلبية التي تم تحويلها إلى وأجبرت التعبير انزيم 10. في حين أن هذا الأسلوب هو قوي في قياس حركية الخلية كما thro دورات هذاهتاف اشمئزاز مراحل متعددة، واحدة قيد هو فقدان المعلومات توقيت خلال التحولات، وكذلك في إطار المراحل G2 و M. كما الخلايا والمضي قدما من خلال G2 إلى M، نحن غير قادرين على التمييز ليس فقط على مرحلتين، ولكن أيضا للسكان شبه G1، تستند فقط على محتوى الحمض النووي. في التطبيقات التي تتطلب هذا التمايز، فمن الممكن يحتمل أن الخلايا BrdU المشترك وصمة عار وصفت مع الأجسام المضادة ضد الحلقيات أو البروتينات الخلوية الأخرى التي عبارات محددة إلى المرحلة المطلوبة من دورة الخلية 12،13. ستكون هناك حاجة لتحسين إضافية لضمان أن الأجسام المضادة cyclin متوافقة مع التسمية BrdU وبروتوكول المناعية تلطيخ. من الناحية المثالية، على نحو كاف للتمييز بين مختلف مراحل دورة الخلية، قد تكون هناك حاجة إلى الأجسام المضادة cyclin عدة لتسمية المشترك عينة واحدة في وقت واحد. مختبر لدينا تعمل على وضع العلامات آخر من BrdU-نبض الخلايا المسمى مع B cyclin والفوسفات هيستون الأجسام المضادة من 3 إلى التفريق بين الخلايافي G2 مقابل M مرحلة من مراحل دورة الخلية. شارك في وضع العلامات مع الأجسام المضادة cyclin، بالإضافة إلى تلطيخ PI وFITC BrdU، يزيد كثيرا من مضاعفات التدفق الخلوي من الأجهزة على حد سواء، وتحليل البيانات (قضايا التعويض مضان) المنظور. مع ظهور جيل جديد من cytometers تدفق، وينبغي أن تقدم في قدراتها وظيفة التخفيف من حدة هذه المخاوف التقنية.
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
نشكر اندي جونسون من مركز البحوث الطبية الحيوية في جامعة كولومبيا البريطانية للحصول على المساعدة مع تحليل نظام مراقبة الأصول الميدانية. يتم توفير التمويل للبحوث السرطانية في المختبر وونغ من قبل المعهد الكندي لابحاث السرطان في المجتمع (منحة التشغيل # 019250)، وإعادة الاستثمار من أموال البحوث التابع لكلية العلوم الصيدلية، جامعة كولومبيا البريطانية. ويدعم JMYW من كراسي البحث وكندا، ومايكل سميث مؤسسة لبرامج الصحة بحوث التطوير الوظيفي.
Materials
| Name | Company | Catalog Number | Comments |
| الكاشف | شركة | فهرس العدد | تعليقات |
| bromodeoxyuridine | بيكتون ديكنسون | 55089 | |
| propidium يوديد | سيغما | 287075 | 1mg/ml الأوراق المالية |
| FITC مكافحة BrdU | بيكتون ديكنسون | 347583 | |
| الصوديوم tetraborate | الصياد | S80172 | 0.1M، ودرجة الحموضة 8.5 |
| FACS العيار | بيكتون ديكنسون |
References
- Musgrove, E. A., Caldon, C. E., Barraclough, J., Stone, A., Sutherland, R. L. Cyclin D as a therapeutic target in cancer. Nat. Rev. Cancer. 11, 558-572 (2011).
- Molchadsky, A., Rivlin, N., Brosh, R., Rotter, V., Sarig, R. p53 is balancing development, differentiation and de-differentiation to assure cancer prevention. Carcinogenesis. 31, 1501-1508 (2010).
- Dickson, M. A., Schwartz, G. K. Development of cell-cycle inhibitors for cancer therapy. Curr. Oncol. 16, 36-43 (2009).
- Banfalvi, G. Cell cycle synchronization of animal cells and nuclei by centrifugal elutriation. Nat. Protoc. 3, 663-673 (2008).
- van Opstal, A., Boonstra, J. Inhibitors of phosphatidylinositol 3-kinase activity prevent cell cycle progression and induce apoptosis at the M/G1 transition in CHO cells. Cell Mol. Life Sci. 63, 220-228 (2006).
- Gasnereau, I. Flow cytometry to sort mammalian cells in cytokinesis. Cytometry. A. 71, 1-7 (2007).
- Harper, J. V. Synchronization of cell populations in G1/S and G2/M phases of the cell cycle. Methods Mol. Biol. 296, 157-166 (2005).
- Pedrali-Noy, G. Synchronization of HeLa cell cultures by inhibition of DNA polymerase alpha with aphidicolin. Nucleic Acids Res. 8, 377-387 (1980).
- Merrill, G. F. Cell synchronization. Methods Cell Biol. 57, 229-249 (1998).
- Fleisig, H. B., Wong, J. M. Telomerase promotes efficient cell cycle kinetics and confers growth advantage to telomerase-negative transformed human cells. Oncogene. , (2011).
- Cai, D., Byth, K. F., Shapiro, G. I. AZ703, an imidazo[1,2-a]pyridine inhibitor of cyclin-dependent kinases 1 and 2, induces E2F-1-dependent apoptosis enhanced by depletion of cyclin-dependent kinase 9. Cancer Res. 66, 435-444 (2006).
- Pozarowski, P., Darzynkiewicz, Z. Analysis of cell cycle by flow cytometry. Methods Mol. Biol. 281, 301-311 (2004).
- Sherwood, S. W., Rush, D. F., Kung, A. L., Schimke, R. T. Cyclin B1 expression in HeLa S3 cells studied by flow cytometry. Exp. Cell Res. 211, 275-281 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved