Method Article
Célula de medida Cinética la progresión del ciclo con el etiquetado metabólico y Citometría de Flujo
En este artículo
Resumen
Rastreo cambios sutiles en la progresión y la cinética de las fases del ciclo celular puede llevarse a cabo mediante el uso de una combinación de marcaje metabólico de los ácidos nucleicos con BrdU y tinción de ADN genómico total a través de yoduro de propidio. Este método evita la necesidad de sincronización química de ciclo de las células, impidiendo así la introducción de daño en el DNA no específico, que a su vez afecta a la progresión del ciclo celular.
Resumen
El control preciso de la iniciación y progresión posterior a través de las distintas fases del ciclo celular son de importancia primordial en la proliferación de las células. La división celular ciclo es una parte integral del crecimiento y la reproducción y la desregulación de los principales componentes del ciclo celular han sido implicados en los eventos precipitantes de 1,2 carcinogénesis. Agentes moleculares en terapias contra el cáncer con frecuencia buscan vías biológicas responsables de la regulación y la coordinación de la división del ciclo celular 3. Aunque la cinética del ciclo celular tienden a variar según el tipo de célula, la distribución de las células entre las cuatro fases del ciclo celular es bastante consistente dentro de una línea celular particular debido al patrón consistente de mitógeno y la expresión del factor de crecimiento. Eventos genotóxicos y otros factores de estrés celular puede resultar en un bloqueo temporal de la progresión del ciclo celular, lo que resulta en la detención o una pausa temporal en una fase del ciclo celular particular para permitir a las institucionesgación del mecanismo de respuesta adecuada.
La capacidad de observar experimentalmente el comportamiento de una población de células con referencia a su etapa progresión del ciclo celular es un avance importante en la biología celular. Los procedimientos comunes, tales como mitótico quitarse de encima, centrifugación diferencial o de la clasificación de citometría de flujo basada en se utilizan para aislar las células en determinadas fases del ciclo celular 4-6. Estos fraccionados, del ciclo celular enriquecidos fase-poblaciones son luego sometidos a tratamientos experimentales. Rendimiento, la pureza y la viabilidad de las fracciones separadas a menudo puede ser comprometida utilizando estos métodos de separación físicos. A su vez, el lapso de tiempo entre la separación de las poblaciones de células y el inicio de un tratamiento experimental, mediante el cual las células fraccionadas puede pasar de la fase del ciclo celular seleccionado, pueden presentar retos significativos en la implementación exitosa y la interpretación de estos experimentos.
Otros enfoques para stUdy etapas del ciclo celular incluyen el uso de productos químicos para sincronizar las células. El tratamiento de células con inhibidores químicos de los principales procesos metabólicos para cada fase del ciclo celular son útiles para bloquear la progresión del ciclo celular a la siguiente etapa. Por ejemplo, el ribonucleótido reductasa hidroxiurea detiene las células en la coyuntura G1 / S mediante la limitación de la oferta de desoxinucleótidos, los bloques básicos del ADN. Otros productos químicos notables incluyen el tratamiento con afidicolina, un inhibidor de la alfa polimerasa para la detención G1, el tratamiento con colchicina y nocodazole, ambos de los cuales interfieren con la formación de huso mitótico para detener las células en fase M y finalmente, el tratamiento con el ADN terminador de la cadena 5-fluorodeoxyridine iniciar a S fase de la detención 7.9. El tratamiento con estos productos químicos es un medio eficaz para sincronizar una población total de células en una fase particular. Con la eliminación de la sustancia química, las células de reunirse con el ciclo celular al unísono. El tratamiento de la versión de prueba siguiente agentea partir de la química del ciclo celular de bloqueo asegura que la respuesta al fármaco provocó es de un uniforme, ciclo celular etapa específica de la población. Sin embargo, dado que muchos de los sincronizadores químicos son compuestos conocidos genotóxicos, separando la participación de diversas vías de respuesta a los sincronizadores (frente a los agentes de prueba) es un reto.
Aquí se describe un método de marcaje metabólico para el seguimiento de una subpoblación de células activamente bicicleta a través de su progresión desde la fase de replicación del ADN, a través de la división y la separación de sus células hijas. Junto con la cuantificación de citometría de flujo, este protocolo permite la medición de la progresión cinética del ciclo celular en ausencia de ya sea mecánicamente o químicamente inducida celular subraya comúnmente asociada con otras metodologías de células de sincronización del ciclo 10. En las siguientes secciones vamos a discutir la metodología, así como algunas de sus aplicaciones en la investigación biomédica.
Protocolo
1. Preparación de la célula
- Células de placas para lograr una densidad de aproximadamente el 60% de confluencia. Las células deben estar en fase de registro en el momento de la recolección. Para las células MCF7, esto se logra mediante la siembra menos 5 x 10 5 células / placa 10 cm en los medios apropiados. HT29 y LS180 células se sembraron a 6 x 10 5 células / placa 6 cm. Se utilizó medio DMEM suplementado con FBS al 10% y 1x penicilina / estreptomicina. Asegúrese de placas de semillas para los controles adecuados positivos y negativos enAdemás de las muestras de la prueba. Estos incluyen los siguientes:
| yo | control positivo | BrdU sólo |
| ii | control positivo | PI sólo |
| iii | control negativo | BrdU negativo, negativo PI |
(Debe señalarse que un experimento preliminar con puntos de tiempo múltiples tales como la descrita en este protocolo se puede utilizar para limitar el marco de tiempo durante el cual llevar a cabo las colecciones futuras.)
- Las células cultivadas en placas se incuban a 37 ° C, 5% de CO 2 durante 24-48 h, permitiendo así que las células de recuperar y adjuntar.
- Para pulsar las células de la etiqueta con bromodesoxiuridina (BrdU), se sustituye wi DMEMª medio fresco que contiene 10 mM BrdU. Las células se incubaron durante 1 hora a 37 ° C, 5% de CO 2 para permitir la incorporación de BrdU en el DNA. Asegúrese de dejar una placa no se trata de actuar como control negativo.
- Los medios de etiquetado pulso es eliminado y las células se enjuagan brevemente con 1X PBS.
- Medios frescos de crecimiento se añade (menos el BrdU) y las células se permite que continúe a incubar a 37 ° C, 5% de CO 2 hasta el punto de tiempo apropiado para la cosecha se alcanza.
2. La recolección y fijación
- Las células no tratadas desde el paso 1.3 se consideran el punto de tiempo cero. Esta muestra se pueden cosechar junto con el punto de tiempo de 1 h que se recoge inmediatamente después del tratamiento BrdU.
- Para cosechar las células, los medios se retira y las placas se enjuagaron una vez con PBS 1X.
- Las células se tripsinizaron, se recogió en medios de cultivo y se sedimentaron luego por centrifugación a 1500 rpm durante 5 min Supernatant se descarta.
- Enjuague 1-10 x 10 6 células en 5 ml de hielo frío PBS 1X. Centrifugar a 1500 rpm durante 5 min sobrenadante se descarta.
- El pellet de células se resuspende en 100 l de PBS enfriado en hielo / 1% de FBS. La adición de FBS al 1% en PBS ayudas en la prevención de aglutinación celular.
- Añadir estas células gota a gota a 5 ml de -20 ° C, 70% de etanol para fijar las células.
- Incubar en hielo durante 30 min o almacenar a 4 ° C durante la noche. Este es un paso ideal en que se detiene la recogida de muestras de los diversos momentos. Las muestras se pueden dejar en etanol durante varios días, lo que les permite ser procesadas simultáneamente a través del resto del protocolo.
3. BrdU y tinción PI
- Pellets células por centrifugación durante 5 min a 1500 rpm.
- Retire el fijador, pero deje ~ 50 l en el que de aflojar el sedimento por agitación.
- Para desnaturalizar el ADN, se añade lentamente 1 ml de HCl 2N / Triton X-100gota a gota, mientras que un vórtice. Incubar las muestras a temperatura ambiente durante 30 min.
- Pellets células por centrifugación de las muestras durante 5 min a 1500 rpm. Aspirar y descartar el sobrenadante.
- Resuspender el sedimento celular en 1 ml de tetraborato sódico 0,1 M, pH 8,5, para neutralizar el paso de desnaturalización.
- Centrifugar las células durante 5 min a 1500 rpm. Aspirar y descartar el sobrenadante.
- Resuspender el sedimento celular en 75 l de mezcla de tinción BrdU (50 l 0,5% de Tween 20/1% de BSA / PBS + 20 l conjugado con FITC anti-BrdU + 5 l 10 RNasa mg / ml).
- Incubar a temperatura ambiente durante 45 minutos protegido de la luz.
- Para precipitar las células, centrifugar las muestras durante 5 min a 1500 rpm. Aspirar y descartar el sobrenadante.
- Resuspender el sedimento celular en 1 ml de PBS que contenía 5 ug / ml de yoduro de propidio.
4. Citometría de Flujo
- Para analizar las células, un citómetro de flujo equipado con un láser de 488 nm y elfiltros adecuados es necesario. El software de análisis tales como CellQuest es necesaria la creación de las parcelas se describen a continuación.
- Cuando se ejecuta la muestra a través del citómetro de flujo, crear una dispersión hacia adelante (SSC-H) vs dispersión lateral (FSC-H) plan para garantizar la distribución del tamaño apropiado de las células (Figura 1A). Ambos de estos parámetros se trazan en una escala lineal.
- Al mismo tiempo ver una parcela de FL3-H (IP mancha) vs FL2-W (fig. 1B). Esta trama se utiliza para crear una puerta (R3) para aislar la fracción de células que están dentro del patrón de distribución normal del ciclo celular. En general, este patrón de distribución se caracteriza por dos grupos de células de la contenido de ADN 2N y 4N de tinción PI que representa el G1 y G2 fases del ciclo celular, respectivamente. Una cadena de células situadas entre estos 2 grupos es representativo de la replicación del ADN en curso que se produce en la fase S del ciclo celular.
- Crear un plan displaying las células cerradas (R3) desde el paso 4.3, con FL1-H (FITC, gráfico log) en el eje y PI (gráfico lineal) en el eje x (fig. 1C). Esta parcela se utilizará para establecer los parámetros restantes en los diversos controles descritos en el punto 1.1, así como para recopilar datos para el análisis.
- Coloque el PI sólo muestra teñida en el citómetro. Ajuste la ganancia para colocar en el G1 ~ 200 en el eje x. Esto será más fácil de visualizar en un histograma de la mancha de PI.
- Un segundo control implica la ejecución de una muestra de BrdU-sólo en el citómetro de flujo. Ajuste la ganancia para que las 2 poblaciones de células (BrdU positivos vs negativos BrdU) aparecen en la trama. Idealmente, las células BrdU negativas están posicionados para aparecer justo por debajo de 10 -1.
- El control final es la muestra de BrdU / PI negativo. Ejecutar este control negativo para asegurar que las células no aparecen en cualquiera de los cuadrantes de la mano derecha o superiores.
- Una vez que los parámetros de las distintas parcelas se han establecido, elcitómetro de flujo está calibrado y listo para el procesamiento de las células BrdU y PI manchados. Un mínimo de 10.000 células que se encuentran cerrada en la correcta fracción de PI (consulte el paso 4.3) debe ser leído por colección.
- Para analizar los datos recogidos, el software como FlowJo o FACSDiVa se utilizan. Cada una de las parcelas antes mencionadas pueden ser recreados en estos programas y realizar un análisis cuantitativo y estadístico.
- El punto final del análisis implica varias etapas sucesivas. La creación de una parcela de FITC vs PI con células cerradas como positivo de la trama PI vs FL2 W-PI permite distinguir la población ciclista. Una segunda puerta se crea a partir de esta trama mediante el aislamiento de la población BrdU positivas. Expresando esta población distintiva en un histograma con la PI en el eje X permite realizar un seguimiento de la evolución temporal de la progresión del ciclo celular. Esto puede ser aún más visualizaron mediante el trazado de la cantidad de BrdU de células positivas con G1 o G2 contenido como una función del tiempo.
5. Los resultados representativos
Normalmente las células ciclismo teñidas con yoduro de propidio tienen picos distintos a G1 y G2, que corresponden a las células que contienen el contenido de ADN 2N y 4N, respectivamente (Figura 2). Pulso etiquetado con BrdU permite etiquetado selectivo de una subpoblación de células que están activamente sintetizando ADN (fase es decir, S). Poco después de la eliminación del reactivo BrdU, todas las células marcadas se encuentran en la fase S (Figura 3). Al restringir el etiquetado de un pulso corto uno es capaz de seguir este momento distintas sub-población de las células a lo largo de numerosos puntos de tiempo a medida que pasan a través de las siguientes fases del ciclo celular. Esto puede ser visualizada en el punto de tiempo de 1 h en la Figura 3 como una clara falta de G1 y G2 picos.
Información adicional se puede derivar de la etapa de etiquetado BrdU. No sólo la proporción de células que se dividen activamente medir, pero una estiMate de distribución etapa del ciclo celular entre dos muestras se puede determinar también. Por la recolección de células a intervalos igualmente espaciados después de la eliminación del reactivo BrdU, las células pueden rastrearse a medida que continúan ciclo, el progreso de G2 y finalmente se mueven a través de la división celular de las células originales, finalmente emergiendo como células hijas BrdU-positivas con G1 contenido de ADN (Figura 4). Un ejemplo de cuantificación fase del ciclo celular y análisis cinético se proporciona en la Figura 5.
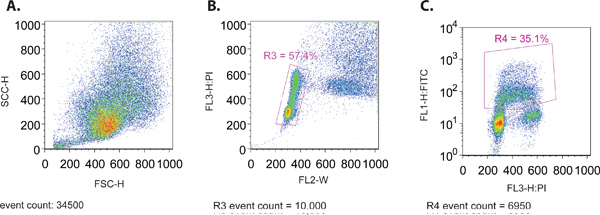
Figura 1. (A) la dispersión hacia adelante en comparación con gráfico de dispersión lateral de un representante de la población de células MCF7. (B) PI en función del ancho (FL-W) Parcela de una población de células MCF7 representante. De apertura de puerta se muestra para excluir dobletes de células en el análisis final (R3). Dobletes celulares tendrán un mayor ancho de pulso de una sola célula, ya que tardan más en pasar a través del rayo láser y therefmineral puede excluirse del análisis. (C) en comparación con FITC PI (BrdU) Parcela de una muestra representativa de células MCF7. De apertura de puerta se muestra para incluir sólo los FITC (BrdU) células positivas (R4).
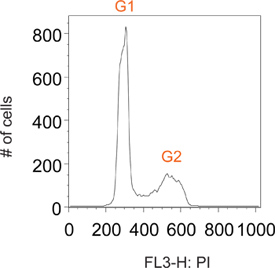
Figura 2. Gráfico representativo histograma de una población total de células normalmente bicicleta.

Figura 3. Histograma de las células que han sido recogidos 1h después de la eliminación del impulso de BrdU, después de compuerta para FITC (BrdU)-células positivas. BrdU de células positivas en un punto de tiempo temprano después de la eliminación de etiqueta muestran perfiles de PI que corresponden a las muestras que muestra el contenido de ADN consistente con las células que están en la fase S del ciclo celular, lo que confirma el etiquetado con éxito de células sólo durante la síntesis de ADN.
 lt = "Figura 4" />
lt = "Figura 4" />
Figura 4. Comparación de la cinética de progresión del ciclo celular entre las líneas celulares de cáncer, cánceres de colon HT29 (A) y LS180 (B), así como el cáncer de mama MCF7 (C). Las células se recogieron cada hora durante 8 horas, tras la eliminación del impulso de BrdU. En este experimento, se observó un perfil claro de la progresión acelerada del ciclo celular a través de la fase G2 del ciclo celular en la LS180 línea celular de colon. Comparación de la cinética entre los dos perfiles de células de cáncer colorrectal, la aparición de un pico G1 es evidente en T = 4 horas después de BrdU en las células LS180, en comparación con el punto en el tiempo correspondiente a la línea de células HT-29, que carece de este pico. En comparación con cualquiera de las dos líneas celulares de colon, las células MCF7 en bicicleta a un ritmo significativamente reducido. Haz clic aquí para ver más grande la figura .
volver 5 "/>
Figura 5. (A) del ciclo celular fase de análisis cuantitativo de las células cancerosas BrdU marcado. El algoritmo de Decano / Jett / Fox se aplicó a HT29, LS180 y MCF7 (ilustrado en color verde). Las células resultantes distribuciones de fase del ciclo de cada muestra se expresa como porcentaje del total de BrdU de células positivas para cada fase. Sólo selecciona los puntos de tiempo para cada línea celular se muestran, como los análisis de algunos de los puntos de tiempo anteriores produjeron resultados no válidos. En estos puntos de tiempo anteriores, todas las células BrdU-positivas están en fase S y por lo tanto carecen G1 distinta y picos G2, que son necesarias para la aplicación del algoritmo. (B) histogramas de las células cancerosas que muestra la cinética de la progresión a través de G2 / M fases del ciclo celular. La progresión a través G2 / M fases es el más rápido de las células LS180, seguido por HT29 y MCF7. Haga clic aquí para ver más grande la figura .
jpg "alt =" Figura S1 "/>
Figura S1. Controles de citometría de flujo. MCF7 células se muestran como (A) control negativo donde las células no son ni PI ni manchada BrdU. (B) PI tiñen solamente. (C) BrdU marcado con FITC muestras.
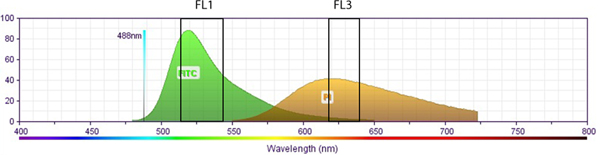
Figura S2. Esquema ilustración que muestra la relación entre espectro de emisión fluorescente de PI frente a FITC (BrdU). Las ventanas de recogida espectrales para canal fluorescente 1 (FL1, para FITC) y el canal fluorescente 3 (FL3, para PI) se muestran en las cajas correspondientes. No hay solapamiento entre los espectros de fluoróforo FL1 y detección FL3. Evidentemente, la compensación de fluorescencia no es necesario cuando los datos experimentales de PI y FITC-co-BrdU marcado células se recogen en los FL1/FL3 canales, respectivamente. Espectros de fluorescencia se obtuvieron a partir de BD Biosciences página web:target = "_blank"> http://www.bdbiosciences.com/research/multicolor/spectrum_viewer. Haga clic aquí para ver más grande la figura .
Discusión
Mediante la combinación de la citometría de flujo con la incorporación de BrdU, tenemos las herramientas necesarias para estudiar la cinética del ciclo celular. La característica distintiva de BrdU para funcionar como un análogo de la timidina es lo que permite la cuantificación de ADN contenido de una celda de ciclismo. La incorporación de BrdU en una hebra de ADN hija creciente durante la fase de síntesis del ciclo celular es lo que permite seguir una subpoblación de células de ciclismo a través de la replicación del ADN en la fase S, a un período de crecimiento en G2 y finalmente a la división celular . Daughter BrdU-positivas células pueden ser continuamente seguido hasta que punto en el tiempo la etiqueta de BrdU se diluye por la división celular en la medida en que se reduce la señal a los niveles de fondo.
Uso de yoduro de propidio para determinar el contenido total de ADN, que son capaces de seguir la progresión del ciclo celular en G1 S → G2 / M →. La capacidad de seguir la tasa de ciclismo de las células es importante y útil en muchas aplicaciones, particularmente FOr estudios pre-clínicos que involucran específicos al ciclo celular de ADN fármacos inductores o daños durante el proceso de desarrollo de medicamentos para determinar la sensibilidad fase del ciclo celular de los nuevos compuestos 11. La ventaja más obvia de usar una técnica de marcaje metabólico es la eliminación de sincronización química de las células. Como la mayoría de los tratamientos químicos que inducen la detención del ciclo celular en sí son genotóxicos, la disección de los efectos del ciclo celular de sensibilidad de los nuevos compuestos en la presencia de estas sustancias puede no ser factible.
Hemos demostrado la versatilidad de esta técnica de etiquetado de BrdU metabólica con PI co-tinción. Utilizando este protocolo, hemos demostrado con éxito que el aumento en la progresión del ciclo celular a través de la fase G2 / M del ciclo celular se puede observar en las células humanas negativas telomerasa-que han sido transformadas para han obligado a expresión de la enzima 10. Si bien este método es de gran alcance en la medición de la cinética de la célula, ya que los ciclos through etapas múltiples, una limitación es la pérdida de información de temporización durante las transiciones, así como dentro de las fases G2 y M. Como las células proceder a través de G2 a M, que son incapaces de distinguir no sólo las dos fases, sino también la población sub-G1, basado únicamente en el contenido de ADN. En aplicaciones donde se requiere esta diferenciación, es potencialmente posible co-manchas células BrdU marcadas con anticuerpos contra ciclinas u otras proteínas celulares cuyas expresiones son específicos de la fase deseada del ciclo celular 12,13. Optimización adicional será necesario para asegurar que los anticuerpos ciclina son compatibles con la etiqueta BrdU y protocolo inmuno-tinción. Idealmente, para diferenciar adecuadamente las diversas fases del ciclo celular, varios anticuerpos ciclina puede ser necesaria para la co-etiqueta una sola muestra de forma simultánea. Nuestro laboratorio está trabajando en la post-etiquetado de BrdU pulso células marcadas con la ciclina B y fosfato histona 3 anticuerpos para diferenciar entre célulasen la fase G2 versus M del ciclo celular. Co-etiquetado con anticuerpos ciclina, además de tinción PI y FITC BrdU aumenta sustancialmente la complicación de la citometría de flujo, tanto desde el hardware y el análisis de datos (emisiones de fluorescencia de compensación) perspectiva. Con el advenimiento de la nueva generación de citómetros de flujo, los avances en su capacidad y funcionalidad debe resolver estos problemas técnicos.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Damos las gracias a Andy Johnson, del Centro de Investigación Biomédica de la UBC para la asistencia con el análisis de FACS. Financiación de Investigación del Cáncer en el Laboratorio de Wong es proporcionada por la Sociedad Canadiense del Cáncer del Instituto de Investigación (subvención de funcionamiento # 019250) y de Reinversión de los fondos de investigación de la Facultad de Ciencias Farmacéuticas de la UBC. JMYW con el apoyo de las Cátedras de investigación de Canadá y la Michael Smith Foundation para los programas de Investigación en Salud de desarrollo profesional.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Empresa | Número de catálogo | Comentarios |
| bromodesoxiuridina | Becton Dickinson | 55089 | |
| yoduro de propidio | Sigma | 287075 | 1mg/ml de valores |
| FITC anti-BrdU | Becton Dickinson | 347583 | |
| tetraborato de sodio | Pescador | S80172 | 0,1 M, pH 8,5 |
| Calibre FACS | Becton Dickinson |
Referencias
- Musgrove, E. A., Caldon, C. E., Barraclough, J., Stone, A., Sutherland, R. L. Cyclin D as a therapeutic target in cancer. Nat. Rev. Cancer. 11, 558-572 (2011).
- Molchadsky, A., Rivlin, N., Brosh, R., Rotter, V., Sarig, R. p53 is balancing development, differentiation and de-differentiation to assure cancer prevention. Carcinogenesis. 31, 1501-1508 (2010).
- Dickson, M. A., Schwartz, G. K. Development of cell-cycle inhibitors for cancer therapy. Curr. Oncol. 16, 36-43 (2009).
- Banfalvi, G. Cell cycle synchronization of animal cells and nuclei by centrifugal elutriation. Nat. Protoc. 3, 663-673 (2008).
- van Opstal, A., Boonstra, J. Inhibitors of phosphatidylinositol 3-kinase activity prevent cell cycle progression and induce apoptosis at the M/G1 transition in CHO cells. Cell Mol. Life Sci. 63, 220-228 (2006).
- Gasnereau, I. Flow cytometry to sort mammalian cells in cytokinesis. Cytometry. A. 71, 1-7 (2007).
- Harper, J. V. Synchronization of cell populations in G1/S and G2/M phases of the cell cycle. Methods Mol. Biol. 296, 157-166 (2005).
- Pedrali-Noy, G. Synchronization of HeLa cell cultures by inhibition of DNA polymerase alpha with aphidicolin. Nucleic Acids Res. 8, 377-387 (1980).
- Merrill, G. F. Cell synchronization. Methods Cell Biol. 57, 229-249 (1998).
- Fleisig, H. B., Wong, J. M. Telomerase promotes efficient cell cycle kinetics and confers growth advantage to telomerase-negative transformed human cells. Oncogene. , (2011).
- Cai, D., Byth, K. F., Shapiro, G. I. AZ703, an imidazo[1,2-a]pyridine inhibitor of cyclin-dependent kinases 1 and 2, induces E2F-1-dependent apoptosis enhanced by depletion of cyclin-dependent kinase 9. Cancer Res. 66, 435-444 (2006).
- Pozarowski, P., Darzynkiewicz, Z. Analysis of cell cycle by flow cytometry. Methods Mol. Biol. 281, 301-311 (2004).
- Sherwood, S. W., Rush, D. F., Kung, A. L., Schimke, R. T. Cyclin B1 expression in HeLa S3 cells studied by flow cytometry. Exp. Cell Res. 211, 275-281 (1994).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados