Method Article
Avidez baseado Triagem Interação Extracelular (AVEXIS) para a detecção escalável de baixa afinidade Extracelular receptor-ligante Interações
Neste Artigo
Resumo
AVEXIS é uma alta taxa de ensaio interação proteína desenvolvida para a tela de forma sistemática para novas extracelular do receptor-ligante pares envolvidos em processos de reconhecimento celular. Ele é projetado especificamente para detectar interações protéicas transitórios que são difíceis de identificar com outras abordagens de alto rendimento.
Resumo
Proteína extracelular: interações entre proteínas secretadas ou de membrana ancoradas proteínas são fundamentais para a coesão de iniciar a comunicação intercelular e garantir dentro de organismos multicelulares. Proteínas predito para formar interacções extracelulares são codificados por aproximadamente um quarto de genes humanos 1, mas apesar da sua importância e abundância, a maioria destas proteínas não têm documentado parceiro de ligação. Primeiramente, isto é, devido à sua intratabilidade bioquímica: proteínas de membrana-incorporados são difíceis de solubilizar na sua conformação nativa e conter estruturalmente importantes modificações pós-tradução. Além disso, as afinidades de interação entre proteínas receptoras são geralmente caracterizadas por força de interação extremamente baixas (meia-vida <1 segundo) que impossibilitam sua detecção com muitos comumente utilizados métodos de alto débito 2.
Aqui, nós descrevemos um ensaio, AVEXIS (avidez de base EXtracellular Interação Tela) que supera estes desafios técnicos que permitam a detecção de interações protéicas muito fraco (t 1/2 ≤ 0,1 seg), com uma baixa taxa de falsos positivos 3. O ensaio é executado geralmente num formato de alta taxa de transferência, para permitir o rastreio sistemático de muitos milhares de interacções em um formato conveniente de microtitulação de placa (Fig. 1). Baseia-se na produção de bibliotecas solúveis de proteínas recombinantes que contêm os fragmentos ectodomínio de receptores de superfície celular ou proteínas secretadas dentro do qual a tela para interacções, portanto, esta abordagem é adequada para o tipo I, tipo II, a GPI-linked receptores da superfície celular e secretada proteínas, mas não para as proteínas de membrana multipass tais como canais de iões ou transportadores.
As bibliotecas de proteínas recombinantes são produzidos usando um sistema de expressão conveniente e de alto nível de mamífero 4, para assegurar que as modificações pós-tradução importantes, tais como glycosylação e ligações dissulfeto são adicionados. Expressas proteínas recombinantes são secretados para o meio e produzida em duas formas: uma isca biotinilado, que pode ser capturado em uma fase de estreptavidina-revestido sólido adequado para o rastreio, e uma enzima pentamerised-etiquetados presa (β-lactamase). A isca e as proteínas são apresentados presas umas às outras de uma forma binária para detectar interacções directas entre eles, semelhantes a um ELISA convencional (Fig. 1). O pentamerisation das proteínas no presa é conseguido através de uma sequência peptídica da proteína matriz da cartilagem oligomérico (COMP) e aumenta a concentração local de ectodomínios proporcionando assim ganhos de avidez significativas para permitir interacções mesmo muito transientes a ser detectado. Normalizando as actividades de ambos isca e presa a níveis predeterminados antes de rastreio, que mostraram que as interacções com monoméricos meias-vidas de 0,1 seg pode ser detectada com baixas taxas de falsos positivos 3.
Protocolo
1. Compilando uma biblioteca de Bait and Prey expressão plasmídeo Vetores
- Compilar uma lista de receptores de superfície celular e proteínas secretadas de interesse a serem selecionados para interações e recuperar suas seqüências a partir de um banco de dados adequado de proteína de seqüência. A maioria das proteínas contendo um N-terminal péptido de sinal secretor são adequados (estes incluem o tipo I, IGP-ligados e secretada proteínas). Tipicamente, uma família de proteínas (por exemplo, superfamília das imunoglobulinas ou de todos os receptores restringidas a um tipo de célula específico, tal como o de eritrócitos) seriam seleccionadas.
- Determinar a extensão das regiões extracelulares através da identificação da localização do péptido de sinal ea região transmembranar da proteína usando o software de predição característica. Normalmente usamos v3.0 SignalP 5 e 6 TMHMM v2.0.
- Design conjuntos de iniciadores que amplificam o fragmento ectodomínio inteira para cada receptor. Nós temos um conjunto de vectores de isca e presas que são adequados para este propósito, que são umavailable de Addgene ( http://www.addgene.org/~~V ). Conceber o iniciador de sentido em torno do início da metionina para incluir um sítio de enzima de restrição Notl e uma sequência de Kozak óptima, isto é seguido por 25 pares de bases de correspondência exacta do gene específico de sequência (Fig. 2A).
- Conceber o iniciador anti-sentido para truncar proteínas receptor tipo I imediatamente antes da região transmembranar prevista, de modo a expressar o ectodomínio inteiro como uma proteína solúvel recombinante. Incluir um sítio de restrição Asei neste iniciador que deve então traduzir em quadro para um rato C-terminal da proteína Cd4d3 tag 4 7 (Fig. 2A).
- Amplificar os fragmentos ectodomínio de todos os genes usando estes primers e cloná-los na isca ou vetor presa. Às vezes acham que é útil para a primeira cloná-los em vetores de ônibus antes de subclonagem em um vetor de expressão apropriada dos mamíferos, nós usamos um derivado do vetor pTT3 3,4. Tanto a isca e vetores presas contain C-terminal da proteína etiquetas como se segue (Fig. 2B).
- Iscas: Uma etiqueta contendo os domínios 3 e 4 das células CD4 de rato (Cd4d3 4) da proteína seguido por uma sequência peptídica que é um substrato para a enzima BirA E.coli e pode, portanto, ser monobiotinylated sobre um resíduo específico da lisina (Fig. 2B) . O Cd4d3 4 etiqueta é reconhecido pelo anticorpo monoclonal OX68 e é utilizado para quantificar a expressão das proteínas de isco por ELISA. As proteínas de isca são, portanto, monomérica e monobiotinylated. Vectores de isco de proteína adicionais onde o péptido biotinylatable é substituída por uma etiqueta de 6-o seu para a purificação estão disponíveis.
- Presas: As presas também conter um rato Cd4d3 4 tag seguido por uma sequência peptídica a partir do rato de proteína oligomérica matriz da cartilagem (COMP) e um C-terminal da enzima β-lactamase. O péptido COMP assegura formas os pentâmeros presas uma vez expressa (Fig. 2B).
2. Prey e Expressão da proteína-Bait
Usamosum sistema de expressão de alto nível conveniente usando cultura de suspensão da linha de células HEK293E 4 para produzir bibliotecas de nossa proteína, mas qualquer sistema de expressão de mamífero deve ser apropriada. Uma alternativa comercialmente disponível é o sistema de Freestyle. As células são rotineiramente cultivadas em uma plataforma de agitação (125 rpm) a 37 ° C, 5% de CO2 a 70% de humidade relativa. Proteínas de controle positivos e negativos devem ser expressas. O rato Cd4d3 4 tag fragmento somente está disponível como isca e presa e são adequados controles negativos. Da mesma forma, isca presa e vetores que codificam um controlo positivo estão disponíveis (Addgene); que normalmente usam o rato Cd200-Cd200R interação 8.
- Semente as células HEK293E o dia antes da transfecção, a uma densidade de 2,5 x 10 5 células mL -1. Nós cultura rotineiramente as células em volumes de 50 mL em meios Freestyle293 seguindo as recomendações do fabricante. Para garantir biotinilação eficiente, complemento tele meio de cultura de células usadas para produzir proteínas de isca com D-biotina até uma concentração final de 100 uM. Meio utilizado para expressar as proteínas de presa não necessita de ser complementada com adicional D-biotina.
- No dia seguinte, as células transfectar usando um reagente de transfecções adequado (por exemplo, 293fectin). Use 25 ug do isco ou presas construções de plasmídeo para transfectar uma cultura de 50 mL. Para produzir os iscos biotinilados, co-transfectar codificação do plasmídeo a isca construir com um plasmídeo que codifica uma forma segregada da proteína-biotina ligase E.coli ( BirA), que está disponível a partir Addgene. Co-transfecção de plasmídeos isca em uma razão de 10:1 (2,5 ug) do plasmídeo que codifica a proteína secretada BirA.
- Culturas de colheita cinco dias após a transfecção por primeira granulação as células por centrifugação a 3000 X g durante 20 minutos, seguido por filtração do sobrenadante através de um filtro de 0,22 uM.
[Dica: Bait e proteína presas deve ser armazenado diluído a 4 ° C e como uma diretriz geral deve ser usado dentro de um ano. Adicionar bacteriostáticos, tais como 50 ug / mL polimixina B sulfato ou 10 mM de NaN3 para evitar a contaminação bacteriana dos sobrenadantes.]
3. A normalização do Isca e amostras rapina
Uma das características essenciais do ensaio AVEXIS é que, porque as proteínas recombinantes são secretadas podem ser diluído ou concentrado (normalizado) para dentro de actividades de limiar estabelecido antes de serem utilizados no ensaio. Verificou-se que os níveis em que as proteínas recombinantes são expressos abrangem uma grande variedade - até 4 ordens de magnitude - e assim o passo de normalização reduz significativamente o número de falsos positivos durante as telas.
3,1 normalização Bait
Nota: não conjugada D-biotina deve ser removido a partir do suporte (tipicamente por diálise) uma vez que irá competir com a bai biotiniladot proteína para a ligação a estreptavidina sítios de ligação.
- Transferir sobrenadantes de isca em rótulo de diálise, tubos, cortar de forma segura e diálise extensivamente contra um tampão adequado, tal como PBS para remover a biotina livre.
[Tip: Nós descobrimos que a diálise suficiente é normalmente conseguido por 6 x 50 mL sobrenadantes de isca contra um volume de 4,5 L de PBS com 4 mudanças ao longo de um período de 24 horas. Diálise insuficiente pode ser observada por um inibição da ligação da proteína em diluições baixas durante o passo de normalização isca (Fig. 3A).
- Executar um ELISA para determinar os níveis relativos em que as proteínas de isca são expressos. Prepara-se uma série de diluições das proteínas biotiniladas isca e capturá-los em uma placa de microtitulação de estreptavidina-revestido. Use o rato Cd4d3 4 tag para detectar e quantificar as proteínas de isco capturadas utilizando um anticorpo monoclonal (OX68). Concentrar ou diluir proteínas isca para o valor mínimo necessário para saturar toda a biotem sítios de ligação no poço de uma placa de estreptavidina-revestido.
- Bloquear os poços de uma placa de estreptavidina-revestida com tampão fosfato saline/0.1% de Tween-20 (PBST) / 2% de albumina sérica bovina (BSA) durante 15 minutos.
- Numa placa separada, fazer uma série de diluição (quatro diluições 1:3 são normalmente suficientes) das proteínas isca em PBST BSA / 2% e transferência para poços de uma placa de estreptavidina-revestido. Incubar durante 1 hora à temperatura ambiente.
- Lavar 3x em PBST. Adicionar 100 uL de 2 ug / mL de ratinho anti-rato IgG Cd4d3 4 incubar (OX68) durante 1 hora à temperatura ambiente.
- Lavar 3x em PBST. Adicionar 100 uL de rato anti-fosfatase alcalina a 1:5.000 de diluição em PBST / BSA a 2% e incubar durante 1 hora à temperatura ambiente.
- Lavar 3x em PBST e realizar uma lavagem final em PBS para remover qualquer resíduo de detergente. Adicionar 100 uL de 1 mg / mL de substrato em 104 dietanolamina tampão (dietanolamina a 10% (v / v), 0,5 mM de MgCl2, 10 mM de NaN3, pH9.8, armazenada ao abrigo da luz a 4° C).
- Após uma hora, a absorvância medida a 405 nm. Os resultados representativos de normalização de isca são mostrados na Figura 3A.
- Proteínas de isco que são expressas em níveis que são suficientes para saturar todos os sítios de ligação de biotina de uma placa de estreptavidina-revestidos, quando usado sem diluição, deve ser concentrada utilizando concentradores Vivaspin (Vivascience, 10kDa MWCO). Como guia, estima-se que ~ ug 5 de uma proteína isco típico (~ 80 kDa) é suficiente para saturar uma placa de 96 poços.
- Proteínas de isco expressas em níveis elevados podem ser diluídos em PBST BSA / 2% a uma concentração suficiente para saturar a placa de estreptavidina-revestido. A actividade dos iscos deve ser reverificados após diluição ou concentração para garantir que eles saturar todos os sítios de ligação de biotina na placa de estreptavidina-revestido.
3,2 normalização Prey
- Quantificar os níveis relativos em que as proteínas alimentares são expressas utilizando o β-lactamaseatividade enzimática.
- Em primeiro lugar, fazer uma série de diluições do sobrenadante contendo as proteínas de presa em PBST / 2% de tampão de BSA. Em seguida, adicionar 20 uL das diluições a 60 uL de uma 242 iM (0,125 mg / mL) de solução nitrocefina (Calbiochem).
- Imediatamente transferir a placa para um leitor de placas de microtitulação que leva uma medição da absorvância a 485 nm, a cada minuto durante 20 minutos à temperatura ambiente. Os resultados representativos de normalização presas são mostrados na Figura 3B.
- Concentre-se amostras utilizando concentradores centrífugos ou diluí-los em BSA PBST / 2% para chegar a um limiar de atividade de ~ nmol min 2 -1 volume de negócios de nitrocefin. Praticamente, isto é alcançado se tudo o nitrocefina é hidrolisado no interior ~ 7 minutos.
4. AVEXIS Procedimento de Triagem
- Lavar uma placa de estreptavidina-revestido em PBST.
- Adicionar 100 uL de BSA PBST / 2% a cada poço e incubar durante 30 minutos para bloquear quaisquer locais de ligação de proteína espúrias dentro de cada poço.
[Dica: para remover qualquer tampão de lavagem residual após as etapas de lavagem, a placa é aproveitado - energicamente - em toalhas de papel]
- Remover a solução de bloqueio com um movimento inteligente da placa ao longo de um dissipador e adicionar 100 uL de isca biotinilado normalizada monomérica aos poços apropriados e incubar durante 1 hora à temperatura ambiente.
- Remover as amostras de isco a partir da placa, por viradas para cima, a placa e inteligentemente flicking sobre uma pia, e lavar 3 vezes em PBST.
- Adicionar 100 uL da presa pentamerized normalizada construir a cada poço e incubar à temperatura ambiente durante 1 hora, lavar como no passo 4,4 e realizar uma lavagem final com apenas PBS.
- Adicionar 60 ul de 242 mM solução nitrocefina (dissolver 5 mg de nitrocefina em 500 uL de DMSO, misturar bem e em seguida diluir o nitrocefina em 40 mL de PBS e passar através de um filtro de 0,22 um antes da adição às placas) e incubar à temperatura ambiente . Interacções positivas pode ser observadopelo olho uma vez que o nitrocefina amarelo é hidrolisado para uma cor vermelha. Quantificar por leitura da absorvância a 485 nm usando um leitor de placas. Uma placa de típico e quantificação é mostrado na fig. 4.
[Tip: interacções positivas são geralmente observadas no prazo de 2 horas à temperatura ambiente, embora as chapas devem ser colocadas a 4 ° C durante 16 horas para garantir que todos os potenciais interacções são detectados. Descobrimos também que nitrocefina precipitado e imperfeições no plástico da placa de microtitulação tais como riscos / impressões digitais podem ocasionalmente levar a artefatuais falsos positivos a 485 nm, apesar de não hidrólise nitrocefina evidente. Portanto, é aconselhável para tirar fotos das placas para registrar visualmente volume de negócios nitrocefin nos poços.]
5. Os resultados representativos
Um exemplo representativo de uma placa de rastreio AVEXIS é mostrado na Figura 4. Deve-se observar hidrólise (amarelo para vermelho) do substrato nitrocefina nocontrolo positivo poços (tanto o mediada por anticorpo de controlo de captura de presas e também a interacção de controlo positivo) dentro de cerca de 10 minutos. Algumas interações dentro da tela também são observados dentro dessa escala de tempo, mas outros podem demorar mais tempo (algumas horas) para aparecer. Tipicamente, uma taxa de sucesso de cerca de 0,4-0,6% (uma interacção positiva para cada 150-250 interacções a ser rastreados) é típica, dependendo das bibliotecas de proteína a ser rastreados.
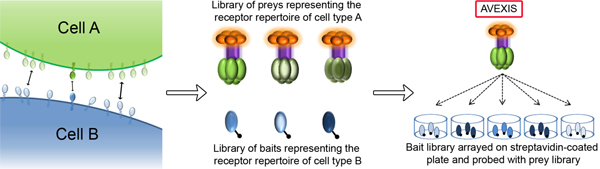
Figura 1. Identificação de interacções receptor-ligando que medeiam os processos de reconhecimento celular usando AVEXIS. O esquema mostra duas células interagindo (A e B) troca de informações através das interações realizadas entre as proteínas de membrana incorporadas receptores. AVEXIS é um ensaio de interacção proteína escalável especificamente concebidos para identificar novos pares receptor-ligando que são caracterizadas por forças de interacção muito fracas. Recombinante parabibliotecas de proteínas luble representando o ectodomínio totalidade do repertório de receptor na superfície celular de ambas as células são compilados quer como pentamérica presas β-lactamase marcados (tipo de célula A) ou monoméricos iscos marcado com biotina (para B tipo de célula). O pentamerisation das presas aumenta a concentração local de ectodomínios para efectuar um ganho de avidez geral de modo que as interacções mesmo muito transientes podem ser detectadas. A biblioteca isca é vestida em estreptavidina placas revestidas e sistematicamente sondado para interacções com as proteínas presas. Depois de uma lavagem breve, quaisquer presas capturadas são detectados utilizando a actividade β-lactamase associado com a presa.

Figura 2. Bait e design construção presa. (A) A proteína do receptor de rato Cd200 é fornecido como um exemplo de como os ectodomínios inteiras de proteínas de células de receptor de superfície são determinados e os iniciadores são concebidos para tornar tanto iscae expressão construções presas. A sequência da proteína traduzida de cDNA e são mostrados a partir do péptido de sinal N-terminal para a membrana-medindo região transmembranar de rato Cd200. Um iniciador de sentido é concebido de modo a incluir um 5 'Notl sítio de enzima de restrição ea sequência de Kozak óptima seguido por 25 bases da sequência correspondência exacta para a sequência de cDNA Cd200. O iniciador anti-sentido contém um local de Asei e 25 bases da sequência correspondência exacta localizado imediatamente a montante do resíduo seleccionado ectodomínio truncamento. Para manter o ectodomínio no quadro com o rato Cd4d3 4 tag, o local de Asei deve traduzir como Gly-Ala-Pro. (B) representações esquemáticas da isca e construções de expressão presas. Cada um contém ectodomínios receptores ladeado por Notl e sites de ascos e uma etiqueta de 4 Cd4d3. Os iscos conter uma sequência de peptídeo C-terminal que pode ser especificamente monobiotinylated por cotransfecção com um plasmídeo expressando um secretada enzima BirA. As presas são seguidos pela seqüência pentamerisationa partir da proteína da matriz da cartilagem oligomérico (COMP) ea enzima β-lactamase.
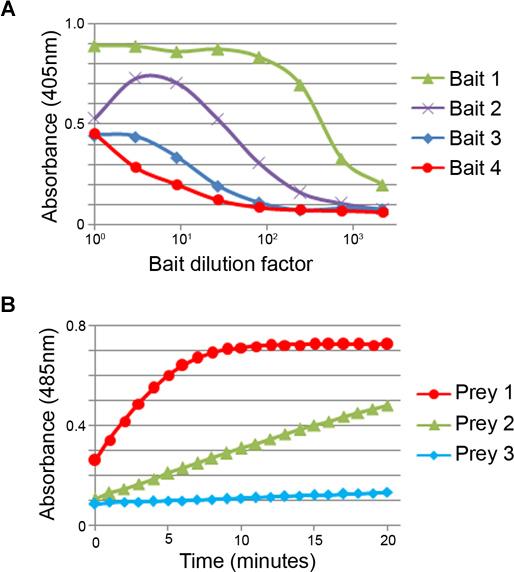
Figura 3. Normalização da isca e proteínas presas. (A) exemplos representativos de normalização isca. Uma série de diluições de quatro diferentes sobrenadantes de isco dialisados foram detectados por ELISA utilizando um anticorpo anti-CD4 tag monoclonal. Os quatro iscas são expressos em diferentes níveis 1> 2> 3> 4. Iscos devem ser normalizados para um nível de limiar que satura os locais de ligação de biotina em cada poço. Iscos altamente expressos podem ser diluídas para conservar a proteína (por exemplo, um isco pode ser diluído ~ 1:100), e iscos mal-expressas concentrou-se. Leituras diminuíram em diluições de baixo custo são, por vezes, observada em alguns iscos (por exemplo, a isca 2) que é atribuível à presença de D-biotina não conjugada devido à diálise incompleta. (B) Os níveis em que atacam as proteínas são expressionado é quantificado utilizando a taxa de hidrólise de um substrato β-lactamase, nitrocefina. No exemplo mostrado, os três presas são expressos em níveis diferentes: 1 presa> 2> 3. Presas devem ser normalizados para uma actividade de ~ 2 nmol min -1, o que corresponde a completar a hidrólise de 14,5 nmol nitrocefina em ~ 7 minutos (por exemplo, presa 1). As presas outros neste exemplo deve ser concentrado antes da utilização na triagem.
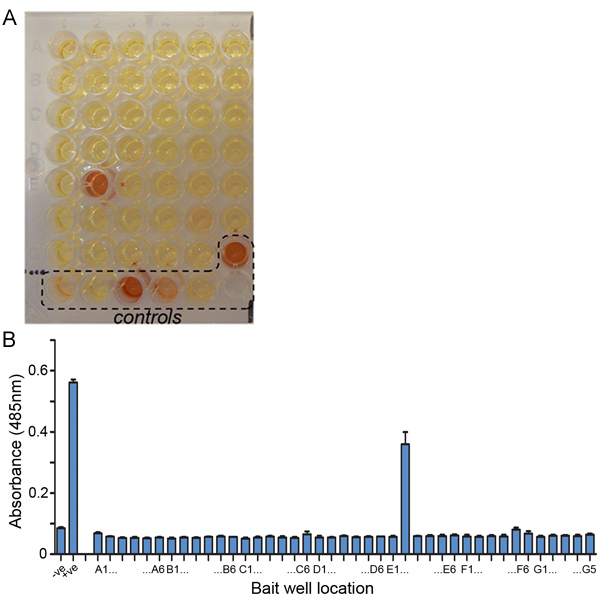
Figura 4. Triagem representativas resultados AVEXIS. (A) Uma fotografia de uma placa representativa triagem AVEXIS. A proteína está presa sondado contra 41 iscas diferentes e uma interação positiva é detectada em E2 também. Controlos utilizados nas placas de rastreio incluem: um anticorpo anti-CD4 biotinilado para capturar toda a proteína a presa adicionado ao poço (G6), uma interacção de controlo: rato Cd200 (isco)-Cd200R (presas) com o Cd200R presas utilizadas na diluição limite (H3), 1:10 (H4) e 1:100 (H5). Controles negativos foram: a Cd4d3 4 isca sondado com a proteína presa sendo exibido (H1) ea presa Cd200R (H2). (B) Quantificação dos valores de absorvância de a mesma tela realizada em triplicado. Os pontos de dados são a média ± DP.
Discussão
Quando células vivas são observados in vivo, suas membranas plasmáticas exibem comportamentos altamente dinâmicos: ampliação e processos de membrana de retracção como contatar e se comunicar com seus 2 vizinhos. As interacções físicas entre as proteínas de membrana incorporados receptores que medeiam muitos destes contactos evoluíram para ser extremamente fraca, de modo a permitir que este comportamento altamente móveis. Estimou-se que as forças de interacção monoméricas como fraco como 50 uM poderia ser suficiente para impulsionar as interacções espontâneas em densidades de receptores fisiológicos 9, o que torna a detecção de interacções novos extremamente desafiantes 2,10. O método AVEXIS aqui descrito fornece um método sensível para a detecção de proteína extracelular transitória: interações protéicas que podem ser implementadas de uma forma escalável com uma baixa taxa de falsos positivos. Enquanto outros métodos escaláveis têm sido desenvolvidos para detectar interacções extracelulares 11-15,Uma vantagem de AVEXIS é que os parâmetros experimentais, tais como a isca e actividades de presas foram quantificados para detectar mesmo os mais fracos das interacções (t 1/2 ≤ 0,1 s), mantendo uma baixa taxa de falsos positivos 3. Além disso, os procedimentos de preparação simplificados e robustos amostra permitiram este ensaio a ser implementado em uma escala muito maior do que outros ensaios e recentemente descrita uma tela de interação sistemática, totalizando mais de 16.500 potenciais interacções do ~ 16.
O ensaio pode ser realizado em qualquer proteína para a qual é possível expressar um fragmento de proteína recombinante solúvel. Este inclui, portanto, as proteínas que contêm um péptido de sinal N-terminal, tal como o tipo I, IGP-ligados e secretada proteínas. Recentemente, concebemos um conjunto de vetores que agora nos permitem expressar proteínas do tipo II como iscas 17. O ensaio não é geralmente adequado para proteínas de membrana, tais como multipass transportador de iõess ou bombas, uma vez que não são susceptíveis de ser correctamente dobrada fora do contexto de uma membrana plasmática. Temos aplicado este a uma variedade de diferentes sistemas e com êxito expressaram proteínas extracelulares a partir de peixe-zebra 3,16,18, humano, rato e P. falciparum para telas de interação.
Em termos de os recursos necessários para configurar uma tela AVEXIS, nós descobrimos que um gargalo significativo é a selecção de construção, e sequenciação completa dos plasmídeos de expressão. Este aspecto do método pode levar até um ano para fazer ~ isca 100 e construções de presa, no entanto, com o custo decrescente de síntese de genes, que agora favorecer comercialmente terceirizando este aspecto do projecto. O sistema de expressão de mamífero em conjunto com uma grande agitação de cultura de tecidos incubadora (usamos um INFORS HT celular Multitron) permite um único pesquisador para expressar e normalizar até ~ 100 isca e proteínas de presas de um mês. Uma vez que as proteínas são produzidas e normalizados, screening para interacções é rápida, com até 12 placas de 96 poços a ser convenientemente transformados por dia. O equipamento apenas por medida que têm desenvolvido para facilitar a produção de um número tão grande de proteínas é um comprimido pistão de ar de propulsão, que é utilizada para passar até cinco sobrenadantes através de um filtro 0.22μm em paralelo.
A classe principal de interacções que podem ser perdidas, quando comparado com as interacções esperados a partir da literatura (falsos negativos) são interacções homofílico, embora alguns destes interacções podem ser detectados 3. Nos casos em que as interacções esperados não são detectados, acreditamos que isto é devido à formação de interacções homofílico pelas proteínas de presa (uma presa "mascaramento" efeito) que, em seguida, impede interacções adicionais com proteínas de isco imobilizadas. A frequência com que as interacções são detectados depende do conteúdo da biblioteca de proteína a ser rastreada. Como um guia para o leitor, uma tela de> 30, 000 interacções dentro da superfamília das imunoglobulinas do peixe-zebra resultou em 188 positivos - uma frequência de 0,6% 3,16,18. Uma verificação muito rápida que pode ser realizada para verificar todos os acessos positivos é para determinar se a interacção pode ser detectada em ambas as orientações isca-presa, isto é, a mesma interacção pode ser detectada independentemente do facto de as proteínas de ligação estão presentes tanto como isco um ou uma presa. Sempre que têm observado este comportamento reciprocidade, a ligação foi subsequentemente demonstrado ser específico, demonstrando ligação saturável directa de proteínas purificadas utilizando ressonância plasmon de superfície. Ressalte-se que pelo fato de aumentar a avidez de ligação por artificialmente pentamerising as proteínas presas, nós não consideramos o teste apropriado para comparar quantitativamente força de interação. Para obter biofísicos parâmetros de ligação de interações que usamos proteínas monoméricas e ressonância plasmon de superfície. Finalmente, uma vez uma interacção tenha sido identificada, o oinatureza rendimento gh do ensaio torna relativamente fácil de se adaptar o ensaio a tela para reagentes tais como anticorpos ou moléculas pequenas que bloqueiam a interacção.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi financiado pelo Wellcome número conceder confiança [077108] atribuído ao GJW.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Cat. Número | Comentários |
| Freestyle mídia | Invitrogen | 12338018 | |
| Nitrocefin | Calbiochem | 484400 | |
| SA-revestidos placas de microtítulo | Nunc | 734-1284 | |
| OX68 anticorpo | AbDSerotec | MCA1022R | |
| Tubo de diálise | Perfurar | PN68100 | |
| A polimixina B | Sigma | P4932 | |
| D-biotina | Sigma | B4639-5G | |
| Substrato-104 | Sigma | 1040-506 | |
| Vivaspin-20 concentradores centrífugos | Músculo da coxa | VS2002 | |
| Filtros de 0,22 uM | Nalgene | 190-2520 |
Referências
- Fagerberg, L., Jonasson, K., von Heijne, G. Prediction of the human membrane proteome. Proteomics. 10, 1141-1141 (2010).
- Wright, G. J. Signal initiation in biological systems: the properties and detection of transient extracellular protein interactions. Molecular bioSystems. 5, 1405-1405 (2009).
- Bushell, K. M., Sollner, C., Schuster-Boeckler, B. Large-scale screening for novel low-affinity extracellular protein interactions. Genome research. 18, 622-622 (2008).
- Durocher, Y., Perret, S., Kamen, A. High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human 293-EBNA1 cells. Nucleic acids research. 30, e9-e9 (2002).
- Bendtsen, J. D., Nielsen, H., von Heijne, G. Improved Prediction of Signal Peptides: SignalP 3.0. Journal of molecular biology. 340, 783-783 (2004).
- Krogh, A., Larsson, B., von Heijne, G. Predicting transmembrane protein topology with a hidden markov model: application to complete genomes. Journal of molecular biology. 305, 567-567 (2001).
- Brown, M. H., Barclay, A. N. Expression of immunoglobulin and scavenger receptor superfamily domains as chimeric proteins with domains 3 and 4 of CD4 for ligand analysis. Protein engineering. 7, 515-515 (1994).
- Wright, G. J., Puklavec, M. J., Willis, A. C. Lymphoid/neuronal cell surface OX2 glycoprotein recognizes a novel receptor on macrophages implicated in the control of their function. Immunity. 13, 233-23 (2000).
- Dustin, M. L., Golan, D. E., Zhu, D. M. Low affinity interaction of human or rat T cell adhesion molecule CD2 with its ligand aligns adhering membranes to achieve high physiological affinity. The Journal of biological chemistry. 272, (1997).
- Wright, G. J., Martin, S., Bushell, K. M. High-throughput identification of transient extracellular protein interactions. Biochemical Society transactions. 38, (2010).
- de Wildt, R. M., Tomlinson, I. M., Ong, J. L. Isolation of receptor-ligand pairs by capture of long-lived multivalent interaction complexes. Proceedings of the National Academy of Sciences of the United States of America. 99, (2002).
- Jiang, L., Barclay, A. N. Identification of leucocyte surface protein interactions by high-throughput screening with multivalent reagents. Immunology. 129, 55-55 (2010).
- Urech, D. M., Lichtlen, P., Barberis, A. Cell growth selection system to detect extracellular and transmembrane protein interactions. Biochimica et biophysica acta. 1622, 117-117 (2003).
- Voulgaraki, D., Mitnacht-Kraus, R., Letarte, M. Multivalent recombinant proteins for probing functions of leucocyte surface proteins such as the CD200 receptor. Immunology. 115, 337-337 (2005).
- Wojtowicz, W. M., Wu, W., Andre, I. A vast repertoire of Dscam binding specificities arises from modular interactions of variable Ig domains. Cell. 130, 1134-1134 (2007).
- Martin, S., Sollner, C., Charoensawan, V. Construction of a Large Extracellular Protein Interaction Network and Its Resolution by Spatiotemporal Expression Profiling. Mol. Cell. Proteomics. 9, 2654-2654 (2010).
- Crosnier, C., Bustamante, L. Y., Bartholdson, S. J., Bei, A. K., Theron, M., Uchikawa, M., Mboup, S., Ndir, O., Kwiatkowski, D. P., Duraisingh, M. T., Rayner, J. C., Wright, G. J. Basigin is a receptor essential for erythrocyte invasion by Plasmodium falciparum. Nature. 480, 534-537 (2011).
- Sollner, C., Wright, G. J. A cell surface interaction network of neural leucine-rich repeat receptors. Genome biology. 10, R99-R99 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados