Method Article
低親和性細胞外受容体 - リガンド相互作用の検出のためのスケーラブルな親和性ベースの細胞外相互作用のスクリーニング(AVEXIS)
要約
AVEXISは、細胞認識のプロセスに関与する新規細胞外受容体 - リガンドペアの体系的に画面に開発した高スループット·タンパク質相互作用アッセイである。これは特に、他の高スループットアプローチを用いて識別することが困難である一時的なタンパク質相互作用を検出するように設計されています。
要約
細胞外タンパク質の分泌や膜繋留タンパク質間のタンパク質相互作用は、細胞間の通信を開始し、多細胞生物の中で凝集を確保するため、両方のために重要である。細胞の相互作用を形成すると予測タンパク質はヒトの遺伝子1の約4分の1でエンコードされていませんが、その重要性と豊かさにもかかわらず、これらのタンパク質の大部分は結合パートナーをまとめました。主に、これは彼らの生化学的な難しによるものです。膜に埋め込まれたタンパク質は、それらのネイティブなコンフォメーションに可溶化することが困難であり、構造的に重要な翻訳後修飾が含まれています。また、受容体タンパク質との相互作用の親和性は、しばしば多くの一般的に使用される高スループットの方法2でそれらの検出を排除し、極めて低い相互作用の強さ(半減期<1秒)によって特徴付けられる。
ここでは、アッセイ、AVEXIS(親和性ベースの細胞外を記述する低い偽陽性率は3で、非常に弱いタンパク質相互作用の検出(T 1/2≤0.1秒)を有効にするこれらの技術課題を克服LARインタラクション画面)。アッセイは、通常、便利なマイクロタイタープレートフォーマットの相互作用(図1)の何千の体系的なスクリーニングを有効にするには、ハイスループット形式で実装されています。それは相互作用をスクリーニングするためにその中に細胞表面の受容体または分泌タンパク質の細胞外ドメインのフラグメントを含む可溶性組換えタンパク質ライブラリーの生産に依存しているため、このアプローチでは、タイプに適しているI、II型、GPIアンカー型細胞表面受容体と分泌このようなイオンチャネルやトランスポーターとして、マルチパスの膜タンパク質のタンパク質ではなく。
組換えタンパク質のライブラリは、そのようなglycosylaなどの重要な翻訳後修飾を確保するために、便利な高レベルの哺乳類発現系4を使用して生成されまするとジスルフィド結合が追加されます。発現した組換えタンパク質が培地中に分泌され、二つの形式で生成されます。スクリーニングに適したストレプトアビジンでコーティングされた固相上に捕捉し、pentamerised酵素タグを付けることができ、ビオチン化餌(β-ラクタマーゼ)餌食。餌と獲物タンパク質は、従来のELISA(図1)に似て、それらの間の直接的な相互作用を検出するためにバイナリ形式でお互いに提示されます。捕食中のタンパク質のpentamerisationは軟骨オリゴマーマトリックスタンパク質(COMP)からペプチド配列によって達成し、それにより検出されるにも非常に一時的な相互作用を有効にするには、重要な親和性の向上を提供する外部ドメインの局所濃度を増加させています。餌とスクリーニングの前に所定のレベルに獲物の両方の活動を正規化することによって、我々は0.1秒の単量体の半減期を持つ相互作用が低い偽陽性率3で 検出できることが示されている。
プロトコル
1。餌と獲物プラスミド発現ベクターのライブラリをコンパイルする
- 細胞表面受容体と相互作用をスクリーニングするために興味のある分泌タンパク質のリストをコンパイルし、適切なタンパク質の配列データベースからそれらの配列を取得します。 N末端分泌シグナルペプチドを含むほとんどのタンパク質は、(これらはIを入力して、GPI-結合及び分泌タンパク質含む)に適しています。一般的に、タンパク質ファミリー(例えば、免疫グロブリンスーパーファミリーや、赤血球などの特定の細胞型に制限され、すべての受容体)が選択されます。
- 蛋白質機能予測ソフトウェアを使用して、シグナルペプチドと膜貫通領域の位置を特定することによって、細胞外領域の範囲を決定します。我々は、通常、SignalP v3.0の5 TMHMM v2.0の6を使用します 。
- 各受容体の細胞外ドメイン全体の断片を増幅するデザインのプライマーセット。我々はこの目的に適している餌と獲物のベクトルのスイートを持っているAddgene(339 vailable http://www.addgene.org/~~V )。 NotI制限酵素部位、最適なKozak配列を含むようにメチオニン開始前後センスプライマーを設計し、これは正確に一致する遺伝子特異的配列(図2A)の25塩基対が続いている。
- 直前予測膜貫通領域に可溶性組換え蛋白質として細胞外ドメイン全体を表現するようにI型受容体タンパク質を切り詰めるためにアンチセンスプライマーを設計します。その後、C末端ラットCd4d3 4タンパク質タグ7(図2A)にフレームに変換する必要があり、このプライマーのAscIで制限部位を含む。
- これらのプライマーを使用して、すべての遺伝子から細胞外ドメインの断片を増幅し、餌や獲物のベクトルにそれらのクローンを作成します。我々は、時には適切な哺乳動物発現ベクターにサブクローニングする前に、我々はpTT3ベクトル3,4の導関数を最初に使用するシャトルベクターにそれらのクローンを作成しておくと便利です。餌と獲物ベクトルcontai両方次のようにN、C末端タンパク質タグ(図2B)。
- 餌: 大腸菌のBirA酵素の基質であるペプチド配列が続くので、特定のリジン残基にmonobiotinylatedすることができラットCD4(Cd4d3 4)タンパク質のドメイン3と4を含むタグが(図2B) 。 Cd4d3 4タグはOX68モノクローナル抗体によって認識され、ELISA法によりベイトタンパク質の発現を定量化するために使用されています。餌タンパク質は、したがって、単量体とmonobiotinylatedです。 biotinylatableペプチドを精製するための6-Hisタグに置き換えられます追加のbaitタンパク質ベクターは、ご利用いただけます。
- 餌:餌はまた、ラット軟骨オリゴマーマトリックスタンパク質(COMP)とC末端β-ラクタマーゼ酵素からのペプチド配列に続いてラットCd4d3 4タグが含まれています。 COMPペプチドはペンタマーは一度表明獲物フォームを保証した(図2B)。
2。獲物とベイト蛋白質の発現
我々は、使用私たちのタンパク質ライブラリーを生成するHEK293Eセル4行目の浮遊培養が、任意の哺乳動物発現系を用いて便利な高レベルの発現系が適してなければなりません。市販の代わりに、フリースタイルのシステムです。細胞は、日常的に37℃で振とうプラットフォーム(125 rpm)で°C、70%相対湿度5%CO 2で培養される。正と負の両方の制御タンパク質はまた、表現する必要があります。ラットCd4d3 4タグのみの断片は、餌と餌の両方として使用可能で、適切な負のコントロールです。同様に、ポジティブコントロールをエンコード餌と獲物のベクトルは(Addgene)をご利用いただけます。我々は、通常、ラットCD200-CD200R相互作用8を使用します 。
- シードHEK293E細胞を2.5×10 5細胞の密度mL -1の時の前にトランスフェクションの日。メーカーの推奨に従ってFreestyle293メディアの50 mLの量の私たちは日常的に細胞を培養。効率的なビオチン化を確保するために、tを補う彼は、細胞培養培地、100μMの最終濃度にD-ビオチンと餌のタンパク質を生産するために使用されます。餌食タンパク質を発現するために使用される培地は、追加D-ビオチンを補充する必要はありません。
- 次の日、適切なトランスフェクション試薬(例えば293fectin)を使用してトランスフェクト細胞。 50 mLの文化をトランスフェクトするために餌または獲物プラスミドコンストラクトの25μgを使用しています。 ビオチン化した餌を生成するために、同時トランスフェクションをコードするプラスミド餌は、 大腸菌のタンパク質ビオチンリガーゼ(の分泌型をコードするプラスミドを構築するAddgeneから入手可能ですBIRA)。をコードするプラスミドの10:1(2.5μg)との共同トランスベイトプラスミド分泌BirAのタンパク質である。
- 最初のフィルター0.22μmの上清を濾過し、続いて20分間3000×gで遠心して細胞をペレット化による収穫培養5日後にトランスフェクション。
[ヒント:ベイトとpreyタンパク質sは、4℃で希釈し、一般的なガイドラインは、一年以内に使用されるべきとして格納する必要があります。例えば50μg/ mLのポリミキシンB硫酸塩又は上澄み液の細菌汚染を防ぐために10mMのNaN 3としてbacteriostaticsを追加します。]
3。餌と獲物サンプルの正規化
AVEXISアッセイの主要な特徴の一つは、組換えタンパク質が分泌されているため、彼らは前のアッセイに使用されているに確立された閾値の活動の中で(正規化)に希釈または濃縮することができるということです。最大4桁まで - - 我々は組換えタンパク質が発現されるレベルは、広い範囲にまたがることを発見したので、正規化のステップが大幅に画面中に偽陽性の数を減らすことができます。
3.1ベイトの正規化
注:ビオチン化BAIと競合するので、非標識D-ビオチンは、メディア(通常は透析による)から削除する必要があります結合部位をストレプトアビジンに結合するためのtのタンパク質。
- 透析チューブ、ラベルに餌の培養上清を移し、しっかりとクリップおよび遊離ビオチンを除去するようにPBSのような適当な緩衝液に対して広くdialyse。
[ヒント:我々は、十分な透析は、通常24時間以上4変更を含むPBS中の4.5 Lのボリュームに対して6×50 mLの餌の上清が達成されていることを発見した。不十分な透析は、餌の正規化ステップの間に低希釈でのタンパク質の結合を阻害することによって観察することができた(図3A)。
- 餌のタンパク質が発現される時に相対的なレベルを決定するためにELISAを行います。ビオチン化した餌タンパク質の希釈系列を調製し、ストレプトアビジンコートマイクロタイタープレート上で、それらをキャプチャします。モノクローナル抗体(OX68)を使用してキャプチャされた餌のタンパク質を検出し、定量化するためにラットCd4d3 4タグを使用します。すべてのビオを飽和させるために必要な最小量に餌タンパク質を濃縮または希釈するストレプトアビジンコートしたプレートのウェルに結合部位インチ
- 15分間(BSA)のTween-20(PBST)/ 2%ウシ血清アルブミンsaline/0.1%のリン酸緩衝ストレプトアビジン被覆プレートのウェルをブロックします。
- 別のプレートに、PBST / 2%BSAとストレプトアビジン被覆プレートのウェルへの転送で餌タンパク質の希釈系列(4つ1:03希釈は、通常十分である)を作る。室温で1時間インキュベートする。
- PBSTで3倍の洗浄。室温で1時間に2μg/ mLのマウス抗ラットCd4d3 4 IgG抗体(OX68)インキュベートの100μLを追加します。
- PBSTで3倍の洗浄。 PBST / 2%BSAで1:5,000に希釈した抗マウスアルカリホスファターゼの100μLを加え、室温で1時間インキュベートします。
- PBSTで3倍の洗浄と残留洗剤を削除するには、PBSの最終的な洗浄を行います。ジエタノールアミンバッファー(10%ジエタノールアミン(v / v)で、0.5mmのMgCl 2を 、4℃で遮光して保存されているの10mMのNaN 3、pH9.8で1 mg / mLと基板104の100μLを追加します。°C)。
- 1時間後、405 nmで吸光度を測定します。代表的な餌の正規化の結果は、図3Aに示されています。
- ストレプトアビジンコートプレートのすべてのビオチン結合部位を飽和させるには不十分であるレベルで発現される餌のタンパク質は、希釈せず使用する場合は、Vivaspinコンセントレータ(Vivascience、10kDa MWCO)を用いて濃縮する必要があります。ガイドとして、我々は典型的なbaitタンパク質(〜80 kDa)の〜5μgのは、96ウェルプレートを飽和させるのに十分であると推定している。
- 高レベルで発現餌タンパク質は、ストレプトアビジンコートプレートを飽和するのに十分な濃度にPBST / 2%BSAで希釈することができる。ベイトの活性は、彼らがストレプトアビジンコートプレート内のすべてのビオチン結合部位を飽和ことを確認するために希釈または濃縮した後に再チェックする必要があります。
3.2獲物の正規化
- 獲物タンパク質はβ-ラクタマーゼを使用して表現されるときの相対的なレベルを定量化する酵素活性。
- 最初に、PBST / 2%BSAバッファー中で獲物タンパク質を含む上清の希釈系列を作成します。その後242μM(0.125 mg / mL)はニトロセフィン溶液(Calbiochem)を60μLに希釈液の20μLを追加します。
- 直ちに 、室温で20分間、毎分485 nmでの吸光度の測定を行いマイクロタイタープレートリーダープレートを転送します。代表的な餌の正規化の結果は、図3Bに示されています。
- 遠心コンセントレータを使用してサンプルを濃縮したりニトロセフィンの〜2ナノモルmin -1の売上高のしきい値のアクティビティに到達するためにそれらをPBST / 2%BSAで希釈します。すべてのニトロセフィンが〜7分以内に加水分解されている場合は実質的に、これは達成されます。
4。 AVEXISのスクリーニング方法
- PBSTでストレプトアビジンコートプレートを洗浄してください。
- 各ウェルにPBST / 2%BSAの100μLを追加し、各ウェル内の任意のスプリアスタンパク質結合部位をブロックするために30分間インキュベートします。
[ヒント:洗浄ステップの後に残った洗浄バッファーを除去するために、プレートがタップされた - 精力的に - ペーパータオルの上]
- シンク上のプレートのスマートな映画でブロッキング溶液を除去し、適切なウェルに100μLの正規化されたビオチン化モノマーの餌を追加し、室温で1時間インキュベートします。
- プレートをupturningとスマートシンクの上にフリックでプレートから餌のサンプルを削除し、PBSTで3回洗浄します。
- 正規化されたpentamerizedの獲物の追加100μLを各ウェルに構築し、室温で1時間インキュベートし、ステップ4.4のように洗うだけで、PBSで1最終洗浄を行います。
- 242μMニトロセフィン溶液(さらに40mLのPBSでニトロセフィンを希釈し、プレートに加える前に、0.22μmのフィルターを通過した後、DMSOを500μLにニトロセフィンの5mgを溶解徹底的にミックスして)60μLを追加し、室温でインキュベート。正の相互作用を観察することができる以来、目で黄色のニトロセフィンが赤色に加水分解されています。プレートリーダーを用いて485 nmの吸光度を読み取ることによって定量化する。典型的なプレートと定量は、図に示されています。 4。
[ヒント:プレートはすべての潜在的な相互作用が検出されるように16時間4℃で配置する必要がありますが、正の相互作用は通常、室温で2時間以内に観察される。我々はまた、キズ/指紋などのマイクロタイタープレートのプラスチックの上に沈殿したニトロセフィンと欠点が時折いない明白なニトロセフィンの加水分解にもかかわらず、485nmのartefactual偽陽性につながることを発見した。したがって、視覚的に井戸のニトロセフィン売上高を記録するためにプレートの写真を撮ることをお勧めします。]
5。代表的な結果
代表的なAVEXISスクリーニングプレートの例を図4に示されています。一つのニトロセフィン基質の加水分解(赤に黄色)遵守すべき約10分以内に陽性コントロールウェル(抗体媒介餌食キャプチャコントロールし、また陽性コントロールの相互作用の両方)。画面内のいくつかの相互作用も、この時間スケール内で観察されていますが、他は時間がかかる場合があります(数時間)が表示されます。通常は、約0.4から0.6パーセントのヒット率(スクリーニングされているすべての150から250までの相互作用の正の相互作用)が上映されるタンパク質ライブラリーに応じて、典型的である。
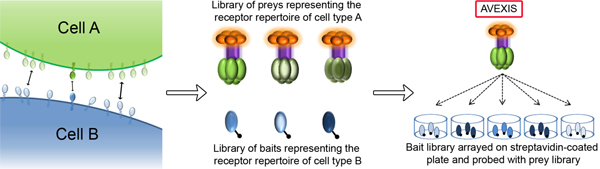
図1。 AVEXISを用いた細胞認識プロセスを媒介する受容体-リガンド相互作用の同定 。回路図は、膜に埋め込まれた受容体タンパク質との間で相互作用を介して情報を交換する2つの相互作用細胞(AとB)を示しています。 AVEXISは、特に非常に弱い相互作用の強さによって特徴付けられる新規な受容体 - リガンドのペアを識別するために設計されたスケーラブルなタンパク質相互作用アッセイである。その組換え両方の細胞の細胞表面受容体レパートリーの全体の細胞外ドメインを表すlubleタンパク質ライブラリーは、五量体β-ラクタマーゼタグ付け餌(セルタイプ)または単量体のビオチンタグの付いた餌(細胞型B用)のいずれかとしてコンパイルされます。食い物のpentamerisationも非常に一時的な相互作用を検出することができるように全体的な親和性の利得を達成するために外部ドメインの局所濃度を増加させます。餌ライブラリは、ストレプトアビジンコートプレート上に配列し、体系的に餌のタンパク質との相互作用のためにプローブされます。簡単に洗浄した後、キャプチャされた捕食は、獲物に関連付けられているβ-ラクタマーゼ活性を用いて検出される。

図2。餌と獲物は、デザインを構築します。 (A)ラットCD200受容体タンパク質は、細胞表面受容体タンパク質の全体の外部ドメインが決定され、プライマーは両方の餌を作るために設計されている方法の例として提供されていますと獲物の発現コンストラクト。 cDNAおよび翻訳されたタンパク質配列のN末端のシグナルペプチドからラットCD200の膜貫通型の膜貫通領域に表示されます。センスプライマーは、CD200 cDNA配列に正確に一致する配列の25塩基に続いて5 'NotI制限酵素部位、最適なKozak配列を含むように設計されています。アンチセンスプライマーは、ASCIのサイトと、選択した細胞外ドメインの切り捨て残基のすぐ上流に位置して正確に一致する配列の25塩基が含まれています。ラットCd4d3 4タグ付きフレームに細胞外ドメインを維持するために、ASCIのサイトは、Gly-ALA-Proのように変換する必要があります。 (B)餌と獲物の発現コンストラクトの概略図。各々は、NotI部位およびAscIサイトやCd4d3 4タグで挟まれた受容体の外部ドメインが含まれています。餌は、特にプラスミドが分泌BirA酵素を発現するトランスフェクションによってmonobiotinylatedすることができますC末端ペプチド配列を含んでいます。食い物はpentamerisationシーケンスが続いている軟骨オリゴマーマトリックスタンパク質(COMP)とβ-ラクタマーゼ酵素から。
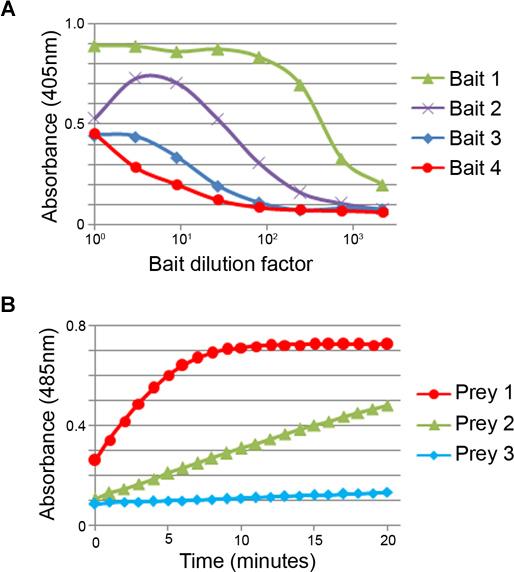
図3。餌と獲物タンパク質の正規化。餌の正規の(A)代表的な例。 4つの異なる透析餌上清の希釈系列は、抗CD4タグモノクローナル抗体を用いたELISAによって検出された。 4餌は異なるレベル1> 2> 3> 4で表されます。餌を各ウェルにビオチン結合部位を飽和しきい値レベルに正規化する必要があります。高度に発現した餌(例えば、餌1〜1:100に希釈することができます)蛋白質を節約するために希釈し、十分に発現して餌を濃縮することができます。低希釈で減少した測定値が時々不完全な透析に起因する共役D-ビオチンの存在に起因しているいくつかの餌(例えば、餌2)で観測されている。 (B)のタンパク質を捕食れるレベルは、exです。押されたβ-ラクタマーゼ基質、ニトロセフィンの加水分解速度を用いて定量化されています。獲物1> 2> 3:示されている例では、3つの餌は、異なるレベルで発現されています。餌(例えば獲物1)〜7分で14.5 nmolのニトロセフィンの加水分解を完了するために対応〜2ナノモル分-1の活動に正規化する必要があります。この例では、他の捕食は、スクリーニングで使用する前に集中しなければなりません。
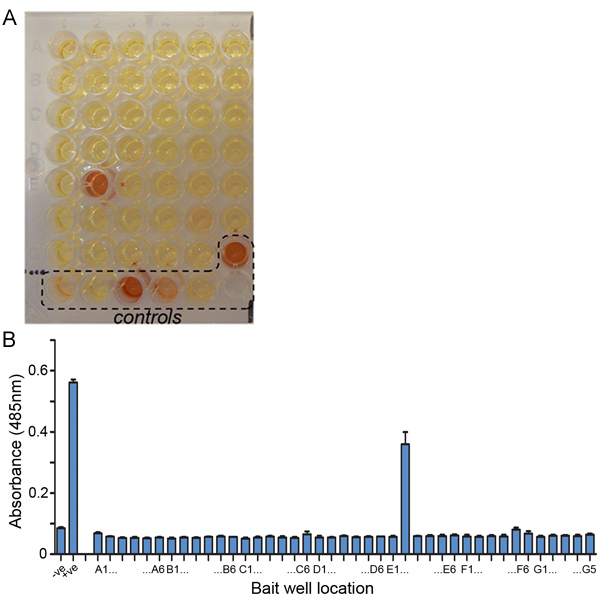
図4。代表的なAVEXISスクリーニング結果。 (A)代表AVEXISスクリーニングプレートの写真。 preyタンパク質は41種類の餌に対してプローブされ、正の相互作用はよくE2が検出された。スクリーニングプレートに使用されるコントロールは、次のとおりです。しきい値の希釈で使用CD200Rの餌食とラットCD200(ベイト)CD200R(獲物):ビオチン化抗CD4すべてのpreyタンパク質をキャプチャする抗体は、(G6)のウェルに制御の相互作用を追加しました(H3)、1:10(H4)と1:100(H5)。ネガティブコントロールは次のとおりだった:Cd4d3 4餌は上映されてpreyタンパク質(H1)をプローブとし、CD200R獲物(H2)。 (B)三重で行われ、同じ画面の吸光度の定量化。データポイントは、平均値±SDである。
ディスカッション
生きている細胞はin vivoで観察された場合、その細胞膜は非常に動的な挙動を示す:彼らが連絡して、彼らの隣人2と通信する際の拡張と後退膜プロセス。これらの接点の多くを仲介する細胞膜に埋め込まれた受容体タンパク質間の物理的相互作用は、この非常に運動性の動作を許可するように非常に弱いように進化してきました。それは50μMとして弱いように単量体の相互作用の強さは非常に2,10に挑戦する新たな相互作用を検出できます生理的受容体密度が9で自発的な相互作用を駆動するのに十分であることと推定されている。低い偽陽性率でスケーラブルな方法で実装することができるタンパク質の相互作用:ここで説明しAVEXISメソッドは一時的な細胞外タンパク質を検出する感度の高い方法を提供します。他のスケーラブルな方法は、11月15日細胞の相互作用を検出するために開発されているが、AVEXISの一つの利点は、そのような餌と捕食活動などの実験パラメータが低い偽陽性率3を維持しながらも(T 1/2≤0.1秒)の相互作用の弱いを検出するために定量化されていることです。さらに、合理化された堅牢な試料調製手順は、他のアッセイよりもはるかに大規模に実装するために、このアッセイを有効にしていると我々は最近〜16500潜在的な相互作用16歳以上の合計体系的相互作用の画面を説明してきました。
アッセイは、可溶性の組換えタンパク質断片を発現させることが可能となっている任意のタンパク質を実行することができます。したがって、これはそのようなI型、GPI-結合及び分泌タンパク質のN末端シグナルペプチドを含むタンパク質が含まれています。我々は最近、今私たちが餌17とタイプIIのタンパク質を発現することができますベクトルのスイートを設計しました。アッセイは、一般的に、イオントランスポーターとして、マルチパスの膜タンパク質には適していませんsまたはポンプが正常に細胞膜のコンテキストの外側で折られることはほとんどありませんので。我々は、異なる様々なシステムにこれを適用していると正常ゼブラフィッシュ3,16,18、ヒト、マウス、およびPから細胞外タンパク質を表明している対話画面での熱帯熱マラリア 。
AVEXIS画面を設定するために必要なリソースの面で、我々は重大なボトルネックが選定、建設、発現プラスミドの完全なシーケンスであることを見出した。メソッドのこの側面は、〜100餌と獲物の構造を作るために年に取ることができますが、遺伝子合成の減少コストで、我々は現在、市販プロジェクトのこの側面をアウトソーシング好む。大揺れ組織培養インキュベーター(我々はINFORS HT Multitronセルを使用してください)と一緒に哺乳動物発現系は発現し、約100餌と獲物タンパク質月までに正規化する単一の研究者を可能にします。タンパク質が生成し、s、正規化されたら、相互作用のためにcreeningする便利な一日あたり処理されている12までの96ウェルプレートで迅速です。我々は、タンパク質のような大規模な数の生産を容易にするために開発されていることを唯一のオーダーメイドの装置が並列に0.22μmフィルターを通して5上清に渡すために使用されている圧縮空気駆動型ピストンです。
これらの相互作用のいくつかは3を検出することができますが、文献(偽陰性)から予想される相互作用に比べ見逃されるかもしれない相互作用のメインクラスは、同種の相互作用があります。予想される相互作用が検出されない場合には、私たちは、これがその後固定化した餌のタンパク質との相互作用を防ぐことができ、さらに餌タンパク質による同種の相互作用の形成(獲物 "マスキング"効果)によるものであると信じています。相互作用が検出された周波数は、スクリーニングされている蛋白質ライブラリのコンテンツに依存します。読者へのガイド> 30の画面として、ゼブラフィッシュ免疫グロブリンスーパーファミリー内の000の相互作用は、188陽性の結果- 0.6パーセント3,16,18の周波数。つまり、結合タンパク質のいずれかの餌として存在するかどうかにかかわらず、同じ相互作用を検出することができます。任意の正のヒットを確認するために実行することができます非常に迅速なチェックでは、相互作用は、両方の餌 - 捕食の方向で検出することができるかどうかを判断することですまたは獲物。我々はこの往復動作を観察したときは、バインディングが続いて表面プラズモン共鳴を用いたタンパク質の精製直接飽和結合を示すことにより、特定であることが示されている。それは我々が人工的に餌のタンパク質をpentamerisingによって結合親和性を高めるために、我々は定量的に相互作用強度を比較するための適切なアッセイを考慮していないことを強調する必要があります。相互作用の生物物理学的結合パラメータを取得するために我々は、単量体蛋白質と表面プラズモン共鳴を使用しています。最後に、かつての相互作用が同定された、ハイアッセイのGHスループットの性質は、そのような抗体または相互作用をブロックする小分子などの試薬をスクリーニングするアッセイ法を適応することが比較的容易になります。
開示事項
著者らは、開示することは何もありません。
謝辞
この作品は、ウェルカムトラスト助成番号[077108]によってサポートされていましたGJWに授与されました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | 猫。数 | コメント |
| フリースタイルメディア | インビトロジェン | 12338018 | |
| ニトロセフィン | カルビオケム | 484400 | |
| SAコーティングされたマイクロタイタープレート | ヌンク | 734-1284 | |
| OX68抗体 | AbDSerotec | MCA1022R | |
| 透析チューブ | ピアース | PN68100 | |
| ポリミキシンB | シグマ | P4932 | |
| D-ビオチン | シグマ | B4639-5G | |
| 基板-104 | シグマ | 1040-506 | |
| Vivaspin-20遠心コンセントレータ | 縫工筋 | VS2002 | |
| 0.22μmのフィルター | ナルゲン | 190-2520 |
参考文献
- Fagerberg, L., Jonasson, K., von Heijne, G. Prediction of the human membrane proteome. Proteomics. 10, 1141-1141 (2010).
- Wright, G. J. Signal initiation in biological systems: the properties and detection of transient extracellular protein interactions. Molecular bioSystems. 5, 1405-1405 (2009).
- Bushell, K. M., Sollner, C., Schuster-Boeckler, B. Large-scale screening for novel low-affinity extracellular protein interactions. Genome research. 18, 622-622 (2008).
- Durocher, Y., Perret, S., Kamen, A. High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human 293-EBNA1 cells. Nucleic acids research. 30, e9-e9 (2002).
- Bendtsen, J. D., Nielsen, H., von Heijne, G. Improved Prediction of Signal Peptides: SignalP 3.0. Journal of molecular biology. 340, 783-783 (2004).
- Krogh, A., Larsson, B., von Heijne, G. Predicting transmembrane protein topology with a hidden markov model: application to complete genomes. Journal of molecular biology. 305, 567-567 (2001).
- Brown, M. H., Barclay, A. N. Expression of immunoglobulin and scavenger receptor superfamily domains as chimeric proteins with domains 3 and 4 of CD4 for ligand analysis. Protein engineering. 7, 515-515 (1994).
- Wright, G. J., Puklavec, M. J., Willis, A. C. Lymphoid/neuronal cell surface OX2 glycoprotein recognizes a novel receptor on macrophages implicated in the control of their function. Immunity. 13, 233-23 (2000).
- Dustin, M. L., Golan, D. E., Zhu, D. M. Low affinity interaction of human or rat T cell adhesion molecule CD2 with its ligand aligns adhering membranes to achieve high physiological affinity. The Journal of biological chemistry. 272, (1997).
- Wright, G. J., Martin, S., Bushell, K. M. High-throughput identification of transient extracellular protein interactions. Biochemical Society transactions. 38, (2010).
- de Wildt, R. M., Tomlinson, I. M., Ong, J. L. Isolation of receptor-ligand pairs by capture of long-lived multivalent interaction complexes. Proceedings of the National Academy of Sciences of the United States of America. 99, (2002).
- Jiang, L., Barclay, A. N. Identification of leucocyte surface protein interactions by high-throughput screening with multivalent reagents. Immunology. 129, 55-55 (2010).
- Urech, D. M., Lichtlen, P., Barberis, A. Cell growth selection system to detect extracellular and transmembrane protein interactions. Biochimica et biophysica acta. 1622, 117-117 (2003).
- Voulgaraki, D., Mitnacht-Kraus, R., Letarte, M. Multivalent recombinant proteins for probing functions of leucocyte surface proteins such as the CD200 receptor. Immunology. 115, 337-337 (2005).
- Wojtowicz, W. M., Wu, W., Andre, I. A vast repertoire of Dscam binding specificities arises from modular interactions of variable Ig domains. Cell. 130, 1134-1134 (2007).
- Martin, S., Sollner, C., Charoensawan, V. Construction of a Large Extracellular Protein Interaction Network and Its Resolution by Spatiotemporal Expression Profiling. Mol. Cell. Proteomics. 9, 2654-2654 (2010).
- Crosnier, C., Bustamante, L. Y., Bartholdson, S. J., Bei, A. K., Theron, M., Uchikawa, M., Mboup, S., Ndir, O., Kwiatkowski, D. P., Duraisingh, M. T., Rayner, J. C., Wright, G. J. Basigin is a receptor essential for erythrocyte invasion by Plasmodium falciparum. Nature. 480, 534-537 (2011).
- Sollner, C., Wright, G. J. A cell surface interaction network of neural leucine-rich repeat receptors. Genome biology. 10, R99-R99 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved