Method Article
Genotipagem de amostras de plantas e animais, sem purificação DNA Antes
Neste Artigo
Resumo
A abordagem de PCR directo apresentado aqui facilita a amplificação por PCR directamente a partir de pequenas quantidades de planta não purificada e do tecido animal.
Resumo
A abordagem de PCR directo facilita a amplificação por PCR directamente a partir de pequenas quantidades de amostras não purificadas e é demonstrado aqui para várias plantas e tecidos animais (Figura 1). Directo de PCR baseia-se especialmente projetados Thermo Scientific Phusion e polimerases de ADN Phire, que incluem um domínio de ADN de cadeia dupla ligação que lhes confere propriedades únicas, tais como a tolerância elevada de inibidores.
PCR baseado em detecção de DNA-alvo tem inúmeras aplicações na pesquisa de plantas, incluindo a análise de plantas genótipo e verificação de transgenes. PCR a partir de tecidos de planta tradicionalmente envolve uma etapa inicial de isolamento de ADN, o que pode requerer reagentes caros e tóxicos. O processo é demorado e aumenta o risco de contaminação cruzada 1, 2. Por outro lado, usando Thermo Scientific Phire Planta directa PCR Kit o ADN alvo pode ser facilmente detectado, sem extracção prévia de ADN. No modelo aqui demonstrado, umaexemplo de derivado análise da sequência clivada polimórfico amplificado (dCAPS) 3,4 é feita directamente a partir de folhas de plantas de Arabidopsis. ensaios dCAPS genotipagem podem ser utilizados para identificar um polimorfismo (SNP) por SNP digestão com endonucleases de restrição específica de alelo 3.
Algumas amostras de plantas tendem a ser mais difícil quando se utiliza métodos directos de PCR em que contêm componentes que interferem com a PCR, tais como compostos fenólicos. Nestes casos, um passo adicional para remover os compostos é tradicionalmente requerido de 2,5. Aqui, este problema é resolvido por meio de um protocolo de diluição rápida e fácil se amplificação por PCR directo (Figura 1). Quinze anos folhas de carvalho são usadas como um modelo para plantas difíceis como a amostra contém grandes quantidades de compostos fenólicos, incluindo taninos.
A transferência de genes em ratos é largamente utilizada para estudar o papel de genes em desenfisiologia volvimento, e a doença humana. A utilização destes animais requer triagem para a presença do transgene, geralmente com PCR. Tradicionalmente, isto envolve um tempo de passo de isolamento de ADN de consumo, durante a qual o ADN para análise de PCR é purificado a partir da cauda do ouvido, ou dedo do pé tecidos 6,7. No entanto, com as Thermo Scientific Phire tecido animal diretos PCR Kit ratos transgênicos podem ser genotipados sem purificação de DNA antes. Neste protocolo de rato transgénico genotipagem é obtida directamente a partir de tecidos da orelha do rato, tal como demonstrado aqui para um exemplo desafiador onde apenas um conjunto de primer é usado para a amplificação de dois fragmentos que diferem muito de tamanho.
Protocolo
1. Genotipagem dos indivíduos planta Arabidopsis com protocolo direto
- Para começar o ensaio de genotipagem dCAPS directamente sobre a folha da planta Arabidopsis, primeiro formular 20 ou 50 ul de reacções de PCR utilizando a Usina Phire directa PCR Kit, como descrito na Tabela 1.
- Em seguida, corte um soco 0,50 mm a partir de uma folha da planta Arabidopsis usando o Harris Uni-Core e Harris esteira de corte. Segurando o perfurador com firmeza, pressione a ponta para o tecido e gire o perfurador e para trás.
- Pressione o êmbolo para ejetar o disco soco em uma mistura de reação de PCR. Certifique-se de que a amostra cai para dentro da solução de PCR e não aderem às paredes do tubo.
- Limpe a ponta do perfurador entre cada amostra para evitar a contaminação cruzada, mergulhando-o em solução de hipoclorito de sódio a 2%. Pressione o êmbolo para cima e para baixo algumas vezes e limpe a ponta com uma toalha de papel. A placa de corte deve ser tambémenxaguado entre amostras.
- Em seguida, utilizam uma Thermo Scientific Piko 24 cavidades Thermal Cycler e Thermo Scientific Piko Placa PCR para realizar as reacções de PCR, utilizando as condições de ciclagem descritas na Tabela 2. As reacções de PCR pode também ser realizada em convencionais de PCR termocicladores.
- Após a PCR, girar o material vegetal. Transferir 5 ul de sobrenadante para um tubo de microcentrífuga novo. Adicionar 4 ul de água e 1 ul da enzima de restrição, SspI. Misturar suavemente e girada para baixo rapidamente para recolher o conteúdo na parte inferior do tubo. Incubar a mistura de reacção durante uma hora a 37 ° C. Inactivar a enzima de restrição, por incubação a 65 ° C durante 20 min.
- Quando a amplificação do ADN directamente a partir de tecidos de plantas, os produtos de PCR de plantas e incluem PCR derivado de componentes que possam interferir com a enzima de digestão de restrição. Por isso, pode ser necessário diluir ou (por exemplo, 1:2 ou 1:3 em água), ou purificar o produto de PCR antes tele digestão subsequente, por exemplo, utilizando um kit comercial, tal como apropriado Thermo Scientific Purification Kit GeneJET PCR.
- Após a digestão com enzimas de restrição, análise dos fragmentos resultantes num gel de agarose. Adicionar 2,5 uL de tampão de carga de 5x à reacção e de electroforese em gel de agarose a realizar com 10 uL da mistura resultante.
2. Amplificar fragmentos específicos de DNA a partir de Carvalho de 15 anos de idade, Folhas usando o protocolo de diluição
- Para começar, corte um soco 2 mm de folha de carvalho.
- Colocar a amostra em 20 ul de tampão de diluição fornecido com a Usina direto Phire Kit PCR. Limpe a ponta do perfurador e corte tapete como antes.
- Triturar a amostra de folha com uma ponta de pipeta de 100 uL, pressionando-o contra brevemente a parede do tubo. Dependendo do material de planta, o protocolo de diluição, por vezes, trabalha melhor sem esmagamento da amostra.
- Girar as amostras brevemente numa microcentrífuga até tele reacções são no fundo dos tubos.
- O sobrenadante pode ser utilizado directamente na PCR, ou pode ser diluído 1:10 ou 1:100 em água estéril, dependendo do tipo de amostra. Utilizar 0,5 ul de 1 ul do sobrenadante ou diluição como molde para uma reacção de PCR 20 ul. Preparar a reacção, tal como descrito na Tabela 1.
- Uma vez que as reacções são preparados, empregar uma Thermo Scientific Piko 24 cavidades Thermal Cycler e Thermo Scientific Piko Placa PCR para realizar as reacções de PCR, utilizando as condições de ciclagem descritas na Tabela 2. As reacções de PCR pode também ser realizada em convencionais de PCR termocicladores.
- Após a PCR, adicionam-se 5 ul de tampão de carregamento de 5x à reacção e de electroforese em gel de agarose a realizar com 15 uL da mistura resultante.
3. Genotipagem de camundongos transgênicos que utilizam o protocolo de diluição
- Iniciar o protocolo de diluição em ratinhos transgénicos, colocando um perfurador 2 mm da mouse orelha em 20 ul de tampão de diluição contendo 0,5 uL de Aditivo DNARelease fornecido com o Kit de tecido animal Phire PCR directo.
- Incubar as amostras à temperatura ambiente, durante 2 min, seguido de 2 minutos de incubação a 98 ° C.
- Girar as amostras brevemente numa microcentrífuga até que as reacções estão na parte inferior dos tubos.
- Use 1 ul de sobrenadante como molde para uma reacção de PCR 20 uL, preparado tal como descrito na Tabela 3. Qualquer sobrenadante que não está a ser utilizado pode ser imediatamente transferida para um novo tubo e armazenado a -20 ° C.
- Em seguida, utilizam uma Thermo Scientific Piko 24 cavidades Thermal Cycler e Thermo Scientific Piko Placa PCR para realizar as reacções de PCR, utilizando as condições de ciclagem descritas na Tabela 4. Mais uma vez, as reacções de PCR pode também ser realizada em termocicladores convencionais de PCR.
- Seguindo PCR, adicionam-se 5 ul de tampão de carregamento de 5x à reacção e de electroforese em gel de agarose a executar wul 15 i da mistura resultante.
4. Resultados representativos
Na técnica dCAPS o sítio de restrição dentro do SNP de interesse é introduzida ou destruídos ou usando um iniciador de PCR, com uma ou mais diferenças para o DNA-alvo. A genotipagem de indivíduos de plantas de Arabidopsis foi realizada com a técnica dCAPS directamente a partir de punções de folha. Os produtos amplificados foram digeridos e os fragmentos resultantes revelando o genótipo de cada indivíduo foram analisados por electroforese em gel (Figura 2).
Neste exemplo, os 160 pb produtos de PCR contendo o local SNP de interesse (G ou alelo A), no genoma de Arabidopsis foram amplificados a partir de punções de folha da planta com a planta directa Phire Kit PCR. O iniciador directo continha uma incompatibilidade na extremidade 3 ', criando um local de restrição SspI-específica no ADN alvo, que inclui o SNP de interesse (alelo A), mas nãono outro alelo do SNP (Figura 2B).
Protocolos de diluição é necessária para material de planta desafiador, tais como a folha de carvalho, devido à sua elevada concentração de compostos fenólicos. Usando o protocolo de diluição descrito aqui, o fragmento de 297 pb de DNA cloroplástico foi amplificado utilizando o protocolo de três passos. Amostras de folhas de carvalho com diferentes diluições são mostrados na Figura 3, para além dos controlos positivo e negativo.
O animal Phire Tissue Kit de PCR directo foi empregado com um protocolo de desafio em que apenas um conjunto de iniciadores foi utilizado para a amplificação de dois fragmentos com uma diferença de tamanho grande, resultando em rendimentos abundantes de ambos os produtos correctamente tamanho de 1500 pb para ratos transgénicos e 200 pb para ratinhos de tipo selvagem (Figura 4). A banda mais fraca superior com camundongos heterozigotos é devido à concorrência de ambos os modelos (alelos) para o par de primers mesmo, porém, o genotyping resultados são inequívocos.
A estabilidade das amostras preparadas utilizando o protocolo de diluição foi também testado. Os resultados mostram que as amostras de diluição podem ser armazenadas a -20 ° C durante pelo menos um ano. Além disso, repetidos de congelamento / descongelamento não afectou significativamente a reacção (Figura 5). Também é mostrado a amplificação a partir de amostras de rato robusto orelha tecido com Phire polimerase de DNA e do método de PCR directa em comparação com hot start Taq polimerase e DNA purificada (Figura 6).
| Componentes | Reacção de 20 uL | 50 reação ul | Conc final. |
| H 2 O | adicionar 20 ul | adicionar a 50 ul | |
| 2x Phire Planta PCR buffer | 10 ul | 25 ul | 1x |
| Um iniciador | X ul | X ul | 0,5 uM |
| iniciador B | X ul | X ul | 0,5 uM |
| Phire Hot Start DNA Polimerase II | 0,4 ul | 1 ul | |
| Amostra / protocolo direto | 0,50 milímetros perfurador | ||
| Amostra / diluição protocolo | 0,5-1 ul |
Tabela 1. Condições de reação para Usina de PCR utilizado neste protocolo.
| Passo ciclo | Temp. | Tempo | Ciclos |
| Desnaturação inicial | 98 ° C | 5 min | 1 |
| Desnaturação Recozimento * Extensão | 98 ° C X ° C 72 ° C | 5 seg 5 seg 20 sec | 40 |
| Extensão final | 72 ° C 4 ° C | 1 min segurar | 1 |
Tabela 2. Condições do ciclismo para Usina de PCR utilizado neste protocolo.
* A calculadora Tm emoscientific.com / pcrwebtools "target =" _blank "> www.thermoscientific.com / pcrwebtools é recomendado para a determinação da Tm para primers a serem usados com ADN polimerase Hot Phire Iniciar II. A temperatura recomendada para recozimento primers ≤ 20 nt é igual a Tm mais baixa dado pela ferramenta web. Para iniciadores> 20 nt, utilizar uma temperatura de recozimento de 3 ° C mais elevada do que a Tm mais baixa dado pela ferramenta web.
| Componentes | Reacção de 20 uL | Conc final. |
| H 2 O | adicionar 20 ul | |
| 2x Phire tecido animal PCR buffer | 10 ul | 1x |
| Um iniciador | X ul | 0,5 uM |
| iniciador B | X ul | 0,5 uM |
| Phire Hot Start DNA Polimerase II | 0,4 ul | |
| Amostra / diluição protocolo | 1 ul |
Tabela 3. Condições de reacção para tecidos animais PCR utilizada neste protocolo.
| Passo ciclo | Temp. | Tempo | Ciclos |
| Desnaturação inicial | 98 ° C | 5 min | 1 |
| Desnaturação Recozimento * Extensão | 98 ° C X ° C 72 ° C | 5 seg 5 seg 20 seg ≤ 1 kb 20 seg / kb> 1 kb | 40 |
| Extensão final | 72 ° C 4 ° C | 1 min Segurar | 1 |
Tabela 4. Condições do ciclismo para tecidos animais PCR utilizados neste protocolo.
* O calculador de Tm em www.thermoscientific.com / pcrwebtools é recomendado para a determinação da Tm para primers para ser usado com Phire Hot DNA Polymerase Iniciar II. A temperatura recomendada para recozimento primers ≤ 20 nt é igual ao Tm mais baixa dado pela ferramenta web. Para iniciadores> 20 nt, utilizar uma temperatura de recozimento de 3 ° C mais elevada do que a mais baixa Tm determinada pela ferramenta web.
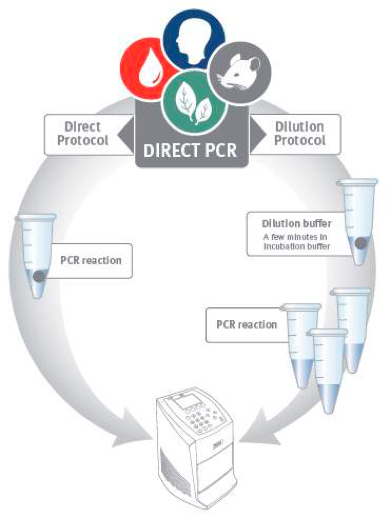
Figura 1. PCR directo do fluxo de trabalho. Directo de PCR pode ser realizada utilizando dois protocolos alternativos. No protocolo direto uma pequena quantidade de amostra é adicionado diretamente ao PCR reacção. O protocolo de diluição emprega um passo de pré-incubação breve, antes da PCR para libertar o DNA do material da amostra.
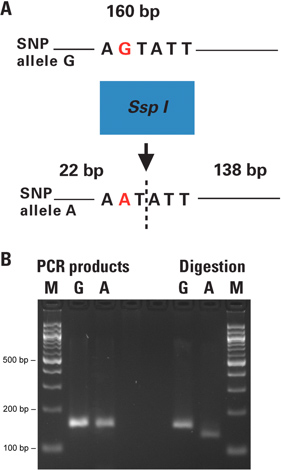
Figura 2. A genotipagem de indivíduos de plantas de Arabidopsis com dCAPS técnica directamente a partir de punções de folha. A) A figura 2A mostra o princípio do ensaio dCAPS realizada. O sítio de restrição dentro do SNP de interesse é introduzido ou removido ou por PCR utilizando um iniciador com uma ou mais diferenças para o DNA-alvo. Os produtos de PCR são digeridos, e os fragmentos resultantes revelar o genótipo de cada indivíduo, quando analisado por electroforese. B) 0,50 milímetros punções de folhas das plantas foram colocadas directamente em 50 ul de reacções de PCR. Os 160 pb a produtos de PCR contendo o local SNP (G ou alelo A) foram amplificadas com iniciadores a introdução de um sítio único SspI para o alelo. Os produtos de PCR foram não purificados digestãoted com a enzima de restrição Sspl. Fragmentos resultantes foram analisados num gel de agarose a 3%. Pista M é o marcador de tamanho; pistas A e G correspondem aos alelos do SNP de cada amostra. Os resultados obtidos foram confirmadas por análise convencional de extracção de ADN, seguido por PCR e digestão de restrição (dados não mostrados). As reacções de controlo negativo sem ADN molde foram incluídos no conjunto de ensaio, e corrido num gel de agarose separado em paralelo com as reacções de PCR actuais antes de realizar as digestões (dados não mostrados).
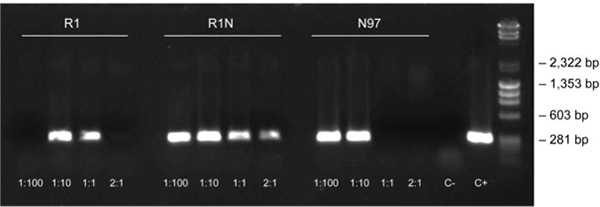
Figura 3. Protocolo de diluição utilizando-se amostras de folhas de carvalho. O protocolo de diluição foi usado para amplificar o fragmento de 297 pb de DNA cloroplástico em amostras de folhas de carvalho (3-passo do protocolo, hibridação a 62 ° C) em diluições diferentes (1:100, 1:10, 1 : 1 e 2:1) e con positivo e negativotrols [C +: controlo positivo de DNA purificada (Arabidopsis), C-: controlo negativo sem ADN]. A nomenclatura amostra representa o local de coleta da amostra (cidades na Finlândia) e da amostra de numeração.

Figura 4. A genotipagem de ratinhos transgénicos com um par de iniciadores, utilizando o protocolo de diluição. Tecidos da orelha dos nove ratinhos individuais (pistas 1-9) foram colocados em 20 ul de tampão de diluição incluindo Aditivo DNARelease. Após as incubações à temperatura ambiente e 98 ° C, 1 ml de sobrenadante foi utilizado como molde na reacção de PCR 20 ul. Tamanhos de fragmentos: 1500 bp (transgênicos) e 200 pb (tipo selvagem).

Figura 5. As amostras preparadas de acordo com o protocolo de diluição são estáveis durante o armazenamento a longo prazo. Amostras de tecidos da orelha de rato foram inc ubated em 20 ul de tampão de diluição incluindo Aditivo DNARelease e submetidos a congelamento repetido / descongelamento (pista 1), armazenado a -20 ° C durante um ano (pista 2), ou utilizada imediatamente para PCR (pista 3). Os tamanhos dos fragmentos amplificados foram de 900 pb, 1500 pb e 3200 pb.
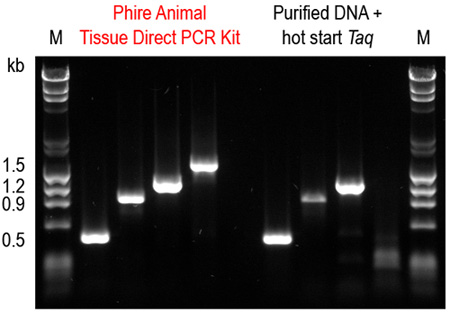
Figura 6. Phire tecido animal directa PCR Kit supera um sistema de purificação de ADN comercial combinado com um hot start Taq DNA polimerase. Quatro amplicons (0,5-1,5 kb) foram amplificados a partir de tecidos de rato da orelha utilizando o protocolo de diluição do Tissue Phire directa animal Kit PCR. Para efeitos de comparação, o ADN foi primeiro purificado utilizando um kit comercial de extracção de ADN e os mesmos fragmentos foram amplificados utilizando um hot start Taq ADN polimerase de acordo com as recomendações dos fabricantes. Apenas com o Animal Tissue Phire directa PCR Kit foram todos os quatro fragmentos amplificados com sucesso amplificados.
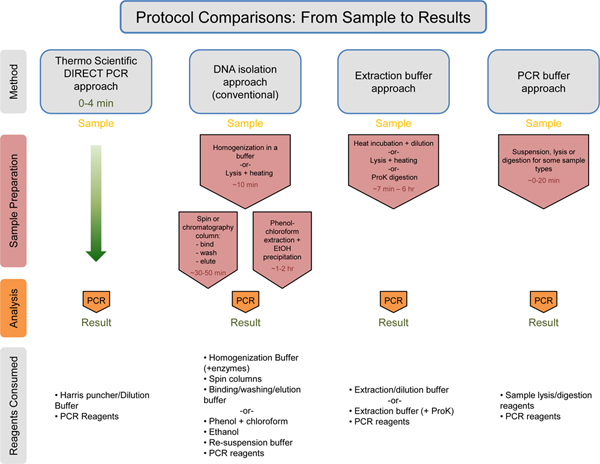
Figura 7. Universal comparação do fluxo de trabalho com a estimativa dos tempos / reagentes consumidos. Thermo Scientific directa abordagem de PCR é comparada com a abordagem de isolamento de ADN, a abordagem de tampão de extracção, e a abordagem de tampão PCR. O tempo previsto para cada abordagem, antes da etapa de PCR é listada em texto vermelho. A Thermo Scientific direto abordagem PCR leva apenas 0-4 minutos para a preparação da amostra antes da PCR. Abaixo de cada método, os reagentes consumidos são listados. A Thermo Scientific direto abordagem PCR usa a menor quantidade de reagentes em comparação com os outros métodos. Clique aqui para ver maior figura .
Discussão
A abordagem de PCR directo demonstrado aqui permite a amplificação por PCR directamente a partir de pequenas quantidades de amostras não purificadas, reduzindo o tempo necessário e simplificar o fluxo de trabalho para a planta e genotipagem do animal (Figura 7). Demonstraram também aqui é o uso do protocolo de diluição em combinação com a metodologia de PCR directo (Figura 3). O protocolo de diluição é recomendado com amostras difíceis (por exemplo, folhas de plantas idade, espécies de plantas que contêm compostos interferir) ou com comprimento (ou GC-rico) amplicons. Este protocolo é particularmente útil quando se inicia um novo experimento de PCR direto, permitindo a otimização da reação. O protocolo pode servir como uma ferramenta para resolver as dificuldades ocasionais, tais como rendimentos de produto são reduzidas devido a diferenças no material de tecido e / ou de iniciadores utilizados. Além disso, durante a execução de reacções múltiplas da mesma amostra, a utilização do protocolo de diluição assegura a totalidade da amostra não é consumida numareacção.
A fim de purificar DNA a partir de plantas para a PCR, a convenção foi realizar a lise das células, seguido por isolamento do ADN, utilizando vários componentes que podem potencialmente interferir com a análise de PCR 8. Para plantas particularmente difícil, com elevado teor de compostos fenólicos, a adição de polivinilpirrolidona foi tradicionalmente usado para remover os compostos que se ligam ao DNA após a lise das células de 2,5. Como evidente, estas complicadas, demoradas etapas pode ser evitado através da utilização da planta Phire directa PCR Kit para detectar o DNA-alvo. A lise celular e passos de isolamento de DNA pode ser omitido utilizando as técnicas dCAPS sensíveis directamente a partir de folhas de plantas de Arabidopsis (Figura 2). Como demonstrado aqui, o protocolo de diluição gere eficazmente a presença de componentes problemáticos que podem interferir com a PCR (figura 3).
Tradicionalmente, um pré-requisito para genotipagem de animais foi isolation de DNA genómico a partir de tecido animal por meio de um tóxico, processo que consome tempo de incubação caracteriza-se por uma longa com proteinase K para digerir a pele e tecido conjuntivo, seguido por extracção com solvente orgânico, a precipitação de álcool, e os passos de centrifugação 6,9,10. Tal como demonstrado aqui, a simplificação deste processo é conseguido através do uso do Animal Tissue Phire directa PCR Kit, permitindo que ratinhos transgénicos para ser genotipados sem purificação prévia de ADN (Figura 4). O exemplo demonstrado neste artigo é particularmente difícil uma vez que apenas um conjunto de iniciadores foi utilizado para a amplificação de dois fragmentos com um tamanho grande diferença. Apesar de dificuldade inata do protocolo, o uso da metodologia de PCR directo em conjunto com o protocolo de diluição simples resultou em rendimentos elevados dos dois produtos de PCR (Figura 4).
PCR baseado em detecção de DNA-alvo tem muitas aplicações na pesquisa, incluindo a análise para identificar o genótipoo papel dos genes na fisiologia, desenvolvimento e doença. Devido à tolerância inibidor das ADN-polimerases especializadas, os protocolos podem ser concluídas em um tempo mínimo de ADN sem purificação prévia.
Divulgações
Produção e livre acesso a este artigo é patrocinado pela Thermo Fisher Scientific, Inc.
Agradecimentos
Para as amostras de Arabidopsis e os primers de PCR interessados agradecemos o professor Jaakko Kangasjärvi e seu grupo, O Grupo de estresse da planta, Biologia Vegetal, Departamento de Biociências, Universidade de Helsinque. Os experimentos com o método tradicional foram realizadas pela Sra. Airi Lamminmäki.
Amostras de camundongos transgênicos foram fornecidos pelo Dr. Jaana Vesterinen, Instituto de Biomedicina / Bioquímica, da Universidade de Helsinki.
Harris Uni-Core e Harris esteira de corte são marcas comerciais da Shunderson Communications Inc. Todas as outras marcas são de propriedade de Thermo Fisher Scientific Inc. e suas subsidiárias.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Phire Planta directa PCR Kit | Thermo Fisher Scientific | F-130 | 200 reacções (50 uL cada uma) |
| Phire tecido animal direto PCR Kit | Thermo Fisher Scientific | F-140 | 200 reations (50 ul cada) |
| Harris Uni-Core 0,35 mm (rosa) | Thermo Fisher Scientific | F-180S / L | Qtd: 5/25 |
| Harris Uni-Core 0,50 milímetros (azul) | Thermo Fisher Scientific | F-185S / L | Qtd: 5/25 |
| Harris corte Mat 6,4 × 7,6 centímetros | Thermo Fisher Scientific | F-190 | Qty: 5 |
| SspI | Thermo Fisher Scientific | ER0771 | 100 ul (100 reacções) |
| Cycler Piko 24-Bem térmica | Thermo Fisher Scientific | TCP0024 | |
| 24 Bem Piko Placas PCR | Thermo Fisher Scientific | SLP0241 | |
| GeneJET PCR Purification Kit | Thermo Fisher Scientific | K0701 K0702 | 50 preps 250 preps |
Referências
- Doyle, J. J., Doyle, J. L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin. 19, 11-15 (1987).
- Kim, C. S., Lee, C. H., Shin, J. S., Chung, Y. S., Hyung, N. I. A simple and rapid method for isolation of high quality genomic DNA from fruit trees and conifers using PVP. Nucleic Acids Research. 25, 1085-1086 (1997).
- Neff, M. M., Neff, J. D., Chory, J., Pepper, A. E. dCAPS, a simple technique for the genetic analysis of single nucleotide polymorphisms: experimental applications in Arabidopsis thaliana genetics. The Plant Journal. 14, 387-392 (1998).
- Michaels, S. D., Amasino, R. M. A robust method for detecting single-nucleotide changes as polymorphic markers by PCR. The Plant Journal. 14, 381-385 (1998).
- John, M. E. An efficient method for isolation of RNA and DNA from plants containing polyphenolics. Nucleic Acids Research. 20, 2381-23 (1992).
- Wang, Z., Storm, D. R. Extraction of DNA from mouse tails. BioTechniques. 41, 410-412 (2006).
- Malumbres, M., Mangues, R., Ferrer, N., Lu, S., Pellicer, A. Isolation of High Molecular Weight DNA for Reliable Genotyping of Mice. BioTechniques. 22, 1114-1119 (1997).
- Yang, Y., Kim, J. Y., Soh, M. S., Kim, D. S. A simple and rapid gene amplification from Arabidopsis Leaves Using AnyDirect system. Journal of Biochemistry and Molecular Biology. 40, 444-447 (2007).
- Sambrook, J., Fritsch, E., Maniatis, T. . Molecular Cloning: A Laboratory. , (1989).
- Meldgaard, M., Bollen, P. J. A., Finsen, B. Non-invasive method for sampling and extraction of mouse DNA for PCR. Laboratory Animals. 3, 413-441 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados