Method Article
Um Ensaio Bioluminescência Cálcio de análise funcional do Mosquito ( Aedes aegypti) E Tick ( Rhipicephalus microplus) G receptores acoplados à proteína
Neste Artigo
Resumo
Este protocolo fornece instruções para clonal de células de seleção de linha e um ensaio de bioluminescência de cálcio para analisar as relações estrutura-atividade de síntese neuropeptídeos de artrópodes em seus cognatos GPCRs. Este ensaio pode ser usado para deorphanization receptor e estudos de relação estrutura-atividade para o projeto análogo sintético e peptídeo / drogas lead-descoberta.
Resumo
Receptores hormonais artrópodes são alvos potenciais para pesticidas romance como eles regulam muitos processos essenciais fisiológicas e comportamentais. A maioria deles pertence à superfamília dos G receptores acoplados à proteína (GPCRs). Nós nos concentramos na caracterização de artrópodes receptores de cininas do carrapato e do mosquito. Cininas artrópodes são neuropeptídeos multifuncional com myotropic, diurético, ea função dos neurotransmissores. Aqui, um método para análises sistemáticas de relações estrutura-actividade de cininas insetos em dois heteróloga cinina receptor-expressando sistemas é descrito. Nós fornecemos informações importantes para o desenvolvimento de análogos biostable cinina com o potencial de interromper o diurético, myotropic, e / ou os processos digestivos em carrapatos e mosquitos.
Os receptores de cininas do carrapato bovino do sul, Boophilus microplus (Canestrini), e do mosquito Aedes aegypti (Linnaeus), foram expressos de forma estável na linha de células de mamíferos CHO-K1. Análise funcional desses receptores foram concluídas usando um ensaio de cálcio placa bioluminescência que mede a bioluminescência para determinar os níveis intracelulares de cálcio citoplasmático a pedido peptídeo a essas células recombinantes. Este método tira vantagem da proteína aequorin, um fotoproteína isolado luminescentes água-viva. Nós transitoriamente transfectadas o aequorin plasmídeo (mtAEQ/pcDNA1) em linhagens de células que expressa de maneira estável os receptores de cininas. Essas células foram então tratadas com o celenterazina cofactor, que complexos com aequorin intracelular. Este vínculo quebra na presença de cálcio, emitindo níveis de luminescência indicativo da concentração de cálcio. Como o receptor de cininas sinais através da liberação de cálcio intracelular, a intensidade do sinal está relacionado com a potência do peptídeo.
Este protocolo é uma síntese de vários protocolos descritos anteriormente, com modificações, que apresenta passo-a-passo para a expressão estável de GPCRs em uma linha de células de mamíferos através de ensaios placa funcional (Staubly et al, 2002 e Stables et al, 1997.. ). Usando esta metodologia, nós fomos capazes de estabelecer linhas de células estáveis expressando o mosquito e os receptores de cininas carrapato, compare a potência de três cininas mosquito, identificar crítica posições de aminoácidos para a interação ligante-receptor, e executar semi-throughput screening de um peptídeo biblioteca. Porque cininas insetos são suscetíveis à degradação enzimática rápida por peptidases endógenas, eles são severamente limitados em uso como ferramentas para controle de pragas ou estudos endocrinológicos. Portanto, nós também testou análogos cinina contendo ácido isobutírico amino (AIB) para aumentar a sua potência e Biostability. Este analógico peptidase-resistentes representa uma vantagem importante no desenvolvimento de análogos biostable cinina de insetos e pode ajudar no desenvolvimento de neuropeptídeo baseado estratégias de controle de artrópodes.
Protocolo
1. Estabelecimento de linhagens celulares estáveis
- Clone o seu GPCR de interesse e inseri-lo em um vetor de expressão que incorpora a 5 'seqüência de consenso Kozak (AGAC / GCCATGG) em torno do códon de iniciação para a ligação ribossomal ideal em um sistema de mamíferos (Kozak, 1986). Aqui usamos o pcDNA3.1/Bm-KR plasmídeo para o receptor de cinina carrapato, eo pcDNA3.1/Aedae-KR plasmídeo para o receptor de cinina mosquito (Holmes et al, 2003;. Pietrantonio et al, 2005).. O pcDNA3.1 (-) vetor codifica resistência à ampicilina para seleção de bactérias e resistência a neomicina (G418) para seleção em células de mamíferos.
- Crescer CHO-K1 células vazias (sem plasmídeos) (ATCC, Manassas, VA, EUA) ou linha de outra célula desejada em um frasco de T-25 (BD Falcon) a 37 ° C em 5% incubadora de CO 2 umidificado (Holmes et al ., 2003). Todas as incubações devem ser feitos sob estas condições, a menos que especificado em contrário. Manter as células vazias no meio de crescimento (F12K média com 10% de soro fetal bovino) com 1X antibióticos antimicótica (Invitrogen, CA).
- Para dividir células, aquecer todas as soluções a 37 ° C. Remova o meio de idade no frasco T-25 e enxágüe com 5 ml de PBS e remova PBS. Para trypsinize células, adicionar 2 ml PBS-Tripsina-EDTA (34 ml PBS, 2 ml de bicarbonato de sódio 7,5%, 4 ml 10X de tripsina-EDTA) por 2 min. Adicionar 3 ml de meio e aspirado médio cima e para baixo para misturar células. Transferência média com células em um tubo cônico e centrifugar por 2 min a ~ 200-300 g (1.000 rpm). Elimine o sobrenadante e ressuspender as células em 5 ml de meio. Diluir as células ressuspendidas a uma concentração de 1:5 ou 1:10 com meio fresco e transferir 5 ml em um frasco de T-25 novo.
- Depois que as células estão crescendo de forma saudável (cerca de 2-3 dias), a semente da células CHO-K1 em T-25 frascos de cultura de tecidos e cultivá-las durante a noite em meio de crescimento sem antibióticos até que sejam confluentes cerca de 30% (aproximadamente 18 horas). O grau de confluência pode ser determinada por células observação sob microscopia fluorescente invertido.
- Prepare as misturas a seguir para cada amostra:
- Combine 1-2 mg DNA (exemplo: uso de 4μl 265μg/μl pcDNA3.1/Aedae-KR) com 100 ul Opti-MEM eu Redução Médio de soro (Invitrogen).
- Mix 6 Reagente Lipofectin mL (InvitrogenTM) em 100 ml de soro médio F12K livre, fazendo uma proporção de 1:1 de Lipofectin de DNA. Incubar à temperatura ambiente por 30-45 min.
- Remova o meio de crescimento das células velhas e lavar as células com 5 ml de soro médio F12K livre e, em seguida, remover o F12K meio isento de soro. Em um tubo de 15 ml, misture delicadamente a mistura de transfecção em 1,8 ml de meio fresco F12K de forma gota a gota. Depois, lavou as células a partir do passo 1.5 com PBS e adicione esta solução de transfecção nova para as células. Incubar por 18 horas.
- Mudança a médio e F12K médio mais 10% de soro fetal bovino sem antibióticos e incubar durante a noite. Dividir as células em duas T-25 frascos com F12K média mais 10% de soro fetal bovino sem antibióticos por mais 18 horas (para divisão de células por favor, veja o passo 1.3).
- Substituir o meio com meio seletivo (F12K média mais 10% de soro fetal bovino com 800μg/ml GENETICIN, Invitrogen). Cultura as células usando o meio seletivo para 3-4 semanas. Com o tempo isso vai selecionar para células que têm incorporados de forma estável o plasmídeo em seu DNA genômico. Continue mantendo as células usando meio de manutenção (F12K média mais 10% de soro fetal bovino com 400μg/ml GENETICIN). Periodicamente congelar linhas celulares com relação 1:1 dos meios de comunicação de congelamento (meio seletivo com DMSO 20%) para evitar perde em caso de contaminação inesperado.
- Seleção de linhagens de células clonais: como um primeiro passo, trypsinize e centrifugar as células a partir da etapa com 1,8 meio de manutenção como no passo 1.3. Re-suspender as células em meio de manutenção 5 ml, tomar 0,5 ml da célula suspender e adicionar 4,5 ml de meio de manutenção fresco para obter uma diluição de 10x. Transferir a diluição 10x em 12 poços de uma placa de 96 poços, acrescentando 100 ml a cada poço selecionar para células individuais.
- Continuar a fazer 10x diluições em série destas células para uma suspensão teórico final de uma célula por 100 l (normalmente a diluição final será na faixa de 10 -11 a 10 -19; o número total de 10x diluições em série é ~ 19) . Imediatamente após cada diluição, transferir 100 ml da diluição em 12 poços da placa de 96 poços. Após 18 horas de incubação, observar 96 placas bem sob uma luz invertida ou poços de fluorescência microscópio e marca que parece conter apenas uma única célula ou células que contêm dois obviamente dividido de uma única célula. Mantenha observando todos os dias e meio mudam a cada três dias.
- Quando os poços são conflu 80%diferentes (cerca de uma semana), lavar os poços marcados com 200 mL PBS e trypsinize-los com 100 ul de PBS-tripsina-EDTA solução. Transferência de células de cada um marcado bem em um poço de uma placa 6-bem com um meio de manutenção ml. Cultivar essas células para três dias depois transferir células em frasco T25 individual. Testar essas células utilizando o ensaio de bioluminescência de cálcio com peptídeos agonistas (ver secção 2).
- Selecione uma linha de células a partir do passo 1,11 com a maior resposta no ensaio placa de cálcio bioluminescência e realizar pela segunda vez a única célula fases de selecção seguintes 1,9-1,11. Periodicamente congelar as linhagens celulares.
- Da seleção secundário descrito no passo 1.12, escolher 2-3 linhagens de células com maior resposta no ensaio placa de cálcio bioluminescência e mantê-las em cultura por mais de cálcio ensaios placa de bioluminescência. Acompanhe os números passagem. De tempos em tempos, congelar linhas celulares de passagens cedo de modo que você pode sempre voltar a eles se as linhas de células com passagens mais parar de executar de forma consistente.
2. O cálcio ensaio de placa bioluminescência
- Ligadura do gene repórter de interesse em um vetor de expressão. Aqui usamos aequorin mtAEQ/pcDNA1 plasmídeo (um presente de drs. CJP Grimmelikhuijzen Williamson e Michael, University of Copenhagen, Dinamarca). Transformar o plasmídeo em E. coli MC1061/PS células (Invitrogen) e purificá-los através de um spin-QIAprep miniprep kit (Qiagen Inc.). Na etapa final eluir o plasmídeo com tampão Tris sem EDTA, e não água.
- Crescer linhas celulares a partir do passo 1,13 expressando o receptor desejado no meio de manutenção. Quando as células são 90% confluentes, trypsinize, centrífuga e então re-suspender as células em 5 ml meio de manutenção como no passo 1.3. Diluir células (cerca de 10x com meio de manutenção) e contagem do número de células com células contra (Bright-Line hemocitômetro) sob microscopia. Ajustar o número de células de aproximadamente 2 x 10 5 células / ml (média de 20 células em um dos 9 quadrados mostrou no hemocitômetro). Células de semente 2 ml diluído em media em cada poço de uma placa de seis também. Incubar por 24 horas (as células devem atingir cerca de 60% após a confluência de incubação).
- Mudança de mídia na placa de poços de 6 a OPTI-MEM médio. Para cada bem, misture 96 mL OPTI-MEM com 4 mL de reagente Transfection FuGENE 6 (Bioquímicos Roche) em um tubo de microcentrífuga e deixe descansar em temperatura ambiente por 5 min. Adicionar 1 mg de aequorin / pcDNA um plasmídeo de DNA para cada tubo e, em seguida, agite a amostra por 1 min, incubar em temperatura ambiente por 15-20 minutos. Adicione cada mistura em cada poço de uma forma gota a gota enquanto agitando o prato também. Incubar as placas durante 6 horas e mudar a médio e F12K meio contendo 10% de soro fetal bovino sem antibiótico.
- Após incubar as células em seis placa assim por 24 horas, trypsinize, centrífuga e re-suspender as células como no passo 1.3. Conte o número de células de 400.000 células / ml como passo 2.1 e transferência de 100 l (40.000 mL cells/100 total) em cada poço de um 96-bem fina placa de fundo branco de microtitulação (Costar 3610). Incubar por mais 24 horas até cerca de 80% confluência celular. Esta é a melhor concentração de células para o ensaio de bioluminescência.
- Prepare 90μl/well de um livre de cálcio media DMEM (Invitrogen) contendo 5 mM celenterazina (Invitrogen) no escuro (celenterazina é sensível à luz). Pegue a placa de 2,4, remover a velha mídia e adicione este 90μl em cada poço. Incubar as placas por 3 horas no escuro a 37 ° C e 5% CO 2, após o qual as células do prato está pronto para ser testado.
3. Operação do instrumento e análise de dados
- Cada leitor de placas bioluminescência é diferente. Realizamos o nosso ensaio utilizando um leitor de placas Novostar (Labtechnologies BMG) no modo bioluminensence. Se você usa um instrumento diferente, você deve se adaptar ao protocolo.
- Purgar as bombas leitor de placas (ou BOMBAS PRIME) antes de usar. Desligue a luz no quarto antes de colocar a placa no suporte da placa. Uma vez que o suporte da placa foi fechada, acender as luzes.
- Solubilizar peptídeos (em um tubo Eppendorf de 1,5 ml) na mídia sem cálcio DMEM. Definir a "profundidade Aspirar" e "Determinação de posição" da solução de peptídeo antes de usar. Desafio as células com 10 ml (10x), com diferentes concentrações de peptídeos (FFFSWG-NH2, Aedes-K1-3, ou peptídeo desejado outros) e imediatamente começar a gravar a emissão de luz. Criámos o instrumento para registrar a emissão de luz (465 nm) para cada poço a cada 2 segundos para um tempo total de 50 segundos.
- Certifique-se incluir um controlo positivo, como um análogo ativo (analógico FFFSWGa tem sido utilizado, Taneja-Bageshwar et al., 2009) e um controle negativo, como as células transfectadas único vetor. O controle negativo será necessário na análise dos dados para definir o limiar de referência (ver resultados representativos).Um peptídeo, sem relação inativos também pode ser adicionado como um controle negativo.
- Após a corrida terminar, lave a bomba de instrumento (ou BOMBAS PRIME) em seguida, coloque a sua amostra peptídeo seguinte. Salvar seus dados e lavar as bombas novamente.
- Manipulação de dados: transferência dos dados de emissão de luz de cada poço em uma folha de dados do Microsoft Excel.
- Colar os dados do Excel para o software 4.0 do Prisma GraphPad Software Inc. (San Diego, CA, EUA). As concentrações de peptídeo vários é o eixo X e unidades de bioluminescência é o eixo Y. Para normalizar os dados, traçar uma curva log-resposta. Selecione um não-lineares de regressão análise do ajuste da curva (equação sigmoidal dose-resposta com inclinação variável) para obter curvas concentração-resposta para cada peptídeo. O programa plota os valores no final e dá a EC 50.
- Cada experimento deve ser repetido três vezes para análise de dados.
4. Resultados representativos:
Quando expressa em células CHO-K1, o mosquito Aedes aegypti receptor de cininas comportou-se como um receptor multiligand e funcionalmente respondeu a concentrações tão baixas como 1 nM dos três endogenours Aedes cininas, Aedae cininas 1-3, testados individualmente usando o ensaio de cálcio placa bioluminescência . A Figura 1 mostra que a ordem de classificação de potência obtido foi Aedae-K-3> Aedae-K-2> Aedae-K-1, com base nos respectivos valores de CE 50 de 3-Aedae-K, 16,04 nM; Aedae-K- 2, 26,6 nM e Aedae-K-1, 48,85 nM, que foram estatisticamente diferentes (P <0,05) (Pietrantonio et al., 2005).
Nós também usamos este teste para determinar quais os resíduos de cininas são fundamentais para a interação peptídeo-receptor de cininas. Peptídeos inseto cinina compartilhar uma pentapeptide C-terminal que representa a seqüência mínima exigida para a atividade biológica, também conhecido como core. Na Tabela 1, os análogos núcleo cinina peptídeo foram sintetizados como uma série de substituição da alanina cinina núcleo pentapeptide FFSWGa e testados por um ensaio de placa de cálcio bioluminescência (Taneja-Bageshwar et al., 2006). Descobrimos que os aminoácidos Phe 1 e Trp 4 foram essenciais para a atividade do cininas inseto para ambos os receptores.
O ensaio também pode ser usado para testar peptídeos projetado para Biostability reforçada. A Tabela 2 mostra os análogos projetados cinina contendo ácido isobutírico amino (AIB) sobre o carrapato testado receptor recombinante cininas e Figura 2 mostra a comparação da atividade de seis alfa-amino ácido isobutírico análogos no receptor de cininas carrapato expressar CHO-K1 linha celular por um de cálcio ensaio de bioluminescência placa (Taneja-Bageshwar et al., 2009). O hexapeptide analógico FFFSWGa é adicionada para um controle positivo para a atividade do receptor. O analógico FF [Aib] WGA resultou mais ativo do que este controle analógico hexapeptide. O analógico com duas substituições de ácido aminoisobutyric, [Aib] FF [Aib] WGA, foi o mais potente dos análogos substituição dupla testados (Tabela 2 e Figura 2).
Para mais exemplos de como este ensaio tem sido e pode ser aplicado ver Nachman e Pietantonio (2010), Nachman et al. (2009), Taneja-Bageshwar et al. (2008a), e Taneja-Bageshwar et al. (2008b).
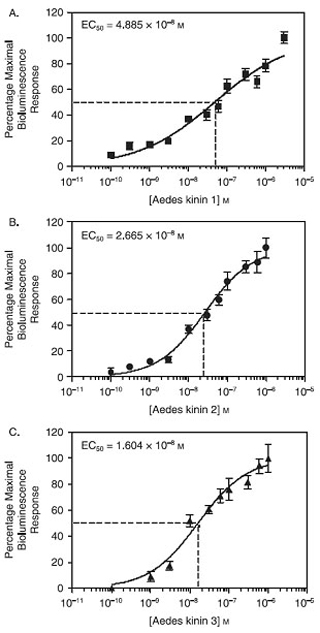
Figura 1. Estimativa do Aedes cininas concentração efetiva (EC 50) em células CHO-K1 E10 por um ensaio de placa de cálcio bioluminescência. O eixo y das curvas de concentração-resposta foi obtido a partir de unidades de bioluminescência, expressa em percentagem da resposta máxima observada para cada peptídeo. Pontos de dados representam a média de seis repetições obtidas durante três experimentos independentes. Barras representam o erro padrão. (A) Estimativa da Aedae-K1 EC 50 = 48 nM. (B) Estimativa da Aedae-K2 EC 50 = 26 nM. (C) Estimativa da Aedae-K3 EC 50 = 16 nM. EC 50 Aedae-K3 50 Aedae-K2 50 Aedae-K1; P <0,05. Análise estatística e gráficos foram com o software GraphPad Prism 4.0.
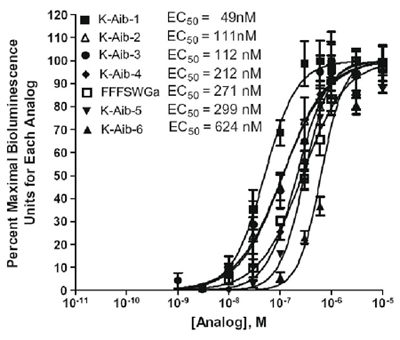
Figura 2. Comparação da atividade de seis alfa-amino ácido isobutírico análogos no receptor de cininas carrapato expressar CHO-K1 linha celular por um ensaio de placa de cálcio bioluminescência. O eixo y representa unidades por cento máxima bioluminescência para cada analógico, expresso em percentagem de bioluminescência observada na concentração versus a resposta máxima observada entre todas as concentrações testadas para cada analógico. Análise estatística e gráficos foram realizados com o software GraphPad Prism 4.0.
| Tick linha celular receptor | Mosquito linha celular receptor | |||
| Peptídeos | EC 50 (nM) | Bioluminescência resposta máxima em 1 mM | EC 50 (nM) | Bioluminescência resposta máxima em 1 mM |
| AFSWGa | Eu | Eu | Eu | Eu |
| FASWGa | 586 | 5600 | ND | 400 |
| FFAWGa | 64 | 12800 | 621 | 3050 |
| FFSAGa | Eu | Eu | Eu | Eu |
| FFSWAa | 417 | 10600 | 2800 | 1830 |
| FFSWGa | 590 | 10800 | ND | 525 |
| FSWGa | Eu | Eu | Eu | Eu |
| FFSWa | Eu | Eu | Eu | Eu |
| FFSWG-OH | Eu | Eu | Eu | Eu |
| FFFSWGa | 259 | 13000 | 562 | 10000 |
| FF [Aib] WGA | 29 | 12700 | 445 | 9300 |
Tabela 1. Potências estimado (EC 50) ea resposta bioluminescência máxima de todos os peptídeos testado em escala e receptor mosquito linhagens de células transfectadas *.
* A EC 50 estimativas da concentração necessária para induzir uma resposta meia-máxima. I: Inactive, se a resposta bioluminescência é inferior a 300 unidades (nível de vetor somente células transfectadas). R: A posição onde o resíduo na respectiva FFSWGa peptídeo foi substituído por alanina. ND: O analógico foi testado, mas era ou não muito ativo ou não ativo em molarities inferior, portanto, uma EC50 não pôde ser determinado.
| K-Aib-1 | [Aib] FF [Aib] WGA |
| K-Aib-2 | [Α MEF] FF [Aib] WGA |
| K-Aib-3 | Ac-R [Aib] FF [Aib] WGA |
| K-Aib-4 | Ac-R [β3F] FF [Aib] WGA |
| K-Aib-5 | [Aib] RFF [Aib] WGA |
| K-Aib-6 | [Aib-Aib-Aib-Aib] RFF [Aib] WGA |
Tabela 2. Cinina análogos (K) contendo ácido isobutírico amino (AIB) sobre o carrapato testado receptor recombinante cininas. Ac: acetil; α Me: α metil-fenilalanina; β3F: β3-fenilalanina, um: amida.
Discussão
Fomos capazes de realizar a caracterização funcional do receptor de neuropeptídeo descoberto pela primeira vez desde o Arachnida (carrapatos, ácaros e aranhas), o receptor de cininas carrapato, usando esse protocolo. Este método tem três aplicações principais. Primeiro, a técnica pode ser aplicada para deorphanization receptor através de medições de atividade ligante. Segundo, o ensaio pode resolver ligante-receptor relações estrutura-actividade (SAR). Em terceiro lugar, os métodos podem ser usados na descoberta de medicamentos. Além disso, este protocolo pode ser usado para estudar a atividade de agonistas ou antagonistas em quase qualquer GPCR. Estamos começando a adaptar este protocolo para triagem de pequenas bibliotecas. A linhagem celular utilizamos não expressam a proteína G onipresente G 16. Nós não precisamos, porque os receptores de cininas artrópodes sinal através da proteína Gq e da cascata de cálcio intracelular e conservar este propriedades de sinalização em células de mamíferos, como mostrado aqui.
Divulgações
Agradecimentos
Drs. CJP Grimmelikhuijzen e Michael Williamson da Universidade de Copenhague (Dinamarca), são apreciados por fornecer a aequorin plasmídeo. Nosso colaborador, o Dr. Ronald J. Nachman da ARS-USDA (TX, EUA), é reconhecido para a síntese peptídica e para fornecer o leitor de placas Novostar.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| DMEM | Invitrogen | ABCD1234 | |
| Células CHO-K1 | ATCC | CCL-61 | Manassas, VA, EUA |
| F12K médio | Invitrogen | 21127 | |
| Soro fetal bovino | Sigma-Aldrich | F0643 | |
| Tripsina-EDTA (10x) | Invitrogen | 15400 | |
| Antibiótico antimicótico | Invitrogen | 15240 | |
| Opti-MEM eu Redução Médio Serum | Invitrogen | 31985 | |
| Reagente Lipofectin | Invitrogen | 18292-011 | |
| GENETICIN | Invitrogen | 10131035 | |
| MC1061/P3 Ultracomp | Invitrogen | C663-03 | |
| QIAprep rodada miniprep kit | Qiagen Inc. | 19064 | |
| FuGENE reagente Transfection 6 | Roche | 11 814 443 001 | |
| De 96 poços da placa microtitere branca fina fundo | Costar | 3610 | |
| sem cálcio DMEM media | Invitrogen | 21068 | |
| Celenterazina | Invitrogen | C-2944 | |
| Brilhante-Line hemacitómetro | Hausser Scientific | Horsham, PA | |
| Novostar | Labtechnologies BMG | ||
| Prism software 4.0 | GraphPad Software Inc. | San Diego, CA, EUA | |
| T-25 e T-75 Frascos | BD Falcon | 353014 e 353135 |
Referências
- Kozak, M. An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs. Nucleic Acids Research. 15, 8125-8148 (1987).
- Nachman, R., Pietrantonio, P. V. Interaction of mimetic analogs of insect kinin neuropeptides with arthropod receptors. Neuropeptide systems as Targets for Parasite and Pest Control. Geary, T. , Landes Bioscience. Madamme Curie Library. (2010).
- Nachman, R. J., Pietrantonio, P. V., Coast, G. M. Towards the development of novel pest management agents based upon insect kinin neuropeptide analogs. Annals of the New York Academy of Sciences. , 1163-11251 (2009).
- Taneja-Bageshwar, S., Strey, A., Isaac, R. E., Coast, G. M., Zubrzak, P., Pietrantonio, P. V., Nachman, R. J. Biostable agonists that match and/or exceed the activity of insect kinins on recombinant arthropod GPCRs. General and Comparative Endocrinology. 162, 122-128 (2009).
- Taneja-Bageshwar, S., Strey, A., Kaczmarek, K., Zabrocki, J., Pietrantonio, P. V., Nachman, R. J. Comparison of insect kinin analogs with cis-peptide bond, type VI-turn motifs identifies optimal stereochemistry for interaction with a recombinant arthropod kinin receptor from the southern cattle tick Boophilus microplus. Peptides. 29, 295-301 Forthcoming.
- Taneja-Bageshwar, S., Strey, A., Zubrzak, P., Williams, H., Reyes-Rangel, G., Juaristi, E., Pietrantonio, P. V., Nachman, R. J. Identification of selective and non-selective, biostable beta-amino acid agonists of recombinant insect kinin receptors from the southern cattle tick Boophilus microplus and mosquito Aedes aegypti. Peptides. 29, 302-309 Forthcoming.
- Taneja-Bageshwar, S., Strey, A., Zubrzak, P., Pietrantonio, P. V., Nachman, R. J. Comparative structure-activity analysis of insect kinin core analogs on recombinant kinin receptors drom southern cattle tick Boophilus microplus (Acari: Ixodidae) and mosquito Aedes aegypti (Diptera: Culicidae). Archives of Insect Biochemistry and Physiology. 62, 128-140 (2006).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14, 55-67 (2005).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12, 27-38 (2003).
- Staubli, F., Jorgensen, T. J. D., Cazzamali, G., Williamson, M., Lenz, C., Sondergaard, L., Roepstorff, P., Grimmelikhuijzen, C. J. P. Molecular identification of the insect adipokinetic hormone receptors. Proceedings of the National Academy of Sciences USA. 99, 3446-3451 (2002).
- Stables, J., Green, A., Marshall, F., Fraser, N., Knight, E., Sautel, M., Milligan, G., Lee, M., Rees, S. A bioluminescent assay for agonist activity at potentially any G-protein coupled receptor. Analytical Biochemistry. 252, 115-126 (1997).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados