Method Article
Ein Calcium Biolumineszenzassay für die funktionelle Analyse von Mosquito ( Aedes aegypti) Und Tick ( Rhipicephalus microplus) G-Protein gekoppelten Rezeptoren
In diesem Artikel
Zusammenfassung
Dieses Protokoll enthält Anweisungen für die klonale-Zelllinie Auswahl und einem Calcium-Biolumineszenz-Assay, um die Struktur-Aktivitäts-Beziehungen von synthetisierten Arthropoden Neuropeptide auf ihren verwandten GPCRs zu analysieren. Dieser Test kann für die Rezeptor deorphanization und Struktur-Wirkungs-Beziehungen für synthetische Analog-Design-und Peptid-/ Drogen-Lead Discovery verwendet werden.
Zusammenfassung
Arthropoden Hormonrezeptoren sind potentielle Ziele für neue Pestizide, wie sie viele wichtige physiologische und verhaltensbezogene Prozesse regulieren. Die meisten von ihnen gehören zu der Superfamilie der G-Protein-gekoppelte Rezeptoren (GPCRs). Wir haben uns auf die Charakterisierung von Arthropoden Kinin Rezeptoren aus der Zecke und Moskito konzentriert. Arthropoden Kinine sind multifunktionale Neuropeptide mit myotroper, harntreibend und Neurotransmitter-Funktion. Hier wird ein Verfahren zur systematischen Analyse von Struktur-Aktivitäts-Beziehungen von Insekten Kinine auf zwei heterologen Kinin-Rezeptor-exprimierenden Systemen beschrieben. Wir liefern wichtige Informationen, die für die Entwicklung von biostabilen Kinin-Analoga mit dem Potenzial, das Diuretikum, myotroper und / oder Verdauungsprozesse in Zecken und Mücken stören.
Die Kinin Rezeptoren aus dem südlichen Vieh tick, Boophilus microplus (Canestrini), und die Mücke Aedes aegypti (Linnaeus), waren stabil in der Säugetier-Zelllinie CHO-K1 zum Ausdruck gebracht. Funktionelle Analysen dieser Rezeptoren wurden abgeschlossen mit einem Calcium-Biolumineszenz Platten-Assay, dass die intrazelluläre Biolumineszenz Maßnahmen zur zytoplasmatischen Kalziumspiegel auf Peptid-Anwendung, um diese rekombinanten Zellen zu bestimmen. Diese Methode nutzt die Aequorin-Protein, einem Photoprotein von leuchtenden Quallen isoliert. Wir transient transfizierten die Aequorin Plasmid (mtAEQ/pcDNA1) in Zelllinien, die stabil exprimiert die Kinin Rezeptoren. Diese Zellen wurden dann mit dem Cofaktor Coelenterazin, die Komplexe mit intrazellulären Aequorin behandelt. Diese Bindung bricht in Anwesenheit von Calcium, emittierende Lumineszenz Ebenen bezeichnend für die Calcium-Konzentration. Wie der Kinin-Rezeptor-Signale durch die Freisetzung von intrazellulären Calcium ist die Intensität des Signals, um die Wirksamkeit des Peptids verbunden.
Dieses Protokoll ist eine Synthese aus mehreren zuvor beschriebenen Protokolle mit Modifikationen, es zeigt Schritt-für-Schritt-Anleitungen für die stabile Expression von GPCRs in einer Säugetier-Zelllinie durch funktionelle Assays Platte (Staubly et al, 2002 und Stables et al, 1997.. ). Mit dieser Methode können wir stabile Zelllinien, die Mücke und die Zecke Kinin Rezeptoren herzustellen waren, vergleichen Sie die Potenz von drei Moskito Kinine, identifizieren kritische Aminosäure-Positionen für die Ligand-Rezeptor-Interaktion und führen semi-Throughput-Screening von Peptid- Bibliothek. Da Insekten Kinine anfällig für schnelle enzymatische Abbau durch endogene Peptidasen sind, sind sie stark in Verwendung als Werkzeuge für die Schädlingsbekämpfung oder endokrinologischen Studien beschränkt. Deshalb haben wir auch Kinin-Analoga, die Amino Isobuttersäure (Aib), um ihre Potenz und Biostabilität verbessern getestet. Diese Peptidase-resistenter Analog stellt einen wichtigen Vorsprung bei der Entwicklung von biostabilen Insekten Kinin-Analoga und kann bei der Entwicklung von Neuropeptid-basierte Arthropoden Regelstrategien Hilfe.
Protokoll
1. Gründung von stabilen Zelllinien
- Clone Ihrer GPCR von Interesse und legen Sie sie in einen Expressionsvektor mit eingebautem 5 "Kozak-Konsensus-Sequenz (GCCA / GCCATGG) um das Startcodon für optimale ribosomalen Bindungsstellen in einem Säugetier-System (Kozak, 1986). Hier verwenden wir die Plasmid pcDNA3.1/Bm-KR für die Zecke Kinin-Rezeptor, und die Plasmid-pcDNA3.1/Aedae-KR für die Moskito-Kinin-Rezeptor (Holmes et al, 2003;. Pietrantonio et al, 2005.). Die pcDNA3.1 (-)-Vektor kodiert Ampicillinresistenz für die Selektion in Bakterien und Neomycin (G418)-Resistenz zur Selektion in Säugetierzellen.
- Wachsen CHO-K1 leere Zellen (ohne Plasmide) (ATCC, Manassas, VA, USA) oder andere gewünschte Zelllinie in einem T-25-Kolben (BD Falcon) bei 37 ° C in einer 5% CO 2 befeuchteten Inkubator (Holmes et al ., 2003). Alle weiteren Inkubationen sollten unter diesen Bedingungen durchgeführt werden sofern nicht anders angegeben. Pflegen Sie die leeren Zellen in Wachstumsmedium (F12K Medium mit 10% fötalem Rinderserum) mit 1X Antibiotika-Antimykotikum (Invitrogen, CA).
- Um Zellen teilen, aufzuwärmen alle Lösungen auf 37 ° C. Entfernen Sie altes Medium in den T-25 überführt und gründlich mit 5 ml PBS und entfernen Sie dann PBS. Um trypsinize Zellen, 2 ml PBS-Trypsin-EDTA (34 ml PBS, 2 ml 7,5% Natriumbicarbonat, 4 ml 10x Trypsin-EDTA) für 2 min. Add 3 ml Medium und saugen Medium nach oben und unten, um Zellen zu mischen. Transfer-Medium mit Zellen in einem konischen Rohr und zentrifugieren für 2 min bei ~ 200-300 g (1.000 rpm). Überstand verwerfen und wieder auszusetzen Zellen in 5 ml Medium. Verdünnen Sie die resuspendierten Zellen in einer Konzentration von 1:5 oder 1:10 mit frischem Medium und Transfer 5 ml in eine neue T-25 Kolben.
- Nachdem die Zellen gesund wachsen (ca. 2-3 Tage), Samen der CHO-K1-Zellen in T-25 Zellkulturflaschen und wachsen sie über Nacht in Wachstumsmedium ohne Antibiotika, bis sie etwa 30% konfluent (ca. 18 Stunden). Der Grad der Konfluenz kann durch Beobachtung Zellen unter umgekehrten Fluoreszenz-Mikroskopie bestimmt werden.
- Bereiten Sie die folgenden Mischungen für jede Probe:
- Kombinieren 1-2 ug DNA (Beispiel: Nutzung von 4μl 265μg/μl pcDNA3.1/Aedae-KR) mit 100 ul Opti-MEM I Reduzierte Serum Medium (Invitrogen).
- Mix 6 ul Lipofectin Reagent (InvitrogenTM) in 100 ul F12K serumfreiem Medium, so dass ein 1:1-Verhältnis von Lipofectin, um DNA. Inkubieren bei Raumtemperatur für 30-45 min.
- Entfernen Sie die alte Wachstumsmedium von den Zellen und die Zellen mit 5 ml F12K serumfreiem Medium und entfernen Sie dann die F12K serumfreien Medium. In einem 15 ml-Tube, mischen die Transfektion Mischung in 1,8 ml frisch F12K Medium in einem Dropdown-weise Mode. Dann wusch die Zellen aus Schritt 1.5 mit PBS und stell 'das neue Transfektion Lösung zu den Zellen. Inkubieren für 18 Stunden.
- Ändern Sie den Medium zu Medium plus 10% fötalem Rinderserum ohne Antibiotika F12K beimpft und über Nacht. Split die Zellen in zwei T-25 Flaschen mit F12K Medium plus 10% fötalem Rinderserum ohne Antibiotika für weitere 18 Stunden (für die Spaltung Zellen siehe Schritt 1.3).
- Ersetzen Sie das Medium mit selektivem Medium (F12K Medium plus 10% fötalem Rinderserum mit 800μg/ml Geneticin, Invitrogen). Kultur der Zellen mit dem selektiven Medium für 3-4 Wochen. Im Laufe der Zeit wird für Zellen, die stabil das Plasmid in ihre genomische DNA integriert auszuwählen. Weiter erhalten die Zellen mit Hilfe von Wartungs-Medium (F12K Medium plus 10% fötalem Rinderserum mit 400μg/ml Geneticin). Von Zeit zu Zeit einfrieren Zelllinien mit 1:1 Verhältnis des Einfrierens Medien (selektive Medium mit 20% DMSO), um verliert im Falle eines unerwarteten Kontaminationen zu verhindern.
- Die Auswahl klonalen Zelllinien: als einen ersten Schritt, trypsinize und Zentrifuge die Zellen aus Schritt 1.8 mit Wartung Medium wie in Schritt 1.3. Re-suspend-Zellen in 5 ml Medium Wartung, nehmen Sie 0,5 ml der Zelle einzustellen und fügen Sie 4,5 ml frisches Wartung mittel-bis 10-fach Verdünnung zu machen. Übertragen Sie die 10x Verdünnung in 12 Vertiefungen einer 96-Well-Platte, die Zugabe von 100 ul in jede Vertiefung für einzelne Zellen zu markieren.
- Weiter zu 10x serielle Verdünnungen dieser Zellen für eine theoretische Endsuspension von einer Zelle pro 100 ul (in der Regel die letzte Verdünnung wird im Bereich von 10 -11 bis 10 -19 sein, die Gesamtzahl der 10-fach serielle Verdünnungen ist ~ 19) machen . Unmittelbar nach jeder Verdünnung, Transfer 100 ul der Verdünnung in 12 Wells der 96-Well-Platte. Nach 18 Stunden Inkubation, beobachten 96 Well-Platten unter einem inversen Licht-oder Fluoreszenz-Mikroskop und Mark Wells, die enthalten nur eine einzige Zelle enthalten oder zwei Zellen, die offensichtlich aus einer einzigen Zelle geteilt erscheinen. Halten Sie beobachten jeden Tag, und ändern Medium alle drei Tage.
- Wenn der Brunnen sind 80% confluent (etwa eine Woche), spülen gekennzeichneten Vertiefungen mit 200 ul PBS und trypsinize sie mit 100 ul PBS-Trypsin-EDTA-Lösung. Transfer-Zellen aus jedem Well in eine Vertiefung einer 6-well-Platte mit 1 ml Medium Wartung markiert. Wachsen die Zellen für 3 Tage dann Transfer Zellen in einzelne T25 Kolben. Testen Sie diese Zellen unter Verwendung des Kalzium-Biolumineszenz-Assay mit Agonisten Peptide (siehe Abschnitt 2).
- Wählen Sie 1 Zelllinie, die aus Schritt 1,11 mit der höchsten Resonanz in der Calcium-Biolumineszenz Platten-Assay und führen Sie ein zweites Mal die einzelne Zelle Auswahl folgende Schritte 1,9-1,11. Von Zeit zu Zeit einfrieren Zelllinien.
- Von den sekundären Auswahl in Schritt 1.12 beschrieben, wählen Sie 2-3 Zellen mit der größten Resonanz in der Calcium-Biolumineszenz Platten-Assay und halten sie in der Kultur für weitere Calcium-Biolumineszenz-Assays Platte. Verfolgen Durchgang Zahlen. Von Zeit zu Zeit, freeze-Zelllinien aus frühen Passagen, so dass Sie immer wieder zurückkommen können, um sie, wenn die Zell-Linien mit mehr Passagen konsequent aufhören.
2. Die Calcium-Biolumineszenz Platten-Assay
- Ligieren des Reporter-Gen von Interesse in einen Expressionsvektor. Hier haben wir Aequorin Plasmid mtAEQ/pcDNA1 (ein Geschenk von Drs. CJP Grimmelikhuijzen und Michael Williamson, University of Copenhagen, Dänemark). Transform das Plasmid in E. coli-Zellen MC1061/PS (Invitrogen) und reinige sie mit einem QIAprep Spin Miniprep Kit (Qiagen Inc.). In den letzten Schritt zu eluieren das Plasmid mit Tris-Puffer ohne EDTA, kein Wasser.
- Wachsen Zelllinien aus Schritt 1,13 Expression des gewünschten Rezeptor in der Instandhaltung Medium. Wenn die Zellen 90% konfluent sind, trypsinize, Zentrifuge und dann wieder die Zellen in 5 ml Medium Wartung, wie in Schritt 1.3. Verdünnen Zellen (ca. 10x mit wartungsfreien medium) und zählen Zellzahl mit Zellzahl (Bright-Line Hämazytometer) unter dem Mikroskop. Passen Sie die Zellzahl auf ca. 2 x 10 5 Zellen / ml (durchschnittlich 20 Zellen in einem der 9 Quadrate zeigte sich in der Hämazytometer). Seed 2 ml verdünnt Zellen in Medien in jedes Well einer sechs-Well-Platte. Inkubationszeit von 24 Stunden (die Zellen erreichen sollte etwa 60% Konfluenz nach Inkubation).
- Ändern Medien in der 6 Vertiefungen Platte OPTI-MEM-Medium. Für jeden gut mischen 96 ul OPTI-MEM mit 4 ul FuGENE 6 Transfektionsreagenz (Roche Biochemicals) in einem Mikrozentrifugenröhrchen und lassen Sie sich bei Raumtemperatur für 5 min. Add 1 pg Aequorin / pcDNA 1 Plasmid-DNA in jedes Röhrchen und dann schütteln die Probe für 1 min inkubieren bei Raumtemperatur für 15-20 min. Fügen Sie jeder Mischung in jedes Well in einer tropfenweise unter leichtem Schütteln der Well-Platte. Die Inkubation für 6 Stunden und ändern Sie die mittel-bis Medium mit 10% fötalem Rinderserum ohne antibiotische F12K.
- Nach Inkubation der Zellen in sechs Well-Platte für 24 Stunden, trypsinize, Zentrifuge und Resuspendieren der Zellen wie in Schritt 1.3. Zählen Sie die Zellzahl auf 400.000 Zellen / ml als Schritt 2,1 und Transfer 100 ul (insgesamt 40.000 Zellen/100 ul) in jede Vertiefung einer 96-well weißen dünnen Boden Mikrotiterplatte (Costar 3610). Inkubieren für weitere 24 Stunden bis etwa 80% Zellkonfluenz. Dies ist die optimale Konzentration von Zellen für die Biolumineszenz-Assay.
- Bereiten 90μl/well einer Calcium-freiem DMEM Medium (Invitrogen) mit 5 uM Coelenterazin (Invitrogen) in den dunklen (Coelenterazin ist lichtempfindlich). Nehmen Sie die Platte von 2,4, entfernen Sie alte Medien und stell 'das 90μl in jede Vertiefung. Die Platten für 3 Stunden im Dunkeln bei 37 ° C und 5% CO 2, wonach die Zellen in der Platte sind bereit, getestet werden.
3. Gerätebedienung und Datenanalyse
- Jeder Biolumineszenz-Reader ist das anders. Wir führen unsere Tests mit einem Novostar (BMG Labtechnologies) Platten-Lesegerät in bioluminensence Modus. Wenn Sie ein anderes Instrument verwenden, müssen Sie anpassen Protokoll.
- Spülen Sie die Platte Leser Pumpen (oder Prime Pumpen) vor dem Gebrauch. Schalten Sie das Licht in den Raum, bevor die Platte auf den Teller Inhaber. Sobald der Halter geschlossen hat, schalten die Lichter an.
- Solubilisieren Peptide (in einem 1,5 ml Eppendorf-Röhrchen) in der Calcium-freiem DMEM-Medien. Stellen Sie die "absaugen Tiefe" und "Positionsbestimmung" der Peptid-Lösung vor dem Gebrauch. Fordern Sie die Zellen mit 10 ul (10x) mit unterschiedlichen Konzentrationen der Peptide (FFFSWG-NH2, Aedes-K1-3, oder andere gewünschte Peptid) und beginnt sofort mit der Aufnahme der Lichtemission. Wir haben das Instrument, um die Lichtemission (465 nm) für jeden gut alle 2 Sekunden für eine Gesamtzeit von 50 Sekunden Rekord aufgestellt.
- Vergewissern Sie sich, um eine positive Kontrolle wie eine aktive analoge (analog FFFSWGa verwendet wurde, Taneja-Bageshwar et al., 2009) und eine negative Kontrolle wie vector nur transfizierten Zellen enthalten. Die negative Kontrolle wird während der Datenanalyse notwendig, um die Baseline-Schwelle (siehe repräsentative Ergebnisse).Ein unabhängiger, inaktive Peptid kann auch als Negativ-Kontrolle ergänzt werden.
- Nach dem Lauf abgeschlossen ist, waschen Sie das Instrument Pumpe (oder Prime Pumpen), dann legen Sie die nächste Peptid Probe. Speichern Sie Ihre Daten und waschen Sie die Pumpen wieder.
- Datenverarbeitung: Übertragen Sie die Daten der Lichtemission aus jedem Well in eine Microsoft Excel-Datenblatt.
- Fügen Sie die Daten aus Excel in Prism-Software 4.0 aus GraphPad Software Inc. (San Diego, CA, USA). Die verschiedenen Peptid-Konzentrationen ist der X-Achse und Biolumineszenz-Einheiten ist die Y-Achse. Zur Normalisierung der Daten, Grundstück ein Protokoll-Wirkungs-Kurve. Wählen Sie eine nicht-lineare Regressionskurve Analyse (sigmoide Dosis-Wirkungs-Gleichung mit variabler Steigung) zu Konzentrations-Wirkungs-Kurven für jedes Peptid zu erhalten. Das Programm zeichnet die Werte am Ende und gibt der EC 50.
- Jedes Experiment sollte mindestens drei Mal für die Datenanalyse wiederholt werden.
4. Repräsentative Ergebnisse:
Wenn in CHO-K1-Zellen exprimiert, verhielten sich die Mücke Aedes aegypti Kinin-Rezeptor als Multiligand Rezeptor und funktionell reagierte auf so niedrige Konzentrationen wie 1 nM der drei endogenours Aedes Kinine, Aedae Kinine 1-3, getestet einzeln mit dem Kalzium-Biolumineszenz Platten-Assay . Abbildung 1 zeigt, dass die Reihenfolge der Wirksamkeit erhalten Aedae-K-3> Aedae-K-2> Aedae-K-1, auf den jeweiligen EC 50-Werte von Aedae-K-3, 16.04 nM beruhte; Aedae-K- 2, 26,6 nM und Aedae-K-1, 48,85 nM, die statistisch signifikant verschieden (P <0,05) (Pietrantonio et al., 2005).
Wir verwendeten auch diesen Test, um festzustellen, welche Kinin Rückstände von entscheidender Bedeutung für die Kinin-Peptid-Rezeptor-Interaktion sind. Insect Kinin Peptide haben eine C-terminale Pentapeptid, dass die minimale Sequenz für die biologische Aktivität, die auch als Kern bezeichnet erforderlich ist. In Tabelle 1 wurden die Kinin Peptid Kern-Analoga als Alanin Ersatz-Serie der Core-Kinin Pentapeptid FFSWGa synthetisiert und getestet von einem Kalzium-Biolumineszenz Platten-Assay (Taneja-Bageshwar et al., 2006). Wir fanden, dass die Aminosäuren Phe 1 und Trp 4 wesentlichen für die Aktivität der Insekten Kinine für beide Rezeptoren wurden.
Der Test kann auch verwendet werden, um Peptide für eine verbesserte Biostabilität konzipiert testen. Tabelle 2 zeigt die entworfen Kinin-Analoga, die Amino Isobuttersäure (Aib) auf die Zecke rekombinanten Kinin-Rezeptor und Abbildung 2 zeigt die Aktivität getestet Vergleich von sechs alpha-Amino Isobuttersäure-Analoga auf die Zecke Kinin-Rezeptor exprimierenden CHO-K1-Zelllinie durch eine Kalzium- Biolumineszenz Platten-Assay (Taneja-Bageshwar et al., 2009). Das Hexapeptid analog FFFSWGa ist für eine positive Kontrolle für Rezeptor-Aktivität aufgenommen. Die analogen FF [Aib] WGA führte aktiver als diese Hexapeptid Steuerung analog. Die analogen mit zwei Aminoisobuttersäure Ersatz, [Aib] FF [Aib] WGA wurde der stärkste der Doppel-Ersatz-Analoga getestet (Tabelle 2 und Abbildung 2).
Weitere Beispiele dafür, wie dieser Test wurde und angewendet sehen Nachman und Pietantonio (2010), Nachman et al. (2009), Taneja-Bageshwar et al. (2008a) und Taneja-Bageshwar et al. (2008b).
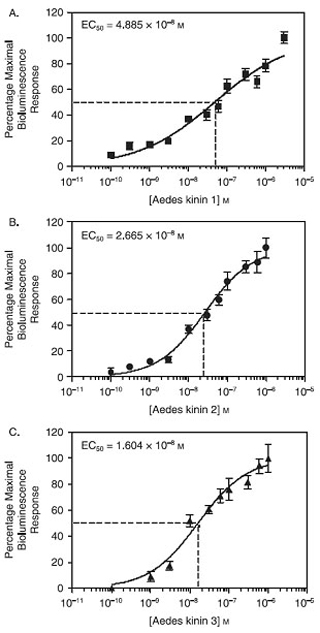
Abbildung 1. Schätzung von Aedes Kinine effektive Konzentration (EC 50) auf CHO-K1 E10-Zellen durch ein Kalzium-Biolumineszenz Platten-Assay. Die y-Achse in die Konzentrations-Wirkungs-Kurven von Biolumineszenz-Einheiten als Prozentsatz der maximalen Antwort für jeden beobachteten ausgedrückt wurde erhalten Peptid. Die Datenpunkte repräsentieren den Durchschnitt von sechs Wiederholungen in drei unabhängigen Experimenten. Die Balken stellen den Standardfehler. (A) Schätzung von Aedae-K1 EC 50 = 48 nM. (B) Abschätzung der Aedae-K2 EC 50 = 26 nM. (C) Schätzung von Aedae-K3 EC 50 = 16 nM. EC 50 Aedae-K3 50 Aedae-K2 50 Aedae-K1; P <0,05. Statistische Analysen und Diagramme wurden mit dem GraphPad Prism 4.0-Software.
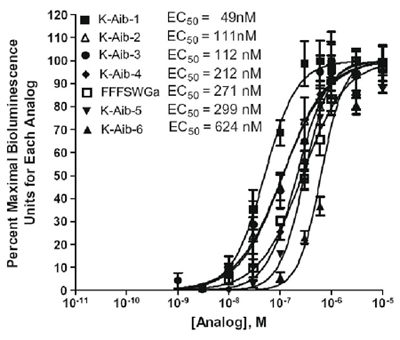
Abbildung 2. Activity Vergleich von sechs alpha-Amino Isobuttersäure-Analoga auf die Zecke Kinin-Rezeptor exprimierenden CHO-K1-Zelllinie durch eine Kalzium-Biolumineszenz Platten-Assay. Die y-Achse repräsentiert Prozent maximal Biolumineszenz Einheiten für jeden analogen als Prozentsatz der Biolumineszenz bei einer Konzentration beobachtet ausgedrückt Vergleich der maximalen Resonanz bei allen Konzentrationen für jeden analogen getestet beobachtet. Statistische Analysen und Diagramme wurden mit GraphPad Prism 4.0-Software durchgeführt.
| Tick-Rezeptor-Zell-Linie | Mosquito-Rezeptor-Zell-Linie | |||
| Peptide | EC 50 (nM) | Maximal Biolumineszenz Resonanz auf 1 mM | EC 50 (nM) | Maximal Biolumineszenz Resonanz auf 1 mM |
| AFSWGa | Ich | Ich | Ich | Ich |
| FASWGa | 586 | 5.600 | ND | 400 |
| FFAWGa | 64 | 12.800 | 621 | 3.050 |
| FFSAGa | Ich | Ich | Ich | Ich |
| FFSWAa | 417 | 10.600 | 2.800 | 1.830 |
| FFSWGa | 590 | 10.800 | ND | 525 |
| FSWGa | Ich | Ich | Ich | Ich |
| FFSWa | Ich | Ich | Ich | Ich |
| FFSWG-OH | Ich | Ich | Ich | Ich |
| FFFSWGa | 259 | 13.000 | 562 | 10.000 |
| FF [Aib] WGA | 29 | 12.700 | 445 | 9.300 |
Tabelle 1. Geschätzte Potenzen (EC 50) und maximal Biolumineszenz Resonanz aller Peptide auf Pump und Moskito-Rezeptor transfizierten Zelllinien getestet *.
* Der EC 50 Schätzungen der Konzentration erforderlich, um eine halbmaximale Antwort induzieren. I: Inaktiv, wenn Biolumineszenz Reaktion weniger als 300 Einheiten (Level of vector-only-transfizierten Zellen) ist. A: Die Position, wo der jeweilige Rückstand in das Peptid FFSWGa durch Alanin ersetzt wurde. ND: Die analogen getestet wurde, aber entweder nicht sehr aktiv oder nicht aktiv war bei niedrigeren Molaritäten, also ein EC50 konnte nicht ermittelt werden.
| K-Aib-1 | [Aib] FF [Aib] WGA |
| K-Aib-2 | [Α MeF] FF [Aib] WGA |
| K-Aib-3 | Ac-R [Aib] FF [Aib] WGA |
| K-Aib-4 | Ac-R [β3F] FF [Aib] WGA |
| K-Aib-5 | [Aib] RFF [Aib] WGA |
| K-Aib-6 | [Aib-Aib-Aib-Aib] RFF [Aib] WGA |
Tabelle 2. Kinin-Analoga (K), die Amino Isobuttersäure (Aib) auf die Zecke rekombinanten Kinin-Rezeptor getestet. Ac: Acetyl; α Me: α methyl-Phenylalanin; β3F: β3-Phenylalanin; a: Amid.
Diskussion
Wir konnten die funktionelle Charakterisierung des ersten Neuropeptid-Rezeptor aus der Arachnida (Zecken, Milben und Spinnen), die Zecke Kinin-Rezeptor entdeckt durchführen, die dieses Protokoll verwenden. Diese Methode hat drei primäre Anwendungen. Erstens kann die Technik für die Rezeptor-Ligand deorphanization durch Aktivität Messungen angewendet werden. Zweitens kann der Assay-Lösung Ligand-Rezeptor-Struktur-Aktivitäts-Beziehungen (SAR). Drittens können die Methoden in der Wirkstoffforschung eingesetzt werden. Darüber hinaus kann dieses Protokoll verwendet, um die Aktivität von Agonisten oder Antagonisten an fast jedem GPCR zu studieren. Wir sind dabei, dieses Protokoll für das Screening von kleinen Bibliotheken anzupassen. Die Zelllinie wir genutzt drückt nicht die allgegenwärtige G-Protein G 16. Wir brauchten es, weil Arthropoden Kinin Rezeptoren Signal durch den Gq-Protein und die intrazellulären Calcium-Kaskade und sie erhalten diese Signalwege in Säugerzellen wie hier gezeigt.
Offenlegungen
Danksagungen
Drs. CJP Grimmelikhuijzen und Michael Williamson von der University of Copenhagen (Dänemark) sind für die Bereitstellung der Aequorin Plasmid geschätzt. Unsere Mitarbeiterin, Dr. Ronald J. Nachman von ARS-USDA (TX, USA), ist für die Peptid-Synthese und für die Bereitstellung der Novostar Plattenlesegerät anerkannt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| DMEM | Invitrogen | ABCD1234 | |
| CHO-K1-Zellen | ATCC | CCL-61 | Manassas, VA, USA |
| F12K Medium | Invitrogen | 21127 | |
| Fetal Bovine Serum | Sigma-Aldrich | F0643 | |
| Trypsin-EDTA (10x) | Invitrogen | 15400 | |
| Antibiotika-Antimykotikum | Invitrogen | 15240 | |
| Opti-MEM I Reduzierte Serum Medium | Invitrogen | 31985 | |
| Lipofectin Reagent | Invitrogen | 18292-011 | |
| Geneticin | Invitrogen | 10131035 | |
| MC1061/P3 Ultracomp | Invitrogen | C663-03 | |
| QIAprep Spin Miniprep Kit | Qiagen Inc. | 19064 | |
| FuGENE 6 Transfektionsreagenz | Roche | 11 814 443 001 | |
| 96-Well-weißen dünnen Boden microtitere Platte | Costar | 3610 | |
| Calcium-freiem DMEM Medien | Invitrogen | 21068 | |
| Coelenterazin | Invitrogen | C-2944 | |
| Helle-Line Hämazytometer | Hausser Scientific | Horsham, PA | |
| Novostar | BMG Labtechnologies | ||
| Prism-Software 4.0 | GraphPad Software Inc. | San Diego, CA, USA | |
| T-25 und T-75 Flaschen | BD Falcon | 353014 und 353135 |
Referenzen
- Kozak, M. An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs. Nucleic Acids Research. 15, 8125-8148 (1987).
- Nachman, R., Pietrantonio, P. V. Interaction of mimetic analogs of insect kinin neuropeptides with arthropod receptors. Neuropeptide systems as Targets for Parasite and Pest Control. Geary, T. , Landes Bioscience. Madamme Curie Library. (2010).
- Nachman, R. J., Pietrantonio, P. V., Coast, G. M. Towards the development of novel pest management agents based upon insect kinin neuropeptide analogs. Annals of the New York Academy of Sciences. , 1163-11251 (2009).
- Taneja-Bageshwar, S., Strey, A., Isaac, R. E., Coast, G. M., Zubrzak, P., Pietrantonio, P. V., Nachman, R. J. Biostable agonists that match and/or exceed the activity of insect kinins on recombinant arthropod GPCRs. General and Comparative Endocrinology. 162, 122-128 (2009).
- Taneja-Bageshwar, S., Strey, A., Kaczmarek, K., Zabrocki, J., Pietrantonio, P. V., Nachman, R. J. Comparison of insect kinin analogs with cis-peptide bond, type VI-turn motifs identifies optimal stereochemistry for interaction with a recombinant arthropod kinin receptor from the southern cattle tick Boophilus microplus. Peptides. 29, 295-301 Forthcoming.
- Taneja-Bageshwar, S., Strey, A., Zubrzak, P., Williams, H., Reyes-Rangel, G., Juaristi, E., Pietrantonio, P. V., Nachman, R. J. Identification of selective and non-selective, biostable beta-amino acid agonists of recombinant insect kinin receptors from the southern cattle tick Boophilus microplus and mosquito Aedes aegypti. Peptides. 29, 302-309 Forthcoming.
- Taneja-Bageshwar, S., Strey, A., Zubrzak, P., Pietrantonio, P. V., Nachman, R. J. Comparative structure-activity analysis of insect kinin core analogs on recombinant kinin receptors drom southern cattle tick Boophilus microplus (Acari: Ixodidae) and mosquito Aedes aegypti (Diptera: Culicidae). Archives of Insect Biochemistry and Physiology. 62, 128-140 (2006).
- Pietrantonio, P. V., Jagge, C., Taneja-Bageshwar, S., Nachman, R. J., Barhoumi, R. The mosquito Aedes aegypti (L.) leucokinin receptor is a multiligand receptor for the three Aedes kinins. Insect Molecular Biology. 14, 55-67 (2005).
- Holmes, S. P., Barhoumi, R., Nachman, R. J., Pietrantonio, P. V. Functional analysis of a G protein-coupled receptor from the Southern cattle tick Boophilus microplus (Acari: Ixodidae) identifies it as the first arthropod myokinin receptor. Insect Molecular Biology. 12, 27-38 (2003).
- Staubli, F., Jorgensen, T. J. D., Cazzamali, G., Williamson, M., Lenz, C., Sondergaard, L., Roepstorff, P., Grimmelikhuijzen, C. J. P. Molecular identification of the insect adipokinetic hormone receptors. Proceedings of the National Academy of Sciences USA. 99, 3446-3451 (2002).
- Stables, J., Green, A., Marshall, F., Fraser, N., Knight, E., Sautel, M., Milligan, G., Lee, M., Rees, S. A bioluminescent assay for agonist activity at potentially any G-protein coupled receptor. Analytical Biochemistry. 252, 115-126 (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten