Method Article
Neuromodulação e Transportes mitocondrial: Imagens ao vivo em neurônios do hipocampo durante muito tempo
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Nós descrevemos um protocolo que permite imagens de mitocôndrias na vida neurônios através de microscopia de fluorescência durante muito tempo. Imagem por longos períodos é realizado através de lentivírus mediada expressão de uma proteína fluorescente mitochondrially alvo e uso de uma infra-top estágio incubadora que foi projetada e construída em nosso laboratório.
Resumo
Para entender a relação entre o transporte mitocondrial e função neuronal, é fundamental observar o comportamento mitocondrial em viver neurônios cultivados por longos períodos 1-3. Isto é agora possível através do uso de corantes vitais e proteínas fluorescentes com que os componentes do citoesqueleto, organelas, e outras estruturas em células vivas podem ser rotulados e então visualizados através de microscopia de fluorescência dinâmica. Por exemplo, nos neurônios de frango embrionárias Simpático, movimento mitocondrial foi caracterizada utilizando o corante vital rodamina 123 4. Em outro estudo, as mitocôndrias foram visualizados nos neurônios do prosencéfalo rato por transfecção de eYFP mitochondrially alvo 5. No entanto, imaging de neurônios primários ao longo de minutos, horas ou mesmo dias apresenta uma série de questões. Lugar entre estes estão: 1) manutenção das condições de cultivo, como temperatura, umidade e pH durante as sessões de imagem longa, 2) um forte sinal estável fluorescentes para garantir a qualidade das imagens adquiridas e medição precisa da intensidade do sinal durante a análise de imagem; e 3) limitar tempos de exposição durante a aquisição de imagens para minimizar e evitar fotobranqueamento fototoxicidade.
Aqui, nós descrevemos um protocolo que permite a observação, visualização e análise do movimento mitocondrial em culturas de neurônios do hipocampo com alta resolução temporal e sob condições de apoio ótima vida. Temos construído um preço acessível estágio-top incubadora que fornece boa regulação da temperatura e fluxo de gás na atmosfera, e também limita o grau de evaporação media, assegurando pH estável e osmolaridade. Esta incubadora é conectado, via de entrada e saída de mangueiras, com um padrão de cultura de tecidos da incubadora, que oferece níveis de umidade constante e uma atmosfera de CO% 05-10 fevereiro de ar /. Este projeto oferece uma alternativa de baixo custo para incubadoras microscópio significativamente mais caros que não necessariamente garantem a viabilidade das células durante muitas horas ou mesmo dias. Para visualizar as mitocôndrias, que infectar as células com um lentivírus que codifica uma proteína fluorescente vermelha que é direcionado para a mitocôndria. Isso garante um sinal forte e persistente, que, em conjunto com o uso de uma fonte estável de luz xenon, que nos permite limitar tempos de exposição durante a aquisição de imagem e tudo, mas impede fotobranqueamento e fototoxicidade. Duas portas de injeção na parte superior da incubadora estágio-top permitir que a administração aguda de neurotransmissores e outros reagentes destinados para modular o movimento mitocondrial. Na expressão de soma, mediada por lentivírus de uma organela-alvo a proteína fluorescente vermelha ea combinação de nosso palco-top incubadora, um microscópio invertido de fluorescência convencional, câmera CCD, e fonte de luz xenon nos permitem adquirir imagens de lapso de tempo de transporte mitocondrial em neurônios vivos mais durações mais longas do que as possíveis em estudos a implantação convencional corantes vitais e off-the-shelf sistemas de suporte de vida.
Protocolo
1. Descrição do Lab-built Stage-top Incubadora
Manter as células vivas em um estágio do microscópio por longos períodos oferece três grandes desafios: 1) controle de temperatura do ambiente ea regulação; 2) controle de umidade, ou seja, manter a umidade da atmosfera ambiente, e 3) manutenção do pH adequado no meio de cultura. Estas questões "suporte de vida" são essenciais para experimentos envolvendo a observação a longo prazo de neurônios cultivados, células que são particularmente sensíveis às mudanças de temperatura e pH. A seguir, descrevemos um simples laboratório construído estágio-top incubadora que nós concebidos e construídos para imagens ao vivo dos neurônios mais longos períodos. Esta incubadora é ligada, através de um circuito fechado, a um padrão de cultura de tecidos incubadora (Thermo Scientific, Asheville, Carolina do Norte), que fornece um estábulo aquecida (37 ° C), atmosfera úmida de CO 10% de ar 2 / 90%.
- Incubadora de gabinete: O corpo da incubadora (Figura 1 (I, II); A) foi fabricado em uma máquina computadorizada C & C moagem a partir de um pedaço sólido de plástico delrin preto. Mede 97,74 milímetros (L) x 73,60 milímetros (W) x 28,58 milímetros (H), (dimensões internas de 96,74 milímetros x 72,60 milímetros x 27,58 milímetros) fornecer um volume fechado de cerca de 19.370 centímetros 3. Dois buracos foram perfurados em cada extremidade do recinto e equipados com farpas de metal enfiada para acomodar as mangueiras de entrada e saída de / para a cultura de tecidos incubadora. A abertura retangular medindo 70,0 milímetros x 43,0 milímetros foi moído para fora no topo do compartimento para permitir a colocação de uma janela de plástico de policarbonato (Figura 1 (I, II); B). A base da incubadora (Figura 1 (I, II, III); C; vista superior e perfil mostrado em detalhe no canto superior esquerdo), branqueado a partir de 16/03 estoque de alumínio ", as medidas de 159,77 milímetros (L) x 109,86 milímetros (W ) x 3,175 milímetros (D), e é projetado para se encaixar no recesso de inserção de uma motorizada Leica 3 Placa-estágio (modelo 11-522-068, Leica GmBh, Leipzig, Alemanha). Quatro postes de aço com roscas internas foram anexados ao . cantos da thebase por embutir parafusos de cabeça chata Estes fornecem pontos de fixação sólida para o gabinete de incubadora, que foi perfurado para fora em cada canto para aceitar as mensagens (Figura 1 (II, III); D). A junta Sorbothane (McMaster Carr, Inc., Elmhurst, IL) foi cortado e montado a base para fornecer uma vedação na interface cerco / base. quatro parafusos de latão com threading correspondente à dos posts são usados para prender a caixa à base (Figura 1 (II, III);. D) Um buraco de diâmetro 35,1 milímetros com um lábio fino recesso foi cortado no centro da base de incubadora para acomodar GBMS 35mm (Figura 1 (III); E; detalhe no canto superior esquerdo); bases adicionais foram projetados para acomodar tamanhos outro prato da cultura.
- Elementos de aquecimento: Dois resistores de 10 Kohm calor do dissipador (Digi-Key Corp, Thief River Falls, MN) estão afixadas nas paredes internas da caixa incubadora. Estes estão ligados a um DC 9V, 500mA transformador que é ligado a um controlador de temperatura Alife 1000W terrário (Carolina Abastecimento Pet, Irmo, SC). Uma sonda com fio colocado através de uma junta na janela de policarbonato do recinto incubadora detecta a temperatura ambiente interna e determina o fluxo de corrente para os resistores. Em conjunto com a cultura de tecidos incubadora, as resistências de fornecer uma medida adicional de controle de temperatura ambiente.
- Sistema de circuito fechado de atmosfera: Para fornecer um ambiente umidificado e aquecido, constante do ar 10% de CO 2 / 90%, a incubadora estágio superior é conectado, via de entrada e saída de mangueiras (Figura 1 (I); F, G), para um standard, jaqueta de água de cultura de tecidos incubadora (Figura 1 (I); H); Forma Scientific Modelo 3154; Thermo Scientific, Inc., Asheville, NC). Mesmo antes de ligar para a incubadora estágio superior, o tubo de alimentação (Figura 1 (I); F) é executado em uma bomba de aquário padrão (Figura 1 (I); I; Lifegard QuietOne Modelo 1200, Pentair Aquatics, El Monte, CA) que foi fechado em uma caixa selada de plástico ABS (Figura 1 (I); J; Modelo 1150, Pelican Products, Inc., Torrance, CA) para manter um circuito fechado. Esta bomba promove o fluxo de ar contínuo a partir da cultura de tecidos incubadora para a incubadora estágio superior. Após a fase de bomba, a mangueira de entrada corre para um Erlenmeyer de 1500ml (Figura 1 (I); K) que atua como um silenciador para minimizar a transmissão de vibração da bomba para a incubadora estágio superior. Uma mangueira de saída (Figura 1 (I); G), levando da incubadora estágio superior ao de cultura de tecidos incubadora (Figura 1 (I); H) é equipado com um ventilador de computador incluso (Figura 1 (I); L), que, como a bomba, também se destina a promover o fluxo de ar contínuo.
- PFTE tampa de membrana para 35mm GBM: Antes de colocar a cultura neuronal na incubadora estágio superior de imagem, o GBM 35mm é equipado com um especial membrane tampa (Figura 1 (II, IV); M; detalhe mostrado no canto superior direito) para permitir a troca de gás e, ao mesmo tempo minimizar a evaporação do meio de cultura. Esta tampa consiste de um aro de plástico delrin e uma folha de pré-corte de PFTE membrana (Teflon; Durafilm americano Co., Inc., Holliston MA), que foi esticado por cima da borda e mantido no lugar com uma junta viton que desliza em um recessed canal ao longo do lado do aro plástico delrin.
- Portas de injeção: Dois buracos foram perfurados na janela de policarbonato (Figura 1 (II), detalhe centro, setas amarelas perto B) da incubadora em estágio superior. Estes foram equipados com aço inoxidável seringa Hamilton termina para fornecer portas de injeção para administrar 5-HT, DA, agonistas e antagonistas do receptor diversos, e outros reagentes durante um determinado experimento.
2. Preparação de culturas primárias Hippocampal
Todo o trabalho é realizado tanto em capela de fluxo laminar ou um BSL2 em uma bancada de fluxo laminar. Primária os neurônios do hipocampo estão isolados do E18 embriões de ratos de acordo com procedimentos padrão 6-7, e são cultivadas em meio livre de soro que tem sido condicionada pela principal astrócitos corticais. Células gliais são preparados de acordo com métodos publicados 7. O meio condicionado consiste em baixa de glicose DMEM, suplementado com prolina (1,76 ug / ml), asparagina (0,83 ug / ml), vitamina B12 (0,34 ug / ml), glicose (20mM), rica em lipídios BSA (0,5 mg / ml ) e 2% do B27 8-10. Não antibióticos são adicionados ao meio como eles podem interferir com a transcrição do gene neuronal.
- Cobrir a parte central de lamínula de vidro de um prato de cultura 35 milímetros com fundo de vidro (GBM) com poli-D-lisina (0,05 mg / ml em PBS), e deixar em repouso por duas horas a 37 ° C. Aspirar a solução de poli-D-lisina, deixe secar por 20 minutos em uma capela de fluxo laminar BSL2. Cobrir a parcela lamela poli-D-lisina revestido do GBM com laminina (0,01 mg / ml em PBS), e deixe por um mínimo de 40 minutos antes de retirar a solução laminina em excesso. Reservada para 20 minutos.
- Dissecar hipocampo do cérebro de embriões de ratos E18, e dissociá-los, como descrito nos Protocolos atual em Neurociências 6.
- Diluir células dissociadas em meio de crescimento para permitir uma densidade de 110 mil células por GBM. Calcular a concentração necessária de células em seu master mix de acordo com o número de GBMS você estará se preparando.
- Lugar GBMS semeadas em uma temperatura incubadora ata conjunto de 37 ° C e uma atmosfera de mistura de CO 10% de ar 2 / 90%.
- Três a cinco dias depois, dependendo das condições de crescimento dos neurônios, adicione arabinoside C (0,14 ng / ml) para as culturas para suprimir a proliferação glial.
- Permitir que as culturas a crescer por duas semanas antes de infectar com o lentivírus. Durante este tempo, substituir um terço do volume de meio em cada GBM com meio fresco a cada três dias. Não exceda esta quantidade de mídia, pois isso pode levar ao choque osmótico e morte celular.
3. Preparação de proteína recombinante Lentivirus Encoding Red Fluorescent
Para os investigadores que não têm acesso às instalações para a produção de lentivírus recombinante, produção sob encomenda por uma entidade comercial por exemplo, Sistema de Biociências (Mountain View, CA) é uma opção.
A mitochondrially-alvo gene da proteína fluorescente vermelha (MitoTurboRFP; Axxora LLC, San Diego, CA) é inserido em uma auto-inativação do vírus da imunodeficiência felina recombinante sob o controle transcricional do enhancer do gene promotor citomegalovírus principais imediato início de 11. Lentivírus recombinantes são produzidos por transitoriamente transfecting células 293T.
- Placa 293T células com uma densidade de aproximadamente 75.000 células / cm 2, no dia seguinte, co-transfecção as células com plasmídeos codificando o vetor recombinante viral, FIV gag e pol genes, eo vírus da estomatite vesicular gene da glicoproteína G, usando PolyJet (SignaGen Laboratories, Gaithersburg, MD). Um total de 12 ug de DNA (4,8 mg vetor viral, 4,8 mg gagpol plasmídeo, e 2,4 mg VSV G plasmídeo) é usada para cada placa de cultura de células 293T 10 centímetros.
- Após 24 horas, aspirar o meio de cultura e células lavar com vermelho de fenol livre de solução salina Hanks equilibrada para remover DNA residual. Adicionar 10ml de soro livre de médio neural basal suplementado com 50μg/ml rica em lipídios e BSA Glutamax.
- No dia seguinte, a colheita do sobrenadante, através de um filtro de 0,2 micron filtro de proteína baixa ligação e adicionar a uma unidade de ultrafiltração Vivaspin 20 polietersulfona (Sartorius, Concord, EUA). Pré-tratamento na unidade Vivaspin sequencialmente, lavagem com etanol 70%, a água do tecido grau, cultura e tampão fosfato. Concentre-se o vírus contendo sobrenadante ~ 50 vezes por centrifugação a 1500xg por 30 minutos. Preparação alíquota do vírus e armazenar em N 2 líquido.
- Estimar a quantidade de vírus infectando ratos B104 células com uma alíquota de vírus concentrado, e medindo a expressão da proteína fluorescente por citometria de fluxo 72 horas mais tarde. A porcentagem de células positivas fornece uma estimativa da quantidade de volume de vírus ou seja, vírus concentrados necessários para obter a expressão da proteína fluorescente em um determinado número de neurônios primários.
4. Infecção de neurônios cultivados
Culturas de neurônios do hipocampo estão infectados em 14 dias in vitro simplesmente adicionando a quantidade de vírus para infectar estimada em até 50% de todos os neurônios com base em dados de citometria de fluxo. Não polibrene é usado. Culturas são mantidas por 3 dias antes de verificar a expressão da proteína fluorescente. Se o sinal é muito fraco, então, a cultura é devolvido à cultura de tecidos incubadora e retestados após vários dias.
5. Manutenção geral do Sistema de Suporte Closed Circuit Vida
- Para manter a umidade adequada, certifique-se que a jaqueta da incubadora de água é verificado periodicamente e cheia, quando necessário. Certifique-se de colocar um de aço inox ou bandeja de alumínio dentro da incubadora contendo um pequeno volume de água (25 mm de profundidade) e algicida.
- Quando necessário, desmarque a entrada e mangueiras de saída do circuito atmosfera incubadora pelo esvaziamento de água coletadas dos tubos de captação. Lavar periodicamente as mangueiras com etanol 70%.
6. Aplicação da tampa de membrana para GBM e Colocação em Estágio-top Incubadora
- Antes da colocação do GBM dentro da incubadora estágio-top, recoloque a tampa de plástico com a tampa de membrana coberta com uma capa de cultura de tecidos. Uma vez feito isso, você pode mover o GBM coberta com o microscópio.
- Cuidadosamente do banco do GBM com a membrana coberta de tampa na abertura recesso na base da incubadora em estágio superior. Para evitar empurrões do GBM, certifique-se que a base já está em vigor no palco microscópio, já que os clipes de base para o palco com alguma dificuldade, o melhor é colocar o GBM após a base está em posição.
- Alinhar o gabinete incubadora com a postes de aço na base incubadora e inferior da caixa na base. Aperte os parafusos até que uma boa vedação é alcançado entre caixa e base.
7. Aquisição de imagem
Note-se que a maioria das plataformas de software disponíveis de imagem têm funcionalidade comparável em uma ampla gama de microscópios e hardware relacionados. Uma variedade de aquisição de imagem e plataformas de software de análise estão disponíveis, incluindo Metamorph e programas concebidos para marcas específicas de microscópio, como Leica Application Suite, da Nikon NIS Elements, e AxioVision Carl Zeiss. Neste protocolo, descrevemos a aquisição de imagem e procedimentos de análise foi realizada utilizando Slidebook 5 (Intelligent imagem Innovations, Denver, CO). No entanto, as etapas constituintes de cada operação descrita no presente protocolo pode ser facilmente adaptado para o uso de uma variedade de outros programas.
Descrição do microscópio de fluorescência invertido, configurações de filtro, câmera CCD, fonte de luz xenon, e software de imagem:
Para imagens dinâmicas de transporte mitocondrial em neurônios do hipocampo, usamos uma Leica DMI-6000B microscópio invertido de fluorescência e Modelo 11-522-068 estágio motorizado (Leica Microsystems GmbH CMS, Wetzlar, Alemanha) equipado com um Sensicam Cooke EQ câmera CCD (A Cooke Corporation, Romulus, MI), um Sutter Lambda 02/10 roda de filtros e controlador (Sutter Instrument Company, Novato, CA), e um Sutter DG-4 300W fonte de luz xenon. Para visualizar as mitocôndrias rotulados com a proteína fluorescente vermelha MitoTurbo, usamos a combinação de um filtro de 555nm na fonte DG-4 luz para excitação e filtros de 600nm (pico; Sedat Quad Modelo refletores 86100bs montado Leica DM cubo filtro de série, tecnologia Chroma Corp, Bellows Falls, VT) e 617nm no microscópio e roda de filtros, respectivamente, para a emissão.
Para aquisição e análise de imagem, usamos o microscópio digital de pacote de software de imagem Slidebook 5. Este é um pacote abrangente que permite o controle totalmente automatizado do microscópio, palco, roda de filtros, câmera e fonte de luz durante a aquisição de imagem, bem como uma variedade de módulos de processamento de imagem e análise.
Abaixo, fornecemos específico, passo-a-passo para a aquisição de imagens de lapso de tempo de mitocôndrias movendo-se em neurônios fluorescentes rotulados com Slidebook 5.
- Certifique-se que o microscópio, controlador de roda de filtros, fonte de luz e câmera CCD ter sido ligado antes de abrir Slidebook 5.
- Para geração de imagens ao vivo das mitocôndrias, mude para um objetivo óleo de imersão-63X, menor a torre objetivo o suficiente para fornecer acesso ao objetivo abaixo do estágio de microscópio (e estágio-Top incubadora), e cuidadosamente aplicar o óleo diretamente sobre a superfície da objetiva. Abra a janela de foco, clicando no ícone de 'Janela Focus' na barra de ferramentas Slidebook. Na janela de foco, acender a luz brightfield deslizando um controle deslizante rotulado 'lâmpada' para ajustar a intensidade de campo claro para um nível adequado. Adquirir foco em um campo de células e encontrar uma célula de interesse.
- Sob o 'Scope' tab, selecione a opção 'Cy3 "fluor. Usando o oculares, sob iluminação fluorescente encontrar o plano de foco das mitocôndrias nas células que foram marcadas com a proteína TurbRed Mito. Depois de ter adquirido o foco através do oculares, mude para a câmera CCD e re-adquirir o foco se necessário.
- Abrir a janela de captura de imagem, clicando no ícone "Captura de Imagem" na barra de ferramentas Slidebook. Começando com um tempo de exposição inicial de 100ms, encontrar o tempo de exposição ideal usando o 'Test' e 'Find Melhor' botões, alternativamente, você pode usar o botão de 'Once'. Lembre-se que o tempo de exposição deve fornecer intensidade ampla espalhados por todo o campo de imagem inteiro (por exemplo, 0-2500; indicado pelo histograma na parte inferior da janela de captura de imagem) dentro de uma duração mínima (por exemplo, 200-800ms).
- Antes de iniciar lapso de tempo de aquisição de imagem, abra a janela "Avançado", clicando na guia 'Avançado' ainda dentro da janela de captura de imagem. Encontrar o 'Focus' tab, marque a opção "Autofous 'durante opção time-lapse/multipoint capta', e ajustar as definições de focagem automática de lapso de tempo de aquisição de imagem. Geralmente, usamos os seguintes parâmetros para uma focagem automática: o foco de atualização a cada 2-3 frames, selecionar como o autofoco canal do fluor usada para imagens rotuladas mitocôndrias, ou seja, Cy3 intervalo de busca total 2 hum para ampliação 63x.
- No 'Capture' janela, sob caixa "Tipo de Captura", marque a opção "Timelapse" e selecione o intervalo desejado de imagem e duração da sessão de representação gráfica em opções 'Capture Timelapse. Em nossos estudos dos efeitos da neuromoduladores no transporte mitocondrial, time-lapse de imagem foi realizado em sessões de uma hora em que um total de 360 imagens foram obtidas em intervalos de 10 segundos entre as imagens.
- Iniciar lapso de tempo de aquisição de imagens, clicando no botão "Iniciar" no lado inferior direito, do 'Capture' janela.
- Após a inicial, controle ou, a sessão de imagens, administrar neurotransmissores e outros reagentes através das portas da incubadora top-top estágio e iniciar uma sessão de imagem novo.
8. Análise de Imagem
- Abra o arquivo de imagem salvo após a sessão de imagens passado.
- Mitocôndrias individuais podem ser rotulados em uma série de imagens de lapso de tempo automaticamente ou manualmente, empregando as funções previstas no mascaramento Slidebook 5.
- Sob a 'máscara' menu, selecionar "segmento" da barra de menu. Deslizando a linha de limite de baixa e alta da ferramenta "histograma", mascarando todas as partículas em azul na imagem inteira, cobrindo todas as mitocôndrias contidas no processo, mas deixando partículas tão discreta quanto possível. Aplique a máscara para a série de imagens completo.
- Criar uma segunda máscara (sob a 'máscara' menu, selecione 'Criar'), que abrange toda a imagem, exceto para o processo de interesse em que as partículas foi destacado pela máscara anterior. Isto é conseguido, em primeiro lugar, usando a ferramenta 'lápis' mais grossa para traçar os limites das áreas fora do processo, e então, usando a ferramenta "balde de tinta" para preencher as regiões delimitadas. Aplicar esta máscara para a série imagem inteira.
- Em 'Máscara', 'Operações Máscara' selecionar e executar "Minus" operação, ou seja, a segunda máscara é subtraído da máscara de punho (toda a imagem, além do processo). A terceira máscara será gerada em que apenas o processo de juro. Note que esta nova máscara será aplicada à série imagem inteira.
- Em 'Anotações', selecione 'Objeto IDs. "
- Verificar a continuidade e atribuições numéricas de cada um dos mascarados mitocôndrias manualmente rever a série de imagens (em Slidebook 5, o 'play', 'frame a frente', e 'quadro inverso,' botões abaixo da janela de imagem pode ser usada para esta finalidade).
- Selecione a 'máscara' guia na barra de menu. Em 'Máscara', 'Rastreamento de Partículas' selecionar e executar 'partícula básica de rastreamento "para gerar" Estatísticas Path ", incluindo as coordenadas do centróide para cada mitocôndria mascarados.
- Distância percorrida por cada mitocôndria entre dois frames adjacentes imagem é calculado a partir das coordenadas de cada partícula em cada frame.
- Em nossos estudos anteriores sobre o efeito de neuromoduladores no movimento mitocondrial, foram identificadas três populações distintas de mitocôndrias:. "Estacionária", "oscilatório, 'e' direcional em movimento" Se uma mitocôndria viaja menos do que 0,2 um (ou 2 pixels, sob a ampliação 63X, 1 pixel = 0,10235 um) dentro de uma hora, caracteriza-se como "estacionário". Se uma mitocôndria se move pelo menos 0,2 um, mas menos do que 2.5 um, em um ciclo anterógrada-retrógrada, é definida como "oscilatório." Finalmente, se uma mitocôndria percorre uma distância líquida de mais de 2,5 hum em uma direção, ele é classificado como movimento direcional. Descrito na Figura 2 é um histograma mostrando o movimento de todas as mitocôndrias rotulados em um experimento representativo, bem como um gráfico mostrando a distribuição percentual das três populações distintas da mitocôndria.
- Velocidade média de cada mitocôndria é calculado de acordo com a distância total percorrida durante uma sessão de imagem dada. A velocidade média de uma população mitocondrial é calculado somando as velocidades individuais e dividindo pelo número total de rastreados mitocôndrias.
- Kymographs pode ser gerado usando um módulo fornecido em Slidebook 5. Usando o 'Máscara' função, desenhar uma linha fina entre toda a extensão de um determinado processo (por exemplo, axônio), não se esqueça de passar por muitos centróides mitocondrial possível. Vá para a 'máscara' guia na barra de menu e selecione "Operações Avançadas 'e depois' Análise de curva suave." Use a configuração padrão para análise da curva lisa ou customize como desejar. Executar o módulo de análise suave curva. No final da análise, uma quimógrafo da sessão de imagem será exibida.
- Vá para a barra de menu e "Ver", selecione e depois em 'Exportar TIFF.
- Abra a salvo. Tif contendo o quimógrafo no Photoshop ou um programa de processamento comparável imagem e converter a imagem para tons de cinza invertidos.
9. Resultados representante
Pelo monitoramento e análise de movimento mitocondrial em culturas de neurônios do hipocampo, temos demonstrado uma ligação entre o tráfico de neuromodulação e mitocondrial. Especificamente, nós descobrimos que a serotonina (5-HT) ou o agonista do receptor 5-HT1A, 8-OH-DPAT, estimula o movimento mitocondrial (Figura 2A-C) 8, enquanto que a dopamina (DA) ou do agonista do receptor D2, a bromocriptina, inibe mitocondrial movimento (Figura 2D-G) 9.
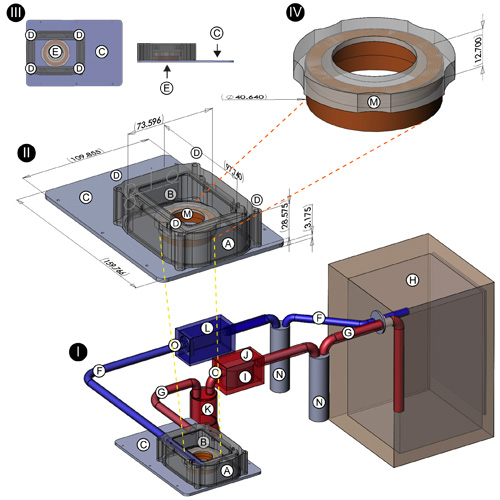
Figura 1. Concepção de sistema fechado de circuito fase-top incubadora Os seguintes componentes do sistema de incubadora são mostrados: resistente ao calor invólucro de plástico delrin (A); abertura retangular de policarbonato janela de plástico (B); base de alumínio da incubadora (C); buracos. a aceitar postes de aço de base (D); buraco de diâmetro 35,1 milímetros com lábio recessed fina no centro de incubadora de base para acomodar pratos GBM 35mm (E); mangueiras Nalgene (conexões entre cultura de tecidos e estágio-top incubadoras; armadilhas umidade) ( F, G, N); cultura de tecidos incubadora (H); aquário bomba (I); hermética caixa de plástico ABS (habitação para bomba de aquário) (J); Erlenmeyer 2000ml (silenciador para a supressão de vibração na mangueira antes da fase-top incubadora) (K); invólucro plástico para ventilador de arrefecimento (L); armação de plástico para 35mm tampa GBM (M); posição de torneiras de plástico (O). Localização dos portos para a administração dos reagentes são indicados por setas amarelas em (II).

Figura 2. Resultados representativos: a regulamentação do transporte mitocondrial A.. Axônio de um neurônio de rato típico do hipocampo em cultura. Mitocôndrias rotulados com uma proteína fluorescente lentivírus-codificados são mostrados em verde; axônios immunolabeled com neurofilamento fosfo-anticorpos são mostrados em vermelho. Extensão do axônio é indicado por setas amarelas. Imagem é composta de quatro micrografias sobrepostas. B. Exemplo de uma série de imagens de lapso de tempo que mostre alterações no movimento mitocondrial após a administração de 5-HT. Imagens foram adquiridas através de um microscópio invertido de fluorescência e armazenadas como seqüências que foram posteriormente convertidos em filmes Quicktime. Uma seqüência de imagens representativas mostras individuais mitocôndrias em diferentes momentos antes (painel esquerdo) e administração (painel direito) após de 8-OH-DPAT, um agonista do receptor 5-HT1A. Retângulo vertical vermelha destaca uma mitocôndria estacionária (esquerda) e uma mitocôndria oscilatório (direita) ao longo de vários pontos do tempo. A mitocôndria oscilatório indicado (painel esquerdo) está se movendo em direção ao terminal axonal após o tratamento com 8-OH-DPAT (painel direito; vermelho com borda setas brancas). A linha vertical amarela (painel direito) indica a posição inicial da mitocôndria em movimento. Intervalos de tempo são mostradas no canto inferior do lado direito de cada frame. Ampliação (63 ×) é indicado no canto inferior direito do painel direito. C, Lotes D. mostre alterações no movimento mitocondrial após a administração de 5-HT. Mudanças no movimento mitocondrial antes (C) e depois (D) administração de 5-HT são apresentados como parcelas de velocidade (eixo X) versus posições iniciais das mitocôndrias individuais ao longo do axônio (eixo Y). Velocidade e proporção de estacionárias (vermelho), oscilatório (azul), e direcional em movimento (verde) mitochondria são representados em gráficos e gráficos de pizza (inserções acima parcelas), respectivamente. Red linhas pontilhadas projetando a partir regiões destacadas do axônio cartoon para o eixo Y de cada parcela indicar a localização aproximada e extensão do segmento axônio que foi fotografada. E, Terrenos F. mostre alterações no movimento mitocondrial após a administração de DA. Mudanças no movimento mitocondrial antes (E) e depois (F) a administração de DA são apresentados como parcelas de velocidade (eixo X) versus posições iniciais das mitocôndrias individuais ao longo do axônio (eixo Y). Velocidade e proporção de estacionárias (vermelho), oscilatório (azul), e direcional em movimento (verde) mitocôndrias são representados em gráficos e gráficos de pizza (inserções acima parcelas), respectivamente. Red linhas pontilhadas projetando a partir regiões destacadas do axônio cartoon para o eixo Y de cada parcela indicar a localização aproximada e extensão do segmento axônio que foi fotografada. G, H. kymographs Representante mostrando movimento mitocondrial em um neurônio cultivadas antes de (G) e depois (H) A administração do agonista do receptor D1R, bromocriptina. O neurônio foi fotografada por uma hora antes (G) e uma hora após a administração (H) de bromocriptina.
Discussão
Empregando lentivírus mediada expressão de uma proteína fluorescente alvejado a mitocôndria em neurônios cultivados infectados e uma incubadora barata laboratório construído estágio-top que permite imagens de células vivas por longos períodos, temos sido capazes de investigar a ligação entre o movimento mitocondrial e os sinais de neuromoduladores , como a serotonina (5-HT), dopamina (DA) e acetilcolina (ACh). Nossos estudos têm ajudado a elucidar uma via de sinalização que, pela primeira vez, links tráfico mitocondrial para mudanças na atividade dos neurônios-modulado por neurotransmissores como a 5-HT e DA - que são o cerne da função neural. Nós achamos que o uso de proteínas fluorescentes alvo permite a observação de mitocôndrias rotulados na vida neurônios cultivados por longos períodos que podem ser mais fisiologicamente relevante do que a duração muito mais curta que são possíveis usando corantes vitais. Além disso, a intensidade do sinal de uma proteína fluorescente nos permite manter os tempos de exposição curtos durante a aquisição de imagem, minimizando a possibilidade de fotodegradação ou fototoxicidade. Finalmente, um estágio-top simples e barato incubadora que mantém a temperatura ambiente, umidade e níveis de CO 2, enquanto minimiza a evaporação da mídia, nos permite acompanhar o movimento mitocondrial em neurônios vivos por horas ou mesmo dias. Pesquisadores que desejam fabricar uma incubadora de estágio-top para as observações a longo prazo de mitocôndrias nos neurônios viver não precisa seguir os detalhes precisos do nosso projeto, desde que as propriedades dos materiais utilizados (por exemplo, o gás membrana permeável para evitar a evaporação da mídia ) e os princípios aplicados (por exemplo, controle de temperatura e umidade, o buffer de manutenção do pH, da osmolaridade) são geralmente consistentes com o que é descrito neste protocolo.
Divulgações
Agradecimentos
Gostaríamos de agradecer Donald Hutson para contribuir seus conhecimentos técnicos e muita habilidade durante o projeto e fabricação da incubadora em estágio superior. Estamos também gratos a Ayda Dashtaei por sua excelente assistência técnica. Todo o trabalho foi apoiado pela Fundação de Pesquisa Neurociências.
Materiais
| Name | Company | Catalog Number | Comments |
| Quantidade | Descrição (e localização na Figura 1) | ||
|---|---|---|---|
| 1 | Cultura de tecidos incubadora (H) | ||
| 1 | Resistente ao calor gabinete plástico (delrin ou comparáveis) (A) | ||
| 1 | Armação de plástico para 35mm tampa GBM (para a aposição de membrana para placa de Petri) (M) | ||
| 02/01 | linear pé Limpar PFTE material da membrana (Teflon) | ||
| 4 | Polegar parafusos de latão | ||
| 2 | Pequena 10kOhm resistores dissipador de calor (usados como elementos de aquecimento no interior estágio-top gabinete incubadora) | ||
| 1 | Transformador (fonte de corrente 9V para resistores) | ||
| 1 | Terrário controlador de temperatura e sonda (regulação termostática de poder para resistores dissipador de calor através de transformador) | ||
| 1 | 2000ml Erlenmeyer (silenciador para a supressão de vibração na mangueira antes da fase-top incubadora) (K) | ||
| 1 | 1 / 8 "folha Sorbothane (junta material para base de estágio-top incubadora) | ||
| 1 | Hermético ABS (ou comparável) caixa de plástico (carcaça para a bomba de aquário) (J) | ||
| 1 | Aquário da bomba (I) | ||
| 1 | Ventilador pequeno computador | ||
| 1 | Invólucro de plástico para ventilador de arrefecimento (L) | ||
| 1 | 9V transformador para computador ventoinha de refrigeração | ||
| 20-30 pés | Nalgene ou silicone mangueira (conexões entre cultura de tecidos e-top estágio incubadoras; armadilhas umidade) (F, G, N) | ||
| 2 | Torneiras de plástico (para abrir e fechar o fluxo de ar antes e depois do estágio-top incubadora) (O) | ||
| 4 | Conectores de bronze farpado mangueira (mangueira para conexões de / para o estágio-top incubadora e gabinete de bomba de aquário) | ||
| 2 | Acopladores de bronze rápida (para conexões de mangueira de / para o estágio-top incubadora) | ||
| 2 | Acopladores de bronze rápida (para conexões de mangueira de / para o estágio-top incubadora) |
Tabela 1. Stage-top incubadora feita com partes:
| Nome do reagente | Companhia | Número de catálogo |
|---|---|---|
| Poli-D-lisina | Sigma-Aldrich | P7280-5mg |
| laminina | Roche Applied Science | 11243217001 |
| 35 milímetros com fundo de vidro pratos | Mattek | P35GC-0-14-C |
| DMEM | Life Technologies | 10567 |
| B27 | Life Technologies | 17504-044 |
| Glutamax | Life Technologies | 35050 |
| Rica em lipídios BSA | Life Technologies | 11020-021 |
| L-Asparagina | Sigma-Aldrich | P0380-100G |
| L-Proline | Sigma-Aldrich | A8381-100G |
| A vitamina B-12 | Sigma-Aldrich | V2876-100mg |
| 5-HT | Sigma-Aldrich | H9523-25mg |
| 8-OH-DPAT | Sigma-Aldrich | H8520-25mg |
| Dopamina | Sigma-Aldrich | H8502-5G |
| Bromocriptina | Sigma-Aldrich | B2134-25mg |
| SKF38393 | Sigma-Aldrich | D047-100mg |
Referências
- Ligon, L. A., Steward, O. Movement of mitochondria in the axons and dendrites of cultured hippocampal neurons. J Comp Neurol. 427, 340-350 (2000).
- Miller, K. E., Sheetz, M. P. Direct evidence for coherent low velocity axonal transport of mitochondria. J Cell Biol. 173, 373-381 (2006).
- Macaskill, A. F. Miro1 is a calcium sensor for glutamate receptor-dependent localization of mitochondria at synapses. Neuron. 61, 541-555 (2009).
- Morris, R. L., Hollenbeck, P. J. Axonal transport of mitochondria along microtubules and F-actin in living vertebrate neurons. J Cell Biol. 131, 1315-1326 (1995).
- Rintoul, G. L., Filiano, A. J., Brocard, J. B., Kress, G. J., Reynolds, I. J. Glutamate decreases mitochondrial size and movement in primary forebrain neurons. J Neurosci. 23, 7881-7888 (2003).
- Crawley, J. N. Current protocols in neuroscience. , J. Wiley. (1999).
- Fedoroff, S., Richardson, A. Protocols for neural cell culture. , 3rd edn, Humana Press. (2001).
- Chen, S., Owens, G. C., Crossin, K. L., Edelman, D. B. Serotonin stimulates mitochondrial transport in hippocampal neurons. Mol Cell Neurosci. 36, 472-483 (2007).
- Chen, S., Owens, G. C., Edelman, D. B. Dopamine inhibits mitochondrial motility in hippocampal neurons. PLoS One. 3, e2804-e2804 (2008).
- Chen, S., Owens, G. C., Makarenkova, H., Edelman, D. B. HDAC6 regulates mitochondrial transport in hippocampal neurons. PLoS One. , e10848-e10848 (2010).
- Curran, M. A., Kaiser, S. M., Achacoso, P. L., Nolan, G. P. Efficient transduction of nondividing cells by optimized feline immunodeficiency virus vectors. Mol Ther. 1, 31-38 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados