Method Article
La neuromodulación y mitocondrial de transporte: Imágenes en vivo en las neuronas del hipocampo durante largos períodos de tiempo
* Estos autores han contribuido por igual
En este artículo
Resumen
Se describe un protocolo que permite imágenes de las mitocondrias en la vida neuronas a través de microscopía de fluorescencia durante largos períodos de tiempo. Imágenes durante períodos prolongados se lleva a cabo a través de lentivirus mediada por la expresión de una proteína mitocondrial, dirigida fluorescentes y el uso de una etapa de bajo costo-top incubadora que fue diseñado y construido en nuestro laboratorio.
Resumen
Para entender la relación entre el transporte mitocondrial y la función neuronal, es fundamental para observar el comportamiento de las mitocondrias en vivo las neuronas cultivadas de duración extendida 1-3. Esto es ahora posible mediante el uso de colorantes vitales y las proteínas fluorescentes con los componentes del citoesqueleto, orgánulos y otras estructuras en las células vivas pueden ser etiquetados y luego visualizados a través de microscopía de fluorescencia dinámica. Por ejemplo, en las neuronas simpáticas embrionarias de pollo, el movimiento se caracterizó mitocondrial utilizando el colorante vital importancia rodamina 123 4. En otro estudio, las mitocondrias se visualizan en las neuronas del cerebro anterior de rata mediante la transfección de mitocondrias objetivo EYFP 5. Sin embargo, las imágenes de las neuronas primarias en cuestión de minutos, horas o incluso días, presenta una serie de cuestiones. La primera de ellas son: 1) el mantenimiento de las condiciones de cultivo, tales como temperatura, humedad y pH durante las sesiones de formación de imágenes de largo, 2) una señal fuerte y estable fluorescentes para asegurar tanto la calidad de las imágenes obtenidas y la medición exacta de la intensidad de la señal durante el análisis de la imagen; y 3) la limitación de los tiempos de exposición durante la adquisición de la imagen para reducir al mínimo y evitar photobleaching fototoxicidad.
Aquí se describe un protocolo que permite la observación, la visualización y análisis del movimiento mitocondrial en cultivos de neuronas del hipocampo de alta resolución temporal y bajo condiciones óptimas de mantenimiento de vida. Hemos construido un escenario económico-top incubadora que proporciona una buena regulación de la temperatura y el flujo de gas atmosférico, y también limita el grado de evaporación de medios, asegurando la estabilidad del pH y osmolaridad. Esta incubadora está conectado, a través de mangueras de entrada y de salida, a un nivel de cultivo de tejidos incubadora, que ofrece un nivel constante de humedad y una atmósfera de 5-10% CO 2 / aire. Este diseño ofrece una alternativa rentable a las incubadoras de microscopio mucho más caros que no necesariamente asegurar la viabilidad de las células durante muchas horas o incluso días. Para visualizar las mitocondrias, que infectan a las células con un lentivirus que codifica una proteína fluorescente roja que se dirige a la mitocondria. Esto asegura una señal fuerte y persistente, que, junto con el uso de una fuente de luz de xenón estable, nos permite limitar el tiempo de exposición durante la adquisición de imágenes y todo, pero se opone a photobleaching y fototoxicidad. Dos puertos de inyección en la parte superior de la incubadora de etapa superior permiten la administración aguda de los neurotransmisores y otros reactivos destinados a modular el movimiento mitocondrial. En suma, lentivirus mediada por la expresión de un orgánulo orientada proteína fluorescente de color rojo y la combinación de nuestra etapa-top incubadora, un microscopio de fluorescencia convencional invertido, cámara CCD, y la fuente de luz de xenón permiten obtener imágenes con lapso de tiempo de transporte mitocondrial en neuronas vivas más prolongados que los que sea posible en los estudios convencionales despliegue colorantes vitales dentro y fuera de la plataforma de sistemas de soporte vital.
Protocolo
1. Descripción del Laboratorio de Piedra Etapa-top Incubadora
Mantener las células vivas en una platina del microscopio para la concesión de prórrogas ofrece tres desafíos principales: 1) control de la temperatura ambiente y la regulación, 2) control de la humedad, es decir, manteniendo el contenido de humedad de la atmósfera ambiental, y 3) el mantenimiento del pH apropiado en el medio de cultivo. Estos temas "soporte vital" son fundamentales para experimentos que implican la observación a largo plazo de los cultivos de neuronas, células que son particularmente sensibles a los cambios de temperatura y pH. A continuación, se describe un simple laboratorio construido etapa superior incubadora que hemos diseñado y construido para imágenes en vivo de las neuronas durante periodos prolongados de tiempo. Esta incubadora está conectado, a través de un circuito cerrado, a un nivel de cultivo de tejidos incubadora (Thermo Scientific, Asheville, NC), que proporciona un establo caliente (37 ° C), atmósfera húmeda de CO2 al 10% / 90% de aire.
- Incubadora de caja: El cuerpo de la incubadora (Figura 1 (I, II); A) se fabricó en una fresadora computarizada C & C a partir de una sólida pieza de plástico negro delrin. Mide 97.74mm (L) x 73.60mm (W) x 28.58mm (H), (dimensiones internas de 96.74mm x 72.60mm x 27.58mm) proporcionar un volumen cerrado de aproximadamente 19.370 cm 3. Dos agujeros fueron perforados en ambos extremos de la caja y equipados con púas de latón roscado para dar cabida a las mangueras de entrada y salida desde / hacia el cultivo de tejidos incubadora. Una abertura rectangular que mide 70.0mm x 43.0mm fue molida a cabo en la parte superior de la carcasa para permitir la colocación de una ventana de plástico de policarbonato (Figura 1 (I, II), B). La base de la incubadora (Figura 1 (I, II, III); C; vista desde arriba y el perfil se muestra en detalle en la parte superior izquierda), fresadas a partir de 03.16 acciones de aluminio ", las medidas de 159.77mm (L) x 109.86mm (W ) x 3.175mm (D), y está diseñado para encajar en el hueco de inserción de un motorizado Leica 3-platina (Modelo 11-522-068, Leica GmbH, Leipzig, Alemania). Cuatro postes de acero con roscas internas se adjunta a . las esquinas de thebase por empotrar tornillos de cabeza plana Estos proporcionan sólidos puntos de fijación para la caja incubadora, que se ha perforado a cabo en cada esquina para aceptar los cargos (Figura 1 (II, III), D). Una junta Sorbothane (McMaster Carr, Inc., Elmhurst, IL) fue cortado y montado en la base para proporcionar un sello en la interfaz del recinto / de base. cuatro tornillos de bronce con rosca equivalente a la de los mensajes se utilizan para asegurar la caja a la base (Figura 1 (II, III);. D) Un agujero de diámetro 35.1mm con un borde empotrado delgada fue cortado en el centro de la base de la incubadora para dar cabida a GBMs 35 mm (Figura 1 (III), E, detalle en la parte superior izquierda); bases adicionales han sido diseñados para adaptarse a otros tamaños de placa de cultivo.
- Los elementos calefactores: Dos resistencias de 10 Kohm disipador de calor (Digi-Key Corp., Thief River Falls, MN) se fijan a las paredes internas del recinto incubador. Estos están conectados a un DC 9 V, transformador de 500 mA que está conectado a un controlador de Vida Artificial 1000W temperatura del terrario (Carolina Pet Supply, Irmo, Carolina del Sur). Una sonda de cable colocado a través de una junta en la ventana de policarbonato de la caja incubadora detecta la temperatura del ambiente interno y determina el flujo de corriente a las resistencias. En conjunto con la incubadora de cultivo de tejidos, las resistencias de proporcionar una medida adicional de control de la temperatura ambiente.
- Sistema cerrado ambiente del circuito: Para proporcionar un ambiente constante humidificado y calentado del aire del 10% de CO 2 / 90%, la incubadora de etapa superior se conecta, a través de mangueras de entrada y de salida (Figura 1 (I), F, G), a una estándar, con camisa de agua de cultivo de tejidos incubadora (Figura 1 (I), H); Forma Scientific modelo 3154, Thermo Scientific, Inc., Asheville, NC). Justo antes de conectarse a la incubadora de etapa superior, el tubo de entrada (Figura 1 (I), F) se encuentra con una bomba de acuario estándar (Figura 1 (I), I; Lifegard QuietOne modelo 1200, Pentair Aquatics, El Monte, CA) que ha sido encerrado en una caja de plástico sellada ABS (Figura 1 (I), J, Modelo 1150, Pelican Products, Inc., Torrance, CA) para mantener un circuito cerrado. Esta bomba promueve el flujo de aire continuo de la incubadora de cultivo de tejidos a la incubadora de etapa superior. Después de la etapa de la bomba, la manguera de entrada se ejecuta a un matraz Erlenmeyer de 1500 ml (Figura 1 (I), K), que actúa como un amortiguador para minimizar la transmisión de la vibración de la bomba a la incubadora de etapa superior. Una manguera de salida (Figura 1 (I), G) que va desde la incubadora de etapa superior a la incubadora de cultivo de tejidos (Figura 1 (I), H) está equipado con un ventilador de ordenador suministrado (Figura 1 (I), L), que, como la bomba, es también la intención de promover el flujo de aire continuo.
- PFTE tapa de la membrana de 35 mm GBM: Antes de colocar la cultura neuronal en la incubadora de etapa superior de la imagen, la MBG de 35 mm está equipado con un especial membrane tapa (Figura 1 (II, IV), M, detalle que se muestra en la parte superior derecha) para permitir el intercambio de gases y al mismo tiempo minimizar la evaporación del medio de cultivo. Esta tapa se compone de un anillo de plástico delrin y una hoja de pre-corte de la membrana de PTFE (Teflon, American Durafilm Co., Inc., Holliston MA) que ha sido estirada sobre el borde y en su lugar con una junta de vitón que se desliza en una canal empotrado en el lateral de la llanta de plástico delrin.
- Puertos de inyección: Dos agujeros fueron perforados en la ventana de policarbonato (Figura 1 (II), el detalle del centro, cerca de las flechas amarillas B) de la incubadora de etapa superior. Estos fueron equipados con acero inoxidable jeringa Hamilton acaba de proporcionar los puertos de inyección para la administración de 5-HT, DA, varios agonistas y antagonistas del receptor, y otros reactivos durante un experimento dado.
2. La preparación de cultivos primarios de hipocampo
Todo el trabajo se lleva a cabo, ya sea en una campana de flujo laminar BSL2 o en un banco de flujo laminar. Primaria las neuronas del hipocampo están aisladas de embriones de rata E18 de acuerdo con los procedimientos estándar de 6.7, y se cultivan en medio libre de suero que ha sido condicionada por los astrocitos corticales primaria. Las células gliales son preparados de acuerdo con los métodos publicados 7. El medio condicionado se compone de glucosa baja DMEM, suplementado con prolina (1,76 ug / ml), asparagina (0,83 ug / ml), vitamina B12 (0,34 ug / ml), la glucosa (20 mM), ricas en lípidos BSA (0,5 mg / ml ) y el 2% de B27 80-10. No antibióticos se añaden al medio ya que pueden interferir con la transcripción de genes neuronales.
- Cubra la parte de vidrio cubreobjetos central de una placa de cultivo de 35 mm con fondo de vidrio (GBM) con poli-D-lisina (0,05 mg / ml en PBS), y dejar reposar durante dos horas a 37 º C. Aspirar la solución de poli-D-lisina, dejar secar durante 20 minutos en una campana de flujo laminar BSL2. Cubrir la parte cubreobjetos poli-D-lisina de la MBG con la laminina (0,01 mg / ml en PBS), y dejar actuar durante un mínimo de 40 minutos antes de retirar el exceso de solución de laminina. Ponga a un lado durante 20 minutos.
- Diseccionar el hipocampo de los cerebros de embriones de rata E18, y se disocian como se describe en los protocolos actuales en Neurociencia 6.
- Diluir las células disociadas en el medio de cultivo para permitir una densidad de 110.000 células por GBM. Calcular la concentración necesaria de las células en su mezcla de maestro de acuerdo con el número de GBMs que se prepara.
- Lugar sembrado GBMs en una incubadora conjunto ATA de 37 ° C y una mezcla de la atmósfera de CO2 al 10% / 90% de aire.
- De tres a cinco días más tarde, dependiendo de las condiciones de crecimiento de las neuronas, añadir arabinósido C (0,14 ng / ml) a las culturas de suprimir la proliferación glial.
- Permita que las culturas de crecer durante dos semanas antes de infectar a los lentivirus. Durante este tiempo, reemplazar un tercio del volumen del medio en cada uno de GBM con medio fresco cada tres días. No exceda de esta cantidad de medios de comunicación, ya que esto puede llevar a un shock osmótico y la muerte celular.
3. Preparación de codificación recombinante Lentivirus Red proteína fluorescente
Para los investigadores que no tienen acceso a las instalaciones para la producción de los lentivirus recombinante, la producción personalizada de un comercial de la entidad, por ejemplo Sistema de Biociencias (Mountain View, CA) es una opción.
A mitocondrialmente de genes diana proteína fluorescente roja (MitoTurboRFP; Axxora LLC, San Diego, CA) se inserta en un auto-inactivación de virus recombinante de la inmunodeficiencia felina bajo el control transcripcional del potenciador del citomegalovirus importante promotor del gen temprano inmediato 11. Lentivirus recombinantes se producen de forma transitoria la transfección de células 293T.
- Placa de células 293T a una densidad de ~ 75.000 células / cm 2, al día siguiente, co-transfectar las células con plásmidos que codifican el vector viral recombinante, gag FIV y genes pol, y el virus de la estomatitis vesicular gen de la glicoproteína G, con Polyjet (SignaGen laboratorios, Gaithersburg, MD). Un total de 12 ug de ADN (4,8 mg vector viral, 4,8 mg gagpol plásmido, y 2,4 mg de plásmido VSV G) se utiliza para cada plato de cultivo de 10 cm de células 293T.
- Después de 24 horas, se aspira el medio de cultivo y las células de lavado con rojo fenol libre de solución salina balanceada de Hanks para extraer el ADN residual. Añadir 10 ml de medio libre de suero neural basal suplementado con 50μg/ml rica en lípidos y Glutamax BSA.
- Al día siguiente, la cosecha del filtro sobrenadante, a través de un filtro de 0,2 micras de proteínas de unión de baja y agregar a una unidad de ultrafiltración Vivaspin 20 polietersulfona (Sartorius, Concord, EE.UU.). Pre-tratamiento de la unidad Vivaspin secuencialmente lavado con etanol al 70% del agua de cultivo de tejidos de grado, y la solución salina de tampón fosfato. Concentrar el virus que contienen sobrenadante ~ 50 veces por centrifugación a 1500xg durante 30 minutos. Alícuota del virus de la preparación y almacenamiento en N2 líquido.
- Estimar la cantidad de virus al infectar las células de ratas B104 con una alícuota del virus concentrado, y medir la expresión de proteínas fluorescentes por citometría de flujo 72 horas después. El porcentaje de células positivas proporciona una estimación de la cantidad de volumen es decir, virus de virus concentrados necesarios para obtener la expresión de proteínas fluorescentes en un número determinado de neuronas primarias.
4. La infección de cultivos de neuronas
Culturas del hipocampo las neuronas infectadas a los 14 días in vitro mediante la simple adición de la cantidad de virus para infectar estima hasta en un 50% de todas las neuronas sobre la base de datos de citometría de flujo. No polibreno se utiliza. Cultivos se mantienen durante 3 días antes de comprobar si la expresión de proteínas fluorescentes. Si la señal es demasiado débil, entonces la cultura se devuelve a la incubadora de cultivo de tejidos y nuevamente después de varios días.
5. Mantenimiento General del Sistema de Circuito Cerrado de Soporte de Vida
- Para mantener la humedad adecuada, asegúrese de que la chaqueta de la incubadora de agua se verifica periódicamente y se llena cuando sea necesario. Asegúrese de colocar una bandeja de acero inoxidable o de aluminio dentro de la incubadora que contiene una pequeña cantidad de agua (25 mm de profundidad) y alguicida.
- Cuando sea necesario, desactive la mangueras de entrada y salida del circuito de la atmósfera incubadora al vaciar el agua recogida de los tubos de captación. Periódicamente las mangueras al ras con el 70% de etanol.
6. La aplicación de la tapa de membrana para GBM y la colocación en la etapa-top Incubadora
- Antes de la colocación de la membrana basal dentro de la incubadora etapa superior, colocar la tapa de plástico con la tapa de la membrana de la cubierta en una campana de cultivo de tejidos. Una vez hecho esto, puedes mover la membrana basal cubierto para el microscopio.
- Cuidadosamente el asiento del GBM con la membrana cubierta de tapa en la apertura empotrada en la base de la incubadora de etapa superior. Para evitar empujones del GBM, asegúrese de que la base ya está en su lugar en la platina del microscopio, ya que la base de clips en la etapa con cierta dificultad, lo mejor es colocar la membrana basal después de la base está en la posición.
- Alinear la caja de incubación de los postes de acero en la base de la incubadora e inferior del recinto a la base. Apriete los tornillos hasta que un buen sellado se logra entre caja y la base.
7. Adquisición de imágenes
Tenga en cuenta que la mayoría de las plataformas disponibles del software de imágenes tienen una funcionalidad comparable a través de una amplia gama de microscopios y equipos relacionados. Una variedad de adquisición de imágenes y análisis de las plataformas de software están disponibles, incluyendo MetaMorph y programas diseñados para marcas específicas de microscopio, como Leica Application Suite, Nikon NIS elementos, y AxioVision Carl Zeiss. En este protocolo, se describe la adquisición de imágenes y procedimientos de análisis se realizó utilizando Slidebook 5 (Imagen Inteligente Innovaciones, Denver, CO). Sin embargo, los pasos constitutivos de cada operación que se describe en este protocolo se puede adaptar fácilmente para el uso de una variedad de otros programas.
Descripción del microscopio invertido de fluorescencia, las configuraciones de filtro, una cámara CCD, la fuente de luz de xenón, y software de imagen:
De imágenes dinámicas del transporte mitocondrial en las neuronas del hipocampo, se utiliza una Leica DMI-6000B microscopio invertido de fluorescencia y Modelo 11-522-068 platina (Leica Microsystems CMS GmbH, Wetzlar, Alemania) equipado con un ecualizador de Cooke Sensicam cámara CCD (El Cooke Corporation, Detroit, MI), un Sutter Lambda 10-2 rueda de filtros y el controlador (la compañía de Sutter Instrument, Novato, CA), y Sutter DG-4 300W fuente de luz de xenón. Para visualizar las mitocondrias marcadas con la proteína fluorescente de color rojo MitoTurbo, se utiliza la combinación de un filtro de 555nm en la fuente de la Dirección General de la luz-4 para la excitación y filtros de 600 nm (pico; Sedat Divisor de haz cuádruple Modelo 86100bs instalado en Leica DM cubo serie de filtros, tecnología Chroma Corp., Bellows Falls, VT) y 617nm en el microscopio y la rueda de filtros, respectivamente, para la emisión.
Para la adquisición y análisis de imágenes, se utiliza el microscopio de imagen digital paquete de software Slidebook 5. Este es un paquete completo que permite el control automatizado del microscopio, el escenario, rueda de filtros, la cámara y fuente de luz durante la adquisición de la imagen, así como una variedad de módulos de procesamiento de imágenes y análisis.
A continuación, ofrecemos específicos, paso a paso las instrucciones para la adquisición de imágenes de lapso de tiempo de las mitocondrias en las neuronas en movimiento marcado con fluorescencia utilizando Slidebook 5.
- Asegúrese de que el microscopio, el controlador de la rueda de filtros, fuente de luz y una cámara CCD se han activado antes de la apertura de Slidebook 5.
- Para imágenes en vivo de las mitocondrias, cambiar a un 63X de inmersión en aceite objetivo, reducir la torreta objetivo lo suficiente como para facilitar el acceso al objetivo por debajo de la platina del microscopio (y la etapa-Top incubadora), y aplicar cuidadosamente el aceite directamente a la superficie del objetivo. Abra la ventana activa, haga clic en el icono de la 'Ventana de enfoque "en la barra de herramientas Slidebook. En el foco de la ventana, se encienda el indicador campo claro, deslizando un deslizador como 'lámpara' para ajustar la intensidad de campo claro a un nivel adecuado. Adquisición de centrarse en un campo de las células y encontrar una célula de interés.
- En el marco del "Alcance", seleccione el 'CY3' fluor. Usando los oculares, con iluminación fluorescente encontrar el plano de enfoque para las mitocondrias en las células que han sido etiquetados con la proteína Mito TurbRed. Una vez que han adquirido a través de los oculares enfoque, cambiar a la cámara CCD y volver a adquirir enfoque si es necesario.
- Abra la ventana de captura de imágenes haciendo clic en el icono de 'Captura de Imagen "en la barra de herramientas Slidebook. Comenzando con un tiempo de exposición inicial de 100 ms, encontrar el tiempo óptimo de la exposición con el 'Test' y 'encontrar el mejor' botones, como alternativa, puede usar el 'Once' botón. Recuerde que el tiempo de exposición debe proporcionar la intensidad de una amplia difusión en todo el campo de imagen (por ejemplo, 0-2500, indicado por el histograma en la parte inferior de la ventana de captura de imágenes) en un tiempo mínimo (por ejemplo, 200-800ms).
- Antes de iniciar el lapso de tiempo de adquisición de imágenes, abrir el "Opciones avanzadas" ventana haciendo clic en la pestaña "Avanzado" aún dentro de la ventana de captura de imágenes. Encontrar el "foco" pestaña, seleccione la 'Autofous' en la opción time-lapse/multipoint captura, y los ajustes de enfoque automático para la adquisición de la imagen de lapso de tiempo. Generalmente, utilizamos los siguientes parámetros para el enfoque automático: enfoque de actualización cada 2-3 marcos; seleccionar el enfoque automático como el canal de flúor utilizados para obtener imágenes de la etiqueta mitocondrias, es decir, CY3; rango de búsqueda para un total de 2 um aumento 63x.
- En la 'captura' ventana, en la casilla "Tipo de captura ', marque la opción" Timelapse "y seleccione el intervalo de imagen deseada y la duración de la sesión de imágenes en las opciones de' Captura Timelapse". En nuestros estudios de los efectos de los neuromoduladores en el transporte mitocondrial, time-lapse de imágenes se realizó en sesiones de una hora en la que se adquirieron un total de 360 imágenes a intervalos de 10 segundos entre imágenes.
- Inicio lapso de tiempo de adquisición de imágenes haciendo clic en el botón "Inicio" en la parte inferior, derecha, de la "captura" de la ventana.
- Después de la inicial, o el control, sesión de imágenes, administración de los neurotransmisores y otros reactivos a través de los puertos de la parte superior de la incubadora de etapa-top y comenzar una nueva sesión de imágenes.
8. Análisis de Imágenes
- Abra el archivo de imagen guardado después de la sesión de imágenes pasado.
- Individuales mitocondrias pueden ser etiquetados en una serie de imágenes de lapso de tiempo de forma automática o manualmente mediante el empleo de las funciones de enmascaramiento siempre en Slidebook 5.
- Bajo la "Máscara" del menú, seleccione "segmento" de la barra de menús. Al deslizar la línea de umbral bajo y alto de la "histograma" herramienta, enmascarando todas las partículas de color azul en la imagen completa, que abarca todas las mitocondrias contenidas en el proceso, pero dejando las partículas de lo más discreto posible. Aplicar la máscara de la serie de imagen.
- Crear una segunda máscara (bajo la "Máscara" del menú, seleccione "Crear") que cubre toda la imagen, excepto para el proceso de interés en que las partículas se ha destacado por la máscara anterior. Esto se logra, en primer lugar, utilizando la herramienta "lápiz" la parte más gruesa para trazar los límites de las zonas fuera del proceso, y luego, usando la herramienta "cubo de pintura para rellenar las regiones limitadas. Aplique esta mascarilla a la serie de imagen.
- En "Máscara", "Operaciones de la máscara de" seleccionar y realizar "menos" la operación, es decir, la segunda máscara se resta de la máscara de puño (la imagen completa, excepto el proceso). Una tercera máscara se generará en el que sólo el proceso de interés se pone de relieve. Tenga en cuenta que esta nueva máscara se aplica a la serie de imagen.
- Bajo "Anotaciones", seleccione "ID de objeto.
- Verificar la continuidad y la asignación numérica de cada uno de enmascarados mitocondrias revisando manualmente la serie de imágenes (en Slidebook 5, el 'juego', 'cuadro hacia adelante "y" retroceso de cuadro,' botones debajo de la ventana de la imagen se puede utilizar para este propósito).
- Seleccione la "Máscara" pestaña en la barra de menú. En 'Máscara', 'de rastreo de partículas "y seleccione" Seguimiento de las partículas básicas' run para generar "Estadísticas Camino", incluidas las coordenadas del centroide de cada mitocondria enmascarados.
- Distancia recorrida por cada mitocondria entre dos cuadros de imagen adyacente se calcula a partir de las coordenadas de cada partícula en cada fotograma.
- En nuestros estudios anteriores sobre el efecto de los neuromoduladores en el movimiento de las mitocondrias, se identificaron tres poblaciones distintas de las mitocondrias:. "Estacionario", "oscilatorios", y "direccional en movimiento" Si una mitocondria viaja a menos de 0,2 um (o píxeles 2, bajo ampliación de 63X, 1 píxel = 0,10235 UM) en una hora, que se caracteriza por ser "estacionaria". Si una mitocondria se mueve por lo menos 0,2 um, pero menos de 2.5 um, en un ciclo anterógrada, retrógrada, que se define como "oscilante". Por último, si una mitocondria recorre una distancia neta de más de 2,5 um en una dirección, que se clasifica como el movimiento direccional. Muestra en la Figura 2 es un histograma que muestra el movimiento de todas las mitocondrias etiquetados en un experimento representativo, así como un gráfico circular que muestra la distribución porcentual de las tres poblaciones distintas de las mitocondrias.
- Velocidad media de cada mitocondria se calcula de acuerdo a la distancia total recorrida durante una sesión de imágenes dadas. La velocidad media de una población mitocondrial se calcula sumando las velocidades individuales y dividiéndolo por el número total de mitocondrias seguimiento.
- Kymographs pueden ser generados usando un módulo establecido en Slidebook 5. Uso de la "Máscara" función, dibujar una línea delgada a través de toda la extensión de un determinado proceso (por ejemplo axón), asegúrese de pasar por tantos centroides mitocondrial como sea posible. Vaya a la "Máscara" pestaña en la barra de menú y selecciona "Operaciones avanzadas," y luego "análisis de la curva suave". Utilizar la configuración predeterminada para el análisis de curva suave o personalizar a su gusto. Ejecute el módulo de análisis de la curva suave. Al final del análisis, un quimógrafo de la sesión de imágenes en la pantalla.
- Ir a la barra de menú y "Ver", selecciona y luego en 'Exportar TIFF.
- Abra el archivo. Tif contiene el quimógrafo en Photoshop o un programa de procesamiento de imagen comparable y convertir la imagen a escala de grises invertida.
9. Resultados representante
Mediante el seguimiento y análisis del movimiento mitocondrial en cultivos de neuronas del hipocampo, que han demostrado un vínculo entre la neuromodulación y el tráfico de las mitocondrias. Específicamente, encontramos que la serotonina (5-HT) o el agonista de los receptores 5-HT 1A, 8-OH-DPAT, estimula el movimiento de las mitocondrias (Figura 2A-C) 8, mientras que la dopamina (DA) o el agonista de los receptores D2, la bromocriptina inhibe movimiento de las mitocondrias (Figura 2-G) 9.
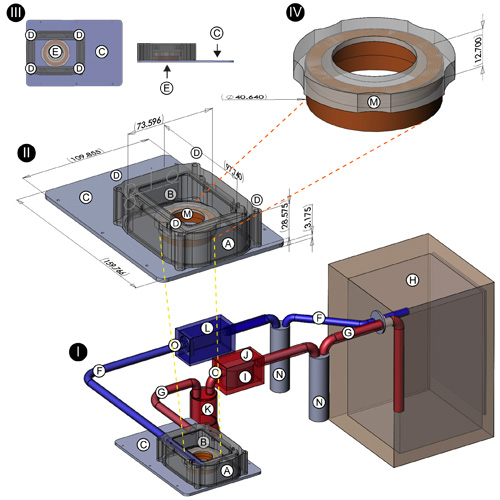
Figura 1. Diseño de la etapa superior del sistema de circuito cerrado de incubadora de los siguientes componentes del sistema de incubadoras se muestran: resistente al calor caja de plástico delrin (A); abertura rectangular para ventana de policarbonato de plástico (B), base de aluminio de la incubadora (C); agujeros. para aceptar los postes de acero de base (D), 35.1mm de diámetro con labio empotrado delgada en el centro de la incubadora de base para acomodar los platos de 35 mm GBM (E); mangueras Nalgene (conexiones entre el cultivo de tejidos y la etapa superior, incubadoras, trampas de humedad) ( F, G, N); incubadora de cultivo de tejidos (H), bomba de acuario (I); hermética caja de plástico ABS (alojamiento de la bomba de acuario) (J), 2000 ml Erlenmeyer (silenciador para la supresión de vibraciones en la manguera antes de la etapa-top incubadora) (K); caja de plástico para el ventilador de refrigeración (L); marco de plástico de 35 mm la tapa GBM (M), la posición de las llaves de paso de plástico (O). Ubicación de los puertos para la administración de los reactivos se indican con flechas amarillas en (II).

Figura 2. Los resultados representativos: la regulación del transporte mitocondrial A.. Axón de una neurona del hipocampo de ratas típicas de la cultura. Las mitocondrias marcadas con una proteína fluorescente lentivirus codificados se muestran en verde, los axones immunolabeled con anticuerpos fosfo-neurofilamentos se muestran en rojo. Extensión de los axones se indica mediante flechas de color amarillo. La imagen se compone de cuatro micrografías se superponen. B. Ejemplo de una serie de imágenes de lapso de tiempo que muestra los cambios en el movimiento mitocondrial después de la administración de 5-HT. Las imágenes fueron adquiridas a través de un microscopio de fluorescencia invertido y se almacenan como secuencias que más tarde se convirtieron en películas de QuickTime. Una secuencia de imágenes muestra representativa de cada mitocondria, en diferentes momentos antes (izquierda) y después (derecha) la administración de 8-OH-DPAT, un agonista del receptor 5-HT1A. Vertical rectángulo rojo destaca una mitocondria fijas (izquierda) y una mitocondria oscilatorio (derecha) a través de múltiples puntos de tiempo. La mitocondria oscilatorio se indica (izquierda) se está moviendo hacia la terminal del axón después del tratamiento con 8-OH-DPAT (panel de la derecha, con borde rojo puntas de flecha blanca). La línea vertical amarilla (derecha) indica la posición inicial de la mitocondria en movimiento. Intervalos de tiempo se muestran en la parte inferior esquina derecha de cada cuadro. Ampliación (63 x) se indica en la esquina inferior derecha del panel de la derecha. C, D. Parcelas de cambios en el movimiento mitocondrial después de la administración de 5-HT. Cambios en el movimiento antes de las mitocondrias (C) y después (D) la administración de 5-HT se presentan como las parcelas de la velocidad (eje X) vs posiciones iniciales de cada uno de las mitocondrias a lo largo del axón (eje Y). La velocidad y la proporción de fijos (rojo), oscilatorio (azul), y en movimiento direccional (verde) mitochondria están representados en las parcelas y los gráficos circulares (inserciones por encima de las parcelas), respectivamente. Las líneas rojas de puntos que sobresalen de las regiones destacadas del axón de dibujos animados para el eje de cada parcela indican la ubicación aproximada y la extensión del segmento de los axones que fue fotografiada. E, F. Parcelas de cambios en el movimiento mitocondrial después de la administración de la DA. Cambios en el movimiento antes de las mitocondrias (E) y después (F) la administración de DA se presentan como las parcelas de la velocidad (eje X) vs posiciones iniciales de cada uno de las mitocondrias a lo largo del axón (eje Y). La velocidad y la proporción de fijos (rojo), oscilatorio (azul), y en movimiento direccional (verde) las mitocondrias están representados en las parcelas y los gráficos circulares (por encima de las inserciones parcelas), respectivamente. Las líneas rojas de puntos que sobresalen de las regiones destacadas del axón de dibujos animados para el eje de cada parcela indican la ubicación aproximada y la extensión del segmento de los axones que fue fotografiada. G, H. kymographs Representante mostrando el movimiento de las mitocondrias en las neuronas cultivadas antes (G) y después (H) la administración del agonista de los receptores D1R, bromocriptina. La neurona fue fotografiada durante una hora antes (G) y después de una hora (H) la administración de bromocriptina.
Discusión
El empleo de lentivirus mediada por la expresión de una proteína fluorescente dirigidos a la mitocondria en cultivos de neuronas infectadas y un bajo costo de laboratorio construido etapa superior incubador que permite imágenes de células vivas para la concesión de prórrogas, que han sido capaces de investigar la relación entre el movimiento mitocondrial y señales de neuromoduladores , como la serotonina (5-HT), dopamina (DA), y la acetilcolina (ACh). Nuestros estudios han contribuido a esclarecer una vía de señalización que, por primera vez, los enlaces tráfico mitocondrial de los cambios en la actividad de las neuronas-modulado por neurotransmisores como la 5-HT y DA - que están en el corazón de la función neural. Nos encontramos con que el uso de proteínas fluorescentes dirigidas permite la observación de las mitocondrias en la etiqueta que viven las neuronas cultivadas durante largos períodos que pueden ser fisiológicamente más relevante que la duración mucho más corta que son posibles con colorantes vitales. Además, la intensidad de la señal de la proteína fluorescente que nos permite mantener los tiempos de exposición a corto durante la adquisición de la imagen, reduciendo al mínimo la posibilidad de photobleaching o fototoxicidad. Por último, una etapa superior sencillo y barato incubadora que mantiene la temperatura ambiente, humedad, y los niveles de CO 2, mientras se minimiza la evaporación de los medios de comunicación, nos permite seguir el movimiento de las mitocondrias en el que viven las neuronas durante horas o incluso días. Los investigadores que deseen fabricar una incubadora de etapa superior de las observaciones a largo plazo de las mitocondrias en neuronas vivas no necesita seguir los detalles precisos de nuestro diseño, siempre que las propiedades de los materiales utilizados (por ejemplo, la membrana permeable a los gases para evitar la evaporación de los medios de comunicación ) y los principios aplicados (por ejemplo, control de temperatura y humedad, de amortiguación del pH, el mantenimiento de la osmolaridad) son generalmente consistentes con lo que se describe en este protocolo.
Divulgaciones
Agradecimientos
Nos gustaría dar las gracias a Donald Hutson por contribuir con su experiencia técnica y una gran habilidad en el diseño y la fabricación de la incubadora de etapa superior. También estamos agradecidos a Ayda Dashtaei por su excelente asistencia técnica. Todo el trabajo fue apoyado por la Fundación de Investigación de Neurociencias.
Materiales
| Name | Company | Catalog Number | Comments |
| Cantidad | Descripción (y ubicación en la Figura 1) | ||
|---|---|---|---|
| 1 | Incubadora de cultivo de tejidos (H) | ||
| 1 | Resistente al calor, caja de plástico (delrin o similar) (A) | ||
| 1 | Marco de plástico de 35 mm la tapa GBM (para la colocación de membrana a una caja de petri) (M) | ||
| 2.1 | pies lineales claras PTFE (Teflón) de la membrana de material | ||
| 4 | Tornillos de bronce del pulgar | ||
| 2 | Pequeñas resistencias disipador 10kOhm (utilizados como elementos de calefacción dentro de la etapa superior de la caja-incubadora) | ||
| 1 | Transformador (fuente de corriente de 9V a las resistencias) | ||
| 1 | Terrario controlador de temperatura y de la sonda (regulación termostática de la energía a las resistencias del disipador de calor a través de transformador) | ||
| 1 | Erlenmeyer de 2000 ml (silenciador para la supresión de vibraciones en la manguera antes de la etapa superior-incubadora) (K) | ||
| 1 | 1 / 8 "hoja de Sorbothane (material de la junta para la base de la etapa superior-incubadora) | ||
| 1 | Hermético ABS (o similar) caja de plástico (de vivienda para la bomba de acuario) (J) | ||
| 1 | Bomba de acuario (I) | ||
| 1 | Equipo pequeño ventilador de refrigeración | ||
| 1 | Carcasa de plástico para ventilador de refrigeración (L) | ||
| 1 | 9V transformador para el ventilador de refrigeración del ordenador | ||
| 20-30ft | Manguera de Nalgene o de silicona (las conexiones entre el cultivo de tejidos y las incubadoras de etapa superior, atrapa la humedad) (F, G, N) | ||
| 2 | Llaves de plástico (para abrir y cerrar el flujo de aire antes y después de la etapa superior-incubadora) (O) | ||
| 4 | De púas de latón conectores de manguera (para las conexiones de la manguera hacia / desde la etapa-top incubadora y el recinto de la bomba de acuario) | ||
| 2 | Enchufes de bronce (para las conexiones de la manguera a / desde el escenario-top incubadora) | ||
| 2 | Enchufes de bronce (para las conexiones de la manguera a / desde el escenario-top incubadora) |
Tabla 1. Etapa superior incubadora partes:
| Nombre del reactivo | Empresa | Número de catálogo |
|---|---|---|
| Poli-D-lisina | Sigma-Aldrich | P7280-5MG |
| laminina | Roche Applied Science | 11243217001 |
| 35 mm con fondo de cristal platos | MatTek | P35GC-0-14-C |
| DMEM | Tecnologías de la Vida | 10567 |
| B27 | Tecnologías de la Vida | 17504-044 |
| Glutamax | Tecnologías de la Vida | 35050 |
| Ricas en lípidos BSA | Tecnologías de la Vida | 11020-021 |
| L-asparagina | Sigma-Aldrich | P0380-100G |
| L-prolina | Sigma-Aldrich | A8381-100G |
| La vitamina B-12 | Sigma-Aldrich | V2876-100MG |
| 5-HT | Sigma-Aldrich | H9523-25MG |
| 8-OH-DPAT | Sigma-Aldrich | H8520-25MG |
| La dopamina | Sigma-Aldrich | H8502-5G |
| Bromocriptina | Sigma-Aldrich | B2134-25MG |
| SKF38393 | Sigma-Aldrich | D047-100MG |
Referencias
- Ligon, L. A., Steward, O. Movement of mitochondria in the axons and dendrites of cultured hippocampal neurons. J Comp Neurol. 427, 340-350 (2000).
- Miller, K. E., Sheetz, M. P. Direct evidence for coherent low velocity axonal transport of mitochondria. J Cell Biol. 173, 373-381 (2006).
- Macaskill, A. F. Miro1 is a calcium sensor for glutamate receptor-dependent localization of mitochondria at synapses. Neuron. 61, 541-555 (2009).
- Morris, R. L., Hollenbeck, P. J. Axonal transport of mitochondria along microtubules and F-actin in living vertebrate neurons. J Cell Biol. 131, 1315-1326 (1995).
- Rintoul, G. L., Filiano, A. J., Brocard, J. B., Kress, G. J., Reynolds, I. J. Glutamate decreases mitochondrial size and movement in primary forebrain neurons. J Neurosci. 23, 7881-7888 (2003).
- Crawley, J. N. Current protocols in neuroscience. , J. Wiley. (1999).
- Fedoroff, S., Richardson, A. Protocols for neural cell culture. , 3rd edn, Humana Press. (2001).
- Chen, S., Owens, G. C., Crossin, K. L., Edelman, D. B. Serotonin stimulates mitochondrial transport in hippocampal neurons. Mol Cell Neurosci. 36, 472-483 (2007).
- Chen, S., Owens, G. C., Edelman, D. B. Dopamine inhibits mitochondrial motility in hippocampal neurons. PLoS One. 3, e2804-e2804 (2008).
- Chen, S., Owens, G. C., Makarenkova, H., Edelman, D. B. HDAC6 regulates mitochondrial transport in hippocampal neurons. PLoS One. , e10848-e10848 (2010).
- Curran, M. A., Kaiser, S. M., Achacoso, P. L., Nolan, G. P. Efficient transduction of nondividing cells by optimized feline immunodeficiency virus vectors. Mol Ther. 1, 31-38 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados