Method Article
A Cultura da Motor Primário e neurônios sensoriais no Media Definidas em electrospun Poly-L-ácido lático nanofibras Andaimes
Neste Artigo
Resumo
Fibras alinhadas electrospun direcionar o crescimento de neurônios in vitro e são um componente potencial de andaimes regeneração nervosa. Nós descrevemos um procedimento para elaborar substratos fibra electrospun e da cultura livre de soro-sensorial primário de ratos E15 (DRG) e neurônios motores. Visualização de neurônios por imunocitoquímica também está incluído.
Resumo
Eletrofiação é uma técnica para a produção de micro-escala nanométrica para fibras. Fibras podem ser electrospun com diferentes graus de alinhamento, de altamente alinhado completamente ao acaso. Além disso, as fibras pode ser girado de uma variedade de materiais, incluindo polímeros biodegradáveis, tais como poli-L-láctico (PLLA). Estas características tornam as fibras electrospun adequado para uma variedade de aplicações andaime em engenharia de tecidos. Nosso foco é sobre o uso de fibras electrospun alinhados para a regeneração do nervo. Nós temos mostrado previamente que as fibras alinhadas electrospun PLLA direcionar o crescimento de ambos os neurônios sensoriais e motoras primária in vitro. Sustentamos que o uso de um sistema primário de cultura de células é essencial quando se avalia biomateriais para os neurônios modelo real encontrada in vivo, tanto quanto possível. Aqui, descrevemos técnicas utilizadas em nosso laboratório para electrospin andaimes fibroso e cultura explantes gânglios da raiz dorsal, bem como dissociar os neurônios sensoriais e motoras, em andaimes electrospun. No entanto, o electrospinning e / ou técnicas de cultura aqui apresentados são facilmente adaptadas para uso em outras aplicações.
Protocolo
1. Poli-L-láctico (PLLA) Spinning Solution
- Dissolver 0,4 g PLLA em 9 mL de clorofórmio por agitação em fogo baixo.
- Adicionar 1 mL dimetilformamida para a solução, trazendo a concentração final da solução para PLLA 4% (w / v) em clorofórmio: DMF 9:1 (v / v).
- Coloque a solução em um polipropileno ou seringa de vidro com uma ponta de metal blunt 23ga.
2. Spinning Preparação do Substrato 1
- Faça uma solução de 8% (w / v) de PLGA 85:15 (poli-lático-co-glicólico ácido) em clorofórmio por agitação em fogo baixo.
- Revestimento de vidro limpo lamínulas em PLGA cobrindo a superfície de cada lamínula com a solução de PLGA. Permitir que o PLGA para secar a uma película fina (aprox. 30 min).
3. Eletrofiação 2
- Seguro PLGA tampa de vidro revestido desliza para colecionador com fita de carbono condutora. Para fibras alinhadas, o coletor é uma roda motorizada. Para fibras aleatórias, o coletor é uma placa estacionária.
- Seringa lugar na ponta da bomba com 20 cm de roda de colecionador. Conjunto de bomba a cerca de 2 mL / hr e se estiver usando uma roda, conjunto do motor para 300-400 RPM. Se possível, aplique um viés -2 kV DC para o coletor e 15 kV a ponta de metal. Na ausência de acesso a uma fonte de alimentação bipolar, terra do coletor.
- Fibras será jato da ponta da seringa e recolher na roda girando. Continue girando até que a densidade desejada de fibras é obtido. Passe a ponta de metal com uma toalha de papel afixado a uma haste não-condutor periodicamente para evitar entupimento na ponta.
4. Moating 1
- Spinning seguinte, 'fosso' as amostras electrospun pipetando uma linha de PLGA em todo o perímetro da lamínula. Permitir que o PLGA para secar. Isto irá manter o alinhamento das fibras durante a cultura.
5. Revestimento de proteína
- Fibras de vidro electrospun e controles precisam ser revestidas em proteínas antes de cultura de células. Cobrir os substratos em uma solução de proteína, pelo menos, uma hora e depois aspirar o excesso de solução e continuar aspirando até os substratos estão secos. Soluções de proteína possíveis incluem: PLL (poli-L-lisina) (100 mcg / mL), laminina (25 mcg / mL) ou fibronectina (50 mcg / mL). Se PLL é utilizado, os substratos devem ser lavados em água estéril e seco duas vezes após o revestimento inicial.
6. Obtenção de embriões de ratos 3 E15
* Todos os experimentos foram feitos de acordo com o Guia de NIH para Cuidado e Uso de Animais de Laboratório, aprovado pela Universidade de Michigan Comissão de Uso e Cuidados dos Animais.
- Preparação: Verifique se o animal está grávida. Descongelar 3 mL de tripsina, 3 mL FBS e uma garrafa quente do L15. Fogo polonês uma pipeta Pasteur. Desinfectar todos os instrumentos cirúrgicos em etanol 70% por 30 min.
- Preparar e aquecer media chapeamento (ver Tabela 1).
- Eutanásia: Realizar uma injeção IP de cetamina / xilazina. Esperar 10-15 minutos e verificar se há falta de córnea e pedal reflexos de retirada. Uma vez que os reflexos estão ausentes, execute uma injeção de pentobarbital IC (FatalPlus).
- Tenda a pele do abdômen. Corte através da pele e camadas musculares para expor a cavidade abdominal. Localize o útero e retirá-la no colo do útero e ovários.
- Remoção dos embriões do útero com uma tesoura e coloque-os imediatamente em L15 quente. (Todos os seguintes procedimentos sejam concluídos em um microscópio de dissecação e embriões e os cabos devem ser dissecados submerso em L15 quente em todos os momentos.) Decapite os embriões fechando forceps em torno do queixo e abaixo do osso occipital do crânio.
7. Dissecção 3
- Coloque o embrião de um lado. Proteger a medula espinhal com um conjunto de pinças enquanto usa o outro conjunto para descascar afastado membros e órgãos abdominais.
- Vire o embrião e mantê-lo firme com um conjunto de fórceps. Snip ao longo do comprimento do embrião, do pescoço à cauda, até que o cabo inteiro é exposto.
- Segure a extremidade do cabo com cuidado e puxe-o sobre si mesmo para a cauda para remover. O cabo vai puxar livre com membrana e gânglios da raiz dorsal (DRG) em anexo.
- Se DRG explante ou cultura dissociada neurônio sensorial é a ser executada, o DRG snip fora o cabo e transferi-los para um prato de doce L15 quente.
- DRG para a cultura de explantes, pule para o passo 10,2
- Para a cultura neurônio sensorial dissociada, pule para o passo 9
- Para motor a cultura de neurônios, o DRG serão removidos com a membrana no passo 7,5
- Remover a membrana da medula espinhal, segurando-o na extremidade superior da medula e peeling-lo para baixo, semelhante ao de remover uma meia longa. Repita o procedimento para todos os embriões e depois cortar as cordas em pequenos (2-3 mm) peças.
- Despeje os cabos cortados e L15 em um cone, girando em 1000 RPM por 2-3 min para agregar as peças.
- Deitar fora o sobrenadante e adicionar 3 mL de tripsina para os cabos peletizada. Incubar em banho-maria a 37 ° C por 20 min.
- Adicionar 3 mL FBS a cônica e girar a 1000 RPM por 2-3 min para re-pellet.
- Deitar fora o sobrenadante e casaco de um incêndio polido Pasteur pipeta com FBS.
- Adicionar uma pipeta Pasteur cheio de L15 para a cônica e depois triturar delicadamente até obter uma solução homogênea, sem grumos visíveis. Evitar bolhas.
- Prepare uma solução de 9% do Optiprep em L15. Prepare um tubo com 3 mL da solução Optiprep para cada dois embriões (se houver um número ímpar de embriões, arredondar para cima).
- Gota a solução homogeneizada para a solução Optiprep, dividindo-o igualmente entre todos os tubos. Girar os tubos a 2000 RPM por 15 min.
- Recolher com cuidado o topo 2 mL de cada tubo e piscina em um 50 mL cônico. Preencher o cônico com L15 e girar a 1000 RPM por 5 minutos para enxaguar as células do Optiprep.
- Deitar fora o sobrenadante e ressuspender as células em uma pequena quantidade de media chapeamento (250-500 mL). Contar as células usando a exclusão de tripan azul para identificar as células vivas. Pule para o passo 10,1
9. Sensoriais Neuron Processing (SN) 7
- Despeje o DRG removido da medula espinhal e L15 em um tubo cônico e giram a 1000 RPM por 2-3 min para agregar as peças.
- Deitar fora o sobrenadante e adicionar 3 mL de tripsina ao DRG peletizada. Incubar em banho-maria a 37 ° C por 10 min.
- Adicionar 3 mL FBS a cônica e girar a 1000 RPM por 2-3 min para re-pellet.
- Deitar fora o sobrenadante e casaco de um incêndio polido Pasteur pipeta com FBS.
- Adicionar uma pipeta Pasteur cheio de L15 para a cônica e depois triturar delicadamente até obter uma solução homogênea, sem grumos visíveis. Evitar bolhas.
- Girar o homogeneizado a 1000 RPM por 5 min. Deitar fora o sobrenadante e ressuspender as células em uma pequena quantidade de media plating SN (250-500 mL). Contar as células usando a exclusão de tripan azul para identificar as células vivas. Continue até a etapa 10,1
10. Revestimento e Cultura
- Para SN dissociados ou cultura MN:
- Cobrir os substratos com algumas gotas de mídia em seguida, adicione um volume adequado de suspensão celular. Células dissociadas devem ser banhados com uma densidade baixa (25-50 células / mm 2). Permitir que as células a aderir, pelo menos, uma hora antes de inundar os poços com a mídia.
- DRG para a cultura de explantes:
- Cobrir os substratos com algumas gotas de mídia em seguida, adicione DRG para a mídia. Organizar o DRG para que eles estão uniformemente distribuídas em todo o substrato (aproximadamente 4 DRG vai caber em um pedaço 22x22 mm capa). Permitir que o DRG para aderir por pelo menos 4 horas antes da inundação dos poços com a mídia.
- Culturas pode ser mantido por até 4 dias sem mudança de mídia. Para culturas mais, as mudanças meia media deve ser feito com alimentação de mídia. Alimentação de mídia é a mesma composição que media plating menos a L-glutamina.
11. Imunocitoquímica 1,5,8
- Fixação células: media Aspirar e substituir com calorosa PFA 4% (paraformaldeído) por 30 min. Em seguida, executar 3X 5 min lava 1x PBS.
- Bloqueio / permeabilização: Prepare bloco / perm solução (1,25% de soro albumina bovina em 1X PBS, 0,05% Triton X-100 e 2,0% de soro de cabra normal). Aspirar PBS e aplicar bloco / perm solução para amostras por 30 minutos. Em seguida, executar 1X 5 min lava 1x PBS.
- Anticorpo primário: Prepare a solução de anticorpo primário de trabalho (10% soro de cabra normal, 1,25% albumina sérica bovina, 0,1% Na azida, 0,05% Triton X-100 mL e 10 com 1x PBS). Adicionar a quantidade adequada do anticorpo primário (ver Tabela 2). Linha de vários pratos com parafilme. Coloque uma gota 200μl de solução de anticorpo primário sobre o parafilme para cada substrato. Inverter os substratos, flutuando-los lado célula para baixo sobre a solução de anticorpo primário trabalhando durante a noite (se o quarto tem ar condicionado ou particularmente seco, um pedaço de papel saturado de água pode ser adicionada a um canto do prato para evitar a evaporação da solução de trabalho) .
- Anticorpo secundário: Remove os substratos do primário (a solução de trabalho podem ser recolhidos, armazenados a 4 ° C e reutilizados) e realizar 2X 5 min lava 1x PBS. Aplicar 200 mL de anticorpo secundário diluído 1:200 em PBS (também invertida em parafilme prato forrado) por 4 horas.
- Retire do secundário em seguida, executar 2X 5 min lava 1x PBS. Substratos de montagem em lâminas com Prolong ouro contendo DAPI ou outro contador adequado nuclear mancha.
12. Resultados representativos:
A morfologia típica de alinhados e el aleatóriaectrospun fibras são mostrados na Figura 1. Nós normalmente obter MN pureza> 90% 7,8 neurônios com este protocolo e mantivemos DRG culturas durante o tempo que uma semana sem qualquer crescimento de fibroblastos significativa. A Figura 2 mostra a aparência típica MN em vidro e fibras após 24 horas de cultura e imunomarcação. DRG imunocoradas cultivados por três dias em vidro e fibras são representadas na Figura 3.

Figura alinhamento Fiber 1. É manipulado por escolha de colecionador. A.) Alinhados fibras fiadas em um coletor roda girando e B.) fibras aleatórias girou em um coletor placa estacionária. Barra de escala = 20 mM.
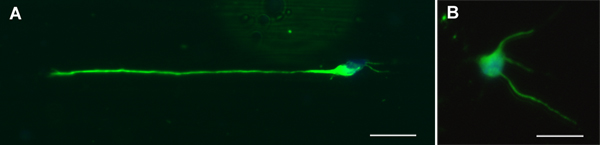
Figura 2. Neurônios motores Representante coradas para TuJ1 (verde) e DAPI (azul) após 24 horas de cultura na A. revestido PLL) fibras e B.) de vidro. Barra de escala = 20 mM.
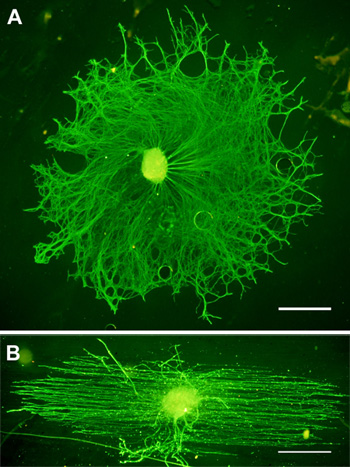
Figura 3. Manchada Representante DRG para neurofilamento (verde) após 3 dias de cultura em PLL A. revestido) de vidro e B.) fibras. Barra de escala = 200 mM.
| Solução estoque: | MN mídia: | DRG / SN mídia: |
| 10 mg mL -1 de albumina | 12,5 mL | - |
| 10 mg mL -1 apo-transferrina | 50 ul | 40 mL |
| 50 mg mL -1 β-estradiol | 2,7 mL | 2,2 mL |
| 0,1 mg mL -1 biotina | 50 ul | - |
| 16 mg mL -1 catalase | 8 mL | - |
| 15 mg mL -1 D-galactose | 50 ul | - |
| 50 mg mL -1 hidrocortisona | 3,7 mL | 2,9 mL |
| 0,63 mg mL -1 progesterona | 0,5 mL | - |
| 16 mg mL -1 putrescina | 50 ul | - |
| 50 mg mL -1 de selênio | 3,4 mL | 4,1 mL |
| 2,5 mg mL -1 superóxido dismutase | 50 ul | - |
| * 500 ng mL -1 fator de crescimento neural | - | 1 mL |
| * 100X PSN | 0,5 mL | 0,5 mL |
| * B27 | 1 mL | 1 mL |
| * 2 mM L-glutamina | 35 mL | 35 mL |
| * Neurobasal | a 50 mL | a 50 mL |
Tabela 1. Adicionar asterisco (*) componentes para a mídia pouco antes de usar. Os demais componentes podem ser preparados como solução estoque e mantido a -20 ° C até ser necessário 6,7.
| Primário (concentração) | Neurônios: | Glia: | Fibroblastos: |
| anti-β-tubulina (TuJ1) (1:1000) | ✓ | X | X |
| anti-neurofilamento (1:1000) | ✓ | X | X |
| anti-S-100 (1:250) | X | ✓ | ✓ |
| anti-NGFR p75 (1:500) | ✓ | ✓ | X |
Tabela 2. A seleção do anticorpo primário depende dos objetivos do pesquisador. O acima são vários anticorpos e as concentrações que temos utilizado com sucesso em nosso laboratório. S-100 é particularmente útil para identificar as células de Schwann e / ou verificar se há contaminação fibroblastos, mas note que ele deve ser usado em combinação com NGFR p75 distinguir entre glia e fibroblasts4. Temos notado também que NGFR p75 manchas neurites muito levemente, enquanto neurofilamento ou TuJ1 são excelentes opções, se o objetivo é visualizar neurites individual.
Discussão
Este protocolo tem várias etapas críticas. A primeira envolve a produção adequada dos substratos fibra electrospun. Em meio líquido, as fibras PLLA, PLGA cinema e fosso PLGA será separada da lamínula de vidro como uma única unidade. Se o PLGA é omitido, as fibras PLLA não continuará a ser uma folha plana - eles vão enrolar em um emaranhado inutilizável. Assim, o filme PLGA está incluído como um substrato adequado para manter o alinhamento da fibra durante a cultura. O fosso é adicionado após girar tanto para garantir que as fibras estão firmemente fixos ao filme PLGA e acrescentar rigidez estrutural para o filme. O fosso também serve como uma alça útil quando os substratos são manipuladas durante a fixação, coloração e montagem. Trituração é o segundo passo crítico. Todo esforço deve ser feito para evitar a formação de bolhas. Além disso, temos obtido rendimentos muito maior quando uma pipeta-fogo polido é utilizada para esta etapa. Ao fogo polonês, acender um bico de Bunsen e anexar uma lâmpada para a pipeta. Passe a ponta da pipeta rapidamente através da chama 2-3 vezes, enquanto continuamente apertando e soltando o bulbo - fluxo de ar através da pipeta ajudará a impedir que a ponta de fechar completamente. Examine a ponta da pipeta de modo que o buraco ainda está aberto e que as bordas ligeiramente arredondadas aparecem antes do uso.
Eletrofiação é um processo muito versátil, os parâmetros electrospinning pode ser modificado para produzir fibras com uma variedade de morfologias. Tan et al. (2005) detalha um estudo sistemático dos parâmetros que afetam o diâmetro das fibras PLLA electrospun. Wang et al. (2009) apresenta um estudo detalhado dos parâmetros que influenciam o alinhamento das fibras electrospun PLLA.
Divulgações
Agradecimentos
NIH K08 EB003996
Materiais
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| PLLA | Boehringer Ingelheim | Resomer L210 | ||
| PLGA 85:15 | Sigma | 43471 | ||
| L15 | Gibco | 11415 | ||
| Albumin | Sigma | A2289 | ||
| Apo-transferrin | Akron | AK8227 | ||
| Biotin | Fisher | AC 23009-0010 | ||
| Galactose | Sigma | G0625 | ||
| Progesterone | Sigma | P7556 | ||
| Putrescine | Sigma | P5780 | ||
| Selenium | Sigma | S9133 | ||
| β-estradiol | Sigma | E 1132 | ||
| Hydrocortisone | Sigma | H0396 | ||
| Catalase | Sigma | C40 | ||
| Superoxide dismutase | Sigma | S4636 | ||
| Neurobasal | Gibco | 21103-049 | ||
| PSN | Gibco | 15640 | ||
| L-glutamine | Nalgene | 1680149 | ||
| Trypsin | Nalgene | 1689149 | ||
| Fetal bovine serum | Gibco | 26140 | ||
| Optiprep | Accurate | 2011 | ||
| PLL | Sigma | P4832 | ||
| Fibronectin | Sigma | F 4759 | ||
| Laminin | Invitrogen | 23017-015 | ||
| B27 | Gibco | 17504-044 | ||
| BSA | Sigma | A7906 | ||
| Anti-TuJ1 | BD Biosciences | 556321 | ||
| Anti-neurofilament | Millipore | AB1987 | ||
| Anti-S100 | Sigma | S2532 | ||
| Anti-NGFR p75 | Sigma | N3908 | ||
| Normal goat serum | Sigma | G6767 | ||
| Triton X-100 | Sigma | T9284 | ||
| Sodium azide | Sigma | S8032 | ||
| Carbon tape | Ted Pella | 13073-1 | ||
| Prolong Gold +DAPI | Invitrogen | P36931 |
Referências
- Corey, J. M., Gertz, C. C., Wang, B. S., Birrell, L. K., Johnson, S. L., Martin, D. C., Feldman, E. L. The design of electrospun PLLA nanofiber scaffolds compatible with serum-free growth of primary motor and sensory neurons. Acta. Biomater. 4, 863-875 (2008).
- Lin, D. Y., Johnson, M. A., Vohden, R. A., Chen, D., Martin, D. C. Tailored nanofiber morphologies using modulated electrospinning for biomedical applications. Mat. Res. Soc. Symp. Proc. 736, D3.8.1-D3.8.6 (2003).
- Banker, G., Goslin, K. . Culturing Nerve Cells. , (1998).
- Kameda, Y. Expression of glial progenitor markers p75NTR and S100 protein in the developing mouse parathyroid gland. Cell Tissue Res. 327, 15-23 (2007).
- Corey, J. M., Lin, D. Y., Mycek, K. B., Chen, Q., Samuel, S., Feldman, E. L., Martin, D. C. Aligned electrospun nanofibers specify the direction of dorsal root ganglia neurite growth. J. Biomed. Mater. Res. A. 83, 636-645 (2007).
- Vincent, A. M., Mobley, B. C., Hiller, A., Feldman, E. L. IGF-I prevents glutamate-induced motor neuron programmed cell death. Neurobiol. Dis. 16, 407-416 (2004).
- Russell, J. W., Windebank, A. J., Schenone, A., Feldman, E. L. Insulin-like growth factor-I prevents apoptosis in neurons after nerve growth factor withdrawal. J. Neurobiol. 36, 455-467 (1998).
- Gertz, C. C., Leach, M. K., Birrel, L. K., Martin, D. C., Feldman, E. L., Corey, J. M. Accelerated neuritogenesis and maturation of primary spinal motor neurons in response to nanofibers. Dev. Neurobiol. 70, 589-603 (2010).
- Tan, S. -. H., Kotaki, M., Ramakrishna, S. Systematic parameter study for ultra-fine fiber fabrication via electrospinning process. Polymer. 46, 6128-6134 (2005).
- Wang, H. B., Mullins, M. E., Cregg, J. M., Hurtado, A., Oudega, M., Trombley, M. T., Gilbert, R. J. Creation of highly aligned electrospun poly-L-lactic acid fibers for nerve regeneration applications. J. Neural Eng. 6, (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados