Method Article
ثقافة موتور الابتدائية والخلايا العصبية الحسية في وسائل الإعلام على معرفة السقالات Electrospun Nanofiber بولي - L - lactide
In This Article
Summary
محاذاة الألياف electrospun مباشر على نمو الخلايا العصبية في المختبر ، وتشكل عنصرا إمكانات التجدد السقالات العصبية. وصفنا إجراء لإعداد ركائز الألياف electrospun وثقافة خالية من المصل الأولية الحسية E15 الفئران (DRG) والخلايا العصبية الحركية. كما يتم تضمين التصور من الخلايا العصبية التي كيمياء سيتولوجية مناعية.
Abstract
Electrospinning هو أسلوب لإنتاج نانو في الدقيقة النطاق الألياف. يمكن electrospun الألياف مع درجات متفاوتة من المواءمة ، من الانحياز إلى حد كبير عشوائية تماما. بالإضافة ، يمكن نسج الألياف من مجموعة متنوعة من المواد ، بما في ذلك البوليمرات القابلة للتحلل مثل بولي - L - حامض اللبنيك (PLLA). هذه الخصائص تجعل الألياف electrospun مناسبة لمجموعة متنوعة من التطبيقات السقالات في هندسة الأنسجة. تركيزنا هو على استخدام الألياف electrospun الانحياز لتجديد العصبية. لقد أظهرنا سابقا أن محاذاة الألياف electrospun PLLA ثمرة مباشرة من كل من الخلايا العصبية الحسية والحركية الأساسية في المختبر. ونحن نرى أن استخدام نظام الخلية الأولية الثقافة أمر أساسي عند تقييم المواد الحيوية إلى الخلايا العصبية الموجودة في النموذج الحقيقي فيفو بقدر الإمكان. هنا ، نحن تصف التقنيات المستخدمة في المختبر لدينا electrospin السقالات ليفية والثقافة العقد الجذرية الظهرية explants ، فضلا عن فصل الخلايا العصبية الحسية والحركية ، على السقالات electrospun. ومع ذلك ، يتم تكييفها بسهولة وelectrospinning / أو تقنيات الثقافة المعروضة هنا للاستخدام في التطبيقات الأخرى.
Protocol
1. بولي - L - حمض اللبنيك (PLLA) غزل الحل
- حل 0،4 ز PLLA في الكلوروفورم مل 9 من التحريك على نار خفيفة.
- إضافة 1 مل من ثنائي ميثيل الفورماميد إلى الحل ، وبذلك يصبح التركيز النهائي من الحل لPLLA 4 ٪ (W / V) في الكلوروفورم : DMF 09:01 (V / V).
- وضع الحل في البولي بروبلين أو حقنة زجاجية مع طرف معدني 23ga حادة.
2. الغزل إعداد الركيزة 1
- جعل حلا 8 ٪ (وزن / حجم) من PLGA 85:15 (بولي اللبنيك المشترك ، حمض الجليكوليك) في الكلوروفورم بواسطة التحريك على نار خفيفة.
- معطف غطاء زجاجي نظيف في زلات PLGA التي تغطي سطح كل زلة مع تغطية PLGA الحل. السماح ليجف PLGA إلى رقيقة (حوالي 30 دقيقة).
3. Electrospinning 2
- تأمين تغطية PLGA الزجاج المطلي زلات لجامع مع الشريط الكربون الموصلة. للألياف الانحياز ، هو جامع عجلة بالمحركات. للألياف عشوائي ، هو جامع لوحة ثابتة.
- حقنة في مكان مضخة مع 20 سم من الحافة عجلة جامع. مضخة لضبط ما يقرب من 2 مل / ساعة ، وإذا به عجلة ، تعيين المحرك إلى 300-400 دورة في الدقيقة. إذا كان ذلك ممكنا ، وتطبيق التحيز العاصمة -2 كيلو فولت إلى المجمع و+15 كيلو فولت إلى الحافة المعدنية. في غياب إمكانية الحصول على إمدادات الطاقة بين القطبين ، أرض المجمع.
- وألياف طائرة من طرف الحقنة ، وجمع على عجلة دوارة. يستمر الغزل حتى يتم الحصول على الكثافة المطلوبة من الألياف. انتقد الملصقة غيض المعادن مع منشفة ورقية إلى قضيب غير موصل بشكل دوري لمنع انسداد في الطرف.
4. Moating 1
- بعد الغزل "خندق" العينات التي electrospun pipetting خط PLGA حول محيط من انزلاق الغطاء. السماح للPLGA لتجف. هذا وسوف تحافظ على التوافق من الألياف خلال الثقافة.
5. طلاء البروتين
- ألياف الزجاج Electrospun والضوابط ضرورة أن تكون مغلفة في البروتين قبل ثقافة الخلية. تغطية ركائز في محلول البروتين لمدة ساعة على الأقل ، ونضح ثم حل الشفط الزائد وتستمر حتى ركائز جافة. الحلول الممكنة البروتين تشمل : PLL (بولي - L - يسين) (100 ميكروغرام / مل) ، laminin (25 ميكروغرام / مل) أو فبرونيكتين (50 ميكروغرام / مل). إذا تم استخدام PLL ، ينبغي ركائز تشطف في ماء معقم والمجففة مرتين بعد طلاء الأولي.
6. الحصول على أجنة الفئران E15 3
وقد أجريت تجارب * جميع وفقا لدليل المعاهد الوطنية للصحة للرعاية واستخدام الحيوانات المختبرية كما وافقت عليها لجنة جامعة ميشيغان على استخدام ورعاية الحيوانات.
- إعداد : تحقق مما إذا كان الحيوان حاملا. ذوبان الجليد 3 مل التربسين ، 3 مل FBS دافئة وزجاجة من L15. النار تلميع ماصة باستور. تعقيم جميع الأدوات الجراحية في الإيثانول 70 ٪ لمدة 30 دقيقة.
- إعداد وسائل الاعلام الحارة الطلاء (انظر الجدول 1).
- القتل الرحيم : إجراء حقنة IP الكيتامين / زيلازين. انتظر 10-15 دقيقة والتحقق من عدم وجود دواسة القرنية وردود الفعل الانسحاب. ردود الفعل مرة واحدة غائبة ، نفذ حقنة من IC بنتوباربيتال (FatalPlus).
- خيمة جلد البطن. قطع طريق الجلد والعضلات لفضح طبقات تجويف البطن. موقع الرحم وسلخه في عنق الرحم والمبايض.
- إزالة الأجنة من الرحم مع مقص ووضعها فورا في L15 الدافئة. (يتم الانتهاء من كافة الإجراءات التالية تحت مجهر تشريح والأجنة ويجب أن يغطس في الحبال تشريح L15 الدافئة في جميع الأوقات.) قطع رأس الأجنة عن طريق إغلاق ملقط حول الذقن وأسفل عظم القذالي من الجمجمة.
7. التشريح 3
- وضع الجنين على جانب واحد. حماية النخاع الشوكي مع مجموعة واحدة من ملقط مع استخدام مجموعة أخرى لتجريد بعيدا الأطراف وأعضاء البطن.
- بدوره الجنين والاحتفاظ بها ثابتة مع مجموعة واحدة من الملقط. قص على طول الجنين ، من الرقبة الى الذيل ، وحتى ما يتعرض له الحبل كله.
- فهم في نهاية الحبل بعناية وتسحبه على نفسها تجاه الذيل لإزالته. سيتم سحب الحبل الحرة مع غشاء الظهرية والعقد الجذرية (DRG) المرفقة.
- إذا DRG يزدرع أو فصل الخلايا العصبية الحسية هي الثقافة التي يتعين القيام بها ، قص DRG قبالة الحبل ونقلها إلى طبق جديد من L15 الدافئة.
- DRG لثقافة يزدرع ، انتقل إلى الخطوة 10.2
- لفصل الخلايا العصبية الحسية الثقافة ، انتقل إلى الخطوة 9
- للثقافة الخلايا العصبية الحركية ، سيتم إزالة الغشاء مع DRG في الخطوة 7.5
- إزالة غشاء من الحبل الشوكي عن طريق الامساك بها في نهاية العلوي من الحبل السري وتقشير عليه ، مشابهة لإزالة الجورب الطويل. أكرر للجميع الأجنة ثم يقطع الى قطع حبال (2-3 ملم) الصغيرة.
- صب المفروم والحبال L15 الى المخروطية وتدور بسرعة 1000 دورة في الدقيقة لمدة 2-3 دقيقة إلى القطع بيليه.
- تخلصي من طاف وإضافة 3 مل من التربسين إلى الحبال مكعبات. احتضان في حمام الماء ° 37 مئوية لمدة 20 دقيقة.
- أضف 3 مل FBS لالمخروطية وتدور بسرعة 1000 دورة في الدقيقة لمدة 2-3 دقيقة لإعادة بيليه.
- تخلصي من طاف ومعطف النار مصقول مع ماصة باستير FBS.
- إضافة واحد ماصة باستير - L15 الكامل لالمخروطية ويسحن ثم بلطف حتى الحل هو مع عدم وجود كتل متجانسة مرئية. تجنب الفقاعات.
- يعد حل 9 ٪ من Optiprep في L15. يعد أنبوب واحد مع 3 مل من محلول Optiprep لكل الأجنة اثنين (إذا كان هناك عدد فردي من الأجنة ، على مدار متابعة).
- إسقاط حل المتجانس على الحل Optiprep وتقسيمها بالتساوي بين جميع الأنابيب. تدور الأنابيب في 2000 دورة في الدقيقة لمدة 15 دقيقة.
- جمع بعناية أعلى 2 مل من كل أنبوب وحمام سباحة في 50 مل المخروطية. ملء المخروطية مع L15 وتدور في 1000 دورة في الدقيقة لمدة 5 دقائق لشطف خلايا Optiprep.
- تخلصي من طاف وresuspend الخلايا في كمية صغيرة من الطلاء وسائل الاعلام (250-500 ميكرولتر). عد الخلايا باستخدام التريبان الأزرق الاستبعاد لتحديد الخلايا الحية. انتقل إلى الخطوة 10.1
9. الخلية العصبية الحسية (SN) تجهيز 7
- صب DRG إزالتها من النخاع الشوكي وL15 في أنبوب مخروطي الشكل وتدور في 1000 دورة في الدقيقة لمدة 2-3 دقيقة إلى القطع بيليه.
- تخلصي من طاف وإضافة 3 مل من التربسين إلى مكعبات DRG. احتضان في المياه 37 درجة مئوية لمدة الحمام 10 دقيقة.
- أضف 3 مل FBS لالمخروطية وتدور بسرعة 1000 دورة في الدقيقة لمدة 2-3 دقيقة لإعادة بيليه.
- تخلصي من طاف ومعطف النار مصقول مع ماصة باستير FBS.
- إضافة واحد ماصة باستير - L15 الكامل لالمخروطية ويسحن ثم بلطف حتى الحل هو مع عدم وجود كتل متجانسة مرئية. تجنب الفقاعات.
- تدور جناسة في 1000 دورة في الدقيقة لمدة 5 دقائق. تخلصي من طاف وresuspend الخلايا في كمية صغيرة من وسائل الاعلام الطلاء SN (250-500 ميكرولتر). عد الخلايا باستخدام التريبان الأزرق الاستبعاد لتحديد الخلايا الحية. انتقل إلى الخطوة 10.1
10. الطلاء والثقافة
- لنأت SN أو ثقافة MN :
- تغطية ركائز مع بضع قطرات من وسائل الإعلام ثم إضافة وحدة تخزين مناسبة للتعليق الخلية. وينبغي أن تنفصل الخلايا مطلي في مناطق ذات كثافة منخفضة (25-50 خلية / مم 2). السماح للخلايا الالتزام لمدة ساعة على الأقل قبل الفيضانات آبار مع وسائل الاعلام.
- DRG لثقافة يزدرع :
- تغطية ركائز مع بضع قطرات من وسائل الإعلام ثم إضافة DRG لوسائل الاعلام. ترتيب DRG بحيث يتم توزيعها بالتساوي عبر أنهم الركيزة (حوالي 4 DRG سيكون مناسبا على زلة غطاء 22x22 ملم). السماح للDRG الالتزام على الأقل 4 ساعات قبل الفيضانات آبار مع وسائل الاعلام.
- يمكن الحفاظ على الثقافات لمدة تصل إلى 4 أيام من دون تغيير وسائل الإعلام. لفترة أطول الثقافات ، يجب أن نصف العمل مع وسائل الاعلام وسائل الاعلام التغييرات الأعلاف. تغذية وسائل الاعلام هو نفس تكوين وسائل الاعلام الطلاء ناقص لام الجلوتامين.
11. كيمياء سيتولوجية مناعية 1،5،8
- تحديد الخلايا : وسائل الإعلام واستبدالها مع نضح PFA الحارة 4 ٪ (بارافورمالدهيد) لمدة 30 دقيقة. ثم نفذ 3X 5 دقائق يغسل 1X PBS.
- حجب / permeabilization : إعداد كتلة / بيرم حل (1.25 ٪ مصل بقري الزلال في برنامج تلفزيوني 1X ، 0.05 ٪ تريتون X - 100 و 2.0 ٪ مصل الماعز العادي). نضح PBS وتطبيق كتلة / بيرم حل لعينات لمدة 30 دقيقة. ثم نفذ 1X 5 دقائق يغسل 1X PBS.
- الأجسام المضادة الأولية : إعداد الابتدائي حل الضد العمل (10 ٪ مصل الماعز العادية ، 1.25 ٪ ألبومين المصل البقري ، 0.1 ٪ نا آزيد ، 0.05 ٪ تريتون X - 100 وإلى 10 مل مع 1X PBS). إضافة كمية مناسبة من الأجسام المضادة الأولية (انظر الجدول 2). عدة أطباق تمشيا مع parafilm. وضع حبة 200μl الحل الأساسي على الضد parafilm لكل الركيزة. اقلب ركائز ، وتطفو عليها الجانب الخلية أسفل على الضد الحل الأساسي العمل بين عشية وضحاها (إذا كانت الغرفة مكيفة الهواء الجاف أو خاصة ، يمكن إضافة قطعة من الورق المياه المشبعة إلى زاوية الطبق لمنع التبخر من الحل العمل) .
- الأجسام المضادة الثانوية : إزالة ركائز من المرحلة الابتدائية (يمكن جمعها الحل العمل ، وتخزينها في 4 درجات مئوية وإعادة استخدامها) وأداء 2X 5 دقائق يغسل 1X PBS. تطبيق 200 الضد الثانوية ميكرولتر المخفف 1:200 في برنامج تلفزيوني (مقلوب أيضا على طبق parafilm مبطنة) لمدة 4 ساعة.
- إزالته من الثانوية ثم نفذ 2X 5 دقائق يغسل 1X PBS. ركائز جبل على الشرائح التي تحتوي على الذهب مع إطالة دابي أو بأخرى مضادة مناسبة النووية وصمة عار.
12. ممثل النتائج :
مورفولوجيا نموذجية من الانحياز وشرم عشوائيةوتظهر الألياف ectrospun في الشكل 1. نحصل عادة MN نقاء> الخلايا العصبية 90 ٪ 7،8 مع هذا البروتوكول ، وحرصنا على الحفاظ DRG الثقافات لطالما أسبوع واحد دون أي نمو الخلايا الليفية كبيرة. ويبين الشكل 2 مظهر نموذجي MN على الزجاج والألياف النباتية وبعد 24 ساعة من الثقافة وimmunostaining. وصفت DRG Immunostained تربيتها لمدة ثلاثة أيام على الزجاج والألياف في الشكل 3.

يتلاعب محاذاة الألياف الرقم 1. بالاختيار من المجمع. نسج A.) الانحياز ألياف نسج على عجلة دوارة جامع وباء) ألياف عشوائي على جامع لوحة ثابتة. أشرطة النطاق = 20 ميكرومتر.
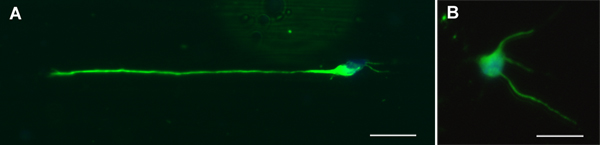
الشكل 2. الخلايا العصبية الحركية الممثل الملون لTuJ1 (الخضراء) ودابي (الأزرق) بعد 24 ساعة من الثقافة على ألف المغلفة PLL) ألياف وباء) والزجاج. أشرطة النطاق = 20 ميكرومتر.
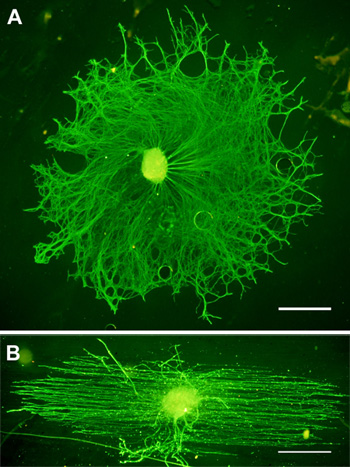
الشكل 3. الممثل الملون DRG لneurofilament (الخضراء) بعد 3 أيام من الثقافة على ألف المغلفة PLL) الزجاج وباء) الألياف. أشرطة النطاق = 200 ميكرومتر.
| الأسهم الحل : | MN سائل الإعلام : | DRG / SN وسائل الإعلام : |
| 10 ملغ مل -1 الألبومين | 12.5 ميكرولتر | -- |
| 10 ملغ مل -1 الاشتقاق ترانسفيرين | 50 ميكرولتر | 40 ميكرولتر |
| 50 ميكروغرام مل -1 β - استراديول | 2.7 ميكرولتر | 2.2 ميكرولتر |
| 0.1 ملغ مل البيوتين -1 | 50 ميكرولتر | -- |
| 16 ملغ مل -1 الكاتلاز | ميكرولتر 8 | -- |
| 15 ملغ مل -1 مد الغالاكتوز | 50 ميكرولتر | -- |
| هيدروكورتيزون 50 ميكروغرام مل -1 | 3.7 ميكرولتر | 2.9 ميكرولتر |
| 0.63 ملغ البروجسترون مل -1 | 0.5 ميكرولتر | -- |
| 16 ملغ مل -1 بوتريسين | 50 ميكرولتر | -- |
| 50 ميكروغرام مل -1 السيلينيوم | 3.4 ميكرولتر | 4.1 ميكرولتر |
| 2.5 ملغ الفائق -1 مل ديسموتاز | 50 ميكرولتر | -- |
| * 500 نانوغرام العصب مل عامل النمو -1 | -- | 1 مل |
| * 100X PSN | 0.5 مل | 0.5 مل |
| * B27 | 1 مل | 1 مل |
| * 2 مم L - الجلوتامين | 35 ميكرولتر | 35 ميكرولتر |
| * Neurobasal | إلى 50 مل | إلى 50 مل |
الجدول 1. إضافة نجمة (*) لمكونات وسائل الاعلام فقط قبل استخدامه. يمكن تحضير المكونات المتبقية كحل الأسهم والاحتفاظ بها في -20 درجة مئوية لحين الحاجة إليها 6،7.
| الابتدائية (تركيز) | العصبية : | الدبق : | الخلايا الليفية : |
| مكافحة β - تويولين (TuJ1) (1:1000) | ✓ | X | X |
| مكافحة neurofilament (1:1000) | ✓ | X | X |
| مكافحة - S - 100 (1:250) | X | ✓ | ✓ |
| مكافحة NGFR P75 (1:500) | ✓ | ✓ | X |
الجدول 2. اختيار من الأجسام المضادة الأولية تعتمد على أهداف محقق. ما سبق هي أضداد عدة وتجمعات لدينا استخدامها مع النجاح في المختبر لدينا. S - 100 مفيدا بشكل خاص للتعرف على خلايا شوان و / أو للتحقق من تلوث الخلايا الليفية ، ولكن الملاحظة التي يجب أن تستخدم في تركيبة مع NGFR P75 للتمييز بين الدبقية وfibroblasts4. لاحظنا أيضا أن NGFR P75 البقع neurites طفيفة للغاية في حين neurofilament أو TuJ1 هي اختيارات ممتازة إذا كان الهدف من ذلك هو تصور neurites الفردية.
Discussion
هذا البروتوكول وخطوات حاسمة عدة. الأول ينطوي على الإنتاج السليم للركائز electrospun الألياف. السائل في وسائل الإعلام ، فإن الألياف PLLA ، فيلم PLGA وخندق PLGA منفصلة عن الزجاج زلة تغطية كوحدة واحدة. إذا تم حذف PLGA ، فإن الألياف PLLA لا تبقى ورقة مسطحة -- أنها سوف عقص الى تشابك غير صالحة للاستعمال. وبالتالي ، يتم تضمين الفيلم باعتباره الركيزة PLGA مناسبة للحفاظ على محاذاة الألياف خلال الثقافة. إضافة الخندق بعد الغزل على حد سواء لضمان أن يتم إصلاح آمن الألياف للفيلم PLGA وإضافة التصلب الهيكلي للفيلم. الخندق أيضا بمثابة مؤشر مفيد عندما يتم معالجته خلال تثبيت ركائز ، وتلطيخ والتركيب. سحن هو الخطوة الثانية الحاسمة. وينبغي بذل كل جهد ممكن لتجنب تكون فقاعات. بالإضافة إلى ذلك ، لقد حصلنا على عوائد أعلى من ذلك بكثير عند استخدام ماصة النار مصقول لهذه الخطوة. إطلاق البولندية ، وعلى ضوء ناسخ بنسن وإرفاق لمبة للماصة. تمرير غيض من ماصة بسرعة من خلال الشعلة 2-3 مرات في حين الضغط باستمرار والافراج عن لمبة -- تدفق الهواء من خلال ماصة سوف تساعد على منع غيض من إغلاق تماما. دراسة غيض من ماصة لضمان ثقب لا يزال مفتوحا وأن تظهر حواف مدورة قليلا قبل الاستخدام.
Electrospinning هو عملية متعددة جدا ، ويمكن تعديل المعلمات electrospinning لإنتاج الألياف مع مجموعة متنوعة من morphologies. تان وآخرون (2005) تفاصيل دراسة منهجية للمعلمات التي تؤثر في القطر من ألياف electrospun PLLA. وانغ وآخرون (2009) يقدم دراسة مفصلة من المعلمات التي تؤثر في محاذاة الألياف PLLA electrospun.
Disclosures
Acknowledgements
NIH K08 EB003996
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| PLLA | Boehringer Ingelheim | Resomer L210 | ||
| PLGA 85:15 | Sigma | 43471 | ||
| L15 | Gibco | 11415 | ||
| Albumin | Sigma | A2289 | ||
| Apo-transferrin | Akron | AK8227 | ||
| Biotin | Fisher | AC 23009-0010 | ||
| Galactose | Sigma | G0625 | ||
| Progesterone | Sigma | P7556 | ||
| Putrescine | Sigma | P5780 | ||
| Selenium | Sigma | S9133 | ||
| β-estradiol | Sigma | E 1132 | ||
| Hydrocortisone | Sigma | H0396 | ||
| Catalase | Sigma | C40 | ||
| Superoxide dismutase | Sigma | S4636 | ||
| Neurobasal | Gibco | 21103-049 | ||
| PSN | Gibco | 15640 | ||
| L-glutamine | Nalgene | 1680149 | ||
| Trypsin | Nalgene | 1689149 | ||
| Fetal bovine serum | Gibco | 26140 | ||
| Optiprep | Accurate | 2011 | ||
| PLL | Sigma | P4832 | ||
| Fibronectin | Sigma | F 4759 | ||
| Laminin | Invitrogen | 23017-015 | ||
| B27 | Gibco | 17504-044 | ||
| BSA | Sigma | A7906 | ||
| Anti-TuJ1 | BD Biosciences | 556321 | ||
| Anti-neurofilament | Millipore | AB1987 | ||
| Anti-S100 | Sigma | S2532 | ||
| Anti-NGFR p75 | Sigma | N3908 | ||
| Normal goat serum | Sigma | G6767 | ||
| Triton X-100 | Sigma | T9284 | ||
| Sodium azide | Sigma | S8032 | ||
| Carbon tape | Ted Pella | 13073-1 | ||
| Prolong Gold +DAPI | Invitrogen | P36931 |
References
- Corey, J. M., Gertz, C. C., Wang, B. S., Birrell, L. K., Johnson, S. L., Martin, D. C., Feldman, E. L. The design of electrospun PLLA nanofiber scaffolds compatible with serum-free growth of primary motor and sensory neurons. Acta. Biomater. 4, 863-875 (2008).
- Lin, D. Y., Johnson, M. A., Vohden, R. A., Chen, D., Martin, D. C. Tailored nanofiber morphologies using modulated electrospinning for biomedical applications. Mat. Res. Soc. Symp. Proc. 736, D3.8.1-D3.8.6 (2003).
- Banker, G., Goslin, K. . Culturing Nerve Cells. , (1998).
- Kameda, Y. Expression of glial progenitor markers p75NTR and S100 protein in the developing mouse parathyroid gland. Cell Tissue Res. 327, 15-23 (2007).
- Corey, J. M., Lin, D. Y., Mycek, K. B., Chen, Q., Samuel, S., Feldman, E. L., Martin, D. C. Aligned electrospun nanofibers specify the direction of dorsal root ganglia neurite growth. J. Biomed. Mater. Res. A. 83, 636-645 (2007).
- Vincent, A. M., Mobley, B. C., Hiller, A., Feldman, E. L. IGF-I prevents glutamate-induced motor neuron programmed cell death. Neurobiol. Dis. 16, 407-416 (2004).
- Russell, J. W., Windebank, A. J., Schenone, A., Feldman, E. L. Insulin-like growth factor-I prevents apoptosis in neurons after nerve growth factor withdrawal. J. Neurobiol. 36, 455-467 (1998).
- Gertz, C. C., Leach, M. K., Birrel, L. K., Martin, D. C., Feldman, E. L., Corey, J. M. Accelerated neuritogenesis and maturation of primary spinal motor neurons in response to nanofibers. Dev. Neurobiol. 70, 589-603 (2010).
- Tan, S. -. H., Kotaki, M., Ramakrishna, S. Systematic parameter study for ultra-fine fiber fabrication via electrospinning process. Polymer. 46, 6128-6134 (2005).
- Wang, H. B., Mullins, M. E., Cregg, J. M., Hurtado, A., Oudega, M., Trombley, M. T., Gilbert, R. J. Creation of highly aligned electrospun poly-L-lactic acid fibers for nerve regeneration applications. J. Neural Eng. 6, (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved