Method Article
수정된 4혈관 폐색에 의해 유도된 대뇌 허혈성 혼수 모델
요약
이 프로토콜은 수정된 4개 혈관 폐색 방법을 사용하여 뇌 허혈성 혼수 모델을 유도하는 과정을 설명합니다.
초록
뇌허혈로 인한 혼수상태는 뇌허혈의 가장 심각한 합병증입니다. 4혈관 폐색은 질병 연구 및 약물 개발을 위한 대뇌 허혈성 혼수 모델을 확립할 수 있습니다. 그러나 일반적으로 사용되는 4개 혈관 폐색법은 주로 목 뒤의 첫 번째 경추의 양측 익상편에 전기응고 펜을 삽입하여 척추 동맥을 전기응고하는 것입니다. 이 과정은 불완전한 전기 응고, 출혈, 뇌간과 척수 손상의 위험을 수반합니다. 수술 24시간 후, 다시 마취된 쥐는 목 앞에서 경동맥 결찰술을 받습니다. 두 번의 수술은 쥐를 더 높은 감염 위험에 노출시키고 실험 기간을 늘립니다. 이 연구에서는 단일 수술 과정에서 척추 동맥이 첫 번째 경추를 관통하는 핵심 부위를 찾기 위해 전방 경추 절개를 사용했습니다. 양측 척추 동맥은 육안 조건에서 전기 소작되었고, 양측 총경동맥은 느슨한 매듭을 배치하기 위해 분리되었습니다. 쥐의 팔다리가 경련을 일으키기 시작하자 양측 총경동맥을 재빨리 결찰하여 허혈성 혼수를 유발했습니다. 이 방법은 두 번의 외과 수술로 인한 감염 위험을 피할 수 있으며 높은 성공률로 수행하기 쉽기 때문에 관련 의사에게 유용한 참고 자료를 제공합니다.
서문
허혈성 뇌 손상은 임상에서 가장 흔한 뇌 손상으로, 뇌혈관 질환 사례의 약 75%를 차지합니다. 허혈은 심각한 이차성 뇌 손상 및질병으로 이어질 수 있으며(1,2), 혼수는 허혈성 저산소성 뇌 손상으로 인한 가장 심각한 증상입니다. 또한 많은 심각한 상태에 대한 최종 경로이기도 합니다3. 혼수상태는 임상실습에서 관리가 어려운 중대하고 심각한 질병이다4. 혼수상태가 오래 지속될수록 잠재적인 위험은 더 커집니다. 신속한 각성은 상태의 악화와 진행을 예방하는 주요 목표입니다. 날록손 주사는 각성을 촉진하는 데 광범위한 임상적 응용이 가능하지만, 여전히 몇 가지 부작용이 있다5. 따라서 안전하고 효과적인 각성 촉진 약물의 개발은 시급히 해결해야 할 문제입니다. 간단하고 조작하기 쉬운 뇌 허혈성 혼수 모델을 확립하는 것은 허혈성 혼수의 발병 기전을 밝히고 약물 개발에 필수적이다 6,7,8.
본 연구의 목적은 양측 척추동맥(VA)의 전기응고술과 양측 총경동맥(CCA)의 임시결찰술을 통해 전반적 허혈혼을 유도하는 모델을 소개하는 것으로, 초보자도 간단하고 사용하기 쉽다. 이전 프로토콜은 첫 번째 수술 시 첫 번째 후방 경추의 양측 익상편 구멍을 노출시키고 익상편 구멍을 전기적으로 태워 양측 VA를 차단하는 것이었습니다. 두 번째 수술은 양측 CCA 9,10,11,12의 결찰에 의해 전체 허혈성 혼수를 유도하기 위해 24시간 후에 수행되었습니다. 그러나 눈에 보이지 않기 때문에 불완전한 전기 응고, 출혈, 뇌간 및 척수 손상의 위험이 있으며 실험 기간이 길어질 수 있습니다. 따라서 이러한 문제를 해결해야 합니다.
여기에서는 허혈성 혼수를 모델링하기 위한 개선된 방법을 제시합니다. 주요 시술은 경부 중앙분리를 절개하고, 육안 상태에서 양측 VA의 전기 절제를 수행하고, 한 번의 수술 중에 양측 CCA를 간략하게 결찰하여 뇌 전체로의 혈액 공급을 차단하여 빠른 뇌파(EEG) 억제를 유발하고 혼수상태에 빠지게 하는 것입니다. 이 방법은 또한 재관류 후 잠시 연속적인 혼수 상태를 유발합니다. 이 절차는 수행하기 쉽고 초보자에게 친숙하며 동물의 2차 외상 감염 위험을 줄여 실험 기간을 단축합니다.
이 프로토콜은 심장 마비로 인한 전신 허혈 혼수 연구에 적합합니다. 또한 허혈성 치매 연구에 이상적인데, 주로 해마 뇌 영역이 허혈에 매우 민감하기 때문입니다. 따라서 일시적인 대뇌 허혈은 해마 뉴런의 손상 또는 손실로 이어질 수 있다13 인지 기능 장애를 초래할 수 있다. 따라서 이 프로토콜은 뇌허혈, 허혈성 혼수 및 허혈성 치매를 연구하는 실무자에게 참조를 제공할 수 있습니다.
프로토콜
실험프로토콜은 포산대학교 실험동물이용위원회와 기관동물보호이용위원회(기록번호: 2023-643656)의 요구사항에 따라 진행되었다. 이 연구에는 수컷 Sprague Dawley(SD) 쥐(200g ± 20g, 6-8주령)가 사용되었습니다. 모든 동물 연구 데이터는 ARRIVE(Animal Research: Reporting In Vivo Experiments) 지침에 따라 작성되었습니다. 연구에 사용된 시약 및 장비의 세부 사항은 재료 표에 나열되어 있습니다.
1. EEG 전극 이식
- 마취 15분 전에 0.05mg/kg의 아트로핀을 피하 주사하여 분비물로 인한 호흡 폐색 및 질식을 예방합니다. 쥐를 마취시키기 위해 20mg/kg 졸레틸과 5mg/kg 자일라진을 근육 주사한다14. 핀셋을 사용하여 쥐의 발가락을 고정하여 깊은 마취를 확인합니다.
- 머리 면도기로 쥐의 머리에서 머리카락을 제거합니다. 비관통 이어 바를 사용하여 뇌 입체 장치에 쥐의 머리를 고정합니다. 멸균 면봉을 사용하여 에탄올과 포비돈 요오드를 수술 부위에 3회 도포하여 피부를 소독합니다.
- 수술용 칼날로 목이 잘린 봉합사를 따라 쥐의 머리 피부를 자릅니다. 두개골을 덮고 있는 근육을 제거하고 두개골을 완전히 노출시킵니다. 멸균 면봉을 사용하여 공정 전반에 걸쳐 출혈을 막으십시오.
- 치과용 시멘트가 두개골에 단단히 부착되도록 귀 세척 볼로 두개골 표면을 불어 말리십시오. 두개골 못의 설치 위치(직경 1.2mm, 길이 3mm)를 검은색 마커로 표시합니다(그림 1, 1단계). 구체적인 위치는 앞쪽 천문점과 다른 4개의 위치입니다.
- 10mL 주사기의 바늘을 사용하여 4개 영역을 순서대로 회전하고 드릴로 뚫습니다. 4개의 두개골 못을 순서대로 두개골에 삽입하여 대뇌 피질과 접촉하도록 합니다(그림 1, 2-3단계).
알림: 뼈 손톱이 녹슬지 않도록 출혈이 있는 경우 멸균 면봉을 사용하여 혈액을 흡수하십시오. - EEG 전극의 은선을 두개골 못에 감습니다. 근전도 전극을 근육에 삽입하고 6-0 봉합사로 고정합니다.
- 의치 베이스 레진과 자가 설정 의치 분말을 혼합하고 전극을 두개골에 고정합니다. 귀 세척 볼을 사용하여 치과용 시멘트 표면에 공기를 불어넣어 경화를 가속화합니다.
- 감염을 예방하기 위해 페니실린 10,000단위를 주사합니다. 각 쥐를 별도의 케이지에 넣어 상호 찢어짐과 전극 손상을 방지합니다. 수술 후 통증을 완화하기 위해 3일 연속 0.2mg/kg 멜록시캠을 피하 주사했습니다. 쥐 상처의 회복과 전극 고정을 위해 3일을 허용합니다(그림 1, 4단계).
2. 뇌허혈성 혼수 모델의 수술 과정
- 3일 후, 쥐를 다시 마취하고 누운 자세를 취합니다. 멸균 면봉을 사용하여 요오드를 세 번 반복적으로 도포한 후 알코올 헹굼/닦아내기를 통해 수술 부위를 소독합니다. 흉골의 위쪽 가장자리에서 목 중앙을 따라 세로로 메스로 약 2-3cm 길이로 절개합니다(그림 1, 5단계).
- 피하 조직과 흉골 설근을 뭉툭하게 분리하여 기관 양쪽의 기관과 장골 근육을 완전히 노출시킨다15.
알림: 전체 절차 동안 기관을 자극하지 마십시오. - 갑상선 높이에서 아래쪽으로 장경관 근육을 뭉툭하게 분리하여 첫 번째와 두 번째 경추를 노출시킵니다. 쥐 조직 확장기로 목 부위를 확장하여 수술 부위를 완전히 노출시킵니다.
- 미세한 집게를 사용하여 경추 추간 공간에서 보이는 근육과 조직을 조심스럽게 분리하여 척추 동맥이 첫 번째 경추로 들어가는 특징적인 위치를 노출시킵니다. 척추 동맥이 첫 번째 경추를 통과하는 것을 관찰할 수 있습니다(그림 1, 단계 6).
참고: 1mL 주사기를 목 아래에 놓으면 수술 조작 공간이 더 명확해집니다. - 전기 응고 펜을 예열하고 척추 동맥이 전기 응고 및 절단되도록 3-5초 동안 해당 부위에 삽입합니다. 흉쇄유돌근의 안쪽 가장자리를 따라 근육과 근막을 분리하고 양측 CCA를 노출시켜 풀어주고 느슨한 매듭을 묶습니다.
알림: 전기 응고 펜은 예열해야 합니다. 그렇지 않으면 척추 동맥을 빠르게 응고시킬 수 없어 출혈을 일으킵니다. 양쪽 척추 동맥은 전기 응고되어 있으며 느슨한 매듭이 CCA 주위에 묶여 있습니다. - 쥐가 의식을 회복하고 팔다리 경련을 보일 때 CCA의 혈류를 차단하기 위해 첫 번째 느슨한 매듭을 빠르게 조입니다. EEG 감지기는 활성 EEG 및 EMG 신호를 감지합니다. 쥐는 몇 초 동안 몸부림치다가 점차 의식을 잃습니다(그림 1, 7단계).
- 고정을 해제한 후 쥐의 팔다리가 뻣뻣하고 바르게 하는 반사는 사라지지만 호흡은 유지되는 것을 관찰하십시오. 이 시점에서, 근전도(EMG)는 직선을 나타내고, EEG는 빠르게 억제되며, 이는 4-VO 유도 뇌허혈 모델이 성공적이었음을 나타낸다16.
참고: 호흡 억제는 양측 CCA 결찰 중 일부 쥐에서 발생합니다. 빠른 기계적 자극은 일부 쥐의 자발적 호흡을 회복시킬 수 있습니다. - "바늘 제어 타이 방법16"에 따라 CCA, ICA, ECA의 분기점에서 약 1.5cm 떨어진 곳에서 6-0 나일론 실을 사용하여 0.5mm 직경의 주사기 바늘로 CCA를 바인딩합니다. 바늘을 조심스럽게 빼내십시오. 이 두 번째 매듭은 이후에 경동맥을 좁게 만듭니다(그림 1, 8단계).
참고: CCA 협착증에 사용되는 합자는 안정적인 나일론 재질로 만들어져야 합니다. 나일론 실은 혈액의 영향을받지 않으며 두꺼워지지 않습니다. 그렇지 않으면 쥐에서 CCA의 극심한 협착을 일으키고 사망률을 높일 수 있습니다. - 허혈 30분 후 첫 번째 매듭을 풀면 CCA가 재관류되지만 두 번째 매듭은 CCA 협착을 일으켜 지속적인 혼수 상태를 유발합니다(그림 1, 9단계). 흡수성 모노필라멘트 봉합사로 피하 조직을 닫고 비흡수성 모노필라멘트 봉합사로 피부를 닫습니다.
3. 동물 회수
- 쥐를 단열 패드에 놓고 감염을 방지하기 위해 10,000 단위의 페니실린을 주입하십시오. 수술 후 통증을 완화하기 위해 3일 연속 0.2mg/kg 멜록시캠을 피하 주사합니다.
- 60분의 재관류 후 쥐가 점차 회복되는지 확인하십시오.
결과
전극 이식으로 인한 염증 및 기타 자극으로 인해 EEG가 불안정할 수 있으므로 쥐는 3일 동안 회복해야 합니다. 3일 후 EEG 및 EMG가 정상인 쥐는 혼수 모델 준비에 포함될 수 있습니다. 쥐를 마취시켰을 때, EEG와 EMG 활동은 약간 억제되었지만 순조롭게 진행되었습니다. 양측 VA를 차단한 전기응고 후 EEG 및 EMG 활성에는 큰 변화가 없었습니다. 약 30분 후, 약물이 대사되고 쥐는 점차 의식을 회복했으며 EEG 및 EMG 활성이 증가했습니다. 쥐가 사지 경련을 보일 때 EEG 및 EMG 신호가 활성화되고 더 이상 직선이 아닌 동안 CCA는 신속하게 결찰되었습니다. 이때 뇌에 혈액 공급을 담당하는 4개의 혈관이 모두 막혀 전반적 뇌허혈이 발생했다. EEG와 EMG 활동은 급격히 억제되어 거의 직선을 이뤘고, 쥐는 더 이상 몸부림치지 않았으며, 안구는 회색과 흰색으로 보였다(그림 2A). 만약 쥐를 혼수상태에 빠뜨릴 수 없다면, 그것은 그 모델이 실패했다는 것을 의미한다.
30분 후, CCA의 첫 번째 결찰 실은 재관류를 위해 방출되었지만, CCA 앞에 놓인 두 번째 결찰 실은 관류 수준을 낮게 유지하여 약 60분 동안 쥐에서 지속적인 혼수 상태를 유발했습니다. 몸의 점진적인 보상과 혈액 관류로 쥐는 점차 깨어났습니다(그림 2B). 쥐의 EEG와 EMG는 깨어난 후 거의 완전히 회복되었습니다.
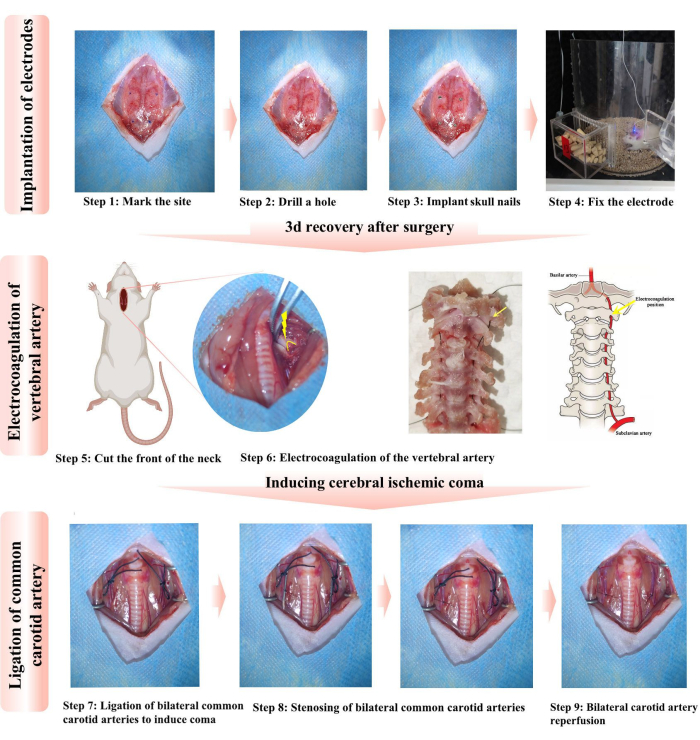
그림 1: 전기 응고 척추 동맥의 위치 다이어그램. 1-3단계는 전극을 이식하기 위한 프로토콜을 간략하게 설명하고 4단계는 전극이 제대로 작동하는지 테스트합니다. 5-6단계에서는 전기 응고를 위한 목 앞쪽과 양측 척추 동맥(VA)의 수술 절개 절차를 자세히 설명합니다. 노란색 화살표와 호는 전기 응고를 위한 주요 위치를 나타냅니다. 실크 실은 척추 동맥이 척추를 통과하는 과정을 시뮬레이션하는 데 사용되어 전기 응고 척추 동맥의 특징적인 위치를 보다 명확하게 표시합니다. 7-9단계는 혼수 상태를 유발하기 위한 양측 총경동맥(CCA)의 결찰 프로토콜을 설명합니다. 모든 절차는 동물 사용 지침을 준수합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 뇌전도(EEG) 및 근전도(EMG)가 혼수상태에서 회복 상태로의 변화. (A) 뇌 허혈성 혼수 중 쥐의 EEG, EMG 및 활동 수준의 파형. (B) 혼수상태에서 깨어남으로 전환하는 쥐의 EEG, EMG 및 활동 수준 다이어그램. 전체 프로세스는 약 90분 동안 지속됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
4척 폐색은 전신 허혈성 및 저산소성 뇌 손상을 유발하며, 이는 임상 실습에서 뇌 허혈로 인한 급성 혼수, 심정지, 질식, 쇼크, 중증 부정맥 및 기타 중요한 임상 상태를 시뮬레이션할 수 있습니다. 한편, 4개 혈관 폐색은 주로 해마(hippocampus)17,18)에 손상을 일으킬 수 있는데, 해마는 인지 기억(cognitive memory)을 담당하는 주요 기능적 뇌 영역이다 19,20,21. 따라서, 4-혈관 폐색(four-vessel occlusion)은 혈관성 치매 모델(vascular dementia model)을 시뮬레이션하는데 사용될 수 있다(22,23). 요약하면, 4개 혈관 폐색에 의한 전신 뇌 허혈 모델은 앞서 언급한 임상 질환을 시뮬레이션하는 데 널리 사용되어 왔습니다.
1979년, Pulsinelli et al.10은 양측 총경동맥과 양측 척추동맥을 차단함으로써 전신경뇌허혈 및 재관류를 달성하였다. 그 이후로, 이 모델은 점차 글로벌 대뇌 허혈 모델 24,25,26에 대해 국제적으로 인정받는 고전적인 준비 방법이 되었습니다. 그러나 이 방법은 제1 경추의 횡돌기와 구멍의 개인차, 작고, 불규칙하고, 휘어진 추간공 등 일부 문제점이 있어 불완전한 전기응고를 초래합니다. 또한 장기간 전기 응고나 과도한 전류는 뇌간과 척수를 손상시킬 위험이 있습니다. 척추 동맥의 불충분한 전기 응고는 심각한 출혈 및 기타 문제를 초래할 수 있습니다 15,16,27.
따라서 학자들은 척추 동맥의 전기 응고의 무결성을 보장하고 모델28,29의 변동성을 줄이기 위해 지속적으로 개선해 왔습니다. 척추 구멍을 통해 척추 동맥을 전기 응고하는 것이 보이지 않기 때문에 Todd et al.30은 척추 동맥을 완전히 노출시키고 아틀라스 구멍을 뚫어 직접 시야 아래에서 태워 전기 응고의 정확도를 높였습니다. 그러나 이 수술 방법은 매우 침습적이며 경추를 손상시킬 수 있습니다. 익상편 구멍의 얇은 벽은 척추 동맥을 쉽게 손상시켜 대량 출혈을 일으키고 상대적으로 높은 사망률을 초래할 수 있습니다. Sugio et al.12는 척추 동맥을 시각화하고 두 번째 경추의 좌우 추간공에 전기 바늘을 삽입하여 척추 동맥을 영구적으로 절단했습니다. Toda 등(31)과 Lu 등(27)은 이러한 해부학적 구조를 기반으로 아틀라스 관절 외부의 제1 및 제2 횡돌기 사이의 척추동맥을 노출시키고 전기응고를 수행하였다. 연구진은 척추동맥이 보이지 않을 때 목 뒤로 척추동맥을 노출시켜 전기응고술을 시행함으로써 전기응고의 불안정성 문제를 해결했다.
그러나 복부와 등 양쪽 수술을 받은 쥐는 여전히 감염 위험이 높았기 때문에 일부 학자들은 목 앞쪽에서 수술을 시도했습니다. Sun Wei et al.15 은 척추 동맥을 전경부에서 분리하고, 소동맥을 결찰 또는 자르고, CCA를 연속적 또는 간헐적으로 잘라냄으로써 전신 뇌 허혈 재관류를 달성했습니다. 이 단계는 척추 동맥이 미묘한 특성으로 인해 분리되기 어렵기 때문에 세심한 작업이 필요합니다. 또한 작은 동맥 클램프는 척추 동맥을 정확하게 고정하기 어렵습니다. 분리가 명확하지 않고 충분히 깨끗하지 않으면 불완전한 클램핑 또는 결찰이 발생하여 의심할 여지 없이 모델의 불안정성을 증가시킵니다.
이 연구는 척추 동맥 전기 응고를 위한 간단하고 실현 가능한 방법을 제공합니다. 핵심 단계는 척추 동맥을 분리하는 것이 아니라 척추 동맥이 교차하여 첫 번째 경추로 들어가는 횡공의 위치를 찾는 것입니다. 이것은 척추 동맥의 입구로, 구부러진 특징이 있어 초보자가 빠르게 찾을 수 있습니다. 전기 응고 펜을 예열한 후 구부러진 위치에 삽입하여 척추 동맥을 빠르게 응고시키고 완전한 폐색을 보장하기 위해 3-5초 동안 지속됩니다. 척추 동맥 전기 응고술과 CCA 결찰술을 모두 한 번의 수술로 수행하여 감염 위험과 실험 기간을 줄였습니다.
또한 모델 동물의 죽음은 주로 뇌혈 공급을 담당하는 4개의 혈관이 모두 막혀서 발생했으며 수술 횟수와는 관련이 없다는 것을 발견했습니다. 그러나 한 번의 수술로 모든 수술을 완료한 것은 실제로 실험 기간을 단축시켰습니다. 또한, 수정된 방법은 전체 대뇌 허혈-재관류 모델을 제조하는 데에도 사용할 수 있습니다. 4개 혈관 폐색에 의한 뇌허혈 혼수 모델은 또한 중국 전통 의학의 "잠김 증후군(locked-in syndrome)" 모델을 시뮬레이션할 수 있다32. 따라서 본 연구에서 소개한 모델은 한의학 종사자들에게도 참고자료가 될 수 있다.
종래 문헌 16,33,34에서, CCA 협착 결찰술은 허혈 30분 후에 수행하였다. 그러나 허혈 30 분 후 일부 쥐는 보상으로 인해 약간의 의식을 보였습니다. 기계적 자극으로 인해 이 쥐들이 깨어나 혼수 상태(coma model)의 실패로 이어질 수 있다. 따라서 본 연구에서는 CCA 협착증 치료를 혼수상태 발병 직후에 시행하였다. 이때 혼수상태의 깊이가 깊어 쥐가 깨어나도록 자극하기 어려웠기 때문에 모델의 안정성이 보장되었습니다. CCA는 이 치료 중 고정된 상태였으며 협착증 치료는 혈류에 영향을 미치지 않았습니다.
또한 쥐의 목 절개에서 3개의 척추 간격으로 있는 척추 동맥이 전기 소작 또는 결찰에 의해 차단될 수 있음을 관찰했습니다. 그러나 첫 번째 척추에 척추 동맥이 들어가는 특징적인 징후가 있어 전기 소작 차단에 매우 적합합니다. 두 번째와 세 번째 척추 사이, 세 번째와 네 번째 척추 사이에는 특징적인 마커가 없기 때문에 봉합 결찰이 더 적합합니다. 그러나 결찰이 충분하지 않다는 단점이 있습니다. 따라서 본 연구에서는 제1척추와 제2척추 사이의 척추동맥을 절단하기 위해 전기소작법을 선택하였다.
또한 이 모델의 성공은 쥐의 체중과 밀접한 관련이 있다는 점에 유의해야 합니다. 체중이 180-200g 사이인 쥐가 혼수 상태를 유발하는 데 더 적합한 것으로 보고되었습니다. 이번 연구에서는 체중이 180g 미만인 쥐는 4개의 혈관이 동시에 손상되는 것을 견디기 어려워 폐사율이 높다는 사실도 밝혀졌다. 반대로, 무게가 220g보다 크면 쥐는 빨리 깨어나고 모델 표준을 충족할 만큼 충분히 오래 혼수 상태에 있지 않습니다.
더욱이, CCA를 좁히는 데 사용되는 핀홀의 직경은 쥐의 혼수 상태에 영향을 미치는 또 다른 요인입니다. 연구에 따르면 0.6mm의 핀홀 직경은 높은 생존율로 6-8시간 동안 쥐에게 지속적인 혼수 상태를 유발할 수 있습니다. 0.45mm의 핀홀 직경은 쥐에게 극심한 동맥 협착을 일으켜 심하게 다친 쥐의 회복에 실패를 초래했으며, 0.7mm의 직경은 1-3시간 동안 지속되는 혼수상태를 초래했지만 상당한 개인차가 있었다16.
그러나 예비 실험에서 0.6mm의 핀홀 직경은 60분 이상 혼수를 유발할 수 없는 반면 0.5mm의 직경은 1-2시간 동안 혼수를 유발할 수 있습니다. 이는 Xiaobing Jia 등의 연구와 다르며, 이는 마취제와 모델링 방법의 차이 때문일 수 있습니다. 이러한 차이점을 밝히기 위해서는 앞으로 더 많은 연구가 필요합니다.
결론적으로, 이 연구는 4개 혈관 교합을 위한 간단하고 실현 가능하며 초보자 친화적인 방법을 제시합니다. 이 책은 뇌 허혈성 혼수 또는 전신 뇌 허혈을 연구하는 의사들에게 귀중한 참고 자료가 될 것입니다.
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 연구는 중국국가자연과학재단(National Natural Science Foundation of China, 82173781, 82373835), 박사후 연구 프로젝트(Postdoctoral Research Project, BKS212055), 포산과학기술국(Foshan Science and Technology Bureau, 2320001007331), 광둥성 기초 및 응용 기초 연구 재단(Guangdong Basic and Applied Basic Research Foundation, 2019A1515010806), 광동성 종합대학 중점 현장 프로젝트(지능형 제조)(2020ZDZX2057), 일반 과학 연구 프로젝트(Characteristic Innovation)의 지원을 받았습니다. 광동성 대학(2019KTSCX195).
자료
| Name | Company | Catalog Number | Comments |
| 16 channel microfiber photoelectrode array | Jiangsu Yige Biotechnology Co., Ltd | 2605 | |
| 4-0 Surgical suture | Nantong Holycon Medical Devices Co.,Ltd. | B-104 | |
| 6-0 Surgical suture | Ningbo MEDICAL Needle Co., Ltd. | JM1216-742417 | |
| EEG electrode | Kedou Brain machine Technology Co., LTD | KD-EEGEMG | |
| Electrocoagulation pen | CONPUVON Company | 465 | |
| Lunion Stage Automatic Sleep Staging System | Shanghai Lulian Intelligent Technology Co., Ltd. | 1336 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 180-220g | |
| Skull nail | GLOBALEBIO,LTD | / | |
| Stereotaxic instrument | Rayward Life Technology Co., Ltd | 68801 | |
| Zoletil 50 | Vic Trading (Shanghai) Co., LTD | BN 88SHA |
참고문헌
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529 (2024).
- Rong, M., et al. A modified model preparation for middle cerebral artery occlusion reperfusion. J Vis Exp. (207), e67060 (2024).
- Hoesch, R. E., Koenig, M. A., Geocadin, R. G. Coma after global ischemic brain injury: Pathophysiology and emerging therapies. Crit Care Clin. 24 (1), 25-44 (2008).
- You, W., et al. Amplitude-integrated electroencephalography predicts outcome in patients with coma after acute brain injury. Neurosc Bull. 34 (4), 639-646 (2018).
- He, F., Jiang, Y., Li, L. The effect of naloxone treatment on opioidinduced side effects A meta-analysis of randomized and controlled trails. Medicine (United States). 95 (37), e4729 (2016).
- Shukla, D. Description of coma and coma arousal therapy in Caraka Sahitā and its corollary in modern medicine. Neurol India. 65 (2), 250-252 (2017).
- Cossu, G. Therapeutic options to enhance coma arousal after traumatic brain injury: State of the art of current treatments to improve coma recovery. Brit J Neurosurg. 28 (2), 187-198 (2014).
- Li, J., Cheng, Q., Liu, F. K., Huang, Z., Feng, S. S. Sensory stimulation to improve arousal in comatose patients after traumatic brain injury: a systematic review of the literature. Neurol Sci. 41 (9), 2367-2376 (2020).
- Pulsinelli, W. A., Levy, D. E., Duffy, T. E. Cerebral blood flow in the four-vessel occlusion rat model. Stroke. 14 (5), 832-834 (1983).
- Pulsinelli, W. A., Brierley, J. B. A new model of bilateral hemispheric ischemia in the unanesthetized rat. Stroke. 10 (3), 267-272 (1979).
- Plaschke, K., et al. Pronounced arterial collateralization was induced after permanent rat cerebral four-vessel occlusion. Relation to neuropathology and capillary ultrastructure. J Neural Transm. 110 (7), 719-732 (2003).
- Sugio, K., Horigome, N., Sakaguchi, T., Goto, M. A model of bilateral hemispheric ischemia- modified four-vessel occlusion in rats: To the editor. Stroke. 19 (7), 922 (1988).
- Sadelli, K., et al. Global cerebral ischemia in rats leads to amnesia due to selective neuronal death followed by astroglial scar formation in the CA1 layer. Neurobiol Learn Mem. 141, 168-178 (2017).
- Song, B. W., et al. 1H-pyrrole-2,5-dione-based small molecule-induced generation of mesenchymal stem cell-derived functional endothelial cells that facilitate rapid endothelialization after vascular injury. Stem Cell Res Ther. 6 (1), 174 (2015).
- Sun, W., et al. A modified four vessel occlusion model of global cerebral ischemia in rats. J Neurosci Methods. 352, 109090 (2021).
- Xiaobing, J., et al. Modifying the four vessel occlusion to establish ischemic brain injury coma model in rats. Sichuan Med J. 29 (4), 384-386 (2008).
- Wang, W., et al. Levodopa improves cognitive function and the deficits of structural synaptic plasticity in hippocampus induced by global cerebral ischemia/reperfusion injury in rats. Front Neurosci. 14, 586321 (2020).
- Zhan, L., Lu, X., Xu, W., Sun, W., Xu, E. Inhibition of MLKL-dependent necroptosis via downregulating interleukin-1R1 contributes to neuroprotection of hypoxic preconditioning in transient global cerebral ischemic rats. J Neuroinflammation. 18 (1), 97 (2021).
- Konaka, K., Miyashita, K., Ishibashi-Ueda, H., Naritomi, H. Severe hyperthermia caused by four-vessel occlusion of main cerebral arteries. Internal Med. 48 (24), 2137-2140 (2009).
- Ferreira, E. D. F., Romanini, C. V., Mori, M. A., de Oliveira, R. M. W., Milani, H. Middle-aged, but not young, rats develop cognitive impairment and cortical neurodegeneration following the four-vessel occlusion/internal carotid artery model of chronic cerebral hypoperfusion. Eur J Neurosci. 34 (7), 1131-1140 (2011).
- Ma, B., et al. Protective effects of extract of Coeloglossum viride var. bracteatum on ischemia-induced neuronal death and cognitive impairment in rats. Behav Pharmacol. 19 (4), 325-333 (2008).
- Song, Y. Y., Chen, Y. H., Li, J. F., Sun, W. A review of animal models of vascular dementia. Chin J Comp Med. 33 (12), 75-85 (2023).
- Liu, B., et al. Autophagy activation aggravates neuronal injury in the hippocampus of vascular dementia rats. Neural Regen Res. 9 (13), 1288-1296 (2014).
- Li, J., Takeda, Y., Hirakawa, M. Threshold of ischemic depolarization for neuronal injury following four-vessel occlusion in the rat cortex. J Neurosurg Anesthesiol. 12 (3), 247-254 (2000).
- Rishitha, N., Muthuraman, A. Ameliorative potential of thymoquinone in four vessel occlusion induced vascular dementia in rats. Alzheimer Dement. 19 (S13), e71053 (2023).
- Oruc, S., et al. The antioxidant and antiapoptotic effects of crocin pretreatment on global cerebral ischemia reperfusion injury induced by four vessels occlusion in rats. Life Sci. 154, 79-86 (2016).
- Lu, D., et al. A modified method to reduce variable outcomes in a rat model of four-vessel arterial occlusion. Neurol Res. 38 (12), 1102-1110 (2016).
- Idt-Kastner, R. S., Paschen, W., Ophoff, B. G., Hossmann, K. A. A modified four-vessel occlusion model for inducing incomplete forebrain ischemia in rats. Stroke. 20 (7), 938-946 (1989).
- McBean, D. E., Kelly, P. A. T. Rodent models of global cerebral ischemia: A comparison of two-vessel occlusion and four-vessel occlusion. Gen Pharmacol. 30 (4), 431-434 (1998).
- Todd, N. V., Picozzi, P., Alan Crockard, H., Russell, A. R. R. Reperfusion after cerebral ischemia: Influence of duration of ischemia. Stroke. 17 (3), 460-466 (1986).
- Toda, S., et al. Highly reproducible rat model of reversible forebrain ischemia - Modified four-vessel occlusion model and its metabolic feature. Acta Neurochir (Wien). 144 (12), 1297-1304 (2002).
- Ma, R., Lu, D., Wang, J., Xie, Q., Guo, J. Comparison of pharmacological activity and safety of different stereochemical configurations of borneol: L-borneol, D-borneol, and synthetic borneol. Biomed Pharmacother. 164, 114668 (2023).
- Ji, X. Y., et al. Potential targets for protecting against hippocampal cell apoptosis after transient cerebral ischemia-reperfusion injury in aged rats. Neural Regen Res. 9 (11), 1122-1128 (2014).
- Martínez-Alonso, E., et al. Differential association of 4E-BP2-interacting proteins is related to selective delayed neuronal death after ischemia. Int J Mol Sci. 22 (19), 10327 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유