Method Article
Modello di coma ischemico cerebrale indotto da occlusione a quattro vasi modificata
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive il processo per indurre un modello di coma ischemico cerebrale utilizzando un metodo di occlusione a quattro vasi modificato.
Abstract
Il coma causato dall'ischemia cerebrale è la complicanza più grave dell'ischemia cerebrale. L'occlusione a quattro vasi può stabilire un modello di coma ischemico cerebrale per la ricerca sulla malattia e lo sviluppo di farmaci. Tuttavia, il metodo di occlusione a quattro vasi comunemente usato prevede principalmente l'inserimento di una penna per elettrocoagulazione nel forame pterigoideo bilaterale della prima vertebra cervicale dietro il collo per elettrocoagulare le arterie vertebrali. Questo processo comporta il rischio di elettrocoagulazione incompleta, sanguinamento e danni al tronco encefalico e al midollo spinale. Ventiquattro ore dopo l'intervento chirurgico, i ratti rianestetizzati vengono sottoposti a legatura dell'arteria carotidea davanti al collo. Due interventi chirurgici espongono i ratti a un rischio più elevato di infezione e aumentano il periodo sperimentale. In questo studio, durante una singola procedura chirurgica, è stata utilizzata un'incisione cervicale anteriore per localizzare il sito chiave in cui l'arteria vertebrale penetra nella prima vertebra cervicale. Le arterie vertebrali bilaterali sono state elettrocauterizzate in condizioni visive, mentre le arterie carotidi comuni bilaterali sono state separate per posizionare i nodi sciolti. Quando gli arti dei ratti hanno iniziato a contrarsi, le arterie carotidi comuni bilaterali sono state rapidamente legate per indurre il coma ischemico. Questo metodo può evitare il rischio di infezione causato da due operazioni chirurgiche ed è facile da eseguire con un alto tasso di successo, fornendo un utile riferimento per i professionisti interessati.
Introduzione
La lesione cerebrale ischemica è la lesione cerebrale più comune nella pratica clinica, rappresentando circa il 75% dei casi di malattia cerebrovascolare. L'ischemia può portare a gravi lesioni cerebrali secondarie e malattie 1,2 e il coma è il sintomo più grave causato da una lesione cerebrale ipossica ischemica. È anche il percorso finale per molte condizioni critiche3. Il coma è una malattia critica e grave nella pratica clinica che è difficile da gestire4. Più a lungo dura il coma, maggiore è il potenziale pericolo. Il risveglio tempestivo è l'obiettivo principale per prevenire il deterioramento e la progressione della condizione. Sebbene l'iniezione di naloxone abbia un'ampia gamma di applicazioni cliniche nel promuovere la veglia, ha ancora alcuni effetti collaterali5. Pertanto, lo sviluppo di farmaci sicuri ed efficaci che promuovono la veglia è un problema urgente che deve essere affrontato. La creazione di un modello di coma ischemico cerebrale semplice e facile da usare è essenziale per chiarire la patogenesi del coma ischemico e per lo sviluppo di farmaci 6,7,8.
Lo scopo di questo studio è quello di introdurre un modello di induzione del coma ischemico globale attraverso l'elettrocoagulazione delle arterie vertebrali bilaterali (VA) e la legatura temporanea delle arterie carotidi comuni bilaterali (CCA), che è semplice e facile da usare per i principianti. Il protocollo precedente prevedeva l'esposizione del forame pterigoideo bilaterale della prima vertebra cervicale posteriore durante la prima operazione e la combustione elettrica del forame pterigoideo per bloccare i VA bilaterali. Una seconda operazione è stata eseguita 24 ore dopo per indurre il coma ischemico totale mediante legatura dei CCA bilaterali 9,10,11,12. Tuttavia, a causa dell'invisibilità, esiste il rischio di elettrocoagulazione incompleta, sanguinamento, lesioni del tronco encefalico e del midollo spinale, nonché un periodo sperimentale prolungato. Pertanto, è necessario affrontare questi problemi.
Qui, presentiamo un metodo migliorato per modellare il coma ischemico. La procedura principale prevede l'esecuzione di un'incisione mediana del collo anteriore, l'esecuzione della resezione elettrica dei VA bilaterali in condizioni visive e la legatura breve dei CCA bilaterali durante un'unica operazione per bloccare l'afflusso di sangue all'intero cervello, causando una rapida inibizione dell'elettroencefalogramma (EEG) e portando al coma. Questo metodo induce anche un breve coma continuo dopo la riperfusione. Questa procedura è facile da eseguire, adatta ai principianti e riduce il rischio di infezione da trauma secondario negli animali, accorciando così il periodo sperimentale.
Il protocollo è adatto per lo studio del coma ischemico globale causato da arresto cardiaco. È ideale anche per lo studio della demenza ischemica, principalmente perché l'area cerebrale dell'ippocampo è estremamente sensibile all'ischemia; Pertanto, l'ischemia cerebrale transitoria può portare a danni o addirittura alla perdita dei neuroni dell'ippocampo13, con conseguente disfunzione cognitiva. Pertanto, il protocollo può fornire un riferimento per i professionisti che studiano l'ischemia cerebrale, il coma ischemico e la demenza ischemica.
Protocollo
Il protocollo sperimentale è stato condotto in conformità con i requisiti del Comitato per l'uso e l'uso degli animali da laboratorio e del Comitato istituzionale per la cura e l'uso degli animali dell'Università di Foshan (numero di registrazione: 2023-643656). Per questo studio sono stati utilizzati ratti maschi Sprague Dawley (SD) (200 g ± 20 g, di età compresa tra 6 e 8 settimane). Tutti i dati della ricerca sugli animali sono stati redatti in conformità con le linee guida ARRIVE (Animal Research: Reporting In Vivo Experiments). I dettagli dei reagenti e delle attrezzature utilizzate nello studio sono elencati nella tabella dei materiali.
1. Impianto di elettrodi EEG
- Iniettare 0,05 mg/kg di atropina per via sottocutanea 15 minuti prima dell'anestesia per prevenire l'ostruzione respiratoria e l'asfissia causate dalle secrezioni. Somministrare un'iniezione intramuscolare di 20 mg/kg di zoletil e 5 mg/kg di xilazina per anestetizzare i ratti14. Usa una pinzetta per bloccare le dita dei piedi del ratto per confermare l'anestesia profonda.
- Rimuovi i peli dalla testa del topo con un rasoio per capelli. Fissa la testa del ratto su un dispositivo stereotassico cerebrale utilizzando barre auricolari non penetranti. Utilizzare batuffoli di cotone sterili per applicare etanolo e iodio povidone tre volte sul sito chirurgico per disinfettare la pelle.
- Taglia la pelle della testa del topo lungo la sutura decapitata con una lama chirurgica. Rimuovere il muscolo che copre il cranio ed esporre completamente il cranio. Utilizzare tamponi di cotone sterili per fermare l'emorragia durante tutto il processo.
- Asciugare la superficie del cranio con una pallina per il lavaggio delle orecchie per aiutare il cemento dentale ad aderire saldamente al cranio. Contrassegnare la posizione di installazione dell'unghia del cranio (diametro 1,2 mm, lunghezza 3 mm) con un pennarello nero (Figura 1, passaggio 1). Le posizioni specifiche sono il punto della fontanella anteriore e altri quattro siti.
- Utilizzare l'ago di una siringa da 10 ml per ruotare e perforare quattro aree in sequenza. Inserire quattro unghie del cranio nel cranio in sequenza, assicurando il contatto con la corteccia cerebrale (Figura 1, passaggi 2-3).
NOTA: Utilizzare tamponi di cotone sterili per assorbire il sangue in caso di sanguinamento per prevenire la ruggine delle unghie ossee. - Avvolgere il filo d'argento dell'elettrodo EEG attorno all'unghia del cranio. Incorporare l'elettrodo elettromiografico nel muscolo e fissarlo con una sutura 6-0.
- Mescolare la resina della base della protesi con la polvere per protesi autofissante e fissare l'elettrodo al cranio. Usa una palla per il lavaggio delle orecchie per soffiare aria sulla superficie del cemento dentale per accelerare l'indurimento.
- Iniettare 10.000 unità di penicillina per prevenire l'infezione. Alloggia ogni ratto in una gabbia separata per evitare lacerazioni reciproche e danni agli elettrodi. Iniettato per via sottocutanea 0,2 mg/kg di meloxicam per tre giorni consecutivi per alleviare il dolore postoperatorio. Attendere 3 giorni per il recupero delle ferite di ratto e la fissazione dell'elettrodo (Figura 1, passaggio 4).
2. Modello di processo chirurgico di coma ischemico cerebrale
- Tre giorni dopo, anestetizzare nuovamente i ratti e metterli in posizione supina. Utilizzare batuffoli di cotone sterili per disinfettare il sito chirurgico attraverso tre applicazioni ripetute di iodio seguite da un risciacquo/salvietta imbevuta di alcol. Praticare un'incisione lunga circa 2-3 cm con un bisturi dal margine superiore dello sterno nel senso della lunghezza lungo la metà del collo (Figura 1, passaggio 5).
- Separare senza mezzi termini il tessuto sottocutaneo e il muscolo sternoioide, esponendo completamente la trachea e i muscoli del lungo collo su entrambi i lati della trachea15.
NOTA: Evitare di stimolare la trachea durante l'intera procedura. - Separare bruscamente i muscoli del lungo collo dal livello della ghiandola tiroidea verso il basso, esponendo la prima e la seconda vertebra cervicale. Espandere l'area del collo con un dilatatore di tessuto di ratto, esponendo completamente il sito chirurgico.
- Utilizzare una pinza fine per separare con cura i muscoli e i tessuti visibili nello spazio intervertebrale cervicale, esponendo la posizione caratteristica in cui l'arteria vertebrale entra nella prima vertebra cervicale. Si può osservare che l'arteria vertebrale passa attraverso la prima vertebra cervicale (Figura 1, passaggio 6).
NOTA: Posizionare una siringa da 1 ml sotto il collo fornisce uno spazio di manipolazione chirurgica più chiaro. - Preriscaldare la penna per elettrocoagulazione e inserirla nell'area per 3-5 secondi per assicurarsi che l'arteria vertebrale sia elettrocoagulata e recisa. Separare i muscoli e la fascia lungo il bordo interno del muscolo sternocleidomastoideo, esporre e liberare i CCA bilaterali e fare un nodo sciolto.
NOTA: La penna per elettrocoagulazione deve essere preriscaldata; in caso contrario, non può coagulare rapidamente l'arteria vertebrale, portando a sanguinamento. Entrambe le arterie vertebrali sono elettrocoagulate e i nodi sciolti sono legati attorno ai CCA. - Stringere rapidamente il primo nodo allentato per bloccare il flusso sanguigno nel CCA quando i ratti riprendono conoscenza e mostrano contrazioni degli arti, mentre il rilevatore EEG rileva segnali EEG ed EMG attivi. I ratti lottano per alcuni secondi e poi perdono gradualmente conoscenza (Figura 1, passaggio 7).
- Dopo aver rilasciato la fissazione, osservare che gli arti del ratto sono rigidi, il riflesso raddrizzante scompare, ma la respirazione viene mantenuta. A questo punto, l'elettromiogramma (EMG) presenta una linea retta e l'EEG viene rapidamente soppresso, indicando che il modello di ischemia cerebrale indotta da 4-VO ha avuto successo16.
NOTA: La depressione respiratoria si verifica in alcuni ratti durante la legatura bilaterale del CCA. Una rapida stimolazione meccanica può ripristinare la respirazione spontanea in alcuni ratti. - Secondo il "metodo16 della cravatta di controllo dell'ago", legare il CCA con un ago da siringa di 0,5 mm di diametro utilizzando un filo di nylon 6-0 a circa 1,5 cm di distanza dalla biforcazione di CCA, ICA ed ECA. Estrarre con cautela l'ago; questo secondo nodo causerà successivamente il restringimento dell'arteria carotide (Figura 1, passaggio 8).
NOTA: La legatura utilizzata per la stenosi CCA deve essere realizzata in materiale di nylon, che è stabile. Il filo di nylon non è influenzato dal sangue e non si addensa; in caso contrario, può causare una stenosi estrema del CCA nei ratti e aumentare il tasso di mortalità. - Dopo 30 minuti di ischemia, sciogliere il primo nodo e il CCA subirà la riperfusione, ma il secondo nodo provocherà una stenosi del CCA, inducendo un coma sostenuto (Figura 1, passaggio 9). Chiudere il tessuto sottocutaneo con suture monofilamento riassorbibili e la pelle con suture monofilamento non assorbibili.
3. Recupero degli animali
- Posiziona i ratti su cuscinetti isolanti e inietta 10.000 unità di penicillina per prevenire l'infezione. Iniettare per via sottocutanea 0,2 mg/kg di meloxicam per tre giorni consecutivi per alleviare il dolore postoperatorio.
- Dopo 60 minuti di riperfusione, assicurati che i ratti si riprendano gradualmente.
Risultati
A causa dell'infiammazione e di altre stimolazioni causate dall'impianto di elettrodi, l'EEG può essere instabile, quindi i ratti devono riprendersi per 3 giorni. I ratti con EEG ed EMG normali dopo 3 giorni potrebbero essere inclusi per la preparazione del modello di coma. Quando i ratti sono stati anestetizzati, l'attività EEG ed EMG è stata leggermente soppressa, ma è proceduta senza intoppi. Non vi è stato alcun cambiamento significativo nell'attività EEG ed EMG dopo l'elettrocoagulazione che ha bloccato i VA bilaterali. Dopo circa 30 minuti, il farmaco è stato metabolizzato, i ratti hanno gradualmente ripreso conoscenza e l'attività EEG ed EMG è aumentata. Quando i ratti mostravano contrazioni degli arti, mentre i segnali EEG ed EMG erano attivi e non più in linea retta, il CCA è stato rapidamente legato. In questo momento, tutti e quattro i vasi sanguigni responsabili dell'afflusso di sangue al cervello erano bloccati, con conseguente ischemia cerebrale globale. Le attività EEG ed EMG sono state rapidamente inibite, formando quasi una linea retta, e il ratto non ha più lottato e i bulbi oculari sono apparsi grigi e bianchi (Figura 2A). Se i ratti non possono essere indotti in coma, significa che il modello ha fallito.
Dopo 30 minuti, il primo filo di legatura dei CCA è stato rilasciato per la riperfusione, ma il secondo filo di legatura posizionato davanti ai CCA ha mantenuto basso il livello di perfusione, inducendo il coma continuo nei ratti per circa 60 minuti. Con la graduale compensazione e la perfusione sanguigna del corpo, i ratti si sono gradualmente svegliati (Figura 2B). L'EEG e l'EMG dei ratti si sono ripresi quasi completamente dopo il risveglio.
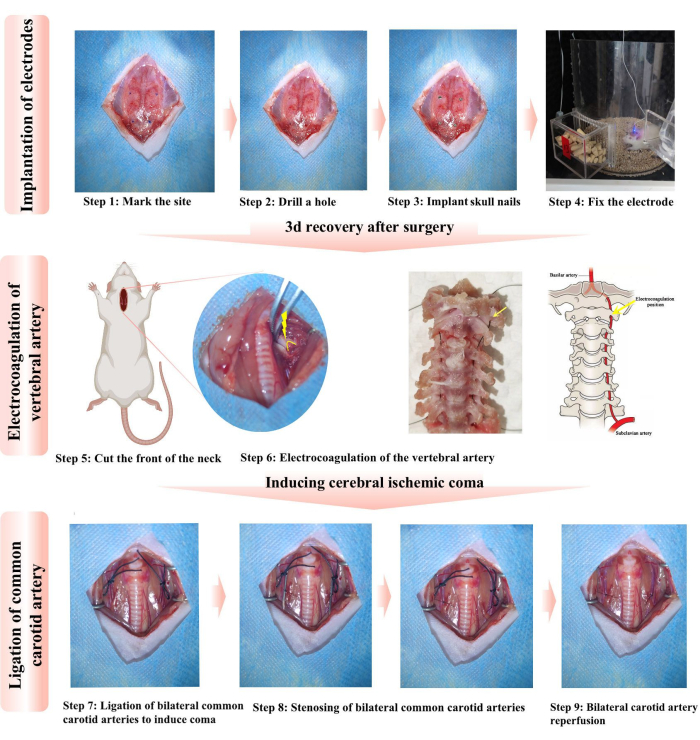
Figura 1: Diagramma di posizione dell'arteria vertebrale per elettrocoagulazione. I passaggi 1-3 delineano il protocollo per l'impianto degli elettrodi e il passaggio 4 verifica se gli elettrodi funzionano correttamente. Le fasi 5-6 descrivono in dettaglio la procedura di incisione chirurgica nella parte anteriore del collo e delle arterie vertebrali bilaterali (VA) per l'elettrocoagulazione. Le frecce e gli archi gialli indicano i siti chiave per l'elettrocoagulazione. I fili di seta vengono utilizzati per simulare il passaggio dell'arteria vertebrale attraverso la colonna vertebrale, fornendo un'indicazione più chiara della posizione caratteristica dell'arteria vertebrale elettrocoagulata. Le fasi 7-9 descrivono i protocolli per la legatura delle arterie carotidi comuni bilaterali (CCA) per indurre il coma. Tutte le procedure aderiscono alle linee guida sull'uso degli animali. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: L'elettroencefalogramma (EEG) e l'elettromiogramma (EMG) passano dal coma al recupero. (A) Forma d'onda dell'EEG, dell'EMG e dei livelli di attività nei ratti durante il coma ischemico cerebrale. (B) Diagramma dell'EEG, dell'EMG e dei livelli di attività nei ratti in transizione dal coma al risveglio. L'intero processo dura circa 90 minuti. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'occlusione a quattro vasi induce lesioni cerebrali ischemiche e ipossiche globali, che possono simulare coma acuto, arresto cardiaco, asfissia, shock, aritmia grave e altre condizioni cliniche critiche causate dall'ischemia cerebrale nella pratica clinica. Nel frattempo, l'occlusione a quattro vasi può portare a danni principalmente nell'ippocampo17,18, che è l'area funzionale primaria del cervello responsabile della memoria cognitiva 19,20,21. Pertanto, l'occlusione a quattro vasi può essere utilizzata anche per simulare un modello di demenza vascolare22,23. In sintesi, il modello di ischemia cerebrale globale indotta da occlusione a quattro vasi è stato ampiamente utilizzato per simulare le suddette malattie cliniche.
Nel 1979, Pulsinelli et al.10 hanno raggiunto l'ischemia cerebrale globale e la riperfusione bloccando le arterie carotidi comuni bilaterali e le arterie vertebrali bilaterali. Da allora, il modello è diventato gradualmente un metodo di preparazione classico riconosciuto a livello internazionale per i modelli di ischemia cerebrale globale 24,25,26. Tuttavia, questo metodo presenta alcuni problemi, come le differenze individuali nel processo trasverso e nel forame della prima vertebra cervicale, inclusi forami piccoli, irregolari e curvi, con conseguente elettrocoagulazione incompleta. Inoltre, l'elettrocoagulazione a lungo termine o l'eccessiva corrente elettrica possono comportare il rischio di danneggiare il tronco encefalico e il midollo spinale. Un'elettrocoagulazione insufficiente dell'arteria vertebrale può portare a sanguinamento significativo e altri problemi 15,16,27.
Pertanto, gli studiosi hanno continuamente apportato miglioramenti per garantire l'integrità dell'elettrocoagulazione dell'arteria vertebrale e ridurre la variabilità del modello28,29. A causa dell'invisibilità dell'elettrocoagulazione dell'arteria vertebrale attraverso il forame vertebrale, Todd et al.30 hanno esposto completamente l'arteria vertebrale e l'hanno bruciata sotto visione diretta perforando il forame atlante, aumentando così l'accuratezza dell'elettrocoagulazione. Tuttavia, questo metodo chirurgico è altamente invasivo e può danneggiare il rachide cervicale. La parete sottile del forame pterigoideo può facilmente danneggiare l'arteria vertebrale, causando sanguinamento massiccio e determinando un tasso di mortalità relativamente alto. Sugio et al.12 hanno visualizzato l'arteria vertebrale e l'hanno recisa in modo permanente inserendo un ago elettrico nei forami intervertebrali sinistro e destro della seconda vertebra cervicale. Toda et al.31 e Lu et al.27 hanno esposto l'arteria vertebrale tra il primo e il secondo processo trasverso al di fuori dell'articolazione dell'atlante sulla base di questa struttura anatomica ed hanno eseguito l'elettrocoagulazione. Questi ricercatori hanno risolto il problema dell'instabilità nell'elettrocoagulazione quando l'arteria vertebrale non era visibile esponendola dietro il collo ed eseguendo l'elettrocoagulazione.
Tuttavia, i ratti sottoposti a chirurgia sia all'addome che alla schiena avevano ancora un aumentato rischio di infezione, quindi alcuni studiosi hanno tentato di operare dalla parte anteriore del collo. Sun Wei et al.15 hanno raggiunto l'ischemia-riperfusione cerebrale globale separando l'arteria vertebrale dal collo anteriore, legando o tagliando le piccole arterie e tagliando continuamente o in modo intermittente il CCA. Questo passaggio richiede un'operazione meticolosa, poiché l'arteria vertebrale è difficile da separare a causa della sua natura sottile. Inoltre, i piccoli morsetti arteriosi sono difficili da bloccare con precisione l'arteria vertebrale. Se la separazione non è abbastanza chiara e pulita, porterà a un serraggio o a una legatura incompleti, che senza dubbio aumentano l'instabilità del modello.
Questo studio fornisce un metodo semplice e fattibile per l'elettrocoagulazione dell'arteria vertebrale. Il passo chiave non è separare l'arteria vertebrale, ma localizzare il forame trasverso dove l'arteria vertebrale attraversa ed entra nella prima vertebra cervicale. Questo è l'ingresso dell'arteria vertebrale, che ha una caratteristica curva, che consente ai principianti di localizzarla rapidamente. Dopo aver preriscaldato la penna per elettrocoagulazione, inserirla in posizione curva per coagulare rapidamente l'arteria vertebrale, durando 3-5 s per garantire la completa occlusione. Sia l'elettrocoagulazione dell'arteria vertebrale che la legatura CCA sono state eseguite in un'unica operazione, riducendo il rischio di infezione e la durata dell'esperimento.
Abbiamo anche scoperto che la morte dell'animale modello è stata causata principalmente dal blocco di tutti e quattro i vasi sanguigni responsabili dell'afflusso di sangue cerebrale e non era correlata al numero di operazioni chirurgiche. Tuttavia, il completamento di tutte le operazioni in un unico intervento chirurgico ha effettivamente abbreviato il periodo sperimentale. Inoltre, il metodo modificato può essere utilizzato anche per preparare il modello globale di ischemia-riperfusione cerebrale. Il modello di coma di ischemia cerebrale indotta da occlusione a quattro vasi può anche simulare il modello di "sindrome locked-in" nella medicina tradizionale cinese32. Pertanto, il modello introdotto in questo studio può anche fornire un riferimento per i praticanti della medicina tradizionale cinese.
Nella letteratura precedente 16,33,34, la legatura della stenosi CCA è stata eseguita 30 minuti dopo l'ischemia. Tuttavia, dopo 30 minuti di ischemia, alcuni ratti hanno mostrato una leggera coscienza a causa della compensazione. La stimolazione meccanica potrebbe causare il risveglio di questi ratti, portando al fallimento del modello di coma. Pertanto, nel nostro studio, il trattamento con stenosi CCA è stato effettuato immediatamente dopo l'inizio del coma. In questo momento, la profondità del coma era profonda, rendendo difficile stimolare i ratti a svegliarsi, garantendo la stabilità del modello. Il CCA era in uno stato di clamping durante questo trattamento e il trattamento con stenosi non avrebbe influenzato il flusso sanguigno.
Inoltre, nell'incisione del collo dei ratti, è stato osservato che le arterie vertebrali in tre intervalli spinali potrebbero essere bloccate dall'elettrocauterizzazione o dalla legatura. Tuttavia, c'è un segno caratteristico dell'ingresso dell'arteria vertebrale nella prima colonna vertebrale, che lo rende molto adatto per il blocco dell'elettrocauterizzazione. A causa della mancanza di marcatori caratteristici tra la seconda e la terza vertebra, nonché tra la terza e la quarta vertebra, la legatura della sutura è più adatta. Tuttavia, c'è uno svantaggio di una legatura insufficiente. Pertanto, in questo studio, l'elettrocauterizzazione è stata scelta per tagliare l'arteria vertebrale tra la prima e la seconda vertebra.
Inoltre, va notato che il successo di questo modello è strettamente correlato al peso dei ratti. È stato riportato che i ratti di peso compreso tra 180 e 200 g sono più adatti a indurre il coma. In questo studio, è stato anche scoperto che i ratti di peso inferiore a 180 g difficilmente possono sopportare il danno di quattro vasi sanguigni contemporaneamente, portando a un alto tasso di mortalità. Al contrario, se il peso è superiore a 220 g, il ratto si sveglierà rapidamente e non rimarrà in coma abbastanza a lungo da soddisfare lo standard del modello.
Inoltre, il diametro del foro stenopeico utilizzato per restringere il CCA è un altro fattore che influenza la durata del coma nei ratti. Gli studi hanno dimostrato che un diametro del foro stenopeico di 0,6 mm può indurre un coma continuo nei ratti per 6-8 ore con un alto tasso di sopravvivenza. Un diametro stenopeico di 0,45 mm ha causato un'estrema stenosi arteriosa nei ratti, portando al mancato recupero dei ratti gravemente feriti, mentre un diametro di 0,7 mm ha provocato un coma della durata di 1-3 ore, ma con significative differenze individuali16.
Tuttavia, nell'esperimento preliminare, un diametro stenopeico di 0,6 mm non poteva indurre il coma per più di 60 minuti, mentre un diametro di 0,5 mm poteva indurre il coma per 1-2 ore. Questo differisce dallo studio di Xiaobing Jia et al., che potrebbe essere dovuto a differenze negli anestetici e nei metodi di modellazione. In futuro sono necessari ulteriori studi per chiarire queste differenze.
In conclusione, questo studio presenta un metodo semplice, fattibile e adatto ai principianti per l'occlusione a quattro vasi. Serve come prezioso riferimento per i professionisti che studiano il coma ischemico cerebrale o l'ischemia cerebrale globale.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (82173781 e 82373835), dal progetto di ricerca post-dottorato (BKS212055), dal progetto di innovazione scientifica e tecnologica del Foshan Science and Technology Bureau (2320001007331), dalla Guangdong Basic and Applied Basic Research Foundation (2019A1515010806), dai progetti chiave sul campo (produzione intelligente) delle università generali nella provincia del Guangdong (2020ZDZX2057) e dai progetti di ricerca scientifica (innovazione caratteristica) del generale Università nella provincia del Guangdong (2019KTSCX195).
Materiali
| Name | Company | Catalog Number | Comments |
| 16 channel microfiber photoelectrode array | Jiangsu Yige Biotechnology Co., Ltd | 2605 | |
| 4-0 Surgical suture | Nantong Holycon Medical Devices Co.,Ltd. | B-104 | |
| 6-0 Surgical suture | Ningbo MEDICAL Needle Co., Ltd. | JM1216-742417 | |
| EEG electrode | Kedou Brain machine Technology Co., LTD | KD-EEGEMG | |
| Electrocoagulation pen | CONPUVON Company | 465 | |
| Lunion Stage Automatic Sleep Staging System | Shanghai Lulian Intelligent Technology Co., Ltd. | 1336 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 180-220g | |
| Skull nail | GLOBALEBIO,LTD | / | |
| Stereotaxic instrument | Rayward Life Technology Co., Ltd | 68801 | |
| Zoletil 50 | Vic Trading (Shanghai) Co., LTD | BN 88SHA |
Riferimenti
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529 (2024).
- Rong, M., et al. A modified model preparation for middle cerebral artery occlusion reperfusion. J Vis Exp. (207), e67060 (2024).
- Hoesch, R. E., Koenig, M. A., Geocadin, R. G. Coma after global ischemic brain injury: Pathophysiology and emerging therapies. Crit Care Clin. 24 (1), 25-44 (2008).
- You, W., et al. Amplitude-integrated electroencephalography predicts outcome in patients with coma after acute brain injury. Neurosc Bull. 34 (4), 639-646 (2018).
- He, F., Jiang, Y., Li, L. The effect of naloxone treatment on opioidinduced side effects A meta-analysis of randomized and controlled trails. Medicine (United States). 95 (37), e4729 (2016).
- Shukla, D. Description of coma and coma arousal therapy in Caraka Sahitā and its corollary in modern medicine. Neurol India. 65 (2), 250-252 (2017).
- Cossu, G. Therapeutic options to enhance coma arousal after traumatic brain injury: State of the art of current treatments to improve coma recovery. Brit J Neurosurg. 28 (2), 187-198 (2014).
- Li, J., Cheng, Q., Liu, F. K., Huang, Z., Feng, S. S. Sensory stimulation to improve arousal in comatose patients after traumatic brain injury: a systematic review of the literature. Neurol Sci. 41 (9), 2367-2376 (2020).
- Pulsinelli, W. A., Levy, D. E., Duffy, T. E. Cerebral blood flow in the four-vessel occlusion rat model. Stroke. 14 (5), 832-834 (1983).
- Pulsinelli, W. A., Brierley, J. B. A new model of bilateral hemispheric ischemia in the unanesthetized rat. Stroke. 10 (3), 267-272 (1979).
- Plaschke, K., et al. Pronounced arterial collateralization was induced after permanent rat cerebral four-vessel occlusion. Relation to neuropathology and capillary ultrastructure. J Neural Transm. 110 (7), 719-732 (2003).
- Sugio, K., Horigome, N., Sakaguchi, T., Goto, M. A model of bilateral hemispheric ischemia- modified four-vessel occlusion in rats: To the editor. Stroke. 19 (7), 922 (1988).
- Sadelli, K., et al. Global cerebral ischemia in rats leads to amnesia due to selective neuronal death followed by astroglial scar formation in the CA1 layer. Neurobiol Learn Mem. 141, 168-178 (2017).
- Song, B. W., et al. 1H-pyrrole-2,5-dione-based small molecule-induced generation of mesenchymal stem cell-derived functional endothelial cells that facilitate rapid endothelialization after vascular injury. Stem Cell Res Ther. 6 (1), 174 (2015).
- Sun, W., et al. A modified four vessel occlusion model of global cerebral ischemia in rats. J Neurosci Methods. 352, 109090 (2021).
- Xiaobing, J., et al. Modifying the four vessel occlusion to establish ischemic brain injury coma model in rats. Sichuan Med J. 29 (4), 384-386 (2008).
- Wang, W., et al. Levodopa improves cognitive function and the deficits of structural synaptic plasticity in hippocampus induced by global cerebral ischemia/reperfusion injury in rats. Front Neurosci. 14, 586321 (2020).
- Zhan, L., Lu, X., Xu, W., Sun, W., Xu, E. Inhibition of MLKL-dependent necroptosis via downregulating interleukin-1R1 contributes to neuroprotection of hypoxic preconditioning in transient global cerebral ischemic rats. J Neuroinflammation. 18 (1), 97 (2021).
- Konaka, K., Miyashita, K., Ishibashi-Ueda, H., Naritomi, H. Severe hyperthermia caused by four-vessel occlusion of main cerebral arteries. Internal Med. 48 (24), 2137-2140 (2009).
- Ferreira, E. D. F., Romanini, C. V., Mori, M. A., de Oliveira, R. M. W., Milani, H. Middle-aged, but not young, rats develop cognitive impairment and cortical neurodegeneration following the four-vessel occlusion/internal carotid artery model of chronic cerebral hypoperfusion. Eur J Neurosci. 34 (7), 1131-1140 (2011).
- Ma, B., et al. Protective effects of extract of Coeloglossum viride var. bracteatum on ischemia-induced neuronal death and cognitive impairment in rats. Behav Pharmacol. 19 (4), 325-333 (2008).
- Song, Y. Y., Chen, Y. H., Li, J. F., Sun, W. A review of animal models of vascular dementia. Chin J Comp Med. 33 (12), 75-85 (2023).
- Liu, B., et al. Autophagy activation aggravates neuronal injury in the hippocampus of vascular dementia rats. Neural Regen Res. 9 (13), 1288-1296 (2014).
- Li, J., Takeda, Y., Hirakawa, M. Threshold of ischemic depolarization for neuronal injury following four-vessel occlusion in the rat cortex. J Neurosurg Anesthesiol. 12 (3), 247-254 (2000).
- Rishitha, N., Muthuraman, A. Ameliorative potential of thymoquinone in four vessel occlusion induced vascular dementia in rats. Alzheimer Dement. 19 (S13), e71053 (2023).
- Oruc, S., et al. The antioxidant and antiapoptotic effects of crocin pretreatment on global cerebral ischemia reperfusion injury induced by four vessels occlusion in rats. Life Sci. 154, 79-86 (2016).
- Lu, D., et al. A modified method to reduce variable outcomes in a rat model of four-vessel arterial occlusion. Neurol Res. 38 (12), 1102-1110 (2016).
- Idt-Kastner, R. S., Paschen, W., Ophoff, B. G., Hossmann, K. A. A modified four-vessel occlusion model for inducing incomplete forebrain ischemia in rats. Stroke. 20 (7), 938-946 (1989).
- McBean, D. E., Kelly, P. A. T. Rodent models of global cerebral ischemia: A comparison of two-vessel occlusion and four-vessel occlusion. Gen Pharmacol. 30 (4), 431-434 (1998).
- Todd, N. V., Picozzi, P., Alan Crockard, H., Russell, A. R. R. Reperfusion after cerebral ischemia: Influence of duration of ischemia. Stroke. 17 (3), 460-466 (1986).
- Toda, S., et al. Highly reproducible rat model of reversible forebrain ischemia - Modified four-vessel occlusion model and its metabolic feature. Acta Neurochir (Wien). 144 (12), 1297-1304 (2002).
- Ma, R., Lu, D., Wang, J., Xie, Q., Guo, J. Comparison of pharmacological activity and safety of different stereochemical configurations of borneol: L-borneol, D-borneol, and synthetic borneol. Biomed Pharmacother. 164, 114668 (2023).
- Ji, X. Y., et al. Potential targets for protecting against hippocampal cell apoptosis after transient cerebral ischemia-reperfusion injury in aged rats. Neural Regen Res. 9 (11), 1122-1128 (2014).
- Martínez-Alonso, E., et al. Differential association of 4E-BP2-interacting proteins is related to selective delayed neuronal death after ischemia. Int J Mol Sci. 22 (19), 10327 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon