Method Article
修飾された4血管閉塞によって誘発された脳虚血性昏睡モデル
要約
このプロトコルは、修正された4血管閉塞法を使用して脳虚血性昏睡モデルを誘導するプロセスを説明しています。
要約
脳虚血による昏睡は、脳虚血の最も深刻な合併症です。4血管閉塞は、疾患研究や医薬品開発のための脳虚血性昏睡モデルを確立することができます。ただし、一般的に使用される4血管閉塞法では、主に首の後ろにある最初の頸椎の両側翼状孔に電気凝固ペンを挿入して、椎骨動脈を電気凝固します。このプロセスは、不完全な電気凝固、出血、および脳幹と脊髄の損傷のリスクを伴います。手術の24時間後、再麻酔をかけたラットは首の前で頸動脈結紮術を受けます。2回の手術では、ラットは感染のリスクが高くなり、実験期間が長くなります。この研究では、1 回の外科的処置中に、椎骨動脈が最初の頸椎を貫通する重要な部位を特定するために、前方頸椎切開が使用されました。両側椎骨動脈は視覚条件下で電気焼灼されましたが、両側の総頸動脈は緩い結び目を配置するために分離されました。ラットの手足がけいれんし始めると、両側の総頸動脈がすぐに結紮され、虚血性昏睡を誘発しました。この方法は、2回の外科手術による感染のリスクを回避でき、成功率が高く、簡単に実施できるため、関連する開業医にとって有用な参考資料となります。
概要
虚血性脳損傷は、臨床診療で最も一般的な脳損傷であり、脳血管疾患の症例の約75%を占めています。虚血は重度の二次性脳損傷や疾患1,2を引き起こす可能性があり、昏睡は虚血性低酸素性脳損傷によって引き起こされる最も重篤な症状です。また、多くの重篤な状態3の最終的な経路でもあります。昏睡は、臨床診療では重篤で重篤な病気であり、管理が困難です4.昏睡状態が長引くほど、潜在的な危険性は大きくなります。迅速な覚醒は、状態の悪化と進行を防ぐための主要な目標です。ナロキソン注射は覚醒を促進するために幅広い臨床応用がありますが、それでもいくつかの副作用があります5。そのため、安全で効果的な覚醒促進薬の開発は喫緊の課題です。虚血性昏睡の病因を解明し、医薬品開発のためには、シンプルで操作が容易な脳虚血性昏睡モデルを確立することが不可欠である6,7,8。
本研究の目的は、両側脊椎動脈 (VA) の電気凝固術と両側総頸動脈 (CCA) の一時的な結紮により、全般的な虚血性昏睡を誘発するモデルを紹介することであり、これは初心者にとって簡単で使いやすいものです。以前のプロトコルでは、最初の手術中に最初の後部頸椎の両側翼状突起孔を露出させ、翼状突起孔を電気的に燃焼させて両側の VA をブロックする必要がありました。24時間後に2回目の手術が行われ、両側CCA9,10,11,12のライゲーションにより全虚血性昏睡を誘発した。しかし、目に見えないため、不完全な電気凝固、出血、脳幹、脊髄損傷のリスクがあり、実験期間が長引くリスクがあります。したがって、これらの問題に対処する必要があります。
ここでは、虚血性昏睡をモデル化するための改良された方法を紹介します。主な手順には、正中頸部を切開し、視覚条件下で両側のVAの電気的切除を行い、1回の手術で両側のCCAを短時間結紮して脳全体への血液供給を遮断し、急速な脳波(EEG)阻害を引き起こし、昏睡を引き起こすことが含まれます。この方法はまた、再灌流後に短時間の連続的な昏睡を誘発する。この手順は、実施が簡単で、初心者にやさしく、動物の二次外傷感染のリスクを減らし、それによって実験期間を短縮します。
このプロトコルは、心停止によって引き起こされる全体的な虚血性昏睡の研究に適しています。また、主に海馬の脳領域が虚血に非常に敏感であるため、虚血性認知症の研究にも理想的です。したがって、一過性脳虚血は、海馬ニューロンの損傷または喪失さえも引き起こし、認知機能障害をもたらす可能性がある13。したがって、このプロトコルは、脳虚血、虚血性昏睡、および虚血性認知症を研究する開業医に参考を提供することができます。
プロトコル
実験プロトコルは、佛山大学の実験動物の使用および施設動物の管理および使用委員会の要件に従って実施されました(記録番号:2023-643656)。この研究には、雄のSprague Dawley(SD)ラット(200 g±20 g、6〜8週齢)を使用しました。すべての動物実験データは、ARRIVE(Animal Research: Reporting In Vivo Experiments)ガイドラインに従って作成されています。本試験で使用した試薬および機器の詳細は、 資料表に記載されています。
1. 脳波電極の埋め込み
- 麻酔の15分前に0.05mg / kgのアトロピンを皮下に注射して、 ?? 物による呼吸閉塞と窒息を防ぎます。.ラットに麻酔をかけるために、20 mg / kgゾレチルと5 mg / kgキシラジンの筋肉内注射を投与します14。ピンセットを使用してラットのつま先を固定し、深い麻酔を確認します。
- ヘアシェーバーでネズミの頭から毛を取り除きます。非貫通性の耳棒を使用して、ラットの頭を脳の定位固定装置に固定します。滅菌コットンボールを使用して、エタノールとポビドンヨウ素を手術部位に3回塗布し、皮膚を消毒します。
- ラットの頭の皮膚を切断された縫合糸に沿って外科用刃で切ります。頭蓋骨を覆っている筋肉を取り除き、頭蓋骨を完全に露出させます。滅菌綿棒を使用して、プロセス全体で出血を止めます。
- 耳洗いボールで頭蓋骨の表面をブロードライして、歯科用セメントが頭蓋骨にしっかりと付着するのを助けます。頭蓋骨の釘の取り付け位置(直径1.2 mm、長さ3 mm)を黒いマーカーでマークします(図1、ステップ1)。具体的な位置は、前泉門と他の4つのサイトです。
- 10 mLシリンジの針を使用して、4つの領域を順番に回転させ、ドリルで穴を開けます。4本の頭蓋骨の釘を頭蓋骨に順番に挿入し、大脳皮質との接触を確保します(図1、ステップ2-3)。
注:骨の爪の錆びを防ぐために、出血の場合に血液を吸収するために滅菌綿棒を使用してください。 - EEG電極の銀線を頭蓋骨の爪に巻き付けます。筋電図電極を筋肉に埋め込み、6-0縫合糸で固定します。
- 義歯ベース樹脂と自己硬化性義歯用パウダーを混合し、電極を頭蓋骨に固定します。耳洗ボールを使用して歯科用セメントの表面に空気を吹き込み、硬化を促進します。
- 感染を防ぐために10,000単位のペニシリンを注射します。各ラットを別々のケージに収容して、相互の引き裂きや電極の損傷を防ぎます。術後の痛みを軽減するために、0.2 mg / kgメロキシカムを3日間連続して皮下注射しました。ラットの創傷の回復と電極の固定に3日間かかります(図1、ステップ4)。
2. 脳虚血性昏睡モデルの手術過程
- 3日後、ラットに再度麻酔をかけ、仰臥位に置きます。滅菌コットンボールを使用して、ヨウ素を3回繰り返し塗布した後、アルコールリンス/ワイプを行うことで手術部位を消毒します。胸骨の上縁から首の中央に沿って縦にメスで約2〜3cmの長さを切開します(図1、ステップ5)。
- 皮下組織と胸骨舌骨筋を鈍く分離し、気管と気管の両側の長股筋を完全に露出させる15。
注:手順全体を通して気管を刺激することは避けてください。 - 長蝶筋を甲状腺のレベルから下方に鈍く分離し、第1および第2頸椎を露出させます。ラット組織拡張器で首の部分を拡張し、手術部位を完全に露出させます。
- 細い鉗子を使用して、頸椎間腔に見える筋肉と組織を慎重に分離し、椎骨動脈が最初の頸椎に入る特徴的な位置を露出させます。椎骨動脈が最初の頸椎を通過することが観察できます(図1、ステップ6)。
注:1mLのシリンジを首の下に置くと、より明確な外科的操作スペースが得られます。 - 電気凝固ペンを予熱し、その領域に3〜5秒間挿入して、椎骨動脈が電気凝固して切断されていることを確認します。胸鎖乳突筋の内側の縁に沿って筋肉と筋膜を分離し、両側のCCAを露出させて解放し、緩い結び目を作ります。
注意: 電気凝固ペンは予熱する必要があります。そうしないと、椎骨動脈を迅速に凝固させることができず、出血につながります。両方の椎骨動脈は電気凝固され、CCAの周りに緩い結び目が結ばれています。 - ラットが意識を取り戻し、手足のけいれんを示したときに、脳波検出器がアクティブな脳波とEMG信号を検出するときに、CCAの血流を遮断するために最初の緩い結び目をすばやく締めます。ラットは数秒間もがき、その後徐々に意識を失います(図1、ステップ7)。
- 固定を解除した後、ラットの手足が硬くなり、立ち直り反射が消えますが、呼吸は維持されるのを観察します。この時点で、筋電図(EMG)は直線を示し、EEGは急速に抑制され、4-VO誘発脳虚血モデルが成功したことを示しています16。
注:呼吸抑制は、両側CCA結紮中に一部のラットで発生します。急速な機械的刺激により、一部のラットでは自発呼吸を回復させることができます。 - 「ニードルコントロールタイ法16」に従って、CCA、ICA、ECAの分岐部から約1.5cm離れたところに6-0ナイロン糸を使用して、直径0.5mmのシリンジ針でCCAを縛ります。針を慎重に引き出します。この2番目の結び目は、その後、頸動脈を狭くします(図1、ステップ8)。
注:CCA狭窄に使用される結紮糸は、安定したナイロン素材でできている必要があります。ナイロン糸は血液の影響を受けず、太くなりません。そうしないと、ラットのCCAの極端な狭窄を引き起こし、死亡率を増加させる可能性があります。 - 虚血が30分続いた後、最初の結び目をほどくとCCAは再灌流されますが、2番目の結び目はCCAの狭窄を引き起こし、持続的な昏睡を誘発します(図1、ステップ9)。吸収性モノフィラメント縫合糸で皮下組織を閉じ、非吸収性モノフィラメント縫合糸で皮膚を閉じます。
3. 動物の回復
- ラットを断熱パッドに置き、感染を防ぐために10,000ユニットのペニシリンを注入します。0.2 mg / kgメロキシカムを3日間連続して皮下注射して、術後の痛みを軽減します。.
- 60分の再灌流後、ラットが徐々に回復することを確認します。
結果
電極の埋め込みによる炎症などの刺激により、脳波が不安定になる可能性があるため、ラットは3日間回復する必要があります。3日後に脳波とEMGが正常なラットは、昏睡モデルの準備に含めることができます。ラットに麻酔をかけたところ、脳波と筋電図の活動はわずかに抑制されましたが、スムーズに進行しました。電気凝固術が両側のVAをブロックした後、EEGおよびEMG活性に有意な変化はありませんでした。約30分後、薬物は代謝され、ラットは徐々に意識を取り戻し、EEGとEMGの活動が増加しました。ラットが四肢のけいれんを示し、EEGとEMGの信号がアクティブでなくなったとき、CCAはすぐに結紮されました。この瞬間、脳への血液供給を司る4本の血管が全て詰まり、全身性脳虚血が引き起こされました。EEGとEMGの活動は急速に阻害され、ほぼ直線を形成し、ラットはもはやもがくことはなく、眼球は灰色と白に見えました(図2A)。ラットを昏睡状態に誘導できない場合は、モデルが失敗したことを意味します。
30分後、CCAの1本目のライゲーションスレッドは再灌流のために解放されましたが、CCAの前に置かれた2本目のライゲーションスレッドは灌流レベルを低く保ち、ラットに約60分間連続的な昏睡を誘発しました。体内の段階的な補償と血液の灌流により、ラットは徐々に目覚めました(図2B)。ラットの脳波と筋電図は、起床後にほぼ完全に回復しました。
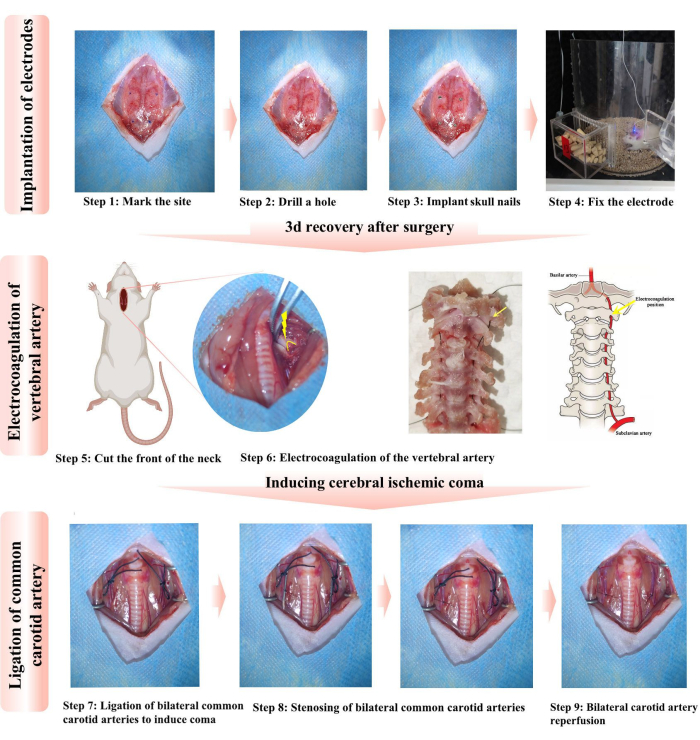
図1:電気凝固椎骨動脈の位置図。 ステップ1〜3では、電極を埋め込むためのプロトコルの概要を説明し、ステップ4では、電極が適切に機能しているかどうかをテストします。ステップ5〜6では、電気凝固のための首の前部と両側椎骨動脈(VA)の外科的切開手順について詳しく説明します。黄色の矢印と円弧は、電気凝固の主要な部位を示しています。絹糸は、脊椎動脈が脊椎を通過することをシミュレートするために使用され、電気凝固した椎骨動脈の特徴的な位置をより明確に示します。ステップ 7 から 9 では、昏睡を誘発するための両側総頸動脈 (CCA) の結紮のプロトコルについて説明します。すべての手続きは、動物の使用ガイドラインに準拠しています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:昏睡状態から回復状態までの脳波(EEG)と筋電図(EMG)の変化。(A) 脳虚血性昏睡中のラットの脳波、筋電図、および活動レベルの波形。(B)昏睡状態から覚醒状態に移行するラットの脳波、筋電図、および活動レベルの図。全体のプロセスは約90分続きます。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
4血管閉塞は、全体的な虚血性および低酸素性脳損傷を誘発し、急性昏睡、心停止、窒息、ショック、重度の不整脈、および臨床診療における脳虚血によって引き起こされるその他の重大な臨床状態をシミュレートすることができます。一方、4血管閉塞は、主に海馬17,18において損傷を引き起こす可能性があり、これは認知記憶19,20,21に関与する主要な機能的脳領域である。したがって、4血管閉塞は、血管性認知症モデルをシミュレートするためにも使用できます22,23。要約すると、4血管閉塞誘発性全球脳虚血モデルは、前述の臨床疾患のシミュレーションに広く使用されています。
1979年、Pulsinelliら10は、両側の総頸動脈と両側脊椎動脈を遮断することにより、全体的な脳虚血と再灌流を達成しました。それ以来、このモデルは徐々に国際的に認められた古典的な調製方法になりました 全体的な脳虚血モデル 24,25,26.しかし、この方法では、第1頸椎の横突起や孔の個人差、小さな孔、不規則な孔、湾曲した孔など、いくつかの問題があり、電気凝固が不完全になります。さらに、長期間の電気凝固術や過度の電流は、脳幹や脊髄を損傷するリスクをもたらす可能性があります。椎骨動脈の電気凝固が不十分な場合、重大な出血やその他の問題を引き起こす可能性があります15,16,27。
したがって、学者は、椎骨動脈の電気凝固の完全性を確保し、モデル28,29のばらつきを減らすために継続的に改善を行ってきました。椎骨孔を介して椎骨動脈を電気凝固させることは不可能であるため、Todd et al.30 は椎骨動脈を完全に露出させ、アトラス孔を貫通して直接視下で燃焼させ、それによって電気凝固の精度を向上させました。ただし、この外科的方法は非常に侵襲的であり、頸椎を損傷する可能性があります。翼状孔の薄い壁は椎骨動脈を損傷しやすく、大量の出血を引き起こし、比較的高い死亡率をもたらします。Sugioら12は、椎骨動脈を視覚化し、第2頸椎の左右の椎間孔に電気針を挿入することにより、椎骨動脈を永久に切断しました。Toda et al.31 と Lu et al.27 は、この解剖学的構造に基づいて、アトラス関節の外側で第 1 と第 2 の横突起の間の椎骨動脈を露出させ、電気凝固を行いました。これらの研究者たちは、椎骨動脈が見えない場合の電気凝固の不安定性の問題を、椎骨動脈を頸部の後ろに露出させて電気凝固を行うことで解決しました。
しかし、腹部と背中の手術を受けたラットは依然として感染リスクが高かったため、一部の学者は首の前から手術を試みました。Sun Weiら15 は、前頸部から椎骨動脈を分離し、小動脈を結紮またはクリッピングし、CCAを連続的または断続的にクリッピングすることにより、全体的な脳虚血再灌流を達成しました。このステップは、椎骨動脈がその微妙な性質のために分離するのが難しいため、細心の注意を払った操作が必要です。さらに、小さな動脈クランプは、椎骨動脈を正確にクランプすることが困難です。分離が明確で十分にきれいでない場合、不完全なクランプまたはライゲーションにつながり、モデルの不安定性が確実に増加します。
この研究は、椎骨動脈電気凝固のための簡単で実行可能な方法を提供します。重要なステップは、椎骨動脈を分離することではなく、椎骨動脈が交差して最初の頸椎に入る横椎孔を見つけることです。これは椎骨動脈への入り口で、湾曲した特徴があり、初心者でもすぐに見つけることができます。電気凝固ペンを予熱した後、湾曲した位置に挿入して椎骨動脈をすばやく凝固させ、3〜5秒間持続して完全な閉塞を確保します。椎骨動脈電気凝固術とCCA結紮術の両方を1回の手術で実施し、感染リスクと実験期間を短縮しました。
また、モデル動物の死亡は、主に脳の血液供給を担う4本の血管すべての閉塞によるものであり、手術回数とは関係ないこともわかりました。しかし、1回の手術ですべての手術を完了することで、確かに実験期間は短縮されました。さらに、改変された方法は、全体的な脳虚血再灌流モデルを調製するためにも使用できます。4血管閉塞誘発性脳虚血昏睡モデルは、伝統的な中国医学の「閉じ込め症候群」モデルをシミュレートすることもできる32。したがって、この研究で紹介されたモデルは、伝統的な中国医学の開業医にとっても参考になることができます。
以前の文献16,33,34では、CCA狭窄結紮術は虚血の30分後に行われた。しかし、虚血の30分後、一部のラットは代償のためにわずかな意識を示しました。機械的刺激により、これらのラットが目を覚まし、コマモデルの失敗につながる可能性があります。そこで、本研究では、昏睡状態の発症直後にCCA狭窄治療を行いました。このとき、コマの深さが深く、ラットを刺激して目を覚ますのが難しく、モデルの安定性が確保されていました。この治療中、CCAはクランプ状態にあり、狭窄治療は血流に影響を与えませんでした。
さらに、ラットの頸部切開では、3つの脊椎間隔の椎骨動脈が電気焼灼または結紮によって閉塞される可能性があることが観察されました。ただし、最初の脊椎には椎骨動脈の侵入の特徴的な兆候があり、電気焼灼の遮断に非常に適しています。第2椎骨と第3椎骨の間、および第3椎骨と第4椎骨の間には特徴的なマーカーがないため、縫合結紮がより適しています。しかしながら、結紮が不十分であるという欠点がある。したがって、この研究では、第 1 椎骨と第 2 椎骨の間の椎骨動脈を切断するために電気焼灼が選択されました。
さらに、このモデルの成功はラットの体重と密接に関連していることに注意する必要があります。体重が180〜200 gのラットは、昏睡を誘発するのに適していると報告されています。この研究では、体重が180g未満のラットは、4本の血管の損傷に同時に耐えられず、死亡率が高いことも判明しました。逆に、重量が220 gを超えると、ラットはすぐに目を覚まし、モデル基準を満たすのに十分な時間昏睡状態に留まりません。
さらに、CCAを狭窄させるために使用されるピンホールの直径は、ラットの昏睡期間に影響を与える別の要因です。研究によると、ピンホールの直径0.6mmは、高い生存率でラットに6〜8時間連続的な昏睡を誘発できることが示されています。0.45mmのピンホール径はラットに極度の動脈狭窄を引き起こし、重傷を負ったラットの回復に失敗し、直径0.7mmは1〜3時間続く昏睡をもたらしましたが、有意な個人差がありました16。
しかし、予備実験では、ピンホール径0.6mmでは60分以上コマを誘発できず、直径0.5mmでは1〜2時間コマを誘発することができました。これは、Xiaobing Jiaらの研究とは異なり、麻酔薬とモデリング方法の違いによるものかもしれません。これらの違いを解明するためには、今後さらなる研究が必要です。
結論として、この研究は、4血管閉塞のためのシンプルで実現可能、そして初心者に優しい方法を提示します。これは、脳虚血性昏睡または全体的な脳虚血を研究する開業医にとって貴重な参考資料として機能します。
開示事項
著者は何も開示していません。
謝辞
この研究は、中国国家自然科学基金会(82173781および82373835)、ポスドク研究プロジェクト(BKS212055)、佛山科学技術局の科学技術イノベーションプロジェクト(2320001007331)、広東省基礎応用基礎研究基金会(2019A1515010806)、広東省の一般大学の主要フィールドプロジェクト(インテリジェント製造)(2020ZDZX2057)、および一般科学研究プロジェクト(特性イノベーション)の支援を受けました。広東省の大学(2019KTSCX195)。
資料
| Name | Company | Catalog Number | Comments |
| 16 channel microfiber photoelectrode array | Jiangsu Yige Biotechnology Co., Ltd | 2605 | |
| 4-0 Surgical suture | Nantong Holycon Medical Devices Co.,Ltd. | B-104 | |
| 6-0 Surgical suture | Ningbo MEDICAL Needle Co., Ltd. | JM1216-742417 | |
| EEG electrode | Kedou Brain machine Technology Co., LTD | KD-EEGEMG | |
| Electrocoagulation pen | CONPUVON Company | 465 | |
| Lunion Stage Automatic Sleep Staging System | Shanghai Lulian Intelligent Technology Co., Ltd. | 1336 | |
| Miniature hand-held skull drill | Rayward Life Technology Co., Ltd | 87001 | |
| Penicillin sodium | Chengdu Kelong Chemical Co., Ltd. | 17121709-2 | |
| SD rats | SPF ( Beijing ) Biotechnology Co.,Ltd. | 180-220g | |
| Skull nail | GLOBALEBIO,LTD | / | |
| Stereotaxic instrument | Rayward Life Technology Co., Ltd | 68801 | |
| Zoletil 50 | Vic Trading (Shanghai) Co., LTD | BN 88SHA |
参考文献
- Hou, Y., et al. Rhodiola crenulata alleviates hypobaric hypoxia-induced brain injury by maintaining BBB integrity and balancing energy metabolism dysfunction. Phytomedicine. 128, 155529 (2024).
- Rong, M., et al. A modified model preparation for middle cerebral artery occlusion reperfusion. J Vis Exp. (207), e67060 (2024).
- Hoesch, R. E., Koenig, M. A., Geocadin, R. G. Coma after global ischemic brain injury: Pathophysiology and emerging therapies. Crit Care Clin. 24 (1), 25-44 (2008).
- You, W., et al. Amplitude-integrated electroencephalography predicts outcome in patients with coma after acute brain injury. Neurosc Bull. 34 (4), 639-646 (2018).
- He, F., Jiang, Y., Li, L. The effect of naloxone treatment on opioidinduced side effects A meta-analysis of randomized and controlled trails. Medicine (United States). 95 (37), e4729 (2016).
- Shukla, D. Description of coma and coma arousal therapy in Caraka Sahitā and its corollary in modern medicine. Neurol India. 65 (2), 250-252 (2017).
- Cossu, G. Therapeutic options to enhance coma arousal after traumatic brain injury: State of the art of current treatments to improve coma recovery. Brit J Neurosurg. 28 (2), 187-198 (2014).
- Li, J., Cheng, Q., Liu, F. K., Huang, Z., Feng, S. S. Sensory stimulation to improve arousal in comatose patients after traumatic brain injury: a systematic review of the literature. Neurol Sci. 41 (9), 2367-2376 (2020).
- Pulsinelli, W. A., Levy, D. E., Duffy, T. E. Cerebral blood flow in the four-vessel occlusion rat model. Stroke. 14 (5), 832-834 (1983).
- Pulsinelli, W. A., Brierley, J. B. A new model of bilateral hemispheric ischemia in the unanesthetized rat. Stroke. 10 (3), 267-272 (1979).
- Plaschke, K., et al. Pronounced arterial collateralization was induced after permanent rat cerebral four-vessel occlusion. Relation to neuropathology and capillary ultrastructure. J Neural Transm. 110 (7), 719-732 (2003).
- Sugio, K., Horigome, N., Sakaguchi, T., Goto, M. A model of bilateral hemispheric ischemia- modified four-vessel occlusion in rats: To the editor. Stroke. 19 (7), 922 (1988).
- Sadelli, K., et al. Global cerebral ischemia in rats leads to amnesia due to selective neuronal death followed by astroglial scar formation in the CA1 layer. Neurobiol Learn Mem. 141, 168-178 (2017).
- Song, B. W., et al. 1H-pyrrole-2,5-dione-based small molecule-induced generation of mesenchymal stem cell-derived functional endothelial cells that facilitate rapid endothelialization after vascular injury. Stem Cell Res Ther. 6 (1), 174 (2015).
- Sun, W., et al. A modified four vessel occlusion model of global cerebral ischemia in rats. J Neurosci Methods. 352, 109090 (2021).
- Xiaobing, J., et al. Modifying the four vessel occlusion to establish ischemic brain injury coma model in rats. Sichuan Med J. 29 (4), 384-386 (2008).
- Wang, W., et al. Levodopa improves cognitive function and the deficits of structural synaptic plasticity in hippocampus induced by global cerebral ischemia/reperfusion injury in rats. Front Neurosci. 14, 586321 (2020).
- Zhan, L., Lu, X., Xu, W., Sun, W., Xu, E. Inhibition of MLKL-dependent necroptosis via downregulating interleukin-1R1 contributes to neuroprotection of hypoxic preconditioning in transient global cerebral ischemic rats. J Neuroinflammation. 18 (1), 97 (2021).
- Konaka, K., Miyashita, K., Ishibashi-Ueda, H., Naritomi, H. Severe hyperthermia caused by four-vessel occlusion of main cerebral arteries. Internal Med. 48 (24), 2137-2140 (2009).
- Ferreira, E. D. F., Romanini, C. V., Mori, M. A., de Oliveira, R. M. W., Milani, H. Middle-aged, but not young, rats develop cognitive impairment and cortical neurodegeneration following the four-vessel occlusion/internal carotid artery model of chronic cerebral hypoperfusion. Eur J Neurosci. 34 (7), 1131-1140 (2011).
- Ma, B., et al. Protective effects of extract of Coeloglossum viride var. bracteatum on ischemia-induced neuronal death and cognitive impairment in rats. Behav Pharmacol. 19 (4), 325-333 (2008).
- Song, Y. Y., Chen, Y. H., Li, J. F., Sun, W. A review of animal models of vascular dementia. Chin J Comp Med. 33 (12), 75-85 (2023).
- Liu, B., et al. Autophagy activation aggravates neuronal injury in the hippocampus of vascular dementia rats. Neural Regen Res. 9 (13), 1288-1296 (2014).
- Li, J., Takeda, Y., Hirakawa, M. Threshold of ischemic depolarization for neuronal injury following four-vessel occlusion in the rat cortex. J Neurosurg Anesthesiol. 12 (3), 247-254 (2000).
- Rishitha, N., Muthuraman, A. Ameliorative potential of thymoquinone in four vessel occlusion induced vascular dementia in rats. Alzheimer Dement. 19 (S13), e71053 (2023).
- Oruc, S., et al. The antioxidant and antiapoptotic effects of crocin pretreatment on global cerebral ischemia reperfusion injury induced by four vessels occlusion in rats. Life Sci. 154, 79-86 (2016).
- Lu, D., et al. A modified method to reduce variable outcomes in a rat model of four-vessel arterial occlusion. Neurol Res. 38 (12), 1102-1110 (2016).
- Idt-Kastner, R. S., Paschen, W., Ophoff, B. G., Hossmann, K. A. A modified four-vessel occlusion model for inducing incomplete forebrain ischemia in rats. Stroke. 20 (7), 938-946 (1989).
- McBean, D. E., Kelly, P. A. T. Rodent models of global cerebral ischemia: A comparison of two-vessel occlusion and four-vessel occlusion. Gen Pharmacol. 30 (4), 431-434 (1998).
- Todd, N. V., Picozzi, P., Alan Crockard, H., Russell, A. R. R. Reperfusion after cerebral ischemia: Influence of duration of ischemia. Stroke. 17 (3), 460-466 (1986).
- Toda, S., et al. Highly reproducible rat model of reversible forebrain ischemia - Modified four-vessel occlusion model and its metabolic feature. Acta Neurochir (Wien). 144 (12), 1297-1304 (2002).
- Ma, R., Lu, D., Wang, J., Xie, Q., Guo, J. Comparison of pharmacological activity and safety of different stereochemical configurations of borneol: L-borneol, D-borneol, and synthetic borneol. Biomed Pharmacother. 164, 114668 (2023).
- Ji, X. Y., et al. Potential targets for protecting against hippocampal cell apoptosis after transient cerebral ischemia-reperfusion injury in aged rats. Neural Regen Res. 9 (11), 1122-1128 (2014).
- Martínez-Alonso, E., et al. Differential association of 4E-BP2-interacting proteins is related to selective delayed neuronal death after ischemia. Int J Mol Sci. 22 (19), 10327 (2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved