Method Article
Modeling Posthemorrhagic Hydrocephalus of Prematurity in Rats
요약
신생아 쥐에서 출혈후 미숙수두증(PHHP)을 융모양막염과 뇌실내 출혈을 결합하여 모델링할 수 있습니다. 이러한 산전 및 산후 사건의 조합은 대두증, 심실 비대증 및 두개내압 상승을 포함한 PHP의 임상적 특징을 수명 전반에 걸쳐 정확하게 요약합니다.
초록
출혈후 미숙아수두증(PHHP)은 재태 연령(GA)이 32주 미만인 초미숙아에서 발생하는 중증 뇌실내 출혈(IVH)의 심각한 후유증입니다. PHHP는 두개내압(ICP) 상승의 임상 증상과 관련된 뇌척수액(CSF)의 축적으로 정의됩니다. HHP를 앓고 있는 영아는 평생 션트 의존증을 앓고 있으며, 절반은 생후 1년 이내에 재수술이 필요하고 많은 경우 평생 동안 여러 번의 추가 수술이 필요합니다. 산전 융모막염은 미숙아를 중증 IVH에 걸리게 하고 HHP의 외과적 치료가 필요한 경우 신생아 패혈증이 발생하는 경향이 있습니다. 이러한 임상적 특징은 전신 염증이 PHHP 병태생리학의 필수 구성 요소임을 시사합니다.
여기에서는 쥐에서 PHHP의 모든 임상적 측면과 필수 기능을 요약한 동물 모델을 정의합니다. 이 프로토콜의 목표는 자궁 융모양막염과 산후 IVH에서 용해된 적혈구를 사용하여 HHP를 생성하는 방법을 설명하는 것입니다. 이 전임상 접근법은 진행성 대두증 및 돔형 두개골, 두개내 압력 상승 및 뇌실 비대증을 산출하며, 이는 자기 공명 영상(MRI) 또는 현미경을 통해 감지할 수 있습니다. 뇌척수액 역학의 지속적인 방해 외에도 쥐는 성인이 될 때까지 인지 지연과 기능 장애를 가지고 있습니다. 따라서 이 전임상 플랫폼은 분자, 세포, 생화학, 조직학적, 이미징 및 기능적 결과 측정을 통합할 수 있는 PHHP의 독특하고 비교할 수 없는 중개 연구를 촉진합니다. 또한 맥락막신경총(choroid plexus), 뇌실막운동성(ependymal motile cilia) 및 글림프계(glymphatic system)를 병렬로 엄격하게 분석하는 데 사용할 수 있습니다. 마지막으로, 수두증 치료를 위한 새로운 외과적 중재 전략 및 비수술적 치료 접근법을 조사하기 위한 귀중한 전임상 도구가 될 수도 있습니다.
서문
출혈 후 미숙수두증(PHHP)은 여전히 상당한 공중 보건 문제로 남아 있습니다. 뇌실내 출혈(IVH)에 이차적으로 발생하는 두개내압(ICP) 상승과 함께 뇌척수액(CSF)의 증상 축적으로 정의되는 PHHP는 미숙아 뇌병증의 심각한 징후이며 전 세계 조산 및 후천성 수두증 1,2의 부담에 크게 기여합니다. 전 세계적으로 매년 약 400,000명의 신생아가 수두증을 앓거나 평생 앓게 되며3 많은 수가 치료 부족으로 인해 사망합니다3. PHHP는 선진국에서 중증 IVH를 가진 미숙아(임신 <32주)에서 흔하게 발생하며, 이미 생명을 위협하는 다른 동반 질환을 앓고 있는 가장 아픈 영아에게 영향을 미치는 경우가 많습니다 4,5.
수두증에 사용할 수 있는 유일한 치료법은 수술이다6. 뇌척수액을 전환하기 위한 심실복막(VP) 션트(CSF), 내시경 제3뇌실절개술(ETV) 또는 맥락막신경총 응고를 동반한 ETV(ETV-CPC)에 관계없이, 첫 번째 영구 중재 시점에 영아가 6개월 이상일 때 수술 절차가 더 오래 지속됩니다7. 가장 흔한 옵션인 VP 션트는 종종 1년 이내에 실패하고 어린이를 평생 합병증, 반복 수술 및 입원에 노출시켜 어린이, 가족 및 사회에 막대한 비용을 초래합니다. 8 특히, 언제라도 실패할 수 있는 션트(shunt)로 인한 불안은 가족에게 부담이 된다9. 잦은 수술을 포함하여 증상이 있는 수두증이 있는 소아를 돌보는 것은 소아과 의료 지출의 주요 원인입니다 10,11,12,13,14. 2003년 아동의 션트 관련 지출로 인한 연간 추정 비용은 20억 달러였다15. 션트가 있는 어린이는 입원 환자의 0.6%에 불과하지만 소아과 병원 비용의 3.1%를 발생시킵니다15. 따라서 PHHP 치료를 위한 안전한 비수술적 치료법을 발견하는 것이 가장 중요합니다.
영아의 경우, PHHP는 뇌출혈이 처음 확인된 후 몇 주에서 몇 달 동안 지속되는 임상 기간 경과에 걸쳐 IVH 이후 발생합니다. HCRN(Hydrocephalus Clinical Research Network)에서 실시한 연구에 따르면 VP 션트는 PHHP16을 가진 신생아에게 가장 좋은 수술 옵션으로 남아 있습니다. 숙련된 소아 신경외과 치료를 받을 수 있는 고소득 국가의 HHP를 앓고 있는 소아의 경우에도 결과는 최적과는 거리가 멀어서, HHP를 가진 영아에게 삽입된 션트의 >50%가 첫 2년 이내에 외과적 재수술이 필요하다8. HHP에 대한 더 안전하고 효과적인 치료법을 찾아야 할 분명한 필요성에도 불구하고 연구는 장애물에 직면해 있습니다. HHP에 대한 전임상 문헌이 종종 공수수종(hydrocephalus ex vacuo) 17,18에 의해 유발되는 뇌실비대와 대두증(macrocephaly)19,20을 동반한 증상이 있는 수두증을 적절하게 구별하지 못하기 때문에 진전이 방해를 받고 있습니다. 실제로, 수두증의 발달 모델에는 진행성 대두증 및/또는 ICP 상승 측정이 포함되어야 한다1.
임상 및 전임상 통찰력을 통합함으로써 연구 설계가 개선되고 PHHP2에 대한 이해가 촉진되었습니다. 전 세계 다양한 센터에서 수행된 연구에 따르면 IVH는 융모양막염 21,22,23,24,25,26,27,28에 이차적으로 발생하는 매우 조산한 신생아에서 가장 흔합니다. 태반 감염 및 염증 외에도 신생아 패혈증은 또 다른 중요한 위험 인자이며, IVH에서 심실비대증, 증상이 있는 PHHP로 진행되고 그에 따른 외과적 개입에 중심적인 역할을 할 수 있다29. 전임상 및 임상 데이터는 혈액 매개 염증이 수두증20을 유발할 수 있으며, 전신 염증이 맥락막신경총30에 의한 CSF 분비를 증가시킨다는 것을 뒷받침합니다. 또한, 지주막하 출혈 및 IVH가 있는 성인과 패혈증을 앓고 있는 성인은 션트가 필요할 가능성이 훨씬 더 높다31. 보다 최근의 문헌에서는 염증이 CSF 19,20,32의 뇌실막운동성 섬모 추진력을 감소시키고 글림프계에 의한 CSF 재흡수를 감소시키는 것으로 확인되었습니다 33,34,35,36. 전반적으로, 전신 염증은 PHHP1의 주요 병태생리학적 및 임상적 동인입니다.
이러한 결과를 고려하여 연령에 적합한 HHP의 전임상 모델을 만들었습니다. 이 모델은 출생 직후 및 출생 초기의 IVH와 조산의 주요 원인인 융모양염을 결합한 것이다19. 이 실험적 접근법은 자궁에서 태반 기능 부전, 태반 염증 및 양수 내 염증으로 시작하여 융모막염 7,8,9,10,11,12,13,14,15,16,17,18,19 를 정의합니다 ,20,21,22,
23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,
43,44,45입니다. 구체적으로, 배아 18일 임신한 쥐댐에서 복부 개복술을 통해 태아 염증 반응 증후군, 태반 호중구증가증, 전염증성 중추신경계 미세환경을 조산으로 요약한다 (E18)37,38,39,40,41,42,43,44,45. 자궁 내 손상은 일시적인 양측 자궁 동맥 폐색에 의해 유발되어 일시적인 전신 저산소증-허혈(TSHI)을 일으킨 후 양수 내 주사로 지질다당류(LPS)를 주사합니다37,38,39,40,41,42,43,44,45. 그 후, CSF 역학을 교란하고 살아있는 새끼의 수두증 발달을 촉진하기 위해 IVH는 출생 후 1일차에 유도됩니다. 이것은 외측심실로 연안 용해된 적혈구(RBC)의 양측 기관내복실 주사(ICV)로 이루어집니다 19,37,44. 그런 다음 새끼는 수두증이 발달하고 평생 동안 연구됩니다.
프로토콜
존스 홉킨스 대학의 동물 관리 및 사용 위원회(ACUC)는 여기에 설명된 모든 실험 절차를 승인했습니다. 이 프로토콜은 임신한 Sprague-Dawley 쥐댐과 암수 모두의 새끼를 활용합니다.
1. E18에 융모양막염 유도
참고: 이 프로토콜의 자궁 내 모욕 부분은 이전에 자세히 게시되었으며 위에 요약되어 있으며 별도의 JOVE 프로토콜 및 비디오 19,37,38,39,40,41,42,43,44,46의 주제입니다.. 간단히 말해서, 임신한 암컷 Sprague-Dawley 쥐는 배아 18일(E18)에 TSHI 및 양수 내 LPS 투여를 포함하는 융모양염을 유발하기 위해 복부 개복술을 받습니다.
- 마취
- E18 임신 랫드 댐에서 2-4% 이소플루란으로 마취를 유도합니다.
- 인덕션 챔버에서 임산부의 댐을 제거하고 37°C로 설정된 드레이프된 수술용 순환수 담요에 쥐를 누운 자세로 놓습니다.
- 각막 건조를 방지하기 위해 안과 연고를 바르십시오. 발가락 핀치 반사가 없는지 확인하기 위해 발을 부드럽게 쥐십시오. 15-20분마다 마취 깊이를 모니터링하고 발가락 꼬집음 반응이 양성인 경우 이소플루란을 증가시킵니다.
- 목덜미에 부프레노르핀 서방형(0.1mg/kg SC)을 투여합니다.
- 수술 준비 및 스크럽
- 표준 멸균 기술을 사용하여 복부를 면도하십시오.
- 베타딘과 70% 에탄올을 번갈아 가며 복부를 3번 문지릅니다.
- 멸균 수술용 드레이프를 사용하여 동물을 드레이핑합니다.
- 복부 개복술
- 준비된 복부 피부를 메스로 3cm 정도 정중하게 절개합니다.
- 집게와 수술용 가위를 사용하여 복부 근막층을 지지하고 근육층의 무혈관 선알바를 절개하여 복막강에 접근합니다.
- 자궁을 외부화합니다.
- 동맥류 클립으로 자궁 동맥을 분리하고 60분 동안 고정합니다. 온도를 유지하고 멸균 식염수로 복강 내 내용물을 촉촉하게 유지하십시오.
- 클립을 제거하고 각 태아의 각 양막에 100μL의 LPS(4μg/sac의 LPS 용액)를 주입합니다. 태아나 태반을 건드리지 마십시오.
- 자궁 뿔에 관개를 주고 멸균 식염수를 3배 넉넉하게 밭에 덧대십시오.
- 개복술 닫기
- 복막강에 있는 자궁 뿔을 교체합니다.
- 근막층 가장자리를 다시 근사치하고 Running 3-0 봉합사를 사용하여 닫습니다.
- 피부층을 다시 근사화하고 러닝 3-0 봉합사를 사용하여 피부를 닫습니다.
- 26G 바늘을 사용하여 상처 가장자리 주위에 0.125% 부피바카인을 피하 주사합니다.
- 가짜 대조군의 경우, 마취 기간 동안 통제하기 위해 동일한 시간 동안 개복술을 수행합니다. 동맥을 조이지 말고 양수 주사를 투여하지 마십시오. 시술이 끝나면 3-0 봉합사를 사용하여 두 층(복부 근육 근막과 피부)으로 개복술을 닫습니다. 모든 경우에 새끼는 만삭(E21/22)에 태어나 댐에서 보살핌을 받습니다.
2. P1에 용해된 적혈구의 준비
- 혈액 채취
- E18에서 융모양막염을 앓은 새끼로부터 출생 후 1일차(P1)에 수컷 Sprague-Dawley 새끼 한 마리와 암컷 한 마리를 데려갑니다. 전용 수술 가위로 각 기증자 강아지의 목을 빠르게 베십시오.
참고: 우리는 헌혈자 코호트에서 각각을 대표하여 잠재적인 성별 편견을 제거하기 위해 혈액 수집을 위해 1마리의 수컷 강아지와 1마리의 암컷 강아지를 사용합니다. 또한, 당사는 성별이 일치하는 쌍을 사용하여 용해된 적혈구를 주입하기에 충분한 부피와 수율을 보장합니다. 일반적으로 각 기증자 새끼는 최대 4-5마리의 새끼에게 ICV 주사를 수행할 수 있을 만큼 충분한 용해된 적혈구를 생성합니다. - 0.2mL의 멸균 식염수가 들어 있는 2mL 마이크로 원심분리 튜브에 혈액을 즉시 수집하고, 참수 후 자유롭게 흐르는 혈액만 수집하도록 주의하고 조기 용혈을 유발할 수 있으므로 더 많은 혈액을 생성하기 위해 긁거나 짜지 않도록 주의하십시오. 소용돌이 잘.
참고: 정확한 혈액의 양은 개별 기증자, 동물 및 체중에 따라 다르지만 위의 예방 조치를 유지하면서 최대가 되어야 합니다. - 작은 수술용 가위로 혈전을 자르거나 다집니다.
- 혈액 현탁액을 500 × g 에서 4 °C에서 10 분 동안 원심 분리하고, 상층액을 제거하고, 펠릿을 0.2 mL의 멸균 식염수에 재현탁시킨다. 소용돌이 잘.
- 작은 수술 용 가위로 와류 잔류 혈전을 자르거나 다집니다.
- 2.1.4-2.1.5 단계를 두 번 더 반복하여 총 3 회 반복하고 각 용해 라운드 사이에 70 % 에탄올 스프레이로 수술 용 가위를 청소합니다.
- E18에서 융모양막염을 앓은 새끼로부터 출생 후 1일차(P1)에 수컷 Sprague-Dawley 새끼 한 마리와 암컷 한 마리를 데려갑니다. 전용 수술 가위로 각 기증자 강아지의 목을 빠르게 베십시오.
- 적혈구의 용해
- 최종 원심분리 후, 펠릿에 0.25mL의 멸균 식염수를 첨가합니다. 소용돌이 글쎄.
- 서스펜션을 드라이아이스에 5분 동안 놓습니다.
- 드라이 아이스에서 현탁액을 제거하고 완전히 해동 될 때까지 37.5 °C로 설정된 인큐베이터에 5 분 동안 놓고 잘 소용돌이칩니다.
- 총 3회(3회 동결 및 3회 동결)에 대해 동결 및 해동 주기를 반복합니다.
- 마지막 해동이 끝나면 소용돌이를 일으키고 빠른 회전을 수행합니다. 이제 적혈구가 용해되어 사용할 준비가 되었습니다.
참고: 혼합물은 불투명한 토마토 주스와 같은 색상이어야 하며 주사기에 쉽게 빨려 들어갈 수 있어야 합니다.
3. P1에 용해된 적혈구의 Intracerebrovenular 주사
- 저체온증을 이용한 마취
- 젖은 얼음 위에 작은 플랫폼을 놓아 식히십시오.
- 강아지의 피부를 보호하기 위해 마른 실험실 물티슈를 위에 놓습니다.
참고: 이 평평하고 차가운 표면은 강아지를 마취하고 주입하는 데 사용됩니다. - 온난화 패드에서 강아지(P1세)를 저체온증으로 마취시키기 위해 차가운 플랫폼 위의 작업 물티슈로 옮깁니다.
- 발을 쥐어 마취 깊이를 확인하고 발가락 핀치 반사가 없는지 확인합니다.
- 외부 수술용 램프를 가장 밝은 설정으로 설정합니다.
- 조수가 검지와 중지를 사용하여 동물의 머리 정중선을 부드럽게 유지하고 두개골을 트랜스라이트화하여 두개골을 통한 측면 심실을 시각화합니다. 관상 봉합사의 피부와 촉진을 통해 상시상동(정중선)을 교차하는 랜드마크로 미세한 집게로 시각화하여 브레그마를 식별합니다.
- ICV 주사
- 마취된 강아지의 머리를 70% 에탄올에 적신 면봉으로 닦습니다.
- 주사 부위를 시상 봉합사에서 1mm 측면, 람다와 브레그마의 중간으로 식별하고 표시합니다.
- 시각화 후 0.3mL, 길이 8mm, 31G 인슐린 주사기와 초미세 경피 바늘을 사용하여 용해된 적혈구 20μL를 우측 측심실에 주입합니다. 자유형 기술을 사용하여 바늘 길이의 약 절반 깊이까지 바늘을 똑바로 아래쪽으로 삽입하고 바늘을 천천히 주입 및 제거합니다(약 10-15초에 걸쳐 주입 및 제거 과정).
- 주입된 용해된 적혈구의 배출을 방지하기 위해 주입 후 몇 초 동안 바늘을 제자리에 두십시오.
- 좌측 심실에 대해 반복하고 용해된 적혈구 20μL를 주입합니다.
- 마취에서 회복하기 위해 37.5 °C로설정된 보온 패드에 강아지를 놓습니다.
- 강아지의 성별을 기록하고 고유한 동물 식별자를 할당합니다.
- 동물이 흉골 누운 상태를 안전하게 유지할 수 있도록 온난화 패드에서 완전히 회복되고 의식을 회복한 후에만 강아지를 가정용 케이지로 되돌려 보내야 합니다.
- 건강과 웰빙을 위해 모든 새끼 쥐를 매일 모니터링하십시오.
4. P2에서 성공적인 양측 뇌실내 출혈 확인
- 두부 초음파
- 머리 초음파를 준비하기 위해 P2 강아지를 집 케이지에서 제거하십시오.
- 초음파 프로브에 초음파 젤을 놓고 프로브를 두개골 상단에 놓습니다.
- 매우 가벼운 압력으로 프로브를 움직여 심실을 시각화합니다. IVH를 나타내는 외측심실에서 양측 과음향성을 확인합니다.
5. 성공적인 posthemorrhagic hydrocephalus의 확인
- 대두증을 확인하기 위해 머리 둘레를 대리하는 귀 내 거리(IAD)를 측정합니다.
- 측정을 준비하려면 머리 둘레를 측정하는 데 적합한 작은 줄자를 구해야 하며, 이상적으로는 명확하게 시각화된 밀리미터 표시가 있어야 합니다.
- 마스크를 쓴 관찰자가 집 우리에서 강아지를 제거하도록 합니다.
- 강아지를 부드럽게 안고 귀에서 귀까지의 거리(귀 내 거리, IAD)를 측정하고 값을 밀리미터 단위로 기록합니다.
- P1에서 P15까지 매일 IAD를 반복하고 값을 그래프로 표시합니다. IAD를 직렬로 추적하고 댐에서 물리적으로 분리된 새 케이지(강아지 젖을 떼는 표준 시점)로 강아지를 재배치할 때 P21에서 다시 측정합니다. 이후 P25부터 P60까지 5일마다 IAD를 반복합니다.
- 상승된 두개내 압력을 확인하기 위한 개방 압력 측정
- 마스크를 쓴 관찰자가 집 우리에서 강아지를 꺼내게 합니다.
- 안락사를 준비하기 위해 75-100mg/kg의 복강내(IP) 케타민과 5-10mg/kg IP 자일라진으로 마취합니다.
- 발을 쥐어 마취 깊이를 확인하고 발가락 꼬집음/페달 반사가 없는지 확인합니다.
- 압력계에 연결된 작은 바늘(31G)을 경추 접합부 CSF 공간에 삽입합니다.
- 압력계의 개방 압력을 기록하십시오.
- 바늘을 제거하고 날카로운 가위로 쥐의 목을 베고 조직 채취를 진행하십시오.
- 심실비대증 평가를 위한 체외자기공명영상(Ex-vivo magnetic resonance imaging, MRI)
- 안락사를 준비하기 위해 75-100mg/kg의 복강내(IP) 케타민과 5-10mg/kg IP 자일라진으로 마취합니다.
- 발을 쥐어 마취 깊이를 확인하고 발가락 꼬집음/페달 반사가 없는지 확인합니다.
- 쥐에게 인산염 완충 식염수(PBS)를 관류한 다음 잘 고정될 때까지 4% 파라포름알데히드(PFA)를 투여합니다.
- 뇌를 제거하고 뇌를 4% PFA로 떨어뜨립니다.
- 50mL 원뿔형 튜브에 2% 아가로스에 뇌를 삽입합니다. 실온에 두십시오.
- 생체 외 MRI를 위해 뇌를 MRI 스캐너로 이식합니다.
- 11.7T MRI 실행: T2 터보 RARE; TE/TR = 30.0/3000밀리초; 평균 = 2; 에코 간격 = 10.000ms; 희귀 요소 = 8; 슬라이스 수 = 30; 슬라이스 두께 = 1mm; 이미지 크기 = 128 x 128; 시야각 = 28mm x 28mm; 슬라이스 해상도 = 0.219 x 0.219 mm2; FA = 90.0°입니다.
참고: MRI 영상은 성공적인 PHHP 모델링의 증거를 제공하지만 PHHP를 확인하기 위해 주어진 코호트의 모든 뇌를 스캔할 필요는 없습니다. IAM 및 ICP 측정은 위에서 설명한 대로 확인하기에 충분합니다. 궁극적으로 시험관이 생체 내 또는 생체 외 MRI를 수행할 수 있는 능력은 MRI 스캐너 접근성, 자금 및 기술적 능력과 같은 다양한 요인에 따라 달라집니다. 이 단계는 PHHP 모델을 새로 통합할 때 검증에 특히 유용합니다. 개방 압력 상승과 같은 두개내압 증가에 대한 문서화된 징후가 없는 경우, MRI 영상에서 고립된 심실 비대증 소견이 수두증을 나타내 지 않는다는 점에 유의하는 것이 중요합니다.
결과
이 모델을 사용하면 용해된 적혈구를 주입한 후 며칠 및 몇 주 후에 수두증이 발생합니다. 수두증의 일반적인 실험 설계 및 진행에 대한 표현이 그림 1에 나와 있습니다. 그룹당 5-6마리의 가짜 동물과 6-8마리의 PHHP 동물을 평가했습니다. 청소년 시절에 PHP를 가진 쥐는 대두증(그림 2), 두개내 압력 상승(그림 3) 및 심실 비대증(그림 4)을 보였습니다. 이러한 발견의 별자리와 조합은 수두증을 나타냅니다. 이 쥐는 또한 발달 지연19을 가지고 있으며, 성인이 되어서도 지속적인 인지 장애와 높은 ICP를 가지고 생존한다. 이 모델에서 수컷은 암컷보다 성능이 더 떨어졌는데,19 이는 수컷이 수두증에 걸리기 쉬운 임상 시나리오를 재현한다 3,19. 이 실험 플랫폼을 사용하여 수두증을 연구하는 연구자는 진행성 대두증과 IVH 유도 후 5일 동안 발생하고 수명 동안 유지되는 돔형 두개골을 시각화하여 절차의 성공적인 완료를 확인할 수 있습니다(그림 2). 지속적인 대두증은 필수적이고, 임상적으로 중요하며, 성공적인 시술의 쉽게 식별할 수 있는 징후입니다. 출생 후 21일째(P21)까지 IAD(임상적으로 사용된 머리 둘레의 대리모)와 개방 압력의 통계적으로 유의미한 증가는 정량화할 수 있습니다(그림 3). 마찬가지로, 심실 비대증과 심실 용적의 증가는 MRI 및 조직학에서 가짜 대조군과 비교하여 관찰할 수 있습니다(그림 4)1,2,19. 구조적 MRI 영상 또는 크레실 바이올렛 또는 헤마톡실린 및 에오신 염색과 같은 표준 조직학적 절차를 통한 심실 용적의 정량화는 보다 정교한 확산 및 기능적 이미징을 훌륭하게 보완합니다. 이러한 데이터는 대두증, 심실 확장을 유발하는 CSF 역학 교란, ICP 상승 등 PHHP의 임상적 특징과 일치합니다.
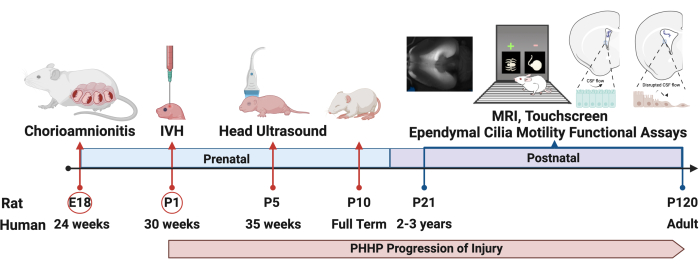
그림 1: 실험 설계. PHHP를 유도하는 프로토콜은 배아 18일째(E18)에 쥐에서 융모양염을 유도하고 출생 후 1일째(P1)에 심실내 출혈을 유도하는 것으로 시작합니다. 수두증은 평생 동안 발달하고 진화하며 성인기까지 기능 분석을 포함한 여러 지표로 평가할 수 있습니다. 약어 : PHHP = 미숙아의 posthemorrhagic hydrocephalus; IVH = 뇌실내 출혈. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: HHP를 대표하는 대두증(Macrocephaly). PHP를 가진 쥐는 가짜 대조군에 비해 두개골이 커지고, 두개골이 반구형이며, 대두증이 있습니다. 약기 : PHHP = 미숙아의 posthemorrhagic 수두증. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
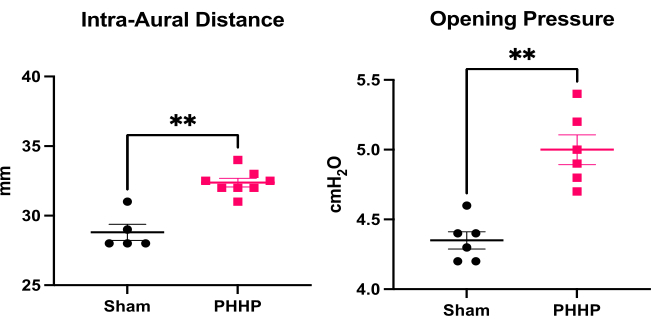
그림 3: 대두증 및 두개내압 상승의 정량화. PHHP(n=8)를 가진 쥐는 가짜 대조군(n=5-6)에 비해 출생 후 21일(P21)에 귀 내 거리(머리 둘레에 대한 대리모)가 증가하고 개방 압력(두개내 압력, n=6)이 증가했습니다. (t-test **p < 0.01, 오차 막대는 평균의 표준 오차를 나타냄) 약기 : PHHP = 미숙아의 posthemorrhagic 수두증. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
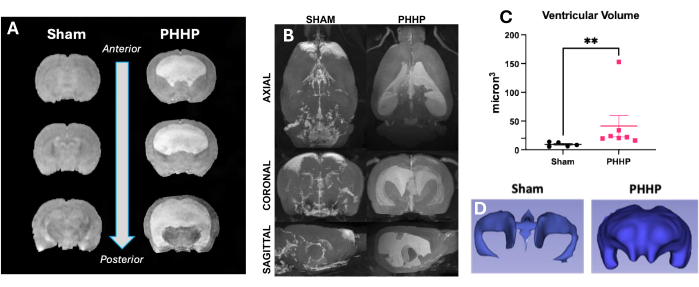
그림 4: PHP가 있는 쥐는 중등도-중증의 심실비대증을 가지고 있습니다. PHP를 가진 쥐는 자기 공명 영상에서 명확하게 식별할 수 있는 가짜 대조군에 비해 심실이 커지고 심실 부피가 증가했습니다. (A) T2 구조 영상은 P21에서 전방에서 후방까지 관상쇄 평면의 심실 확장을 보여줍니다. (B) 가짜 동물에 비해 PHHP 쥐의 심실 용적 증가는 P60에서 성체 쥐의 축면, 관상면, 시상면에서도 볼 수 있습니다. 심실 용적은 (C) MRI(n=5-7/그룹)를 사용하여 정량화할 수 있으며 (D) 모든 연령에서 심실계의 3D 재건과 쌍을 이룰 수 있습니다. (t-test **p < 0.01, 오차 막대는 평균의 표준 오차를 나타냄). 약기 : PHHP = 미숙아의 posthemorrhagic 수두증. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
PHHP 유도를 위한 이 프로토콜은 출생부터 성인기까지 ICP, 심실비대, 대두증의 만성 상승을 포함하여 수두증의 표현형 특징과 수반되는 뇌 구조 및 기능에 대한 엄격하고 정량화할 수 있으며 임상적으로 번역 가능한 결과 측정을 가능하게 합니다4. 생화학적, 조직학적, 기능적 분석법은 맥락막신경총(choroid plexus), 뇌실막(ependyma), 글림프계(glymphatic system)뿐만 아니라 회백질(gray matter19)의 건강을 평가하는 데 사용할 수 있다. 또한 이 모델은 기능적 CSF 및 생세포 섬모 이미징과 다중 모드 신경 이미징 및 생물 행동 결과의 통합을 지원할 수 있습니다. 또한 다중 매개 변수 유세포 분석 및 동적 신경 세포 분석을 사용하여 조직학 및 면역 화학과 함께 기계론적 연구를 결합하여 심실 미세환경을 엄격하게 평가하는 데 사용할 수 있습니다. 인지 및 실행 기능에 대한 디지털 보행 평가 및 터치스크린 테스트 2,19와 함께 이 접근 방식은 이전에 PHHP의 중개 연구에 사용되지 않았던 세포, 유체 및 신경 행동 바이오마커의 평가를 가능하게 할 수 있습니다.
PHHP를 가진 소아 가족의 경우, 내구성 있는 션트 기능 다음으로 최우선 순위는 인지 결과의 개선과 비수술적 치료 전략의 약속입니다 47,48,49. 이러한 요구를 해결하기 위한 약물 요법의 개발은 PHHP 2,47,48,49를 가진 아동 치료를 변화시키는 첫 번째 단계입니다. 이 전임상 모델은 약물 요법 및 신흥 의약품을 테스트하는 데 적합합니다. CSF 역학을 조절하도록 설계된 비수술적 중재 및 약물 치료의 평가에 적합합니다. 이러한 약물은 쥐에 대한 여러 투여 경로(즉, 복강내, 정맥 주사, 피하, 삼투압 미니 펌프)를 통해 투여할 수 있으며 수두증 및 심실 비대증은 영상 및 임상 징후를 사용하여 수명 전반에 걸쳐 추적, 모니터링 및 정량화할 수 있습니다. 뇌 건강의 여러 측면도 분석할 수 있으며, 여기에는 심실 용적, 백질 손실 및 기능적 연결성이 포함됩니다. 조직학, 면역조직화학, qPCR 및 관련 실험은 특정 영역 및 발달적으로 구별되는 종말점에서 조직을 채취하여 수행할 수 있습니다. 쥐를 대상으로 한 이 연구 플랫폼은 또한 뇌성마비, 간질, 만성 통증을 포함한 수두증 관련 동반질환에 대한 연구를 촉진할 수 있다4.
이 모델의 사망률은 3-7%이며 IVH19,44 후 첫 48시간 동안 가장 빈번하게 발생합니다. 때때로 새끼 쥐는 체중이 증가하지 않고 효과적으로 먹이를 먹지 못합니다. 이러한 번성 실패는 성공적인 시술과 관련된 진행성 대두증의 직접적인 결과일 수 있으며, 잘못된 ICV 주사 기술로 인한 피질/피질하 출혈의 직접적인 결과일 수 있습니다. 필요한 정밀도가 없으면 피질 출혈성 경색 또는 두개골 기저 외상이 관찰될 수 있습니다. 산후 관리는 산전 또는 산후 중재에 의해 중단될 수 있는데, 이는 강아지가 머리 모양, 신체 크기 및 행동과 관련하여 가짜 대조군과 현저히 다르기 때문입니다. 고급 신경 해부학적 숙련도와 결합된 적절한 수술 및 주사 기술은 위의 대표적인 결과가 완전히 실현되도록 하는 데 중요합니다.
이 전임상 플랫폼은 임신한 쥐에서 개복 개복술 절개술을 필요로 합니다. 이를 위해서는 고도의 수술 기술이 필요합니다. 출생 후 기간에 용해된 적혈구를 외측심실에 정확하게 주입하지 못하더라도 IVH 또는 PHHP가 발생하지 않으며 이러한 쥐는 진행성 대두증, 개방 압력 상승 또는 심실 비대증을 보일 정도로 성장하지 않습니다. 자유 손 주사와 신생아 설치류의 심실 해부학적 구조에 대한 편안함은 필수적입니다. 특히, 열린 천문과 상대적으로 얇은 두개골은 투과조명을 가능하게 하고 바늘의 성공적인 배치에 필요한 브레그마 및 측면 뇌실의 등쪽 측면과 같은 신경 해부학적 랜드마크의 식별을 용이하게 합니다. 편측성 IVH는 양쪽 측심실에 접근하지 않는 경우 가능하며, 이로 인해 일시적이지만 지속적인 대두증이 발생하지 않을 수 있습니다. 심실 접근 후 CSF 배출은 성공적인 주사를 나타내는 적절한 지표입니다. 마찬가지로, 용해된 적혈구를 주입하기 전에 CSF를 바늘 허브로 흡인하면 주입기가 주입을 진행할 수 있는 적절한 심실 공간에 있는지 확인할 수 있습니다. MRI에서 심실비대는 수두증(뇌연화증)이 없는 경우에도 나타날 수 있지만, 이 소견의 조합은 개방 압력 상승 및 신경인지 결핍과 함께 PHHP 기술의 성공적인 실행을 나타냅니다.
절차적 성공에 대한 분석은 용해된 적혈구의 ICV 주사를 받은 강아지와 가짜 새끼 또는 ICV 주사를 받은 강아지와 융모양막염을 경험했지만 용해된 적혈구의 ICV 주사를 경험하지 않은 대조군 강아지 간의 위의 대표 지표를 비교하여 확인할 수 있습니다.중요한 것은 가짜 댐이 이소플루란에 노출되고 개복술 및 자궁 외재화가 이루어진다는 것입니다. 그러나 PHHP 모델과 달리 양막과 자궁은 복강으로 되돌아가고 자궁 동맥 폐색이나 LPS 주사 없이 개복술이 완료됩니다. 이러한 가짜 댐에서 태어난 새끼는 일반적으로 자궁 내 TSHI+LPS의 특정 조합(가짜 태아가 경험하지 않음)과 HHP로 이어지는 IVH의 특정 조합이기 때문에 용해된 적혈구의 주사를 받지 않습니다. 또한 TSHI+LPS 또는 IVH에 노출되지 않은 연령 및 성별 일치 대조군을 보유함으로써 모델의 기술적 성공을 검증하고 중재를 받은 PHHP 코호트의 결과를 가짜 코호트의 결과와 보다 직접적으로 비교할 수 있습니다. 이 비교를 통해 모델과 그 안의 모든 치료 개입 모두에 대한 강력한 효능 테스트를 수행할 수 있습니다.
기술적 숙련도가 필요함에도 불구하고, 이 모델은 연령에 적합하고, 전신 염증을 포함하며, 성인이 될 때까지 PHHP 후유증이 진화하고, 정교한 기능 검사 및 신경 영상과 같은 중개 결과 측정을 평가할 수 있는 기회를 제공하기 때문에 초기 IVH 및 수두증의 다른 모델에 비해 유리합니다 30,50,51,52. 또한 지속적인 심실 비대증과 ICP 상승을 초래합니다. 용해된 적혈구를 사용하면 이 모델의 번역 관련성이 높아집니다. IVH를 앓고 있는 조산아는 전혈이 심실로 방출됩니다. 이 혈액은 심실 CSF 시스템에 남아 있다가 몇 주에 걸쳐 분해되어(적혈구 용해) 심실에서 지속적인 염증 반응을 일으키며, 일반적으로 정기 두부 초음파에서 뇌실막성 과반향성(ependymal hyper-echogenicity)으로 간주된다53,54. 용해된 적혈구의 사용은 수두증 및 지속적인 심실비대를 생성하는 데 있어 개별 혈액 제제/성분의 효능을 평가하는 이전 연구를 확증하고 입증합니다55. 포장된 적혈구와 달리, 용해된 적혈구의 심실 주사는 주사 후 24시간 경과19,55 이상으로 MRI에서 심실을 크게 확대합니다. 용해된 적혈구 주사는 포장된 적혈구 또는 식염수 주사와 비교할 때 뇌실 주위 공간에서 뇌 헤옥시게나제-1 및 페리틴 수치를 상향 조절하는 것으로 밝혀졌다55. 이는 인간 IVH의 병태생리학이 주로 초기 혈액의 파괴와 철분 분해 산물 및 그에 따른 조직 손상에 수반되는 기타 혈액 성분의 점진적인 방출에 기인하기 때문에 중요합니다.
헴-옥시게나제 1은 헴 분해의 주요 효소이고 페리틴은 철 저장 단백질입니다. 따라서, 용해된 RBC 주사 후 증가된 뇌실 주위 농도는 인간 IVH 병인과 밀접하게 일치합니다. 마지막으로, 심실 공간에만 철을 주입하는 것은 탄산 무수효소(carbonic anhydrase)와 같은 적혈구의 다른 성분을 무시하는 것이다 29. 또한, 철분 주입은 유도된 IVH의 잠재적 중증도를 최대화하지 않으며, 이는 후속 수두증의 가능성과 직접적인 상관관계가 있습니다. 용해된 적혈구를 사용하는 선택과 마찬가지로, 양쪽 심실을 모두 주입하는 이유는 번역을 증가시키기 위함입니다. 임상 문헌에 따르면 더 심각한 IVH와 후속 PHHP 사이의 연관성이 분명히 증가했음을 보여줍니다. 양측성 출혈을 도입하는 것은 그 자체로 IVH의 중증도를 증가시킬 뿐만 아니라 생식 기질에서 심실 공간으로 확장될 가능성과 그에 따른 심실 확장 가능성을 증가시킨다. 또한, 상술한 바와 같이, 양측 주사는 또한 CSF 의사소통을 평가하는 모드를 허용한다. 20마이크로리터는 지속적인 수두증을 안정적으로 달성할 수 있는 가장 낮은 부피이며 새끼 쥐의 사망률이 복잡한 변수가 될 정도로 큰 실질 관여가 없습니다.
결론적으로, 진행성 대두증, 두개내압 상승, 뇌실비대, 성인기로의 인지 지연을 포함하여 PHHP의 임상적 측면을 요약하는 동물 모델의 사용은 이 분야에 엄격함을 더하고 새로운 치료 접근법에 필요한 독특하고 비할 데 없는 연구를 촉진하고 이러한 일반적인 형태의 주산기 뇌 손상의 복잡한 병태생리학에 대한 기계론적 이해를 향상시킵니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
저자들은 미국 국립보건원(National Institutes of Health, R01HL139492), 의회 주도 의학 연구 프로그램(Congressionally Directed Medical Research Program, W81XWH1810166, W81XWH1810167, W81XWH2210461, W81XWH2210462), 수두증 협회(Hydrocephalus Association), 루디 슐테 연구소(Rudi Schulte Research Institute)가 제공한 기금에 감사한다.
자료
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Pharmco | 111000200 | Diluted to 70% |
| Betadine surgical scrub | Cardinal Health | NDC-67618-151-17 | |
| Blunt Forceps | Roboz | RS-8100 | |
| Bravmini Plus Cordless Rechargeable Trimmer | Wahl | 41590-0438 | |
| Carbon Steel Surgical blades | Bard-Parker | 371151-11 | |
| centrifuge | Eppendorf | 5424R | |
| Cotton Gauze Sponge | Fisherbrand | 22-362-178 | Small, 6 inch sterile |
| Cotton-tipped Applicators | Fisherbrand | 23-400-114 | 30 G 1 |
| Eye Lubricant | Refresh Lacri Lube | 75929 | |
| Far infrared warming pad | Kent scientific | RT-0501 | |
| Incubator - Genie Temp-Shaker 100 | Scientific Industries | SI-G100 | |
| Insulin Syringes | BD | 328438 | 0.3 cc 3 mm 31 G, ultrafine |
| Isoflurane | Covetrus | 11695067772 | |
| Ketamine hydrochloride injection | Dechra | 17033-101-10 | |
| Kimwipes | Kimtech Science | BXTNI141300 | |
| LPS 011B4 | Sigma | L2630 | |
| microcentrifuge tubes | Thermo Fisher Scientific | 3453 | 2.0 mL |
| Needle | BD | 305122 | 1 mL |
| Needle | BD | 305128 | 25 G 5/8 |
| Needle Holders | Kent Scientific Corp. | INS14109 | 12.5 CM STR |
| OR Towels | Cardinal Health | 287000-008 | |
| Paper measuring tape | Cardinal Health | SKU | |
| Saline Solution, 0.9% | Sigma | S8776 | |
| Scissors | Roboz | RS-6808 | |
| SomnoSuite | Kent Scientific | SS6823B | |
| Sterile Alcohol Prep Pads | Fisherbrand | 06-669-62 | Sterile |
| Surgical gloves | Biogel | 40870 | |
| Surgical Scissors | Roboz | RS-5880 | |
| Surgical Scissors | EST | 14002-16 | |
| Syringe | BD | 309628 | |
| T/Pump (Heat Therapy Pump) | Stryker Medical | TP700 | |
| Vessel Clips | Kent Scientific Corp. | INS14120 | 30 G Pressure |
| Xylazine injection | vet one | NDC 13985-704-10 |
참고문헌
- Sevensky, R., Newville, J. C., Tang, H. L., Robinson, S., Jantzie, L. L. Cumulative damage: Cell death in posthemorrhagic hydrocephalus of prematurity. Cells. 10 (8), 1911 (2021).
- Robinson, S., Jantzie, L. L. Pathogenesis of posthemorrhagic hydrocephalus of prematurity: New horizons. Semin Perinatol. 46 (5), 151596 (2022).
- Dewan, M. C., et al. Global hydrocephalus epidemiology and incidence: systematic review and meta-analysis. J Neurosurg. 130 (4), 1065-1079 (2018).
- Robinson, S. Neonatal posthemorrhagic hydrocephalus from prematurity: pathophysiology and current treatment concepts. J Neurosurg Pediatr. 9 (3), 242-258 (2012).
- Gigi, M., Roth, J., Eshel, R., Constantini, S., Bassan, H. Health-related quality of life after post-haemorrhagic hydrocephalus in children born preterm. Dev Med Child Neurol. 61 (3), 343-349 (2019).
- Muir, R. T., Wang, S., Warf, B. C. Global surgery for pediatric hydrocephalus in the developing world: a review of the history, challenges, and future directions. Neurosurg Focus. 41 (5), E11 (2016).
- Kulkarni, A. V., et al. Endoscopic third ventriculostomy and choroid plexus cauterization in infant hydrocephalus: a prospective study by the Hydrocephalus Clinical Research Network. J Neurosurg Pediatr. 21 (3), 214-223 (2018).
- Riva-Cambrin, J., et al. Risk factors for shunt malfunction in pediatric hydrocephalus: a multicenter prospective cohort study. J Neurosurg Pediatr. 17 (4), 382-390 (2016).
- Agajany, N., et al. The impact of neonatal posthemorrhagic hydrocephalus of prematurity on family function at preschool age. Early Hum Dev. 137, 104827 (2019).
- Berry, J. G., et al. Characteristics of hospitalizations for patients who use a structured clinical care program for children with medical complexity. J Pediatr. 159 (2), 284-290 (2011).
- Berry, J. G., et al. Hospital utilization and characteristics of patients experiencing recurrent readmissions within children's hospitals. JAMA. 305 (7), 682-690 (2011).
- Berry, J. G., et al. Trends in resource utilization by children with neurological impairment in the United States inpatient health care system: a repeat cross-sectional study. PLoS Med. 9 (1), e1001158 (2012).
- Drake, J. M., et al. Randomized trial of cerebrospinal fluid shunt valve design in pediatric hydrocephalus. Neurosurgery. 43 (2), 294-303 (1998).
- Simon, T. D., et al. Cerebrospinal fluid shunt infection: Emerging paradigms in pathogenesis that affect `prevention and treatment. J Pediatr. 206, 13-19 (2019).
- Simon, T. D., et al. Hospital care for children with hydrocephalus in the United States: utilization, charges, comorbidities, and deaths. J Neurosurg Pediatr. 1 (2), 131-137 (2008).
- Riva-Cambrin, J., et al. Predictors of success for combined endoscopic third ventriculostomy and choroid plexus cauterization in a North American setting: a Hydrocephalus Clinical Research Network study. J Neurosurg Pediatr. 24 (2), 128-138 (2019).
- Emmert, A. S., et al. Characterization of a novel rat model of X-linked hydrocephalus by CRISPR-mediated mutation in L1cam. J Neurosurg. 132 (3), 945-958 (2019).
- Strahle, J. M., et al. Role of hemoglobin and iron in hydrocephalus after neonatal intraventricular hemorrhage. Neurosurgery. 75 (6), 696-705 (2014).
- Robinson, S., et al. Extended combined neonatal treatment with erythropoietin plus melatonin prevents posthemorrhagic hydrocephalus of prematurity in rats. Front Cell Neurosci. 12, 322 (2018).
- Yung, Y. C., et al. Lysophosphatidic acid signaling may initiate fetal hydrocephalus. Sci Transl Med. 3 (99), 99ra87 (2011).
- Moscuzza, F., et al. Correlation between placental histopathology and fetal/neonatal outcome: chorioamnionitis and funisitis are associated to intraventricular haemorrage and retinopathy of prematurity in preterm newborns. Gynecol Endocrinol. 27 (5), 319-323 (2011).
- Salas, A. A., et al. Histological characteristics of the fetal inflammatory response associated with neurodevelopmental impairment and death in extremely preterm infants. J Pediatr. 163 (3), 652-657 (2013).
- Arayici, S., et al. The effect of histological chorioamnionitis on the short-term outcome of preterm infants ≤32 weeks: a single-center study. J Matern Fetal Neonatal Med. 27 (11), 1129-1133 (2014).
- Shankaran, S., et al. Maternal race, demography, and health care disparities impact risk for intraventricular hemorrhage in preterm neonates. J Pediatr. 164 (5), 1005-1011.e3 (2014).
- Lu, H., Wang, Q., Lu, J., Zhang, Q., Kumar, P. Risk factors for intraventricular hemorrhage in preterm infants born at 34 weeks of gestation or less following preterm premature rupture of membranes. J Stroke Cerebrovasc Dis. 25 (4), 807-812 (2016).
- Stark, M. J., Hodyl, N. A., Belegar, V. K., Andersen, C. C. Intrauterine inflammation, cerebral oxygen consumption and susceptibility to early brain injury in very preterm newborns. Arch Dis Child Fetal Neonatal Ed. 101 (2), F137-F142 (2016).
- Lee, J., et al. A new anti-microbial combination prolongs the latency period, reduces acute histologic chorioamnionitis as well as funisitis, and improves neonatal outcomes in preterm PROM. J Matern Fetal Neonatal Med. 29 (5), 707-720 (2016).
- Edwards, J. M., Edwards, L. E., Swamy, G. K., Grotegut, C. A. Magnesium sulfate for neuroprotection in the setting of chorioamnionitis. J Matern Fetal Neonatal Med. 31 (9), 1156-1160 (2018).
- Alan, N., et al. Reduced ventricular shunt rate in very preterm infants with severe intraventricular hemorrhage: an institutional experience. J Neurosurg Pediatr. 10 (5), 357-364 (2012).
- Karimy, J. K., et al. Inflammation-dependent cerebrospinal fluid hypersecretion by the choroid plexus epithelium in posthemorrhagic hydrocephalus. Nat Med. 23 (8), 997-1003 (2017).
- Wessell, A. P., et al. A sustained systemic inflammatory response syndrome is associated with shunt-dependent hydrocephalus after aneurysmal subarachnoid hemorrhage. J Neurosurg. 130 (6), 1984-1991 (2018).
- Abdi, K., et al. Uncovering inherent cellular plasticity of multiciliated ependyma leading to ventricular wall transformation and hydrocephalus. Nat Commun. 9 (1), 1655 (2018).
- Goulding, D. S., et al. Neonatal hydrocephalus leads to white matter neuroinflammation and injury in the corpus callosum of Ccdc39 hydrocephalic mice. J Neurosurg Pediatr. 25 (5), 476-483 (2020).
- Hussain, R., et al. Potentiating glymphatic drainage minimizes post-traumatic cerebral oedema. Nature. 623 (7989), 992-1000 (2023).
- Cai, Y., et al. The relationship between inflammation, impaired glymphatic system, and neurodegenerative disorders: A vicious cycle. Neurobiol Dis. 192, 106426 (2024).
- Mogensen, F. L., Delle, C., Nedergaard, M. The glymphatic system (en)during inflammation. Int J Mol Sci. 22 (14), 7491 (2021).
- Jantzie, L. L., Winer, J. L., Maxwell, J. R., Chan, L. A., Robinson, S. Modeling encephalopathy of prematurity using prenatal hypoxia-ischemia with intra-amniotic lipopolysaccharide in rats. J Vis Exp. (105), e53196 (2015).
- Kitase, Y., et al. Chorioamnionitis disrupts erythropoietin and melatonin homeostasis through the placental-fetal-brain axis during critical developmental periods. Front Physiol. 14, 1201699 (2023).
- Maxwell, J. R., Denson, J. L., Joste, N. E., Robinson, S., Jantzie, L. L. Combined in utero hypoxia-ischemia and lipopolysaccharide administration in rats induces chorioamnionitis and a fetal inflammatory response syndrome. Placenta. 36 (12), 1378-1384 (2015).
- Ozen, M., et al. Chorioamnionitis precipitates perinatal alterations of heme-oxygenase-1 (HO-1) homeostasis in the developing rat brain. Int J Mol Sci. 22 (11), 5773 (2021).
- Yellowhair, T. R., et al. CXCR2 blockade mitigates neural cell injury following preclinical chorioamnionitis. Front Physiol. 10, 324 (2019).
- Yellowhair, T. R., et al. Chorioamnionitis in rats precipitates extended postnatal inflammatory lymphocyte hyperreactivity. Dev Neurosci. , 1-11 (2019).
- Yellowhair, T. R., et al. Preclinical chorioamnionitis dysregulates CXCL1/CXCR2 signaling throughout the placental-fetal-brain axis. Exp Neurol. 301 (Pt B), 110-119 (2018).
- Jantzie, L. L., et al. Complex pattern of interaction between in utero hypoxia-ischemia and intra-amniotic inflammation disrupts brain development and motor function. J Neuroinflammation. 11, 131 (2014).
- Jantzie, L. L., et al. Repetitive neonatal erythropoietin and melatonin combinatorial treatment provides sustained repair of functional deficits in a rat model of cerebral palsy. Front Neurol. , 233 (2018).
- Maxwell, J. R., et al. Prenatal alcohol exposure and chorioamnionitis results in microstructural brain injury in a preclinical investigation. Ann Pediatr Res. 4 (1), 1031 (2020).
- Karimy, J. K., et al. Outcomes of the 2019 hydrocephalus association workshop, "Driving common pathways: extending insights from posthemorrhagic hydrocephalus". Fluids Barriers CNS. 20 (1), 4 (2023).
- Jakopin, N. E., et al. Establishing ranked priorities for future hydrocephalus research. J Neurosurg. 139 (2), 492-501 (2022).
- Koschnitzky, J. E., et al. Opportunities in posthemorrhagic hydrocephalus research: outcomes of the Hydrocephalus Association Posthemorrhagic Hydrocephalus Workshop. Fluids Barriers CNS. 15 (1), 11 (2018).
- Strahle, J., et al. Mechanisms of hydrocephalus after neonatal and adult intraventricular hemorrhage. Transl Stroke Res. 3 (Suppl 1), 25-38 (2012).
- Segado-Arenas, A., et al. Cognitive impairment and brain and peripheral alterations in a murine model of intraventricular hemorrhage in the preterm newborn. Mol Neurobiol. 55 (6), 4896-4910 (2018).
- Li, Q., et al. Targeting germinal matrix hemorrhage-induced overexpression of sodium-coupled bicarbonate exchanger reduces posthemorrhagic hydrocephalus formation in neonatal rats. J Am Heart Assoc. 7 (3), e007192 (2018).
- Gaisie, G., Roberts, M. S., Bouldin, T. W., Scatliff, J. H. The echogenic ependymal wall in intraventricular hemorrhage: sonographic-pathologic correlation. Pediatr Radiol. 20 (5), 297-300 (1990).
- Mohammad, K., et al. Consensus approach for standardizing the screening and classification of preterm brain injury diagnosed with cranial ultrasound: A Canadian perspective. Front Pediatr. 618236, (2021).
- Gao, C., et al. Role of red blood cell lysis and iron in hydrocephalus after intraventricular hemorrhage. J Cereb Blood Flow Metab. 34 (6), 1070-1075 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유