Method Article
Modélisation de l’hydrocéphalie posthémorragique de la prématurité chez le rat
Dans cet article
Résumé
L’hydrocéphalie posthémorragique du prématuré (PHHP) peut être modélisée chez le rat nouveau-né en associant la chorioamnionite et l’hémorragie intraventriculaire. La combinaison de ces événements prénataux et postnatals récapitule avec précision les caractéristiques cliniques du PHHP, notamment la macrocéphalie, la ventriculomégalie et l’élévation de la pression intracrânienne, tout au long de la vie.
Résumé
L’hydrocéphalie posthémorragique du prématuré (PHHP) est une séquelle grave d’une hémorragie intraventriculaire (IVH) sévère chez les grands prématurés de moins de 32 semaines d’âge gestationnel (AG). La PHHP est définie par l’accumulation de liquide céphalo-rachidien (LCR) associée à des symptômes cliniques d’élévation de la pression intracrânienne (PIC). Les nourrissons atteints de PHHP souffrent d’une dépendance à vie à la dérivation, la moitié nécessitant une intervention chirurgicale répétée au cours de la première année de vie et beaucoup nécessitant plusieurs interventions chirurgicales supplémentaires tout au long de la vie. La chorioamnionite prénatale prédispose les nouveau-nés prématurés à une hémorragie intraveineuse sévère et à la nécessité d’un traitement chirurgical des tendances PHHP avec septicémie néonatale. Ces caractéristiques cliniques suggèrent que l’inflammation systémique fait partie intégrante de la physiopathologie du PHHP.
Ici, nous définissons un modèle animal qui récapitule tous les aspects cliniques et les caractéristiques essentielles de la PHHP chez le rat. L’objectif de ce protocole est d’illustrer comment la chorioamnionite in utero et l’HVI postnatale à l’aide de globules rouges lysés peuvent être combinées pour produire des PHHP. Cette approche préclinique permet d’obtenir une macrocéphalie progressive et des crânes bombés, une pression intracrânienne élevée et une ventriculomégalie qui peuvent être détectées par imagerie par résonance magnétique (IRM) ou par microscopie. En plus d’une perturbation soutenue de la dynamique du LCR, les rats présentent également un retard cognitif et une incapacité fonctionnelle à l’âge adulte. En conséquence, cette plateforme préclinique facilite des études translationnelles uniques et inégalées sur le PHHP qui peuvent intégrer des mesures moléculaires, cellulaires, biochimiques, histologiques, d’imagerie et de résultats fonctionnels. Il peut également être utilisé pour une analyse rigoureuse du plexus choroïde, des cils mobiles épendymaires et du système glymphatique en parallèle. Enfin, il peut également s’agir d’un outil préclinique inestimable pour l’étude de nouvelles stratégies d’intervention chirurgicale et d’approches thérapeutiques non chirurgicales pour le traitement de l’hydrocéphalie.
Introduction
L’hydrocéphalie posthémorragique du prématuré (PHHP) reste un problème de santé publique important. Définie par une accumulation symptomatique de liquide céphalo-rachidien (LCR) concomitante à une pression intracrânienne élevée (PIC) secondaire à une hémorragie intraventriculaire (HIV), la PHHP est une manifestation grave de l’encéphalopathie du prématuré et contribue de manière significative au fardeau mondial de la prématurité et de l’hydrocéphalie acquise 1,2. À l’échelle mondiale, environ 400 000 nourrissons naissent chaque année avec ou acquièrent le fardeau de l’hydrocéphalie3 à vie et beaucoup meurent en raison de l’absence de traitement3. La PHHP est fréquente dans les pays développés chez les grands prématurés (<32 semaines de gestation) atteints d’hémorragie intraveineuse sévère, et touche souvent les nourrissons les plus malades qui souffrent déjà d’autres comorbidités potentiellement mortelles 4,5.
Le seul traitement disponible pour l’hydrocéphalie est la chirurgie6. Les interventions chirurgicales permettent une meilleure longévité lorsque les nourrissons ont plus de 6 mois au moment de la première intervention permanente, qu’il s’agisse d’une dérivation ventriculo-péritonéale (VP) pour détourner le liquide céphalo-rachidien (LCR), d’une troisième ventriculostomie endoscopique (VTE) ou d’une VTE avec coagulation du plexus choroïde (VTE-CPC)7. L’option la plus courante, les dérivations VP, échoue souvent dans l’année et prédispose les enfants à toute une vie de complications, de chirurgies répétées et d’hospitalisations, ce qui coûte cher à l’enfant, à la famille et à la société. 8 En particulier, l’anxiété liée à une dérivation susceptible d’échouer à tout moment est pesante pour les familles9. Les soins aux enfants atteints d’hydrocéphalie symptomatique, y compris les interventions chirurgicales fréquentes, sont l’une des principales causes de dépenses de santé pédiatrique 10,11,12,13,14. Le coût annuel estimé des dépenses liées aux dérivations chez les enfants était de 2 milliards de dollars en 200315. Alors que les enfants atteints de dérivation ne représentent que 0,6 % des admissions à l’hôpital, ils génèrent 3,1 % des frais hospitaliers pédiatriques15. Ainsi, la découverte de thérapies sûres et non chirurgicales pour le traitement du PHHP est primordiale.
Chez les nourrissons, la PHHP se développe après une hémorragie intraveineuse au cours d’une période clinique qui dure des semaines à des mois après l’identification initiale de l’hémorragie cérébrale. Une étude menée par le Réseau de recherche clinique sur l’hydrocéphalie (HCRN) a confirmé que les dérivations VP restent la meilleure option chirurgicale pour les nouveau-nés atteints de PHHP16. Même pour les enfants atteints de PHHP dans les pays à revenu élevé ayant accès à des soins neurochirurgicaux pédiatriques qualifiés, les résultats sont loin d’être optimaux, avec >50 % des shunts placés chez les nourrissons atteints de PHHP nécessitant une révision chirurgicale au cours des 2 premières années8. Malgré le besoin évident d’identifier des traitements plus sûrs et plus efficaces pour les PHHP, la recherche s’est heurtée à des obstacles. Les progrès ont été entravés en partie parce que la littérature préclinique sur la PHHP ne parvient souvent pas à distinguer correctement la ventriculomégalie causée par l’hydrocéphalie ex vacuo 17,18 de l’hydrocéphalie symptomatique avec macrocéphalie19,20. En effet, les modèles développementaux de l’hydrocéphalie devraient inclure une macrocéphalie progressive et/ou des mesures d’une ICP1 élevée.
La fusion des connaissances cliniques et précliniques a amélioré la conception de l’étude et propulsé notre compréhension de PHHP2. Des études menées dans divers centres à travers le monde ont montré que l’HVI est plus fréquente chez les nouveau-nés très prématurés secondaires à la chorioamnionite 21,22,23,24,25,26,27,28. En plus de l’infection placentaire et de l’inflammation, la septicémie néonatale est un facteur de risque supplémentaire important et peut jouer un rôle central dans la progression de l’IVH à la ventriculomégalie à la PHHP symptomatique et à l’intervention chirurgicale ultérieure29. Les données précliniques et cliniques soutiennent que l’inflammation transmissible par le sang peut provoquer l’hydrocéphalie20, et que l’inflammation systémique augmente la sécrétion de LCR par le plexus choroïde30. De plus, les adultes atteints d’hémorragie sous-arachnoïdienne et d’hémorragie intraveineuse qui souffrent également de septicémie sont beaucoup plus susceptibles d’avoir besoin d’un shunt31. Des publications plus récentes ont confirmé que l’inflammation réduit la propulsion des cils mobiles épendymaires du LCR 19,20,32 et la réabsorption du LCR par le système glymphatique 33,34,35,36. Dans l’ensemble, l’inflammation systémique est un facteur physiopathologique et clinique clé dans le PHHP1.
Compte tenu de ces résultats, nous avons créé un modèle préclinique de PHHP adapté à l’âge. Ce modèle combine l’hémorragie intranatale immédiate et précoce avec la chorioamnionite, principale cause de naissance prématurée19. Cette approche expérimentale commence in utero, avec l’insuffisance placentaire, l’inflammation placentaire et l’inflammation intraamniotique qui définissent la chorioamnionite 7,8,9,10,11,12,13,14,15,16,17,18,19 ,20,21,22,
23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,
43, 44, 45. Plus précisément, nous récapitulons un syndrome de réponse inflammatoire fœtale, une neutrophilie placentaire et un microenvironnement pro-inflammatoire du SNC chez la période préprématurée via laparotomie abdominale chez des mères rates gravides au 18e jour embryonnaire (E18)37,38,39,40,41,42,43,44,45. Les lésions intra-utérines sont induites par une occlusion bilatérale temporaire de l’artère utérine entraînant une hypoxie-ischémie systémique transitoire (TSHI) suivie d’une injection intraamniotique de lipopolysaccharide (LPS)37,38,39,40,41,42,43,44,45. Par la suite, pour perturber la dynamique du LCR et catalyser le développement de l’hydrocéphalie chez les petits nés vivants, l’HVI est induite le 1er jour postnatal. Ceci est accompli par injection intra-ventriculaire bilatérale (ICV) de globules rouges lysés (GR) dans les ventricules latéraux 19,37,44. Les petits sont ensuite étudiés au fur et à mesure que l’hydrocéphalie se développe et tout au long de leur vie.
Protocole
Le Comité de protection et d’utilisation des animaux (ACUC) de l’Université Johns Hopkins a approuvé toutes les procédures expérimentales décrites dans le présent document. Ce protocole utilise des mères de rats Sprague-Dawley gestantes et des petits des deux sexes.
1. Induction de la chorioamnionite sous E18
REMARQUE : La partie de ce protocole sur l’insulte in utero a déjà été publiée en détail, est résumée ci-dessus et fait l’objet d’un protocole JOVE séparé et d’une vidéo 19,37,38,39,40,41,42,43,44,46. En bref, les rates Sprague-Dawley femelles enceintes subissent une laparotomie abdominale au 18e jour embryonnaire (E18) pour induire une chorioamnionite, qui comprend l’administration de TSHI et de LPS intraamniotique.
- Anesthésie
- Induire une anesthésie chez la mère de rat gravide E18 avec 2-4 % d’isoflurane.
- Retirez la mère enceinte de la chambre d’induction et placez le rat en position couchée sur une couverture d’eau circulante chirurgicale drapée réglée à 37 °C.
- Appliquez une pommade ophtalmique pour prévenir le dessèchement de la cornée. Pressez doucement une patte pour confirmer l’absence de réflexe de pincement des orteils. Surveillez la profondeur de l’anesthésique toutes les 15 à 20 minutes et augmentez la dose d’isoflurane en cas de réponse positive au pincement des orteils.
- Administrer de la buprénorphine à libération prolongée (0,1 mg/kg SC) sur la nuque.
- Préparation chirurgicale et gommage
- À l’aide d’une technique stérile standard, rasez l’abdomen.
- Frottez l’abdomen 3 fois avec une alternance de bétadine et d’éthanol à 70 %.
- Drapez l’animal à l’aide de champs chirurgicaux stériles.
- Laparotomie abdominale
- Faites une incision médiane de 3 cm sur la peau abdominale préparée avec un scalpel.
- Utilisez des pinces et des ciseaux chirurgicaux pour maintenir la couche fasciale abdominale et faites une incision de la linea alba avasculaire de la couche musculaire pour accéder à la cavité péritonéale.
- Extérioriser l’utérus.
- Isolez et clampez les artères utérines à l’aide de pinces d’anévrisme pendant 60 min. Maintenez la température et maintenez le contenu intraabdominal humide avec une solution saline stérile.
- Retirez les clips et injectez 100 μL de LPS (4 μg/sac de solution de LPS) dans chaque sac amniotique de chaque fœtus. Ne dérangez pas le fœtus ou le placenta.
- Irriguez généreusement les cornes utérines et le champ 3x avec une solution saline stérile.
- Fermeture de la laparotomie
- Replacez les cornes utérines dans la cavité péritonéale.
- Rapprochez les bords de la couche musculofasciale et fermez-la à l’aide d’une suture 3-0.
- Rapprochez la couche cutanée et fermez la peau à l’aide d’une suture 3-0.
- À l’aide d’une aiguille de 26 g, injectez par voie sous-cutanée 0,125 % de bupivacaïne sur les bords de la plaie.
- Pour les contrôles simulés, effectuez la laparotomie pendant la même durée pour contrôler la durée de l’anesthésie. Ne clampez pas les artères et n’administrez pas d’injections intraamniotiques. À la fin de la procédure, fermez la laparotomie en deux couches (muscle abdominal, fascia et peau) à l’aide d’une suture 3-0. Dans tous les cas, les petits naissent à terme (E21/22) et sont pris en charge par la mère.
2. Préparation des globules rouges lysés sur P1
- Prélèvement de sang
- Prendre un petit rat Sprague-Dawley mâle et une femelle au jour 1 postnatal (P1) d’une portée qui a souffert de chorioamnionite le E18. Décapitez rapidement chaque chiot donneur avec des ciseaux chirurgicaux dédiés.
REMARQUE : Nous utilisons 1 chiot mâle et 1 chiot femelle pour la collecte de sang afin d’éliminer un biais sexuel potentiel en représentant chacun dans les cohortes de donneurs. De plus, nous utilisons une paire de sexe apparié pour garantir un volume et un rendement suffisants de globules rouges lysés pour injecter leurs compagnons de portée. En règle générale, chaque petit donneur produit suffisamment de globules rouges lysés pour effectuer l’injection d’ICV sur un maximum de 4 à 5 compagnons de portée. - Prélevez immédiatement le sang dans un tube de microcentrifugation de 2 ml contenant 0,2 ml de solution saline stérile, en prenant soin de ne recueillir que le sang qui s’écoule librement après la décapitation et de ne pas gratter ou presser pour produire plus de sang, car cela conduit à une hémolyse prématurée. Vortex bien.
REMARQUE : La quantité exacte de sang varie en fonction de l’animal donneur et du poids, mais elle doit être maximale tout en maintenant les précautions ci-dessus. - Hacher/émincer les caillots sanguins avec de petits ciseaux chirurgicaux.
- Centrifuger la suspension sanguine à 500 × g pendant 10 min à 4 °C, retirer le surnageant et remettre la pastille en suspension dans 0,2 mL de solution saline stérile. Vortex bien.
- Hacher/hacher les caillots sanguins résiduels post-vortex avec de petits ciseaux chirurgicaux.
- Répétez les étapes 2.1.4-2.1.5 deux fois de plus pour un total de 3 fois, en nettoyant les ciseaux chirurgicaux avec un spray d’éthanol à 70 % entre chaque cycle de lyse.
- Prendre un petit rat Sprague-Dawley mâle et une femelle au jour 1 postnatal (P1) d’une portée qui a souffert de chorioamnionite le E18. Décapitez rapidement chaque chiot donneur avec des ciseaux chirurgicaux dédiés.
- Lyse des globules rouges
- Après la centrifugation finale, ajouter 0,25 mL de solution saline stérile à la pastille ; Vortex bien.
- Placez la suspension sur de la glace carbonique pendant 5 min.
- Retirez la suspension de la glace sèche, placez-la dans un incubateur réglé à 37,5 °C pendant 5 minutes jusqu’à ce qu’elle soit complètement décongelée, et agitez bien.
- Répétez les cycles de congélation et de décongélation pour un total de 3 fois (trois gels et trois dégels).
- À la fin du dernier dégel, vortex et effectuez une rotation rapide. Les RBC sont maintenant lysés et prêts à l’emploi.
REMARQUE : Le mélange doit être d’une couleur opaque semblable à du jus de tomate et être facilement aspiré dans des seringues.
3. Injections intra-ventriculaires de globules rouges lysés sur P1
- Anesthésie par hypothermie
- Placez une petite plate-forme sur de la glace humide pour refroidir.
- Placez une lingette sèche de laboratoire sur le dessus pour protéger la peau du chiot.
REMARQUE : Cette surface froide plane est utilisée pour l’anesthésie et l’injection des chiots. - Transférer sur le petit (âgé de P1) du coussin chauffant sur la lingette de travail sur la plate-forme froide pour induire l’anesthésie par hypothermie.
- Confirmez la profondeur de l’anesthésie en serrant une patte et en confirmant l’absence de réflexe de pincement des orteils.
- Réglez une lampe chirurgicale externe sur ses réglages les plus lumineux.
- Avec un assistant utilisant son index et son majeur pour maintenir doucement la ligne médiane de la tête de l’animal, transilluminez le crâne pour visualiser les ventricules latéraux à travers le crâne. Identifiez le bregma en visualisant le sinus sagittal supérieur (ligne médiane) à travers la peau et en palpant la suture coronale avec de fines pinces comme points de repère d’intersection.
- Injection ICV
- Essuyez la tête du chiot anesthésié avec un coton-tige imbibé d’éthanol à 70 %.
- Identifiez et marquez le site d’injection à 1 mm latéral de la suture sagittale, à mi-chemin entre lambda et bregma.
- Après la visualisation, utilisez une seringue à insuline de 0,3 mL de 8 mm de long et 31 G avec une aiguille percutanée ultrafine pour injecter 20 μL de globules rouges lysés dans le ventricule latéral droit. Insérez l’aiguille directement vers le bas à l’aide d’une technique à main levée sur une profondeur d’environ la moitié de la longueur de l’aiguille et injectez et retirez l’aiguille lentement (processus d’injection et de retrait sur environ 10 à 15 s).
- Laissez l’aiguille en place pendant quelques secondes après l’injection pour empêcher la sortie des globules rouges lysés injectés.
- Répétez l’opération avec le ventricule latéral gauche et injectez 20 μL de globules rouges lysés.
- Placez le chiot sur un coussin chauffant réglé à 37,5 °C pour se remettre de l’anesthésie.
- Notez le sexe du petit et attribuez-lui un identificateur unique de l’animal.
- Ne remettez le chiot dans la cage de la maison qu’après s’être complètement rétabli sur le coussin chauffant et avoir repris conscience afin que l’animal puisse maintenir en toute sécurité sa position couchée sternale.
- Surveillez quotidiennement tous les bébés rats pour leur santé et leur bien-être.
4. Confirmation de la réussite de l’hémorragie intraventriculaire bilatérale sur P2
- Échographie de la tête
- Pour vous préparer à l’échographie de la tête, retirez les chiots P2 de leur cage domestique.
- Placez du gel à ultrasons sur la sonde à ultrasons et positionnez la sonde sur le dessus du crâne.
- Avec une pression extrêmement légère, déplacez la sonde pour visualiser les ventricules. Confirmer l’hyperéchogénicité bilatérale dans les ventricules latéraux représentant l’HVI.
5. Confirmation du succès de l’hydrocéphalie posthécorragique
- Mesure de la distance intra-auriculaire (IAD), un substitut de la circonférence de la tête, pour confirmer la macrocéphalie
- Pour vous préparer à la mesure, procurez-vous un petit ruban à mesurer approprié pour mesurer la circonférence de la tête, idéalement avec des désignations millimétriques clairement visualisées.
- Demandez à un observateur masqué de retirer le chiot de sa cage domestique.
- Tout en tenant doucement le chiot, mesurez la distance d’une oreille à l’autre (distance intra-aurale, IAD) et notez la valeur en millimètres.
- Répétez l’IAD tous les jours de P1 à P15 et tracez graphiquement les valeurs. Suivre en série l’IAD et mesurer à nouveau à P21 lors de la relocalisation des petits dans de nouvelles cages physiquement séparées de la mère (qui est le point de temps standard pour le sevrage des petits). Répétez l’IAD par la suite tous les 5 jours en commençant à P25 jusqu’à P60.
- Mesure de la pression d’ouverture pour confirmer une pression intracrânienne élevée
- Demandez à un observateur masqué de retirer le chiot de sa cage d’origine.
- Anesthésier avec 75 à 100 mg/kg de kétamine intrapéritonéale (IP) et 5 à 10 mg/kg de xylazine IP en préparation de l’euthanasie.
- Vérifiez la profondeur de l’anesthésie en serrant une patte et en confirmant l’absence de pincement des orteils/réflexe de pédale.
- Insérez une petite aiguille (31 G) reliée à un manomètre dans l’espace de la jonction cervicomédullaire du LCR.
- Enregistrez la pression d’ouverture sur le manomètre.
- Retirez l’aiguille et décapitez le rat avec des ciseaux tranchants et procédez au prélèvement de tissus.
- Imagerie par résonance magnétique (IRM) ex-vivo pour l’évaluation de la ventriculomégalie
- Anesthésier avec 75-100 mg/kg de kétamine intrapéritonéale (IP) et 5-10 mg/kg IP Xylazine en préparation de l’euthanasie.
- Vérifiez la profondeur de l’anesthésie en serrant une patte et en confirmant l’absence de pincement des orteils/réflexe de pédale.
- Perfuser les rats avec une solution saline tamponnée au phosphate (PBS), suivie de 4 % de paraformaldéhyde (PFA) jusqu’à ce qu’ils soient bien fixés.
- Retirez le cerveau et fixez-le dans 4 % de PFA
- Encastrer le cerveau dans de l’agarose à 2 % dans un tube conique de 50 ml. Laissez-le reposer à température ambiante.
- Transférez le cerveau vers l’IRM pour l’IRM ex vivo .
- Exécutez l’IRM 11.7T comme suit : T2 Turbo RADE ; TE/TR = 30,0/3000 ms ; moy = 2 ; Espacement des échos = 10.000 ms ; Facteur RARE = 8 ; nombre de tranches = 30 ; épaisseur de la tranche = 1 mm ; taille de l’image = 128 x 128 ; Champ de vision = 28 mm x 28 mm ; résolution de tranche = 0,219 x 0,219 mm2 ; FA = 90,0°.
REMARQUE : Bien que l’imagerie par IRM fournisse la preuve de la réussite de la modélisation du PHHP, il n’est pas nécessaire de scanner tous les cerveaux d’une cohorte donnée pour vérifier le PHHP. Les mesures IAM et ICP sont suffisantes pour vérifier comme décrit ci-dessus. En fin de compte, la capacité d’un chercheur à effectuer une IRM in vivo ou ex vivo dépendra de divers facteurs tels que l’accès au scanner IRM, les fonds et les capacités techniques. Cette étape est particulièrement utile pour la validation lors de l’intégration récente du modèle PHHP. Il est essentiel de noter qu’en l’absence de signes documentés d’augmentation de la pression intracrânienne, tels qu’une pression d’ouverture élevée, des signes isolés de ventriculomégalie à l’imagerie IRM ne représentent pas une hydrocéphalie.
Résultats
En utilisant ce modèle, l’hydrocéphalie se développe dans les jours et les semaines suivant l’injection de globules rouges lysés. La figure 1 présente une représentation d’un plan d’expérience typique et de la progression de l’hydrocéphalie. Nous avons évalué 5 à 6 animaux fictifs et 6 à 8 animaux PHHP par groupe. À l’âge juvénile, les rats atteints de PHHP présentaient une macrocéphalie (figure 2), une pression intracrânienne élevée (figure 3) et une ventriculomégalie (figure 4). La constellation et la combinaison de ces résultats représentent l’hydrocéphalie. Ces rats ont également un retard de développement19 et, à l’âge adulte, survivent avec des difficultés cognitives persistantes et une PIC élevée. Les mâles obtiennent de moins bons résultats que les femelles dans ce modèle19, qui reproduit le scénario clinique où les mâles sont plus enclins à développer une hydrocéphalie 3,19. Les chercheurs qui utilisent cette plateforme expérimentale pour étudier l’hydrocéphalie seront en mesure de confirmer la réussite de la procédure en visualisant une macrocéphalie progressive et un crâne bombé qui se développe au cours des 5 jours suivant l’induction de l’HVI et qui se maintient tout au long de la vie (Figure 2). La macrocéphalie soutenue est un signe essentiel, cliniquement important et facilement identifiable d’une procédure réussie. Au 21e jour postnatal (P21), les augmentations statistiquement significatives des DAI (substitut de la circonférence de la tête utilisé en clinique) et de la pression d’ouverture sont quantifiables (Figure 3). De même, la ventriculomégalie et l’augmentation du volume ventriculaire sont observables à l’IRM et à l’histologie par rapport aux témoins fictifs (Figure 4)1,2,19. La quantification du volume ventriculaire, soit par imagerie IRM structurelle, soit par des procédures histologiques standard comme le violet de crésyle ou la coloration à l’hématoxyline et à l’éosine, est un excellent complément à une diffusion plus sophistiquée et à l’imagerie fonctionnelle. Ces données sont cohérentes avec les caractéristiques cliniques du PHHP, y compris la macrocéphalie, la dynamique perturbée du LCR entraînant une expansion ventriculaire et une PIC élevée.
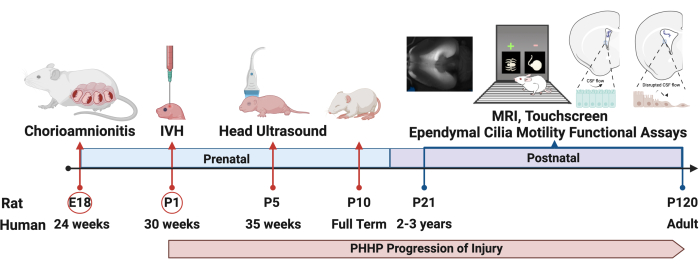
Figure 1 : Conception expérimentale. Le protocole pour induire la PHHP commence par l’induction de la chorioamnionite chez le rat au 18e jour embryonnaire (E18) et de l’hémorragie intraventriculaire au 1er jour postnatal (P1). L’hydrocéphalie se développe et évolue tout au long de la vie et peut être évaluée par plusieurs paramètres, y compris des tests fonctionnels, jusqu’à l’âge adulte. Abréviations : PHHP = hydrocéphalie posthéloragique du prématuré ; IVH = hémorragie intraventriculaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Macrocéphalie typique du PHHP. Les rats atteints de PHHP ont des crânes élargis et bombés et une macrocéphalie par rapport aux témoins fictifs. Abréviation : PHHP = hydrocéphalie posthégoragique du prématuré. Veuillez cliquer ici pour voir une version agrandie de cette figure.
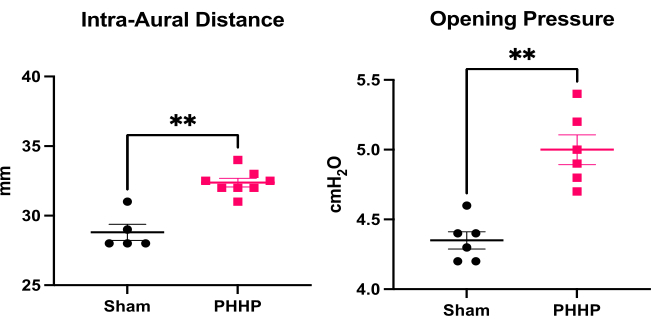
Figure 3 : Quantification de la macrocéphalie et de l’élévation de la pression intracrânienne. Les rats atteints de PHHP (n = 8) ont une distance intra-auditive accrue (un substitut de la circonférence de la tête) et une pression d’ouverture accrue (pression intracrânienne, n = 6) le 21e jour postnatal (P21) par rapport aux témoins simulés (n = 5-6). (test t **p < 0,01, les barres d’erreur représentent l’erreur type de la moyenne). Abréviation : PHHP = hydrocéphalie posthégoragique du prématuré. Veuillez cliquer ici pour voir une version agrandie de cette figure.
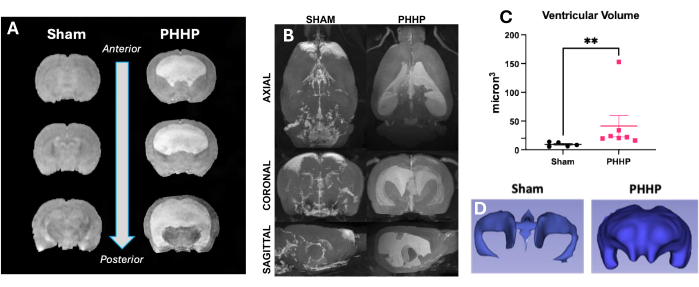
Figure 4 : Les rats atteints de PHHP présentent une ventriculomégalie modérée à sévère. Les rats atteints de PHHP ont des ventricules élargis et un volume ventriculaire accru par rapport aux témoins fictifs clairement identifiables à l’imagerie par résonance magnétique. (A) L’imagerie structurelle T2 montre une dilatation ventriculaire dans le plan coronal de l’avant vers l’arrière à P21. (B) L’augmentation du volume ventriculaire chez les rats PHHP par rapport aux animaux fictifs est également visible dans les plans axial, coronal et sagittal chez les rats adultes à P60. Les volumes ventriculaires peuvent être quantifiés à l’aide de l’IRM (C) (n=5-7/groupe) et associés à la reconstruction 3D (D) du système ventriculaire à tout âge. (test t **p < 0,01, les barres d’erreur représentent l’erreur type de la moyenne). Abréviation : PHHP = hydrocéphalie posthégoragique du prématuré. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce protocole pour l’induction de la PHHP permet des mesures rigoureuses, quantifiables et cliniquement traduisibles de la structure et de la fonction cérébrales concomitantes aux caractéristiques phénotypiques de l’hydrocéphalie, y compris l’élévation chronique de la PIC, la ventriculomégalie et la macrocéphalie, de la naissance à l’âge adulte4. Des tests biochimiques, histologiques et fonctionnels peuvent être utilisés pour évaluer la santé du plexus choroïde, de l’épendyme et du système glymphatique, ainsi que de la matière grise et blanche19. De plus, ce modèle peut soutenir l’intégration de l’imagerie fonctionnelle du LCR et des cils vivants avec la neuroimagerie multimodale et les résultats biocomportementaux. Il peut également être utilisé pour combiner des études mécanistes utilisant la cytométrie en flux multiparamétrique et des dosages dynamiques de cellules neurales avec l’histologie et l’immunochimie afin d’évaluer rigoureusement le microenvironnement ventriculaire. Associée à l’évaluation numérique de la marche et aux tests sur écran tactile de la cognition et de la fonction exécutive 2,19, cette approche peut permettre l’évaluation de biomarqueurs cellulaires, fluides et neurocomportementaux qui n’étaient pas utilisés auparavant dans les études translationnelles du PHHP.
Pour les familles d’enfants atteints de PHHP, la priorité absolue après une fonction de dérivation durable est l’amélioration des résultats cognitifs et la promesse de stratégies de traitement non chirurgicales 47,48,49. Le développement de pharmacothérapies pour répondre à ces besoins est la première étape vers la transformation des soins aux enfants atteints de PHHP 2,47,48,49. Ce modèle préclinique se prête à l’essai de régimes médicamenteux et de produits pharmaceutiques émergents. Il est approprié pour l’évaluation d’interventions non chirurgicales et de traitements pharmacologiques conçus pour moduler la dynamique du LCR. Ces médicaments peuvent être administrés par plusieurs voies d’administration chez le rat (c.-à-d. intrapéritonéale, intraveineuse, sous-cutanée, minipompe osmotique) et leur hydrocéphalie et leur ventriculomégalie peuvent être suivies, surveillées et quantifiées tout au long de la vie à l’aide de l’imagerie et des signes cliniques. De multiples aspects de la santé du cerveau peuvent également être testés, notamment le volume ventriculaire, la perte de substance blanche et la connectivité fonctionnelle. L’histologie, l’immunohistochimie, la qPCR et les expériences associées peuvent être réalisées sur le prélèvement de tissus dans des régions spécifiques et des critères d’évaluation distincts sur le plan du développement. Cette plate-forme d’étude chez le rat peut également faciliter l’étude des comorbidités associées à l’hydrocéphalie, notamment la paralysie cérébrale, l’épilepsie et la douleur chronique4.
La mortalité dans ce modèle est de 3 à 7 % et survient le plus souvent dans les 48 premières heures suivant l’hémorragie intraveineuse19,44. Parfois, les ratons ne parviennent pas à prendre du poids et à se nourrir efficacement. Ce retard de croissance peut être le résultat direct d’une macrocéphalie progressive associée à une procédure réussie, ou d’une hémorragie corticale/sous-corticale causée par une mauvaise technique d’injection ICV. En l’absence de la précision nécessaire, un infarctus hémorragique cortical ou un traumatisme de la base du crâne peuvent être observés. Les soins postnatals peuvent être perturbés par les interventions prénatales ou postnatales décrites car les petits sont nettement différents des témoins fictifs en ce qui concerne la forme de la tête, la taille du corps et le comportement. Une technique chirurgicale et d’injection appropriée, combinée à une compétence neuroanatomique avancée, est cruciale pour garantir que les résultats représentatifs ci-dessus sont pleinement réalisés.
Cette plateforme préclinique nécessite une laparotomie abdominale ouverte pour être réalisée chez les rates gravides. Cela nécessite des compétences chirurgicales avancées. Au cours de la période postnatale, l’absence d’injection précise de globules rouges lysés dans les ventricules latéraux n’entraînera pas d’hémorragie intraveineuse ni de PHHP et ces rats ne se développeront pas pour présenter une macrocéphalie progressive, une pression d’ouverture élevée ou une ventriculomégalie. Le confort avec les injections à main levée et l’anatomie ventriculaire des rongeurs néonatals est essentiel. Notamment, des fontanelles ouvertes et des crânes relativement minces rendent possible la transillumination et facilitent l’identification de repères neuroanatomiques tels que le bregma et les faces dorsales des ventricules latéraux nécessaires à la mise en place réussie de l’aiguille. Une hémorragie intraveineuse unilatérale est possible si les deux ventricules latéraux ne sont pas accessibles, ce qui peut entraîner une macrocéphalie transitoire mais non persistante. La sortie du LCR après l’accès ventriculaire est un indicateur approprié de la réussite des injections. De même, l’aspiration du LCR dans l’embout de l’aiguille avant l’injection des globules rouges lysés permet de s’assurer que l’injecteur se trouve dans l’espace ventriculaire approprié pour procéder à l’injection. Bien que la ventriculomégalie à l’IRM puisse être présente en l’absence d’hydrocéphalie (encéphalomalacie), la combinaison de cette découverte, ainsi que d’une pression d’ouverture élevée et de déficits neurocognitifs, représente l’exécution réussie de la technique PHHP.
L’analyse du succès de la procédure peut être vérifiée en comparant les paramètres représentatifs ci-dessus entre les petits qui ont subi une injection ICV de globules rouges lysés et les petits simulés ou chez les petits qui ont subi une injection ICV par rapport aux petits témoins qui ont présenté une chorioamnionite mais pas l’injection ICV de globules rouges lysés. Il est important de noter que les mères fictives subissent une exposition à l’isoflurane ainsi qu’une laparotomie et une extériorisation utérine. Contrairement au modèle PHHP, cependant, les sacs amniotiques et l’utérus sont ensuite renvoyés dans la cavité abdominale et la laparotomie est terminée sans occlusion de l’artère utérine ni injection de LPS. Les petits issus de ces mères fictives ne reçoivent généralement pas d’injections de globules rouges lysés, car c’est la combinaison spécifique de TSHI + LPS in utero (que les fœtus fictifs ne connaissent pas) suivie d’une hémorragie intraveineuse qui conduit à la PHHP. De plus, en ayant des témoins appariés selon l’âge et le sexe qui ne sont exposés ni à TSHI+LPS ni à IVH, nous sommes en mesure de valider le succès technique du modèle et de comparer plus directement les résultats des cohortes PHHP qui ont reçu une intervention avec les résultats de leurs homologues fictifs. Cette comparaison permet d’effectuer des tests d’efficacité robustes à la fois du modèle et de toute intervention thérapeutique dans celui-ci.
Malgré la compétence technique requise, ce modèle est avantageux par rapport à d’autres modèles d’IVH et d’hydrocéphalie précoces, car il est adapté à l’âge, intègre l’inflammation systémique, a des séquelles PHHP évolutives à l’âge adulte et offre la possibilité d’évaluer des mesures de résultats translationnelles telles que des tests fonctionnels sophistiqués et la neuroimagerie 30,50,51,52. Il entraîne également une ventriculomégalie soutenue et une ICP élevée. L’utilisation de globules rouges lysés augmente la pertinence translationnelle de ce modèle. Les nouveau-nés prématurés qui souffrent d’hémorragie intraveineuse ont du sang total libéré dans leurs ventricules. Ce sang reste dans le système ventriculaire du LCR et se dégrade au fil des semaines (lyse des globules rouges), ce qui entraîne une réponse inflammatoire persistante dans les ventricules, souvent observée à l’échographie de routine de la tête comme une hyper-échogénicité épendymaire53,54. L’utilisation de globules rouges lysés corrobore et corrobore les travaux antérieurs évaluant l’efficacité de produits/composants sanguins individuels dans la création d’hydrocéphalie et de ventriculomégalie soutenue55. Contrairement aux globules rouges emballés, l’injection intraventriculaire de globules rouges lysés entraîne une hypertrophie significative des ventricules à l’IRM 24 h après l’injection et au-delà de19,55. Il a été constaté que l’injection de globules rouges lysés régule à la hausse les niveaux d’hémaggénase-1 et de ferritine dans l’espace périventriculaire par rapport aux globules rouges emballés ou à l’injection saline55. Ceci est important car la physiopathologie de l’hémorragie intraveineuse humaine est en grande partie due à la dégradation du sang initial et à la libération progressive de produits de dégradation du fer et d’autres composants sanguins concomitants aux lésions tissulaires qui en résultent.
L’hème-oxygénase 1 est une enzyme majeure dans la dégradation de l’hème, et la ferritine est une protéine de stockage du fer ; ainsi, leur concentration subventriculaire accrue après l’injection de globules rouges lysés s’aligne étroitement sur l’étiologie de l’HVI humaine. Enfin, l’injection de fer uniquement dans les espaces ventriculaires néglige d’autres composants des globules rouges tels que l’anhydrase carbonique 29. De plus, l’injection de fer ne maximise pas la gravité potentielle de l’hémorragie intraveineuse induite, qui est directement corrélée à la probabilité d’une hydrocéphalie ultérieure. Comme le choix d’utiliser des globules rouges lysés, la raison d’être de l’injection des deux ventricules est d’augmenter la traduction. La littérature clinique montre une association accrue claire entre une hémorragie intraveineuse plus sévère et une PHHP ultérieure. L’introduction d’hémorragies bilatérales augmente en soi la gravité de l’hémorragie intraveineuse ainsi que la probabilité d’extension de la matrice germinale dans les espaces ventriculaires et la dilatation ventriculaire qui en résulte - une autre caractéristique de l’hémorragie intraventriculaire plus sévère. De plus, comme décrit ci-dessus, l’injection bilatérale permet également d’évaluer la communication du LCR. Vingt microlitres est le volume le plus bas pour atteindre de manière fiable une hydrocéphalie soutenue et sans atteinte parenchymateuse significative, de sorte que la mortalité des petits rats devient une variable de complication.
En conclusion, l’utilisation d’un modèle animal qui récapitule les aspects cliniques du PHHP, y compris la macrocéphalie progressive, l’élévation de la pression intracrânienne, la ventriculomégalie et le retard cognitif à l’âge adulte, ajoute de la rigueur au domaine et facilite des études uniques et inégalées nécessaires à de nouvelles approches thérapeutiques et à une meilleure compréhension mécaniste de la physiopathologie complexe de cette forme courante de lésion cérébrale périnatale.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les auteurs sont reconnaissants du financement fourni par les National Institutes of Health (R01HL139492), le Congressionally Directed Medical Research Program (W81XWH1810166, W81XWH1810167, W81XWH2210461 et W81XWH2210462), l’Association de l’hydrocéphalie et l’Institut de recherche Rudi Schulte.
matériels
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Pharmco | 111000200 | Diluted to 70% |
| Betadine surgical scrub | Cardinal Health | NDC-67618-151-17 | |
| Blunt Forceps | Roboz | RS-8100 | |
| Bravmini Plus Cordless Rechargeable Trimmer | Wahl | 41590-0438 | |
| Carbon Steel Surgical blades | Bard-Parker | 371151-11 | |
| centrifuge | Eppendorf | 5424R | |
| Cotton Gauze Sponge | Fisherbrand | 22-362-178 | Small, 6 inch sterile |
| Cotton-tipped Applicators | Fisherbrand | 23-400-114 | 30 G 1 |
| Eye Lubricant | Refresh Lacri Lube | 75929 | |
| Far infrared warming pad | Kent scientific | RT-0501 | |
| Incubator - Genie Temp-Shaker 100 | Scientific Industries | SI-G100 | |
| Insulin Syringes | BD | 328438 | 0.3 cc 3 mm 31 G, ultrafine |
| Isoflurane | Covetrus | 11695067772 | |
| Ketamine hydrochloride injection | Dechra | 17033-101-10 | |
| Kimwipes | Kimtech Science | BXTNI141300 | |
| LPS 011B4 | Sigma | L2630 | |
| microcentrifuge tubes | Thermo Fisher Scientific | 3453 | 2.0 mL |
| Needle | BD | 305122 | 1 mL |
| Needle | BD | 305128 | 25 G 5/8 |
| Needle Holders | Kent Scientific Corp. | INS14109 | 12.5 CM STR |
| OR Towels | Cardinal Health | 287000-008 | |
| Paper measuring tape | Cardinal Health | SKU | |
| Saline Solution, 0.9% | Sigma | S8776 | |
| Scissors | Roboz | RS-6808 | |
| SomnoSuite | Kent Scientific | SS6823B | |
| Sterile Alcohol Prep Pads | Fisherbrand | 06-669-62 | Sterile |
| Surgical gloves | Biogel | 40870 | |
| Surgical Scissors | Roboz | RS-5880 | |
| Surgical Scissors | EST | 14002-16 | |
| Syringe | BD | 309628 | |
| T/Pump (Heat Therapy Pump) | Stryker Medical | TP700 | |
| Vessel Clips | Kent Scientific Corp. | INS14120 | 30 G Pressure |
| Xylazine injection | vet one | NDC 13985-704-10 |
Références
- Sevensky, R., Newville, J. C., Tang, H. L., Robinson, S., Jantzie, L. L. Cumulative damage: Cell death in posthemorrhagic hydrocephalus of prematurity. Cells. 10 (8), 1911 (2021).
- Robinson, S., Jantzie, L. L. Pathogenesis of posthemorrhagic hydrocephalus of prematurity: New horizons. Semin Perinatol. 46 (5), 151596 (2022).
- Dewan, M. C., et al. Global hydrocephalus epidemiology and incidence: systematic review and meta-analysis. J Neurosurg. 130 (4), 1065-1079 (2018).
- Robinson, S. Neonatal posthemorrhagic hydrocephalus from prematurity: pathophysiology and current treatment concepts. J Neurosurg Pediatr. 9 (3), 242-258 (2012).
- Gigi, M., Roth, J., Eshel, R., Constantini, S., Bassan, H. Health-related quality of life after post-haemorrhagic hydrocephalus in children born preterm. Dev Med Child Neurol. 61 (3), 343-349 (2019).
- Muir, R. T., Wang, S., Warf, B. C. Global surgery for pediatric hydrocephalus in the developing world: a review of the history, challenges, and future directions. Neurosurg Focus. 41 (5), E11 (2016).
- Kulkarni, A. V., et al. Endoscopic third ventriculostomy and choroid plexus cauterization in infant hydrocephalus: a prospective study by the Hydrocephalus Clinical Research Network. J Neurosurg Pediatr. 21 (3), 214-223 (2018).
- Riva-Cambrin, J., et al. Risk factors for shunt malfunction in pediatric hydrocephalus: a multicenter prospective cohort study. J Neurosurg Pediatr. 17 (4), 382-390 (2016).
- Agajany, N., et al. The impact of neonatal posthemorrhagic hydrocephalus of prematurity on family function at preschool age. Early Hum Dev. 137, 104827 (2019).
- Berry, J. G., et al. Characteristics of hospitalizations for patients who use a structured clinical care program for children with medical complexity. J Pediatr. 159 (2), 284-290 (2011).
- Berry, J. G., et al. Hospital utilization and characteristics of patients experiencing recurrent readmissions within children's hospitals. JAMA. 305 (7), 682-690 (2011).
- Berry, J. G., et al. Trends in resource utilization by children with neurological impairment in the United States inpatient health care system: a repeat cross-sectional study. PLoS Med. 9 (1), e1001158 (2012).
- Drake, J. M., et al. Randomized trial of cerebrospinal fluid shunt valve design in pediatric hydrocephalus. Neurosurgery. 43 (2), 294-303 (1998).
- Simon, T. D., et al. Cerebrospinal fluid shunt infection: Emerging paradigms in pathogenesis that affect `prevention and treatment. J Pediatr. 206, 13-19 (2019).
- Simon, T. D., et al. Hospital care for children with hydrocephalus in the United States: utilization, charges, comorbidities, and deaths. J Neurosurg Pediatr. 1 (2), 131-137 (2008).
- Riva-Cambrin, J., et al. Predictors of success for combined endoscopic third ventriculostomy and choroid plexus cauterization in a North American setting: a Hydrocephalus Clinical Research Network study. J Neurosurg Pediatr. 24 (2), 128-138 (2019).
- Emmert, A. S., et al. Characterization of a novel rat model of X-linked hydrocephalus by CRISPR-mediated mutation in L1cam. J Neurosurg. 132 (3), 945-958 (2019).
- Strahle, J. M., et al. Role of hemoglobin and iron in hydrocephalus after neonatal intraventricular hemorrhage. Neurosurgery. 75 (6), 696-705 (2014).
- Robinson, S., et al. Extended combined neonatal treatment with erythropoietin plus melatonin prevents posthemorrhagic hydrocephalus of prematurity in rats. Front Cell Neurosci. 12, 322 (2018).
- Yung, Y. C., et al. Lysophosphatidic acid signaling may initiate fetal hydrocephalus. Sci Transl Med. 3 (99), 99ra87 (2011).
- Moscuzza, F., et al. Correlation between placental histopathology and fetal/neonatal outcome: chorioamnionitis and funisitis are associated to intraventricular haemorrage and retinopathy of prematurity in preterm newborns. Gynecol Endocrinol. 27 (5), 319-323 (2011).
- Salas, A. A., et al. Histological characteristics of the fetal inflammatory response associated with neurodevelopmental impairment and death in extremely preterm infants. J Pediatr. 163 (3), 652-657 (2013).
- Arayici, S., et al. The effect of histological chorioamnionitis on the short-term outcome of preterm infants ≤32 weeks: a single-center study. J Matern Fetal Neonatal Med. 27 (11), 1129-1133 (2014).
- Shankaran, S., et al. Maternal race, demography, and health care disparities impact risk for intraventricular hemorrhage in preterm neonates. J Pediatr. 164 (5), 1005-1011.e3 (2014).
- Lu, H., Wang, Q., Lu, J., Zhang, Q., Kumar, P. Risk factors for intraventricular hemorrhage in preterm infants born at 34 weeks of gestation or less following preterm premature rupture of membranes. J Stroke Cerebrovasc Dis. 25 (4), 807-812 (2016).
- Stark, M. J., Hodyl, N. A., Belegar, V. K., Andersen, C. C. Intrauterine inflammation, cerebral oxygen consumption and susceptibility to early brain injury in very preterm newborns. Arch Dis Child Fetal Neonatal Ed. 101 (2), F137-F142 (2016).
- Lee, J., et al. A new anti-microbial combination prolongs the latency period, reduces acute histologic chorioamnionitis as well as funisitis, and improves neonatal outcomes in preterm PROM. J Matern Fetal Neonatal Med. 29 (5), 707-720 (2016).
- Edwards, J. M., Edwards, L. E., Swamy, G. K., Grotegut, C. A. Magnesium sulfate for neuroprotection in the setting of chorioamnionitis. J Matern Fetal Neonatal Med. 31 (9), 1156-1160 (2018).
- Alan, N., et al. Reduced ventricular shunt rate in very preterm infants with severe intraventricular hemorrhage: an institutional experience. J Neurosurg Pediatr. 10 (5), 357-364 (2012).
- Karimy, J. K., et al. Inflammation-dependent cerebrospinal fluid hypersecretion by the choroid plexus epithelium in posthemorrhagic hydrocephalus. Nat Med. 23 (8), 997-1003 (2017).
- Wessell, A. P., et al. A sustained systemic inflammatory response syndrome is associated with shunt-dependent hydrocephalus after aneurysmal subarachnoid hemorrhage. J Neurosurg. 130 (6), 1984-1991 (2018).
- Abdi, K., et al. Uncovering inherent cellular plasticity of multiciliated ependyma leading to ventricular wall transformation and hydrocephalus. Nat Commun. 9 (1), 1655 (2018).
- Goulding, D. S., et al. Neonatal hydrocephalus leads to white matter neuroinflammation and injury in the corpus callosum of Ccdc39 hydrocephalic mice. J Neurosurg Pediatr. 25 (5), 476-483 (2020).
- Hussain, R., et al. Potentiating glymphatic drainage minimizes post-traumatic cerebral oedema. Nature. 623 (7989), 992-1000 (2023).
- Cai, Y., et al. The relationship between inflammation, impaired glymphatic system, and neurodegenerative disorders: A vicious cycle. Neurobiol Dis. 192, 106426 (2024).
- Mogensen, F. L., Delle, C., Nedergaard, M. The glymphatic system (en)during inflammation. Int J Mol Sci. 22 (14), 7491 (2021).
- Jantzie, L. L., Winer, J. L., Maxwell, J. R., Chan, L. A., Robinson, S. Modeling encephalopathy of prematurity using prenatal hypoxia-ischemia with intra-amniotic lipopolysaccharide in rats. J Vis Exp. (105), e53196 (2015).
- Kitase, Y., et al. Chorioamnionitis disrupts erythropoietin and melatonin homeostasis through the placental-fetal-brain axis during critical developmental periods. Front Physiol. 14, 1201699 (2023).
- Maxwell, J. R., Denson, J. L., Joste, N. E., Robinson, S., Jantzie, L. L. Combined in utero hypoxia-ischemia and lipopolysaccharide administration in rats induces chorioamnionitis and a fetal inflammatory response syndrome. Placenta. 36 (12), 1378-1384 (2015).
- Ozen, M., et al. Chorioamnionitis precipitates perinatal alterations of heme-oxygenase-1 (HO-1) homeostasis in the developing rat brain. Int J Mol Sci. 22 (11), 5773 (2021).
- Yellowhair, T. R., et al. CXCR2 blockade mitigates neural cell injury following preclinical chorioamnionitis. Front Physiol. 10, 324 (2019).
- Yellowhair, T. R., et al. Chorioamnionitis in rats precipitates extended postnatal inflammatory lymphocyte hyperreactivity. Dev Neurosci. , 1-11 (2019).
- Yellowhair, T. R., et al. Preclinical chorioamnionitis dysregulates CXCL1/CXCR2 signaling throughout the placental-fetal-brain axis. Exp Neurol. 301 (Pt B), 110-119 (2018).
- Jantzie, L. L., et al. Complex pattern of interaction between in utero hypoxia-ischemia and intra-amniotic inflammation disrupts brain development and motor function. J Neuroinflammation. 11, 131 (2014).
- Jantzie, L. L., et al. Repetitive neonatal erythropoietin and melatonin combinatorial treatment provides sustained repair of functional deficits in a rat model of cerebral palsy. Front Neurol. , 233 (2018).
- Maxwell, J. R., et al. Prenatal alcohol exposure and chorioamnionitis results in microstructural brain injury in a preclinical investigation. Ann Pediatr Res. 4 (1), 1031 (2020).
- Karimy, J. K., et al. Outcomes of the 2019 hydrocephalus association workshop, "Driving common pathways: extending insights from posthemorrhagic hydrocephalus". Fluids Barriers CNS. 20 (1), 4 (2023).
- Jakopin, N. E., et al. Establishing ranked priorities for future hydrocephalus research. J Neurosurg. 139 (2), 492-501 (2022).
- Koschnitzky, J. E., et al. Opportunities in posthemorrhagic hydrocephalus research: outcomes of the Hydrocephalus Association Posthemorrhagic Hydrocephalus Workshop. Fluids Barriers CNS. 15 (1), 11 (2018).
- Strahle, J., et al. Mechanisms of hydrocephalus after neonatal and adult intraventricular hemorrhage. Transl Stroke Res. 3 (Suppl 1), 25-38 (2012).
- Segado-Arenas, A., et al. Cognitive impairment and brain and peripheral alterations in a murine model of intraventricular hemorrhage in the preterm newborn. Mol Neurobiol. 55 (6), 4896-4910 (2018).
- Li, Q., et al. Targeting germinal matrix hemorrhage-induced overexpression of sodium-coupled bicarbonate exchanger reduces posthemorrhagic hydrocephalus formation in neonatal rats. J Am Heart Assoc. 7 (3), e007192 (2018).
- Gaisie, G., Roberts, M. S., Bouldin, T. W., Scatliff, J. H. The echogenic ependymal wall in intraventricular hemorrhage: sonographic-pathologic correlation. Pediatr Radiol. 20 (5), 297-300 (1990).
- Mohammad, K., et al. Consensus approach for standardizing the screening and classification of preterm brain injury diagnosed with cranial ultrasound: A Canadian perspective. Front Pediatr. 618236, (2021).
- Gao, C., et al. Role of red blood cell lysis and iron in hydrocephalus after intraventricular hemorrhage. J Cereb Blood Flow Metab. 34 (6), 1070-1075 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon