Method Article
휴대용 진단을 위한 CRISPR-Cas 매개 다중분석물 합성 소변 바이오마커 검사
요약
이 프로토콜은 종양 관련 단백질 분해 효소 활성의 생체 외 분석을 통해 현장 암 진단을 가능하게 하는 CRISPR-Cas 매개 다중 분석물 합성 소변 바이오마커 검사에 대해 설명합니다.
초록
정밀 진단 개발을 위한 합성 바이오마커를 개발하면 기존의 생체 유체 측정에 사용되는 것 이상의 경로를 통해 질병을 검출할 수 있습니다. 합성 바이오마커는 일반적으로 질병 발생 및 진행 중 국소 질병 미세환경의 생화학적 변화를 반영하기 위해 생체액에서 읽을 수 있는 신호를 제공하는 리포터를 사용합니다. 리포터의 약동학적 농도와 질병 신호의 생화학적 증폭은 진단 검사에서 높은 민감도와 특이도를 달성하는 데 가장 중요합니다. 여기에서 암 진단 플랫폼은 종양 미세환경에서 비정상적인 단백질 분해 서명에 의해 방출될 수 있는 화학적으로 안정화된 DNA 리포터를 운반하는 활성 기반 나노센서라는 합성 바이오마커의 한 가지 형식을 사용하여 구축됩니다. 질병 리포터로서의 합성 DNA는 바코드로 사용함으로써 멀티플렉싱 기능을 제공하여 한 번에 여러 단백질 분해 서명을 판독할 수 있습니다. 소변으로 방출된 DNA 리포터는 CRISPR RNA와의 교잡을 통해 CRISPR 뉴클레아제를 사용하여 검출되며, 이는 효소 활성화 시 형광 또는 비색 신호를 생성합니다. 이 프로토콜에서는 DNA 바코드, 활성 기반 나노 센서가 구성되고 전이성 결장직장암의 전임상 마우스 모델에서 응용이 예시됩니다. 이 시스템은 질병 생물학에 따라 고도로 수정이 가능하며 여러 질병 신호를 동시에 생성하므로 나노 센서 투여, 소변 수집 및 현장 진단을 가능하게 하는 종이 검사만 필요한 최소 침습 프로세스를 통해 질병 특성을 포괄적으로 이해할 수 있습니다.
서문
흘린 단백질 및 DNA와 같은 종양 바이오마커를 식별하기 위한 상당한 노력에도 불구하고, 암 진단 분야는 혈액 순환 시 존재량이 적거나 급격한 저하로 인해 압박을 받고 있다1. 보완 전략으로, 질병 특징에 선택적으로 반응하여 증폭된 신호를 생성하는 생체공학적 합성 바이오마커는 정확하고 접근 가능한 진단을 향한 새로운 길을 제시합니다 2,3. 검출을 돕기 위해 이러한 합성 바이오마커는 효소 증폭과 같은 종양 의존적 활성화 메커니즘을 활용하여 신호 대 잡음비가 개선된 분석물을 생성합니다4. 본원에서, 암 관련 효소인 프로테아제의 한 종류가 혈액 또는 소변과 같은 생체액으로부터 검출 가능한 질병 보고자를 방출하기 위해 주사 가능한 나노스케일 센서를 활성화시키는데 활용된다(5,6). 종양 이질성에 비추어 볼 때, 프로테아제 활성화 센서 패널을 개발하면 다양한 프로테아제 절단 이벤트를 '질병 시그니처'로 결합하여 암 발생률과 진행을 보다 구체적이고 다중화된 방식으로 평가하는 다중 분석물 검사가 가능합니다.
프로테아제-활성화 합성 바이오마커는 불활성 담체(7)의 표면에 접합된 펩티드 기질을 포함하는 것으로 개발되었다. in vivo에 주입될 때, 이 펩타이드는 종양으로 운반되고, 종양 프로테아제에 의한 효소 절단은 검출을 위해 리포터를 혈액 또는 소변으로 방출합니다. 프로테아제 활성화 합성 바이오마커를 사용한 다중 검출은 칵테일 내의 각 합성 바이오마커에 고유한 분자 바코드로 라벨링해야 합니다. 이를 위해 대량 바코드 및 리간드 인코딩 리포터(8,9,10)를 포함한 다양한 접근법이 개발되었다. 몇 가지 다른 신호 가능성으로 제한될 수 있는 이러한 멀티플렉싱 방법과 달리 DNA 바코드는 인간 질병 상태의 높은 복잡성과 이질성에 따라 더 많은 조합을 제공합니다. 합성 바이오마커의 다중성을 확장하기 위해 센서는 생체 유체 신호를 생체 외 증폭하기 위해 CRISPR-Cas 뉴클레아제를 통해 검출할 수 있도록 각 리포터에 고유한 DNA 염기서열을 라벨링하여 바코드를 부착합니다. 이 단일 가닥 DNA(ssDNA) 바코드는 상보적인 CRISPR 가이드 RNA(crRNA)에 결합하여 CRISPR-Cas12a11의 표적 트리거 측부 뉴클레아제 활성을 활성화하도록 설계되었습니다. 이 뉴클레아제 활성은 형광 역학을 통해 또는 종이 스트립을 사용하여 검출된 리포터 DNA 가닥을 절단하는 데 사용할 수 있습니다.
프로테아제(in vivo) 및 CRISPR-Cas(ex vivo)를 통한 분자 증폭 외에도, 프로테아제 활성화 합성 바이오마커의 또 다른 주요 설계 특징은 나노물질 약동학을 활용하여 생체 유체의 진단 신호 농도를 증가시키는 것입니다10. 한 가지 접근법은 나노 입자 담체를 사용하여 표면 복합 펩타이드 기판의 순환 시간을 늘리는 것입니다. 폴리에틸렌 글리콜(PEG) 덴드리머는 종양에 대한 전달을 증가시키기 위해 상대적으로 작은 유체역학적 직경과 다원자가를 가진 나노캐리어로 선택됩니다. 종양 전달을 촉진하기에 충분히 작지만, PEG 담체의 크기는 신장 사구체 여과 장벽의 ~5nm 크기 컷오프보다 커서 절단된 펩티드 기질만이 신장에 의한 크기 여과를 이용하여 소변으로 제거될 수 있다12. 이 프로토콜에서는 전임상 쥐 모델에서 DNA 바코드 활성 기반 나노센서의 합성 및 적용을 위한 다단계 워크플로우가 요약되어 있으며, 여러 암 유형13의 쥐 모델에서 질병 상태를 분류하기 위해 이 그룹이 사용한 CRISPR-Cas 매개 다중 분석 물질 합성 소변 바이오마커 테스트의 설정을 강조합니다. 다재다능한 설계 원리로 인해 나노센서의 세 가지 기능적 구성 요소인 나노캐리어(PEG 폴리머), 자극 반응 모듈(프로테아제 활성화 기질) 및 생체 유체 리포터(DNA 바코드)는 모두 응용 분야별 요구 사항에 따라 정밀하게 교환할 수 있으므로 표적 및 방출 특이성을 맞춤화하여 모듈화가 가능합니다.
프로토콜
모든 동물 연구는 저자 소속 기관의 IACUC(Institutional Animal Care and Use Committee)의 승인을 받습니다. 이러한 실험을 적절하게 수행하기 위해서는 사육실, 멸균 후드, 마취 및 윤리적 종말점 안락사를 포함한 표준 동물 관리 시설이 필요합니다. 모든 실험은 기관 및 국가 지침에 따라 수행되며 기관의 수의사 직원이 감독합니다. 실험에 사용된 암컷 BALB/c 마우스는 상업적 출처( 재료 표 참조)에서 얻었으며 연구 시작 시 연령이 6주에서 8주 사이였습니다. 맞춤형 합성 DNA, crRNA, FRET 기반 펩타이드 기판 프로브 및 센서 펩타이드의 염기서열은 보충 표 1에 나와 있습니다.
1. 프로테아제 활성화 펩타이드 기질 선택
- 이전에 발표된 보고서에 따라 종양 결절이 있는 건강한 폐 또는 폐 조직에서 조직 샘플을 수집하고 준비합니다13.
- 조직을 단일 세포 현탁액으로 자동 해리하기 위해 조직 해리 튜브를 사용하여 사전 냉각된 인산염 완충 식염수(PBS, pH 7.4)(200mg tissue/mL PBS)에서 조직을 균질화합니다.
- 원심분리기 조직은 6,000 x g 에서 4°C에서 5분 동안 균질화합니다. 상층액을 새 튜브에 보관하십시오.
- 상층액을 14,000 x g 에서 4°C에서 25분 동안 원심분리합니다.
- 비신코닌산(BCA) 단백질 분석 키트를 사용하여 단백질 농도를 측정합니다( 재료 표 참조).
- 샘플에 PBS를 추가하여 0.33mg/mL 용액을 준비합니다.
- 아래 단계에 따라 단백질 분해 활성을 평가합니다.
- 384웰 플레이트에서 5μL, 6μM FRET 기반 펩타이드 기판 프로브를 각 웰에 추가합니다. 각 프로브에 대해 반응을 세 번 수행합니다.
참고: FRET 기반 펩타이드 기판 프로브에는 형광단 및 소광체 쌍으로 종결된 짧은 펩타이드 서열(표적 프로테아제 또는 프로테아제 그룹에 특이적으로 설계된 6-8개의 아미노산)이 포함되어 있습니다. 2개의 FRET 프로브가 보충 표 1 에 예로 설명되어 있습니다. 프로브의 전체 라이브러리는 Hao et al.에서 찾을 수 있습니다.13. - 프로브가 플레이트 바닥에 있는지 확인하기 위해 180 x g 의 실온에서 10초 동안 웰 플레이트를 원심분리합니다.
- 각 웰에 25μL 0.33mg/mL 조직 샘플 또는 40μM 재조합 프로테아제13 을 추가합니다.
참고: 조직 샘플 또는 재조합 프로테아제의 최종 농도는 고유한 단백질 분해 활성에 따라 최적화해야 할 수 있습니다. 예를 들어, 장과 같은 고도의 단백질 분해 조직은 초기 효소 절단을 모니터링하기 위해 더 높은 희석 인자를 필요로 할 수 있습니다. - 웰 플레이트를 180 x g (실온)에서 잠시 원심분리하여 프로브와 조직 용해물을 혼합합니다.
- 플레이트 리더로 37°C에서 1시간 동안 2분마다 형광을 측정하여 절단을 즉시 감지하기 시작합니다(λex: 485nm, λem: 535nm).
NOTE: 특정 fluorophore 및 quencher 쌍에 대해 적절한 excitation 및 emission 파장을 사용하십시오. 이 연구의 경우 FAM 형광단에 대한 매개변수(λex: 485nm 및 λem: 535nm)가 설정됩니다. - 형광 측정 데이터를 분석하려면 https://github.com/nharzallah/NNanotech-Kinetic 에서 제공하는 효소 역학 분석을 위한 Python( 재료 표 참조) 패키지를 활용하십시오. 이 스크립트는 처음 8-10개의 초기 시간 지점의 선형 피팅 기울기를 사용하여 초기 반응 속도(V0)를 계산합니다.
- 384웰 플레이트에서 5μL, 6μM FRET 기반 펩타이드 기판 프로브를 각 웰에 추가합니다. 각 프로브에 대해 반응을 세 번 수행합니다.
2. 센서 배합 및 특성화
- DNA와 프로테아제 활성화 펩타이드(PAP)의 접합체를 합성합니다.
- 20-mer 인산화 DNA 리포터를 3'-DBCO 그룹(1.1 eq., 재료 표 참조)과 함께 C-말단 시스테인 말단이 있는 아지드 종결 PAP를 실온에서 >4시간 동안 100mM 인산염 완충액(pH 7.0)에 배양합니다. 하룻밤 동안 방치할 경우 4 °C에서 배양합니다.
- 생체 분자에 이상적인 컬럼이 장착된 고성능 액체 크로마토그래피(HPLC) 시스템에서 제품을 정제합니다( 재료 표 참조). HPLC 그래디언트를 5% A 완충액(H2O의 0.05% TFA)에서 시작하도록 설정하고, 20분 동안 등용매를 유지하고, 0.3mL min-1의 유속으로 65분에 80% B 완충액(0.05% TFA, 99.95% 아세토니트릴)에 도달하고, ~31분에 머무름 시간으로 접합체 산물을 수집합니다.
- 매트릭스14로 α-시아노-4-하이드록시신남산을 사용하여 매트릭스 보조 레이저 탈착/이온화 비행 시간(MALDI-TOF) 질량 분석법으로 정제된 접합체를 검증합니다( 재료 표 참조).
- DNA로 인코딩된 활성 기반 나노센서를 합성합니다.
- 2mg의 다가 PEG(40kDa, 8-arm, 재료 표 참조)를 1mL의 100mM 인산염 완충액(pH 7.0) 및 필터(컷오프: 0.2μm)에 말레이미드 반응성 그룹과 함께 용해시킵니다.
- 시스테인 말단 DNA-펩타이드 접합체(2 eq., 재료 표 참조)를 PEG에 첨가하고 실온에서 >4시간 동안 반응시킵니다. 하룻밤 동안 방치할 경우 4 °C에서 배양합니다.
- 고속 단백질 액체 크로마토그래피(FPLC)에서 시판되는 덱스트란-아가로스 복합 매트릭스 컬럼과 함께 크기 배제 크로마토그래피를 사용하여 비접합 물질을 제거합니다( 재료 표 참조). PBS에서 시료를 실행하고 DNA의 경우 260nm, 펩타이드의 경우 280nm에서 흡광도를 모니터링합니다.
- 합성된 나노센서를 원심 필터 튜브(MWCO = 10kDa)로 제조업체의 권장 속도에 따라 농축합니다( 재료 표 참조).
- λex: 485 nm 및 λem: 535 nm에서 ssDNA 분석 키트(재료 표 참조)와 플레이트 리더를 사용하여 DNA 농도를 정량화합니다. 나노센서를 4°C에서 보관합니다.
- DNA로 인코딩된 활성 기반 나노센서의 특성을 분석합니다.
- 동적 광산란(DLS)으로 DNA로 인코딩된 나노센서의 유체역학적 입자 크기를 측정합니다.
알림: 나노 센서의 예상 크기 범위는 15-50nm이며 평균 크기는 20-30nm입니다. 제한된 크기 범위가 필요한 경우 FPLC(2.3단계)를 사용하여 분자량이 다른 더 좁은 분획을 분리할 수 있습니다. - 원심 필터 튜브(MWCO = 10kDa)를 사용하여 나노센서를 0.5mg/mL(DNA 농도 기준)로 농축하고 극저온 홀더에 장착된 탄소 필름으로 코팅된 구리 그리드에 샘플을 로드합니다. 극저온 투과 전자 현미경(200kV, 배율 10,000-60,000)을 사용하여 형태를 관찰합니다.14.
- 동적 광산란(DLS)으로 DNA로 인코딩된 나노센서의 유체역학적 입자 크기를 측정합니다.
3. 센서 주입 및 소변 채취
- 기준선 측정을 위해 소변을 수집합니다.
- 마우스를 베이스로 96웰 플레이트가 있는 맞춤형 하우징 챔버( 보충 그림 1 참조)에 놓습니다.
- 마우스를 제지하고 방광에 부드러운 압력을 가하여 접시에 남아 있는 소변을 제거합니다.
- 마우스를 일반 하우징으로 교체한 후 96웰 플레이트에서 수집된 소변(~100-200μL)을 1.5mL 튜브에 피펫팅합니다.
- 전임상 쥐 종양 모델을 확립합니다.
- 6-8주 된 BALB/c 암컷 마우스에 루시페라아제 발현 MC26-Fluc 세포주(100k 세포/마우스)를 정맥 주사하여 접종합니다( 자료표 참조). in vivo 형광 이미징 시스템을 사용하여 매주 종양 진행을 모니터링합니다.
참고: 발광 신호로 표시되는 가시적 종양 부담은 이 특정 세포주를 주입한 후 대략 2주차에 발생합니다. 종양이 진행되는 동안 종양이 있는 동물을 정기적으로 주의 깊게 확인하십시오.
- 6-8주 된 BALB/c 암컷 마우스에 루시페라아제 발현 MC26-Fluc 세포주(100k 세포/마우스)를 정맥 주사하여 접종합니다( 자료표 참조). in vivo 형광 이미징 시스템을 사용하여 매주 종양 진행을 모니터링합니다.
- 종양 이식 후 다른 시점에 나노 센서를 주입합니다.
- 멸균 PBS에서 DNA 바코드로 1nmol 농도의 나노 센서를 포함하는 주입 용액(최대 부피 200μL)을 준비합니다.
- PBS의 200μL 센서 용액을 각 실험용 마우스에 정맥 주사합니다.
- 1.1-1.3단계에 설명된 대로 센서 주입 후 1시간에 건강한 대조군 및 종양이 있는 마우스에서 소변 샘플을 수집합니다.
참고: 신선한 소변 샘플은 DNA 바코드 분석으로 직접 처리하거나 얼음 위에서 즉시 냉동할 수 있습니다.
4. DNA 바코드의 CRISPR 검출: 형광 기반
- 신선한 소변 샘플을 사용하거나 냉동 샘플을 얼음 위에서 해동하십시오. 소변 샘플을 실온에서 800 x g 에서 5분 동안 원심분리합니다.
- 보충 표 2의 시약을 결합하고 Cas12a 효소(재료 표 참조)를 마지막으로 첨가하고 피펫팅하여 반응을 위아래로 부드럽게 혼합합니다. 37°C에서 30분 동안 반응을 배양합니다.
- 보충 표 3에 나타낸 바와 같이, 2단계의 곱을 이용하여 3회에 걸쳐 리포터 반응을 실행한다. 마지막으로 2단계의 반응을 추가하고 플레이트 리더로 빠르게 가져옵니다.
- 3시간 동안 2분마다 37°C에서 플레이트 리더로 형광을 측정하여 LbaCas12a 활성화를 검출합니다(λex: 485nm 및 λem: 535nm).
- 형광 측정 데이터를 분석하려면 https://github.com/nharzallah/NNanotech-Kinetic 에서 제공되는 효소 역학 분석을 위한 Python 패키지를 활용하십시오. 이 스크립트는 처음 8-10개의 초기 시간 지점의 선형 피팅 기울기를 사용하여 초기 반응 속도(V0)를 계산합니다.
5. DNA 바코드의 CRISPR 검출: 종이 기반
- 소변 샘플을 실온에서 800 x g 에서 5분 동안 원심분리합니다.
참고: 형광 기반 및 종이 기반 CRISPR 검출을 위해 소변 샘플을 병렬로 실행합니다. - 보충 표 2의 시약을 결합합니다. 37°C에서 30분 동안 배양합니다.
참고: 이 배양 단계는 형광 기반 CRISPR 검출의 배양 단계와 동일합니다. - 종이 스트립에서 측면 유동 분석을 위해 FAM-비오틴 표지된 DNA 리포터를 사용하여 리포터 반응을 실행합니다( 재료 표 참조). 보충 표 4 의 시약을 단계 2의 생성물을 사용하여 96웰 플레이트에 결합합니다. 알루미늄 호일로 덮고 37°C에서 1시간 동안 배양합니다.
NOTE: 위에서 설명한 형광 기반 CRISPR 검출 분석에서 실시간 kinetics 모니터링에 따라 최적의 배양 시간을 선택합니다. - 96웰 플레이트의 새 웰에 80μL의 PBS를 추가합니다. 3단계에서 채취한 샘플 20μL를 이 웰에 추가합니다.
- 각 웰에 하나의 측면 흐름 종이 스트립을 놓고 액체가 스트립 상단에 도달할 때까지 기다립니다(<5분). 대조군 및/또는 s의 모양을 찾으십시오.amp종이 스트립의 밴드.
- 측면 유동 스트립의 사진을 찍고 ImageJ를 사용하여 밴드 강도를 정량화합니다.
결과
프로테아제 활성화 펩타이드 기질 지명
조직의 단백질 분해 활성의 변화를 반영하는 센서를 설계하기 위해, 조직 내의 프로테아제 활성은 먼저 펩타이드 프로브라이브러리(13 )를 사용하여 특성화됩니다(그림 1). 신선 및 냉동 조직 샘플은 조직 샘플과 기질 절단을 감지하도록 설계된 FRET 프로브를 결합하여 종양 미세환경의 단백질 분해 활성에 대한 상당한 정보를 제공할 수 있습니다. FAM 형광단 및 CPQ-2 소광체가 있는 FRET 프로브 라이브러리는 조직 샘플과 함께 배양됩니다. 형광 분광광도법으로 측정한 가짜 조직과 종양 조직 사이의 절단 속도 차이가 가장 큰 프로브는 생체 내 나노 센서에 사용하기 위한 펩타이드 링커로 선택됩니다(그림 1A). 종양 환경의 생리학을 더 잘 이해하고 프로테아제 발현 프로파일을 활성 프로파일과 효과적으로 비교하기 위해, 그림 1B의 두 가지 예제 프로브에서 시연된 바와 같이 FRET 프로브를 재조합 프로테아제와 함께 배양하여 기질 절단을 특정 프로테아제 활성과 연관시킬 수 있습니다.
센서 공식화 및 특성화
나노센서는 그림 2A와 같이 고분자 코어, 펩타이드 및 단일 가닥 DNA 바코드로 구성됩니다. 고분자 코어는 최대 8개의 펩타이드-DNA 접합체의 운반체 역할을 하는 40kDa, PEG 덴드리머입니다(그림 2B). ~1.4kDa의 펩타이드는 단백질 분해 활성을 통해 절단되도록 설계된 아미노산 서열로 코어와 DNA를 연결합니다. 단일 가닥 DNA 바코드는 길이가 20 염기쌍, ~6.8kDa이며 생체 내 안정성 향상을 위해 화학적으로 변형되었습니다. 접합 후 펩타이드-DNA 구조체는 HPLC 를 통해 정제되어 접합 성분과 유리 성분을 분리할 수 있습니다(그림 2C). 질량 분석 결과 접합체의 분자량은 8.283kDa이며, 이는 펩타이드 및 DNA 바코드의 구성 분자량이 각각 1.4kDa 및 6.8kDa임을 감안할 때 예상됩니다. 펩타이드-DNA 접합체는 PEG 덴드리머에 추가로 접합됩니다. 결과 센서는 FPLC를 사용하여 정제되어 PEGylated 센서에 비해 머무름 시간이 연장되는 유리 펩타이드-DNA를 제거합니다(그림 2D). 센서의 크기는 동적 광산란 및 극저온 투과 전자 현미경을 통해 특성화할 수 있으며, 이는 코어에 펩타이드-DNA를 ~8nm에서 ~20nm로 첨가한 후 직경이 증가했음을 나타냅니다(그림 2B). 입자 크기의 차이는 구성 사슬의 유연성과 각 PEG 덴드리머에 접합된 다양한 수의 펩타이드-DNA 팔에 기인할 수 있습니다.
전임상 쥐 질병 모델
센서를 테스트하기 위한 생체 내 작업에는 BALB/c 마우스의 폐에서 3주 동안 종양을 확립하고, 나노 센서를 주입하고, 센서 주입 후 1시간 후에 소변을 채취하는 작업이 포함됩니다(그림 3A). 질병 유도 후 샘플과 비교하기 위해 종양 접종 전에 기준선 소변 샘플도 채취합니다. 악성 종양 검출에 대한 센서의 효능을 평가하기 위해 루시페라아제 발현 대장암 세포주 MC26(MC26-Fluc)을 정맥 주사하여 생체 내 발광 영상에서 폐종양 결절을 볼 수 있습니다. 헤마톡실린 및 에오신 염색13은 그림 3B에서 검은색 화살표로 표시된 바와 같이 종양 보유 마우스와 가짜 대조군 마우스에서 각각 폐 조직의 조직 병리학을 나타내고, 주사 후 11일 및 21일 시점에 종양 형성의 증거를 나타낸다.
화학적으로 안정화된 DNA에 의한 CRISPR 활성화
ssDNA 바코드 및 상보적인 crRNA 쌍을 통해 Cas12a 활성화를 최적화하기 위해 다양한 올리고뉴클레오티드 서열과 길이를 테스트했습니다. Cas12a의 활성화는 FRET 쌍을 가진 방관자 DNA 리포터의 Cas12a 절단으로 인한 시간 경과에 따른 형광 증가를 측정하여 평가됩니다. 절단 속도의 증가는 대표적인 crRNA/바코드 쌍에서 볼 수 있듯이 화학적으로 변형된 ssDNA 바코드의 농도가 더 높은 것과 관련이 있습니다(그림 4B). 중요한 것은 그림 4B에 표시된 바와 같이 농도와 활성화 사이의 선형 관계를 통해 판독값이 소변 내 DNA 바코드 존재를 반영하고 생체 내 단백질 분해 활성을 간접적으로 반영할 수 있다는 것입니다. 또한, 보충 표 1에 자세히 설명된 바와 같이 여러 개의 서로 다른 crRNA 염기서열을 Cas12a 활성화에 사용할 수 있으며, 이는 멀티플렉싱을 가능하게 하는 데 중요합니다. DNA 활성제는 분석 성능의 유사성을 기반으로 생체 내 센서의 구성을 위해 선택되었습니다. 합성 바이오마커의 생체 내 안정성에 중요한 화학적으로 변형된 ssDNA는 변형되지 않은 dsDNA 및 ssDNA와 비교하여 Cas12a 활성화를 입증했습니다(그림 4C).
화학적으로 안정화된 DNA 바코드의 다중 소변 검출
여러 crRNA 변형 단일 가닥 DNA(ssDNA) 활성제 쌍은 서로 다른 염기서열 간의 직교성을 검증했습니다. 이를 통해 그림 5A에 표시된 것처럼 여러 well assay에서 동시에 판독할 수 있습니다. 또한 처리되지 않은 소변의 변형된 DNA 분자는 그림 5B와 같이 측면 흐름 종이 스트립의 비색 판독을 사용하여 검출할 수 있습니다. 선행 '샘플 밴드'의 존재는 Cas12a가 요로 DNA에 의해 촉발된 후 리포터 절단을 통해 검출 가능한 FAM이 방출됨을 나타냅니다. Cas12a가 쥐 소변의 DNA 활성제에 의해 활성화되면 플루오레세인(FAM)-비오틴 쌍을 이루는 올리고뉴클레오티드 리포터를 절단하여 FAM 분자를 방출한 다음 '샘플 밴드'에서 검출할 수 있습니다. 비오틴과 스트렙타비딘의 결합으로 인해 '대조군'에 갇힌 기자가 포획됩니다. 나노센서는 in vivo 실험을 위해 선택되며 프로테아제 활성화 가능한 펩타이드와 고유한 DNA 바코드를 사용하여 구성됩니다. 펩타이드는 체외 조직 프로파일링(그림 1A)을 통해 지명되고 DNA 바코드는 유사한 Cas12a 활성화를 기반으로 선택됩니다(그림 4B).

그림 1: 센서 구성을 위해 대장암에서 조절 장애 프로테아제에 의해 활성화된 펩타이드 기질 식별. (A) FAM 형광단 및 CPQ-2 소광제가 측면에 있는 펩타이드 서열로 각각 구성된 FRET 쌍 펩타이드 기질은 재조합 단백질 분해 효소 또는 조직 균질액에 대해 스크리닝됩니다. (B) FRET 쌍을 이루는 펩타이드 기질의 대표적인 프로테아제 절단 역학(프로브 1 & 2). 이 그림은 Hao et al.13에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 고분자 PEG 코어를 사용한 DNA 바코드 활성 기반 나노센서의 특성 분석. (A) DNA 바코드 나노센서는 올리고뉴클레오티드로 바코드화된 프로테아제 활성화 펩타이드로 기능화된 고분자 나노캐리어(8-arm PEG)로 구성됩니다. (B) 동적 광산란 분석은 8.3nm(PEG 코어만 해당) 및 13nm(기능성 센서)에서 입자 크기가 증가했음을 보여줍니다. (C) 펩타이드-DNA 접합체의 HPLC 정제. 접합체는 질량 분석법에서 분석되며 예상 분자량을 보여줍니다. (D) 센서의 FPLC 정제는 기능화된 센서와 결합되지 않은 펩타이드-DNA 접합체의 분리를 보여줍니다. 이 그림은 Hao et al.13에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
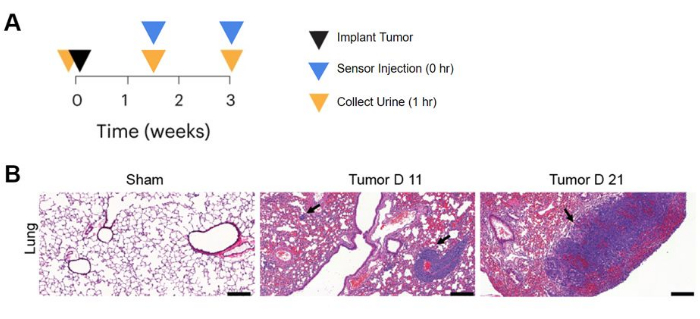
그림 3: 생체 내 질병 유도 및 센서 활용. (A) 종양 발달에 대한 다양한 시점에서 나노센서를 사용한 종단 종양 모니터링 타임라인. (B) 종양 접종 후 11일 및 21일에 CRC 폐 종양이 있는 BALB/c 마우스와 식염수 주입 Sham 대조군 마우스의 조직학적 폐 염색. 스케일 바 = 200μm. 장기를 고정하고, 파라핀에 묻고, 헤마톡실린과 에오신으로 염색했습니다. 이 연구는 시점당 n=3마리의 마우스로 수행되었으며 대표 동물의 이미지가 표시됩니다. 화살표는 폐의 종양 결절을 나타냅니다. 이 그림은 Hao et al.13에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
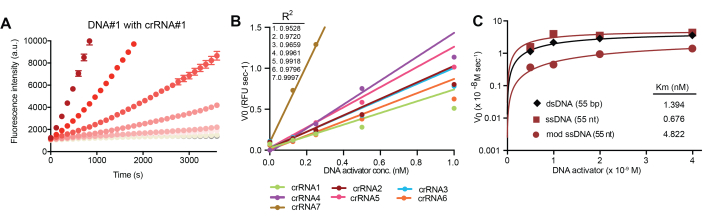
그림 4: 화학적으로 안정화된 DNA 활성제에 의한 Cas12a 활성화. (A) 상보적인 crRNA와의 결합을 통한 대표적인 ssDNA 바코드에 의한 Cas12a의 활성화는 분광 광도계를 통해 형광 강도로 측정된 바와 같이 용량 의존적 방식으로 방관자 DNA의 trans-cleavage를 초래합니다. (B) 초기 반응 속도(V0)는 (A)의 반응 시작 시 곡선의 기울기로부터 결정되고 분석 성능의 선형 범위를 결정하기 위해 플롯됩니다. (C) 이중 가닥, 단일 가닥 및 화학적으로 변형된 DNA 활성제에 의한 Cas12a 활성화. 이 그림은 Hao et al.13에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 두 가지 검출 옵션을 사용한 다중 CRISPR-Cas12 매개 DNA 바코드 판독. (A) Cas12a 형광 절단 분석에서 서로 다른 변형된 ssDNA 활성제-crRNA 쌍의 활성화 시 Cas12a의 Trans-cleavage rate를 측정합니다. 분석은 i.v. 투여 1시간 후 1nmol의 변형된 ssDNA 활성제를 주입한 마우스에서 채취한 소변 샘플로 수행됩니다. 이 그림은 Hao et al.13에서 발췌한 것입니다. (B) 소변 샘플 활성화 Cas12a의 종이 판독 값이 종이 스트립의 다른 위치에 나타납니다. 위쪽 밴드는 절단된 FAM DNA 리포터의 것이고 아래쪽 밴드는 절단된 FAM-비오틴 리포터의 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 96웰 플레이트 위에 놓을 소변 수집 챔버. 마우스는 96웰 플레이트에 소변을 보기 위해 실린더 내부에 임시로 배치됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: 센서 제형 및 CRISPR 분석을 위한 올리고 및 펩타이드 서열. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 2: 형광 기반 및 종이 기반 Cas12a 및 소변 샘플 반응용 시약. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 3: 형광 기반 CRISPR 검출을 위한 리포터 반응 시약. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 4: 종이 기반 CRISPR 검출을 위한 리포터 반응 시약. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에 제시된 것은 최소 침습 주입 센서를 사용하여 질병 관련 단백질 분해 활성을 평가하는 휴대용 소변 검사를 통한 다중 암 검출을 위한 고도로 맞춤화된 플랫폼입니다. 종양 프로테아제에 의해 활성화되면 펩타이드 기질 절단은 DNA 바코드 방출 을 통해 소변으로 증폭됩니다. 소변 샘플의 합성 DNA 리포터는 형광 검출 또는 간단한 종이 기반 테스트를 사용하여 2차 CRISPR-Cas 매개 효소 증폭으로 판독할 수 있습니다. DNA 바코딩은 합성 바이오마커를 라벨링하여 다중성을 제공하는 매력적인 방법입니다. 화학적 변형을 통해 DNA 바코드의 안정성을 개선하는 것은 생체 내 나노센서 안정성을 유지하는 데 필수적입니다. 특히, CRISPR-Cas12a를 통한 DNA 바코드 검출은 백본이 안정화된 완전히 포스포로티오에이트 변형 DNA 바코드를 사용하여 활성화할 수 있습니다. 그러나 화학적 변형은 안정성이 증가하기 때문에 CRISPR-Cas12a의 활성화 속도를 원래의 DNA에 비해 감소시킵니다. 또한, crRNA에 말단 변형을 삽입하거나 DNA 바코드 내의 상이한 변형된 올리고뉴클레오티드를 검사하는 것은 CRISPR-매개 DNA 바코드 검출(15)의 감도를 더욱 증가시킬 수 있으며, 이에 따라 암 진단의 검출 한계(LOD)를 개선할 수 있다.
분자 증폭 외에도 조기 암 발견에 필요한 LOD를 얻기 위한 또 다른 핵심 전략은 신장에 의한 크기 여과를 활용하여 합성 DNA 리포터를 소변에 농축하는 것입니다. 이를 위해서는 DNA 바코드의 크기를 최적화하는 것이 중요합니다. 20-mer crRNA-complementary DNA는 소변 샘플에서 최적의 CRISPR-Cas12a 매개 DNA 바코드 판독을 나타냈습니다. 이 최적의 길이는 다른 CRISPR 뉴클레아제 또는 전임상 동물 모델에 적용할 때 다를 수 있습니다.
이 검출 시스템의 재현성을 유지하려면 주입 가능한 나노 센서의 철저한 특성 분석을 수행하여 배치 간 변동을 최소화하는 것이 중요합니다. 코어당 펩타이드-DNA 접합체 수의 변화는 소변으로 방출되는 DNA 바코드의 양을 변경하므로 최종 판독에 영향을 미칩니다. 마찬가지로, 센서를 정맥 주사로 조심스럽게 주입하면 센서 투여의 일관성을 유지하는 데 도움이 됩니다. 주어진 시점에 각 동물로부터 최소 50μL의 소변량을 적절하게 수집하려면 종양이 있는 동물의 수분을 유지하는 것이 중요합니다. 이는 마우스를 젖지 않는 물 젤에 보관하거나 소변 채취 1시간 전에 PBS를 피하 주사함으로써 뒷받침될 수 있다16.
소변 수집 시기와 CRISPR-Cas 매개 DNA 바코드 판독 기간은 분석 일관성에 중요한 요소입니다. 순환 중인 바코드는 정맥 주사 및 혈액으로부터의 크기 의존적 신장 여과 후 특징적인 단일 지수 농도 감소를 겪으며, 마우스 모델13에서 투여 후 1시간 후에 최고조에 달한다. 이 시점은 동물 모델에 따라 다를 수 있습니다. CRISPR-Cas 활성화 분석의 두 가지 판독 형식(형광 vs. 종이 기반 측면 유동 분석)의 경우, 측면 유동 전에 형광 기반 역학을 추적하여 CRISPR-Cas 절단 산물을 판독하기 위한 최적의 종말점을 확보하는 것이 중요합니다.
이 접근법은 단백질 분해 및 CRISPR-Cas 매개 효소 활성화의 이중 신호 증폭 단계와 질병의 복잡성을 포착하는 멀티플렉싱 기능을 통합하기 때문에 유리합니다. 센서의 다중성을 확장하려면 신중한 재료 주입이 필요하며 휴대성과 사용 편의성을 유지하기 위해 판독 처리량을 확장해야 합니다. 이 전략은 여러 모델에서 단백질 분해 효소 활성의 철저한 특성화와 특정 질병 또는 질병 단계에 대한 단백질 분해 프로파일의 특이성을 필요로 합니다. 또한 센서 주입은 생검과 같은 많은 진단 대안보다 덜 침습적이지만 정맥 주사는 센서 투여를 위해 훈련된 정맥 전문의에게 의존할 수 있으므로 임상 환경에서 초기 검출이 아닌 질병 모니터링으로 사용 사례가 제한될 수 있습니다. 전신 주입 외에도 DNA 바코드 나노센서는 비침습적 경구, 흡입 및 국소 전달을 통해 적용할 수 있는 제형으로 추가로 설계할 수 있어 휴대용 질병 감지 및 질병 진행 및 치료 평가의 손쉬운 자가 모니터링이 가능합니다.
공개
S.N.B., L.H. 및 R.T.Z.는 본 저작물의 내용과 관련된 특허 출원에 발명자로 기재되어 있습니다. S.N.B.는 Glympse Bio, Satellite Bio, Lisata Therapeutics, Port Therapeutics, Intergalactic Therapeutics, Matrisome Bio의 지분을 보유하고 있으며 Vertex의 이사입니다. Moderna에 대한 컨설팅을 제공하고 Johnson & Johnson, Revitope 및 Owlstone으로부터 후원 연구 자금을 받습니다.
감사의 말
이 연구는 국립 암 연구소 (Swanson 생명 공학 센터)의 Koch Institute 지원 보조금 번호 P30-CA14051, 국립 환경 보건 과학 연구소의 핵심 센터 보조금 P30-ES002109, Koch Institute의 Marble Center for Cancer Nanomedicine, Kathy and Curt Marble Cancer Research Fund를 통한 Koch Institute Frontier Research Program의 지원을 받았습니다. Virginia and D. K. Ludwig Fund for Cancer Research(암 연구를 위한 버지니아 및 D. K. 루드비히 기금)를 설립했습니다. A.E.V.H.는 NIH가 지원하는 박사전 과정 교육 펠로우십(T32GM130546)의 지원을 받습니다. S.N.B.는 하워드 휴즈 의학 연구소 연구원입니다. L.H.는 미국 국립 암 연구소(National Cancer Institute)의 K99/R00 Pathway to Independence Award와 보스턴 대학교(Boston University)의 스타트업 펀딩을 지원받고 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| 10x NEB Buffer 2.1 | New England Biolabs | B6002SVIAL | |
| 20-mer phosphorothioated DNA reporters with 3’-DBCO group | IDT | Custom DNA | |
| Agilent 1100 High Performance Liquid Chromatography system with Vydac 214TP510 C4 column | Agilent | HPLC | |
| ÄKTA fast protein liquid chromatography (FPLC) | GE Healthcare | FPLC | |
| Amicon ultracentrifuge tubes (MWCO = 10 kDa) | EMD millipore | Various volumes available | |
| Azide-terminated PAPs with C-terminus cysteine | CPC Scientific | Custom peptide | |
| crRNAs | IDT | See Supplementary Table 1 | |
| Cryogenic transmission electron microscopy | JEM-2100F | JEOL | cyroTEM |
| Cysteine terminated DNA-peptide conjugates | CPC Scientific | Custom peptide | |
| Dynamic light scattering (DLS) | DLS | ||
| EnGen LbaCas12a (Cpf1), 100 µM | New England Biolabs | M0653T | |
| Experimental animals | Taconic Biosciences | BALB/cAnNTac | 6–8 weeks of age |
| gentleMACS C tubes | Miltenyi Biotec | 130-093-237 | tissue homogenization |
| HybriDetect Universal Lateral Flow Assay Kit | Miltenyi Biotec | MGHD 1 | |
| Matrix-assisted laser desorption/ionization–time of flight (MALDI–TOF) mass spectrometry | Bruker | Microflex MALDI–TOF | |
| MC26-Fluc cell line | Kenneth K. Tanabe Laboratory, Massachusetts General Hospital | ||
| multivalent PEG (40 kDA, 8-arm) with maleimide-reactive group | JenKem | A10020-1 / 8ARM(TP)-MAL-40K,1 g | |
| Python, Version 3.9 | https://www.python.org/ | ||
| Quant-iT OliGreen ssDNA Assay Kit and Quant-iT OliGreen ssDNA Reagent | Invitrogen | O11492 | ssDNA assay kit |
| ssDNA FAM-T10-Quencher and FAM-T10-Biotin reporter substrates | IDT | Custom DNA | |
| Superdex 200 Increase 10/300 GL column | GE Healthcare | GE28-9909-44 | For FPLC |
| Tecan Infinite Pro M200 plate reader | Tecan | ||
| ThermoFisher Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 |
참고문헌
- Soleimany, A. P., Bhatia, S. N. Activity-based diagnostics: an emerging paradigm for disease detection and monitoring. Trends Mol Med. 26 (5), 450-468 (2020).
- Muir, R. K., Guerra, M., Bogyo, M. M. Activity-based diagnostics: recent advances in the development of probes for use with diverse detection modalities. ACS Chem Biol. 17 (2), 281-291 (2022).
- Heitzer, E., Haque, I. S., Roberts, C. E. S., Speicher, M. R. Current and future perspectives of liquid biopsies in genomics-driven oncology. Nat Rev Genet. 20 (2), 71-88 (2019).
- Dudani, J. S., Warren, A. D., Bhatia, S. N. Harnessing protease activity to improve cancer care. Annu Rev Canc Biol. 2, 353-376 (2018).
- Hanahan, D. Hallmarks of cancer: new dimensions. Cancer Discov. 12 (1), 31-46 (2022).
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nat Med. 19 (11), 1423-1437 (2013).
- Kwong, G. A., et al. Synthetic biomarkers: a twenty-first century path to early cancer detection. Nat Rev Cancer. 21 (10), 655-668 (2021).
- Kirkpatrick, J. D., et al. Urinary detection of lung cancer in mice via noninvasive pulmonary protease profiling. Sci Transl Med. 12 (537), eaaw0262 (2020).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. J Am Chem Soc. 136 (39), 13709-13714 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nat Biotechnol. 31 (1), 63-70 (2013).
- Chen, J. S., et al. CRISPR-Cas12a target binding unleashes indiscriminate single-stranded DNase activity. Science. 360 (6387), 436-439 (2018).
- Choi, H. S., et al. Renal clearance of quantum dots. Nat Biotechnol. 25 (10), 1165-1170 (2007).
- Hao, L., et al. CRISPR-Cas-amplified urinary biomarkers for multiplexed and portable cancer diagnostics. Nat Nanotechnol. 18 (7), 798-807 (2023).
- Hao, L., et al. Microenvironment-triggered multimodal precision diagnostics. Nat Mater. 20 (10), 1440-1448 (2021).
- Ghanta, K. S., et al. 5'-Modifications improve potency and efficacy of DNA donors for precision genome editing. Elife. 10, e72216 (2021).
- Bekkevold, C. M., Robertson, K. L., Reinhard, M. K., Battles, A. H., Rowland, N. E. Dehydration parameters and standards for laboratory mice. J Am Assoc Lab Anim Sci. 52 (3), 233-239 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유