Method Article
בדיקת סמנים ביולוגיים סינתטיים בשתן סינתטי בתיווך CRISPR-Cas לאבחון נייד
In This Article
Summary
פרוטוקול זה מתאר בדיקת סמנים ביולוגיים סינתטיים בשתן סינתטי בתיווך CRISPR-Cas, המאפשרת אבחון סרטן נקודתי באמצעות ניתוח ex vivo של פעילויות פרוטאז הקשורות לגידול.
Abstract
יצירת סמנים ביולוגיים סינתטיים לפיתוח אבחון מדויק אפשרה זיהוי מחלות דרך מסלולים מעבר לאלה המשמשים למדידות ביו-נוזליות מסורתיות. סמנים ביולוגיים סינתטיים בדרך כלל עושים שימוש בכתבים המספקים אותות קריאים בנוזל הביולוגי כדי לשקף את השינויים הביוכימיים במיקרו-סביבה המקומית של המחלה במהלך היארעות המחלה והתקדמותה. הריכוז הפרמקוקינטי של המדווחים וההגברה הביוכימית של אות המחלה הם בעלי חשיבות עליונה להשגת רגישות גבוהה וספציפיות בבדיקת אבחון. כאן, פלטפורמה לאבחון סרטן בנויה באמצעות פורמט אחד של סמנים ביולוגיים סינתטיים: ננו-חיישנים מבוססי פעילות הנושאים כתבי DNA מיוצבים כימית שניתן לשחרר על ידי חתימות פרוטאוליטיות חריגות במיקרו-סביבה של הגידול. דנ"א סינתטי כמדווח מחלות מעניק יכולת ריבוב באמצעות השימוש בו כברקוד, המאפשר קריאה של חתימות פרוטאוליטיות מרובות בבת אחת. כתבי דנ"א המשוחררים לשתן מזוהים באמצעות נוקלאזות CRISPR באמצעות הכלאה עם RNA קריספר, אשר בתורו מייצרים אות פלואורסצנטי או קולורימטרי בעת הפעלת האנזים. בפרוטוקול זה נבנים ננו-חיישנים מבוססי פעילות המבוססים על ברקוד DNA ויישומם מודגם במודל עכברי פרה-קליני של סרטן מעי גס גרורתי. מערכת זו ניתנת לשינוי רב על פי הביולוגיה של המחלה ומייצרת אותות מחלה מרובים בו זמנית, מה שמאפשר הבנה מקיפה של מאפייני המחלה בתהליך זעיר פולשני הדורש מתן ננו-חיישנים בלבד, איסוף שתן ובדיקת נייר המאפשרת אבחון נקודתי.
Introduction
למרות המאמץ המשמעותי לזהות סמנים ביולוגיים של גידולים כגון חלבונים שנשפכו ודנ"א, תחום אבחון הסרטן היה מתוח על ידי השפע הנמוך שלהם או השפלה מהירה במחזור הדם1. כאסטרטגיה משלימה, סמנים ביולוגיים סינתטיים מהונדסים ביולוגית המגיבים באופן סלקטיבי לתכונות מחלה כדי ליצור אותות מוגברים מייצגים דרכים חדשות לקראת אבחון מדויק ונגיש 2,3. כדי לסייע בזיהוי, סמנים ביולוגיים סינתטיים אלה רותמים מנגנוני הפעלה תלויי גידול, כגון הגברה אנזימטית, כדי לייצר אנליטים עם יחס אות לרעש משופר4. כאן, קבוצה של אנזימים הקשורים לסרטן, פרוטאזות, ממונפים כדי להפעיל חיישנים ננומטריים הניתנים להזרקה כדי לשחרר מדווחי מחלות הניתנים לזיהוי מהנוזלים הביולוגיים כגון דם או שתן 5,6. לאור ההטרוגניות של הגידול, פיתוח פאנל של חיישנים המופעלים על ידי פרוטאז מאפשר בדיקות מולטיאנליטיות המשלבות אירועי מחשוף פרוטאז שונים לכדי "חתימת מחלה" כדי להעריך היארעות סרטן והתקדמות באופן ספציפי יותר, מרובה.
פותחו סמנים ביולוגיים סינתטיים המופעלים על ידי פרוטאז המהווים מצעי פפטיד מצומדים לפני השטח של נשא אינרטי7. כאשר הם מוזרקים in vivo, פפטידים אלה נישאים אל הגידול, שם מחשוף אנזימטי על ידי פרוטאזות הגידול משחרר את הכתבים לדם או לשתן לצורך זיהוי. זיהוי מרובב עם סמנים ביולוגיים סינתטיים המופעלים על ידי פרוטאז דורש שכל סמן ביולוגי סינתטי בתוך קוקטייל יסומן בברקוד מולקולרי ייחודי. לשם כך פותחו גישות שונות, כולל ברקודים המוניים וכתבים מקודדי ליגנד 8,9,10. בניגוד לשיטות אלה של ריבוב אשר עשויות להיות מוגבלות למספר אפשרויות אות שונות, ברקוד DNA מאפשר שילובים רבים יותר בהתאם למורכבות הגבוהה וההטרוגניות של מצבי מחלה אנושיים. כדי להרחיב את הריבוי של סמנים ביולוגיים סינתטיים, החיישנים מקודדים על ידי תיוג כל כתב עם רצף DNA ייחודי לזיהוי באמצעות נוקלאז CRISPR-Cas כדי להגביר את האות הביופלואיד ex vivo. ברקודים אלה של דנ"א חד-גדילי (ssDNA) מתוכננים להיקשר לרנ"א מנחה קריספר משלים (crRNAs), ולהפעיל את פעילות הנוקלאז הבטחוני המופעל על ידי המטרה של CRISPR-Cas12a11. ניתן להשתמש בפעילות נוקלאז זו כדי לבקע גדיל דנ"א של כתב שזוהה באמצעות קינטיקה פלואורסצנטית או באמצעות רצועות נייר.
בנוסף להגברה מולקולרית באמצעות פרוטאזות (in vivo) ו-CRISPR-Cas (ex vivo), מאפיין מרכזי נוסף של סמנים ביולוגיים סינתטיים המופעלים על ידי פרוטאז כרוך ברתימת פרמקוקינטיקה ננו-חומרית להגדלת ריכוז אות האבחון בנוזלים ביולוגיים10. גישה אחת היא שימוש בנשא ננו-חלקיקים כדי להגדיל את זמן הסירקולציה של מצעי פפטיד מצומדים על פני השטח. דנדרימר פוליאתילן גליקול (PEG) נבחר כננו-נשא בעל קוטר הידרודינמי קטן יחסית ורב-ערכיות כדי להגביר את המסירה לגידולים. בעוד שהוא קטן מספיק כדי לקדם את העברת הגידול, גודלו של נשא ה- PEG גדול יותר מהחתך בגודל ~ 5 ננומטר של מחסום הסינון הגלומרולרי של הכליה, כך שרק מצעי פפטיד שסועים יכולים להתנקות לתוך השתן, תוך ניצול סינון הגודל על ידי הכליות12. בפרוטוקול זה, תהליך העבודה הרב-שלבי מתואר לסינתזה וליישום של ננו-חיישנים מבוססי פעילות ברקוד-DNA במודל מורין פרה-קליני, תוך הדגשת ההתקנה של בדיקת סמנים ביולוגיים סינתטיים בשתן סינתטי בתיווך CRISPR-Cas, אשר שימשה קבוצה זו כדי לסווג את מצב המחלה במודלים מורינים של סוגי סרטן מרובים13. הודות לעקרון התכנון הרב-תכליתי, כל שלושת המרכיבים הפונקציונליים של הננו-חיישן - הננו-נשא (פולימר PEG), המודול המגיב לגירויים (מצע המופעל על ידי פרוטאז) והכתב הביופלואיד (ברקוד DNA) - ניתנים להחלפה מדויקת בהתאם לצרכים ספציפיים ליישום, מה שמאפשר מודולריות על ידי התאמת ספציפיות המטרה והשחרור.
Protocol
כל המחקרים בבעלי חיים מאושרים על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) במוסד המחברים. מתקנים סטנדרטיים לטיפול בבעלי חיים, כולל תאי דיור, ברדסים סטריליים, הרדמה והמתת חסד אתית נדרשים כדי לבצע ניסויים אלה כראוי. כל הניסויים נערכים בהתאם להנחיות מוסדיות וארציות ובפיקוח הצוות הווטרינרי במוסד. נקבות עכברי BALB/c, המשמשות לניסויים, מתקבלות ממקור מסחרי (ראו טבלת חומרים) וגילן נע בין 6 ל-8 שבועות בתחילת המחקר. רצפים עבור DNA מסונתז בהתאמה אישית, crRNA, בדיקות מצע פפטידי מבוסס FRET, ופפטידים חיישנים מסופקים בטבלה משלימה 1.
1. בחירת מצע פפטידי המופעל על ידי פרוטאז
- לאסוף ולהכין דגימות רקמה מרקמת ריאה או ריאה בריאה עם גושים סרטניים בעקבות דוחשפורסם בעבר 13.
- הומוגניזציה של רקמות במי מלח חוצצים פוספט מקורר מראש (PBS, pH 7.4) (200 מ"ג רקמה/מ"ל PBS) עם צינורות דיסוציאציה של רקמות לדיסוציאציה אוטומטית של רקמות לתרחיפים חד-תאיים.
- רקמת הצנטריפוגה הומוגנטית ב 6,000 x גרם במשך 5 דקות ב 4 ° C. שמור את supernatant בצינור חדש.
- צנטריפוגה את supernatant ב 14,000 x גרם במשך 25 דקות ב 4 ° C.
- מדוד את ריכוז החלבון באמצעות ערכת בדיקת חלבון של חומצה ביכומונית (BCA) (ראה טבלת חומרים).
- הוסף PBS למדגם כדי להכין תמיסת 0.33 מ"ג / מ"ל.
- הערך את הפעילות הפרוטאוליטית לפי השלבים הבאים.
- בצלחת של 384 בארות, הוסיפו 5 μL, 6 μM מצע פפטידי מבוסס FRET לכל באר. עבור כל בדיקה, לבצע את התגובה משולשת.
הערה: בדיקת מצע פפטיד מבוססת FRET מכילה רצף פפטידי קצר (6-8 חומצות אמינו, שנועד להיות ספציפי לפרוטאז מטרה או לקבוצת פרוטאזות) המסתיים בזוג פלואורופור ומרווה (quencher). שתי בדיקות FRET מתוארות בטבלה משלימה 1 כדוגמה. את הספרייה המלאה של הגשושיות ניתן למצוא ב- Hao et al.13. - צנטריפוגו את צלחת הבאר במשך 10 שניות בטמפרטורת החדר ב 180 x גרם כדי להבטיח את הגשושיות בתחתית הצלחת.
- הוסף 25 μL 0.33 מ"ג / מ"ל דגימת רקמה או 40 מיקרומטר פרוטאז רקומביננטי13 לכל באר.
הערה: ייתכן שיהיה צורך למטב את הריכוז הסופי של דגימת הרקמה או הפרוטאז הרקומביננטי בהתאם לפעילות הפרוטאוליטית הפנימית שלהם. לדוגמה, רקמות פרוטאוליטיות מאוד כגון מעיים עשויות לדרוש גורמי דילול גבוהים יותר כדי לאפשר ניטור של שסע אנזימטי ראשוני. - צנטריפוגה את צלחת הבאר לזמן קצר ב 180 x גרם (בטמפרטורת החדר) כדי לערבב את הגשושיות ואת lysates רקמות.
- התחל מיד לזהות מחשוף בדיקה על ידי מדידת פלואורסצנטיות עם קורא הלוחות ב 37 ° C כל 2 דקות במשך 1 שעה (λex: 485 ננומטר; λem: 535 ננומטר) כדי לפקח על המחשוף.
הערה: השתמש באורכי גל העירור והפליטה המתאימים לזוגות פלואורופורים ומרווה ספציפיים. במקרה של מחקר זה, פרמטרים (λex: 485 nm ו- λem: 535 nm) נקבעים עבור פלואורופור FAM. - כדי לנתח את נתוני המדידה הפלואורסצנטיים, השתמש בחבילת Python (ראה טבלת חומרים) לניתוח קינטיקה של אנזימים הזמין ב- https://github.com/nharzallah/NNanotech-Kinetic. סקריפט זה מחשב את מהירות התגובה הראשונית (V0) באמצעות שיפוע ההתאמה הליניארית של 8-10 נקודות הזמן ההתחלתיות הראשונות.
- בצלחת של 384 בארות, הוסיפו 5 μL, 6 μM מצע פפטידי מבוסס FRET לכל באר. עבור כל בדיקה, לבצע את התגובה משולשת.
2. ניסוח ואפיון חיישנים
- לסנתז את הצמידות של DNA ופפטיד המופעל על ידי פרוטאז (PAP).
- לדגור על כתבי DNA פוספורותיו של 20 מר עם קבוצת 3'-DBCO (1.1 eq., ראה טבלת חומרים) עם PAPs עם סיום אזיד עם C-terminus ציסטאין מסתיים במאגר פוספט של 100 mM (pH 7.0) בטמפרטורת החדר למשך >4 שעות. אם עוזבים לילה, לדגור ב 4 °C (75 °F).
- לטהר את המוצר על מערכת כרומטוגרפיה נוזלית (HPLC) בעלת ביצועים גבוהים המצוידת בטור אידיאלי לביומומולקולות (ראה טבלת חומרים). הגדר את שיפוע HPLC להתחיל ממאגר 5% A (0.05% TFA ב- H2O), לשמור איזוקרטי למשך 20 דקות ולהגיע למאגר 80% B (0.05% TFA, 99.95% אצטוניטריל) ב- 65 דקות עם קצב זרימה של 0.3 מ"ל min-1, ואסוף את המוצר המצומד עם זמן שמירה ב~ 31 דקות.
- אמת את המצומדים המטוהרים על ידי ספקטרומטריית מסות ספיחה בלייזר/זמן יינון טיסה (MALDI-TOF) בעזרת מטריצה באמצעות חומצה α-ציאנו-4-הידרוקסיצינאמית כמטריצה14 (ראה טבלת חומרים).
- סנתז ננו-חיישנים מבוססי פעילות המקודדים בדנ"א.
- יש להמיס 2 מ"ג של PEG רב-ערכי (40 kDa, 8-arm, ראו טבלת חומרים) עם קבוצה תגובתית maleimide ב-1 מ"ל של 100 mM חיץ פוספט (pH 7.0) ומסנן (cutoff: 0.2 μm).
- הוסף את הצמידות של DNA-פפטיד ציסטאין (2 eq., ראה טבלת חומרים) ל- PEG ולהגיב בטמפרטורת החדר במשך >4 שעות. אם עוזבים לילה, לדגור ב 4 °C (75 °F).
- הסר את החומרים הלא מצומדים באמצעות כרומטוגרפיה של אי הכללת גודל עם עמודת מטריצה מרוכבת דקסטרן-אגרוז הזמינה מסחרית על כרומטוגרפיה נוזלית של חלבון מהיר (FPLC) (ראה טבלת חומרים). הפעל דגימות ב- PBS ונטר ספיגה ב- 260 ננומטר עבור DNA ו- 280 ננומטר עבור פפטידים.
- רכז את הננו-חיישנים המסונתזים עם צינורות מסנן צנטריפוגליים (MWCO = 10 kDa) בהתאם למהירות המומלצת של היצרן (ראה טבלת חומרים).
- כמת את ריכוז הדנ"א באמצעות ערכת בדיקת ssDNA (ראה טבלת חומרים) וקורא לוחות ב- λex: 485 nm ו- λem: 535 nm. אחסן את הננו-חיישנים בטמפרטורה של 4°C.
- לאפיין ננו-חיישנים מבוססי פעילות מקודדי DNA.
- מדוד את גודל החלקיקים ההידרודינמיים של ננו-חיישנים המקודדים בדנ"א באמצעות פיזור אור דינמי (DLS).
הערה: טווח הגדלים הצפוי של ננו-חיישנים הוא 15-50 ננומטר, עם גודל ממוצע של 20-30 ננומטר. אם רוצים טווח גדלים מוגבל, ניתן להשתמש ב- FPLC (בשלב 2.3) כדי לבודד שברים צרים יותר עם משקלים מולקולריים שונים. - רכז את הננו-חיישנים ל -0.5 מ"ג / מ"ל (לפי ריכוז DNA) עם צינורות מסנן צנטריפוגליים (MWCO = 10 kDa) וטען את הדגימות על רשת נחושת מצופה סרט פחמן המורכבת על מחזיק קריו. התבונן במורפולוגיה באמצעות מיקרוסקופ אלקטרונים קריוגני (200 kV, הגדלה של 10,000-60,000)14.
- מדוד את גודל החלקיקים ההידרודינמיים של ננו-חיישנים המקודדים בדנ"א באמצעות פיזור אור דינמי (DLS).
3. הזרקת חיישנים ואיסוף שתן
- יש לאסוף שתן למדידה בסיסית.
- הכניסו את העכבר לתא דיור מותאם אישית (ראו איור משלים 1) עם צלחת בת 96 בארות כבסיס.
- רסן את העכבר והפעל לחץ עדין על שלפוחית השתן כדי לרוקן את שאריות השתן על הצלחת.
- פיפטה את השתן שנאסף (~ 100-200 μL) מן צלחת 96 באר לתוך צינור 1.5 מ"ל לאחר החלפת העכבר לבית רגיל.
- הקמת מודל גידול מורין פרה-קליני.
- חסן עכברות BALB/c בנות 6 עד 8 שבועות על ידי הזרקה תוך ורידית עם קו תאי MC26-Fluc המבטא לוציפראז (100k תאים / עכבר) (ראה טבלת חומרים). מעקב אחר התקדמות הגידול מדי שבוע באמצעות מערכת הדמיה פלואורסצנטית in vivo .
הערה: עומס הגידול הנראה לעין המצוין על ידי אות זוהר מתרחש בערך בשבוע השני של הזרקת קו תאים מסוים זה. בדוק היטב בעלי חיים נושאי גידול במהלך התקדמות הגידול על בסיס קבוע.
- חסן עכברות BALB/c בנות 6 עד 8 שבועות על ידי הזרקה תוך ורידית עם קו תאי MC26-Fluc המבטא לוציפראז (100k תאים / עכבר) (ראה טבלת חומרים). מעקב אחר התקדמות הגידול מדי שבוע באמצעות מערכת הדמיה פלואורסצנטית in vivo .
- הזרקת ננו-חיישנים בנקודות זמן שונות לאחר השתלת הגידול.
- הכינו תמיסת הזרקה (נפח מרבי של 200 μL) המכילה ננו-חיישנים בריכוז של 1 nmol על ידי ברקוד DNA ב-PBS סטרילי.
- הזריקו תמיסת חיישן 200 μL ב-PBS לכל עכבר ניסיוני תוך ורידי.
- יש לאסוף דגימות שתן מעכברי בקרה בריאה ועכברים נושאי גידול בשעה אחת לאחר הזרקת החיישן, כמתואר בשלבים 1.1-1.3.
הערה: ניתן לעבד דגימות שתן טריות לניתוח ברקוד DNA ישירות או להקפיא מיד על קרח.
4. זיהוי CRISPR של ברקודי DNA: מבוסס פלואורסצנטיות
- השתמשו בדגימות שתן טריות או הפשירו דגימות קפואות על קרח. דגימות שתן צנטריפוגות ב 800 x גרם במשך 5 דקות בטמפרטורת החדר.
- שלב את הריאגנטים בטבלה משלימה 2, הוסף את האנזים Cas12a (ראה טבלת חומרים) אחרון וערבב בעדינות את התגובה על ידי פיפטציה למעלה ולמטה. לדגור את התגובה ב 37 ° C במשך 30 דקות.
- הפעל את תגובת המדווח, כפי שמוצג בטבלה משלימה 3, במשולש באמצעות המכפלה של שלב 2. הוסף את התגובה משלב 2 האחרון והבא במהירות לקורא הלוחות.
- זהה הפעלת LbaCas12a על ידי מדידת פלואורסצנטיות עם קורא לוחות ב 37 ° C כל 2 דקות במשך 3 שעות (λex: 485 ננומטר ו λem: 535 ננומטר) כדי לפקח על קינטיקה מחשוף של כתב DNA.
- כדי לנתח את נתוני המדידה הפלואורסצנטיים, השתמש בחבילת Python לניתוח קינטיקה של אנזימים הזמין ב- https://github.com/nharzallah/NNanotech-Kinetic. סקריפט זה מחשב את מהירות התגובה הראשונית (V0) באמצעות שיפוע ההתאמה הליניארית של 8-10 נקודות הזמן ההתחלתיות הראשונות.
5. זיהוי CRISPR של ברקודי DNA: מבוסס נייר
- דגימות שתן צנטריפוגות ב 800 x גרם במשך 5 דקות בטמפרטורת החדר.
הערה: הפעל את דגימות השתן לזיהוי CRISPR מבוסס פלואורסצנטיות ומבוסס נייר במקביל. - שלב את הריאגנטים בטבלה משלימה 2. יש לדגור בטמפרטורה של 37°C למשך 30 דקות.
הערה: שלב דגירה זה זהה לזה של זיהוי CRISPR מבוסס פלואורסצנטיות. - הפעל את תגובת הכתב באמצעות כתב FAM-ביוטין המסומן ב- DNA לבדיקת זרימה צידית על רצועת נייר (ראה טבלת חומרים). שלב את הריאגנטים בטבלה משלימה 4 בצלחת של 96 בארות באמצעות המכפלה של שלב 2. מכסים ברדיד אלומיניום ודגרים ב-37°C למשך שעה.
הערה: בחר את זמן הדגירה האופטימלי בהתאם לניטור קינטיקה בזמן אמת בבדיקת זיהוי CRISPR מבוססת פלואורסצנטיות שתוארה לעיל. - לבאר טרייה של צלחת 96 בארות, להוסיף 80 μL של PBS. הוסף 20 μL של מדגם משלב 3 לבאר זו.
- מניחים פס נייר זרימה רוחבי אחד לכל באר וממתינים עד שהנוזל מגיע לחלק העליון של הרצועה (<5 דקות). חפש את המראה של רצועות הבקרה ו/או הדגימה ברצועת הנייר.
- צלם תמונה של רצועת הזרימה הצידית וכמת את עוצמת הרצועה באמצעות ImageJ.
תוצאות
מינוי מצעי פפטיד המופעלים על ידי פרוטאז
כדי לתכנן חיישנים שישקפו שינויים בפעילות הפרוטאוליטית של הרקמה, פעילות הפרוטאז ברקמה מאופיינת תחילה באמצעות ספרייה של גשושיות פפטידיות13 (איור 1). דגימות רקמה טריות וקפואות יכולות לספק מידע משמעותי על הפעילות הפרוטאוליטית של המיקרו-סביבה של הגידול על ידי שילוב דגימות רקמה עם בדיקות FRET שנועדו לזהות שסע המצע. ספרייה של בדיקות FRET עם פלואורופור FAM ומרווה CPQ-2 מודגרת עם דגימות רקמות. גשושיות עם ההבדל הגדול ביותר בקצב המחשוף בין רקמת דמה לרקמת גידול, כפי שנמדד על-ידי ספקטרופוטומטריה פלואורסצנטית, נבחרות כמקשרים פפטידים לשימוש בננו-חיישנים in vivo (איור 1A). כדי להבין טוב יותר את הפיזיולוגיה של סביבת הגידול ולהשוות ביעילות פרופילי ביטוי פרוטאז לפרופילי פעילות, ניתן לדגור את גשושיות FRET עם פרוטאזות רקומביננטיות כדי לקשר בין מחשוף המצע לפעילות פרוטאז ספציפית, כפי שמודגם בשתי בדיקות לדוגמה באיור 1B.
ניסוח ואפיון חיישנים
הננו-חיישנים מורכבים מליבה פולימרית, פפטידים וברקודים של דנ"א חד-גדילי, כפי שמתואר באיור 2A. הליבות הפולימריות הן 40 kDa, דנדרימרים PEG שפועלים כנשאים של עד 8 צימודים פפטידים-דנ"א (איור 2B). הפפטידים, ~1.4 kDa, מחברים את הליבה והדנ"א עם רצף חומצות אמינו שנועד להיבקע באמצעות פעילות פרוטאוליטית. ברקוד הדנ"א החד-גדילי הוא באורך 20 זוגות בסיסים, ~6.8 kDa, ועבר שינוי כימי לשיפור היציבות in vivo. לאחר הצמידה, מבנה הפפטידים-דנ"א מטוהר באמצעות HPLC, מה שמאפשר הפרדה בין המרכיבים המצומדים והחופשיים (איור 2C). ניתוח ספקטרומטריית מסות מצביע על כך שלמצומד יש משקל מולקולרי של 8.283 kDa, אשר צפוי בהתחשב במשקלים המולקולריים המרכיבים את הפפטיד והברקוד DNA של 1.4 kDa ו- 6.8 kDa, בהתאמה. הצמידות הפפטידית-דנ"א מצומדת עוד יותר לדנדרימר PEG. החיישן שנוצר מטוהר באמצעות FPLC כדי להסיר פפטידים-דנ"א חופשיים אשר מציגים זמן שמירה ממושך בהשוואה לאלה של PEGylated (איור 2D). ניתן לאפיין את גודל החיישן באמצעות פיזור אור דינמי ומיקרוסקופ אלקטרונים קריוגני, המצביעים על עלייה בקוטר בעקבות תוספת פפטיד דנ"א לליבה מ~8 ננומטר ל~20 ננומטר (איור 2B). השונות בגודל החלקיקים עשויה לנבוע מהגמישות של השרשראות המרכיבות ומספר משתנה של זרועות פפטידים-דנ"א המצומדות לכל דנדרימר PEG.
מודל פרה-קליני של מחלת מורין
עבודת In vivo לבדיקת החיישנים כוללת יצירת גידולים במשך 3 שבועות בריאות של עכברי BALB/c, הזרקת ננו-חיישנים ואיסוף שתן שעה לאחר הזרקת החיישן (איור 3A). דגימת שתן בסיסית נלקחת גם לפני חיסון הגידול כדי להשוות עם דגימות לאחר השראת המחלה. על מנת להעריך את יעילות החיישן בזיהוי ממאירות, קו תאי סרטן המעי הגס MC26 (MC26-Fluc) הביטוי לוציפראז מוזרק לווריד, וכתוצאה מכך גושי גידול הריאה נראים בהדמיה in vivo luminescence. צביעת המטוקסילין ואוזין13 חושפת היסטופתולוגיה של רקמת הריאה מעכברים נושאי גידול ובקרת דמה, בהתאמה, ועדות להיווצרות הגידול לאחר 11 ו-21 יום לאחר ההזרקה, כפי שמצוין בחצים שחורים באיור 3B.
הפעלת CRISPR על ידי DNA מיוצב כימית
כדי למטב את הפעלת Cas12a באמצעות ברקודי ssDNA וזיווג crRNA משלים, נבדקו רצפים ואורכים שונים של אוליגונוקלאוטידים. ההפעלה של Cas12a מוערכת על ידי מדידת העלייה בפלואורסצנטיות לאורך זמן עקב מחשוף Cas12a של כתב DNA של צופה מהצד עם זיווג FET. עלייה בקצב המחשוף קשורה לריכוזים גבוהים יותר של ברקוד ssDNA שעבר שינוי כימי, כפי שמוצג עם זוג crRNA/ברקוד מייצג (איור 4B). חשוב לציין שקשר ליניארי בין ריכוז להפעלה, כפי שמוצג באיור 4B, מאפשר לקריאה להיות משקפת נוכחות ברקוד דנ"א בשתן ומשקפת בעקיפין פעילות פרוטאוליטית in vivo. יתר על כן, ניתן להשתמש במספר רצפי crRNA שונים, כמפורט בטבלה משלימה 1, להפעלת Cas12a, שהיא קריטית להפעלת ריבוב. מפעילי DNA נבחרו לבניית חיישני in vivo בהתבסס על הדמיון שלהם בביצועי המבחן. ה-ssDNA שעבר שינוי כימי, שהוא קריטי ליציבות in vivo של הסמן הביולוגי הסינתטי, הדגים הפעלת Cas12a, בהשוואה ל-dsDNA ו-ssDNA שלא עברו שינוי (איור 4C).
זיהוי שתן מרובב של ברקודי DNA מיוצבים כימית
זוגות מפעילי DNA חד-גדילי (ssDNA) מרובים שעברו שינוי crRNA אומתו עבור האורתוגונליות שלהם בין רצפים שונים. זה מאפשר קריאה סימולטנית במספר מבחני באר, כפי שמתואר באיור 5A. נוסף על כך, מולקולות דנ"א מהונדסות בשתן לא מעובד יכולות להיות מזוהות באמצעות קריאה קולורימטרית על רצועות נייר עם זרימה רוחבית, כפי שמוצג באיור 5B. נוכחותה של "רצועת הדגימות" המובילה מצביעה על שחרור FAM הניתן לזיהוי דרך מחשוף הכתב לאחר ש- Cas12a מופעל על ידי ה- DNA של השתן. כאשר Cas12a מופעל על ידי מפעיל הדנ"א בשתן של עכברים, הוא חותך את כתב האוליגונוקלאוטיד המזווג לפלואורסצאין (FAM)-ביוטין, ומשחרר את מולקולת ה-FAM, אשר לאחר מכן ניתנת לזיהוי ב"פס הדגימה". כתבים חסרי אונים נלכדים ב"פס הבקרה" בשל קשירת ביוטין לסטרפטווידין. ננו-חיישנים נבחרים לניסויי in vivo ונבנים באמצעות פפטידים הניתנים להפעלת פרוטאז וברקודים נפרדים של DNA. פפטידים מועמדים באמצעות פרופיל רקמות ex vivo (איור 1A), וברקודים של דנ"א נבחרים בהתבסס על הפעלה דומה של Cas12a (איור 4B).

איור 1: זיהוי מצעים פפטידים המופעלים על-ידי פרוטאזות לא מווסתות בסרטן המעי הגס לצורך בניית חיישנים. (A) מצעי פפטיד מזווגים FRET, שכל אחד מהם מורכב מרצף פפטידי שמשני צדדיו פלואורופור FAM ומרווה CPQ-2, נבדקים כנגד אנזימים פרוטאוליטיים רקומביננטיים או הומוגנטים ברקמות. (B) קינטיקה מייצגת של מחשוף פרוטאז של מצעי פפטיד מזווגים FRET (בדיקה 1 ו-2). האיור נלקח מתוך Hao et al.13. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: אפיון ננו-חיישן מבוסס פעילות ברקוד דנ"א עם ליבת PEG פולימרית. (A) ננו-חיישנים עם ברקוד דנ"א מורכבים מננו-נשא פולימרי (PEG בעל 8 זרועות) המתופקד עם פפטידים המופעלים על ידי פרוטאז בברקוד עם אוליגונוקלאוטידים. (B) ניתוח פיזור אור דינמי מראה גידול בגודל החלקיקים מ-8.3 ננומטר (ליבת PEG בלבד) ל-13 ננומטר (חיישן פונקציונלי). (C) טיהור HPLC של צימוד פפטיד DNA. הצמידות מנותחת בספקטרומטריית מסות ומראה משקל מולקולרי צפוי. (D) טיהור FPLC של החיישן מראה הפרדה בין חיישן פונקציונלי לבין צימוד פפטידי-DNA בלתי מוגבל. האיור נלקח מתוך Hao et al.13. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
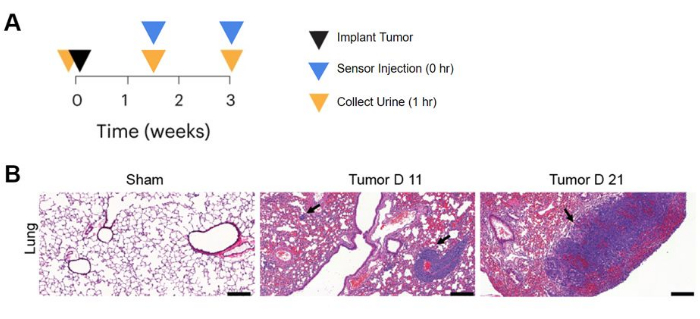
איור 3: השראת מחלת In vivo וניצול חיישנים. (A) ציר זמן של ניטור גידול אורכי עם ננו-חיישן בנקודות זמן שונות במהלך התפתחות הגידול. (B) צביעת ריאות היסטולוגית של עכברי BALB/c הנושאים גידולי ריאה CRC לאחר 11 ו-21 יום לאחר חיסון הגידול ועכברי ביקורת Sham בהזרקת מלח. סרגל קנה מידה = 200 מיקרומטר. איברים היו קבועים, משובצים בפרפין ומוכתמים בהמטוקסילין ואוזין. המחקר נעשה עם n = 3 עכברים לנקודת זמן ומוצגות תמונות מחיה מייצגת. חצים מצביעים על גושים סרטניים בריאה. האיור נלקח מתוך Hao et al.13. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
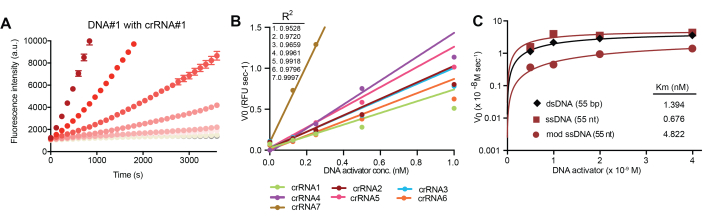
איור 4: הפעלת Cas12a על-ידי מפעילי דנ"א מיוצבים כימית. (A) הפעלה של Cas12a על-ידי ברקוד ssDNA מייצג באמצעות קשירה עם crRNA משלים גורמת לפיצול טרנס-מחשוף של דנ"א של צופה מהצד באופן תלוי מינון, כפי שנמדד על-ידי עוצמת פלואורסצנטיות באמצעות ספקטרופוטומטר. (B) מהירות התגובה הראשונית (V0) נקבעת משיפוע העקומה בתחילת התגובה ב-(A) ומתוכננת לקבוע את הטווח הליניארי של ביצועי המבחן. (C) הפעלת Cas12a על ידי מפעילי DNA דו-גדילי, חד-גדילי ומהונדס-כימית. האיור נלקח מתוך Hao et al.13. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: קריאת ברקוד DNA בתיווך CRISPR-Cas12 עם שתי אפשרויות זיהוי. (A) שיעורי המחשוף הטרנס-מחשוף של Cas12a בעת הפעלה של זוגות שונים של ssDNA activator-crRNA נקבעים בבדיקת המחשוף הפלואורסצנטי Cas12a. בדיקות מבוצעות עם דגימות שתן שנאספו מעכברים שהוזרקו עם 1 nmol של מפעיל ssDNA שונה לאחר 1 שעה של מתן i.v. האיור נלקח מתוך Hao et al.13. (B) קריאת נייר של Cas12a המופעל על ידי דגימת שתן עם שינויים קולורימטריים מופיעה במקומות שונים ברצועת הנייר. הרצועה העליונה היא של כתב FAM DNA שסוע והלהקה התחתונה היא של כתב FAM-biotin uncaved. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: תא איסוף שתן להניח מעל צלחת של 96 בארות. העכבר ממוקם באופן זמני בתוך הגליל להשתנה לתוך צלחת 96 באר. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 1: רצפי אוליגו ופפטידים לניסוח חיישנים ובדיקת קריספר. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 2: ריאגנטים לתגובת Cas12a מבוססת פלואורסצנטיות ומבוססת נייר ודגימת שתן. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 3: ריאגנטים של תגובת כתב לזיהוי CRISPR מבוסס פלואורסצנטיות. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 4: ריאגנטים של תגובת כתבים לזיהוי CRISPR מבוסס נייר. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
כאן מוצגת פלטפורמה הניתנת להתאמה אישית רבה לגילוי סרטן מרובה משתתפים עם בדיקת שתן ניידת המעריכה פעילות פרוטאוליטית הקשורה למחלה באמצעות חיישן מוזרק זעיר פולשני. כאשר מופעל על ידי פרוטאזות גידוליות, מחשוף המצע הפפטידי מוגבר באמצעות שחרור ברקוד DNA לתוך השתן. את כתבי הדנ"א הסינתטי בדגימת שתן ניתן לקרוא באמצעות הגברה אנזימטית משנית בתיווך CRISPR-Cas באמצעות זיהוי פלואורומטרי או בדיקה פשוטה מבוססת נייר. ברקוד DNA הוא שיטה אטרקטיבית לתיוג סמנים ביולוגיים סינתטיים כדי לאפשר ריבוב. שיפור היציבות של ברקודי הדנ"א באמצעות שינוי כימי הוא הכרחי לשמירה על יציבות ננו-חיישנים in vivo. באופן ספציפי, זיהוי ברקוד DNA באמצעות CRISPR-Cas12a יכול להיות מופעל באמצעות ברקודי DNA מהונדסים לחלוטין עם עמוד שדרה מיוצב. השינוי הכימי מפחית את מהירות ההפעלה של CRISPR-Cas12a ביחס למקבילו המקורי בדנ"א, עם זאת, בשל יציבותו המוגברת. יתר על כן, הכנסת שינויים טרמינליים ל- crRNA או בדיקת אוליגונוקלאוטידים שונים שהשתנו בברקודי ה- DNA עשויים להגביר עוד יותר את הרגישות של זיהוי ברקוד DNA בתיווך קריספר15, ובכך לשפר את גבול הגילוי (LOD) של אבחון סרטן.
בנוסף להגברה מולקולרית, אסטרטגיית מפתח נוספת להשגת ה- LOD הנדרש לגילוי מוקדם של סרטן כוללת ניצול סינון גודל על ידי הכליות כדי לרכז את כתבי ה- DNA הסינתטי בשתן. לשם כך, קריטי לייעל את גודל ברקודי הדנ"א. DNA משלים של 20 מיליון crRNA הציג קריאת ברקוד DNA אופטימלית בתיווך CRISPR-Cas12a מדגימות השתן. אורך אופטימלי זה עשוי להשתנות כאשר הוא מיושם על נוקלאזות CRISPR שונות או מודלים פרה-קליניים של בעלי חיים.
כדי לשמור על יכולת השחזור של מערכת זיהוי זו, חשוב לבצע אפיון יסודי של ננו-חיישנים הניתנים להזרקה כדי למזער את השונות בין אצווה לאצווה. שונות במספר הצמידות פפטידים-דנ"א לכל ליבה תשנה את כמות ברקודי הדנ"א המשתחררים לשתן ולכן תשפיע על הקריאה הסופית. באופן דומה, הזרקה זהירה של החיישן לווריד תסייע לעקביות במינון החיישן. על מנת להבטיח איסוף שתן מתאים של לפחות 50 מיקרוליטר של נפח שתן מכל בעל חיים בנקודת זמן נתונה, שמירה על הידרציה של בעלי חיים נושאי גידול היא קריטית. ניתן לתמוך בכך על ידי שמירה על העכברים על ג'ל מים שאינו מרטיב או הזרקת PBS תת עורית שעה לפני איסוף השתן16.
תזמון איסוף השתן ומשך קריאת ברקוד DNA בתיווך CRISPR-Cas הם גורמים קריטיים לעקביות המבחן. ברקודים במחזור עוברים דעיכת ריכוז חד-מעריכית אופיינית לאחר הזרקה תוך ורידית וסינון כליות תלוי גודל מהדם, ומגיעים לשיא שעה לאחר מתן בדגמי עכברים13. נקודת זמן זו עשויה להשתנות במודל אחר של בעלי חיים. עבור שני פורמטי הקריאה של מבחני ההפעלה של CRISPR-Cas (בדיקת זרימה צידית פלואורסצנטית לעומת בדיקת זרימה צידית מבוססת נייר), חשוב לעקוב אחר הקינטיקה מבוססת הפלואורסצנטיות לפני הזרימה הרוחבית, מה שמאפשר את נקודת הקצה האופטימלית לקריאת מוצר המחשוף של CRISPR-Cas.
גישה זו היא יתרון בשל שילוב של שלבי הגברת אות כפולים מהפעלה אנזימטית פרוטאוליטית בתיווך CRISPR-Cas, ויכולת הריבוב ללכוד את מורכבות המחלה. הרחבת ריבוי החיישנים תחייב מינון חומרים זהיר וכן הרחבת תפוקת הקריאה כדי לשמור על ניידות וקלות שימוש. אסטרטגיה זו דורשת אפיון יסודי של פעילות הפרוטאז במספר מודלים ואת הספציפיות של הפרופיל הפרוטאוליטי כלפי מחלה מסוימת, או שלב מחלה. יתר על כן, בעוד הזרקת חיישנים היא פחות פולשנית מרבות מהחלופות האבחנתיות כגון ביופסיה, הזרקה תוך ורידית עשויה להסתמך על פלבוטומיסטים מיומנים למתן חיישנים, מה שעלול להגביל את מקרה השימוש לניטור מחלות במקום לגילוי ראשוני בסביבה קלינית. בנוסף להזרקה מערכתית, ניתן להנדס עוד יותר את ננו-חיישני ה- DNA המקודדים באמצעות פורמולציות שניתן ליישם באמצעות מסירה פומית, בשאיפה ומקומית לא פולשנית, כדי לאפשר זיהוי מחלות נייד וניטור עצמי קל של התקדמות המחלה והערכת הטיפול.
Disclosures
S.N.B., L.H. ו-R.T.Z. רשומים כממציאים בבקשת פטנט הקשורה לתוכן עבודה זו. S.N.B. מחזיקה במניות Glympse Bio, Satellite Bio, Lisata Therapeutics, Port Therapeutics, Intergalactic Therapeutics, Matrisome Bio, והיא דירקטורית ב-Vertex; מייעץ למודרנה, ומקבל מימון מחקר ממומן מג'ונסון אנד ג'ונסון, רוויטופ וינשוף.
Acknowledgements
מחקר זה נתמך בחלקו על ידי מענק תמיכה של מכון קוך מספר P30-CA14051 מהמכון הלאומי לסרטן (מרכז סוונסון לביוטכנולוגיה), מענק מרכז ליבה P30-ES002109 מהמכון הלאומי למדעי בריאות הסביבה, מרכז מרבל לננו-רפואה של סרטן במכון קוך, תוכנית מחקר הגבולות של מכון קוך באמצעות קרן קתי וקורט מארבל לחקר הסרטן, וקרן וירג'יניה וד.ק. לודוויג לחקר הסרטן. A.E.V.H. נתמך על ידי מלגת הכשרה קדם-דוקטורנטית במימון NIH (T32GM130546). S.N.B. הוא חוקר במכון הרפואי הווארד יוז. L.H. נתמכת על ידי K99/R00 Pathway to Independence Award מהמכון הלאומי לסרטן ומימון סטארט-אפ מאוניברסיטת בוסטון.
Materials
| Name | Company | Catalog Number | Comments |
| 10x NEB Buffer 2.1 | New England Biolabs | B6002SVIAL | |
| 20-mer phosphorothioated DNA reporters with 3’-DBCO group | IDT | Custom DNA | |
| Agilent 1100 High Performance Liquid Chromatography system with Vydac 214TP510 C4 column | Agilent | HPLC | |
| ÄKTA fast protein liquid chromatography (FPLC) | GE Healthcare | FPLC | |
| Amicon ultracentrifuge tubes (MWCO = 10 kDa) | EMD millipore | Various volumes available | |
| Azide-terminated PAPs with C-terminus cysteine | CPC Scientific | Custom peptide | |
| crRNAs | IDT | See Supplementary Table 1 | |
| Cryogenic transmission electron microscopy | JEM-2100F | JEOL | cyroTEM |
| Cysteine terminated DNA-peptide conjugates | CPC Scientific | Custom peptide | |
| Dynamic light scattering (DLS) | DLS | ||
| EnGen LbaCas12a (Cpf1), 100 µM | New England Biolabs | M0653T | |
| Experimental animals | Taconic Biosciences | BALB/cAnNTac | 6–8 weeks of age |
| gentleMACS C tubes | Miltenyi Biotec | 130-093-237 | tissue homogenization |
| HybriDetect Universal Lateral Flow Assay Kit | Miltenyi Biotec | MGHD 1 | |
| Matrix-assisted laser desorption/ionization–time of flight (MALDI–TOF) mass spectrometry | Bruker | Microflex MALDI–TOF | |
| MC26-Fluc cell line | Kenneth K. Tanabe Laboratory, Massachusetts General Hospital | ||
| multivalent PEG (40 kDA, 8-arm) with maleimide-reactive group | JenKem | A10020-1 / 8ARM(TP)-MAL-40K,1 g | |
| Python, Version 3.9 | https://www.python.org/ | ||
| Quant-iT OliGreen ssDNA Assay Kit and Quant-iT OliGreen ssDNA Reagent | Invitrogen | O11492 | ssDNA assay kit |
| ssDNA FAM-T10-Quencher and FAM-T10-Biotin reporter substrates | IDT | Custom DNA | |
| Superdex 200 Increase 10/300 GL column | GE Healthcare | GE28-9909-44 | For FPLC |
| Tecan Infinite Pro M200 plate reader | Tecan | ||
| ThermoFisher Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 |
References
- Soleimany, A. P., Bhatia, S. N. Activity-based diagnostics: an emerging paradigm for disease detection and monitoring. Trends Mol Med. 26 (5), 450-468 (2020).
- Muir, R. K., Guerra, M., Bogyo, M. M. Activity-based diagnostics: recent advances in the development of probes for use with diverse detection modalities. ACS Chem Biol. 17 (2), 281-291 (2022).
- Heitzer, E., Haque, I. S., Roberts, C. E. S., Speicher, M. R. Current and future perspectives of liquid biopsies in genomics-driven oncology. Nat Rev Genet. 20 (2), 71-88 (2019).
- Dudani, J. S., Warren, A. D., Bhatia, S. N. Harnessing protease activity to improve cancer care. Annu Rev Canc Biol. 2, 353-376 (2018).
- Hanahan, D. Hallmarks of cancer: new dimensions. Cancer Discov. 12 (1), 31-46 (2022).
- Quail, D. F., Joyce, J. A. Microenvironmental regulation of tumor progression and metastasis. Nat Med. 19 (11), 1423-1437 (2013).
- Kwong, G. A., et al. Synthetic biomarkers: a twenty-first century path to early cancer detection. Nat Rev Cancer. 21 (10), 655-668 (2021).
- Kirkpatrick, J. D., et al. Urinary detection of lung cancer in mice via noninvasive pulmonary protease profiling. Sci Transl Med. 12 (537), eaaw0262 (2020).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. J Am Chem Soc. 136 (39), 13709-13714 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nat Biotechnol. 31 (1), 63-70 (2013).
- Chen, J. S., et al. CRISPR-Cas12a target binding unleashes indiscriminate single-stranded DNase activity. Science. 360 (6387), 436-439 (2018).
- Choi, H. S., et al. Renal clearance of quantum dots. Nat Biotechnol. 25 (10), 1165-1170 (2007).
- Hao, L., et al. CRISPR-Cas-amplified urinary biomarkers for multiplexed and portable cancer diagnostics. Nat Nanotechnol. 18 (7), 798-807 (2023).
- Hao, L., et al. Microenvironment-triggered multimodal precision diagnostics. Nat Mater. 20 (10), 1440-1448 (2021).
- Ghanta, K. S., et al. 5'-Modifications improve potency and efficacy of DNA donors for precision genome editing. Elife. 10, e72216 (2021).
- Bekkevold, C. M., Robertson, K. L., Reinhard, M. K., Battles, A. H., Rowland, N. E. Dehydration parameters and standards for laboratory mice. J Am Assoc Lab Anim Sci. 52 (3), 233-239 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved