Method Article
제브라피시의 태아 알코올 스펙트럼 장애를 모델링하여 불리한 배아 환경이 성인의 사회적 행동에 미치는 영향을 특성화합니다.
요약
현재 프로토콜의 목표는 성체 제브라피쉬에 대한 사회적 선호도 분석을 수립하고 사용하는 데 필요한 단계를 개략적으로 설명하고 에탄올로 인한 사회적 결함을 특성화하는 데 사용할 수 있음을 입증하는 것입니다.
초록
태아 알코올 스펙트럼 장애(FASD)는 알코올로 인한 모든 선천적 결함을 설명합니다. 성장 결핍, 두개골, 행동 및 인지 이상과 같은 선천적 결함은 FASD와 관련이 있습니다. 사회적 어려움은 FASD와 관련된 일반적인 행동 이상이며 종종 심각한 건강 문제를 초래합니다. 동물 모델은 에탄올로 인한 사회적 결함의 원인이 되는 메커니즘을 이해하는 데 매우 중요합니다. 제브라피쉬는 외부에서 수정된 투명한 알을 생산하는 사회적 척추 동물입니다. 이러한 특성은 연구자에게 FASD 표현형을 생성하기 위한 정확하면서도 간단한 절차와 FASD와 관련된 사회적 결핍을 모델링하는 데 활용할 수 있는 타고난 행동을 제공합니다. 따라서 제브라피시는 FASD의 사회적 결핍을 특성화하는 데 이상적입니다. 현재 프로토콜의 목표는 발달 초기에 부정적인 환경의 결과와 성인기의 사회적 행동에 미칠 수 있는 영향을 특성화하는 데 사용할 수 있는 간단한 행동 분석을 사용자에게 제공하는 것입니다. 이 프로토콜은 돌연변이 또는 기형 유발 물질이 성인의 사회적 행동에 미치는 영향을 특성화하는 데 사용할 수 있습니다. 여기에 설명된 프로토콜은 20분 사회적 분석 동안 개별 물고기의 사회적 행동을 특성화하는 방법을 보여줍니다. 또한, 현재 프로토콜을 사용하여 얻은 데이터는 프로토콜이 성인 제브라피시에서 배아 에탄올로 인한 사회적 결함의 영향을 특성화하는 데 사용될 수 있다는 증거를 제공합니다.
서문
태아 알코올 노출은 총칭하여 태아 알코올 스펙트럼 장애(FASD)1로 알려진 다양한 선천적 기형을 유발할 수 있습니다. 사회적 어려움과 같은 장애 행동은 FASD 2,3과 관련된 흔한 선천적 결함입니다. 불행히도, 사회적 어려움은 종종 심각한 정신건강 문제를 야기하며4, 이는 FASD를 가진 개인의 삶의 질에 부정적인 영향을 미칠 수 있다. 따라서 에탄올로 인한 사회적 결함의 원인이 되는 메커니즘을 이해하는 것이 가장 중요합니다.
제브라피시는 생물학적, 행동적 특성을 가지고 있어 에탄올로 인한 사회적 결함의 원인이 되는 메커니즘에 대한 이해를 발전시키는 데 매우 적합합니다. 예를 들어, 제브라피쉬는 외부에서 투명한 수정란을 대량으로 생산합니다. 이러한 생물학적 특성을 통해 연구자는 정확하고 복제 가능한 FASD 표현형을 쉽게 만들 수 있습니다5. 수정 24시간 후(hpf)에서 배아를 에탄올에 노출시키려면 해부 현미경을 사용하여 투명한 난자를 검사하고 Kimmel et al.6과 같이 이전에 발표된 연구를 기반으로 배아를 단계화한 다음 원하는 기간 동안 원하는 에탄올 농도에 난자를 배치하기만 하면 됩니다. 융모막은 알코올7에 대한 약한 장벽이기 때문에 에탄올은 배아를 쉽게 목욕시킵니다. 노출을 막으려면 에탄올 용액에서 계란을 제거하기만 하면 됩니다. 제브라피쉬는 연구자들에게 FASD 표현형을 생성하는 간단하면서도 정확한 방법을 제공하는 것 외에도, 인간 유전자의 70%가 제브라피시 orthologue를 가지고 있기 때문에 연구자들이 인간과 유전자 비교를 할 수 있도록 하여 인간 질병 관련 유전자를 이해하는 데 유용한 도구이다8. 또한, 다른 동물 모델과는 달리, 제브라피쉬는 숄즈(shoals)10라고 불리는 사회적 집단9을 형성한다. 떼를 지어 다니는 행동은 배아 에탄올 노출이 사회적 행동에 미치는 영향을 특성화하는 데 사용될 수 있다11. 더욱이, 제브라피시에서는 컴퓨터가 제어하는 사회적 자극12 또는 실시간 사회적 자극13을 사용하여 사회적 반응을 이끌어낼 수 있습니다.
이전 연구에서는 그룹14에서 성인 제브라피쉬의 사회적 반응을 특성화했지만, 이 접근법의 한계는 개별 물고기의 행동을 신경전달물질 수준의 변화와 같은 특정 측정치와 연관시킬 수 없다는 것입니다11. 다음 프로토콜은 사용자에게 개별 성인 제브라피시의 사회적 행동을 특성화할 수 있는 기능을 제공합니다. 사회적 행동은 개별 물고기에 대해 획득되기 때문에 프로토콜 사용자는 이제 각 물고기의 획득된 행동 프로필을 종속적인 결과와 연관시킬 수 있습니다. 예를 들어, 이전 연구는 배아 에탄올 노출이 사회적 자극에 대한 도파민 반응을 손상시킨다는 것을 보여주었다11. 여기에 표시된 데이터는 배아 에탄올 노출을 독립 변수로 사용했지만, 프로토콜 사용자는 다른 약물 치료나 유전적 돌연변이가 사회적 행동에 미치는 영향을 특성화할 수 있습니다. 또한, 프로토콜 사용자는 배아 치료가 행동을 어떻게 변화시키는지 조사하는 데 국한되지 않고 성체 제브라피시의 급성 약물 치료가 사회적 행동에 어떤 영향을 미치는지도 결정할 수 있습니다15.
프로토콜
여기에 설명된 모든 방법은 사우스다코타 대학교의 기관 동물 관리 및 사용 위원회(IACUC)의 승인을 받았습니다.
1. 제브라피시 사육, 관리 및 배아 에탄올 노출
- 설명된 대로 제브라피쉬를 키우고 번식시킵니다16.
- 에탄올 노출
- 에탄올 노출을 수행할 적절한 발달 단계를 선택합니다. 이 프로토콜에서 배아는 24hpf의 에탄올에 노출되었습니다.
- 계란을 1.0% 에탄올 부피/부피에 2시간15분 동안 놓습니다. EM mL당 난자 1개의 비율을 사용하는 것이 좋습니다. 구체적으로, 50mL의 배아 배지(EM, EM 레시피는 Westerfield16 참조)에 배아를 넣은 다음 500μL의 EM을 제거하고 500μL의 에탄올로 대체합니다.
- 에탄올에 노출된 후, 설명된 대로 배아를 융기한다17. 물고기가 16주가 되었을 때의 사회적 행동을 분석합니다.
2. 무작위 배정 및 탱크 설정
- 온라인 무작위 염기서열 생성기를 사용하여 행동 분석을 수행하기 전에 모든 시험을 선 험 적으로 무작위 배정합니다. 자극 측과 치료 그룹이 무작위로 달라지는지 확인합니다.
- 하루 중 시간이나 테스트 요일과 같은 혼란 요인을 피하기 위해 매일 같은 시간에 행동 분석을 시작하고 종료하고 모든 실험 물고기가 테스트될 때까지 연속적으로 행동 테스트를 수행합니다.
- 이 분석(그림 1)을 위해앞서 설명한 바와 같이 1.4L 탱크를 탱크 너비를 따라 외부에 배치된 37L 탱크(50cm x 25cm x 30cm, L x W x H)를 사용합니다.
- 37L 수조의 뒷면과 바닥에 흰색 골판지 플라스틱을 깔아 실험용 물고기와 배경 사이의 대비를 높이고 비디오 추적을 개선합니다.
- 1.4L 수조의 외벽에 주름진 플라스틱을 놓고 실험용 물고기에 대한 사회적 자극의 대비를 높입니다. 마지막으로 1.4L 탱크와 37L 탱크 사이에 흰색 골판지 플라스틱을 놓습니다. 이 불투명한 장벽은 실험용 물고기가 습관화되는 동안 사회적 자극을 보는 것을 방지하는 데 사용됩니다.
- 37L 수조의 전체 길이와 1.4L 수조의 절반을 캡처하고 성인 실험 물고기를 정확하게 추적할 수 있을 만큼 충분히 먼 거리에 카메라를 배치합니다.
참고: 어느 쪽이 자극을 잡고 있는지 확인하면 연구자가 추적 영역에 올바르게 레이블을 지정했는지 확인하고 백업으로 중복성을 제공합니다. - 적외선 추적을 사용하지 않는 경우 37L 탱크를 켜야 합니다. 시중에서 판매되는 수족관 후드 조명과 15W T8 전체 스펙트럼 램프를 사용하십시오.
참고: 여러 경기장을 설정하는 경우 동일한 램프가 있는 동일한 수족관 후드를 사용하십시오.
3. 사회적 분석 실시
- 먼저 행동 분석에 사용되는 37L 탱크에 하우징 랙에 사용된 물과 동일한 물을 채웁니다. 수온이 하우징 랙에서 2°C 이내인지 확인하십시오.
- 하루가 끝나면 37L 탱크를 비우십시오. 매일 깨끗한 물로 시험을 시작하십시오. 37L 탱크의 수위와 1.4L 탱크의 수위가 동일한지 확인하십시오. 방의 온도가 37 ° C에서 28.5 ° C의 물을 2 ° C로 유지하지 못하면 28.5 ° C의 따뜻한 물로 물을 교체하십시오.
- 다음으로 관심 영역을 설정합니다. 영역을 생성하려면 선택한 사용자의 수동 추적 소프트웨어를 참조하십시오. 이 프로토콜에서는 상단과 하단의 37L 탱크 길이를 따라 줄자를 사용하여 5cm 단위를 표시했습니다. 테스트 탱크가 50cm인 경우 5cm 단위는 각각 5cm인 10개의 구역으로 이어집니다.
- 37L 탱크에 표시된 표시를 참조로 사용하여 소프트웨어를 사용하여 상단의 5cm 지점을 하단의 해당 5cm 지점에 연결하여 구역을 구성합니다. 또한 아래쪽과 자극을 따라 영역을 만듭니다. 관심 영역을 사용자 지정합니다.
- 이 프로토콜의 추적 소프트웨어를 사용하여 구역으로부터의 거리와 구역에서 보낸 시간을 측정합니다. 이 프로토콜에서는 12개의 영역이 사용되었습니다.
- 구역 1에서 10까지의 시간과 자극 및 바닥으로부터의 거리를 자극에 가장 가까운 구역으로 구역 1로 정량화하고 구역 10은 자극에서 가장 먼 구역으로 정량화합니다.
- 다음으로, 사회적 자극에 사용될 두 마리의 수컷과 두 마리의 암컷을 선택합니다. 가장 좋은 방법은 실험용 물고기와 동일한 코호트의 수컷과 암컷을 사용하는 것입니다. 그것이 불가능하다면 실험용 물고기의 변형, 나이 및 크기와 일치하는 물고기를 찾으십시오.
- 실험용 물고기를 수용 탱크에서 실험용 경기장(37L 탱크)으로 옮깁니다. 그물을 사용하여 하우징 탱크에 있는 물고기를 잡습니다. 물고기가 들어있는 그물을 물고기 물이 담긴 용기에 넣으십시오.
참고: 이 접근 방식을 사용하면 수조 사이를 이동하는 동안 실험용 물고기에 대한 스트레스를 줄일 수 있습니다. - 실험용 물고기를 실험장 중앙에 놓습니다.
- 사용자가 선택한 소프트웨어(사용자 설명서 참조)에 따라 감지 설정이 만족스러우면 20분 평가판을 시작합니다. 처음 10분 동안은 37L 탱크와 1.4L 탱크 사이의 불투명 장벽을 제자리에 두십시오. 이것은 실험용 물고기가 두 마리의 수컷 제브라피시와 두 마리의 암컷 제브라피시로 구성된 사회적 자극을 보는 것을 방지하고 물고기가 테스트 경기장13,17에 적응할 수 있도록 합니다.
- 10분 후 탱크 뒤에서 당겨 불투명한 장벽을 조심스럽게 제거합니다. 이를 통해 실험용 물고기는 사회적 자극을 볼 수 있습니다.
- 추적 소프트웨어를 사용하여 사용자의 선호도와 소프트웨어 설명서에 따라 실험용 물고기 11, 12, 17 의 행동을 추적하고 정량화합니다. 현재 프로토콜에서는 사회적 자극과 탱크 바닥으로부터의 거리와 모든 영역에서 보낸 시간을 정량화합니다.
- 기존 데이터 분석 도구를 사용하여 데이터를 분석합니다.
결과
그림 2는 Fernandes et al.17에서 수정되었으며 배아 에탄올 노출이 자극으로부터의 거리를 조사하여 떼를 짓는 반응을 무디게 한다는 것을 보여줍니다. 그림 2의 데이터는 20분 실험 동안 사회적 자극으로부터의 거리를 나타냅니다. Y축은 거리를 센티미터 단위로 나타내고 X축은 20분 시도를 1분 간격으로 나눈 것을 나타냅니다. X축을 따라 있는 검은색 막대는 불투명한 장벽이 제거되고 사회적 자극이 테스트 물고기에게 보이는 시간을 나타냅니다. 처음에는 모든 그룹에서 일단 사회적 자극이 가시화되면 사회적 자극을 향해 급격히 감소하는데, 이는 9 분에서 10 분 사이의 거리의 가파른 감소로 결정 될 수 있지만, 대조군 물고기는 사회적 자극에 매우 가깝게 유지되는 반면 알코올은 그렇지 않습니다. 이는 배아 에탄올 노출이 성인의 사회적 행동에 영향을 미친다는 것을 시사한다12,18.
그림 3 은 Fernandes et al.17 에서 수정되었으며 자극까지의 거리를 측정하여 수집된 데이터를 사용하여 배아 에탄올 노출이 떼 반응에 미치는 영향을 추가로 보여줍니다. 그림 3 의 데이터는 사회적 자극이 보였을 때 사회적 자극을 향한 거리의 감소를 나타냅니다. 자극까지의 거리의 평균 감소를 계산하기 위해; 자극 기간(자극이 보이는 경우) 동안 자극까지의 평균 거리는 습관화(사회적 자극이 보이지 않는 경우) 동안 자극까지의 평균 거리에서 뺀 값이므로 음의 값이 클수록 더 강력한 사회적 반응을 나타냅니다.
그림 4 는 구역에서 보낸 시간과 자극까지의 거리를 비교한 것입니다. 그림 4 는 Fernandes et al.17에서 수정되었습니다. 그림 4A 는 자극이 보이는 동안 물고기가 각 구역(X축)에서 소비하는 시간(Y축)을 보여줍니다. 모든 그룹의 물고기가 사회적 자극 통제에 가장 가까운 지역을 선호하는 것으로 보이지만, 물고기는 알코올 처리된 물고기에 비해 지역 1에서 거의 두 배의 시간을 보냅니다(그림 4B). 그림 4C 는 배아 에탄올 노출이 지역 간 그룹 간에 차이가 없었기 때문에 이동성을 손상시키지 않았음을 보여줍니다. 마지막으로, 그림 4D 는 사회적 자극이 없을 때 물고기가 사회적 자극에 가장 가까운 영역에서 시간을 보내지 않는다는 것을 보여줍니다. 따라서 결과는 대조군 물고기가 보일 때 사회적 자극에 접근하고 매우 가까이 머무르는 반면 에탄올 처리된 물고기는 그렇지 않다는 것을 보여줍니다. 또한, 그림 2 와 그림 4C 에 나타난 데이터는 배아 에탄올 노출이 물고기가 사회적 자극(그림 2)을 보거나 움직이는(그림 4C) 능력을 손상시키지 않는다는 것을 시사하며, 따라서 배아 에탄올 노출이 성인 제브라피쉬의 사회적 행동을 손상시킨다는 강력한 증거를 제공합니다.

그림 1: 행동 장치의 개략도. 37L 탱크는 배아 에탄올 노출 유무에 관계없이 성인 제브라피시(ZT140으로 명명됨)의 사회적 행동을 분석하는 데 사용되었습니다. 이 그림은 Fernandes et al.17에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
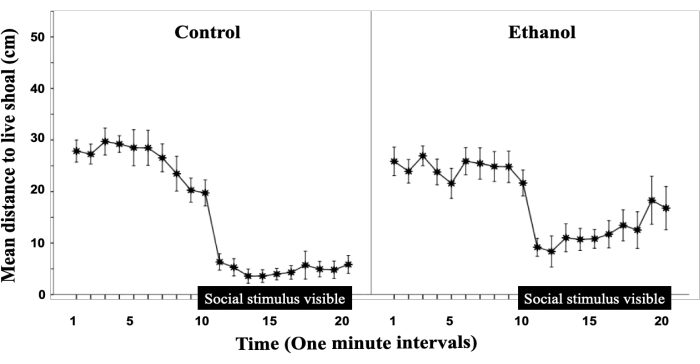
그림 2: 배아 에탄올 노출은 성체 제브라피시의 사회적 행동을 무디게 합니다. 성인 실험 물고기와 살아있는 여울 사이의 평균 거리는 20분 행동 세션의 1분 간격으로 표시되었습니다. 평균 ± SEM이 표시됩니다. 제어(n = 12); 1% 에탄올(EtOH; n = 11). X축 위의 수평 막대는 10분에서 20분 사이로, 실험 대상자가 살아있는 여울을 볼 수 있는 타임라인을 나타냅니다. 알코올 농도는 그래프 위에 표시되어 있습니다. 이 그림은 Fernandes et al.17에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 알코올 처리된 물고기는 살아있는 암초에서 훨씬 더 멀리 떨어져 있습니다. 막대는 살아있는 모래톱이 보이기 전과 후의 물고기가 살아있는 모래톱에서 떨어진 거리의 차이를 나타냅니다. 음수 값이 클수록 동시종에 대한 반응이 더 강하다는 것을 나타냅니다. 평균 ± SEM이 표시됩니다. 평균 ± SEM이 표시됩니다. 제어(n = 12); 1% 에탄올(EtOH; n = 11). 이 그림은 Fernandes et al.17에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 배아 에탄올 노출은 살아있는 여울이 보일 때만 구역 1에서 보낸 시간을 변경합니다. (A) 막대는 자극이 제시되는 동안 10개 구역 모두에서 보낸 시간을 나타냅니다. (B) 막대는 자극 프레젠테이션 동안 영역 1에서 보낸 시간을 나타냅니다. 구역 1은 살아있는 모래톱에서 가장 가까운 구역이고 구역 10은 살아있는 모래톱에서 가장 먼 구역입니다. 물고기 통제 물고기가 구역에서 보내는 시간의 상당한 차이에 주목하십시오. (C) 바는 습관화 중 모든 구역에서 보낸 시간의 평균 백분율을 나타내며, 처음 10분. (D) 막대는 습관화 중 구역 1에서 보낸 시간을 나타냅니다. 평균 ± SEM이 표시됩니다. 표본 크기는 다음과 같습니다: 대조군 (n = 12); 에탄올(EtOH; n = 11). 이 그림은 Fernandes et al.17에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
제브라피쉬는 여러 가지 생물학적, 행동적 특성을 가지고 있어 유전자, 환경 및 행동과 관련된 연구에 매우 매력적인 유기체입니다 5,19. 이 프로토콜은 최종 사용자에게 사회적 행동을 분석하기 위한 비교적 간단한 가이드, 사회적 행동을 수량화하는 여러 가지 방법을 제공하며, 개별 물고기의 행동 반응을 배아 에탄올 노출, 유전적 돌연변이 또는 기타 약리학적 물질과 같은 치료와 연결할 수 있는 잠재력을 가지고 있습니다.
성체 제브라피쉬의 사회적 행동을 분석하려면 선택한 추적 소프트웨어의 사용 설명서와 함께 이 프로토콜을 주의 깊게 따르십시오. 테스트 경기장을 건설하려면 뚜껑과 조명이 있는 37L 탱크, 골판지 플라스틱, 사회적 자극을 위한 두 개의 작은 탱크, 카메라만 있으면 됩니다. 이러한 품목의 대부분은 애완 동물 가게와 대형 상자 소매점에서 구입할 수 있습니다. 한 마리의 제브라피쉬가 한 무리의 제브라피시와 함께 제시될 때, 한 마리의 제브라피쉬의 자연스러운 행동은 그룹과의 거리를 줄이면서 그룹과의 거리를 줄이는 것이며,19 이 행동을 떼를 지어 다니는 반응(shoaling response)19이라고 부른다. 떼를 지어 다니는 반응은 두 가지 방법으로 특징지을 수 있는 사회적 행동이다: 첫째, 사회적 자극이 보일 때 사회적 자극과 한 마리의 물고기12 사이의 거리를 측정하고, 둘째, 사회적 자극이 보일 때 사회적 자극에 가장 가까운 구역에서 보낸 시간을 측정한다. 사회적 자극이 가시화될 때 제브라피시가 5cm 구역에서 보내는 시간을 정량화할 수 있는 능력을 가지고 있다는 것은 이 물고기의 평균 길이가 약 4cm라는 점을 감안할 때 사회적 반응에 대한 강력한 증거를 제공합니다.
50cm 수조를 10, 5cm 영역으로 나누면 테스트 물고기가 모든 구역에 있을 확률이 동일하기 때문에 통계 분석에 도움이 됩니다. 언뜻 보기에는 동일한 결과에 대해 두 개의 측정값을 갖는 것은 중복되는 것처럼 보입니다. 그러나 중복성은 검증을 제공할 수 있습니다. 또한, 습관화 중 거리 및 지속 시간 측정을 사용하여 치료가 시력이나 움직임에 영향을 미치는지 여부를 결정할 수 있습니다. 이 프로토콜은 상업적으로 이용 가능한 자동 추적 소프트웨어13,18를 사용했지만 다른 추적 시스템 또는 훈련된 관찰자에 의한 수동 추적에도 적용할 수 있습니다.
사용하는 추적 소프트웨어에 관계없이 추적을 최적화하기 위해 수행해야 하는 중요한 단계가 있습니다. 먼저 기록되는 물고기와 비교하여 상당한 대비를 제공하는 배경을 선택합니다. 야생형 제브라피쉬는 황금색과 파란색의 가로 줄무늬가 있습니다20; 그들은 또한 노란색 xanthophores, 은빛 또는 파란색 iridophores, 검은 색 melanophores20의 모자이크를 가지고 있습니다. 따라서, AB 야생형 물고기의 행동을 특성화할 때는 흰색 배경 12,13,17을 사용하고, 다른 한편으로는 색소가 부족한 캐스퍼 제브라피쉬의 사회적 행동을 특성화할 때는 검은색 배경17을 사용한다. 둘째, 실험용 물고기를 추적할 수 있는 충분한 조명이 있는지 확인합니다. 추적 경기장이 여러 개 있는 경우 경기장 간의 조명이 동일한지 확인하십시오. 또 다른 중요한 단계는 37L 탱크의 수위가 1.4L 탱크의 수위와 일치하는지 확인하여 테스트 물고기가 사회적 자극이 없는 지역에서 수영할 수 없도록 하는 것입니다. 또한 비디오를 녹화할 때 1.4L 탱크가 프레임 안에 있는지 확인하십시오. 이렇게 하면 데이터의 수동 코딩이 필요하거나 자극 측의 검증이 필요한 경우 백업이 제공됩니다.
프로토콜 내의 일반적인 문제는 주제가 올바르게 추적되지 않거나, 습관화 기간이 충분하지 않으며, 여러 경기장이 설정되었을 때 불투명한 장벽을 당길 때 짧은 시간 지연이 있습니다. 피사체가 올바르게 추적되지 않는 것을 방지하려면 앞에서 언급한 것처럼 물고기와 배경 사이에 충분한 대비가 있는지 확인하고 소프트웨어의 지침을 따르십시오. 또한 사용자의 소프트웨어가 적외선 추적을 허용하는 경우 대비와 관련된 문제를 완화할 수 있습니다. 10분은 습관화 기간에 대해 긴 시간처럼 보일 수 있지만, 우리의 미발표 연구는 습관화 시간을 줄이는 것이 프로토콜에 부정적인 영향을 미친다는 것을 시사합니다. 마지막으로, 37L와 1.4L 탱크 사이의 불투명한 장벽을 수동으로 당기고 여러 경기장을 설치한 경우 여러 사람이 장벽을 당기지 않는 한 모든 장벽을 정확히 동시에 당길 수 없습니다. 또는 한 사람만 분석을 수행하는 경우 어떤 경기장 장벽이 먼저 당겨지는지 균형을 맞춰야 합니다.
프로토콜은 간단하지만 추적 소프트웨어 비용과 물고기를 개별적으로 특성화하는 데 필요한 추가 시간은 잠재적인 함정입니다. 이 프로토콜은 상업적으로 이용 가능한 소프트웨어를 사용하여 실험용 물고기의 행동을 추적하여 여러 경기장을 설정하고 여러 물고기를 기록함으로써 관찰자 편향을 피하고 처리량을 늘렸습니다. 이 프로토콜에는 상용 소프트웨어가 사용되었지만 무료 소프트웨어를 포함한 다른 추적 소프트웨어를 사용할 수 있습니다. 최종 사용자가 선택한 추적과 함께 이 프로토콜을 사용하면 사회적 분석이 재현됩니다. 이 프로토콜에서는 개별 물고기의 행동이 특성화되었습니다. 다른 연구자들은 제브라피시14 그룹을 조사하는 데 초점을 맞추었는데, 이는 한 번에 한 마리의 물고기를 특성화하는 것의 잠재적인 위험을 해결하는 한 가지 방법입니다. 또는 앞서 언급했듯이 여러 테스트 경기장을 동시에 사용하면 처리량을 늘리면서 개별 물고기에 행동 프로필을 할당할 수 있는 기능을 유지할 수 있습니다. 개별 물고기의 행동 프로필을 연관시킬 수 있는 능력을 유지하는 것은 연구자에게 치료 그룹 내의 변동성을 찾을 수 있는 기회를 제공하기 때문에 중요합니다. 배아 에탄올 노출이 대표 데이터에서 독립 변수로 사용되었지만, 현재 프로토콜에 설명된 기술의 향후 적용은 단순히 배아 에탄올 노출이 사회적 행동에 미치는 영향을 특성화하는 데 국한되지 않습니다. 예를 들어, 유전적 돌연변이21 또는 다른 약리학적 치료22 가 사회적 행동에 미치는 영향을 결정할 수 있다. 더욱이, 배아 에탄올 노출 외에도 향후 연구는 다른 기형 유발 물질이 사회적 행동에 미치는 영향을 특성화할 수 있습니다. 따라서 현재 프로토콜은 유전자 및/또는 환경이 사회적 행동에 미치는 영향을 이해하는 데 관심이 있는 모든 연구자에게 유용합니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구를 지원하기 위한 자금은 미국 국립보건원(NIH)/미국 국립알코올남용연구소(NIAAA)[R00AA027567]에서 Y.F.에 제공했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.4-l ZT140 Aquaneering tanks | Aquaneering | ZT140 | Tanks for social stimulus |
| Aqueon 20" Deluxe Fluorescent Full Hood aquarium light | https://www.petco.com/shop/en/petcostore/product/aqueon-aquarium-black-24-fluorescent-deluxe-full-hood-215740 | Light for the 37-I tank | |
| Aqueon Standard Open-Glass Glass Aquarium Tank, 10 Gallon | https://www.petco.com/shop/en/petcostore/product/aga-10g-20x10x12bk-tank-170917 | 37-l tank for the social assay | |
| Ethanol | Fisher Scienticfic | BP28184 | |
| Ethovision XT tracking system | https://www.noldus.com/ethovision-xt | ||
| R-Capable Color Basler GigE Camera | https://www.noldus.com/ethovision-xt | ||
| White corrugated plastic | https://www.homedepot.com/p/Coroplast-48-in-x-96-in-x-0-157-in-4mm-White-Corrugated-Twinwall-Plastic-Sheet-CP4896S/205351385 | Plastic to line the back and the bottom of the 37-I tank and back of the tanks used for the social stimulus |
참고문헌
- Institue Med. Fetal alcohol syndrome: diagnosis, epidemiology, prevention, and treatment. , National Academies Press. Washington, D.C. (1996).
- Abel, E. L. Fetal alcohol syndrome and fetal alcohol effects. , Springer. (1984).
- Stevens, S. A., Clairman, H., Nash, K., Rovet, J. Social perception in children with fetal alcohol spectrum disorder. Child Neuropsychol. 23 (8), 980-993 (2017).
- Streissguth, A. P., et al. Risk factors for adverse life outcomes in fetal alcohol syndrome and fetal alcohol effects. J Dev Behav Pediatr. 25 (4), 228-238 (2004).
- Lovely, C. B., Fernandes, Y., Eberhart, J. K. Fishing for fetal alcohol spectrum disorders: zebrafish as a model for ethanol teratogenesis. Zebrafish. 13 (5), 391-398 (2016).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Lovely, C. B., Nobles, R. D., Eberhart, J. K. Developmental age strengthens barriers to ethanol accumulation in zebrafish. Alcohol. 48 (6), 595-602 (2014).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Norton, W., Bally-Cuif, L. Adult zebrafish as a model organism for behavioural genetics. BMC Neurosci. 11 (1), 90(2010).
- Pitcher, T. J. Heuristic definitions of fish shoaling behaviour. Animal Behav. 31 (2), 611-613 (1983).
- Fernandes, Y., Rampersad, M., Gerlai, R. Embryonic alcohol exposure impairs the dopaminergic system and social behavioral responses in adult zebrafish. Int J Neuropsychopharmacol. 18 (6), pyu089(2015).
- Fernandes, Y., Gerlai, R. Long-term behavioral changes in response to early developmental exposure to ethanol in zebrafish. Alcohol Clin Exp Res. 33 (4), 601-609 (2009).
- Fernandes, Y., Rampersad, M., Jones, E. M., Eberhart, J. K. Social deficits following embryonic ethanol exposure arise in post-larval zebrafish. Addict Biol. 24 (5), 898-907 (2019).
- Buske, C., Gerlai, R. Early embryonic ethanol exposure impairs shoaling and the dopaminergic and serotoninergic systems in adult zebrafish. Neurotoxicol Teratol. 33 (6), 698-707 (2011).
- Pannia, E., Tran, S., Rampersad, M., Gerlai, R. Acute ethanol exposure induces behavioural differences in two zebrafish (Danio rerio) strains: A time course analysis. Behav Brain Res. 259, 174-185 (2014).
- Westerfield, M. The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio)/Monte Westerfield. , University of Oregon Press. Eugene, OR. (2007).
- Fernandes, Y., Rampersad, M., Eberhart, J. K. Social behavioral phenotyping of the zebrafish casper mutant following embryonic alcohol exposure. Behav Brain Res. 356, 46-50 (2019).
- Fernandes, Y., Rampersad, M., Gerlai, R. Impairment of social behaviour persists two years after embryonic alcohol exposure in zebrafish: A model of fetal alcohol spectrum disorders. Behav Brain Res. 292, 102-108 (2015).
- Fernandes, Y., Buckley, D. M., Eberhart, J. K. Diving into the world of alcohol teratogenesis: a review of zebrafish models of fetal alcohol spectrum disorder. Biochem Cell Biol. 96 (2), 88-97 (2018).
- Park, J. S., et al. Innate color preference of zebrafish and its use in behavioral analyses. Mol Cells. 39 (10), 750-755 (2016).
- Gerlai, R., et al. Forward genetic screening using behavioral tests in zebrafish: a proof of concept analysis of mutants. Behav Genet. 47 (1), 125-139 (2017).
- Scerbina, T., Chatterjee, D., Gerlai, R. Dopamine receptor antagonism disrupts social preference in zebrafish: a strain comparison study. Amino Acids. 43 (5), 2059-2072 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유