Method Article
Modellazione dei disturbi dello spettro alcolico fetale nel pesce zebra per caratterizzare l'impatto di un ambiente embrionale avverso sul comportamento sociale adulto
In questo articolo
Riepilogo
L'obiettivo dell'attuale protocollo è quello di delineare i passaggi necessari per stabilire e utilizzare un test di preferenza sociale per il pesce zebra adulto e dimostrare che può essere utilizzato per caratterizzare i difetti sociali indotti dall'etanolo.
Abstract
I disturbi dello spettro alcolico fetale (FASD) descrivono tutti i difetti alla nascita indotti dall'alcol. Difetti alla nascita come deficit di crescita, anomalie craniofacciali, comportamentali e cognitive sono associati alla FASD. Le difficoltà sociali sono anomalie comportamentali comuni associate alla FASD e spesso provocano gravi problemi di salute. I modelli animali sono fondamentali per comprendere i meccanismi responsabili dei difetti sociali indotti dall'etanolo. I pesci zebra sono vertebrati sociali che producono uova trasparenti fecondate esternamente; queste caratteristiche forniscono ai ricercatori una procedura precisa ma semplice per creare il fenotipo FASD e un comportamento innato che può essere sfruttato per modellare i deficit sociali associati alla FASD. Pertanto, i pesci zebra sono ideali per caratterizzare i deficit sociali della FASD. L'obiettivo dell'attuale protocollo è quello di fornire all'utente un semplice test comportamentale che possa essere utilizzato per caratterizzare le conseguenze di un ambiente negativo all'inizio dello sviluppo e gli effetti che può avere sul comportamento sociale in età adulta. Il protocollo può essere utilizzato per caratterizzare l'effetto che le mutazioni o i teratogeni hanno sul comportamento sociale degli adulti. Il protocollo qui delineato dimostra come caratterizzare il comportamento sociale dei singoli pesci durante un saggio sociale di 20 minuti. Inoltre, i dati ottenuti utilizzando l'attuale protocollo forniscono la prova che il protocollo può essere utilizzato per caratterizzare gli effetti dei difetti sociali indotti dall'etanolo embrionale negli zebrafish adulti.
Introduzione
L'esposizione prenatale all'alcol può portare a una varietà di difetti alla nascita noti collettivamente come disturbi dello spettro alcolico fetale (FASD)1. Il comportamento alterato, come le difficoltà sociali, sono difetti alla nascita comuni associati alla FASD 2,3. Sfortunatamente, le difficoltà sociali spesso si traducono in gravi problemi di salute mentale4, che possono influire negativamente sulla qualità della vita delle persone con FASD. Pertanto, è fondamentale comprendere i meccanismi responsabili dei difetti sociali indotti dall'etanolo.
I pesci zebra hanno caratteristiche biologiche e comportamentali che li rendono adatti a far progredire la nostra comprensione dei meccanismi responsabili dei difetti sociali indotti dall'etanolo. Ad esempio, il pesce zebra produce grandi quantità di uova trasparenti fecondate esternamente; queste caratteristiche biologiche consentono ai ricercatori di creare facilmente fenotipi FASD precisi e replicabili5. Per esporre gli embrioni all'etanolo a 24 ore dopo la fecondazione (hpf), è sufficiente utilizzare un microscopio da dissezione per esaminare l'ovulo trasparente e mettere in scena l'embrione sulla base di lavori precedentemente pubblicati come Kimmel et al.6, quindi posizionare l'ovulo nella concentrazione di etanolo desiderata per la durata desiderata. Poiché il corion è una debole barriera all'alcol7, l'etanolo bagna facilmente l'embrione. Per fermare l'esposizione, è sufficiente rimuovere le uova dalla soluzione di etanolo. Oltre a fornire ai ricercatori un metodo semplice ma accurato per creare fenotipi di FASD, il pesce zebra consente anche ai ricercatori di fare confronti genetici con gli esseri umani perché il 70% dei geni umani ha un ortologo del pesce zebra, quindi sono uno strumento prezioso per comprendere i geni correlati alle malattie umane8. Inoltre, a differenza di altri modelli animali, il pesce zebra forma gruppi sociali9 chiamati banchi10. Il comportamento di Shoaling può essere utilizzato per caratterizzare gli effetti che l'esposizione all'etanolo embrionale ha sul comportamento sociale11. Inoltre, nel pesce zebra una risposta sociale può essere suscitata utilizzando stimoli sociali controllati dal computer12 o uno stimolo sociale dal vivo13.
Lavori precedenti hanno caratterizzato la risposta sociale del pesce zebra adulto nei gruppi14, tuttavia una limitazione di questo approccio è l'incapacità di correlare il comportamento di un singolo pesce con una misura specifica come i cambiamenti nei livelli di neurotrasmettitore11. Il seguente protocollo darà agli utenti la possibilità di caratterizzare il comportamento sociale di un singolo pesce zebra adulto. Poiché il comportamento sociale viene acquisito per i singoli pesci, gli utenti del protocollo possono ora correlare il profilo comportamentale acquisito di ciascun pesce con un risultato dipendente. Ad esempio, lavori precedenti hanno dimostrato che l'esposizione all'etanolo embrionale compromette la risposta dopaminergica a uno stimolo sociale11. Mentre i dati mostrati qui hanno utilizzato l'esposizione all'etanolo embrionale come variabile indipendente, gli utenti del protocollo possono caratterizzare gli effetti che altri trattamenti farmacologici o mutazioni genetiche hanno sul comportamento sociale. Inoltre, gli utenti del protocollo non si limitano a esaminare come i trattamenti embrionali alterano il comportamento, ma possono anche determinare come i trattamenti farmacologici acuti nel pesce zebra adulto influiscono sul comportamento sociale15.
Protocollo
Tutti i metodi qui descritti sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) dell'Università del South Dakota.
1. Stabulazione, cura ed esposizione all'etanolo embrionale del pesce zebra
- Allevare e allevare il pesce zebra come descritto16.
- Esposizione all'etanolo
- Scegliere lo stadio di sviluppo appropriato in cui condurre l'esposizione all'etanolo. In questo protocollo gli embrioni sono stati esposti a etanolo a 24 hpf.
- Mettere le uova in etanolo all'1,0% in volume/volume per 2 oree 15. Un rapporto di 1 uovo per mL di EM è una buona pratica. In particolare, posizionare gli embrioni in 50 ml di terreno embrionale (EM; vedere Westerfield16 per la ricetta EM), quindi rimuovere 500 μL di EM e sostituirli con 500 μL di etanolo.
- Dopo l'esposizione all'etanolo, allevare gli embrioni come descritto17. Analizza il comportamento sociale quando i pesci hanno 16 settimane.
2. Randomizzazione e configurazione del serbatoio
- Utilizzando un generatore di sequenze casuali online, randomizza tutti gli studi a priori per condurre i saggi comportamentali. Assicurati che il lato dello stimolo e i gruppi di trattamento varino in modo casuale.
- Per evitare fattori confondenti come l'ora del giorno o il giorno del test, iniziare e terminare il test comportamentale alla stessa ora ogni giorno ed eseguire il test comportamentale in giorni consecutivi fino a quando tutti i pesci sperimentali non sono stati testati.
- Per questo test (Figura 1), utilizzare un serbatoio da 37 L (50 cm x 25 cm x 30 cm, L x P x A) con serbatoi da 1,4 L posizionati all'esterno lungo la larghezza del serbatoio come descritto in precedenza17.
- Rivesti la parte posteriore e il fondo della vasca da 37 L con plastica ondulata bianca per aumentare il contrasto tra i pesci sperimentali e lo sfondo per migliorare il tracciamento video.
- Posizionare la plastica ondulata sulla parete esterna delle vasche da 1,4 L per aumentare il contrasto dello stimolo sociale per i pesci sperimentali. Infine, posizionare della plastica ondulata bianca tra i serbatoi da 1,4 L e i serbatoi da 37 L; Questa barriera opaca viene utilizzata per impedire ai pesci sperimentali di visualizzare lo stimolo sociale durante l'assuefazione.
- Posiziona la fotocamera a una distanza sufficiente per catturare l'intera lunghezza della vasca da 37 L più metà delle vasche da 1,4 L e tracciare con precisione i pesci sperimentali adulti.
NOTA: Vedere quale lato contiene lo stimolo garantisce che i ricercatori abbiano etichettato correttamente le zone di tracciamento e fornisce ridondanza come backup. - Se non viene utilizzato l'inseguimento a infrarossi, assicurarsi di illuminare il serbatoio da 37 L. Utilizzare tutte le luci per cappe per acquari disponibili in commercio con una lampada a spettro completo T8 da 15 W.
NOTA: Se vengono allestite più arene, utilizzare cappe per acquari identiche con lampade identiche.
3. Conduzione del saggio sociale
- Iniziare riempiendo il serbatoio da 37 L utilizzato per il test comportamentale con acqua identica all'acqua utilizzata nel rack di alloggiamento. Assicurarsi che la temperatura dell'acqua sia compresa tra 2 °C e la cremagliera dell'alloggiamento.
- A fine giornata svuotare il serbatoio da 37 L. Inizia ogni giornata di test con acqua fresca. Assicurarsi che il livello dell'acqua nel serbatoio da 37 L e il livello dell'acqua nei serbatoi da 1,4 L siano identici. Se la temperatura dell'ambiente non mantiene l'acqua nel serbatoio da 37 L a 28,5 °C 2 °C, sostituire l'acqua con acqua calda a 28,5 °C.
- Successivamente, imposta le zone di interesse. Consultare il software di tracciamento manuale dell'utente preferito per creare le zone. In questo protocollo, lungo la lunghezza del serbatoio da 37 L in alto e in basso, è stato utilizzato un metro a nastro per segnare incrementi di 5 cm. Dato che la vasca di prova è di 50 cm, incrementi di 5 cm portano a 10 zone di 5 cm ciascuna.
- Utilizzando come riferimento i segni tracciati sul serbatoio da 37 L, utilizzare il software per costruire le zone collegando il punto di 5 cm in alto al corrispondente punto di 5 cm in basso. Inoltre, crea una zona lungo la parte inferiore e lungo lo stimolo. Personalizza le zone di interesse.
- Utilizzare il software di tracciamento di questo protocollo per misurare la distanza da una zona e la durata trascorsa nella zona. In questo protocollo sono state utilizzate 12 zone.
- Quantifica il tempo trascorso nelle zone da 1 a 10 e la distanza dallo stimolo e dal fondo come Zona 1, come la zona più vicina allo stimolo mentre la Zona 10 è la più lontana dallo stimolo.
- Successivamente, seleziona i due maschi e le due femmine che verranno utilizzati per lo stimolo sociale. La migliore pratica sarebbe quella di utilizzare maschi e femmine della stessa coorte dei pesci sperimentali. Se ciò non è possibile, cerca di trovare pesci che corrispondano al ceppo, all'età e alle dimensioni del pesce sperimentale.
- Trasferire i pesci sperimentali dalla vasca di stabulazione all'arena di prova (vasca da 37 L). Usa una rete per catturare i pesci nell'acquario di alloggiamento. Metti la rete con il pesce dentro, in un contenitore con acqua di pesce.
NOTA: L'utilizzo di questo approccio ridurrà lo stress sui pesci sperimentali durante lo spostamento tra le vasche. - Posiziona il pesce sperimentale al centro dell'arena di prova.
- Una volta che le impostazioni di rilevamento sono soddisfacenti in base al software scelto dall'utente (vedere il manuale dell'utente), iniziare la prova di 20 minuti. Durante i primi 10 minuti, lasciare in posizione la barriera opaca tra il serbatoio da 37 L e quello da 1,4 L. Ciò impedirà ai pesci sperimentali di vedere lo stimolo sociale, costituito da due maschi e due femmine di zebrafish, e consentirà ai pesci di acclimatarsi all'arena di test13,17.
- Dopo 10 minuti rimuovere con cura le barriere opache tirandole da dietro la vasca; Questo permetterà ai pesci sperimentali di vedere lo stimolo sociale.
- Utilizzare il software di tracciamento per tracciare e quantificare il comportamento dei pesci sperimentali 11, 12, 17 in base alle preferenze dell'utente e al manuale del software. Nel protocollo attuale, quantificare la distanza dallo stimolo sociale e dal fondo della vasca, nonché il tempo trascorso in tutte le zone.
- Analizza i dati utilizzando gli strumenti di analisi dei dati tradizionali.
Risultati
La Figura 2 è stata modificata da Fernandes et al.17 e mostra che l'esposizione all'etanolo embrionale attenua la risposta di shoaling esaminando la distanza dallo stimolo. I dati in Figura 2 rappresentano la distanza dallo stimolo sociale durante la prova di 20 minuti. L'asse Y mostra la distanza in centimetri mentre l'asse X mostra la prova di 20 minuti suddivisa in intervalli di 1 minuto. La barra nera lungo l'asse X rappresenta il momento in cui le barriere opache sono state rimosse e lo stimolo sociale è visibile al pesce di prova. In tutti i gruppi inizialmente c'è una rapida diminuzione verso lo stimolo sociale una volta che è reso visibile, che può essere determinato dalla forte diminuzione della distanza tra i minuti 9 e 10, tuttavia, mentre i pesci di controllo rimangono molto vicini allo stimolo sociale l'alcol trattato non lo è; Ciò suggerisce che l'esposizione all'etanolo embrionale influisce sul comportamento sociale degli adulti12,18.
La Figura 3 è stata modificata da Fernandes et al.17 e utilizza i dati raccolti misurando la distanza dallo stimolo per mostrare ulteriormente l'effetto che l'esposizione all'etanolo embrionale ha sulla risposta allo shoaling. I dati nella Figura 3 rappresentano la riduzione della distanza verso lo stimolo sociale una volta che è visibile. Calcolare la riduzione media della distanza dallo stimolo; La distanza media dallo stimolo durante il periodo di stimolo (quando lo stimolo è visibile) è stata sottratta dalla distanza media dallo stimolo durante l'assuefazione (quando lo stimolo sociale non è visibile), quindi un valore negativo maggiore rappresenta una risposta sociale più forte.
La Figura 4 mostra il tempo trascorso nelle zone rispetto alla distanza dallo stimolo. La Figura 4 è stata modificata da Fernandes et al.17. La Figura 4A mostra la quantità di tempo (asse Y) che i pesci trascorrono in ciascuna zona (asse X) mentre lo stimolo è visibile. Mentre i pesci di tutti i gruppi sembrano mostrare una preferenza per la zona più vicina al controllo dello stimolo sociale, i pesci trascorrono quasi il doppio del tempo nella zona 1 rispetto ai pesci trattati con alcol (Figura 4B). La Figura 4C mostra che l'esposizione embrionale all'etanolo non ha compromesso la mobilità, poiché non vi era alcuna differenza tra i gruppi tra le zone. Infine, la Figura 4D mostra che in assenza di uno stimolo sociale i pesci non trascorrono del tempo nella zona più vicina allo stimolo sociale. Pertanto, i risultati mostrano che i pesci di controllo si avvicinano e rimangono molto vicini allo stimolo sociale quando sono visibili, mentre i pesci trattati con etanolo non lo fanno. Inoltre, i dati mostrati nella Figura 2 e nella Figura 4C suggeriscono che l'esposizione embrionale all'etanolo non compromette la capacità dei pesci di vedere lo stimolo sociale (Figura 2) o di muoversi (Figura 4C), fornendo quindi una forte evidenza che l'esposizione all'etanolo embrionale compromette il comportamento sociale nel pesce zebra adulto.

Figura 1: Schema dell'apparato comportamentale. Una vasca da 37 litri è stata utilizzata per analizzare il comportamento sociale del pesce zebra adulto (denominato ZT140) con e senza esposizione embrionale all'etanolo. Questa cifra è stata modificata da Fernandes et al.17. Clicca qui per visualizzare una versione più grande di questa figura.
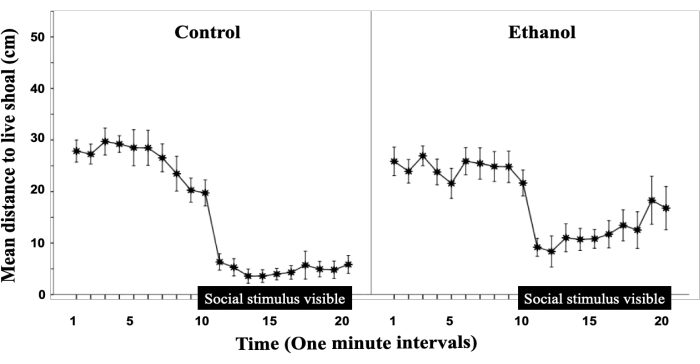
Figura 2: L'esposizione embrionale all'etanolo attenua il comportamento sociale nel pesce zebra adulto. Distanza media tra il pesce sperimentale adulto e il banco vivo tracciata per intervalli di 1 minuto della sessione comportamentale di 20 minuti. Vengono visualizzati la media ± il SEM. Controllo (n = 12); 1% di etanolo (EtOH; n = 11). La barra orizzontale sopra l'asse X, da 10 a 20 minuti, raffigura una linea temporale durante la quale il banco vivo è visibile ai soggetti sperimentali. La concentrazione di alcol è mostrata sopra i grafici. Questa cifra è stata modificata da Fernandes et al.17. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: I pesci trattati con alcol sono significativamente più lontani dal banco vivo. Le barre rappresentano la differenza tra la distanza dei pesci dal banco vivo prima e dopo che il banco vivo è visibile. Valori negativi più grandi suggeriscono una risposta più forte ai conspecifici. Vengono visualizzati la media ± il SEM. Vengono visualizzati la media ± il SEM. Controllo (n = 12); 1% di etanolo (EtOH; n = 11). Questa cifra è stata modificata da Fernandes et al.17. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: L'esposizione all'etanolo embrionale altera la durata del tempo trascorso nella zona 1 solo quando il banco vivo è visibile. (A) Le barre rappresentano il tempo trascorso in tutte le 10 zone durante la presentazione dello stimolo. (B) Le barre rappresentano il tempo trascorso nella zona 1 durante la presentazione dello stimolo. La zona 1 è la zona più vicina al banco vivo, mentre la zona 10 è la più lontana dal banco vivo. Si noti la differenza significativa nella quantità di tempo che i pesci di controllo trascorrono nella zona. (C) Le barre rappresentano la percentuale media di tempo trascorso in tutte le zone durante l'assuefazione, i primi 10 minuti. (D) Le barre rappresentano il tempo trascorso nella zona 1 durante l'assuefazione. Vengono visualizzati la media ± il SEM. Le dimensioni del campione sono le seguenti: Controllo (n = 12); etanolo (EtOH; n = 11). Questa cifra è stata modificata da Fernandes et al.17. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il pesce zebra ha una serie di caratteristiche biologiche e comportamentali che lo rendono un organismo molto attraente per la ricerca che coinvolge i geni, l'ambiente e il comportamento 5,19. Questo protocollo fornisce all'utente finale una guida relativamente semplice per valutare il comportamento sociale, diversi modi per quantificare il comportamento sociale e ha il potenziale per collegare le risposte comportamentali dei singoli pesci con trattamenti come l'esposizione all'etanolo embrionale, le mutazioni genetiche o altre sostanze farmacologiche.
Per valutare il comportamento sociale nel pesce zebra adulto, seguire attentamente questo protocollo insieme al manuale dell'utente del software di tracciamento scelto. Per costruire l'arena di prova, è sufficiente un serbatoio da 37 litri con coperchio e plastica ondulata leggera, due serbatoi più piccoli per lo stimolo sociale e una macchina fotografica; La maggior parte di questi articoli può essere acquistata nei negozi di animali e in qualsiasi rivenditore di grandi dimensioni. Quando un singolo pesce zebra viene presentato con un gruppo di pesci zebra, il comportamento naturale del singolo pesce zebra è quello di ridurre la distanza dal gruppo aumentando il tempo trascorso in prossimità del gruppo19, questo comportamento è chiamato risposta di branco19. La risposta di branco è un comportamento sociale che può essere caratterizzato in due modi: in primo luogo, quando lo stimolo sociale è visibile misura la distanza tra lo stimolo sociale e il singolo pesce12 e in secondo luogo misura il tempo trascorso nella zona più vicina allo stimolo sociale quando è visibile. Avere la capacità di quantificare il tempo che i pesci zebra trascorrono in una zona di 5 cm quando lo stimolo sociale è visibile fornisce una forte evidenza della risposta sociale dato che questi pesci in media sono lunghi circa 4 cm.
Dividere la vasca di 50 cm in aree di 10,5 cm aiuta nell'analisi statistica perché la probabilità che il pesce di prova si trovi in qualsiasi zona è la stessa. A prima vista, avere due misure per lo stesso risultato sembra ridondante. Tuttavia, la ridondanza può fornire una convalida. Inoltre, le misure di distanza e durata durante l'assuefazione possono essere utilizzate per determinare se un trattamento influisce sulla vista o sul movimento. Questo protocollo utilizzava un software di tracciamento automatizzato disponibile in commercio13,18, ma è suscettibile di altri sistemi di tracciamento o anche di tracciamento manuale da parte di un osservatore addestrato.
Indipendentemente dal software di tracciamento utilizzato, ci sono passaggi critici da adottare per ottimizzare il tracciamento. Innanzitutto, seleziona uno sfondo che fornisca un contrasto significativo rispetto al pesce registrato. Il pesce zebra di tipo selvatico ha strisce orizzontali dorate e blu20; Hanno anche mosaici di xantofori gialli, iridofori argentei o blu e melanofori neri20. Così, quando si caratterizza il comportamento di AB, i pesci selvatici usano uno sfondo bianco 12,13,17, mentre quando si caratterizza il comportamento sociale di un pesce zebra casper che manca di pigmento usano uno sfondo nero17. In secondo luogo, assicurati che ci sia un'illuminazione sufficiente per seguire i pesci sperimentali. Se sono presenti più arene di tracciamento, assicurarsi che l'illuminazione sia identica tra le arene. Un altro passo fondamentale è assicurarsi che il livello dell'acqua nella vasca da 37 L corrisponda al livello dell'acqua nelle vasche da 1,4 L, per garantire che i pesci di prova non possano nuotare in aree che non hanno lo stimolo sociale. Inoltre, assicurarsi che il serbatoio da 1,4 L sia nell'inquadratura, durante la registrazione dei video; In questo modo si fornirà un backup nel caso in cui sia necessaria la codifica manuale dei dati o la verifica del lato stimolo.
I problemi tipici all'interno del protocollo sono il soggetto che non viene tracciato correttamente, un periodo di assuefazione insufficiente e un breve ritardo quando si tirano le barriere opache quando sono allestite più arene. Per evitare che il soggetto non venga tracciato correttamente, assicurarsi che ci sia un contrasto sufficiente tra il pesce e lo sfondo, come accennato in precedenza, e che vengano seguite le linee guida del software. Inoltre, se il software dell'utente consente il tracciamento a infrarossi, ciò può alleviare i problemi associati al contrasto. Mentre 10 minuti possono sembrare un tempo lungo per un periodo di assuefazione, il nostro lavoro non pubblicato suggerisce che la riduzione del tempo di assuefazione ha un impatto negativo sul protocollo. Infine, se la barriera opaca tra i serbatoi da 37 L e 1,4 L viene tirata manualmente e se vengono allestite più arene, tutte le barriere non possono essere tirate esattamente nello stesso momento, a meno che non siano più persone a tirare le barriere. In alternativa, se il test è condotto da una sola persona, è necessario controbilanciare le barriere dell'arena che vengono rimosse per prime.
Sebbene il protocollo sia semplice, il costo del software di tracciamento e il tempo extra necessario per caratterizzare i pesci individualmente sono potenziali insidie. Questo protocollo utilizzava un software disponibile in commercio per tracciare il comportamento dei pesci sperimentali, evitando distorsioni dell'osservatore e aumentando la produttività allestendo più arene e registrando così più pesci. Anche se in questo protocollo è stato utilizzato un software commerciale, sono disponibili altri software di tracciamento, incluso il software gratuito. L'utilizzo di questo protocollo con il tracciamento scelto dall'utente finale riprodurrà il test sociale. In questo protocollo è stato caratterizzato il comportamento di un singolo pesce; Altri si sono concentrati sull'esame di gruppi di zebrafish14 , che è un modo per affrontare la potenziale insidia della caratterizzazione di un pesce alla volta. In alternativa, come accennato in precedenza, l'utilizzo di più arene di test contemporaneamente può aumentare la produttività mantenendo la capacità di assegnare un profilo comportamentale a un singolo pesce. Mantenere la capacità di correlare un profilo comportamentale di un singolo pesce è importante perché dà al ricercatore l'opportunità di cercare la variabilità all'interno di un gruppo di trattamento. Sebbene l'esposizione all'etanolo embrionale sia stata utilizzata come variabile indipendente nei dati rappresentativi, le future applicazioni della tecnica delineata nell'attuale protocollo non si limitano alla semplice caratterizzazione degli effetti dell'esposizione all'etanolo embrionale sul comportamento sociale. Ad esempio, si può determinare l'effetto che le mutazioni genetiche21 o altri trattamenti farmacologici22 hanno sul comportamento sociale. Inoltre, oltre all'esposizione all'etanolo embrionale, i lavori futuri possono caratterizzare l'effetto che altri teratogeni hanno sul comportamento sociale. Pertanto, l'attuale protocollo è utile a qualsiasi ricercatore interessato a capire come i geni e/o l'ambiente influenzano il comportamento sociale.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Il finanziamento per sostenere questa ricerca è stato fornito dal National Institutes of Health (NIH)/National Institute on Alcohol Abuse (NIAAA) [R00AA027567] a Y.F.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.4-l ZT140 Aquaneering tanks | Aquaneering | ZT140 | Tanks for social stimulus |
| Aqueon 20" Deluxe Fluorescent Full Hood aquarium light | https://www.petco.com/shop/en/petcostore/product/aqueon-aquarium-black-24-fluorescent-deluxe-full-hood-215740 | Light for the 37-I tank | |
| Aqueon Standard Open-Glass Glass Aquarium Tank, 10 Gallon | https://www.petco.com/shop/en/petcostore/product/aga-10g-20x10x12bk-tank-170917 | 37-l tank for the social assay | |
| Ethanol | Fisher Scienticfic | BP28184 | |
| Ethovision XT tracking system | https://www.noldus.com/ethovision-xt | ||
| R-Capable Color Basler GigE Camera | https://www.noldus.com/ethovision-xt | ||
| White corrugated plastic | https://www.homedepot.com/p/Coroplast-48-in-x-96-in-x-0-157-in-4mm-White-Corrugated-Twinwall-Plastic-Sheet-CP4896S/205351385 | Plastic to line the back and the bottom of the 37-I tank and back of the tanks used for the social stimulus |
Riferimenti
- Institue Med. Fetal alcohol syndrome: diagnosis, epidemiology, prevention, and treatment. , National Academies Press. Washington, D.C. (1996).
- Abel, E. L. Fetal alcohol syndrome and fetal alcohol effects. , Springer. (1984).
- Stevens, S. A., Clairman, H., Nash, K., Rovet, J. Social perception in children with fetal alcohol spectrum disorder. Child Neuropsychol. 23 (8), 980-993 (2017).
- Streissguth, A. P., et al. Risk factors for adverse life outcomes in fetal alcohol syndrome and fetal alcohol effects. J Dev Behav Pediatr. 25 (4), 228-238 (2004).
- Lovely, C. B., Fernandes, Y., Eberhart, J. K. Fishing for fetal alcohol spectrum disorders: zebrafish as a model for ethanol teratogenesis. Zebrafish. 13 (5), 391-398 (2016).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Lovely, C. B., Nobles, R. D., Eberhart, J. K. Developmental age strengthens barriers to ethanol accumulation in zebrafish. Alcohol. 48 (6), 595-602 (2014).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Norton, W., Bally-Cuif, L. Adult zebrafish as a model organism for behavioural genetics. BMC Neurosci. 11 (1), 90(2010).
- Pitcher, T. J. Heuristic definitions of fish shoaling behaviour. Animal Behav. 31 (2), 611-613 (1983).
- Fernandes, Y., Rampersad, M., Gerlai, R. Embryonic alcohol exposure impairs the dopaminergic system and social behavioral responses in adult zebrafish. Int J Neuropsychopharmacol. 18 (6), pyu089(2015).
- Fernandes, Y., Gerlai, R. Long-term behavioral changes in response to early developmental exposure to ethanol in zebrafish. Alcohol Clin Exp Res. 33 (4), 601-609 (2009).
- Fernandes, Y., Rampersad, M., Jones, E. M., Eberhart, J. K. Social deficits following embryonic ethanol exposure arise in post-larval zebrafish. Addict Biol. 24 (5), 898-907 (2019).
- Buske, C., Gerlai, R. Early embryonic ethanol exposure impairs shoaling and the dopaminergic and serotoninergic systems in adult zebrafish. Neurotoxicol Teratol. 33 (6), 698-707 (2011).
- Pannia, E., Tran, S., Rampersad, M., Gerlai, R. Acute ethanol exposure induces behavioural differences in two zebrafish (Danio rerio) strains: A time course analysis. Behav Brain Res. 259, 174-185 (2014).
- Westerfield, M. The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio)/Monte Westerfield. , University of Oregon Press. Eugene, OR. (2007).
- Fernandes, Y., Rampersad, M., Eberhart, J. K. Social behavioral phenotyping of the zebrafish casper mutant following embryonic alcohol exposure. Behav Brain Res. 356, 46-50 (2019).
- Fernandes, Y., Rampersad, M., Gerlai, R. Impairment of social behaviour persists two years after embryonic alcohol exposure in zebrafish: A model of fetal alcohol spectrum disorders. Behav Brain Res. 292, 102-108 (2015).
- Fernandes, Y., Buckley, D. M., Eberhart, J. K. Diving into the world of alcohol teratogenesis: a review of zebrafish models of fetal alcohol spectrum disorder. Biochem Cell Biol. 96 (2), 88-97 (2018).
- Park, J. S., et al. Innate color preference of zebrafish and its use in behavioral analyses. Mol Cells. 39 (10), 750-755 (2016).
- Gerlai, R., et al. Forward genetic screening using behavioral tests in zebrafish: a proof of concept analysis of mutants. Behav Genet. 47 (1), 125-139 (2017).
- Scerbina, T., Chatterjee, D., Gerlai, R. Dopamine receptor antagonism disrupts social preference in zebrafish: a strain comparison study. Amino Acids. 43 (5), 2059-2072 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon