Method Article
对斑马鱼的胎儿酒精谱系障碍进行建模,以表征不良胚胎环境对成人社交行为的影响
摘要
当前方案的目标是概述建立和使用成年斑马鱼社会偏好测定的必要步骤,并证明它可用于表征乙醇诱导的社会缺陷。
摘要
胎儿酒精谱系障碍 (FASD) 描述了所有酒精引起的出生缺陷。出生缺陷,如生长缺陷、颅面、行为和认知异常,与 FASD 有关。社交困难是与 FASD 相关的常见行为异常,通常会导致严重的健康问题。动物模型对于理解导致乙醇诱导的社会缺陷的机制至关重要。斑马鱼是群居脊椎动物,会产生外部受精的透明卵;这些特征为研究人员提供了一种精确而简单的程序来创建 FASD 表型和一种先天行为,可用于模拟与 FASD 相关的社交缺陷。 因此,斑马鱼是表征 FASD 社交缺陷的理想选择。当前协议的目标是为用户提供一种简单的行为分析,可用于描述发育早期负面环境的后果及其对成年期社会行为的影响。该方案可用于表征突变或致畸剂对成人社会行为的影响。此处概述的协议演示了如何在 20 分钟的社会分析期间表征个体鱼的社会行为。此外,使用当前方案获得的数据提供了证据,表明该方案可用于表征胚胎乙醇诱导的成年斑马鱼社会缺陷的影响。
引言
产前酒精暴露会导致各种出生缺陷,统称为胎儿酒精谱系障碍 (FASD)1。行为受损,例如社交困难,是与 FASD 相关的常见出生缺陷 2,3。不幸的是,社交困难经常导致严重的心理健康问题4,这会对 FASD 患者的生活质量产生不利影响。因此,了解导致乙醇诱导的社会缺陷的机制至关重要。
斑马鱼具有生物学和行为特征,这使得它们非常适合促进我们对导致乙醇诱导的社会缺陷的机制的理解。例如,斑马鱼会产生大量透明的外部受精卵;这些生物学特性使研究人员能够轻松创建精确且可复制的 FASD 表型5。要在受精后 24 小时 (hpf) 将胚胎暴露在乙醇中,只需使用解剖显微镜检查透明鸡蛋并根据先前发表的工作(如 Kimmel 等人)6 对胚胎进行分期,然后将鸡蛋置于所需的乙醇浓度中所需的持续时间。由于绒毛膜是酒精的弱屏障7,因此乙醇很容易沐浴胚胎。要停止暴露,只需从乙醇溶液中取出鸡蛋即可。除了为研究人员提供一种简单而准确的方法来创建 FASD 表型外,斑马鱼还允许研究人员与人类进行基因比较,因为 70% 的人类基因具有斑马鱼直系同源物,因此它们是了解人类疾病相关基因的宝贵工具8。此外,与其他动物模式不同,斑马鱼形成称为浅滩10 (shoals) 的社会群体9 (social groups)。浅滩行为可用于描述胚胎乙醇暴露对社会行为的影响11。此外,在斑马鱼中,可以通过使用计算机控制的社会刺激12(computer controlled social stimulis)或活体社会刺激13(live social stimulus)来引起社会反应。
以前的工作已经表征了成年斑马鱼在群体中的社会反应14,但这种方法的一个局限性是无法将个体鱼的行为与特定措施(例如神经递质水平的变化)相关联11。以下协议将使用户能够描述个体成年斑马鱼的社会行为。由于社会行为是针对个体鱼获得的,因此该协议的用户现在可以将每条鱼的获得行为特征与依赖结果相关联。例如,以前的研究表明,胚胎乙醇暴露会损害对社会刺激的多巴胺能反应11。虽然此处显示的数据使用胚胎乙醇暴露作为自变量,但方案用户可以描述其他药物治疗或基因突变对社会行为的影响。此外,方案使用者不仅限于检查胚胎治疗如何改变行为,还可以确定成年斑马鱼的急性药物治疗如何影响社会行为15。
研究方案
此处描述的所有方法均已获得南达科他大学机构动物护理和使用委员会 (IACUC) 的批准。
1. 斑马鱼的饲养、护理和胚胎乙醇暴露
- 按照说明饲养和繁殖斑马鱼16.
- 乙醇暴露
- 选择合适的发育阶段进行乙醇暴露。在该方案中,胚胎暴露于 24 hpf 的乙醇中。
- 将鸡蛋放入 1.0% 乙醇体积/体积中 2 小时15。每 mL EM 的比例为 1 个鸡蛋是很好的做法。具体来说,将胚胎置于 50 mL 胚胎培养基中(EM;有关 EM 配方,请参见 Westerfield16 ),然后去除 500 μL EM 并替换为 500 μL 乙醇。
- 乙醇暴露后,按说明饲养胚胎17.检测鱼 16 周龄时的社会行为。
2. 随机化和水箱设置
- 使用在线随机序列生成器,先 验 地将所有试验随机化以进行行为分析。确保刺激侧和治疗组随机变化。
- 为避免任何混杂因素,例如一天中的时间或测试日期,每天在同一时间开始和结束行为测试,并连续几天进行行为测试,直到所有实验鱼都通过测试。
- 对于该测定(图 1),使用 37 L 罐(50 cm x 25 cm x 30 cm,长 x 宽 x 高),如前所述 17 沿罐的宽度放置在外部的1.4 L 罐。
- 在 37 L 水箱的背面和底部铺上白色波纹塑料,以增加实验鱼与背景之间的对比度,从而改善视频跟踪。
- 将波纹塑料放在 1.4 L 水箱的外壁上,以增加实验鱼的社会刺激的对比度。最后,在 1.4 L 气瓶和 37 L 气瓶之间放置白色波纹塑料;这种不透明的屏障用于防止实验鱼在习惯化期间观看社会刺激。
- 将相机放置在足够远的距离,以捕捉 37 升水箱的整个长度加上 1.4 升水箱的一半,并准确跟踪成年实验鱼。
注意:查看哪一侧持有刺激可确保研究人员正确标记跟踪区域并提供冗余作为备份。 - 如果未使用红外跟踪,请确保照亮 37 L 水箱。使用任何市售的水族箱抽油烟机灯和 15 W T8 全光谱灯。
注意:如果要设置多个场馆,请使用相同的水族箱抽油烟机和相同的灯。
3. 进行社会分析
- 首先用与外壳架中使用的水相同的水填充用于行为测定的 37 L 水箱。确保水温在外壳机架的 2 °C 以内。
- 一天结束时,清空 37 L 的气瓶。每天测试开始时,请用淡水。确保 37 L 水箱中的水位与 1.4 L 水箱中的水位相同。如果房间的温度不能将 37 L 水箱中的水保持在 28.5 °C 2 °C,则用 28.5 °C 的温水代替水。
- 接下来,设置感兴趣的区域。查阅用户选择的手动跟踪软件以创建区域。在该协议中,沿着顶部和底部的 37 L 水箱的长度,使用卷尺标记 5 cm 的增量。假设测试罐为 50 厘米,则 5 厘米的增量会导致 10 个区域,每个区域为 5 厘米。
- 以 37 L 水箱上的标记为参考,使用软件通过将顶部的 5 cm 点连接到底部相应的 5 cm 点来构建区域。此外,沿着底部和刺激创建一个区域。自定义感兴趣区域。
- 使用此协议中的跟踪软件测量与区域的距离以及在该区域中花费的持续时间。在该协议中使用了 12 个区域。
- 量化在 1 到 10 区花费的时间以及与刺激和底部的距离,作为 1 区,作为最靠近刺激的区域,而 10 区距离刺激最远。
- 接下来,选择将用于社交刺激的两名男性和两名女性。最佳做法是使用与实验鱼来自同一队列的雄性和雌性。如果这是不可能的,请尝试找到与实验鱼的品系、年龄和大小相匹配的鱼。
- 将实验鱼从饲养箱转移到测试场(37 L 水箱)。使用网捕捉饲养箱中的鱼。将装有鱼的网放入装有鱼水的容器中。
注意:使用这种方法将减少在水箱之间移动时对实验鱼的压力。 - 将实验鱼放在测试场的中央。
- 根据用户选择的软件(参见用户手册)使检测设置令人满意后,开始 20 分钟的试用。在前 10 分钟内,将 37 L 气瓶和 1.4 L 气瓶之间的不透明屏障留在原位。这将阻止实验鱼看到由两只雄性和两只雌性斑马鱼组成的社会刺激,并让鱼适应测试舞台13,17。
- 10 分钟后,从水箱后面拉出不透明屏障,小心地去除它们;这将使实验鱼看到社会刺激。
- 使用跟踪软件根据用户的偏好和软件手册跟踪和量化实验鱼 11、12、17 的行为。在当前的协议中,量化与社交刺激和水箱底部的距离以及在所有区域花费的时间。
- 使用传统的数据分析工具分析数据。
结果
图 2 是从 Fernandes 等人 17 修改而来的,它表明胚胎乙醇暴露通过检查与刺激的距离来减弱浅滩反应。图 2 中的数据表示 20 分钟试验期间与社交刺激的距离。Y 轴显示以厘米为单位的距离,而 X 轴显示 20 分钟的试用,分为 1 分钟的间隔。沿 X 轴的黑条表示不透明障碍已被移除并且测试鱼可以看到社交刺激的时间。在所有组中,一旦社会刺激可见,最初就会迅速减少,这可以通过 9 到 10 分钟之间距离的急剧减少来确定,然而,虽然对照鱼仍然非常接近酒精处理的社会刺激则不是;这表明胚胎乙醇暴露会影响成人的社会行为12,18。
图 3 是从 Fernandes 等人 17 修改而来的,并使用从测量到刺激的距离中收集的数据来进一步显示胚胎乙醇暴露对浅滩反应的影响。 图 3 中的数据表示一旦社会刺激可见,与社会刺激的距离就会减少。计算刺激距离的平均减少;刺激期间(当刺激可见时)与刺激物的平均距离是从习惯化期间(当社会刺激不可见时)到刺激物的平均距离中减去的,因此较大的负值代表更强的社会反应。
图 4 显示了在区域内花费的时间与到刺激的距离。图 4 是从 Fernandes 等人 17 修改而来的。图 4A 显示了刺激可见时鱼在每个区域(X 轴)花费的时间(Y 轴)。虽然所有组的鱼似乎都表现出对最靠近社会刺激控制的区域的偏好,但与酒精处理的鱼相比,鱼在区域 1 中停留的时间几乎是其两倍(图 4B)。图 4C 显示胚胎乙醇暴露不会损害活动能力,因为各区域组间没有差异。最后,图 4D 显示,在没有社会刺激的情况下,鱼不会在最接近社会刺激的区域停留。因此,结果表明,对照鱼接近并在可见时非常接近社会刺激,而乙醇处理的鱼则不会。此外,图 2 和图 4C 中显示的数据表明,胚胎乙醇暴露不会损害鱼类看到社会刺激(图 2)或移动(图 4C)的能力,因此提供了强有力的证据,证明胚胎乙醇暴露会损害成年斑马鱼的社会行为。

图 1:行为装置示意图。 使用 37 L 水箱测定成年斑马鱼 (名为 ZT140) 在有和没有胚胎乙醇暴露时的社会行为。该图是从 Fernandes 等人 17 修改而来的。 请单击此处查看此图的较大版本。
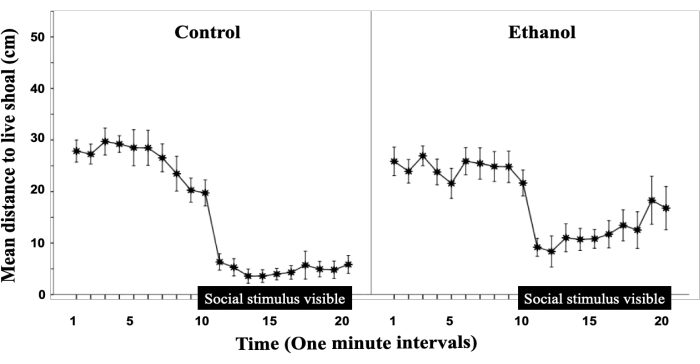
图 2:胚胎乙醇暴露会削弱成年斑马鱼的社会行为。 在 20 分钟的行为会话中,以 1 分钟的间隔绘制成年实验鱼与活浅滩之间的平均距离。显示了 SEM 的平均±。对照 (n = 12);1% 乙醇 (EtOH;n = 11)。X 轴上方的水平条,从 10 到 20 分钟,描绘了实验对象可以看到活浅滩的时间轴。酒精浓度显示在图表上方。该图是从 Fernandes 等人 17 修改而来的。 请单击此处查看此图的较大版本。

图 3:经过酒精处理的鱼离活浅滩明显更远。 条形表示在可见活浅滩之前和之后鱼与活浅滩的距离之差。较大的负值表明对同种反应更强。显示了 SEM 的平均±。显示了 SEM 的平均±。对照 (n = 12);1% 乙醇 (EtOH;n = 11)。该图是从 Fernandes 等人 17 修改而来的。 请单击此处查看此图的较大版本。

图 4:只有当活浅滩可见时,胚胎乙醇暴露才会改变在区域 1 中花费的时间。 (A) 条形表示刺激呈现期间在所有 10 个区域中花费的时间。(B) 条形表示刺激呈现期间在区域 1 中花费的时间。区域 1 是离活浅滩最近的区域,而区域 10 是离活浅滩最远的区域。请注意鱼控制鱼在区域内花费的时间的显着差异。(C) 条形表示习惯化期间在所有区域花费的平均时间百分比,前 10 分钟。(D) 条形表示习惯化期间在 1 区花费的时间。显示了 SEM 的平均±。样本量如下:对照 (n = 12);乙醇 (EtOH;n = 11)。该图是从 Fernandes 等人 17 修改而来的。 请单击此处查看此图的较大版本。
讨论
斑马鱼具有许多生物学和行为特征,使其成为一种极具吸引力的生物体,可用于涉及基因、环境和行为的研究 5,19。该协议为最终用户提供了一个相对简单的指南来检测社会行为,多种量化社会行为的方法,并有可能将个体鱼的行为反应与胚胎乙醇暴露、基因突变或其他药理学物质等治疗联系起来。
为了检测成年斑马鱼的社会行为,请仔细遵循此协议以及所选跟踪软件的用户手册。要建造测试场,只需要一个 37 升的水箱,带盖子和灯、波纹塑料、两个用于社交刺激的小水箱和一个摄像头;这些物品中的大多数都可以在宠物店和任何大型零售商处购买。当一条斑马鱼与一组斑马鱼在一起时,单条斑马鱼的自然行为是缩短与该斑马鱼群的距离,同时增加与该斑马鱼群近距离接触的时间19,这种行为称为浅滩反应19。浅滩反应是一种社会行为,可以用两种方式来表征:第一,当社会刺激可见时,测量社会刺激与单鱼之间的距离12 ,第二测量在最靠近社会刺激的区域花费的时间,当它可见时。鉴于斑马鱼的平均长度约为 4 厘米,因此能够量化斑马鱼在可见的社会刺激在 5 厘米区域内停留的时间,为社会反应提供了强有力的证据。
将 50 厘米的水箱分成 10 个 5 厘米的区域有助于统计分析,因为测试鱼在任何区域的概率都是相同的。乍一看,对同一结果使用两个度量似乎是多余的。但是,冗余可以提供验证。此外,习惯化期间的距离和持续时间测量可用于确定治疗是否影响视力或运动。该协议使用市售的自动跟踪软件13,18,但它适用于其他跟踪系统,甚至可以由训练有素的观察员进行手动跟踪。
无论使用哪种跟踪软件,都需要采取关键步骤来优化跟踪。首先,选择与正在记录的鱼相比提供显著对比度的背景。野生型斑马鱼有金色和蓝色的横条纹20;它们还有黄色黄细胞、银色或蓝色虹膜细胞和黑色黑素细胞20 的马赛克。因此,在表征 AB 野生型鱼的行为时,使用白色背景 12,13,17,另一方面,在表征缺乏色素的卡斯帕斑马鱼的社会行为时,使用黑色背景17。其次,确保有足够的照明来跟踪实验鱼。如果有多个跟踪 arena,请确保 arena 之间的光照相同。另一个关键步骤是确保 37 升水箱中的水位与 1.4 升水箱中的水位相匹配,以确保测试鱼不能在没有社会刺激的区域游泳。此外,录制视频时,请确保 1.4 L 气瓶在框架内;这样做将提供备份,以防需要手动编码数据或需要验证激励侧。
该协议中的典型问题是主题没有被正确跟踪、适应期不足以及在设置多个竞技场时拉动不透明屏障时出现短暂的时间滞后。为避免未正确跟踪拍摄对象,如前所述,确保鱼和背景之间有足够的对比度,并遵循软件的指南。此外,如果用户的软件允许红外跟踪,这可以缓解与对比度相关的问题。虽然 10 分钟对于习惯期来说似乎很长,但我们未发表的工作表明,减少习惯化时间会对协议产生负面影响。最后,如果 37 L 和 1.4 L 气瓶之间的不透明屏障是手动拉动的,并且如果设置了多个竞技场,则除非多人拉动屏障,否则所有屏障都不能同时拉动。或者,如果只有一个人进行检测,则应平衡哪些竞技场障碍首先被拉动。
尽管该协议很简单,但跟踪软件的成本和单独描述鱼特征所需的额外时间是潜在的陷阱。该协议使用市售软件来跟踪实验鱼的行为,从而通过设置多个竞技场从而记录多条鱼来避免观察者偏差并提高吞吐量。尽管本协议中使用了商业软件,但也可以使用其他跟踪软件,包括免费软件。将此协议与最终用户选择的跟踪一起使用将重现社会分析。在该协议中,表征了个体鱼的行为;其他人则专注于检查斑马鱼14 的组,这是解决一次表征一种鱼的潜在陷阱的一种方法。或者,如前所述,同时使用多个测试场可以提高吞吐量,同时保持为单条鱼分配行为特征的能力。保持关联个体鱼的行为特征的能力很重要,因为它让研究人员有机会寻找治疗组内的变异性。尽管胚胎乙醇暴露在代表性数据中用作自变量,但当前方案中概述的技术的未来应用不仅限于简单地描述胚胎乙醇暴露对社会行为的影响。例如,可以确定基因突变21 (genetic mutations)或其他药物治疗22(drug treatment22 )对社会行为的影响。 此外,除了胚胎乙醇暴露外,未来的工作还可以描述其他致畸剂对社会行为的影响。 因此,当前的协议对于任何有兴趣了解基因和/或环境如何影响社会行为的研究人员都很有用。
披露声明
作者没有什么可披露的。
致谢
美国国立卫生研究院 (NIH)/美国国家酒精滥用研究所 (NIAAA) [R00AA027567] 向 Y.F 提供了支持这项研究的资金。
材料
| Name | Company | Catalog Number | Comments |
| 1.4-l ZT140 Aquaneering tanks | Aquaneering | ZT140 | Tanks for social stimulus |
| Aqueon 20" Deluxe Fluorescent Full Hood aquarium light | https://www.petco.com/shop/en/petcostore/product/aqueon-aquarium-black-24-fluorescent-deluxe-full-hood-215740 | Light for the 37-I tank | |
| Aqueon Standard Open-Glass Glass Aquarium Tank, 10 Gallon | https://www.petco.com/shop/en/petcostore/product/aga-10g-20x10x12bk-tank-170917 | 37-l tank for the social assay | |
| Ethanol | Fisher Scienticfic | BP28184 | |
| Ethovision XT tracking system | https://www.noldus.com/ethovision-xt | ||
| R-Capable Color Basler GigE Camera | https://www.noldus.com/ethovision-xt | ||
| White corrugated plastic | https://www.homedepot.com/p/Coroplast-48-in-x-96-in-x-0-157-in-4mm-White-Corrugated-Twinwall-Plastic-Sheet-CP4896S/205351385 | Plastic to line the back and the bottom of the 37-I tank and back of the tanks used for the social stimulus |
参考文献
- Institue Med. . Fetal alcohol syndrome: diagnosis, epidemiology, prevention, and treatment. , (1996).
- Abel, E. L. . Fetal alcohol syndrome and fetal alcohol effects. , (1984).
- Stevens, S. A., Clairman, H., Nash, K., Rovet, J. Social perception in children with fetal alcohol spectrum disorder. Child Neuropsychol. 23 (8), 980-993 (2017).
- Streissguth, A. P., et al. Risk factors for adverse life outcomes in fetal alcohol syndrome and fetal alcohol effects. J Dev Behav Pediatr. 25 (4), 228-238 (2004).
- Lovely, C. B., Fernandes, Y., Eberhart, J. K. Fishing for fetal alcohol spectrum disorders: zebrafish as a model for ethanol teratogenesis. Zebrafish. 13 (5), 391-398 (2016).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn. 203 (3), 253-310 (1995).
- Lovely, C. B., Nobles, R. D., Eberhart, J. K. Developmental age strengthens barriers to ethanol accumulation in zebrafish. Alcohol. 48 (6), 595-602 (2014).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Norton, W., Bally-Cuif, L. Adult zebrafish as a model organism for behavioural genetics. BMC Neurosci. 11 (1), 90 (2010).
- Pitcher, T. J. Heuristic definitions of fish shoaling behaviour. Animal Behav. 31 (2), 611-613 (1983).
- Fernandes, Y., Rampersad, M., Gerlai, R. Embryonic alcohol exposure impairs the dopaminergic system and social behavioral responses in adult zebrafish. Int J Neuropsychopharmacol. 18 (6), pyu089 (2015).
- Fernandes, Y., Gerlai, R. Long-term behavioral changes in response to early developmental exposure to ethanol in zebrafish. Alcohol Clin Exp Res. 33 (4), 601-609 (2009).
- Fernandes, Y., Rampersad, M., Jones, E. M., Eberhart, J. K. Social deficits following embryonic ethanol exposure arise in post-larval zebrafish. Addict Biol. 24 (5), 898-907 (2019).
- Buske, C., Gerlai, R. Early embryonic ethanol exposure impairs shoaling and the dopaminergic and serotoninergic systems in adult zebrafish. Neurotoxicol Teratol. 33 (6), 698-707 (2011).
- Pannia, E., Tran, S., Rampersad, M., Gerlai, R. Acute ethanol exposure induces behavioural differences in two zebrafish (Danio rerio) strains: A time course analysis. Behav Brain Res. 259, 174-185 (2014).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio)/Monte Westerfield. , (2007).
- Fernandes, Y., Rampersad, M., Eberhart, J. K. Social behavioral phenotyping of the zebrafish casper mutant following embryonic alcohol exposure. Behav Brain Res. 356, 46-50 (2019).
- Fernandes, Y., Rampersad, M., Gerlai, R. Impairment of social behaviour persists two years after embryonic alcohol exposure in zebrafish: A model of fetal alcohol spectrum disorders. Behav Brain Res. 292, 102-108 (2015).
- Fernandes, Y., Buckley, D. M., Eberhart, J. K. Diving into the world of alcohol teratogenesis: a review of zebrafish models of fetal alcohol spectrum disorder. Biochem Cell Biol. 96 (2), 88-97 (2018).
- Park, J. S., et al. Innate color preference of zebrafish and its use in behavioral analyses. Mol Cells. 39 (10), 750-755 (2016).
- Gerlai, R., et al. Forward genetic screening using behavioral tests in zebrafish: a proof of concept analysis of mutants. Behav Genet. 47 (1), 125-139 (2017).
- Scerbina, T., Chatterjee, D., Gerlai, R. Dopamine receptor antagonism disrupts social preference in zebrafish: a strain comparison study. Amino Acids. 43 (5), 2059-2072 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。