Method Article
미세 유체 공학 및 형광 현미경을 사용하여 단일 액틴 필라멘트 및 번들의 조립 역학 연구
요약
우리는 형광 현미경과 함께 간단한 액틴 필라멘트 미세 유체 분석을위한 프로토콜을 제시하여 개별 액틴 필라멘트를 실시간으로 정확하게 모니터링하면서 순차적으로 다른 단백질 용액에 노출 할 수 있습니다.
초록
액틴 필라멘트의 조립 및 분해를 조절하는 복잡한 분자 메커니즘을 해독하기 위해서는 잘 조절 된 조건에서 개별 반응을 모니터링하는 것이 큰 자산입니다. 이를 위해 지난 20 년 동안 살아있는 단일 필라멘트 실험이 등장했으며, 대부분 총 내부 반사 형광 (TIRF) 현미경을 사용하여 주요 결과를 제공했습니다. 2011년에는 이러한 실험의 가능성을 더욱 확대하고 문제가 되는 아티팩트가 반복되는 것을 피하기 위해 이러한 분석에서 간단한 미세유체학을 도입했습니다. 이 연구는 개별 액틴 필라멘트가 패시베이션 커버슬립 표면에 한쪽 끝으로 고정되고 흐름과 일치하며 다양한 단백질 솔루션에 연속적으로 노출 될 수있는 우리의 기본 프로토콜을 자세히 설명합니다. 우리는 또한 특정 응용 분야에 대한 프로토콜을 제시하고 흐르는 솔루션의 점성 드래그 덕분에 제어 된 기계적 힘을 어떻게 적용 할 수 있는지 설명합니다. 우리는 이러한 실험의 기술적인주의 사항을 강조하고이 기술을 기반으로 가능한 개발을 간략하게 제시합니다. 이러한 프로토콜 및 설명은 오늘날 사용하기 쉬운 미세 유체 공학 장비의 가용성과 함께 비 전문가가 실험실에서이 분석을 구현할 수 있도록해야합니다.
서문
액틴 필라멘트 및 액틴 필라멘트 네트워크의 조립 및 분해는 여러 생화학 반응에 의해 제어되며 기계적 맥락에 따라 달라집니다. 이러한 복잡한 메커니즘에 대한 통찰력을 얻기 위해서는 개별 필라멘트에 대한 개별 반응을 관찰 할 수있는 것이 매우 중요합니다 (충분히 많은 수로). 지난 수십 년 동안, 주로 총 내부 반사 형광 (TIRF) 현미경을 사용하여 실시간으로 동적 액틴 필라멘트를 관찰하는 것이 핵심 기술로 부상했으며 벌크 용액 생화학 적 분석1로는 얻을 수 없었던 인상적인 결과 목록을 제공했습니다.
이를 달성하기 위해서는 형광 표지 된 액틴 필라멘트를 현미경 커버 슬립의 표면에 가깝게 유지하면서 형광 표지 될 수있는 액틴 결합 단백질 (ABPs)의 용액에 노출시켜야합니다. 이렇게 하면 잘 조절된 생화학적 조건에서 개별 필라멘트에서 발생하는 이벤트를 모니터링하여 반응 속도를 정량화할 수 있는 수단이 제공됩니다. 그러나 여러 가지 특정 제한 사항을 고려해야 합니다. 필라멘트를 표면에 가깝게 인위적으로 유지하면, 종종 다수의 앵커링 포인트 덕분에 또는 메틸셀룰로스와 같은 크라우집제(crowding agent)를 사용함으로써, 이들의 거동을 변경할 수 있다(예를 들어, 이들의 중합 및 탈중합에서 정지를 야기함(2). 각 필라멘트의 윤곽선을 추적하는 것은 특히 새로운 필라멘트 또는 필라멘트 조각이 시간이 지남에 따라 시야에 축적되는 경우 어려울 수 있습니다. 반응은 액틴 단량체와 ABP의 농도가 시간이 지남에 따라 변할 수있는 유한 부피에서 일어나기 때문에 잠재적으로 정확한 속도 상수를 도출하기가 어렵습니다. 마지막으로, ABPs의 용액을 갱신하거나 변경하는 것은 30 초 미만에서 달성하기가 어렵고 종종 샘플에서 불균질 한 단백질 함량을 유발할 것입니다.
10 년 전, 개별 Deoxyribonucleic Acid (DNA) 가닥3을 연구하기 위해 이미 수행 된 작업에서 영감을 얻은 우리는 개별 액틴 필라멘트4를 관찰하고 조작하기 위해 미세 유체학에 기반한 새로운 기술을 도입했습니다. 그것은 고전적인 단일 필라멘트 기술의 앞서 언급 한 한계를 우회 할 수있게합니다. 이러한 미세유체학 분석에서, 액틴 필라멘트는 커버슬립에 흡착된 스펙트린-액틴 종자로부터 성장한다. 따라서 필라멘트는 미세 유체 챔버의 바닥에만 한쪽 끝으로 고정되고 달라 붙지 않고 표면 위로 변동합니다. 필라멘트는 들어오는 용액의 흐름과 일치하므로 윤곽선 길이의 모니터링이 용이해지고 TIRF를 사용할 수 있는 커버슬립 위의 얕은 영역에 유지됩니다. 서로 다른 용액이 혼합되지 않고 동시에 챔버 내로 흐르고 필라멘트가 순차적으로 그리고 빠르게 노출 될 수 있습니다.
여기에서는 실험실에서 단일 액틴-필라멘트 미세유체 분석을 설정하기 위한 일련의 기본 프로토콜을 제안합니다. 커버 슬립 및 미세 유체 챔버는 사전에 (반나절에) 준비 할 수 있으며 여러 생화학 적 조건을 테스트 할 수있는 실험 자체는 하루 이내에 수행됩니다.
프로토콜
1. 미세 유체 챔버 준비
- 여러 챔버 패턴이있는 SU-8 마스터 몰드를 선택하십시오. 일반적인 챔버는 세 개의 입구와 하나의 출구, 높이 20μm, 너비 800μm의 십자형입니다(그림 1). 이러한 마스터 몰드는 외부 회사로부터 구입하거나 학술 실험실에서 제조할 수 있다(예를 들어, Gicquel, Y. et al.5).
- 테이프를 몰드의 가장자리 주위에 놓습니다.
- 길이 50cm, 너비 19mm, 표준 투명 사무용 테이프( 재료 표 참조)를 벤치에 놓고 끈적끈적한 면을 위로 향하게 합니다. 몰드를 테이프의 한쪽 끝과 중간 선을 따라 수직으로 놓습니다.
- 몰드를 테이프의 다른 쪽 끝으로 굴려 몰드 주위에 1cm 테두리를 만듭니다. 테이프를 몰드 바닥 위로 접습니다.
- 폴리디메틸실록산(PDMS) 용액을 준비한다.
- 일회용 계량 접시에 25-30g의 PDMS 베이스 (재료 표)를 직접 부으십시오. 일회용 플라스틱 파스퇴르 피펫으로 10 중량 / 중량 PDMS 경화제 (재료 표)를 추가하십시오.
- 플라스틱 스틱으로 수동적이고 철저하게 혼합하십시오. 경화제가 PDMS 염기 내로 잘 혼입되어 있는지 확인하고, 교반하더라도 많은 기포를 생성한다.
- PDMS 용액을 실온(RT)에서 적어도 5분 동안 진공 데시케이터(표 재료)에서 탈기시킨다. 거품이 팽창하고, 표면으로 상승하며, 진공이 깨지면 파열됩니다.
- PDMS 용액을 SU-8 몰드 위에 붓습니다. 플라스틱 스틱을 사용하여 가능한 한 많은 혼합물을 긁어 내고 옮깁니다.
- PDMS를 두 번째로 탈기(진공 데시케이터에서 5분). 대부분의 거품을 제거하십시오 (상단 표면의 몇 개의 작은 거품은 괜찮습니다).
- 주형을 PDMS가 망상화하고 응고시키기 위해 적어도 5시간 동안 70°C의 오븐에 놓는다.
- 금형에서 고체 PDMS 챔버를 제거합니다.
주의: SU-8 몰드용 실리콘 웨이퍼는 매우 취약하므로 웨이퍼에서 PDMS를 분리할 때는 광범위한주의를 기울여야 합니다. 단단하고 평평한 표면에서 작업하고 웨이퍼를 표면에 평평하게 유지하십시오.- 면도날을 사용하여 금형의 가장자리에서 약 1cm 떨어진 PDMS에서 원형으로 자릅니다. 모든 패턴은 컷 안쪽에 0.5cm 이상이어야합니다. 부드러운 예인선으로 중앙 PDMS 블록을 부드럽게 벗겨냅니다.
주의: 벗겨질 때는 SU-8 몰드를 벤치탑에 평평하게 유지하여 파손되지 않도록 하십시오. - PDMS를 알루미늄 호일을 향한 성형 표면 인 깨끗한 알루미늄 호일에 올려 놓고 표면을 먼지로부터 보호하고 패턴을보다 잘 보이게하십시오.
- 면도날을 사용하여 금형의 가장자리에서 약 1cm 떨어진 PDMS에서 원형으로 자릅니다. 모든 패턴은 컷 안쪽에 0.5cm 이상이어야합니다. 부드러운 예인선으로 중앙 PDMS 블록을 부드럽게 벗겨냅니다.
- 패턴에서 적어도 0.5cm 떨어진 면도날이있는 챔버를 선택하고 자릅니다. 생성된 PDMS 블록은 높이 약 0.5cm, 너비 1.5cm, 길이 3cm입니다. 세 개의 입구와 하나의 출구를 생검 펀치 0.75 mm I.D.로 피어싱하십시오 (재료 표).
- PDMS 챔버를 초순수 에탄올(재료 표)로 청소하고 안전 블로우건(재료 표)을 사용하여 공기 건조합니다. 패턴이 위로 향하도록 된 PDMS를 깨끗한 페트리 접시에 놓고 뚜껑으로 접시를 닫습니다.
2. 유리 커버 슬립 청소
참고 : 여기에서는 일련의 초음파 처리 단계를 기반으로 한 표준 커버 슬립 청소 절차가 자세히 설명되어 있습니다. 다른 유리 커버슬립-세정 절차는 유사한 만족스러운 결과(6,7,8,9)를 달성할 수 있는 많은 다른 간행물에서 설명되었다.
- 10-20개의 커버슬립(길이 40mm)을 폴리테트라플루오로에틸렌(PTFE) 홀더(재질 표)에 놓습니다. 커버슬립을 1 L 유리 비이커(35°C, 30분)에서 0.5 L의 2% 유리 세척액(테이블 오브 머티리얼)으로 초음파 처리한다.
- 유리 세척 용액을 폐기하고 적어도 세 개의 연속 0.5L 욕조에서 dH2O로 커버슬립을 광범위하게 헹구십시오.
- 0.5 L 유리 비이커에 2 M KOH의 2 L를 준비한다. 커버 슬립을 KOH (RT, 30 분)에서 초음파 처리하십시오. KOH를 폐기하고 커버슬립을 dH2O로 헹구어 적어도 세 개의 0.5L 욕조에 헹구십시오.
주의: 적절한 실험실 안전 보호 장비(장갑, 안경 및 실험실 코트)를 사용하십시오. - 커버슬립을 0.5 L의 초순수 에탄올 (RT, 30 분)에 옮기고 초음파 처리하십시오. 커버슬립은 최대 2주 동안 에탄올에 보관할 수 있습니다. 증발을 방지하기 위해 열가소성 필름(재료 표)으로 비커를 닫습니다. 사용하기 전에 커버슬립을 공기 흐름으로 말리십시오.
3. PDMS 약실 집합
- 핫플레이트를 100°C로 예열한다. 청소한 PDMS 챔버 세 개와 유리 커버슬립을 깨끗한 페트리 접시에 담아 두세요. 열린 페트리 접시를 깊은 자외선 (UV) 클리너 (λ = 185 nm, 재료 표 참조)에 놓고 3-5 분 동안 자외선에 노출시킵니다.
참고: 또는 PDMS 챔버 및 커버슬립을 30초 동안 공기 또는 산소 플라즈마에 노출시킬 수 있습니다. - PDMS 챔버를 커버슬립 위에 부드럽게 놓습니다. 접촉한 두 표면이 UV에 직접 노출되었는지 확인하십시오. PDMS가 자동으로 유리에 달라 붙고 챔버가 명확하게 보입니다.
- PDMS-커버슬립 계면에 갇힌 공기를 제거하려면 손가락으로 표면을 매우 부드럽게 누릅니다. 더 단단한 접착을 위해서는 모서리와 측면 위로 더 강하게 누르십시오. 챔버의 천장이 유리 표면과 접촉하지 않도록하십시오.
- 핫플레이트를 향하는 유리 바닥이 있는 챔버를 100°C에서 5분 동안 놓는다. 이 단계 후에, 유리-PDMS 결합은 영구적이 되고, 챔버는 한 번만 사용될 수 있다. 챔버를 즉시 사용하거나 최대 일주일 동안 깨끗한 페트리 접시에 보관하십시오.
4. [선택 사항] 직접 패시베이션 및 기능화
참고: 용도에 따라 챔버는 미세유체 제어 장치에 한 번 연결되거나( 재료 표 참조) 미세유체 장치에 연결되기 전에 피펫을 사용하여 챔버에 직접 솔루션을 수동으로 주입하여 패시베이션 및 기능화할 수 있습니다. 후자는 시약을 적게 소비하고 미세 유체 장치의 폴리 에테르 케톤 (PEEK) 튜브를 통해 용액을 흘려서 잠재적 인 오염을 피할 수있는 이점을 제공합니다. 다음 모든 단계에서 용액은 피펫 팁을 출구에 직접 붙여서 주입됩니다. 챔버 내부에 거품이 생기지 않도록하려면 PDMS 챔버의 출구에 팁을 꽂을 때 피펫 팁에서 작은 액적이 튀어 나오지 않도록하십시오. 마찬가지로 전체 볼륨이 주입되기 전에 피펫 팁을 제거하십시오.
- 20 μL의 PLL-PEG (인산염 완충 식염수 (PBS)에 1 mg / mL)를 주입하십시오. RT에서 최소 1 시간 (또는 하룻밤) 동안 배양하십시오. 증발을 방지하기 위해, PDMS 챔버를 습한 박스(예를 들어, 하부 구획에 물이 있는 빈 팁 박스와 팁 유지 플랫폼 상의 PDMS 챔버)에 놓는다.
- 20 μL의 100 pM 스펙트린-액틴 종자를 주입한다(F-완충액에서, 표 1 및 표 2 참조). 1 분 이상 기다리지 마십시오. 종자 표면 밀도를 조정하기 위해 종자 농도와 타이밍을 조정하고, 큰 통계에 충분히 높고, 필라멘트가 겹치지 않도록 충분히 낮춥니다.
참고: 또는 스펙트린-액틴 종자를 사용할 수 없는 경우, 스트렙타비딘 코팅 커버슬립 9,10에 고정될 비오틴 기능화된 짧은 필라멘트 세그먼트를 사용하십시오. - [선택 사항] 20 μL의 5% 소 혈청 알부민(BSA)을 F-버퍼에 주입한다. RT에서 10 분 동안 그대로 두십시오.
- [선택 사항] F-버퍼에 1mg/mL β-카제인 20μL를 주입합니다. RT에서 10 분 동안 그대로 두십시오.
참고: 4.3 및/또는 4.4단계를 수행하여 챔버를 추가로 패시베이션하십시오. 패시베이션의 선택은 사용 된 단백질에 따라 다르며 모든 ABP에서 똑같이 잘 작동하지 않습니다. 액틴 단독을 사용하는 경우, PLL-PEG 또는 BSA로 충분하다.
5. 미세 유체 장치 연결
주: 최대 네 개의 채널이 있는 압력 기반 미세유체 시스템을 사용하여 미세유체 챔버의 흐름을 제어하십시오(그림 1A, 재료 표 참조). 미세 유체 튜브에 기포가 형성되고 흐름 안정성이 흔들리지 않도록하려면 모든 용액을 탈기하십시오. 5 mL의dH20 및 10 mL의 F-버퍼 스톡을 진공 펌프(궁극 진공 <250 mbar)에 연결된 진공 데시케이터에 넣고 RT에서 적어도 1시간 동안 탈기한다.
- 입구 + 출구 튜브를dH2O(500 μL, 300 mbar)로 헹구십시오.
- 모든 2 mL 저장소 튜브 ( 재료 표 참조)를 300 μL의 F 버퍼로 채 웁니다. 압력을 300mbar로 설정하고 다섯 개에서 여덟 방울 떨어 뜨려 낭비하십시오. 각 채널에 대해 반복하고 압력을 0으로 설정합니다.
- 콘센트를 연결하고 챔버를 광범위하게 헹구십시오.
- 저장소 튜브 4(출구)의 압력을 50mbar로 설정합니다. 튜브 끝에서 액적이 나오면 튜브를 PDMS 챔버의 출구에 연결하십시오. 액체는 챔버에 채워지고 모든 입구에서 나옵니다.
- [선택 사항] 챔버가 직접 부동태화된 경우(섹션 4), 압력을 100mbar로 설정하여 챔버를 50-100μL의 F-버퍼로 헹구십시오(3-5분). 세정 조직으로 입구에서 여분의 액체를 제거하십시오.
- 압력을 20mbar로 설정하십시오.
- 입구를 연결합니다.
- 저장소 튜브의 압력을 1 ~ 50mbar로 설정하십시오. 기포가 유입되지 않도록 하려면 튜브와 PDMS 입구에서 물방울이 나오는지 확인하십시오.
- 튜브를 입구 1에 연결합니다(연결할 때 두 방울이 합쳐짐). 압력을 30mbar로 설정합니다.
- 5.4.1-5.4.2단계를 반복하여 입구 2와 3을 연결합니다.
- 모든 입구의 압력을 20mbar로 설정하고 출구 압력을 0mbar로 설정합니다. 입구의 유속이 거의 같은지 확인하십시오(문제 해결 섹션 참조).
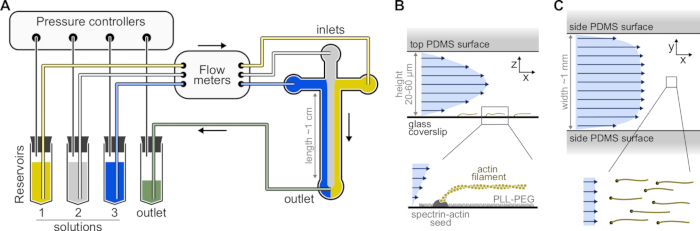
그림 1: 미세유체 챔버를 통해 용액 주입. (A) 단일 액틴 필라멘트 실험을 위한 표준 미세유체 설정. 저장소 1-3에 놓인 단백질 용액은 기상의 압력을 조정하여 챔버 내로 밀어 넣습니다. 생성 된 유량은 유량계로 측정됩니다. 미세 유체 챔버 내부에서는 용액이 적용된 상대 압력 (여기서는 모든 입구에 동일한 압력)에 따라 공간을 혼합하고 차지하지 않습니다. 일반적인 치수: 저장소 튜브에는 최대 2mL의 용액이 들어 있습니다. PEEK 튜브 (0.25mm 내경)는 저장소를 유량계 (튜브 10cm 후)에 연결 한 다음 PDMS 챔버 (다른 70cm 이후)에 연결합니다. 실리콘 튜빙 및 스테인레스 스틸 튜브 커플러는 PEEK 튜브를 PDMS 입구에 연결하는 데 사용됩니다. 주요 미세 유체 채널은 높이 20-60 μm, 너비 약 1 mm, 길이 1 cm입니다. (B,C) 미세 유체 챔버 내부의 흐름 프로파일. (B) 유체는 챔버 높이를 가로질러 포물선 프로파일을 생성한다: v(z) = 6z(h-z)R/h3w, 여기서 h 및 w는 챔버 높이 및 폭이고, R은 총 유량이다. 하단: 표면 앵커된 스펙트린-액틴 시드로부터 중합된 단일 액틴 필라멘트. (c) 챔버 폭이 높이보다 상당히 클 때, 흐름은 PDMS 표면을 제외하고는 챔버 전체에 걸쳐 거의 균일하며, 여기서 제로로 간다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 표준 유량으로 설정 구성
참고: 컴퓨터 제어 압력 시스템을 사용하면 PDMS 챔버에 연결된 모든 입구/출구의 압력을 쉽고 정확하게 조정할 수 있으므로 들어오고 나가는 유량을 제어할 수 있습니다. 사전 설정 구성은 한 번의 마우스 클릭으로 저장하고 켜거나 끌 수 있습니다. 다음은 권장되는 구성입니다(달리 명시되지 않는 한, 출구 압력은 0mbar로 설정됨). 이러한 사전 설정 구성에 대한 예상 유량에 대해서는 표 3 을 참조하십시오. 여기에 표시된 압력은 챔버 형상 및 시스템 구성에 따라 조정되어야 합니다.
-
변경: 하나 이상의 저장소를 변경할 때 이 사전 설정을 사용합니다. 그것은 거품이 유입되는 것을 방지하기 위해 관심있는 튜브에 온화한 후진 흐름을 만듭니다.
- 모든 입구 압력을 12mbar로, 출구 압력을 5mbar로 설정합니다(그림 2B).
-
High Flow 'All': 이 사전 설정을 사용하여 세 가지 솔루션을 병렬로 빠르게 주입할 수 있습니다. 그들은 4 분 이내에 챔버에 도착할 것입니다.
- 모든 입구 압력을 150mbar로 설정합니다.
-
High Flow 'x': 이 사전 설정을 사용하여 솔루션을 빠르게 주입합니다. 그것은 3 분 이내에 챔버에 도달 할 것입니다 (그림 3A-C).
- 입구 'x' 압력을 150mbar(~15μL/분)로 설정합니다. 다른 유입구의 압력은 약 100mbar로 조정되어 이러한 유입구의 결과 유량은 ~ 500nL / min입니다.
-
중간 흐름 '모두': 이 사전 설정을 사용하여 시스템을 일시 중지합니다.
- 모든 입구를 20mbar로 설정합니다(그림 2A).
-
중간 흐름 'x': 이 사전 설정을 사용하면 솔루션 'x'가 대부분의 주 채널 너비를 채울 수 있도록 허용하고( 그림 2C, D 참조), 다른 입구 솔루션을 채널 측으로 제한합니다. 따라서 챔버 내의 액틴 필라멘트는 용액 'x'에 의해서만 부과된 생화학적 조건에 노출될 것이다.
- 입구 'x' 압력을 12mbar로 설정합니다. 다른 입구의 압력을 설정하고 ~ 9mbar로 조정하여 각각의 유량이 ~ 150nL / min이되도록하십시오.
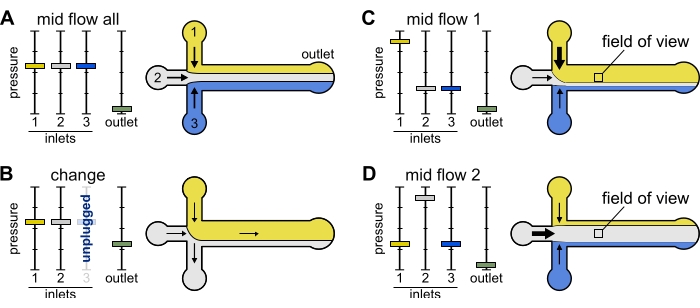
그림 2: 각 저장소에 가해지는 압력은 미세유체 챔버 내부의 용액의 분할/공간 분포를 제어합니다. (A) 저장소에 동일한 압력이 가해지면 각 용액이 챔버의 삼분의 일을 차지합니다. (B) 저수지 튜브 (여기 저수지 3)를 변경할 때 유효 압력이 0으로 떨어지면 후진 흐름이 발생합니다. (C,D) 저장소 중 하나에서 상대 압력을 증가시키면 유리 표면이 단일 용액에 노출될 수 있습니다. 챔버의 중간에서의 시야는 구성 미드 플로우 1(C)과 미드 플로우 2(D) 사이를 교대로 함으로써 용액 1 및 2에 순차적으로 노출될 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 솔루션 'x' 변경
참고: 그림 3A-C에서 볼 수 있듯이 솔루션이 저장소 튜브에서 챔버의 주 채널로 흐를 때까지 몇 분이 걸린다는 점을 명심해야 합니다. 이 최소한의 '데드' 시간은 튜빙에 포함된 액체 부피와 튜빙 내의 유동 프로파일에 의해 부과된다(그림 3A-C).
- 새로운 저장소 튜브에 200-300 μL의 용액을 준비하십시오. 압력을 설정 변경 으로 설정합니다(섹션 6 참조).
- 입구 'x'의 저수지 튜브를 풉니다. 튜브의 용액은 챔버에서 자유 튜브 팁까지 천천히 뒤로 흐릅니다. 측정된 유량은 음수가 됩니다(그림 2B).
- 튜브 팁에 작은 물방울이 형성되면 신선한 용액으로 새 튜브를 조이십시오. 튜브가 압력 시스템에 올바르게 조여지면 입구의 유속이 양수로 돌아갑니다.
- 압력 설정을 하이 플로우 'x'로 설정합니다.
- 미세 유체 구성 및 챔버 형상에 따라 용액이 튜브를 완전히 채우고 챔버에 도달 할 때까지 3-5 분 동안 기다리십시오.
- [선택 사항] 이 과정을 따라 시간에 따른 형광의 증가를 측정한다(도 3C).
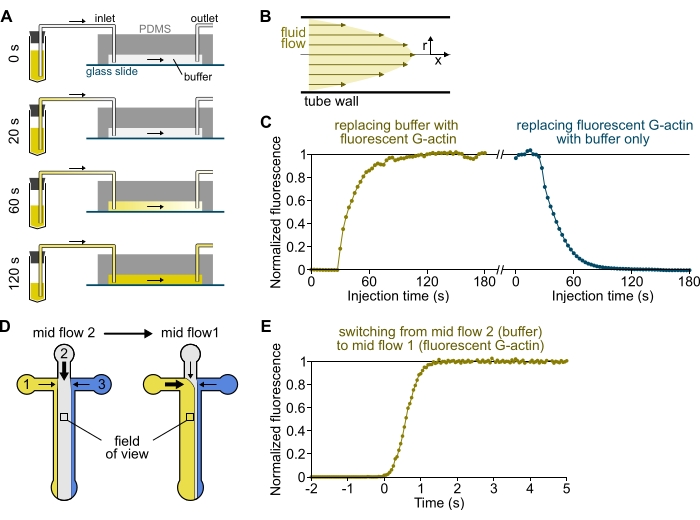
그림 3: 저장소에서 PDMS 챔버로의 용액 도착 지연 및 생화학적 조건의 급격한 변화. (A-C) 저장소에서 PDMS 챔버로의 솔루션 도착이 지연되었습니다. (A) 챔버 형상, 튜브 길이 및 입구에서의 가해진 압력에 따라, 한 용액을 다른 용액으로 교체하는 것은 순간적이지 않다. 저장조 튜브를 형광 용액(0분)을 함유하는 것으로 변경한 후, 용액은 튜빙(0.4분) 및 PDMS 챔버(1-2분)에 점진적으로 충전된다. 150 mbar 인가된 압력, 80 cm PEEK 튜빙, 및 1600 μm 폭, 20 μm 높이 PDMS 챔버에 대해 지시적인 타이밍이 주어진다. (B) PEEK 튜빙 내부의 포물선 유동 프로파일은 튜빙 방사형 프로파일과 챔버 내부를 따라 형광의 효과적인 구배를 생성한다(도 1B 참조). (c) 용액의 지연된 도착은 시간의 함수로서 챔버 내의 배경 후피형광 신호를 측정함으로써 정량화될 수 있다. 실험 조건: 0.5 μM 10% Alexa-568-표지된 G-actin은 유량계 및 80 cm PEEK 튜빙을 통해 150 mbar로 주입된다. (D,E) 생화학 적 조건의 급속한 변화. (D) 두 개의 중간 흐름 조건에서 들어오는 솔루션의 패턴. (e) 액틴 농도의 판독으로서 배경 형광의 증가. 시간 t=0은 형광의 발병이 증가함에 따라 설정된다. 용액 1: 0.5 μM 10% 알렉사-488-표지된 G-액틴, 용액 2: F-완충액. (C,E) PDMS 챔버: 높이 20μm, 너비 1600μm. 표면 위의 ∼2 μm의 에피형광 강도는 전체 시야각에 걸친 신호를 평균화하여 정량화하고, 형광단이 없을 경우 0으로, 최대 강도에서 1로 정규화하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 기본 단일 필라멘트 실험 : 아데노신 디 포스페이트 (ADP) - 액틴 바베드 엔드 탈중합
참고: 이 섹션에서는 작동하지 않는 챔버를 가정합니다(섹션 5에만 해당). 챔버가 직접 기능화된 경우(섹션 4), 단계 8.4에서 시작한다.
- 액틴 필라멘트 씨앗을 사용한 표면 기능화 :
- 용액 3을 200 μL의 50 pM 스펙트린-액틴 시드11을 F-버퍼로 변경한다(섹션 7 참조).
참고 : 또는 스펙틴 액틴 씨앗을 사용할 수없는 경우 스트렙타비딘 코팅 커버 슬립에 고정화 될 비오틴 기능화 된 짧은 필라멘트 세그먼트를 사용할 수 있습니다 (자세한 내용은 9,10 참조). - 하이 플로우 3으로 2 분 동안 주입하십시오.
참고: 최종 종자 밀도에 따라 농도와 시간을 조정하십시오.
- 용액 3을 200 μL의 50 pM 스펙트린-액틴 시드11을 F-버퍼로 변경한다(섹션 7 참조).
- 표면 패시베이션:
- 튜브 3을 F-버퍼 중 300μL의 5% BSA로 변경한다.
- 하이 플로우 3에서 5분 동안 주입한 후 미드 플로우 3에서 5분 동안 주입합니다. 이 두 번째 단계 동안 채널 1 및 2에서 7-8mbar로 압력을 줄여 카운터 유량을 ~-100nL/min으로 확보하여 전체 챔버 표면이 BSA 패시베이션되도록 합니다.
참고: BSA 용액은 더 점성이 있기 때문에 그에 따라 압력을 조정해야 합니다.
- 튜브 3을 F-버퍼로 변경하고 채널을 헹구십시오 (5 분, 하이 플로우 3).
- 다음 200-300 μL 용액을 준비하고, 모든 단백질을 F-버퍼에 희석하십시오.
입구 1, 중합 용액: 1 μM 10% 알렉사-488 표지된 G-액틴, 1 μM 프로필린(표 1).
입구 2, 시효 용액: 0.15 μM 10% 알렉사-488 표지된 G-액틴.
입구 3, 탈중합 용액 : F 버퍼 만.
참고 : Profilin은 자발적인 핵형성을 방지하고 G-actin의 일정한 농도를 유지하기 위해 여기에 사용됩니다. - 튜브 1을 3으로 변경합니다(섹션 7). 3-4 분 동안 High Flow All 사전 설정을 사용하여 주입하십시오. 이제 세 개의 용액이 PEEK 튜브를 채우고 챔버에 도달했습니다(그림 3A). 유리 표면은 데드 타임없이 모든 입구 용액에 노출 될 수 있습니다 (<1 초, 그림 3D, E).
- 현미경을 켭니다. 설정을 설정합니다: 10%-20% 전력에서 150mW 488nm 여기 레이저, 100-200ms 카메라 노출 시간, 200-300nm TIRF 침투 깊이, 60x 목표. 이러한 설정은 원고 전체에서 사용됩니다.
- 필라멘트 중합(그림 4A):
- 압력 설정을 중간 흐름 1 로 설정하여 ~10분 동안 설정합니다.
- [선택 사항] 중합 기록 (1 프레임 / 20 초, TIRF). 필라멘트는 약 10 서브 유닛 / 초 (서브 / s) 1,12에서 중합되어야합니다.
- 필라멘트 에이징: 15분 동안 압력 설정을 Mid Flow 2 로 설정합니다. 임계 농도, 0.15 μM G-액틴에서, 필라멘트 길이는 일정하게 유지되고, 필라멘트는 >99% ADP-F-액틴4로 변할 것이다.
- 탈중합(그림 4A):
- 후불형광 모드에서 1프레임/5초에서 획득을 시작합니다. 채널 2 및 3에는 형광 배경이 매우 낮기 때문에 TIRF를 사용할 필요가 없습니다.
- 한 두 프레임이 끝나면 미드 플로우 3으로 전환합니다. 필라멘트는 약 10 sub/s에서 탈중합되어야 한다(참조12).
- 실험을 재설정하려면 형광 표지 된 모든 필라멘트를 ~ 2 분 동안 최대 전력으로 레이저에 지속적으로 노출시켜 깨뜨립니다. 다른 조건을 테스트하려면 용액 1, 2 또는 3을 변경하고 주입하십시오 (높은 흐름, 3-4 분). 8.7-8.9단계를 반복합니다.
9. 다른 단일 필라멘트 실험
- ABP와 F-액틴의 상호 작용 테스트
참고: 미세유체학은 코필린, 트로포미오신 및 Arp2/3과 같은 여러 측면 결합 ABP의 활성을 정량화하는 데 성공적으로 사용되었습니다. 섹션 8의 프로토콜을 따르십시오.- 채널 3을 F-버퍼에서 관심있는 형광 ABP로 변경한다. 주입 (높은 흐름 3, 3 분).
- 필라멘트 중합: 10분 동안 압력 설정을 중간 흐름 1로 설정합니다.
- ABP 바인딩: TIRF로 수집을 시작합니다. ABP 농도에 따라 프레임 속도를 조정합니다. 1-2 프레임 후 미드 플로우 3으로 전환하십시오.
참고: ABP에 따라 이미지를 촬영할 때 배경 형광을 더욱 줄이기 위해 Mid Flow 2 로 신속하게(예: 5초 미만) 전환하는 것도 가능할 수 있습니다. - ABP 바인딩 해제: 인수를 계속하는 동안 중간 흐름 2로 전환합니다.
- 자유 철조망 단부에서 포르민과의 중합
참고: 포르민은 필라멘트 철조망 말단 중합에 영향을 미치는 것으로 나타났습니다. 미세유체학은 특히 포르민 결합 및 비결합 속도 및 필라멘트 신장에 미치는 영향을 측정하기 위해 적응된다.- 다음 해결 방법을 준비합니다.
채널 1: F-버퍼 중의 10 nM 포르민(표 1).
채널 2: 1 μM 10% 알렉사-488 표지된 G-액틴, 4 μM 프로필린.
채널 3: F 버퍼. - 튜브 1, 2 및 3을 변경합니다(섹션 7). 3-4 분 동안 High Flow All 사전 설정을 사용하여 주입하십시오.
- 필라멘트 중합 시작: 2분 동안 압력 설정을 중간 흐름 2 로 설정합니다.
- 필라멘트 바베드 끝에 대한 포르민 바인딩: 압력 설정을 30초 동안 중간 흐름 1 로 설정합니다.
- 포민 매개 중합: 압력 설정을 중간 흐름 2로 설정합니다. 포르민 mDia1이 철조망 끝에 있는 경우, 필라멘트는 약 50 sub/s13,14,15에서 중합되어야 합니다.
- 다음 해결 방법을 준비합니다.
- 표면 고정 포르민으로부터의 중합/탈중합
참고: 포르민으로 장식된 철조망 끝단의 중합 및 탈중합 속도는 필라멘트에 가해지는 장력에 의존하는 것으로 나타났습니다. 미세유체학에서, 필라멘트 측을 따라 유동하는 유체의 마찰은 필라멘트 길이 및 유량(14,16)에 비례하는 장력을 발생시킨다.- 위에서 설명한 섹션 8의 방법을 사용하여 표면 패시베이션의 경우 8.1, 8.2 및 8.3단계를 다음과 같이 바꿉니다.
- 튜브 3을 1 μg/mL 항-그의 항체를 F-완충액으로 변경한다. 하이 플로우 3으로 2 분 동안 주입하십시오.
- 튜브 3을 F 버퍼에서 5 % BSA로 변경하십시오. 하이 플로우 3에서 5분 동안 주입한 후 미드 플로우 3에서 5분 동안 주입합니다. 이 두 번째 단계 동안 채널 1 및 2에서 7-8mbar로 압력을 줄여 카운터 유량을 ~-100nL/min으로 확보하여 전체 챔버 표면이 BSA 패시베이션되도록 합니다.
- 튜브 3을 100 nM His-태깅된 포르민을 F-완충제로 변경한다. 하이 플로우 3으로 5 분 동안 주입하십시오. 튜브 3을 F 버퍼로 변경하십시오. 튜브에 포민이 남아 있지 않도록 High Flow 3 으로 5분 동안 주입합니다.
- 다음 용액을 준비하고 주입하십시오 (F- 버퍼에 각각 200-300 μL).
채널 1: 1 μM 10% 알렉사-488 표지된 G-액틴.
채널 2: 1 μM 비표지된 G-액틴, 4 μM 프로필린.
채널 3: F 버퍼만 해당됩니다. - 필라멘트 핵화: 표면 고정된 포르민을 G-액틴에 노출시킵니다( 미드 플로우 1 설정).
- 필라멘트 중합: Mid Flow 2를 사용하여 챔버를 프로필린-액틴에 노출시킵니다.
- 획득 시작: 1 프레임/2초, 후피형광. 포르민 mDia1의 경우, 필라멘트는 필라멘트 길이와 유량(14)에 따라 50-80 sub/s로 중합되어야 한다.
- 필라멘트 탈중합: 획득 시작 (1 프레임/4 초, 에피형광). 1-2 프레임 후, 필라멘트를 F 버퍼, 미드 플로우 3에 노출시킵니다. 포르민 mDia1의 경우, 필라멘트는 필라멘트 길이와 유량14에 따라 5-15 sub/s에서 탈중합되어야 한다.
- 위에서 설명한 섹션 8의 방법을 사용하여 표면 패시베이션의 경우 8.1, 8.2 및 8.3단계를 다음과 같이 바꿉니다.
- 레이블이 지정되지 않은 세그먼트가 있는 Actin 필라멘트
참고: Actin 형광 표지는 탈중합17 및 변경된 트로포미오신 결합18 동안 일시 중지와 같은 몇 가지 아티팩트를 생성합니다. 이러한 아티팩트에 대한 해결 방법은 미세 유체 공학을 사용하여 레이블이 지정되지 않은 세그먼트를 표시하는 필라멘트를 조립하는 것입니다.- 다음 용액 (F- 버퍼에 200-300 μL)을 준비하고 주입하십시오.
채널 1: 1 μM 비표지된 G-액틴, 1 μM 프로필린.
채널 2: 0.3 μM 10% 알렉사-488 표지된 G-액틴. - 표면을 채널 2(5분), 채널 1(10분) 및 채널 2(15분)에 순차적으로 노출시켜 각 말단에 형광 표지된 세그먼트를 갖는 ADP-액틴 비표지 세그먼트를 생성한다.
- 다음 용액 (F- 버퍼에 200-300 μL)을 준비하고 주입하십시오.
- 젤솔린이 있는 바베드 엔드 앵커 필라멘트
참고 : 스펙 트린 - 액틴 씨앗을 사용하면 필라멘트가 자유 철조망 끝에서 중합되고 뾰족한 끝은 스펙 트릭틴 시드에 의해 안정화됩니다. 대안은 필라멘트를 젤솔린과 같은 철조망 엔드 캐퍼로 고정시키는 것입니다.- 20 μL의 F-완충액 중의 4 μM 10% Alexa-488 표지된 G-actin의 F-actin 용액을 제조하였다. 액틴이 자발적으로 핵을 형성하고 벤치에서 적어도 30 분 동안 RT에서 중합하게하십시오. 튜브를 알루미늄 호일로 감싸서 빛으로부터 보호하십시오.
- 한편, 미세유체 챔버를 제조하고 5% BSA 및 1% 비오틴-BSA의 혼합물로 표면을 패시베이트한다(단계 8.2 참조).
- F 버퍼로 채널 3을 헹구십시오( 하이 플로우 3에서 2분). 10 μg/mL 뉴트라비딘을 F-버퍼에 주입하십시오( High Flow 3에서 4분).
- 튜브를 다음으로 변경하십시오.
채널 1: 10 nM 비오틴-겔솔린 (표 1).
채널 2: F 버퍼.
채널 3: 0.4 μM 예비중합된 F-액틴. - High Flow All 설정을 사용하여 모든 솔루션을 3분 동안 함께 주입합니다.
- 챔버 전체를 겔솔린에 노출시킵니다(미드 플로우 1, 30초).
- 필라멘트를 표면에 부착하십시오 (저유량 3 : 3 mbar의 채널 3, ~ 2 mbar의 채널 1 및 2, 약 2 분).
- [선택 사항] 필라멘트 밀도가 너무 낮으면 9.5.6 및 9.5.7 단계를 반복하십시오.
- 뾰족한 말단 탈중합: 획득 개시 (1 프레임/30 s, 에피형광). 1-2 프레임 후, 필라멘트를 버퍼에만 노출, 미드 플로우 2. 필라멘트는 약 0.2 sub/s에서 탈중합되어야 한다.
10. ADF/코필린에 의한 파신 유도 필라멘트 다발 형성 및 분해
참고 : 액틴 필라멘트 번들을 형성하려면 챔버 표면에서 충분히 높은 필라멘트 종자 밀도를 가져야합니다. 파신 단백질에 노출될 때, 측방으로 변동하는 이웃 필라멘트는 파신 단백질에 의해 동적으로 가교결합될 것이다. 파신이 필라멘트 측(19)으로부터 신속하게 결합해제됨에 따라, 파신은 필라멘트 번들링을 유지하기 위해 주 유동 용액 내에 지속적으로 존재해야 한다.
- 8.1-8.3단계를 수행합니다.
- 다음 용액 (F- 버퍼 중 200-300 μL)을 준비하십시오.
채널 1, 중합 용액: 1 μM 10% 알렉사-488 표지된 G-액틴, 1 μM 프로필린.
채널 2, 번들링 용액: 200 nM 파신 (표 1), 0.15 μM 10% 알렉사-488 표지된 G-액틴.
채널 3, 분해 용액: 200 nM ADF/코필린 (표 1), 100 nM 파신, 0.15 μM 10% 알렉사-488 표지된 G-액틴. - 튜브 1을 3으로 변경합니다(섹션 7). High Flow All 사전 설정을 사용하여 3-4 분 동안 주입하십시오.
- 필라멘트 중합: ~10분 동안 압력 설정을 Mid Flow 1로 설정합니다. 중합은 TIRF로 이미징 할 수 있습니다.
- 필라멘트 번들링(그림 4C): 이미지 수집 시작(1프레임/5초, 에피형광). 1-2 프레임 후 압력 설정을 Mid Flow 2 로 설정하고 필라멘트 번들링을 관찰하십시오.
- 번들 단편화: 이미지 획득을 시작합니다(1프레임/5초, 후피형광). 1-2 프레임 후, 압력 설정을 Mid Flow 3 으로 설정하고 단일 필라멘트와 번들의 코필린으로 인한 분해를 관찰하십시오.
11. 미세 유체 장치 청소 절차
참고: 한 실험에서 다른 실험으로 인한 오염을 방지하려면 각 실험 후에 모든 튜브와 유량계를 광범위하게 청소하고 완전히 건조하는 것이 중요합니다.
- PDMS 챔버에서 모든 튜빙을 분리하고 챔버를 버립니다.
- PEEK 튜브 및 유량계를 청소하려면 튜브 끝을 빈 15mL 플라스틱 튜브에 테이프로 붙이고 저장소가 거의 비어있을 때까지 최대 압력으로 다음 용액을 주입합니다.
400 μL의 F-버퍼.
400 μL의 0.5 M NaOH.
400 μL의 순수한 물.
200 μL의 이소프로판올. - 빈 저장소로 교체하고 튜브가 완전히 건조 될 때까지 공기를 불어 넣으십시오 (~ 2-4 분, 최대 압력).
12. 이미지 분석
참고 :이 원고는 미세 유체 학에서 단일 액틴 필라멘트를 조립, 조작 및 시각화하는 방법에 중점을두고 있지만 획득 한 영화를 분석하는 간단한 방법이 여기에 제공됩니다. 분석은 섹션 8에 따라 ImageJ를 사용하여 16비트 이미지에서 수행됩니다.
- 이미지 처리는 최소한입니다.
- 중합 또는 탈중합 이미지 스택을 가져옵니다.
- [선택 사항] 배경 빼기 기능으로 이미지 강도를 균질화합니다(기본 설정(예: '롤링 볼 반지름' = 50픽셀)). 이는 영화 촬영 중에 배경 형광이 변하거나 형광 조명이 시야각에 걸쳐 균질하지 않은 경우에 특히 유용합니다.
- 밝기와 대비(배경이 0에 가까우, 필라멘트가 최대에 가까움)를 조정합니다.
- 필라멘트 키모그래프 만들기:
- 일시 중지, 중단 또는 분리되지 않는 필라멘트를 선택합니다. 그렇지 않으면 동작에 따라 선택하지 마십시오. 위에 1-2 픽셀 위의 선을 그립니다 (직선 도구). 필라멘트 번호를 저장합니다(ROI 관리자에 추가).
- Reslice 함수를 적용합니다(슬라이스 수: 5픽셀). 최대 강도(Zprojection 함수)를 계산합니다.
- 중합/탈중합 속도를 측정하십시오:
- 키모그래프에서 필라멘트 철조망 끝을 따라 선을 그립니다(직선 도구, 그림 4A). 선 너비와 높이를 측정합니다 (함수 측정).
- 여러 필라멘트에 대해 12.2-12.3단계를 반복합니다. 중합/탈중합 속도를 계산합니다(그림 4A).
 여기서 v 는 속도(서브/s), w 는 선 너비(픽셀), 픽셀 크기(nm), h 는 선 높이(프레임), dt 는 프레임 사이의 시간(초)입니다. 여기서, 2.7 nm는 필라멘트 길이에 대한 액틴 서브유닛의 효과적인 기여에 상응한다.
여기서 v 는 속도(서브/s), w 는 선 너비(픽셀), 픽셀 크기(nm), h 는 선 높이(프레임), dt 는 프레임 사이의 시간(초)입니다. 여기서, 2.7 nm는 필라멘트 길이에 대한 액틴 서브유닛의 효과적인 기여에 상응한다.
결과
위에서 설명한 모든 실험에서 형광으로 표지된 액틴 필라멘트는 표면에서 낮은 배경 형광을 나타내는 양호한 대비와 함께 명확하게 볼 수 있어야 합니다(그림 4, 일반적인 문제 해결을 위한 보충 파일 1 참조). 액틴 필라멘트는 또한 표면에 달라 붙지 않아야합니다 : 지배적 인 유속이 낮을 때, 액틴 필라멘트의 측면 변동은 살아있는 것을 관찰 할 때 인식 할 수 있어야하며 그들이 끝 중 하나에만 고정되어 있음을 명확하게 결정할 수 있어야합니다. 마찬가지로, TIRF 이미징을 사용할 때 수직 변동은 길이와 시간에 따른 강도의 변화로 볼 수 있어야 합니다. 적용된 유량에 따라 TIRF에 의해 획득된 액틴 필라멘트의 이미지 품질을 최적화하기 위해 TIRF 침투 깊이를 조정해야 할 수도 있습니다.
필라멘트를 중합 조건에 노출시킬 때(섹션 8 참조), 필라멘트 신장은 규칙적이어야 한다(즉, 필라멘트의 끝에서의 신장은 표면 상호작용 또는 영구적인 접착에 의해 방해받지 않는다). 또한, 측정된 필라멘트 바베드 말단 신장 률은 튜브(1,20) 내의 액틴 농도에 따른 예상치와 일치해야 하며, 이는 튜브 용액이 미세유체 챔버까지 정확하게 유동되었음을 나타낸다(도 4A). 유사하게, 완충 용액에 노출될 때, 필라멘트는 그들의 ADP 함량4를 반영하는 속도로 꾸준히 탈중합되어야 한다(도 4A). 이미 성장한 액틴 필라멘트를 형광 표지된 코필린의 용액에 노출시킬 때, 코필린 클러스터는 핵화되고 코필린 농도에 의존하는 속도로 뾰족한 말단과 철조망 둘 다를 향하여 성장할 것이다(도 4B). 파신과 같은 ABP의 잠재적인 가교 활성을 평가할 때(도 4C), 클로즈-바이 액틴 필라멘트 다발을 형성하는 것은 그들의 더 높은 형광 강도 및 그들의 측방향 변동의 변화에 의해 쉽게 검출될 것이다.
액체의 흐름은 미세 유체 챔버의 표면에 고정되어있는 액틴 필라멘트에 점성 마찰력을 가합니다. F-액틴의 마찰력 계수는 필라멘트 미크론 길이 14에 따라 표현되는 η =6.10-4 pN·s/μm2입니다. 중간 유속에서, 필라멘트 높이가 표면 위의 250 nm의 일정한 평균 주위에서 변동함에 따라, 자유 부동 끝에서 필라멘트 앵커링 포인트까지 힘 구배가 존재한다. 따라서 F = 6ηπLv를 사용하여 필라멘트를 따라 임의의 지점에서 가해진 장력을 계산할 수 있으며, 여기서 v는 표면 위의 250 nm의 국부 유속이고 (그림 1B) L은 하류 필라멘트 세그먼트 길이 (즉, 고려 지점에서 자유 단부까지)입니다. 더 높은 유속의 경우, 필라멘트 평균 높이는 일정하지 않지만 앵커링 포인트에서 자유 단부까지 선형적으로 증가하고, 평균 250nm 미만으로 유지되며, 유속에 따라 변할 것이며, 따라서 필라멘트(21)를 따라 더 복잡한 인장력 프로파일을 유도한다.

그림 4: 대표적인 결과. 액틴 필라멘트가 스펙트린-액틴 종자로부터 중합되고 상이한 ABP에 노출되는 전형적인 실험. 명확성을 위해, 시야의 일부분만이 도시된다. (a) 기본 중합-탈중합 실험으로부터의 결과(섹션 8). 필라멘트는 0.8 μM 10% 알렉사-488 표지된 G-액틴의 용액으로 중합되고, 모든 서브유닛을 ADP-액틴(도시되지 않음)으로 전환시키기 위해 15분 동안 숙성시키고, F-버퍼에만 노출될 때 탈중합시킨다. 하단 : 중합 및 탈중합 속도를 정량화하는 데 사용되는 키모 그래프. 1프레임/5초, 200ms 노출 시간, 9% 전력에서 150mW 488nm 레이저, TIRF(레이저 침투 깊이 250nm)에서 획득했습니다. (b) 500 nM mCherry-cofilin-1에 의한 단일 액틴 필라멘트의 단편화. 액틴은 ATP-ATTO48822 (노란색)로 표시되고 코필린-1은 mCherry (파란색)에 융합됩니다. 위쪽: 시야각의 일부. 참고 : 표면에 단백질 응집체. 하단: 필라멘트에 대한 코필린-1의 결합을 보여주는 키모그래프(화살촉은 코필린-1 도메인 핵형성 사건을 보여주며), 단편화 이벤트(번개 기호)로 이어진다. 1프레임/4초, 200ms 노출, 16%에서 150mW 488nm 레이저, 12% 전력에서 100mW 561nm 레이저, 후피형광으로 획득했습니다. (C) 파신에 의한 액틴 필라멘트의 번들링 (10.5 절). 필라멘트는 먼저 0.8 μM 5% 알렉사-488 표지된 G-액틴으로 중합되고 200 nM 파신으로 번들링되었다. 단일 필라멘트와 비교할 때, 필라멘트 번들은 두 개에서 세 배 더 밝게 보이고 흐름과 완벽하게 정렬되지 않습니다. 1프레임/10초, 200ms 노출, 20% 200W 수은 램프 강도, 후광에서 획득했습니다. (A-C) 배경은 ImageJ의 임시 기능으로 뺍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 단백질 이름 | 종 | 유니프로트 참조(시퀀스) | 원래 정화 프로토콜 참조. | 코멘트 |
| 말라 | 토끼 | P68135(전체 길이) | 23 | 형광 표지에 대해서는 ref 24를 참조하십시오. |
| 프로필린1 | 사람의 | P07737(전체 길이) | 25 | 또한 ref 11 참조 |
| 스펙트린-액틴 시드 | 사람의 | 해당 없음 | 26, 27 | 또한 ref 11 참조 |
| 코필린1 | 마우스 | P18760(전체 길이) | 28 | |
| 젤솔린 | 사람의 | P06396(전체 길이) | 29 | |
| mDia1 포르민 | 마우스 | O08808 (aa 552–1255) | 13 | ref 24에서 더 자세한 프로토콜 |
| 파신1 | 사람의 | Q16658(전체 길이) | 30 |
표 1: 액틴 및 액틴 결합 단백질 23,24,25,26,27,28,29,30
| 시약 | 농도 |
| 트리스-HCl pH 7.4 | 5 밀리지미터 |
| 증권 시세 표시기 | 50 밀리지미터 |
| MgCl2 | 1 밀리지미터 |
| 증권 시세 표시기 | 0.2 밀리지미터 |
| 증권 시세 표시기 | 0.2 밀리지미터 |
| 증권 시세 표시기 | 10 밀리지미터 |
| 다브코 | 1 밀리지미터 |
표 2: F-완충액 조성물. DABCO 및 비교적 고농도의 DTT가 형광 현미경 실험 동안 광 노출로 인한 필라멘트에 대한 광유도 손상을 제한하기 위해 사용된다.
| 이름 설정 | 압력 (mBar) | 유속 (nL / 분) |
| 최대 압력 | 300 | ~ 30 000 (지배적 인 채널에서) |
| 고압 | 150 | ~ 15 000 (지배적 인 채널에서) |
| 중간 압력 | 12 | ~ 1500 (지배적 인 채널에서) |
| '변화' 압력 | 모든 입구에 대해 12, 콘센트용 5개 | ~ 500 (각 입구에서) |
표 3: 적용된 압력과 측정된 유량 간의 대응. 결과 유속은 실험 설정에 따라 크게 달라집니다. 값은 단면 20 μm x 800 μm (높이 x 폭)의 1cm 길이의 주 채널을 갖는 미세유체 챔버에 대해 주어지며, 80 cm 길이의 PEEK 튜빙을 갖는 각 저장소에 연결된다.
보충 파일 1 : 고전적인 문제, 원인 및 해결책. 그들은 일반적으로 미세 유체 공학 및 / 또는 단일 액틴 필라멘트로 작업 할 때 문제가 발생했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
액틴 필라멘트가 길이를 따라 여러 지점에 의해 표면에 고정되거나 메틸 셀룰로오스와 같은 크라우드 링제에 의해 그 가까이에 유지되는 표준 단일 필라멘트 방법과 비교할 때, 미세 유체학은 많은 이점을 제공합니다. 표면과의 상호작용이 최소화됨에 따라, 인위적인 일시정지는 신율 및 탈중합 둘 다 회피되는 동안 유도할 수 있다. 필라멘트는 흐름에 의해 정렬되고 서로 평행하여 모니터링과 길이 측정을 용이하게합니다. 필라멘트 주변의 용액은 지속적으로 갱신되어 일정한 단백질 농도에 노출됩니다. 필라멘트가 노출되는 다른 단백질 용액 사이를 신속하게 전환 할 수 있기 때문에 (<1 초, 그림 3D, E) 시간 제어 순차적 실험을 수행 할 수 있으며 이는 종종 운동 연구에 도움이됩니다. 마지막으로, 필라멘트 상의 유동 용액에 의해 가해지는 점성 항력은 필라멘트에 제어된 기계적 응력을 가하기 위해 이용될 수 있다(대표적인 결과 섹션). 적당한 유체 흐름 (미드 플로우 압력 설정)은 필라멘트를 표면 (~ 250nm)에 충분히 가깝게 가져 와서 TIRF로 효율적으로 이미지화하면서 최소한의 장력 (<1pN)14을 생성합니다.
그러나 고전적인 단일 필라멘트 분석과 비교할 때, 미세 유체 학은 더 큰 부피의 단백질 용액을 필요로합니다 : 일반적으로 100 μL 미만의 표준 실험을 수행 할 수있는 경우 100 μL. 이는 귀중한 단백질을 사용할 때 한계가 될 수 있습니다. 고전적 실험은 일련의 미세유체 실험을 시작하기 전에 관련 실험 조건(예를 들어, 상이한 단백질의 절대 또는 상대적 농도)을 확립하는 것을 돕기 위해 사용될 수 있다. 시험관 내에서 다른 단일 필라멘트 기술과 마찬가지로 또 다른 한계는 커버슬립 표면의 불완전한 패시베이션에서 비롯됩니다. 커버슬립 세척 및 패시베이션층의 결합(BSA, PEGylation 등)에서의 재현성은 항상 제어하기 어렵다. PEG-실란 표면 처리에 기초한 원스텝 패시베이션 기술은 많은 실험실(7,15)에서 선택되는 기술이 되었다. 이와 같이, 필라멘트 종자의 유효 밀도는 가능한 한 정확하게 반복되는 경우에도 대략 두 배로 실험마다 달라질 수 있다. 만족스러운 범위의 필라멘트 표면 밀도를 목표로해야하며 필요한 경우 실험을 반복 할 준비를해야합니다. 미세 유체 공학 및 / 또는 단일 액틴 필라멘트로 작업 할 때 일반적으로 발생하는 문제는 보충 파일 1에서 논의됩니다.
여기에 제시된 기본 프로토콜의 경우, 짧은 안정화 필라멘트로 볼 수있는 스펙 트릭틴 시드는 표면에 달라 붙을 때 무작위로 배향된다는 점에 유의해야합니다. 결과적으로,이 씨앗에서 자란 필라멘트가 흐름과 일치함에 따라, 씨앗에 가장 가까운 부분은 각각 자신의 각도로 급격히 구부러질 것입니다. 필라멘트가 구부러지는 길이는 필라멘트가 중간 또는 높은 흐름에 노출 될 때 일반적으로 매우 작습니다. 실제로, 이 길이는 일반적으로 회절 한계(∼200 nm)보다 작을 것이고, 따라서 쉽게 검출되지 않을 것이다. 중요한 것은, 필라멘트 곡률에 민감한 ABP는 이 고도로 구부러진 영역에서 결합하고 다르게 기능할 것이라는 점이다. 결과 편향을 피하기 위해, 가장 간단한 것은 분석(21)으로부터 이 영역을 배제하는 것이다.
미세 유체학을 사용하여 단일 액틴 필라멘트를 조작하고 시각화하기 시작하기 전에 이미 훨씬 더 유연한 단일 DNA 필라멘트3을 연구하는 데 사용되었습니다. 이것은 흐름이 DNA를 극적으로 풀고 겉보기 길이를 극적으로 바꿀 수 있기 때문에 주목할만한 차이를 야기 할 수 있습니다. 미세유체학은 또한 미세소관을 연구하기 위해 여기에 제시된 방법과 매우 유사하게 사용될 수 있다; 이들은 훨씬 더 뻣뻣하지만, 그럼에도 불구하고 그들의 연신율 및 탈중합을 측정하기 위해 흐름과 정렬되도록 만들어질 수 있고, 조건들(31,32)의 신속한 전환을 이용하거나, 미세소관 가소성(7)을 측정하기 위해 수직 유동에 의해 구부러질 수 있다.
필라멘트가 한쪽 끝에만 고정되고 시야의 흐름 방향이 실험 전체에서 동일한 기본 실험을위한 프로토콜을 제시했습니다. 이 두 가지 특성은 다양 할 수 있습니다. 예를 들어, 필라멘트는 필라멘트를 따라 상이한 힘 프로파일을 생성하기 위해 다수의 포인트들에 의해 앵커링될 수 있다. 마찬가지로, 유동 방향은 (엔트리 채널들 사이의 접합부 부근에서, 유동 챔버 내에서) 국부적으로 필라멘트를 구부리도록 변화될 수 있는데, 이는 앵커링되지 않은 부분이 앵커링된 필라멘트 세그먼트(21)와는 다른 방향을 가리키고 있을 것이기 때문이다. 무작위로 고정된 스펙트린-액틴 종자로부터 길쭉한 필라멘트는 또한 가교결합 단백질에 노출되어 다발(33 )을 형성할 수 있다(섹션 10 참조). 미세유체학을 다른 기술(마이크로패터닝, 광학 핀셋 등)과 결합하거나 유동 라인을 수정하기 위해 구획을 갖는 미세유체 챔버를 설계함으로써, 단일 필라멘트 상으로 특정 ABP 활성을 연구하거나 작은 액틴 네트워크(34)를 형성하기 위한 다수의 구성이 생성될 수 있다. 조합의 수는 미세 유체 공학의 장점과 다양성과 함께 분자 규모에서 액틴 네트워크의 시공간 조절을 해독하기 위해 연구자들에게 많은 도구를 제공합니다.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
우리는 B. Ladoux와 R.-M.에게 감사드립니다. UV-cleaner 장비를 사용하는 Mège 실험실과 J. Heuvingh 및 0. du Roure는 실리콘 웨이퍼에서 금형을 준비하고 미세 유체 공학에 대한 팁을 제공하는 초기 교육을 받았습니다. 우리는 유럽 연구위원회 그랜트 StG-679116 (A.J.) 및 Agence Nationale de la Recherche Grants Muscactin and Conformin (G.R.-L.)의 기금을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| β-Casein | Merck | C6905 | Used at 8 mg/mL |
| Biopsy punch (with plunger) | Ted Pella | 15115-2 | ID 0.75 mm, OD 1.07 mm |
| Biotin-BSA | Merck | A8549 | Used at 1 mg/mL |
| BSA | Merck | A8022 | Used at 50 mg/mL |
| Coverslip Mini-Rack Teflon holder | Invitrogen | C14784 | for 8 coverslips |
| Coverslips 22x40mm Thickness #1.5 | Menzel Gläser | 631-1370 | |
| DABCO | Merck | D27802 | component in f-buffer |
| DTT | Euromedex | EU0006-D | component in f-buffer |
| Ester NHS Alexa Fluor 488 | Invitrogen | A20000 | Fluorophore for actin labeling on Lys328. |
| EZ-Link Sulfo-NHS-Biotin | Thermo Scientific | 21338 | To biotinylate actin on Lys328 |
| Hellmanex III | Hellma | 9-307-011-4-507 | Glass cleaning detergent |
| ImageJ | NIH | N/A | open source software |
| Laboport | KNF | 811kn.18 | vacuum pump (ultimate vacuum: 240 mbar) |
| Magic invisible tape | Scotch | 7100024666 | standard transparent office tape |
| Micrewtube | Simport | T341-6T | 2 mL microfluidic reservoir tubes |
| Microfluidic device Part 1: Flow Unit S | Fluigent | FLU-S-D-PCKB | Flowmeter |
| Microfluidic device Part 2: Fluiwell-4C-2 mL | Fluigent | 14002001PCK | Reservoir holder |
| Microfluidic device Part 3: MFCS-EZ | Fluigent | EZ-11000001 EZ-00345001 | Pressure controller |
| Model 42 - UVO-Cleaner | Jelight Inc. | 42-220 | Ultraviolet cleaner |
| N6-(6-Aminohexyl)-ATP-ATTO-488 | Jena Bioscience | NU-805-488 | ATP-ATTO used to label actin |
| neutravidin | Thermo Scientific | 31000 | |
| PLL-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | Use at 1 mg/mL in PBS. |
| Polydimethylsiloxane (PDMS) Sylgard 184 Silicon Elastomer | Dow Corning | 1673921 | Contains PDMS base and curing agent |
| Polyetheretherketone (PEEK) tubing | Merck | Z226661 | “Blue” : I.D. = 0.25 mm |
| Safety blow gun | Coilhose Pneumatics | 700-S | filtered air |
| Silicon tubing | VWR | 228-0701P | connect PEEK to coupler |
| Stainless steel catheter coupler | Prime Bioscience | SC22/15 | Inserted into PDMS inlets and outlet to connect to PEEK tubing |
| Thermoplastic film | Sigma Aldrich | PM996 | Standard "parafilm" |
| Ultrapure ethanol | VWR | 64-17-5 | |
| Ultrasonic cleaning bath | VWR | USC200TH | To accomodate 1 L beakers |
| Vacuum dessicator | SP Bel-Art | F42022-0000 | to degas the PDMS or solutions |
참고문헌
- Wioland, H., Jégou, A., Romet-Lemonne, G. Celebrating 20 years of live single-actin-filament studies with five golden rules. Proceedings of the National Academy of Sciences of the United States of America. 119 (3), 2109506119 (2022).
- Kuhn, J. R., Pollard, T. D. Real-time measurements of actin filament polymerization by total internal reflection fluorescence microscopy. Biophysical Journal. 88 (2), 1387-1402 (2005).
- Brewer, L. R., Bianco, P. R. Laminar flow cells for single-molecule studies of DNA-protein interactions. Nature Methods. 5 (6), 517-525 (2008).
- Jégou, A., et al. Individual actin filaments in a microfluidic flow reveal the mechanism of ATP hydrolysis and give insight into the properties of profilin. PLoS Biology. 9 (9), 1001161 (2011).
- Gicquel, Y., et al. Microfluidic chips for in situ crystal x-ray diffraction and in situ dynamic light scattering for serial crystallography. Journal of Visualized Experiments: JoVE. (134), e57133 (2018).
- Chandradoss, S. D., et al. Surface passivation for single-molecule protein studies. Journal of Visualized Experiments: JoVE. (86), e50549 (2014).
- Schaedel, L., et al. Microtubules self-repair in response to mechanical stress. Nature Materials. 14 (11), 1156-1163 (2015).
- Zimmermann, D., Morganthaler, A. N., Kovar, D. R., Suarez, C. In vitro biochemical characterization of cytokinesis actin-binding proteins. Methods in Molecular Biology. 1369, 151-179 (2016).
- Funk, J., et al. Profilin and formin constitute a pacemaker system for robust actin filament growth. eLife. 8, 50963 (2019).
- Pandit, N. G., et al. Force and phosphate release from Arp2/3 complex promote dissociation of actin filament branches. Proceedings of the National Academy of Sciences of the United States of America. 117 (24), 13519-13528 (2020).
- Wioland, H., et al. ADF/Cofilin accelerates actin dynamics by severing filaments and promoting their depolymerization at both ends. Current Biology: CB. 27 (13), 1956-1967 (2017).
- Pollard, T. D., Mooseker, M. S. Direct measurement of actin polymerization rate constants by electron microscopy of actin filaments nucleated by isolated microvillus cores. The Journal of Cell Biology. 88 (3), 654-659 (1981).
- Kovar, D. R., Harris, E. S., Mahaffy, R., Higgs, H. N., Pollard, T. D. Control of the assembly of ATP- and ADP-actin by formins and profilin. Cell. 124 (2), 423-435 (2006).
- Jégou, A., Carlier, M. -. F., Romet-Lemonne, G. Formin mDia1 senses and generates mechanical forces on actin filaments. Nature Communications. 4, 1883 (2013).
- Breitsprecher, D., et al. Rocket launcher mechanism of collaborative actin assembly defined by single-molecule imaging. Science. 336 (6085), 1164-1168 (2012).
- Courtemanche, N., Lee, J. Y., Pollard, T. D., Greene, E. C. Tension modulates actin filament polymerization mediated by formin and profilin. Proceedings of the National Academy of Sciences of the United States of America. 110 (24), 9752-9757 (2013).
- Niedermayer, T., et al. Intermittent depolymerization of actin filaments is caused by photo-induced dimerization of actin protomers. Proceedings of the National Academy of Sciences. 109 (27), 10769-10774 (2012).
- Gateva, G., et al. Tropomyosin isoforms specify functionally distinct actin filament populations in vitro. Current Biology: CB. 27 (5), 705-713 (2017).
- Aratyn, Y. S., Schaus, T. E., Taylor, E. W., Borisy, G. G. Intrinsic dynamic behavior of fascin in filopodia. Molecular Biology of the Cell. 18 (10), 3928-3940 (2007).
- Pollard, T. D. Rate constants for the reactions of ATP- and ADP-actin with the ends of actin filaments. The Journal of Cell Biology. 103, 2747-2754 (1986).
- Wioland, H., Jegou, A., Romet-Lemonne, G. Torsional stress generated by ADF/cofilin on cross-linked actin filaments boosts their severing. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2595-2602 (2019).
- Colombo, J., et al. A functional family of fluorescent nucleotide analogues to investigate actin dynamics and energetics. Nature Communications. 12 (1), 548 (2021).
- Spudich, J. A., Watt, S. The regulation of rabbit skeletal muscle contraction. I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. The Journal of Biological Chemistry. 246 (15), 4866-4871 (1971).
- Romet-Lemonne, G., Guichard, B., Jégou, A. Using microfluidics single filament assay to study formin control of actin assembly. Methods in Molecular Biology. 1805, 75-92 (2018).
- Gieselmann, R., Kwiatkowski, D. J., Janmey, P. A., Witke, W. Distinct biochemical characteristics of the two human profilin isoforms. European Journal of Biochemistry. 229 (3), 621-628 (1995).
- Lin, D. C., Lin, S. Actin polymerization induced by a motility-related high-affinity cytochalasin binding complex from human erythrocyte membrane. Proceedings of the National Academy of Sciences of the United States of America. 76 (5), 2345-2349 (1979).
- Casella, J. F., Maack, D. J., Lin, S. Purification and initial characterization of a protein from skeletal muscle that caps the barbed ends of actin filaments. The Journal of Biological Chemistry. 261 (23), 10915-10921 (1986).
- Kremneva, E., et al. Cofilin-2 controls actin filament length in muscle sarcomeres. Developmental Cell. 31 (2), 215-226 (2014).
- Le Clainche, C., Carlier, M. -. F. Actin-based motility assay. Current Protocols in Cell Biology. , 1-20 (2004).
- Vignjevic, D., et al. Formation of filopodia-like bundles in vitro from a dendritic network. The Journal of Cell Biology. 160 (6), 951-962 (2003).
- Duellberg, C., Cade, N. I., Holmes, D., Surrey, T. The size of the EB cap determines instantaneous microtubule stability. eLife. 5, 13470 (2016).
- Duellberg, C., Cade, N. I., Surrey, T. Microtubule aging probed by microfluidics-assisted tubulin washout. Molecular Biology of the Cell. 27 (22), 3563-3573 (2016).
- Suzuki, E. L., et al. Geometrical constraints greatly hinder formin mDia1 activity. Nano Letters. 20 (1), 22-32 (2020).
- Wioland, H., Suzuki, E., Cao, L., Romet-Lemonne, G., Jegou, A. The advantages of microfluidics to study actin biochemistry and biomechanics. Journal of Muscle Research and Cell Motility. 41 (1), 175-188 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유