Method Article
쥐의 경내 합성 단백질의 정량적 측정
요약
높은 척수액 단백질 수준은 변경된 혈액 뇌 장벽 또는 신분 합성을 통해 혈장 단백질의 확산의 결과일 수 있습니다. 최적화된 테스트 프로토콜은 두 경우를 모두 구별하는 데 도움이 되며 합성된 단백질의 정량적 측정을 제공하는 이 문서에 제시되어 있습니다.
초록
뇌척수액(CSF)은 뇌와 척수에서 발견되는 유체로서 기초 과학과 임상 과학 모두에 매우 중요합니다. CSF 단백질 조성물의 분석은 신경 질환뿐만 아니라 기초 신경 과학 연구에서 중요한 정보를 제공합니다. 한 가지 주의해야 할 점은 CSF에서 측정된 단백질은 혈청에서 의한 경막 합성 및 과장 둘 다에서 파생될 수 있으며, CSF의 단백질 분석은 이 두 성분의 합만을 결정할 수 있다는 것입니다. 인간뿐만 아니라 동물 모델에서 단백질 과 단백질 을 생산한 단백질을 구별하기 위해, CSF 단백질 프로파일링 측정은 기존의 단백질 분석 도구를 사용하여 알부민 CSF/혈청 지수(Q알부민),혈액-뇌 인터페이스(BBI) 및 단백질 지수(Q 단백질/Q알부민)의 무결성의 마커인 단백질 의 계산을 포함해야 한다. 이 프로토콜은 CSF 및 혈액 수집에서 지수 및 지수 계산에 이르기까지 신경 장애의 마우스 모델에서 의 단백질 합성 및 BBI 손상의 정량적 측정에 대한 전체 절차를 보여줍니다.
서문
뇌척수액(CSF)은 뇌와 척수를 둘러싼 맑고 무색의 액체로 임상적이고 기본적인 과학적 중요성을 지니고 있습니다. CSF는 중추 신경계 (CNS)의 전해 환경을 보존하고, 전신 산 염기 상태의 균형을 맞추고, 신경 세포 및 신경 교세포 세포에 영양분을 공급하고, CNS를 위한 림프계로서의 기능을 공급하고, 호르몬, 신경 전달 물질, 사이토카인 및 기타 신경 펩타이드를 CNS1전반에 걸쳐 수송합니다. 따라서, CSF 조성물은 CNS의 활성을 반영함에 따라, 이 유체는 CNS의 생리적 및 병리학적 상태를 특성화하기 위해 간접적이지만 귀중한 접근을 제공한다.
CSF는 백 년 이상 동안 CNS에 영향을 미치는 조건을 진단하기 위하여 이용되었습니다, 그리고 이 시간의 대부분을 위해, 진단 공구로 임상의에 의해 1 차적으로 공부되었습니다. 그러나, 최근 몇 년 동안 신경 생물학자는 CNS의 병리생리학을 공부하기위한 CSF의 잠재력을 인식했습니다. 특히, 신경과학 분야에서 는 여러 고처리량 단백질 분석 도구가 도입되어 CSF의 단백질 조성에 대한 상세한 연구를 가능하게 되었으며, 이러한 분석이 동적 변화에 대한 통찰력을 제공하는 데 도움이 될 수 있다는 기대를 가지고 있습니다. CNS 내에서 발생합니다.
Luminex 및 Simoa 기술2,3과같은 멀티플렉스 면역 분석 기술의 기술 개발은 오늘날 연구원들에게 매우 낮은 농도에서 수백 개의 단백질을 검출 할 수있는 능력을 제공합니다. 더욱이, 이러한 기술은 작은 샘플 부피를 사용하여, 따라서 CSF의 제한된 샘플 볼륨이 최근까지 유체의 상세한 특성화를 배제한 마우스를 포함한 작은 동물에 대한 연구를 촉진합니다.
그럼에도 불구 하 고, 한 가지 주의할 점은 CSF에서 측정 된 단백질 손상 된 혈액-뇌 인터페이스 (BBI)로 인해 혈 청에서 경막 합성 및/또는 transudation에서 파생 될 수 있습니다. 불행히도, CSF의 단백질 분석만으로는 이 두 성분의 합만을 결정할 수 있다. 트랜스페더와 신경계 생산 단백질을 구별하기 위해 사용 가능한 단백질 분석 도구를 사용하는 CSF 단백질 측정은 혈청 농도의 개별 적인 가변성과 장벽 무결성에 맞게 조정되어야 합니다. 그러나, 이러한 조정은 임상 실습에서 일반적으로 사용되지만, 예를 들어, CSF IgG 지수는 경막 내 IgG 합성4,5,6을검출하기 위한 높은 민감도를 가지며, 현재까지 극소수의 연구 연구가 혈청 농도 및 장벽 무결성에 대한 CSF 단백질 농도를 보정한7,8.
현재, Reibergram 접근은 단백질의 장벽 기능 그리고 intrathecal 합성을 결정하는 가장 좋은 방법입니다. 이는 CSF/혈청 지수 다이어그램에서 그래픽 평가로서, 통합된 방식으로, 장벽(dys) 기능 과 경내 단백질 합성을 모두 분석하며, 독점적으로 혈액 유래 단백질9,10을지칭한다. 고농축 단백질 알부민은 일반적으로 간에서만 생산되기 때문에 기준 단백질로 선택되며 그 크기는 약 70 kDa이며, 작고 큰 단백질11사이의 중간기이기 때문이다. 분석 도면은 1987년 라이버와 펠겐하우어에 의해 처음 정의된 면역글로불린(Igs)11의주요 클래스에 대해, 수천 개의 인간 샘플의 분석으로부터 얻은 결과에 기초하여 경험적으로9. 이 접근법은 분자확산/유량(12)의이론에서 두 픽의 확산 법칙의 적용에 의해 이후에 확인되었다. 이러한 이론은 장벽을 통한 단백질의 확산을 입증하고 과장분포를 가지며 CNS9,13에서단백질의 역학을 정량적으로 설명할 수 있다. 전반적으로, 경막 내 단백질 합성을 입증하기 위한 Reibergram을 사용하는 이점은 혈청에서 CSF에 들어가는 단백질 분획뿐만 아니라 국소 생산으로 인해 CSF에서 발견되는 단백질의 양을 동시에 식별한다는 것입니다.
본 기사 및 관련 프로토콜은 CSF 및 혈액 채취에서 부터 CSF 단백질 수준을 교정하는 최종 계산에 이르기까지, 신경학상 마우스 모델에서 의학적 단백질 합성의 정량적 측정에 대한 전체 절차를 설명합니다. 장애. 이 절차는 (1) 임의의 CSF 단백질의 병리생리학적 기원및 (2) 장벽 무결성의 안정성 및 기능적 중요성을 평가하는 기준을 제공한다. 이 절차 및 프로토콜은 마우스 CSF 샘플을 평가하는 데 유용할 뿐만 아니라 신경 질환 및 인간 환자의 다양한 동물 모델에서 CSF를 분석하는 데에도 유용합니다.
프로토콜
모든 동물 작업은 다트머스의 가이젤 의과 대학에서 기관 동물 관리 및 사용 위원회 (IACUC)에 의해 검토되고 승인 된 프로토콜을 활용합니다.
1. 유체의 컬렉션
참고: 세럼과 CSF가 모두 필요합니다. 생존과 부검을 위해 각 유체 수집에 대한 두 개의 프로토콜이 필요합니다.
- 생존 절차를 이용한 세럼 및 CSF 수집
참고: 생존 유체 수집의 경우, 혈청 수집은 덜 침습적 인 절차이기 때문에 CSF 수집보다 선행되어야합니다. CSF는 혈청 추첨 후 1 주일 이내에 얻어야합니다.- 혈청 수집을위한 복고풍 궤도 출혈 절차.
참고 :이 절차는 마우스14의생존 출혈을위한 것입니다. 설명된 절차는 마우스의 모든 연령, 성별 및 균주에 적용됩니다. IACUC 규칙은 체중의 1 %의 최대 혈액 부피가 단일 혈액 무승부로 제거 될 수 있음을 규정하기 때문에, 절차는 15g 이상의 무게 마우스에서만 수행되는 것이 좋습니다.- 마우스가 포함된 케이지를 랙에서 적절한 작업 영역으로 이동합니다. 산소 유량계를 1L/min으로 켜서 마취 가스 기계를 준비합니다.
- 동물을 유도 챔버에 넣고 뚜껑을 단단히 닫습니다. 이소플루란 기화기를 3.5%로 켜고 동물이 재발할 때까지 모니터링합니다.
- 챔버에서 동물을 제거하고 페달 반사, 즉 단단한 풋 패드 핀치로 마취 수준을 평가하십시오. 절차를 수행하기 전에 마취의 적절한 깊이를 확인 : 회사 핀치에 대한 응답의 부족은 적절한 마취를 나타냅니다.
- 비 지배적 인 손의 엄지 와 검지 손가락으로 귀 뒤의 느슨한 피부를 잡고 마취 된 마우스를 억제하십시오. 검지 손가락을 사용하여 눈 위와 엄지 손가락 위에 피부를 다시 그려 눈 아래 피부를 다시 그립니다.
- 파운더 피펫 끝을 안구 아래 의 안구 소켓에 놓습니다(그림1,왼쪽 패널) 팁을 눈 소켓 의 중간쪽으로 약 45°로 향합니다(그림1,오른쪽 패널). 전진 통로 동안 손가락 사이에 파이펫을 회전시. 부드러운 압력을 가한 다음 혈액이 파이펫에 들어갈 때까지 풀어 놓습니다.
참고: 이 위치에서 한 번에 배출될 수 있는 최대 혈액량은 체중의 약 1%(예: 20g 마우스에서 0.2 mL)입니다. - 모세관을 부드럽게 제거하여 눈의 부상을 방지하고 수집된 혈액을 1.5mL 원심분리기 튜브에 넣습니다. 눈꺼풀을 닫고 추가 출혈을 방지하기 위해 거즈로 가벼운 압력을 가합니다. 일단 완전히 경고하고 모바일 (일반적으로 3-5 분), 그 보유 케이지에 마우스를 반환합니다.
- 실온(RT)에서 30-60분 동안 혈액을 응고한 다음, 4°C 냉장 원심분리기에서 2,000 x g에서 10분 동안 혈액을 원심분리합니다. 깨끗한 파이펫 기술을 사용하여, 새로운에 세럼을 수집, 라벨 0.5 mL 바이알. -80 °C에서 혈청 의 바이알을 즉시 동결.
- 생존 절차가 있는 CSF 수집
참고 : 이 절차는 생존 수술을위한 것이며, 2008 년 Liu와 Duff가 발표 한 프로토콜을 기반으로합니다.15. 마우스는 케타민 (20 mg/mL), 자일라진 (0.5 mg/mL), 그리고 아세프로마진 (0.5 mg/mL) 칵테일에 의해 마취된다.- 랙에서 마우스가 들어있는 케이지를 지정된 수술 작업 영역으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮 멸균 환경에서 수술 공간을 준비합니다. 사용되는 모든 기기와 재료가 수술 전에 멸균되었는지 확인하십시오.
- 마우스를 계량하고 필요한 마취 부피 (20g 마우스의 경우 0.1 mL의 마취 칵테일)를 계산합니다. 복강 내 마취주사 16. 몇 분 후, 적절한 마취를 보장하기 위해 풋 패드를 꼬집어 마우스를 테스트합니다. 더 많은 마취제가 필요한 경우, 마취 칵테일0.01-0.03 mL을 추가로 주입하십시오.
- 가위 나 면도기를 사용하여 머리의 작은 부분, 꼬리 끝, 두개골의 내측을 면도하여 CSF 컬렉션을위한 충분한 작업 영역을 노출하십시오. 마우스를 입체적 기기의 취약한 위치에 놓고 이어바(그림2A)를사용하여 머리를 안정시다.
참고: 마우스는 머리가 몸체와 거의 135° 각도를 형성할 수 있도록 배치됩니다(그림2A). 동물이 배치되면 수술 부위에서 멸균 장을 유지하기 위해 수술 용 드레이프가 사용됩니다. 명확한 접착제 커튼은 동물의 직접적이고 보다 집중적인 시각화를 허용하기 때문에 마우스에서 CSF 수집에 선호됩니다. - 30 % 클로르헨시딘 이과테이트로 수술 부위를 면봉하십시오. 멸균 메스를 사용하여, 시스터나 마그나 위에 근육을 노출하는 occiput에 열등 한 피부의 시상 절개를합니다.
- 집게로 무딘 해부에 의해, 피하 조직과 근육을 분리하여 시스터나 마그나를 노출시다(도 2B). 마이크로트랙터를 사용하여 근육을분리(그림 2B)하고시스테르나 마그나 위에 경막 매터 수막층을 노출시다.
- 멸균 인산완식염수(PBS)로 부드럽게 세척하여 혈액 오염을 제거합니다. 멸균 면봉으로 듀라 메이더를 건조시키고 30G 바늘로 시스터나 마그나를 덮는 멤브레인을 부드럽게 뚫습니다. CSF를 수집하기 위해 작은 유리 모세관을 신속하고 부드럽게 삽입합니다(도2C).
참고: 두개내 압력은 CSF가 모세관으로 자발적으로 흐르도록합니다(그림 2C). 마우스의 연령 및 크기에 따라, 각 마우스로부터 CSF의 약 5-12 μL이 얻어진다. - 조심스럽게 막에서 모세관을 제거합니다. 폴리에틸렌튜브(재료 표)를통해 튜브를 3 mL 주사기에 연결하고 수집된 CSF를 표지된 0.5 mL 튜브(그림2D)에주입합니다. 얼음에 유리병을 보관하십시오.
- 일회용 바늘로 폴리디옥사논의 봉합사(PDS)를 사용하고 매장된봉합사(17)를사용하여 절개를 닫습니다. 말린 혈액이나 조직의 부위를 청소하십시오.
- 진통제 처리로 buprenorphine 염산염의 0.05−0.1 mg/kg를 가진 마우스, 피하 또는 복강 내16를주입하십시오. 또한 탈수를 방지하기 위해 멸균 식염수 1 mL를 피하주사하십시오.
- 회복을 위해 깨끗하고 따뜻한 케이지에 마우스를 다시 놓습니다. 마우스가 이동하여 음식과 물에 닿을 수 있게 되면 케이지를 랙에 다시 놓습니다.
- 4°C 냉장 원심분리기에서 1,000 x g에서 10분 동안 원심분리기 CSF. 육안의 식별과 튜브 의 바닥에 붉은 펠릿의 존재에 대한 육안 검사에 의해 혈액 오염의 정도를 확인합니다. 혈액에 오염된 샘플을 버리십시오.
참고: 혈액 오염된 견본에 있는 CSF 단백질 양의 보정을 위해 이용된 공식은 CSF와 혈청, 헤마토크릿 (HCT) 및 적혈구 (RBC) 카운트에 있는 단백질 함량을 포함하는 방정식 매개변수를 기초로 합니다 CSF 및 혈액18. 그러나 이러한 보정 전략은 소량으로 인해 마우스 CSF 시편에 쉽게 적용할 수 없으므로 교정 전략을 육안으로 제한할 수 있습니다. - 깨끗한 파이펫 기술을 사용하여 CSF를 새로운 0.2 mL 튜브로 수집하고 펠릿을 세포로 남겨 둡습니다. 에어로졸로 인한 체적 손실을 줄이기 위해 PBS로 CSF 1:3을 희석하십시오. CSF의 바이알을 -80°C에서 즉시 동결시.
- 혈청 수집을위한 복고풍 궤도 출혈 절차.
- 비 생존 절차를 이용한 혈청 및 CSF 수집
참고: 생존이 아닌 유체 수집의 경우, CSF 컬렉션은 마우스에 펄스가 있어야 하므로 혈청 수집보다 먼저 합니다.- 부검에서 CSF 컬렉션
참고 : 이 절차는 비 생존 수술을위한 것이며, CSF의 약 10-20 μL은 각 마우스에서 얻어진다. 멸균 수술장은 권장되지만, 비생존 수술에는 필요하지 않습니다.- 랙에서 마우스가 들어있는 케이지를 편안한 작업 공간으로 옮습니다. CSF 컬렉션의 경우 1.1.2.2-1.1.2.7 단계 및 1.1.2.11-1.1.2.12 단계를 따릅니다. 세럼 수집을 위해 섹션 1.2.2로 진행하십시오.
- 심장 내 천자를 통한 혈액 채취 (개방 접근법)
참고: 예상되는 혈액 량은 체중의 약 3%(예: 20g 마우스에서 0.6 mL)입니다.- CSF 컬렉션을 따라 마우스가 풋패드를 꼬집어 충분히 마취되었는지 확인합니다. 어떤 반응이 관찰되면, 마취제의 두 번째 복용량을 투여하십시오. 반응이 관찰되지 않으면 계속진행하십시오.
- 동물을 등에 놓고 70%의 알코올로 복부에 피부를 면봉합니다. 외과 용 가위로 흉강을 열고 심장을 노출시면됩니다. 좌심실에 25G 바늘(3 mL 주사기 부착)을 삽입하고 주사기 플런저에 음압을 부드럽게 가합니다. 혈액이 수집 된 후 바늘을 철회.
- 동물이 죽임을 보장하기 위해 참수 또는 자궁 경부 탈구와 같은 안락사의 보조 방법을 수행합니다.
- 주사기의 플런저를 아래로 밀어 넣고 수집된 혈액을 1.5 mL 바이알에 주입합니다. RT에서 30-60 분 동안 혈액을 응고 한 다음 4 °C 냉장 원심 분리기에서 2,000 x g에서 10 분 동안 원심 분리합니다.
- 깨끗한 파이펫 기술을 사용하여, 새로운에 세럼을 수집, 라벨 0.5 mL 바이알. -80 °C 냉동고에서 혈청 의 바이알을 즉시 동결.
- 부검에서 CSF 컬렉션
2. 단백질 분석
- 바람직한 방법, 예를 들어, 루미넥스 기술을 사용하여, 일치하는 혈청 및 CSF 시편에서 표적 단백질(들) 및 알부민을 정량화한다.
참고: 여기서, Luminex 자기 기술로 주어진 예는, 그러나 효소 연결된 면역 흡착 분석 (ELISAs)를 포함하여 단백질 양을 측정하는 거의 모든 기술은, 현재 프로토콜에 적용될 수 있습니다. 이상적으로, CSF와 혈청 샘플은 동일한 플랫폼에서 알부민과 표적 단백질 모두에 대해 실행됩니다. 분석 조건은 항원 비드 커플링 농도, 혈청 및 CSF 샘플 희석, 각 분석물에 가장 적합한 표준 곡선 및 비특이적 반응성을 줄이기 위한 완충 조성과 같은 프로토콜의 중요한 단계에 최적화되어야 합니다. 상용 키트가 단백질 측정에 사용되는 경우, 예를 들어, 면역 글로불린 이소티핑 키트(재료 표)에 제시된 데이터를 얻는 데 사용됩니다.그림 3제조업체의 지침을 따라야 합니다.- 해동 시 및 분석 전에 원심 분리기 CSF 및 혈청 샘플(10분 동안 2,000 x g)을 사용하고 상판을 사용하여 필터 플레이트 및/또는 프로브의 막힘을 방지합니다. 적절한 샘플 희석을 위해 키트와 함께 제공된 분석 절차를 따르십시오. 그렇지 않으면 각 검사결과 및 유체에 대한 적절한 희석을 결정합니다. 그에 따라 PBS에서 샘플을 희석.
참고: 특정 지침이나 지침이 없는 경우, 각 측정기와 유체에 대한 희석은 연구 테스트 전에 가장 많이 속하는 농도 추정치를 얻는 데 필요한 적절한 희석 범위를 결정하여 확립되어야 합니다. 표준 곡선의 신뢰할 수 있는 범위. 분석할 생물학적 시료의 특성을 알면, 예를 들어 유체의 생리학적 및 병리학적 농도는 낮은, 중간 및 높은 분석물 함량의 샘플로 다른 희석을 시도할 수 있습니다. 시료의 예상 농도 범위가 선험적이라고 알려진 경우, 선택한 표준 곡선 범위 내에 있기 위해 샘플을 희석해야 하는 횟수를 계산한 후 희석을 선택할 수 있습니다.
주의: 희석 계수계산을 통해 CSF가 이미 희석된 경우 1:3을 기억하십시오. - 도 3에서데이터를 생성하는데 사용되는 바와 같이 관심 있는 각 단백질, 예를 들어, 알부민 및 IgG에 대한 표준 곡선을 준비하여, 직렬 희석 기준 표준 단백질에 의해. 표준 곡선을 준비하는 동안 다음 희석을하기 전에 각 높은 농도를 철저히 혼합하십시오.
참고: 선택된 정량화 방법에 관계없이, 시료에서 단백질(들) 농도를 추정하기 위해 분석이 수행될 때마다 표준 곡선을 포함하는 것이 필수적입니다. 기준 표준에 대한 최선의 선택은 관심 있는 단백질의 정제, 공지 농도이다. 표준 곡선을 정의하는 데 사용되는 데이터 포인트 및 복제수뿐만 아니라 특정 희석을 결정하는 것은 표준 곡선의 비선형도 정도에 따라 달라집니다. - 적절한 항체 결합 자기 비드 세트를 선택한다(재료표). 구슬의 개별 유리병에 대해, 1 분 동안 30 s와 소용돌이에 대한 각 바이알을 초음파 처리. 분석 / 세척 버퍼 (PBS, 1 % 소 혈청 알부민 [BSA])에서 각 세트 / μL의 최종 농도로 비드 주식을 희석하여 "작업 구슬 혼합물"을 준비하십시오. 혼합 된 구슬의 50 μL을 평평한 바닥 96 웰 플레이트(재료 표)에각 우물에 추가합니다.
주의: 형광 비드는 빛에 민감합니다. 따라서 절차 전반에 걸쳐 빛에 장시간 노출되지 않도록 보호해야합니다. - 잘 지도 워크시트에 배경, 표준 및 샘플의 배치를 다이어그램으로 가져옵니다.
- 각 배경에 50 μL의 분석/세척 버퍼를 추가하고 각 표준의 50 μL을 표준 곡선의 웰에 추가합니다. 각 희석된 시료의 50 mL를 적절한 우물에 적재하십시오. 호일로 접시를 감싸고 RT에서 30 분 동안 플레이트 셰이커에 교반 (~ 800 rpm)으로 배양하십시오.
- 접시를 핸드헬드자석(재료 표)에놓고 자석에 60년대동안 자석을 놓아 마그네틱 비드를 완벽하게 설정합니다. 잔류 액체를 제거하기 위해 흡수 패드에 플레이트와 탭 플레이트를 부드럽게 디캔팅하여 잘 내용물을 제거합니다.
- 자석에서 제거하여 플레이트를 세척하고, 분석/세척 버퍼 200μl을 추가하고, ~30s를 흔들어 서, 마지막으로 자석에 다시 부착하여 플레이트를 세척합니다. 3회 세탁을 반복합니다.
- 단백질 숙주 종에 대해 제기된 생체측검출 항체, 즉 비오틴 표지 항체를 분석/세척 완충액에서 4 μg/mL로 희석한다. 각 우물에 희석 검출 항체의 50 μL을 추가합니다. 접시를 덮고 ~ 800 rpm에서 플레이트 셰이커에 RT에서 30 분 동안 배양하십시오. 자석에 접시를 놓고 2.1.6 및 2.1.7 단계를 반복합니다.
- 희석 피코에리트린 (PE)-컨쥬게이트 스트렙타비딘 (SAPE) 에 4 μg / mL 분석 / 세척 버퍼. 희석된 SAPE 50 μL을 각 우물에 넣으세요. 접시를 덮고 ~ 800 rpm에서 플레이트 셰이커에 RT에서 30 분 동안 배양하십시오. 자석에 접시를 놓고 2.1.6 및 2.1.7 단계를 반복합니다.
- 자석에서 플레이트를 제거하고 분석 / 세척 버퍼의 100 μL에서 구슬을 다시 일시 중단하십시오. PE 형광 강도(FI)의 크기를 감지할 수 있는 이중 레이저 유동 계 측탐지 기기로 웰을 판독합니다.
참고: 생성된 신호는 비드의 표면에 부착된 표적 항원의 양에 비례한다. - 원시 데이터를 내보내고 표준 단백질 농도대비 검출 신호 FI를 그래프로 표시하여 표준 곡선을 생성합니다. 표준 곡선을 사용하여 샘플에서 의 aalyte(들)의 농도를 계산합니다.
참고: 알부민은 g/dL로 우선적으로 발현되며, 관심 있는 단백질은 mg/dL로 우선적으로 발현됩니다.
- 해동 시 및 분석 전에 원심 분리기 CSF 및 혈청 샘플(10분 동안 2,000 x g)을 사용하고 상판을 사용하여 필터 플레이트 및/또는 프로브의 막힘을 방지합니다. 적절한 샘플 희석을 위해 키트와 함께 제공된 분석 절차를 따르십시오. 그렇지 않으면 각 검사결과 및 유체에 대한 적절한 희석을 결정합니다. 그에 따라 PBS에서 샘플을 희석.
3. 인트라테칼 인덱스 계산
- 단백질 농도 값을 스프레드시트로 구성하고 다음 수식을 적용하여 결과를 분석합니다.
- Q알부민계산 :
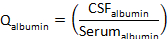
CSF알부민과 세럼알부민은 각각 일치하는 세럼과 CSF 표본에서 알부민의 농도입니다. - Q단백질계산 :

여기서 CSF단백질과 혈청단백질은 각각 일치하는 혈청 및 CSF 견본에 있는 표적 단백질의 사격량입니다. - 단백질 지수 계산:
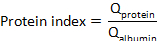
결과
이 대표적인 실험은 다발성 경화증(MS)의 두 가지 임상적으로 관련된 설치류 모델에서 IgG의 경내 합성을 비교하기 위한 것이었다: PLP139-151-유도된재발 실험적 자가면역 뇌척수염(R-EAE) 및 만성 진행성, 테일러의 뮤린 뇌척수염 바이러스 유도 데미엘린 질환.. R-EAE는 재발-송금 MS를 이해하는 데 유용한 모델이지만 TMEV-IDD 모델은 만성 프로그레시브 MS19를특징으로 합니다.
본 연구에서는 R-EAE(n=12) 및 TMEV-IDD(n=28)에서의 경막 내 IgG 합성의 정량적 분석이 수행되었다. 두 그룹 모두 질병의 절정에 분석되었다. 10개의 마우스의 추가 그룹은 샴 처리되었고 연령일치 대조군(cR-EAE n = 4, cTMEV-IDD sham n=6)으로 제공되었다.
시판되는키트(표)를이용한 마그네틱 비드 계 접근법을 사용하여 일치하는 혈청 및 CSF 시편에서 총 IgG를 측정하였다. 총 IgG 값은 하위 클래스 IgG1, IgG2a, IgG2b 및 IgG3 값의 합계에서 파생되었습니다. 알부민은 그 당시 알부민에 대한 루미넥스 분석이 제공되지 않았기 때문에 상업용 마우스 알부민 ELISA키트(재료표)로측정하였다. 모든 측정은 제조업체의 지시에 따라 신중하게 수행되었습니다. 알부민 지수(Q알부민)와IgG 지수(QIgG/Q알부민)는CSF에서 CNS 유래 IgG와 비교하여 혈액-을 분화하는데 사용되었다.
도 3A에도시된 바와 같이, MS의 두 설치류 모델의 CSF에서 실제 수준의 레벨이 현저히 증가하되 상응하는 연령일치 샴 컨트롤(p ≤ 0.026)과 비교하면. 그러나, R-EAE 마우스는 이들 마우스에서 장벽의 투과성 증가를 나타내는 Q알부민 값(p ≤ 0.019)을 현저하게 향상시켰습니다(도3B). 반대로, TMEV-IDD와 샴 마우스(p=0.49) 사이에 Q알부민의 차이가 존재하지 않으므로, TMEV-IDD 마우스7,8에서의 온전한 장벽에 대한 우리의 이전 발견을 확증한다. R-EAE 및 TMEV-IDD에서 IgG를 생산한 경외와 내-테르칼리를 더욱 구별하기 위해, IgG 지수는 TMEV-IDD마우스(p ≤ 0.0006)에서 상당히 높은 값을 나타내고, 따라서 이 모델에서 IgG 내 생산을 측정하였다(그림3C).
높은 IgG 지수와 함께 TMEV-IDD 마우스의 온전한 장벽은 이 모델에서 항체가 CNS 내에서 생성된다는 것을 시사한다. 반대로, R-EAE에서, 상당한 장벽 고장 및 낮은 IgG 지수는 CSF IgG가 주로 경막 내 B 세포가 아닌 말초에 의해 생산된다는 증거를 제공하며, 또한 MS의 급성 모델에서 CSF IgG가 주로 혈청에서 유래된다는 것을 시사한다.

그림 1: 마우스의 레트로 궤도 출혈. 왼쪽: 레트로 궤도 부비동, 안구 및 궤도 뒤를 기준으로 바늘을 올바르게 배치합니다. 오른쪽: 피펫 위치는 눈의 내측 캔에서 시작하여 궤도의 등측으로 미끄러집니다. 모세관은 45°의 각도로 삽입됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 마우스에서의 CSF 수집. (A)이어바는 마우스의 머리를 지지하고, 마우스는 머리가 몸체와 135° 각도를 형성할 수 있도록 내려놓습니다. 화살표는 노출된 시스터나 마그나를 가리킵니다. (B)집게로 무딘 해부에 의해, 근육은 시스테르나 마그나 (화살표로 가리키는)를 노출하도록 분리된다. 마이크로 트랙터는 근육을 분리하는 데 사용됩니다. (C)작은 유리 모세관이 시스터나 마그나로부터 CSF를 수집하는 데 사용된다. CSF는 두개내 압력으로 인해 모세관으로 자발적으로 흐릅니다. 화살표는 모세관에서 수집된 CSF를 가리킵니다. (D)CSF는 변형된 3 mL 주사기를 통해 0.5 mL 튜브로 전달된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: R-EAE 및 TMEV-IDD에서 IgG의 혈액-뇌 장벽 기능 및 경막 합성. 도트 블롯 을 나타내는(A)루미넥스 기술에 의해 측정된 총 IgG(mg/dL)의 CSF 수준,(B)알부민 CSF/혈청 지수(Q알부민),및(C)IgG 지수(QIg/Q알부민)R-EAE 및 TMEV-IDD 마우스뿐만 아니라 연령일치 제어 마우스(cR-EA). 가로선은 해당 그룹의 중앙값을 나타냅니다. p< 0.0001; p < 0.001; **p < 0.01; *p < 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
증가된 CSF 단백질 농도의 평가를 위한 정량적 방법은 CNS의 생리적 및 병리학적 상태의 특성화에 유용한 도구이다. 그러나, CSF 단백질 수준의 신뢰할 수 있는 정량화를 넘어, CSF 단백질의 검출은 CSF에서 혈액과 CNS 유래 분획을 구별하는 결과의 발현을 필요로 한다. 그러나, 현재까지, 일반적으로 사용되는 단백질 정량 화 분석제는 높은 처리량 공구의 도움으로조차, 2개의 단백질 분대 사이 차별을 허용하지 않습니다. 따라서, CNS 구획 내에서 합성된 단백질과 혈액으로부터 유래된 단백질을 구별하기 위해 단백질 측정에 대한 특이적 교정이 제안되었다. 이러한 교정은 혈청 농도와 장벽 무결성 모두에서 개별적인 가변성을 보상합니다. 전반적으로, 이러한 교정은 CSF/혈청 지수(Q단백질)의계산을 기반으로 하며, 이는 혈청 단백질의 개별 농도의 차이로 인한 변동성을 감소시킵니다. 배리어 기능에서의 개별적인 차이와 관련된 Q단백질의 변이는 CsF/혈청 알부민 지수(Q알부민)에Q단백질을 연관시킴으로써 더욱 낮출 수 있다. 두 보정의 조합은 일반적으로 단백질 지수로 알려져 있으며 Q단백질/Q알부민 비율로 계산됩니다4,6.
알부민, 합성 하 고 간에서 분 비, 혈 류에서 순환 하는 주요 플라즈마 단백질. 알부민은 CNS 외부에서 독점적으로 생산되고 CSF의 수준이 낮기 때문에 (~0.15 g / dL), 증가 된 CSF 알부민 수준은 BBI의 손상이나 외상성 CSF 수집으로 인한 혈액 오염을 나타냅니다. 이러한 조건에서 알부민은 혈청 농도에 비례하여 혈청에서 CSF로 트랜스됩니다. 따라서, 혈액 오염이 없는 경우, Q알부민은 장벽기능(20)의지표로서 사용될 수 있다. 반대로, Q알부민은 그대로 BBI21인간과동물의 정상 범위 내에서 일정하게 유지된다. 이러한 지수4,6을 사용하여 단백질 합성 계산에서 근본적인 가정은 새는 장벽이 있는 CSF 단백질의 증가량이 CSF 알부민 농도의 증가에 비례한다는 것이다. 이 가정은 실험적으로 1977 4에서연구 결과에서 확인되었습니다, 있는 저자는 MS 환자에서 건강한 인간 적인 혈청에서 얻은 방사성 표지된 IgG 및 알부민의 혈액-CSF 통로를 감시했습니다.
알부민과 유사하게, 혈액에 있는 어떤 단백질든지 BBI를 교차할 수 있습니다. 장벽이 손상되지 않은 경우, Q단백질은 상대적으로 일정하다. 알부민과는 달리, 그러나, 많은 단백질은 또한 CNS 내에서 합성될 수 있습니다. 결과적으로, 변경 된 Q단백질 손상 된 장벽 및 증가 된 단백질 생산에서 발생할 수 있습니다. 그럼에도 불구하고, 높은 CSF 단백질 농도가 손상된 BBI에 기인할 때, Q단백질 및 Q알부민 둘 다에 대한 값은 그대로 장벽을 가진 동물의 동일한 지수에 대한 값에 비해 증가된다. 대조적으로, 장벽이 손상되지 않은 경우, 증가된 CSF 단백질 농도는 증가된 경막 합성으로 인해 가장 가능성이 높으며, 오직 Q단백질만이 궁극적으로 증가된다.
단백질 지수의 사용은 5가지 인자에 의해 부분적으로 제한될 수 있다: 1) 건강한 동물에서 CSF 알부민 농도의 큰 가변성, 2) 단백질의 상이한 유체역학적 반경, 3) 단백질의 내인성 CNS 발현, 4) 상이한 샘플링 기술, 및 5) BBI의 형태학적 차이. 건강한 동물의 CSF 알부민 농도의 큰 가변성은 최종 단백질 지수에 대한 값에서 상당한 가변성을 초래합니다. 인간에서, 예를 들면, Q알부민은 22세로증가하기 때문에 나이에 따라 달라진다. 이전 보고서는 또한 건강한 인구23에서Q알부민의 성별 기반 차이를 언급했다. 마찬가지로, 마우스 알부민 농도는 연령 및 마우스 균주24에의존하며, 예를 들어, 젊은, 남성, C57Bl/6 마우스를 위한 Q알부민은 노인, 여성, DBA/1J 마우스에 대한 Q알부민과 다를 수 있다. 따라서 장벽 무결성에 대한 표준화된 기준 간격은 종 전체 및 종 내에서 확립할 수 없으며 특정 실험 조건에 따라 적절한 임계값을 계산해야 합니다.
단백질 중 일반적인 색인에 있는 가변성을 일으키는 원인이 되는 또 다른 요인은 그들의 분자 크기입니다. BBI를 통한 혈청 단백질의 통과는 분자 크기에 따라 달라지며, 클리어런스 속도와 분자량(MW) 사이의 상관관계는 BBI의 투과성을 평가하기 위해 널리 사용된다. 일반적인 단백질 구조는 수십에서 수천 개의 아미노산에 이르기까지 다양한 크기입니다. 몇몇 단백질은 8와 20 kDa 사이에서 구역 수색하는 분자량과 가진 chemokines와 같은 상대적으로 작은 분자 크기의 입니다. 이러한 낮은 MW는 BBI의 교차를 선호, 궁극적으로 더 높은 정상 단백질 지수의 결과. 다르게, IgM 같이 그밖 단백질은, 아주 큰 (900-950 kDa), 그러므로 일반적인 조건에서 아주 낮은 색인을 보여주는6. 그러나, 이것은 항상 경우, 이후, 비슷한 MW에도 불구 하 고, 일부 단백질 다른 단백질 보다 훨씬 더 장벽에 침투, 아마도 다른 모양 때문에. 따라서, 단백질의 확산 계수, 따라서 그것에서 계산된 유체역학적 반수, 분자의 크기 및 형상 둘 다에 의존한다25. 단백질의 기하학적 부피와 유체역학적 부피의 근본적인 차이는 150 kDa 이상의 큰 단백질에서 가장 분명하게 드러납니다. 감소하는 클리어런스 속도는, 예를 들어, 세룰로플라스민(132 kDa), IgG(150 kDa), IgA(150 kDa)는 유사한 MW25를가지는 이들 세 단백질의 유체역학적 이질성을 반영한다. 정상적인 상황에서 단백질의 경위 생산이 있을 수도 있습니다. 일부 케모카인, 예를 들어, CXCL10은 전형적으로 장내 로 생산되는 반면, 다른 케모카인은26,27이아닌 다른 화학요법이다. 이것은 대부분의 실험 적인 조건의 단백질 색인의 해석이 일반적으로 나이, 성별 및 긴장 일치 처리되지 않은 통제의 분석을 요구한다는 것을 의미합니다.
체액의 단백질 수준은 또한 다른 샘플링 기술에 의해 영향을 받을 수 있습니다. 여기서 설명한 바와 같이 CSF 수집에 대한 문제가 아닐 수도 있지만-기재된 생존 및 비생존 절차 사이의 CSF 샘플링에 있어서는 차이가 없다-상이한 혈액 수집 방법은 총 혈청 단백질 양에 영향을 미칠 수 있다. 혈액 수집의 일부 방법은 동맥 혈액을 산출, 다른 사람은 정맥 혈액을 산출, 여전히 다른 사람은 모두의 혼합물을 산출하는 동안14. 생존 레트로 궤도 출혈로부터 얻은 샘플은 정맥 혈액과 조직 유체의 혼합물인 반면, 심장 천자로부터의 말단 혈액 수집은 정맥 또는 동맥 혈액 또는14의혼합물을 얻을 수 있다. 건강한 동물에서, 동맥 혈청의 총 단백질 및 알부민 함량은 정맥 혈액혈청(28)의동일한 분획보다 약간 높을 수 있다. 이것은 생존과 비 생존 견본이 비교될 때 고려되어야 합니다.
마지막으로, 고려해야 할 중요한 특징은 적어도 2개의 별개의 장벽, 뇌 미세혈관의 내피에 위치한 혈액-뇌 장벽(BBB)을 포함하는 BBI의 이질적인 형태학적 구조와 코로이드신경총(29)의상피에 위치한 혈액-CSF 장벽(BCSF)이다. 두 장벽 은 다른 메커니즘에 의해 그렇게하지만 두 장벽은 말초와 뇌척수구 사이의 분자와 세포의 통과를 제한하고 조절합니다. BBB는 세포 들 사이 복잡 한 상호 작용을 특징으로 하는 실제 물리적 장벽, BCSF는 생리 장벽의 더 많은, 주로 CSF 흐름에 따라 달라 집니다. CSF 생산, 방출 및 신경학적 조건 및/또는 외상으로 인한 유량의 감소는 BCSF 기능을 손상시키며, 이에 따라 Q알부민9,30,31,32를증가시게 된다. 따라서, Q알부민은 BBB 또는 일반적으로 BBI 투과성보다는 BCSF 투과성의 더 나은 마커 역할을한다.
요약하면, 단백질 지수의 계산은 비교적 간단하고 잘 특성화된 방법이며, 트랜스데이트와 경외생산 단백질 간의 차별에 대한 잘 특성화되어 있다. CSF 샘플에서 단백질의 일반적인 측정을 교정하기 위해 이 포뮬러를 적용하는 이점은 단백질의 대내 합성을 정량화하고 BBI, 특히 BCSF(dys) 기능을 측정하는 객관적인 변수를 생성한다는 것입니다. 이러한 접근법의 견고성을 감안할 때, Q알부민 및 단백질 지수를 통한 CSF 단백질 양의 보정은 (1) 임의의 CSF 단백질의 병리생리학적 기원및 (2) 장벽 무결성의 안정성 및 기능적 중요성을 평가하는 기준을 제공한다. 여기서 CSF 및 혈액 수집으로부터 신경 질환에 대한 마우스 모델에 적용되는 총 CSF 단백질 양을 교정하는 최종 계산에 이르기까지 상세한 프로토콜이 제시된다. 그러나, 동일한 프로토콜은 인간을 포함한 임의의 동물에서 CSF 및 단백질의 단백질의 연구 및 신강 합성에 용이하게 적응될 수 있다. Q알부민 및 IgG 지수는 이미 염증성 신경 질환의 진단을 위한 임상 실습에서 일반적으로 사용되고있다 6. 이러한 동일한 파라미터는 또한 염증성 탈수성 질환26,33,34를가진 환자에서 광범위한 사이토카인 및 케모카인을 평가하는 데 성공적으로 사용되어 왔다.
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 비교 의학 및 연구 센터의 직원에게 감사 (CCMR) 이러한 연구에 사용되는 마우스의 그들의 전문가 치료에 대한 다트머스에서. 보른스타인 연구 기금은 이 연구에 자금을 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 329650 | |
| 1 mL syringe | BD | 329622 | |
| 25 gauge needle | BD | 305122 | |
| 3 mL syringe | BD | 309582 | |
| 30 gauge insulin needle | BD | 305106 | |
| Absorbent pads | Any suitable brand | ||
| Acepromazine | Patterson Vet Supply Inc | ||
| BioPlex Handheld Magnetic Washer | BioRad | 171020100 | Magnet |
| BioPlex MAGPIX Multiplex Reader | BioRad | 171015001 | |
| BioPlex Pro Flat Bottom Plates | BioRad | 171025001 | |
| Biotinilated detection antibody | Any suitable source | The antibody has to be directed against the species of the protein of interest. | |
| Bovine Serum Albumin (BSA) | Sigma | A4503 | |
| Buprenorphine hydrochloride | PAR Pharmaceutical | NDC 42023-179-05 | |
| Capillary Tubes | Sutter Instrument | B100-75-10 | OD: 1.0 mm, ID: 0.75 mm Borosilicate glass 10 cm; drawn over Bunsen to make ID smaller. |
| Centrifuge tube, 0.2 mL | VWR | 20170-012 | |
| Centrifuge tube, 0.5 mL | VWR | 87003-290 | |
| Centrifuge tube, 1.5 mL | VWR | 87003-294 | |
| Chlorhexidine diacetate | Nolvasan | E004272 | |
| Disposable pipettes tips | Any suitable brand | ||
| Ear bars | KOPF Instruments | 1921 or 1922 | |
| Ethanol | Kopter | V1001 | |
| Freezer | VWR | VWR32086A | |
| Gauze | Medline | NON25212 | |
| Heating pad | Sunbeam | XL King Size SoftTouch, 4 Heat Settings with Auto-Off, Teal, 12-Inch x 24-Inch | |
| Induction Chamber | VETEQUIP | ||
| Isoflurane | Patterson Vet Supply Inc | NDC 14043-704-06 | |
| Ketamine (KetaVed) | Patterson Vet Supply Inc | ||
| MagPlex Microspheres (antibody-coupled) | BioRad | Antibody-coupled magnetic bead | |
| Microplate Shaker | Southwest Scientific | SBT1500 | |
| Microretractors | Carfill Quality | ACD-010 | Blunt - 1 mm |
| Microsoft Office (Excel) | Microsoft | ||
| MilliPlex MAP Mouse Immunoglobulin Isotyping Magnetic Bead Panel | EMD Millipore | MGAMMAG-300K | Commercial kit for the quantification through Luminex of a panel of immunoglobulin isotypes and subclasses in mouse fluids. |
| Mouse Albumin capture ELISA kit | Novus Biological | NBP2-60484 | Commercial kit for the quantification through ELISA of albumin in mouse fluids. |
| Multichannel pipette | Eppendorf | 3125000060 | |
| Non-Sterile swabs | MediChoice | WOD1002 | Need to be autoclaved for sterility |
| Oxygen | AIRGAS | OX USPEA | |
| Pasteur Pippettes | Fisher | 13-678-20A | 5 & 3/4" |
| PDS suture with disposable needle, 6-0 Prolen | Patterson Vet | 8695G | P-3 Reverse Cutting, 18" |
| PE-Streptavidin | BD Biosciences | 554061 | |
| Pipetters | Eppendorf | Research seriers | |
| Polyethylene tubing | |||
| Refrigerated Centrifuge | Beckman Coulter | ALLEGRA X-12R | |
| Scale | Uline | H2716 | |
| Scalpel | Feather | EF7281 | |
| Shaver | Harvard Apparatus | 52-5204 | |
| Standard proteins | Any suitable source | The best choice for a reference standard is a purified, known concentration of the protein of interest. | |
| Stereotaxic instrument | KOPF Instruments | Model 900LS | Standard Accessories |
| Sterile 1 x PBS | Corning Cellgro | 21-040-CV | |
| Sterile saline | Baxter | 0338-0048-02 | 0.9 % Sodium Chloride Irrigation USP |
| Surgical Forceps Curved, 7 (2) | Fine Science Tools | 11271-30 | Dumont |
| Surgical Scissors | Fine Science Tools | 14094-11 | Stainless 25x |
| Vaporizer + Flow meter | Moduflex Anhestesia Instruments | ||
| Vortex | Fisher | 02-215-414 | |
| Warming pad | Kent Scientific Corporation | RT-JR-20 | |
| Water Sonicator | Cole Parmer | EW-08895-01 | |
| Xylazine | Patterson Vet Supply Inc |
참고문헌
- Whedon, J. M., Glassey, D. Cerebrospinal fluid stasis and its clinical significance. Alternative Therapies in Health and Medicine. 15 (3), 54-60 (2009).
- Kang, J. H., Vanderstichele, H., Trojanowski, J. Q., Shaw, L. M. Simultaneous analysis of cerebrospinal fluid biomarkers using microsphere-based xMAP multiplex technology for early detection of Alzheimer's disease. Methods. 56 (4), 484-493 (2012).
- Barro, C., et al. Fluid biomarker and electrophysiological outcome measures for progressive MS trials. Multiple Sclerosis. 23 (12), 1600-1613 (2017).
- Tourtellotte, W. W., et al. Multiple sclerosis: measurement and validation of central nervous system IgG synthesis rate. Neurology. 30 (3), 240-244 (1980).
- Bonnan, M. Intrathecal IgG synthesis: a resistant and valuable target for future multiple sclerosis treatments. Multiple Sclerosis International. 2015, 296184 (2015).
- Reiber, H. Cerebrospinal fluid--physiology, analysis and interpretation of protein patterns for diagnosis of neurological diseases. Multiple Sclerosis. 4 (3), 99-107 (1998).
- DiSano, K. D., Linzey, M. R., Royce, D. B., Pachner, A. R., Gilli, F. Differential neuro-immune patterns in two clinically relevant murine models of multiple sclerosis. Journal of Neuroinflammation. 16 (1), 109 (2019).
- Pachner, A. R., Li, L., Lagunoff, D. Plasma cells in the central nervous system in the Theiler's virus model of multiple sclerosis. Journal of Neuroimmunology. 232 (1-2), 35-40 (2011).
- Reiber, H. Flow rate of cerebrospinal fluid (CSF)--a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. Journal of Neurological Sciences. 122 (2), 189-203 (1994).
- Reiber, H., Zeman, D., Kusnierova, P., Mundwiler, E., Bernasconi, L. Diagnostic relevance of free light chains in cerebrospinal fluid - The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clinica Chimica Acta. 497, 153-162 (2019).
- Reiber, H., Felgenhauer, K. Protein transfer at the blood cerebrospinal fluid barrier and the quantitation of the humoral immune response within the central nervous system. Clinica Chimica Acta. 163 (3), 319-328 (1987).
- Dorta-Contreras, A. J. Reibergrams: essential element in cerebrospinal fluid immunological analysis. Revista de Neurologia. 28 (10), 996-998 (1999).
- Metzger, F., Mischek, D., Stoffers, F. The Connected Steady State Model and the Interdependence of the CSF Proteome and CSF Flow Characteristics. Frontiers Neuroscience. 11, 241 (2017).
- Wolforth, J. Methods of blood collection in the mouse. Laboratory Animals. 29, 47-53 (2000).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. Journal of Visualized Experiments. (21), e960 (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Johnston, S. A., Tobias, K. M. Veterinary Surgery: Small Animal Expert Consult - E-Book. Elsevier Health Sciences. , (2017).
- Nigrovic, L. E., Shah, S. S., Neuman, M. I. Correction of cerebrospinal fluid protein for the presence of red blood cells in children with a traumatic lumbar puncture. Journal of Pediatrics. 159 (1), 158-159 (2011).
- McCarthy, D. P., Richards, M. H., Miller, S. D. Mouse models of multiple sclerosis: experimental autoimmune encephalomyelitis and Theiler's virus-induced demyelinating disease. Methods in Molecular Biology. 900, 381-401 (2012).
- Link, H., Tibbling, G. Principles of albumin and IgG analyses in neurological disorders. II. Relation of the concentration of the proteins in serum and cerebrospinal fluid. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 391-396 (1977).
- Tibbling, G., Link, H., Ohman, S. Principles of albumin and IgG analyses in neurological disorders. I. Establishment of reference values. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 385-390 (1977).
- Deisenhammer, F., et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. European Journal of Neurology. 13 (9), 913-922 (2006).
- Johanson, C. E., Stopa, E. G., McMillan, P. N. The blood-cerebrospinal fluid barrier: structure and functional significance. Methods in Molecular Biology. 686, 101-131 (2011).
- Zaias, J., Mineau, M., Cray, C., Yoon, D., Altman, N. H. Reference values for serum proteins of common laboratory rodent strains. Journal of the American Association for Laboratory Animal Science. 48 (4), 387-390 (2009).
- Felgenhauer, K., Renner, E. Hydrodynamic radii versus molecular weights in clearance studies of urine and cerebrospinal fluid. Annals of Clinical Biochemistry. 14 (2), 100-104 (1977).
- Pachner, A. R., DiSano, K., Royce, D. B., Gilli, F. Clinical utility of a molecular signature in inflammatory demyelinating disease. Neurology, Neuroimmunology & Neuroinflammation. 6 (1), 520 (2019).
- Pachner, A. R., Li, L., Gilli, F. Chemokine biomarkers in central nervous system tissue and cerebrospinal fluid in the Theiler's virus model mirror those in multiple sclerosis. Cytokine. 76 (2), 577-580 (2015).
- Gerbi, C. Protein concentration in the arterial and venous renal blood serum of the rabbit. Archives of Biochemistry and Biophysics. 31 (1), 49-61 (1951).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Reiber, H. Proteins in cerebrospinal fluid and blood: barriers, CSF flow rate and source-related dynamics. Restorative Neurology and Neuroscience. 21 (3-4), 79-96 (2003).
- Reiber, H. Knowledge-base for interpretation of cerebrospinal fluid data patterns. Essentials in neurology and psychiatry. Arquivos de Neuropsiquiatria. 74 (6), 501-512 (2016).
- Kuehne, L. K., Reiber, H., Bechter, K., Hagberg, L., Fuchs, D. Cerebrospinal fluid neopterin is brain-derived and not associated with blood-CSF barrier dysfunction in non-inflammatory affective and schizophrenic spectrum disorders. Journal of Psychiatric Research. 47 (10), 1417-1422 (2013).
- Bromader, S., et al. Changes in serum and cerebrospinal fluif cytokines in response to non-neurological surgery: an observational study. Journal of Neuroinflammation. 9, 242 (2012).
- Starhof, C., et al. Cerebrospinal fluid pro-inflammatory cytokines differentiate parkinsonian syndromes. Journal of Neuroinflammation. 15 (1), 305 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유