Method Article
Misurazione quantitativa delle proteine intratecalliamente sintetizzate nei topi
In questo articolo
Riepilogo
Livelli elevati di proteine del fluido spinale possono essere il risultato della diffusione della proteina plasmatica attraverso una barriera emato-encefalica alterata o sintesi intratea. In questo articolo viene presentato un protocollo di test ottimizzato che aiuta a discriminare entrambi i casi e fornisce misurazioni quantitative delle proteine sintetizzate intrathecally.
Abstract
Il liquido cerebrospinale (CSF), un fluido trovato nel cervello e nel midollo spinale, è di grande importanza sia per la scienza di base che clinica. L'analisi della composizione delle proteine CSF fornisce informazioni cruciali nella ricerca sulle neuroscienze di base e sulle malattie neurologiche. Un avvertimento è che le proteine misurate in CSF possono derivare sia dalla sintesi intrateca che dalla trasposizione dal siero, e l'analisi delle proteine del CSF può determinare solo la somma di questi due componenti. Per distinguere tra la trasposizione proteica dal sangue e le proteine prodotte intratelamente nei modelli animali e negli esseri umani, le misurazioni di profilazione delle proteine CSF utilizzando strumenti di analisi delle proteine convenzionali devono includere il calcolo dell'albumina CSF/serum quotient (Qalbumin),un marcatore dell'integrità dell'interfaccia emato-encefalica (BBI), e l'indice proteico(proteinaQ /Qalbumin ), una stima della sintesi di proteine intrateche. Questo protocollo illustra l'intera procedura, dalla raccolta del CSF e del sangue ai calcoli dei quozienti e degli indici, per la misurazione quantitativa della sintesi delle proteine intrateche e la compromissione della BBI nei modelli murini di disturbi neurologici.
Introduzione
Il liquido cerebrospinale (CSF), un liquido chiaro e incolore che circonda il cervello e il midollo spinale, ha una grande importanza clinica e scientifica di base. Il CSF conserva l'ambiente elettrolitico del sistema nervoso centrale (CNS), bilancia lo stato di base dell'acido sistemico, fornisce nutrienti alle cellule neuronali e gliali, funziona come sistema linfatico per il SNC e trasporta ormoni, neurotrasmettitori, citochine e altri neuropepti in tutto il CNS1. Così, poiché la composizione csF riflette l'attività del SNC, questo fluido offre un prezioso, anche se indiretto, accesso per caratterizzare lo stato fisiologico e patologico del SNC.
CSF è stato utilizzato per diagnosticare condizioni che colpiscono il SNC per oltre un centinaio di anni, e per la maggior parte di questo tempo, è stato studiato principalmente dai medici come strumento diagnostico. Tuttavia, negli ultimi anni i neurobiologi hanno riconosciuto il potenziale della CSF per studiare la fisiopatologia del SNC. In particolare, nel regno delle neuroscienze sono stati introdotti diversi strumenti di analisi delle proteine ad alto contenuto di velocità, consentendo uno studio dettagliato della composizione delle proteine del CSF, con l'aspettativa che questa analisi possa contribuire a fornire informazioni sui cambiamenti dinamici all'interno del SNC.
Gli sviluppi tecnologici nelle tecniche di immunoanalisi multiplex come le tecnologie Luminex e Simoa2,3, forniscono ai ricercatori oggi la capacità di rilevare centinaia di proteine a concentrazioni molto basse. Inoltre, queste stesse tecnologie consentono l'uso di piccoli volumi di campioni, promuovendo così studi su piccoli animali, compresi i topi, in cui volumi di campioni limitati di CSF hanno impedito caratterizzazioni dettagliate del fluido fino a poco tempo fa.
Tuttavia, un avvertimento è che le proteine misurate in CSF possono derivare da sintesi intrateca e/o trasuda dal siero a causa di un'interfaccia emato-encefalica danneggiata (BBI). Sfortunatamente, l'analisi delle proteine del CSF da sola può determinare solo la somma di questi due componenti. Per distinguere tra proteine prodotte innodate e intratelamente, le misurazioni delle proteine CSF utilizzando qualsiasi strumento di analisi delle proteine disponibile devono essere regolate per la variabilità individuale nelle concentrazioni di siero e l'integrità delle barriere. Tuttavia, anche se questa regolazione è comunemente utilizzata nella pratica clinica, ad esempio, l'indice CSF IgG, che ha un'elevata sensibilità per rilevare la sintesi intrateca IgG4,5,6, ad oggi pochissimi studi di ricerca hanno corretto le concentrazioni di proteine CSF per la concentrazione di siero e l'integrità della barriera7,8.
Attualmente, l'approccio Reibergram è il modo migliore per determinare la funzione di barriera e la sintesi intratecala delle proteine. Si tratta di una valutazione grafica nei diagrammi quoziente CSF/siero che analizza, in modo integrato, sia la barriera (di)funzione che la sintesi delle proteine intrateche, riferendosi a una proteina esclusivamente derivata dal sangue9,10. L'abbondante albumina proteica è solitamente scelta come proteina di riferimento perché è prodotta solo nel fegato e perché la sua dimensione, circa 70 kDa, è intermedia tra proteine piccole e grandi11. Il diagramma di analisi è stato definito per la prima volta da Reiber e Felgenhauer nel 1987 per le principali classi di immunoglobuine (Igs)11, essendo empiricamente basate sui risultati ottenuti dall'analisi di migliaia di campioni umani9. L'approccio è stato successivamente confermato dall'applicazione delle due leggi di diffusione dei due Fick nella teoria della diffusione molecolare/velocità di flusso12. Tale teoria dimostra la diffusione di una proteina attraverso la barriera ha una distribuzione iperbolica e può spiegare quantitativamente la dinamica delle proteine nel CNS9,13. Nel complesso, il vantaggio di utilizzare il Reibergram per dimostrare la sintesi delle proteine intratecali è che identifica contemporaneamente la frazione proteica che entra nel CSF dal siero e la quantità di proteine presenti nel CSF a causa della produzione locale.
Il presente articolo e il relativo protocollo descrivono l'intera procedura, dalla raccolta del CSF e del sangue ai calcoli finali che correggono i livelli di proteine CSF, per la misurazione quantitativa della sintesi delle proteine intrateche in modelli murini di neurologia Disturbi. Questa procedura fornisce una linea di base rispetto alla quale valutare (1) l'origine patofisiologica di qualsiasi proteina CSF e (2) la stabilità e il significato funzionale dell'integrità della barriera. Questa procedura e questo protocollo non sono solo utili per valutare campioni di CSF dei topi, ma sono anche utili nell'analisi della CSF in una moltitudine di modelli animali di malattie neurologiche e pazienti umani.
Protocollo
Tutto il lavoro sugli animali utilizza protocolli esaminati e approvati dall'Institutional Animal Care and Use Committee (IACUC) della Geisel School of Medicine di Dartmouth.
1. Raccolta di fluidi
NOTA: sono necessari sia il siero che il CSF. Due protocolli per ogni raccolta di fluidi sono necessari per la sopravvivenza e necropsia.
- Raccolta di siero e CSF con procedure di sopravvivenza
NOTA: Per la raccolta dei fluidi di sopravvivenza, la raccolta del siero dovrebbe precedere la raccolta di CSF in quanto è una procedura meno invasiva. Il CSF deve essere ottenuto entro una settimana dall'estrazione del siero.- Procedura di sanguinamento retroorbitale per la raccolta del siero.
NOTA: Questa procedura è per la sopravvivenza del sanguinamento dei topi14. La procedura descritta si applica a qualsiasi età, sesso e sforzo di topi. Poiché le regole Di IACUC impongono che un volume di sangue massimo dell'1% del peso corporeo possa essere rimosso come un singolo prelievo di sangue, si raccomanda che la procedura venga eseguita solo su topi che pesano più di 15 g.- Spostare le gabbie contenenti topi dal rack in un'area di lavoro appropriata. Preparare la macchina del gas per anestesia attivando il misuratore di flusso di ossigeno a 1 L/min.
- Posizionare l'animale nella camera di induzione e chiudere saldamente il coperchio. Accendere il vaporizzatore isoflurano al 3,5% e monitorare l'animale fino a reclinata.
- Togliere l'animale dalla camera e valutare il livello di anestesia mediante riflesso pedale, cioè un pizzico fermo del piede. Garantire un'adeguata profondità di anestesia prima di eseguire la procedura: la mancanza di risposta a un pizzico fermo indica un'anestesia adeguata.
- Restringere il topo anetizzato afferrando la pelle sciolta dietro le orecchie con il pollice e l'indice della mano non dominante. Fai scorrere gli occhi usando l'indice per ritrarre la pelle sopra l'occhio e il pollice per riportare la pelle sotto gli occhi.
- Posizionare la punta di una pipetta Pasteur nella presa oculare sotto il bulbo oculare (Figura 1, pannello sinistro), dirigendo la punta a circa 45 gradi verso il centro della presa oculare (Figura 1, pannello destro). Ruotare la pipetta tra le dita durante il passaggio in avanti. Applicare una leggera pressione e poi rilasciare fino a quando il sangue sta entrando nella pipetta.
NOTA: La quantità massima di sangue che può essere prelevata in una sola volta da questa posizione è di circa l'1% del peso corporeo, ad esempio 0,2 mL da un mouse da 20 g. - Rimuovere delicatamente il capillare per prevenire lesioni all'occhio e posizionare il sangue raccolto in un tubo di centrifuga di 1,5 ml. Chiudere la palpebra e applicare una leggera pressione con garza per evitare ulteriori sanguinamento. Una volta completamente vigile e mobile (di solito 3,5 min), riporta il mouse alla sua gabbia di detenzione.
- Lasciare che il sangue si coaguli per 30-60 min a temperatura ambiente (RT), quindi centrizzare il sangue per 10 min a 2.000 g in una centrifuga refrigerata a 4 gradi centigradi. Utilizzando una tecnica di pipetta pulita, raccogliere il siero in una nuova fiala da 0,5 mL. Congelare immediatamente fiala di siero a -80 gradi centigradi.
- Raccolta CSF con procedura di sopravvivenza
NOTA: Questa procedura è per la chirurgia di sopravvivenza, e si basa sul protocollo pubblicato da Liu e Duff nel 200815. I topi sono anestesizzati da un cocktail di Ketamina (20 mg/mL), xilazina (0,5 mg/mL) e acepromazina (0,5 mg/mL) somministrato per via peritonea.- Spostare le gabbie contenenti topi dal rack ad un'area di lavoro interventistica designata. Preparare lo spazio chirurgico in un ambiente sterile. Assicurarsi che tutti gli strumenti e i materiali utilizzati siano sterilizzati prima dell'intervento chirurgico.
- Pesare il mouse e calcolare il volume di anestesia necessario (0,1 mL di cocktail di anestesia per un mouse da 20 g). Iniettare anestesia intraperitamente16. Dopo alcuni minuti, provare il mouse pizzicando il piede per garantire un'adeguata anestesia. Se è necessaria più anestetico, iniettare ulteriormente 0,01-0,03 mL del cocktail anestetico.
- Utilizzare forbici o un rasoio per radere una piccola area della testa, sull'estremità caudale, mediale sul cranio, per esporre un'area di lavoro abbastanza grande per la raccolta CSF. Posizionare il mouse nella posizione prona sullo strumento stereotaxic e stabilizzare la testa utilizzando le barre dell'orecchio (Figura 2A).
NOTA: Il mouse è disposto in modo che la testa formi un angolo di quasi 135 gradi con il corpo (Figura 2A). Una volta che l'animale è posizionato, un drappo chirurgico viene utilizzato per mantenere un campo sterile presso il sito chirurgico. Per la raccolta di FILE CSF nei topi sono preferiti chiaramente le tende adesive, in quanto consentono una visualizzazione diretta e più mirata dell'animale. - Swab il sito chirurgico con 30% clorhexidine diacetate. Utilizzando un bisturi sterile, fare un'incisione sagittale della pelle inferiore all'occipite per esporre i muscoli sovrastanti la magna della cisterna.
- Con la dissezione smussata con pinze, separare il tessuto sottocutaneo e i muscoli per esporre la cisterna magna (Figura 2B). Utilizzare i microtrattini per tenere i muscoli separati (Figura 2B) ed esporre lo strato meningea dura mater sulla cisterna magna.
- Lavare delicatamente con la salina sterile con tamponamenti di fosfato (PBS) per rimuovere eventuali contaminazioni del sangue. Asciugare il dura mater con un tampone di cotone sterile e forare delicatamente la membrana che copre la cisterna magna con un ago da 30 G. Inserire rapidamente e delicatamente un piccolo tubo capillare in vetro per raccogliere CSF (Figura 2C).
NOTA: La pressione intracranica consente a CSF di fluire spontaneamente nel capillare (Figura 2C). A seconda dell'età e delle dimensioni del topo, da ogni topo si ottengono circa 5-12 l di CSF. - Rimuovere con attenzione il tubo capillare dalla membrana. Collegare il tubo a una siringa da 3 mL attraverso un tubo di polietilene (Table of Materials) e iniettare il CSF raccolto in un tubo etichettato da 0,5 mL ( Figura2D). Tenere le fiale nel ghiaccio.
- Chiudere l'incisione utilizzando sutura polidioxanone (PDS) con ago usa e getta e utilizzando suture sepolte17. Pulire l'area di qualsiasi sangue o tessuto essiccato.
- Iniettare i topi, sottocutaneamente o intraperitinalmente16, con 0,05-0,1 mg/kg di cloruro di buprenorfina come trattamento analgesico. Inoltre, iniettare sottocutaneamente 1 mL di salina sterile per prevenire la disidratazione.
- Riposizionare il mouse in una gabbia pulita e calda per il recupero. Una volta che il mouse è mobile e in grado di raggiungere il cibo e l'acqua, posizionare la gabbia sul rack.
- Centrifuga CSF per 10 min a 1.000 x g in una centrifuga refrigerata a 4 gradi centigradi. Controllare il grado di contaminazione del sangue mediante ispezione visiva per l'identificazione della xantocromia e la presenza di un pellet rosso nella parte inferiore del tubo. Scartare campioni contaminati dal sangue.
NOTA: La formula utilizzata per la correzione delle quantità di proteine CSF in campioni contaminati dal sangue si basa su parametri di equazione che includono contenuto proteico in CSF e siero, ematocrito (HCT) e globuli rossi (RBC) contano in CSF e sangue18. Tuttavia, tale strategia di correzione non può essere facilmente applicata ai campioni di CSF del topo a causa del piccolo volume, limitando così la strategia di correzione a un'ispezione visiva. - Utilizzando una tecnica di pipetta pulita, raccogliere la CSF in un nuovo tubo da 0,2 mL, lasciando dietro di sé il pellet con le cellule. Diluire CSF 1:3 con PBS per ridurre la perdita di volume dovuta all'aerosol. Congelare immediatamente la fiala del CSF a -80 gradi centigradi.
- Procedura di sanguinamento retroorbitale per la raccolta del siero.
- Raccolta di siero e CSF con procedure di non sopravvivenza
NOTA: per la raccolta di fluidi non di sopravvivenza, la raccolta CSF precede la raccolta del siero in quanto il mouse deve avere un impulso.- CSF collection presso necropy
NOTA: Questa procedura è per la chirurgia non di sopravvivenza, e circa 10-20 L di CSF è ottenuto da ogni topo. Un campo chirurgico sterile è raccomandato, ma non richiesto per la chirurgia non di sopravvivenza.- Spostare le gabbie contenenti topi dal rack in un comodo spazio di lavoro. Seguite i passaggi 1.1.2.2, 1.1.2.7 e 1.1.2.11,1.1.2.12 per la raccolta CSF. Procedere alla sezione 1.2.2 per la raccolta del siero.
- Raccolta del sangue tramite puntura intracardiaca (approccio aperto)
NOTA: I volumi di sangue previsti sono circa il 3% del peso corporeo, ad esempio 0,6 mL da un mouse da 20 g.- Dopo la raccolta CSF assicurarsi che il mouse sia ancora sufficientemente afizzato pizzicando il piede. Se si osserva una qualsiasi reazione, somministrare una seconda dose di anestetico. Se non si osserva alcuna reazione, procedere.
- Posizionare l'animale sulla schiena e la pelle di tampone sull'addome con il 70% di alcol. Con le forbici chirurgiche, aprire la cavità toracica ed esporre il cuore. Inserire un ago da 25 G (attaccato a una siringa da 3 mL) nel ventricolo sinistro e applicare delicatamente una pressione negativa sullo stantuffo della siringa. Ritirare l'ago dopo che il sangue è stato raccolto.
- Eseguire un metodo secondario di eutanasia come decapitazione o dislocazione cervicale per garantire che l'animale è deceduto.
- Spingere lo stantuffo della siringa verso il basso e iniettare il sangue raccolto in una fiala da 1,5 mL. Lasciare coagulare il sangue per 30-60 min a RT e quindi centrificarlo per 10 min a 2.000 x g in una centrifuga refrigerata a 4 gradi centigradi.
- Utilizzando la tecnica della pipetta pulita, raccogliere il siero in una nuova fiala da 0,5 mL. Congelare immediatamente fiala di siero in un congelatore -80 gradi centigradi.
- CSF collection presso necropy
2. Analisi delle proteine
- Utilizzare un metodo preferito, ad esempio la tecnologia Luminex, per quantificare le proteine bersaglio e l'albumina in campioni di siero e CSF corrispondenti.
NOTA: Qui viene fornito un esempio con la tecnologia magnetica Luminex, ma praticamente qualsiasi tecnica che misura la quantità di proteine, compresi i saggi immunosorbena legati agli enzimi (ELAISA), può essere applicata al protocollo attuale. Idealmente, i campioni di CSF e siero vengono eseguiti sia per l'albumina che per le proteine target sulla stessa piattaforma. Le condizioni di analisi devono essere ottimizzate per fasi cruciali del protocollo, come la concentrazione di accoppiamento antigene-perline, le diluizioni dei campioni di siero e CSF, le curve standard più adatte per ogni analita e la composizione del buffer per ridurre la reattività non specifica. Se un kit commerciale viene utilizzato per la misurazione di proteine, ad esempio il kit di isotipizzazione dell'immunoglobulina (Tabella dei materiali) utilizzato per ottenere i dati presentati inFigura 3, le istruzioni dei produttori devono essere seguite.- Al momento dello scongelamento e prima dell'analisi, centrifugare campioni di CSF e siero (2.000 x g per 10 minuti) e utilizzare il supernatale per prevenire l'intasamento delle piastre filtranti e/o della sonda. Seguire la procedura di valutazione fornita con il kit per le diluizioni di campione appropriate. In caso contrario, determinare la diluizione appropriata per ogni analita e fluido. Diluire i campioni in PBS di conseguenza.
NOTA: Se non esistono indicazioni o istruzioni specifiche, è necessario stabilire diluizioni per ciascun analita e fluido prima del test di studio, determinando gli intervalli di diluizione appropriati necessari per ottenere stime di concentrazione che rientrano nella maggior parte dei casi gamma affidabile di una curva standard. Conoscere le caratteristiche del campione biologico da analizzare, ad esempio concentrazioni fisiologiche e patologiche nel fluido, permette di provare diverse diluizioni con campioni di basso, medio e alto contenuto di analita. Se l'intervallo previsto di concentrazioni nei campioni è noto a priori, le diluizioni possono essere selezionate dopo aver calcolato quante volte il campione deve essere diluito per essere all'interno dell'intervallo di curve standard scelto.
AVVISO: Calcolando i fattori di diluizione, ricordate che il CSF è già stato diluito 1:3. - Preparare una curva standard per ogni proteina di interesse, ad esempio albumina e IgG, utilizzata per generare dati nella Figura 3,diluindo serialmente le proteine standard di riferimento. Durante la preparazione delle curve standard, mescolare accuratamente ogni maggiore concentrazione prima di effettuare la diluizione successiva.
NOTA: Indipendentemente dal metodo di quantificazione scelto, è essenziale includere una curva standard ogni volta che il test viene eseguito per stimare la concentrazione di proteine nei campioni. La scelta migliore per uno standard di riferimento è una concentrazione purificata e nota della proteina di interesse. La scelta delle diluizioni specifiche, nonché il numero di punti dati e repliche utilizzati per definire la curva standard, dipende dal grado di non linearità nella curva standard. - Selezionare i set di perline magnetiche accoppiati con anticorpo appropriati (Tabella dei materiali). Per le singole fiale di perline, sonicare ciascuna fiala per 30 s e vortice per 1 min. Preparare una "miscela di perline di lavoro" diluindo le scorte di perline ad una concentrazione finale di 50 perline di ogni set / s nel tampone di assaggio / lavaggio (PBS, 1% di albumina di siero bovino [BSA]). Aggiungete 50 l di perline miste ad ogni pozzo in una piastra piatta di 96 pozze (Tabella dei materiali).
AVVISO: Le perle fluorescenti sono sensibili alla luce. Pertanto, devono essere protetti dall'esposizione prolungata alla luce durante tutta la procedura. - Creare un diagramma della posizione di sfondi, standard ed esempi in un foglio di lavoro mappa benfile.
- Aggiungete 50 l di assaggio/lavaggio a ogni po' di fondo e 50 l unpo di ogni standard ai pozze per la curva standard. Caricare 50 mL di ogni campione diluito per ultimo nei pozzi appropriati. Avvolgere la piastra con un foglio e incubare con agitazione (800 rpm) su uno shaker di piastra per 30 min a RT.
- Posizionare la piastra su un magnete portatile (Tavolo dei materiali) e appoggiare la piastra sul magnete per s 60 s per consentire la completa impostazione di perline magnetiche. Rimuovere il contenuto del pozzo decantando delicatamente la piastra e toccare la piastra su pastiglie assorbenti per rimuovere il liquido residuo.
- Lavare la piastra rimuovendola dal magnete, aggiungendo 200 l di tampone di assaggio/lavaggio, agitando per 30 s, e infine ricollegandola al magnete. Ripetere il lavaggio 3x.
- Diluire l'anticorpo di rilevamento biotinylato, cioè l'anticorpo con etichetta biotina allevato contro la specie di ospite di proteine, a 4 g/mL nel tampone di analisi/lavaggio. Aggiungere 50 l dell'anticorpo di rilevamento diluito ad ogni pozzo. Coprire la piastra e incubare per 30 min a RT sullo shaker piastra a 800 rpm. Posizionare la piastra sul magnete e ripetere i passaggi 2.1.6 e 2.1.7.
- Dilute phycoerythrin (PE)-coniugato streptavidin (SAPE) a 4 g/mL in assaggio/lavaggio tampone. Aggiungete a ogni pozzo 50 l di SAPE diluita. Coprire la piastra e incubare per 30 min a RT sullo shaker piastra a 800 rpm. Posizionare la piastra sul magnete e ripetere i passaggi 2.1.6 e 2.1.7.
- Rimuovere la piastra dal magnete e risospendere le perline in 100 -L di aspetto/lavaggio tampone. Leggere i pozzi con un doppio strumento di rilevamento basato sul flusso laser che consente di rilevare la magnitudine dell'intensità della fluorescenza PE (FI).
NOTA: Il segnale, ad esempio FI, generato è proporzionale alla quantità di antigene bersaglio attaccato alla superficie delle perline. - Esportare dati grezzi e creare curve standard grafico segnale di rilevamento FI rispetto alle concentrazioni proteiche standard. Utilizzare le curve standard per calcolare la concentrazione degli analiti nei campioni.
NOTA: L'albume è espresso preferibilmente in g/dL, mentre le proteine di interesse sono espresse preferibilmente in mg/dL.
- Al momento dello scongelamento e prima dell'analisi, centrifugare campioni di CSF e siero (2.000 x g per 10 minuti) e utilizzare il supernatale per prevenire l'intasamento delle piastre filtranti e/o della sonda. Seguire la procedura di valutazione fornita con il kit per le diluizioni di campione appropriate. In caso contrario, determinare la diluizione appropriata per ogni analita e fluido. Diluire i campioni in PBS di conseguenza.
3. Calcoli dell'indice intratecale
- Organizzare i valori di concentrazione delle proteine in un foglio di calcolo e analizzare i risultati applicando le seguenti formule.
- CalcolaalbuminaQ :
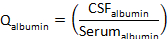
dovealbumin CSF ealbumin serum sono concentrazioni di albumina in siero abbinato e campioni CSF, rispettivamente. - Calcolare laproteinaQ :

dove laproteina CSF e laproteina del siero sono concentrazioni di proteine bersaglio (s) nei campioni di siero e CSF corrispondenti, rispettivamente. - Calcolare l'indice proteico:
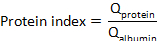
Risultati
Questo esperimento rappresentativo mirava a confrontare la sintesi intratecala di IgG in due modelli di roditori clinicamente rilevanti della sclerosi multipla (MS): il PLP139-151-indotta recissa sperimentale di encefalomiesi (R-EAE) e la progressiva cronica, La malattia demielinante indotta dal virus dell'encefalomielisi del Telemanolio (TMEV-IDD). R-EAE è un modello utile per comprendere la recidiva delle MS, mentre il modello TMEV-IDD è dotato di MS19progressivo cronico.
Per il presente studio, è stata eseguita un'analisi quantitativa della sintesi intratecala di IgG in R-EAE (n - 12) e TMEV-IDD (n - 28). Entrambi i gruppi sono stati analizzati al culmine della loro malattia. Un gruppo aggiuntivo di 10 topi è stato trattato in finzione e ha servito come gruppi di controllo corrispondenti all'età (cR-EAE n - 4, cTMEV-IDD sham n .
Per misurare l'IgG totale in campioni di siero e CSF abbinati, è stato utilizzato un approccio magnetico basato sul perline con il kit disponibile in commercio (Table of Materials). Il valore IgG totale è stato derivato dalla somma dei valori di sottoclasse IgG1, IgG2a, IgG2b e IgG3. Albumin è stato misurato con unkit eLISA album in eLISA perché un saggio Luminex per albumin non era disponibile in quel momento. Tutte le misurazioni sono state eseguite con attenzione seguendo le istruzioni dei produttori. Albumin quotient (Qalbumin)e Indice IgG (QIgG/Qalbumin) sono stati poi utilizzati per differenziare il sangue- contro CnS-derivato IgG nel CSF.
Come mostrato nella Figura 3A, i livelli effettivi di IgG totale sono significativamente aumentati nel CSF di entrambi i modelli di roditori di MS rispetto ai corrispondenti controlli finti corrispondenti all'età (p - 0,026). Tuttavia, i mouse R-EAE mostrano valori dialbumina Q notevolmente migliorati (p 0,019), indicando una maggiore permeabilità della barriera in questi topi (Figura 3B). Al contrario, non esistono differenzenell'albumina Q tra TMEV-IDD e topori farsi (p - 0,49), corroborando così il nostro precedente ritrovamento di una barriera intatta nei topi TMEV-IDD7,8. Per distinguere ulteriormente tra IgG transudate e intrathecally prodotto in R-EAE e TMEV-IDD, è stato misurato l'indice IgG, mostrando valori significativamente più elevati nei topi IDD TMEV (p - 0,0006), e quindi la produzione intrathecal IgG in questo modello (Figura 3C).
Una barriera intatta nei topi TMEV-IDD insieme a un alto indice IgG suggerisce che in questo modello, l'anticorpo viene prodotto all'interno del SNC. Al contrario, in R-EAE, una significativa rottura della barriera e un basso indice IgG forniscono la prova che l'IgG CSF è per lo più prodotto da cellule B periferiche piuttosto che intratece, suggerendo anche che in questo modello acuto di MS, CSF IgG è per lo più derivato dal siero.

Figura 1: sanguinamento retroorbitario dei topi. Sinistra: corretta posizione dell'ago rispetto al seno retroorbitale, al bulbo oculare e alla parte posteriore dell'orbita. A destra: la posizione della pipetta inizia nel canthus mediale dell'occhio e scivola verso l'aspetto dorsale dell'orbita. Il capillare viene inserito con un angolo di 45 gradi. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: raccolta CSF nei topi. (A) Le barre dell'orecchio sostengono la testa del mouse, e il mouse è posato in modo che la testa forma un angolo di 135 gradi con il corpo. La freccia indica la magna della cisterna esposta. (B) Con dissezione smussata con pinze, i muscoli sono separati per esporre la cisterna magna (puntata dalla freccia). I microtrattini sono utilizzati per tenere separati i muscoli. (C) Un piccolo tubo capillare in vetro viene utilizzato per raccogliere il CSF dalla cisterna magna. CSF scorre spontaneamente nel capillare, a causa della pressione intracranica. La freccia indica il CSF raccolto nel capillare. (D) Il CSF viene trasferito in un tubo da 0,5 mL attraverso una siringa da 3 mL modificata. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Funzione di barriera emato-encefalica e sintesi intratecala di IgG in R-EAE e TMEV-IDD. Far blot che rappresenta (A) i livelli CSF del totale IgG (mg/dL) misurato dalla tecnologia Luminex,(B) albumin CSF/serum quotients (Qalbumin)e (C) Indici IgG (QIg/Qalbumin) in mouse R-EAE e TMEV-IDD, nonché mouse di controllo corrispondenti all'età (cR-EAE e cME-ID). Le linee orizzontali rappresentano il valore mediano per tale gruppo. p < 0.0001; p < 0.001; < 0,01; p < 0,05. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
I metodi quantitativi per la valutazione delle maggiori concentrazioni di proteine CSF sono strumenti utili per la caratterizzazione dello stato fisiologico e patologico del SNC. Tuttavia, al di là della quantificazione affidabile dei livelli di proteine CSF, il rilevamento delle proteine CSF richiede un'espressione dei risultati che discriminano tra le frazioni derivate dal sangue e il SNC nel CSF. Tuttavia, ad oggi, i saggi di quantificazione delle proteine comunemente utilizzati non consentono la discriminazione tra i due componenti proteici, anche con l'aiuto di strumenti ad alto contenuto di velocità. Pertanto, sono state proposte correzioni specifiche alle misurazioni delle proteine al fine di distinguere tra proteine sintetizzate all'interno del compartimento del SNC e proteine derivate dal sangue. Tali correzioni compensano la variabilità individuale sia nelle concentrazioni di siero che nell'integrità delle barriere. Nel complesso, queste correzioni si basano su calcoli di un quoziente CSF/siero(proteinaQ), che riduce la variabilità dovuta alle differenze nella concentrazione individuale di proteine del siero. Variazione dellaproteina Q correlata alle differenze individuali nella funzione di barriera può essere ulteriormente abbassata mettendo in relazione laproteina Q a un quoziente di albumina CSF/siero (Qalbumina). La combinazione di entrambe le correzioni è generalmente nota come indice proteico ed è calcolata comeproteinaQ /Q albumin ratio4,6.
L'albumina, sintetizzata e secreta dal fegato, è la principale proteina plasmatica che circola nel flusso sanguigno. Poiché l'albumina è prodotta esclusivamente al di fuori del CNS e i suoi livelli in CSF sono bassi (0,15 g/dL), l'aumento dei livelli di albumina CSF indica noto alla BBI o contaminazione del sangue a causa di emorragia intratecala o collezione traumatica CSF. In una di queste condizioni, l'albumina traslucida dal siero nel CSF in proporzione alla concentrazione del siero. Pertanto, in assenza di contaminazione del sangue,l'albumina Q può essere utilizzata come indicatore della funzione di barriera20. Al contrario,l'albumina Q rimane costante all'interno di intervalli normali in esseri umani e animali con un BBI21intatto . Un presupposto fondamentale per l'utilizzo di questo quoziente4,6 nel calcolo della sintesi delle proteine intrateche è che l'aumento della quantità di proteine CSF in presenza di una barriera che perde è proporzionale all'aumento della concentrazione di albumina di CSF. Questa ipotesi è stata confermata sperimentalmente in uno studio del 19774, in cui gli autori hanno monitorato nei pazienti ms membri il passaggio sangue-CSF di IgG e albumina radioetichettati ottenuti da sera umana sana.
Simile all'albumina, qualsiasi proteina nel sangue può attraversare la BBI. Quando la barriera è intatta, laproteina Q è relativamente costante. A differenza dell'albumina, tuttavia, molte proteine possono anche essere sintetizzate all'interno del CNS. Di conseguenza, unaproteina Q alterata può derivare da una barriera danneggiata e/o da un aumento della produzione di proteine intrateche. Tuttavia, quando un'elevata concentrazione di proteine CSF è dovuta solo a una BBI compromessa, i valori sia perla proteina Q che per l'albumina Q sono aumentati, rispetto ai valori per questi stessi quozienti negli animali con una barriera intatta. Al contrario, quando la barriera è intatta, l'aumento delle concentrazioni di proteine CSF è più probabile a causa di una maggiore sintesi intratecala, e solo laproteina Q è in ultima analisi aumentata.
L'uso dell'indice proteico può essere parzialmente limitato da cinque fattori: 1) la grande variabilità della concentrazione di albumina di CSF negli animali sani, 2) il diverso raggio idrodinamico delle proteine, 3) l'espressione endogena del SNC delle proteine, 4) diverse tecniche di campionamento e 5) le differenze morfologiche del BBI. La grande variabilità della concentrazione di albumina di CSF negli animali sani si traduce in una notevole variabilità nei valori per l'indice proteico finale. Nell'uomo, ad esempio,l'albumina Q dipende dall'età poiché aumenta con l'etàdi 22anni . Un rapporto precedente ha anche menzionato una differenza basata sul sessonell'albumina Q in una popolazione sana23. Allo stesso modo, nei topi, le concentrazioni di albumina dipendono dall'età e dal ceppo dei topi24, ad esempio,l'albumina Q per i topi giovani, maschi, C57Bl/6 può essere diversa dallamitina Q per i topi vecchi, femminili, DBA/1J. Pertanto, non è possibile stabilire intervalli di riferimento standardizzati per l'integrità delle barriere all'interno e all'interno delle specie e le soglie appropriate devono essere calcolate in base alle condizioni sperimentali specifiche.
Un altro fattore che causa variabilità negli indici normali tra le proteine è la loro dimensione molecolare. Il passaggio delle proteine del siero attraverso la BBI dipende dalla loro dimensione molecolare, e la correlazione tra tasso di clearance e peso molecolare (MW) è ampiamente utilizzato per valutare la permeabilità della BBI. Le strutture proteiche generali variano in dimensioni da decine a diverse migliaia di aminoacidi. Alcune proteine sono di dimensioni molecolari relativamente piccole, come le chemiochine, con un peso molecolare compreso tra 8 e 20 kDa. Un Tale Basso MW favorisce l'attraversamento della BBI, con conseguente indici proteici normali più elevati. A differenza di diverso, altre proteine, come IgM, sono molto grandi (900-950 kDa), mostrando quindi indici molto bassi in condizioni normali6. Tuttavia, questo non è sempre il caso, poiché, nonostante un MW simile, alcune proteine permeano la barriera molto meglio di altre proteine, probabilmente a causa di una forma diversa. Così, il coefficiente di diffusione di una proteina, e quindi i raggi idrodinamici calcolati da essa, dipende sia dalle dimensioni che dalla forma delle molecole25. La differenza fondamentale tra il volume geometrico e quello idrodinamico di una proteina diventa più evidente con grandi proteine superiori a 150 kDa. I tassi di sgombero decrescenti di ceruloplasmin (132 kDa), IgG (150 kDa) e IgA (150 kDa) riflettono l'eterogeneità idrodinamica di queste tre proteine, che hanno un MW25simile. È anche possibile che vi sia una produzione intrateca di proteine in circostanze normali. Alcune chemiochine, ad esempio CXCL10, vengono in genere prodotte intrathecally, mentre altre, ad esempio CXCL13, non sono26,27. Ciò significa che l'interpretazione degli indici proteici nella maggior parte delle condizioni sperimentali richiede generalmente l'analisi dei controlli non trattati con età, sesso e deformazione.
I livelli di proteine nei fluidi possono anche essere influenzati da diverse tecniche di campionamento. Anche se questo potrebbe non essere un problema per la raccolta del CSF come descritto qui -non ci sono differenze nel campionamento del CSF tra le procedure di sopravvivenza descritte e le procedure di non sopravvivenza, diversi metodi di raccolta del sangue possono avere un impatto sulla quantità totale di proteine del siero. Alcuni metodi di raccolta del sangue producono sangue arterioso, altri producono sangue venoso, mentre altri ancora producono una miscela di entrambi14. Il campione ottenuto dal sanguinamento retroorbitale di sopravvivenza è una miscela di sangue venoso e fluido tissutale, mentre la raccolta di sangue terminale dalla puntura cardiaca può produrre sangue venoso o arterioso o una miscela di entrambi14. Negli animali sani, il contenuto totale di proteine e di albumina del siero di sangue arterioso può essere leggermente superiore alle stesse frazioni del siero di sangue venoso28. Questo dovrebbe essere preso in considerazione quando vengono confrontati i campioni di sopravvivenza e non di sopravvivenza.
Infine, una caratteristica importante da considerare è la struttura morfologica eterogenea del BBI, che comprende almeno due barriere distinte, la barriera emato-encefalica (BBB) situata all'endotelio dei microvasi cerebrali e la barriera emato-CSF (BCSF) situata all'epitelio dei plex contoide29. Entrambe le barriere limitano e regolano il passaggio di molecole e cellule tra i compartimenti periferici e cerebrospinali, anche se lo fanno con meccanismi diversi. Mentre il BBB è una vera e propria barriera fisica, caratterizzata da una complessa interazione tra le cellule, il BCSF è più di una barriera fisiologica, che dipende principalmente dal flusso di CSF. Riduzioni nella produzione, nel rilascio e nella portata di CSF a causa di condizioni neurologiche e/o traumi compromettono la funzione BCSF, aumentando così la Qalbumin99,30,31,32. Pertanto, Qalbumin serve come un marcatore migliore della permeabilità BCSF piuttosto che la permeabilità BBB o generalmente BBI.
In sintesi, il calcolo di un indice proteico è un metodo relativamente semplice e ben caratterizzato per la discriminazione tra proteine transudate e prodotte intrathecally. Il vantaggio di applicare questa formula per correggere la misurazione generale delle proteine nei campioni di CSF è che genera una variabile oggettiva per quantificare la sintesi intratecale delle proteine e misurare la BBI, in particolare BCSF, (dys)funzione. Data la robustezza di questo approccio, la correzione della proteina CSF ammonta attraversol'albumina Q e l'indice proteico fornisce una linea di base rispetto alla quale valutare (1) l'origine patofisiologica di qualsiasi proteina CSF e (2) la stabilità e il significato funzionale dell'integrità della barriera. Qui viene presentato un protocollo dettagliato, dalla raccolta del CSF e del sangue ai calcoli finali che correggono la quantità totale di proteine CSF, che si applica ai modelli murini per le malattie neurologiche. Tuttavia, lo stesso protocollo può essere facilmente adattato allo studio della CSF e alla sintesi intratecala delle proteine in qualsiasi animale, compresi gli esseri umani. Qalbumina e indice IgG sono già comunemente utilizzati nella pratica clinica per la diagnosi di malattie neurologiche infiammatorie6. Questi stessi parametri sono stati utilizzati con successo anche per valutare una vasta gamma di citochine e chemiochine in pazienti con malattie demielinizzanti infiammatorie26,33,34.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano il personale del Center for Comparative Medicine and Research (CCMR) di Dartmouth per la cura esperta dei topi utilizzati per questi studi. Il Fondo di Ricerca Bornstein ha finanziato questa ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 329650 | |
| 1 mL syringe | BD | 329622 | |
| 25 gauge needle | BD | 305122 | |
| 3 mL syringe | BD | 309582 | |
| 30 gauge insulin needle | BD | 305106 | |
| Absorbent pads | Any suitable brand | ||
| Acepromazine | Patterson Vet Supply Inc | ||
| BioPlex Handheld Magnetic Washer | BioRad | 171020100 | Magnet |
| BioPlex MAGPIX Multiplex Reader | BioRad | 171015001 | |
| BioPlex Pro Flat Bottom Plates | BioRad | 171025001 | |
| Biotinilated detection antibody | Any suitable source | The antibody has to be directed against the species of the protein of interest. | |
| Bovine Serum Albumin (BSA) | Sigma | A4503 | |
| Buprenorphine hydrochloride | PAR Pharmaceutical | NDC 42023-179-05 | |
| Capillary Tubes | Sutter Instrument | B100-75-10 | OD: 1.0 mm, ID: 0.75 mm Borosilicate glass 10 cm; drawn over Bunsen to make ID smaller. |
| Centrifuge tube, 0.2 mL | VWR | 20170-012 | |
| Centrifuge tube, 0.5 mL | VWR | 87003-290 | |
| Centrifuge tube, 1.5 mL | VWR | 87003-294 | |
| Chlorhexidine diacetate | Nolvasan | E004272 | |
| Disposable pipettes tips | Any suitable brand | ||
| Ear bars | KOPF Instruments | 1921 or 1922 | |
| Ethanol | Kopter | V1001 | |
| Freezer | VWR | VWR32086A | |
| Gauze | Medline | NON25212 | |
| Heating pad | Sunbeam | XL King Size SoftTouch, 4 Heat Settings with Auto-Off, Teal, 12-Inch x 24-Inch | |
| Induction Chamber | VETEQUIP | ||
| Isoflurane | Patterson Vet Supply Inc | NDC 14043-704-06 | |
| Ketamine (KetaVed) | Patterson Vet Supply Inc | ||
| MagPlex Microspheres (antibody-coupled) | BioRad | Antibody-coupled magnetic bead | |
| Microplate Shaker | Southwest Scientific | SBT1500 | |
| Microretractors | Carfill Quality | ACD-010 | Blunt - 1 mm |
| Microsoft Office (Excel) | Microsoft | ||
| MilliPlex MAP Mouse Immunoglobulin Isotyping Magnetic Bead Panel | EMD Millipore | MGAMMAG-300K | Commercial kit for the quantification through Luminex of a panel of immunoglobulin isotypes and subclasses in mouse fluids. |
| Mouse Albumin capture ELISA kit | Novus Biological | NBP2-60484 | Commercial kit for the quantification through ELISA of albumin in mouse fluids. |
| Multichannel pipette | Eppendorf | 3125000060 | |
| Non-Sterile swabs | MediChoice | WOD1002 | Need to be autoclaved for sterility |
| Oxygen | AIRGAS | OX USPEA | |
| Pasteur Pippettes | Fisher | 13-678-20A | 5 & 3/4" |
| PDS suture with disposable needle, 6-0 Prolen | Patterson Vet | 8695G | P-3 Reverse Cutting, 18" |
| PE-Streptavidin | BD Biosciences | 554061 | |
| Pipetters | Eppendorf | Research seriers | |
| Polyethylene tubing | |||
| Refrigerated Centrifuge | Beckman Coulter | ALLEGRA X-12R | |
| Scale | Uline | H2716 | |
| Scalpel | Feather | EF7281 | |
| Shaver | Harvard Apparatus | 52-5204 | |
| Standard proteins | Any suitable source | The best choice for a reference standard is a purified, known concentration of the protein of interest. | |
| Stereotaxic instrument | KOPF Instruments | Model 900LS | Standard Accessories |
| Sterile 1 x PBS | Corning Cellgro | 21-040-CV | |
| Sterile saline | Baxter | 0338-0048-02 | 0.9 % Sodium Chloride Irrigation USP |
| Surgical Forceps Curved, 7 (2) | Fine Science Tools | 11271-30 | Dumont |
| Surgical Scissors | Fine Science Tools | 14094-11 | Stainless 25x |
| Vaporizer + Flow meter | Moduflex Anhestesia Instruments | ||
| Vortex | Fisher | 02-215-414 | |
| Warming pad | Kent Scientific Corporation | RT-JR-20 | |
| Water Sonicator | Cole Parmer | EW-08895-01 | |
| Xylazine | Patterson Vet Supply Inc |
Riferimenti
- Whedon, J. M., Glassey, D. Cerebrospinal fluid stasis and its clinical significance. Alternative Therapies in Health and Medicine. 15 (3), 54-60 (2009).
- Kang, J. H., Vanderstichele, H., Trojanowski, J. Q., Shaw, L. M. Simultaneous analysis of cerebrospinal fluid biomarkers using microsphere-based xMAP multiplex technology for early detection of Alzheimer's disease. Methods. 56 (4), 484-493 (2012).
- Barro, C., et al. Fluid biomarker and electrophysiological outcome measures for progressive MS trials. Multiple Sclerosis. 23 (12), 1600-1613 (2017).
- Tourtellotte, W. W., et al. Multiple sclerosis: measurement and validation of central nervous system IgG synthesis rate. Neurology. 30 (3), 240-244 (1980).
- Bonnan, M. Intrathecal IgG synthesis: a resistant and valuable target for future multiple sclerosis treatments. Multiple Sclerosis International. 2015, 296184 (2015).
- Reiber, H. Cerebrospinal fluid--physiology, analysis and interpretation of protein patterns for diagnosis of neurological diseases. Multiple Sclerosis. 4 (3), 99-107 (1998).
- DiSano, K. D., Linzey, M. R., Royce, D. B., Pachner, A. R., Gilli, F. Differential neuro-immune patterns in two clinically relevant murine models of multiple sclerosis. Journal of Neuroinflammation. 16 (1), 109 (2019).
- Pachner, A. R., Li, L., Lagunoff, D. Plasma cells in the central nervous system in the Theiler's virus model of multiple sclerosis. Journal of Neuroimmunology. 232 (1-2), 35-40 (2011).
- Reiber, H. Flow rate of cerebrospinal fluid (CSF)--a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. Journal of Neurological Sciences. 122 (2), 189-203 (1994).
- Reiber, H., Zeman, D., Kusnierova, P., Mundwiler, E., Bernasconi, L. Diagnostic relevance of free light chains in cerebrospinal fluid - The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clinica Chimica Acta. 497, 153-162 (2019).
- Reiber, H., Felgenhauer, K. Protein transfer at the blood cerebrospinal fluid barrier and the quantitation of the humoral immune response within the central nervous system. Clinica Chimica Acta. 163 (3), 319-328 (1987).
- Dorta-Contreras, A. J. Reibergrams: essential element in cerebrospinal fluid immunological analysis. Revista de Neurologia. 28 (10), 996-998 (1999).
- Metzger, F., Mischek, D., Stoffers, F. The Connected Steady State Model and the Interdependence of the CSF Proteome and CSF Flow Characteristics. Frontiers Neuroscience. 11, 241 (2017).
- Wolforth, J. Methods of blood collection in the mouse. Laboratory Animals. 29, 47-53 (2000).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. Journal of Visualized Experiments. (21), e960 (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Johnston, S. A., Tobias, K. M. Veterinary Surgery: Small Animal Expert Consult - E-Book. Elsevier Health Sciences. , (2017).
- Nigrovic, L. E., Shah, S. S., Neuman, M. I. Correction of cerebrospinal fluid protein for the presence of red blood cells in children with a traumatic lumbar puncture. Journal of Pediatrics. 159 (1), 158-159 (2011).
- McCarthy, D. P., Richards, M. H., Miller, S. D. Mouse models of multiple sclerosis: experimental autoimmune encephalomyelitis and Theiler's virus-induced demyelinating disease. Methods in Molecular Biology. 900, 381-401 (2012).
- Link, H., Tibbling, G. Principles of albumin and IgG analyses in neurological disorders. II. Relation of the concentration of the proteins in serum and cerebrospinal fluid. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 391-396 (1977).
- Tibbling, G., Link, H., Ohman, S. Principles of albumin and IgG analyses in neurological disorders. I. Establishment of reference values. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 385-390 (1977).
- Deisenhammer, F., et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. European Journal of Neurology. 13 (9), 913-922 (2006).
- Johanson, C. E., Stopa, E. G., McMillan, P. N. The blood-cerebrospinal fluid barrier: structure and functional significance. Methods in Molecular Biology. 686, 101-131 (2011).
- Zaias, J., Mineau, M., Cray, C., Yoon, D., Altman, N. H. Reference values for serum proteins of common laboratory rodent strains. Journal of the American Association for Laboratory Animal Science. 48 (4), 387-390 (2009).
- Felgenhauer, K., Renner, E. Hydrodynamic radii versus molecular weights in clearance studies of urine and cerebrospinal fluid. Annals of Clinical Biochemistry. 14 (2), 100-104 (1977).
- Pachner, A. R., DiSano, K., Royce, D. B., Gilli, F. Clinical utility of a molecular signature in inflammatory demyelinating disease. Neurology, Neuroimmunology & Neuroinflammation. 6 (1), 520 (2019).
- Pachner, A. R., Li, L., Gilli, F. Chemokine biomarkers in central nervous system tissue and cerebrospinal fluid in the Theiler's virus model mirror those in multiple sclerosis. Cytokine. 76 (2), 577-580 (2015).
- Gerbi, C. Protein concentration in the arterial and venous renal blood serum of the rabbit. Archives of Biochemistry and Biophysics. 31 (1), 49-61 (1951).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Reiber, H. Proteins in cerebrospinal fluid and blood: barriers, CSF flow rate and source-related dynamics. Restorative Neurology and Neuroscience. 21 (3-4), 79-96 (2003).
- Reiber, H. Knowledge-base for interpretation of cerebrospinal fluid data patterns. Essentials in neurology and psychiatry. Arquivos de Neuropsiquiatria. 74 (6), 501-512 (2016).
- Kuehne, L. K., Reiber, H., Bechter, K., Hagberg, L., Fuchs, D. Cerebrospinal fluid neopterin is brain-derived and not associated with blood-CSF barrier dysfunction in non-inflammatory affective and schizophrenic spectrum disorders. Journal of Psychiatric Research. 47 (10), 1417-1422 (2013).
- Bromader, S., et al. Changes in serum and cerebrospinal fluif cytokines in response to non-neurological surgery: an observational study. Journal of Neuroinflammation. 9, 242 (2012).
- Starhof, C., et al. Cerebrospinal fluid pro-inflammatory cytokines differentiate parkinsonian syndromes. Journal of Neuroinflammation. 15 (1), 305 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon