Method Article
小鼠体内合成蛋白的定量测量
摘要
脊髓液蛋白水平升高可能是血浆蛋白在改变的血脑屏障上扩散的结果,也可以是血脑内合成的结果。本文提出了一种优化的测试方案,有助于区分这两种情况,并提供对内代谢蛋白的定量测量。
摘要
脑脊液(CSF)是一种存在于大脑和脊髓中的液体,对基础科学和临床科学都非常重要。CSF蛋白质成分的分析为基础神经科学研究以及神经系统疾病提供了关键信息。需要注意的一点是,在CSF中测量的蛋白质可能同时来自血清的术中合成和转位,而CSF的蛋白质分析只能确定这两个组分的总和。为了区分动物模型和人类血液内产生的蛋白质转位和蛋白质,CSF蛋白质分析测量使用传统的蛋白质分析工具必须包括白蛋白CSF/血清商(Q白蛋白)的计算,这是血脑界面(BBI)完整性的标志,以及蛋白质指数(Q蛋白/Q白蛋白),这是钙蛋白内合成的估计。该协议说明了从CSF和血液采集到商数和指数计算的整个过程,用于定量测量神经疾病小鼠模型中的细胞内蛋白质合成和BBI损伤。
引言
脑脊液(CSF)是一种围绕大脑和脊髓的透明无色液体,具有重要的临床和基本科学意义。CSF保持中枢神经系统(CNS)的电解环境,平衡全身酸碱状态,为神经元和胶质细胞提供营养,作为中枢神经系统的淋巴系统发挥作用,并在CNS1中传输激素、神经递质、细胞因子和其他神经肽。因此,由于CSF成分反映了中枢神经系统的活性,这种流体提供了一个有价值的,但间接的,以表征的中枢神经系统的生理和病理状态。
CSF已经用于诊断影响中枢神经系统的疾病超过一百年,在大部分时间,它主要是由临床医生作为诊断工具研究。然而,近年来,神经生物学家已经认识到CSF在研究中枢神经系统病理生理学方面的潜力。特别是,神经科学领域引入了几种高通量蛋白分析工具,以便对CSF的蛋白质组成进行详细研究,并期望这种分析有助于深入了解动态变化发生在CNS内。
Luminex和Simoa技术2,3等多倍免疫测定技术的技术发展,使今天的研究人员能够以极低的浓度检测数百种蛋白质。此外,这些相同的技术允许使用小样本量,从而促进对小动物,包括小鼠的研究,在小动物中,CSF的有限样本量直到最近才排除了对液体的详细特征。
然而,一个警告是,在CSF中测量的蛋白质可能来自细胞内合成和/或从血清转出由于血脑界面(BBI)受损。不幸的是,仅CSF的蛋白质分析只能确定这两个成分的总和。为了区分转体蛋白和内蛋白,必须根据血清浓度的个体变异性以及屏障完整性调整使用任何可用蛋白质分析工具的CSF蛋白测量。然而,虽然这种调整在临床实践中是常用的,例如CSF IgG指数,该指数对检测细胞内IgG合成4、5、6具有高灵敏度,但迄今为止很少有研究能够纠正CSF蛋白浓度对血清浓度和屏障完整性的7、8。
目前,Reibergram方法是确定蛋白质屏障功能和宫内合成的最佳方法。它是CSF/血清商图中的图形化评估,以综合的方式分析屏障(dys)功能和宫内蛋白合成,指纯血衍生蛋白质9,10。高度丰富的蛋白质白蛋白通常被选择作为参考蛋白,因为它只在肝脏中产生,因为它的大小,大约70kDa,是小蛋白和大蛋白质11之间的中间体。分析图最初由赖伯和费尔根豪尔于1987年对免疫球蛋白(Igs)11的主要类别进行定义,根据对数千个人类样本9的分析结果进行实证分析。该方法随后被两个菲克扩散定律应用于分子扩散/流速理论12得到证实。这种理论证明蛋白质通过屏障扩散具有双曲分布,可以定量解释中枢神经系统9、13中蛋白质的动态。总体而言,使用 Reibergram 来演示片内蛋白合成的优点是,它同时识别从血清进入 CSF 的蛋白质分数,以及由于本地生产而在 CSF 中发现的蛋白质量。
本文和相关协议描述了从CSF和血液采集到最终计算校正CSF蛋白水平,用于神经小鼠小鼠模型中的细胞内蛋白合成的定量测量。障碍。此过程提供了一个基准,用于评估 (1) 任何 CSF 蛋白质的病理生理学来源和 (2) 屏障完整性的稳定性和功能意义。这个程序和协议不仅可用于评估小鼠CSF样本,而且可用于分析多种动物模型的神经系统疾病和人类患者的CSF。
研究方案
所有动物工作都采用达特茅斯盖塞尔医学院机构动物护理和使用委员会 (IACUC) 审查和批准的协议。
1. 流体收集
注:血清和CSF均是必需的。生存和尸体解剖需要每个流体收集两个协议。
- 使用生存程序收集血清和CSF
注:对于生存液体收集,血清收集应先于CSF收集,因为它是一个侵入性较低的程序。CSF 必须在血清抽取后一周内获得。- 血清采集的逆轨出血程序。
注:这个程序是为小鼠生存出血14。所述程序适用于小鼠的任何年龄、性别和菌株。由于IACUC规则规定,单次抽血可以去除最大体重1%的血量,因此建议仅在体重超过15克的小鼠身上进行手术。- 将装有鼠标的笼子从机架移到适当的工作区。将氧气流量计打开至 1 L/min,准备麻醉气体机。
- 将动物放入感应室,并紧闭盖子。将异脱蒸发器打开至3.5%,并监测动物直到静卧。
- 将动物从室中取出,并通过踏板反射评估麻醉水平,即坚定的脚垫捏合。在进行手术之前,确保麻醉深度足够:对牢固的挤压缺乏反应表示麻醉充分。
- 用非主导手的拇指和食指抓住耳朵后面的松弛皮肤,抑制麻醉小鼠。用食指将眼睛和拇指上的皮肤拉回眼睛下方,使眼睛鼓起。
- 将巴斯德移液器的尖端放入眼球下方的眼窝中(图1,左面板),将尖端方向向眼窝中间约45°(图1,右面板)。在前进通道期间,在手指之间旋转移液器。施加温和的压力,然后释放,直到血液进入移液器。
注:一次从该位置提取的最大血液量约为体重的1%,例如,从20克鼠标提取0.2 mL。 - 轻轻取出毛细管,防止眼睛受伤,并将采集的血液放入 1.5 mL 离心管中。关闭眼睑,用纱布施加温和的压力,以防止进一步出血。完全警报和移动(通常为 3⁄5 分钟)后,将鼠标返回到其保持笼。
- 在室温(RT)下,让血液凝固30-60分钟,然后在4°C冷冻离心机中,在2000 x g下将血液离心10分钟。使用干净的移液器技术,将血清收集到新的,标有0.5 mL的瓶中。立即在-80°C冷冻血清小瓶。
- CSF 收集与生存程序
注:此程序用于生存手术,它基于刘和达夫在2008年发布的协议15.小鼠由氯胺酮(20毫克/升L)、木兰素(0.5毫克/mL)和醋丙胺(0.5毫克/mL)鸡尾酒麻醉。- 将装有小鼠的笼子从机架移到指定的手术工作区。在无菌环境中准备手术空间。确保所有使用的仪器和材料在手术前都进行消毒。
- 称量鼠标并计算所需的麻醉体积(20 克鼠标的麻醉鸡尾酒 0.1 mL)。注射麻醉内腹16。几分钟后,通过捏住脚垫来测试鼠标,以确保充分麻醉。如果需要更多的麻醉剂,进一步注射0.01~0.03 mL的麻醉鸡尾酒。
- 使用剪刀或剪报来剪头的一小块区域,在头骨的末端,中,露出足够大的工作区域,供CSF收集。将鼠标置于立体仪器的易发位置,并使用耳条稳定头部(图2A)。
注:鼠标被放下,使头部与身体形成近135°角(图2A)。一旦动物被定位,手术窗帘用于在手术部位维持无菌场。透明胶粘剂窗帘是小鼠 CSF 收集的首选,因为它们允许直接和更集中地可视化动物。 - 用30%氯西丁丁乙酸酯在手术部位进行蒸馏。使用无菌手术刀,使下垂切口的皮肤低于奥皮普暴露的肌肉覆盖在蓄水池麦格纳。
- 通过用钳子钝切除,分离皮下组织和肌肉,以暴露蓄水池(图2B)。使用微缩器将肌肉分开(图2B),并露出水池上杜拉母体脑膜炎层。
- 用无菌磷酸盐缓冲盐水 (PBS) 轻轻清洗,以消除任何可能的血液污染。用无菌棉签干燥杜拉母体,用30G针轻轻刺穿覆盖蓄水池的膜。快速、轻轻地插入一个小玻璃毛细管来收集CSF(图2C)。
注:颅内压力允许CSF自发流入毛细管(图2C)。根据鼠标的年龄和大小,从每只鼠标获得大约 5~12 μL 的 CSF。 - 小心地从膜上取出毛细管。通过聚乙烯管(材料表)将管子连接到3 mL注射器,并将收集的CSF注射到标有0.5 mL的管中(图2D)。把小瓶放在冰上。
- 使用多二恶英结缝合线(PDS)与一次性针头,并使用埋藏缝合17关闭切口。清除任何干燥的血液或组织的区域。
- 注射小鼠,皮下或腹内16,用0.05~0.1毫克/千克的盐酸丁丙诺啡作为镇痛治疗。此外,注射皮下1 mL无菌盐水,以防止脱水。
- 将鼠标放回干净温暖的笼子里进行恢复。一旦鼠标移动,能够到达食物和水,将笼子放回机架上。
- 在4°C冷冻离心机中,在1000 x g下将CSF离心10分钟。通过目视检查检查血液污染程度,以识别异色和管底部存在红色颗粒。丢弃血液污染的样品。
注:用于校正血液污染标本中CSF蛋白质量的公式基于等式参数,包括CSF和血清中的蛋白质含量、血球(HCT)和红血球(RBC)计数(CSF和血液18)。但是,由于体积小,这种校正策略无法轻易应用于小鼠 CSF 试样,因此将校正策略限制为目视检查。 - 使用干净的移液器技术,将CSF收集到一个新的0.2 mL管中,留下带细胞的颗粒。使用 PBS 稀释 CSF 1:3,以减少气溶胶引起的体积损失。立即在-80°C冷冻CSF小瓶。
- 血清采集的逆轨出血程序。
- 使用非生存程序收集的血清和CSF
注:对于非生存液体收集,CSF收集先于血清收集,因为小鼠需要具有脉搏。- 在尸检时收集 CSF
注:此程序用于非生存手术,从每只小鼠获得大约10~20μL的CSF。建议使用无菌手术场,但不要求非生存手术。- 将装有鼠标的笼子从机架移到舒适的工作空间。对于 CSF 集合,请按照步骤 1.1.2.2_1.1.2.7 和 1.1.2.11_1.1.2.12 进行操作。继续第1.2.2节收集血清。
- 通过心脏内穿刺采集血液(开放方法)
注:预期血量约为体重的3%,例如,20克鼠标的0.6 mL。- 遵循 CSF 收集,确保通过捏住脚垫确保鼠标仍然充分麻醉。如果观察到任何反应,施用第二剂麻醉剂。如果未观察到任何反应,请继续。
- 将动物放在背部,用70%酒精将拭子皮肤放在腹部。用手术剪刀,打开胸腔,暴露心脏。将 25 G 针头(连接到 3 mL 注射器)插入左心室,轻轻对注射器柱塞施加负压。采集血液后拔针。
- 执行辅助安乐死方法,如斩首或宫颈脱位,以确保动物死亡。
- 向下推注射器的柱塞,将收集的血液注入 1.5 mL 小瓶中。在RT处让血液凝固30-60分钟,然后在4°C冷冻离心机中以2000 x g将其离心10分钟。
- 使用清洁移液器技术,将血清收集到新的,标有0.5 mL的瓶中。立即在-80°C冷冻器中冷冻小瓶血清。
- 在尸检时收集 CSF
2. 蛋白质分析
- 使用首选方法,例如 Luminex 技术,用于量化匹配血清和 CSF 样本中的目标蛋白和白蛋白。
注:这里给出了Luminex磁性技术的例子,但几乎任何测量蛋白质量的技术,包括酶相关的免疫吸附测定(ELISAs),都可以应用于当前的协议。理想情况下,CSF 和血清样本在同一平台上同时运行白蛋白和目标蛋白。分析条件必须针对协议中的关键步骤进行优化,如抗原-珠耦合浓度、血清和CSF样品稀释、每种分析物的最佳拟合标准曲线以及缓冲组合物,以减少非特异性反应性。如果商业试剂盒用于蛋白质测量,例如免疫球蛋白等分型试剂盒(材料表)用于获取图 3,制造商的指示必须遵循。- 解冻后和分析前,将离心机CSF和血清样品(2,000 x g,10分钟)使用上清液防止过滤板和/或探针堵塞。按照试剂盒提供的检测程序进行适当的样品稀释。否则,确定每种麻醉剂和液体的适当稀释。相应地稀释 PBS 中的样品。
注:如果没有具体的指导或说明,在研究测试之前,必须确定每种分析物和液体的稀释,确定获得浓度估计值所需的适当稀释范围,从而在最标准曲线的可靠范围。了解要分析的生物样本的特性,例如液体中的生理和病理浓度,可以尝试使用低、中、高分析物含量的样品进行不同的稀释。如果样品中的预期浓度范围是先验的,则可以在计算样品必须稀释多少次才能在所选标准曲线范围内后选择稀释。
注意:通过计算稀释系数,请记住 CSF 已被稀释 1:3。 - 通过串行稀释参考标准蛋白,为每种感兴趣的蛋白质准备一个标准曲线,例如白蛋白和IgG,用于生成图3中的数据。在制备标准曲线时,在进行下一次稀释之前,彻底混合每个较高的浓度。
注:无论选择何种定量方法,每次执行检测以估计样品中的蛋白质浓度时,都必须包含一条标准曲线。参考标准的最佳选择是纯化的、已知浓度的感兴趣蛋白质。决定特定的稀释度以及用于定义标准曲线的数据点和复制的数量取决于标准曲线中的非线性程度。 - 选择适当的抗体耦合磁珠集 (材料表)。对于单独的珠子小瓶,将每瓶小瓶声波30秒,涡流1分钟。通过将珠子储存稀释至每组/洗涤缓冲液中50颗珠的最终浓度(PBS,1%牛血清白蛋白[BSA]),制备"工作珠混合物"。在平底96孔板(材料表)中,将50μL的混合珠子添加到每口孔中。
注意:荧光珠是光敏的。因此,在整个过程中,应保护它们免受长时间暴露在光线下。 - 绘制背景、标准和示例在井图工作表上的位置图。
- 在每个背景井中加入 50 μL 的测定/洗涤缓冲液,向标准曲线的井中加入 50 μL 的测定/洗涤缓冲液。将每个稀释样品的 50 mL 最后装载到适当的井中。用铝箔包裹板,在 RT 处用搅拌(±800 rpm)在板摇杆上孵育 30 分钟。
- 将板放在手持磁铁(材料表)上,将板放在磁铁上 60 s,以便完全设置磁珠。通过轻轻将板和锥子板敲入吸水垫上,以去除残留液体,取出井内内容物。
- 通过从磁铁中取出板,加入 200 μL 的测定/洗涤缓冲液,摇动 ±30 s,最后将其重新连接到磁铁,来清洗板。重复洗涤3次。
- 将生物浸化检测抗体,即生物锡标记抗体针对蛋白质宿主物种升高,在测定/洗涤缓冲液中稀释至4微克/mL。在每个井中加入50μL的稀释检测抗体。盖上板,在+800 rpm 的转速下在板摇盘上的 RT 孵育 30 分钟。将板放在磁铁上,重复步骤 2.1.6 和 2.1.7。
- 稀释植物性二苯醚素(PE)-结合链球菌素(SAPE)至4微克/mL的测定/洗涤缓冲液。在每个井中加入50μL的稀释SAPE。盖上板,在+800 rpm 的转速下在板摇盘上的 RT 孵育 30 分钟。将板放在磁铁上,重复步骤 2.1.6 和 2.1.7。
- 从磁铁中取出板,并在 100 μL 的测定/洗涤缓冲液中重新悬浮磁珠。读取井与双激光流为基础的检测仪器,允许检测PE荧光强度(FI)的大小。
注: 生成的信号(例如 FI)与附着在珠子表面的目标抗原量成正比。 - 通过绘制检测信号 FI 与标准蛋白质浓度的图形,导出原始数据并创建标准曲线。使用标准曲线计算样本中的分析剂的浓度。
注:白蛋白以g/dL优先表示,而感兴趣的蛋白质以mg/dL优先表示。
- 解冻后和分析前,将离心机CSF和血清样品(2,000 x g,10分钟)使用上清液防止过滤板和/或探针堵塞。按照试剂盒提供的检测程序进行适当的样品稀释。否则,确定每种麻醉剂和液体的适当稀释。相应地稀释 PBS 中的样品。
3. 计算内数指数
- 将蛋白质浓度值组织到电子表格中,并通过应用以下公式分析结果。
- 计算 Q白蛋白:
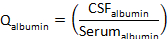
其中CSF白蛋白和血清白蛋白分别是匹配血清和CSF样本中的白蛋白浓度。 - 计算Q蛋白:

其中CSF蛋白和血清蛋白分别是匹配血清和CSF样本中靶蛋白的浓度。 - 计算蛋白质指数:
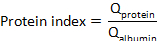
结果
这项具有代表性的实验旨在比较多发性硬化症(MS)两个临床相关啮齿动物模型中IgG的宫内合成:PLP139-151-诱导的复发性自免疫性脑脊髓炎(R-EAE)和慢性渐进性、泰勒的小鼠脑脊髓炎病毒诱发脱骨髓性疾病(TMEV-IDD)。R-EAE是理解复发性MS的有用模型,而TMEV-IDD模型具有慢性渐进性MS19。
在本研究中,对R-EAE(n = 12)和TMEV-IDD(n = 28)中的宫内IgG合成进行了定量分析。两组在疾病高峰时都进行了分析。另外一组10只小鼠被假处理,并作为年龄匹配的对照组(cR-EAE n = 4,cTMEV-IDD sham n = 6)。
使用市售试剂盒(材料表)采用磁珠方法测量匹配血清和CSF样本中IgG总量。IgG 总值来自子类 IgG1、IgG2a、IgG2b 和 IgG3 值的总和。白蛋白是用商业小鼠白蛋白ELISA试剂盒(材料表)测量的,因为当时没有白蛋白的Luminex测定。所有测量均按照制造商的说明进行。然后,使用白蛋白商(Q白蛋白)和IgG指数(QIgG/Q白蛋白)来区分CSF中血与CNS衍生IgG。
如图3A所示,与相应的年龄匹配假对照组(p = 0.026)相比,MS两种啮齿动物模型的 CSF 中总 IgG 的实际水平显著增加。然而,R-EAE小鼠显示显著增强的Q白蛋白值(p = 0.019),表明这些小鼠屏障的渗透性增加(图3B)。相反,TMEV-IDD和假小鼠(p = 0.49)之间在Q白蛋白方面没有差异,从而证实了我们先前在TMEV-IDD小鼠7、8中发现的完整屏障。为了进一步区分R-EAE和TMEV-IDD中产生的异质IgG和内体IgG,测量了IgG指数,显示TMEV-IDD小鼠(p = 0.0006)中值明显较高,因此在此模型中的中度IgG生产(图3C)。
TMEV-IDD小鼠中一个完好的屏障以及高IgG指数表明,在这个模型中,抗体是在CNS内产生的。相反,在R-EAE中,显著的阻隔分解和低IgG指数提供了证据,表明CSF IgG主要是由外周细胞而不是脑内B细胞产生的,也表明在这个急性MS模型中,CSF IgG主要来自血清。

图1:小鼠的逆轨出血。左图:相对于回溯轨道正心、眼球和轨道背面,针的正确位置。右图:移液器位置从眼睛的中部开始,滑向轨道的背向。毛细管以 45° 的角度插入。请点击此处查看此图的较大版本。

图2:小鼠的CSF集合。(A) 耳杆支撑鼠标头,鼠标放下,使头部与身体形成 135° 角。箭头指向裸露的蓄水池。(B) 用钳子进行钝切除,将肌肉分开,露出蓄水池(箭头指向)。微缩器用于将肌肉分开。(C) 一个小玻璃毛细管用于从蓄水池收集CSF。由于颅内压力,CSF自发地流入毛细管。箭头指向毛细管中收集的 CSF。(D) CSF 通过经过改造的 3 mL 注射器转移到 0.5 mL 管中。请点击此处查看此图的较大版本。

图3:R-EAE和TMEV-IDD中IgG血脑屏障功能及血管内合成。代表 (A) 由 Luminex 技术测量的总 IgG (mg/dL) 的 CSF 水平, (B) 白蛋白 CSF/血清商 (Q白蛋白) 和 (C) IgG 指数 (QIg/Q 白蛋白 ) R-EAE 和 TMEV-IDD 小鼠以及年龄匹配对照小鼠 (cR-EAE 和 cTM-IDD) 中的 IgG 指数 (Q Ig /Q白蛋白)水平线表示该组的中值。p < 0.0001;p < 0.001;*p < 0.01;•p < 0.05。请点击此处查看此图的较大版本。
讨论
评估CSF蛋白质浓度增加的定量方法是中枢神经系统生理和病理状态表征的有用工具。然而,除了可靠的CSF蛋白质水平定量外,CSF蛋白的检测还需要表达在CSF中区分血液和CNS衍生成分的结果。然而,迄今为止,常用的蛋白质定量测定不允许区分两种蛋白质成分,即使借助高通量工具也是如此。因此,为了区分在CNS隔间中合成的蛋白质和从血液中提取的蛋白质,提出了对蛋白质测量的具体校正。这种校正可补偿血清浓度和屏障完整性的个体变异性。总体而言,这些修正基于CSF/血清商(Q蛋白)的计算,该计算减少了由于血清蛋白个体浓度差异而导致的变异性。通过将Q蛋白与CSF/血清白蛋白商(Q白蛋白)相关联,可以进一步降低Q蛋白与障碍功能个体差异相关的变异。两种校正的组合通常称为蛋白质指数,计算为Q蛋白/Q白蛋白比4,6。
白蛋白,由肝脏合成和分泌,是血液中循环的主要血浆蛋白。由于白蛋白完全在CNS之外生产,其CSF中的含量较低(±0.15 g/dL),CSF白蛋白水平升高表示BBI或因脑内出血或创伤性CSF收集而造成血液污染。在上述任何情况下,白蛋白从血清转出到CSF中,其血清浓度成正比。因此,在没有血液污染的情况下,Q白蛋白可用作阻隔功能20的指标。相反,Q白蛋白在人和动物的正常范围内保持不变,BBI21完好无损。在计算内蛋白合成计算中使用此商4,6的基本假设是,在存在泄漏屏障的情况下,CSF蛋白的含量增加与CSF白蛋白浓度的增加成正比。这一假设在1977年4年的一项研究中得到了实验证实,在这项研究中,作者在MS患者中监测了从健康人类血清获得的放射性标记IgG和白蛋白的血液-CSF通道。
与白蛋白类似,血液中的任何蛋白质都可以穿过BBI。当屏障完好无损时,Q蛋白相对恒定。然而,与白蛋白不同,许多蛋白质也可以在CNS内合成。因此,改变的Q蛋白可能由受损的屏障和/或增加的钙内蛋白生产。然而,当CSF蛋白浓度升高只是由于BBI受损,Q蛋白和Q白蛋白的值增加,而这些相同的商在动物有一个完整的屏障的值。相反,当屏障完好无损时,CSF蛋白质浓度增加很可能是由于钙内合成的增加,只有Q蛋白最终增加。
蛋白质指数的使用可能部分受五个因素的限制:1)健康动物中CSF白蛋白浓度的较大变异性,2)蛋白质的不同流体动力学半径,3)蛋白质的内源性CNS表达,4)不同的采样技术,以及5)BBI的形态差异。健康动物中CSF白蛋白浓度的较大变异性导致最终蛋白质指数值发生相当大的变异。例如,在人类中,Q白蛋白是年龄依赖的,因为它随着22岁而增加。此前的一份报告还提到,在健康人群中,Q白蛋白存在性别差异。同样,在小鼠白蛋白浓度取决于年龄和小鼠应变24,例如,Q白蛋白为年轻,雄性,C57Bl/6小鼠可能与Q白蛋白为老,雌,DBA/1J小鼠不同。因此,不能在物种之间和物种内建立屏障完整性的标准化参考间隔,必须根据特定的实验条件计算适当的阈值。
导致蛋白质正常指数变异的另一个因素是它们的分子大小。血清蛋白通过BBI取决于其分子大小,清除率和分子量(MW)之间的相关性被广泛用于评价BBI的渗透性。一般蛋白质结构的大小从几十到几千个氨基酸不等。有些蛋白质的分子大小相对较小,如化学基因,分子量范围在8至20kDa之间。如此低的MW有利于跨越BBI,最终导致更高的正常蛋白质指数。不同,其他蛋白质,如IgM,是非常大的(900~950 kDa),因此在正常条件下显示非常低的指数6。然而,情况并非总是如此,因为尽管MW相似,但一些蛋白质渗透到屏障中比其他蛋白质好得多,可能是因为形状不同。因此,蛋白质的扩散系数,以及由此计算出来的流体动力半径,取决于分子的大小和形状25。蛋白质的几何体积和水动力体积之间的根本差异在150 kDa以上的大蛋白质中最为明显。例如,核素素(132 kDa)、IgG(150 kDa)和IgA(150 kDa)的清除率下降反映了这三种蛋白质的流体动力学异质性,它们具有相似的MW25。在正常情况下,蛋白质也可能在片内产生。有些化学素,例如CXCL10,通常在酶内产生,而其他的,如CXCL13,不是26,27。这意味着,在大多数实验条件下解释蛋白质指标通常需要分析年龄、性别和菌株匹配的未经处理的对照。
液体中的蛋白质水平也可能受到不同取样技术的影响。虽然这可能不是此处描述的CSF采集问题 - 所述生存和非存活程序之间在CSF样本中没有差异,但不同的采血方法可能对血清蛋白总量产生影响。一些采血方法产生动脉血,另一些产生静脉血,而其他方法产生两种14的混合物。从生存逆转轨道出血获得的样本是静脉血和组织液的混合物,而从心脏穿刺收集的末期血液可以产生静脉或动脉血液或两者的混合物14。在健康动物中,动脉血清的总蛋白质和白蛋白含量可能略高于静脉血清28的相同部分。在比较存活率和非生存样本时,应考虑这一点。
最后,需要考虑的一个重要特征是BBI的异构形态结构,它包括至少两个不同的屏障,位于脑微血管内皮的血液-脑屏障(BBB)和位于丘脑丛29上皮的血-CSF屏障(BCSF)。这两种屏障限制和调节分子和细胞在周围和脑脊腔之间的传递,尽管它们通过不同的机制来传递。虽然BBB是一个真正的物理屏障,其特点是细胞之间的复杂相互作用,但BCSF更多的是生理屏障,主要取决于CSF的流动。由于神经系统疾病和/或创伤而减少CSF的生产、释放和流速会损害BCSF功能,从而增加Q白蛋白9、30、31、32。因此,Q白蛋白是BCSF渗透性的更好标志,而不是BBB或一般BBI渗透性。
综上所述,蛋白质指数的计算是一种相对简单且特征良好的区分转体蛋白和中度内生产蛋白质的方法。应用此公式纠正 CSF 样品中蛋白质的一般测量的优点是,它生成一个客观变量,以量化蛋白质的球内合成并测量 BBI,特别是 BCSF(dys)功能。鉴于这种方法的鲁棒性,通过Q白蛋白和蛋白质指数校正CSF蛋白量提供了一个基准,据以评估(1)任何CSF蛋白的病理生理学起源和(2)屏障完整性的稳定性和功能意义。这里提出了详细的协议,从CSF和血液收集到最终计算纠正总CSF蛋白质量,这适用于小鼠模型的神经系统疾病。然而,相同的方案可以很容易地适应任何动物,包括人类的CSF和蛋白质的细胞内合成的研究。Q白蛋白和IgG指数已广泛应用于临床,用于炎症性神经系统疾病的诊断6。这些相同的参数也成功地用于评估炎症脱骨髓性疾病26,33,34患者的各种细胞因子和化学因子。
披露声明
作者没有什么可透露的。
致谢
作者感谢达特茅斯的比较医学和研究中心(CCMR)的工作人员对用于这些研究的小鼠进行专家护理。伯恩斯坦研究基金资助了这项研究。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 329650 | |
| 1 mL syringe | BD | 329622 | |
| 25 gauge needle | BD | 305122 | |
| 3 mL syringe | BD | 309582 | |
| 30 gauge insulin needle | BD | 305106 | |
| Absorbent pads | Any suitable brand | ||
| Acepromazine | Patterson Vet Supply Inc | ||
| BioPlex Handheld Magnetic Washer | BioRad | 171020100 | Magnet |
| BioPlex MAGPIX Multiplex Reader | BioRad | 171015001 | |
| BioPlex Pro Flat Bottom Plates | BioRad | 171025001 | |
| Biotinilated detection antibody | Any suitable source | The antibody has to be directed against the species of the protein of interest. | |
| Bovine Serum Albumin (BSA) | Sigma | A4503 | |
| Buprenorphine hydrochloride | PAR Pharmaceutical | NDC 42023-179-05 | |
| Capillary Tubes | Sutter Instrument | B100-75-10 | OD: 1.0 mm, ID: 0.75 mm Borosilicate glass 10 cm; drawn over Bunsen to make ID smaller. |
| Centrifuge tube, 0.2 mL | VWR | 20170-012 | |
| Centrifuge tube, 0.5 mL | VWR | 87003-290 | |
| Centrifuge tube, 1.5 mL | VWR | 87003-294 | |
| Chlorhexidine diacetate | Nolvasan | E004272 | |
| Disposable pipettes tips | Any suitable brand | ||
| Ear bars | KOPF Instruments | 1921 or 1922 | |
| Ethanol | Kopter | V1001 | |
| Freezer | VWR | VWR32086A | |
| Gauze | Medline | NON25212 | |
| Heating pad | Sunbeam | XL King Size SoftTouch, 4 Heat Settings with Auto-Off, Teal, 12-Inch x 24-Inch | |
| Induction Chamber | VETEQUIP | ||
| Isoflurane | Patterson Vet Supply Inc | NDC 14043-704-06 | |
| Ketamine (KetaVed) | Patterson Vet Supply Inc | ||
| MagPlex Microspheres (antibody-coupled) | BioRad | Antibody-coupled magnetic bead | |
| Microplate Shaker | Southwest Scientific | SBT1500 | |
| Microretractors | Carfill Quality | ACD-010 | Blunt - 1 mm |
| Microsoft Office (Excel) | Microsoft | ||
| MilliPlex MAP Mouse Immunoglobulin Isotyping Magnetic Bead Panel | EMD Millipore | MGAMMAG-300K | Commercial kit for the quantification through Luminex of a panel of immunoglobulin isotypes and subclasses in mouse fluids. |
| Mouse Albumin capture ELISA kit | Novus Biological | NBP2-60484 | Commercial kit for the quantification through ELISA of albumin in mouse fluids. |
| Multichannel pipette | Eppendorf | 3125000060 | |
| Non-Sterile swabs | MediChoice | WOD1002 | Need to be autoclaved for sterility |
| Oxygen | AIRGAS | OX USPEA | |
| Pasteur Pippettes | Fisher | 13-678-20A | 5 & 3/4" |
| PDS suture with disposable needle, 6-0 Prolen | Patterson Vet | 8695G | P-3 Reverse Cutting, 18" |
| PE-Streptavidin | BD Biosciences | 554061 | |
| Pipetters | Eppendorf | Research seriers | |
| Polyethylene tubing | |||
| Refrigerated Centrifuge | Beckman Coulter | ALLEGRA X-12R | |
| Scale | Uline | H2716 | |
| Scalpel | Feather | EF7281 | |
| Shaver | Harvard Apparatus | 52-5204 | |
| Standard proteins | Any suitable source | The best choice for a reference standard is a purified, known concentration of the protein of interest. | |
| Stereotaxic instrument | KOPF Instruments | Model 900LS | Standard Accessories |
| Sterile 1 x PBS | Corning Cellgro | 21-040-CV | |
| Sterile saline | Baxter | 0338-0048-02 | 0.9 % Sodium Chloride Irrigation USP |
| Surgical Forceps Curved, 7 (2) | Fine Science Tools | 11271-30 | Dumont |
| Surgical Scissors | Fine Science Tools | 14094-11 | Stainless 25x |
| Vaporizer + Flow meter | Moduflex Anhestesia Instruments | ||
| Vortex | Fisher | 02-215-414 | |
| Warming pad | Kent Scientific Corporation | RT-JR-20 | |
| Water Sonicator | Cole Parmer | EW-08895-01 | |
| Xylazine | Patterson Vet Supply Inc |
参考文献
- Whedon, J. M., Glassey, D. Cerebrospinal fluid stasis and its clinical significance. Alternative Therapies in Health and Medicine. 15 (3), 54-60 (2009).
- Kang, J. H., Vanderstichele, H., Trojanowski, J. Q., Shaw, L. M. Simultaneous analysis of cerebrospinal fluid biomarkers using microsphere-based xMAP multiplex technology for early detection of Alzheimer's disease. Methods. 56 (4), 484-493 (2012).
- Barro, C., et al. Fluid biomarker and electrophysiological outcome measures for progressive MS trials. Multiple Sclerosis. 23 (12), 1600-1613 (2017).
- Tourtellotte, W. W., et al. Multiple sclerosis: measurement and validation of central nervous system IgG synthesis rate. Neurology. 30 (3), 240-244 (1980).
- Bonnan, M. Intrathecal IgG synthesis: a resistant and valuable target for future multiple sclerosis treatments. Multiple Sclerosis International. 2015, 296184 (2015).
- Reiber, H. Cerebrospinal fluid--physiology, analysis and interpretation of protein patterns for diagnosis of neurological diseases. Multiple Sclerosis. 4 (3), 99-107 (1998).
- DiSano, K. D., Linzey, M. R., Royce, D. B., Pachner, A. R., Gilli, F. Differential neuro-immune patterns in two clinically relevant murine models of multiple sclerosis. Journal of Neuroinflammation. 16 (1), 109 (2019).
- Pachner, A. R., Li, L., Lagunoff, D. Plasma cells in the central nervous system in the Theiler's virus model of multiple sclerosis. Journal of Neuroimmunology. 232 (1-2), 35-40 (2011).
- Reiber, H. Flow rate of cerebrospinal fluid (CSF)--a concept common to normal blood-CSF barrier function and to dysfunction in neurological diseases. Journal of Neurological Sciences. 122 (2), 189-203 (1994).
- Reiber, H., Zeman, D., Kusnierova, P., Mundwiler, E., Bernasconi, L. Diagnostic relevance of free light chains in cerebrospinal fluid - The hyperbolic reference range for reliable data interpretation in quotient diagrams. Clinica Chimica Acta. 497, 153-162 (2019).
- Reiber, H., Felgenhauer, K. Protein transfer at the blood cerebrospinal fluid barrier and the quantitation of the humoral immune response within the central nervous system. Clinica Chimica Acta. 163 (3), 319-328 (1987).
- Dorta-Contreras, A. J. Reibergrams: essential element in cerebrospinal fluid immunological analysis. Revista de Neurologia. 28 (10), 996-998 (1999).
- Metzger, F., Mischek, D., Stoffers, F. The Connected Steady State Model and the Interdependence of the CSF Proteome and CSF Flow Characteristics. Frontiers Neuroscience. 11, 241 (2017).
- Wolforth, J. Methods of blood collection in the mouse. Laboratory Animals. 29, 47-53 (2000).
- Liu, L., Duff, K. A technique for serial collection of cerebrospinal fluid from the cisterna magna in mouse. Journal of Visualized Experiments. (21), e960 (2008).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), e2771 (2012).
- Johnston, S. A., Tobias, K. M. Veterinary Surgery: Small Animal Expert Consult - E-Book. Elsevier Health Sciences. , (2017).
- Nigrovic, L. E., Shah, S. S., Neuman, M. I. Correction of cerebrospinal fluid protein for the presence of red blood cells in children with a traumatic lumbar puncture. Journal of Pediatrics. 159 (1), 158-159 (2011).
- McCarthy, D. P., Richards, M. H., Miller, S. D. Mouse models of multiple sclerosis: experimental autoimmune encephalomyelitis and Theiler's virus-induced demyelinating disease. Methods in Molecular Biology. 900, 381-401 (2012).
- Link, H., Tibbling, G. Principles of albumin and IgG analyses in neurological disorders. II. Relation of the concentration of the proteins in serum and cerebrospinal fluid. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 391-396 (1977).
- Tibbling, G., Link, H., Ohman, S. Principles of albumin and IgG analyses in neurological disorders. I. Establishment of reference values. Scandinavian Journal of Clinical Laboratory Investigation. 37 (5), 385-390 (1977).
- Deisenhammer, F., et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force. European Journal of Neurology. 13 (9), 913-922 (2006).
- Johanson, C. E., Stopa, E. G., McMillan, P. N. The blood-cerebrospinal fluid barrier: structure and functional significance. Methods in Molecular Biology. 686, 101-131 (2011).
- Zaias, J., Mineau, M., Cray, C., Yoon, D., Altman, N. H. Reference values for serum proteins of common laboratory rodent strains. Journal of the American Association for Laboratory Animal Science. 48 (4), 387-390 (2009).
- Felgenhauer, K., Renner, E. Hydrodynamic radii versus molecular weights in clearance studies of urine and cerebrospinal fluid. Annals of Clinical Biochemistry. 14 (2), 100-104 (1977).
- Pachner, A. R., DiSano, K., Royce, D. B., Gilli, F. Clinical utility of a molecular signature in inflammatory demyelinating disease. Neurology, Neuroimmunology & Neuroinflammation. 6 (1), 520 (2019).
- Pachner, A. R., Li, L., Gilli, F. Chemokine biomarkers in central nervous system tissue and cerebrospinal fluid in the Theiler's virus model mirror those in multiple sclerosis. Cytokine. 76 (2), 577-580 (2015).
- Gerbi, C. Protein concentration in the arterial and venous renal blood serum of the rabbit. Archives of Biochemistry and Biophysics. 31 (1), 49-61 (1951).
- Abbott, N. J., Patabendige, A. A., Dolman, D. E., Yusof, S. R., Begley, D. J. Structure and function of the blood-brain barrier. Neurobiology of Disease. 37 (1), 13-25 (2010).
- Reiber, H. Proteins in cerebrospinal fluid and blood: barriers, CSF flow rate and source-related dynamics. Restorative Neurology and Neuroscience. 21 (3-4), 79-96 (2003).
- Reiber, H. Knowledge-base for interpretation of cerebrospinal fluid data patterns. Essentials in neurology and psychiatry. Arquivos de Neuropsiquiatria. 74 (6), 501-512 (2016).
- Kuehne, L. K., Reiber, H., Bechter, K., Hagberg, L., Fuchs, D. Cerebrospinal fluid neopterin is brain-derived and not associated with blood-CSF barrier dysfunction in non-inflammatory affective and schizophrenic spectrum disorders. Journal of Psychiatric Research. 47 (10), 1417-1422 (2013).
- Bromader, S., et al. Changes in serum and cerebrospinal fluif cytokines in response to non-neurological surgery: an observational study. Journal of Neuroinflammation. 9, 242 (2012).
- Starhof, C., et al. Cerebrospinal fluid pro-inflammatory cytokines differentiate parkinsonian syndromes. Journal of Neuroinflammation. 15 (1), 305 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。