Method Article
잘 정의된 전단 응력 하에서 단세포 이온 전류의 전기 생리학적 기록
요약
이 프로토콜의 목적은 전단 응력에 의한 메카노민성 이온 채널의 실시간 활성화를 조사하는 데 사용하기 위해 변형된 병렬 플레이트 플로우 챔버를 설명하는 것이다.
초록
유체 전단 응력은 내피 기능에 중요한 역할을 하는 것으로 잘 알려져 있다. 대부분의 혈관 침대에서, 혈류의 급성 증가에서 높은 전단 스트레스는 혈관 확장의 결과로 신호 캐스케이드를 트리거하여 혈관 벽에 기계적 스트레스를 완화. 전단 응력의 패턴은 또한 잘 친동맥질성인 전단 응력과 함께 동맥경화증의 발달에 중요한 요인으로 알려져 있다. 우리는 다양한 중간 세포 신호 경로의 상세한 이해가 있는 동안, 화학 매개체로 기계적인 자극을 첫째로 번역하는 수용체는 완전히 이해되지 않습니다. 메카노민성 이온 채널은 전단 및 조절 전단 유도 세포 신호에 대한 반응에 매우 중요하며, 이에 따라 혈관활성 매개체의 생산을 조절한다. 이러한 채널은 전단에 가장 초기 활성화 된 신호 성분 중 이며 산화 질소 생산을 촉진 을 통해 전단 유도 혈관 확장에 연결 되었습니다 (예를 들어, 안쪽으로 정류 K+ [Kir] 및 과도 수용 체 잠재력 [TRP] 채널) 및 내피 과분극 인자(예를 들어, Kir 및 칼슘 활성화 K+ [KCa] 채널) 및 압전 채널을 수반하는 결정되지 않은 메커니즘을 통해 전단 유도 혈관 수축. 이러한 채널이 전단력에 의해 활성화되는 생물 물리학 적 메커니즘을 이해 (즉, 직접 또는 기본 메카노 수용체를 통해) 내피 기능 장애와 관련된 병리 생리학을 해결하기 위해 잠재적 인 새로운 목표를 제공 할 수 그리고 아히로제네시스. 전기 생리학을 사용하여 실시간으로 이온 채널의 흐름 유도 활성화를 기록하는 것은 여전히 주요 과제입니다. 원뿔 및 플레이트 레오미터 및 폐쇄형 평행 플레이트 유량챔버와 같이 셀을 잘 정의된 전단 응력에 노출하는 표준 방법은 이온 채널 활성화에 대한 실시간 연구를 허용하지 않습니다. 이 프로토콜의 목표는 잘 정의된 전단 응력 하에서 메카노감응이성 이온 채널의 실시간 전기생리학적 기록을 허용하는 변형된 병렬 플레이트 플로우 챔버를 설명하는 것입니다.
서문
혈류에 의해 생성되는 혈역학적 힘은 내피 및 혈관 기능1,2에서중요한 역할을 하는 것으로 잘 알려져 있다. 또한 여러 유형의 이온 채널이 전단 응력 3,4,5의 변화에 급격하게 반응하여 이온 채널이 1차 전단 응력 센서가 될 수 있다는 가설을 세우고 있는 것으로 잘 알려져 있다. 최근에는, 저희와 다른 사람들은 메카노민성 이온 채널이 전단 스트레스에 대한 혈관 활성 반응을 포함하여 여러전단 스트레스 에 민감한 혈관 기능에 중요한 역할을 한다는 것을 보여주었습니다 6,7,8 , 발달 혈관 신생9. 그러나 이온 채널의 전단 응력 감도 메커니즘은 거의 완전히 알려지지 않았습니다. 지식의 이 격차는 잘 정의된 전단 응력 하에서 전기 생리학적 기록을 수행하는 기술적 어려움 때문일 가능성이 높습니다. 이 문서에서는, 따라서, 우리는 이 목표를 달성하기 위하여 우리의 실험실에서일상적으로 수행되는 단계별 상세한 프로토콜6,7,10,11을제공합니다 .
이 방법의 전반적인 목표는 생리학적 범위에서 잘 정의된 전단 응력 하에서 이온 채널 메카노활성화의 실시간 조사를 허용하는 것이다. 이는 전기 생리학적 파이펫이 챔버내로 낮아질 수 있도록 표준 병렬 플레이트 유량 챔버를 수정함으로써 달성되며, 이를 달성하기 위한 독특한 접근법을 제공하는 동안 바닥 판상에서 성장된 접근 세포와 접근 셀을 목표6,7,11. 대조적으로, 이전 간행물에 기술된 표준 병렬 플레이트 유량 챔버는 전단력12 또는 기타 비침습적 접근법13,14에 노출된 세포의 실시간 이미징 분석을 위해 사용될 수 있지만, 그렇지 않은 경우 전기 생리학. 유사하게, 원뿔 및 플레이트 장치는, 전단 응력(15,16)에 세포를 노출시키기 위한 또 다른 강력한 접근법은 또한 전기생리학적 기록에 적합하지 않다. 따라서, 이러한 유동 장치는 이온 채널의 전단 응력 민감도의 조사를 허용하지 않는다. 흐름 하에서 전기 생리학적 기록을 수행하는 데 어려움은 이러한 중요한 효과를 담당하는 메커니즘에 대한 정보의 빈약성에 대한 주된 이유입니다.
동일한 목표를 달성하기 위한 대체 접근 법의 관점에서 정확하거나 제어되는 방법은 없습니다. 몇몇 이전 연구는17,18이상에서 세포의 부근에 가져온 다른 파이펫에서 오는 액체의 스트림에 세포를 노출시킴으로써 흐름의 밑에 이온 채널 활동을 기록하기 위하여 시도했습니다. 이것은 매우 비 생리적, 이러한 조건 하에서 생성 된 기계적 힘은 혈관에서 전단 스트레스의 생리적 프로필과 거의 공통점이 없기 때문에. 유사한 관심사는 열린 챔버의 관류에 의한 생리적 전단 응력 시뮬레이션 시도에 적용됩니다. 우리의 이전 연구 10에서자세히 설명한 바와 같이, 열린 액체 공기 인터페이스는 비 생리학적인 여러 장애 및 재순환을 만듭니다. 이러한 모든 문제를 해결하기 위해, 우리는 또한 우리의 이전 연구에서 "최소 침습 흐름 장치"라고 수정 병렬플레이트 (MPP) 흐름 챔버를 설계 6,7,10,11,만든 아크릴에서 광범위하게 우리의 실험실에서 사용. 그러나, 디자인의 원래 설명이 거의 20 년 전에 출판되었다는 사실에도 불구하고 잘 정의 된 전단 응력하에서 전기 생리학적 기록을 수행 할 수있는 유일한 흐름 장치입니다, 이 방법론은되지 않았습니다 다른 실험실에서 채택하고 흐름에서 전류를 기록하려고 시도하는 연구는 거의 없습니다. 따라서 MPP 유량챔버 사용에 대한 상세한 설명을 제공하는 것은 메카노민성 이온 채널 및 혈관 생물학에 관심이 있는 연구에 큰 도움이 될 것이라고 믿습니다.
프로토콜
우리의 연구에서 동물의 사용은 시카고 동물 관리위원회 (#16-183)에서 일리노이 대학에 의해 승인됩니다.
1. 수정 된 병렬 플레이트 흐름 챔버의 조립
참고: MPP 유동 챔버 조각 의 경우 표 1 및 그림 1을 참조하십시오. 어셈블리용 챔버 조각의 방향을 자세히 설명하는 도식은 그림 1을 참조하십시오.
- 직사각형 커버 유리, 조각 D를 C의 바닥에 부착하려면 먼저 500 μL 실리콘 탄성 중합체 경화제를 5 mL의 실리콘 탄성 중합체 염기5 mL에 철저히 혼합하여 실리콘 탄성 중합체 용액을 만듭니다.
- 실리콘 탄성중합체 용액의 얇은 층을 C피스의 직사각형 공간 의 가장자리 주위에 적용하고 직사각형 커버 유리 조각 D를 탄성중합체 용액에 직접 직접 배치하여 조각 D가 C피스의 열린 직사각형 공간을 완전히 덮도록 합니다. 여분의 실리콘 엘라스토머 용액을 조심스럽게 닦아냅니다.
- 직사각형 커버 유리, 조각 F를 조각 E의 바닥에 접수하기 위한 1.2 단계를 반복하고 실리콘 탄성 중합체 용액이 실온에서 밤새 경화될 수 있도록 합니다.
참고: 일단 경화되면 직사각형 커버 유리는 교체가 필요하기 전에 최대 6 개월 동안 부착된 상태로 유지됩니다. - 하단 챔버 조각, 조각 E로 시작, 순차적으로 다음 순서로 이전의 상단에 각 조각을 배치하여 MPP 흐름 챔버를 조립 : 조각 E (바닥), 조각 C, 조각 B, 조각 A (상단).
- 모서리에 있는 각 조각의 나사 구멍을 정렬하고 조각을 단단히 조여 MPP 플로우 챔버로 흐름을 관리하는 동안 누출이 발생하지 않도록 합니다.
2. MPP 유량 챔버에 셀 준비 및 파종
참고: 배양 된 내피 세포에 대한 2.1-2.7 단계를 따르십시오. 마우스 방부동맥 아케이드로부터 내피 세포를 격리하고 갓 단리된 내피 세포의 제조를 위한 단계 2.8-2.14에 상세한 방법을 따르십시오.
- 6웰 플레이트에서 4-5 개의 12mm 커버 유리 원 /well 및 종자 세포를 10 %와 30 % 컨플루통 사이에 배치하여 단일 세포가 전기 생리학적 기록을 위해 액세스 할 수 있도록합니다.
- 표준 배양 조건 하에서 배양세포 (5% CO2, 37 °C) 이상 세포가 부착 할 수 있도록 2시간 이상 및 저자의 경험에서 내피 세포로 24 시간 이상은 24 개 이상의 하위 합류에서 파종 될 때 패치하기가 매우 평평해지고 어려워집니다. H.
- 6웰 플레이트의 우물에서 부착된 세포를 함유하는 커버 유리를 제거하고, 인산완충식염수(PBS)로 신속하게 헹구고, 2mL 전기생리학적 목욕용액을 함유한35mm 페트리 접시로 옮기기 전에 MPP 흐름으로 이송하기 전에 (표 2) 챔버.
- 커버 유리 원을 직사각형 커버 유리, PP 플로우 챔버의 조각 C에 부착된 조각 D로 전송하여 세포가 공기에 노출되지 않도록 적절한 용액이 커버 유리에 유지되도록 합니다. 커버 유리 원과 세포가 용액에 완전히 잠기도록 원하는 목욕 용액 (~250 μL)을 세포에 추가하십시오.
- 커버 유리 원이 진공 저장소 측에 가장 가까운 반쪽에 놓이도록 배치하여 셀이 조각B의 슬릿 개구부와 일치하도록 합니다. 챔버로 의 흐름은 커버 유리 원의 위치를 방해하지 않습니다.
- 도1.4 및 1.5 단계에 설명된 바와 같이, 적절한 순서로 조각을 함께 나사로 조여 MPP 유동 챔버를 조립하고 도 1에 도시된 바와 같이. 챔버를 현미경 단계로 옮기고 즉시 챔버를 배스 용액으로 정성하여 흡인용 진공 저장소에 도달하십시오 (~10 mL).
- 어두운 테두리와 명백한 핵을 가진 세포를 확인하 여 실험에 대 한 건강 한 세포를 식별 합니다. 다른 세포와 접촉하는 타블링 또는 세포로 보이는 세포를 피하십시오.
참고: 저자의 실험실에서, 인간 대동맥 내피 세포와 배양에서 일차 마우스 간담 간외 세포가 사용된다. 그러나, 특정 연구 요구에 관심 있는 부착 세포의 어떤 다른 유형도 같은 방법으로 사용할 수 있습니다. - 분리 용액에서 고립 된 동맥 아케이드를씻으소서 (표 2). 아케이드를 2 mL의 미리 온난(37°C) 해리 용액(표 2에 나타낸 해리 용액 레시피)을 포함하는 2 mL 원심분리기 튜브로 옮기고 중성 프로테아제(0.5 mg/mL)와 엘라스타아제(0.5 mg/mL)를 함유합니다. 37 °C에서 1 시간 동안 배양하고 10 분마다 부드럽게 흔들어 보입니다.
- 중성 프로테아제/엘라스타제 해리액 1 mL을 제거하고 1 mg/mL 콜라게나아제 타입 1을 추가합니다. 0.5 mg/mL의 최종 콜라게나아제 타입 1 농도를 위해 동맥을 함유하는 용액에 콜라게나아제 용액을 반환합니다. 37 °C에서 2-3 분 동안 배양하십시오.
- 5등급 집게를 사용하여 아케이드를 750μL의 신선하고 차가운 해리 솔루션을 포함하는 35mm 직경의 페트리 접시로 빠르게 옮니다. 또한 효소 소화 된 동맥에서 내피 세포를 기계적으로 해방하기 위해 두 개의 20 G 주사기 바늘을 사용하여 조직을 해리시다.
- 9" 일회용 파스퇴르 유리 파이펫을 사용하여, 유리 파이펫을 사용하여 세포를 새로운 1.5 mL 원심분리관으로 옮기기 전에 셀 용액을 10배 트리토레이한다.
- 페트리 접시를 다른 750 μL의 해리 액으로 씻고 동일한 튜브로 옮김하십시오. 유리 파이펫을 사용하여, 하나 세포 현탁액을 생성하기 위해 적어도 10x를 피펫팅하여 세포를 더욱 기계적으로 분산시켜 내피 세포 무결성을 손상시킬 수 있는 기포를 도입하지 않도록 주의한다.
- 내피 세포 현탁액 (~500-1,000 셀)의 750 μL을 직접 추가하여 저수지 진공 측에 가장 가까운 절반에 MPP 유량 챔버의 조각 D를. 내피 세포가 실온에서 45 분에서 1 시간 사이에 부착되도록하십시오.
- 도1.4 및 1.5 단계에 도시된 바와 같이 적절한 순서로 조각을 함께 나사로 조여 MPP 유동 챔버를 조립하고 도 1에 도시된 바와 같이. 챔버를 현미경 단계로 옮기고 즉시 챔버에 진공 흡인 (~ 10 mL)에 도달하도록 목욕 용액을 주입하십시오. 그들의 거칠고 둥근 표현형19,20에의해 접근 가능한 내피 세포를 확인합니다.
참고: 다양한 소화 방법과 효소 칵테일은 다른 동맥 침대에서 내피 세포를 분리하는 데 사용되었습니다. 메타노 감응 이온 채널의 패치 클램프 전기 생리학에 대한 내피 세포를 분리하기 위해 다양한 조사자가 사용해 온 프로토콜에 대한 자세한 설명은 표 3을 참조하십시오. 이러한 방법은 MPP 유량 챔버와 조합하여 사용하기에 적합합니다.
3. 전단 활성화 메카노감응이온 채널의 전기생리학적 기록을 위한 MPP 유동 챔버에 전단 응력 제어
- 30mL 접합 주사기 실린더를 마이크로보어 튜브가 장착된 3방향 루어 잠금장치(내부 직경: 0.05 인치, 외경: 0.09 인치)에 연결하여 중력 관류 시스템을 MPP의 3mm 직경 입구 구멍에 삽입하는 데 적합합니다. 챔버.
- 양면 테이프를 사용하여 전기 생리학 장비를 둘러싼 패일 케이지의 바깥면에 점진적실린더를 부착합니다(그림 2). MPP 챔버에 튜브를 삽입하기 전에 주사기와 튜브를 목욕 용액으로 미리 채웁니다 (내피 세포에서 K+ 채널을 내적으로 정류하는 데 사용되는 목욕 용액의 표 2 참조). 튜브를 조각 A의 MPP 유동 챔버 입구 구멍에 삽입합니다.
- 진공 저장소에서 용액이 제거되도록 MPP 유량 챔버를 용액으로 미리 채웁니다. 챔버로의 흐름을 멈추고 점진적인 실린더를 맨 위 마크로 리필합니다. 솔루션이 챔버를 통해 흐르도록 허용하고 스톱 워치를 사용하여 주어진 주사기 실린더 높이에서 mL/s를 계산하여 유량을 수동으로 계산합니다.
- 주사기를 올리거나 내리면 흐름을 변경하고 챔버에서 전단하고 원하는 수준의 전단 응력을 찾을 때까지이 과정을 계속하십시오.
- 다음 방정식21을사용하여 병렬 챔버에서 전단 응력 계산 :
θ = 6μQ/h2w
여기서 μ = 유체 점도(g/cm·s), Q = 유량(mL/s) 및 평행 플레이트 챔버 폭(w = 2.2cm) 및 높이(h = 0.1cm)
참고: 현재 중력 관류 시스템에서 현미경 단계보다 57cm 높은 주사기 실린더 높이(실린더 상단에서 측정)에서 유량은 0.3 mL/s입니다. 이 주사기 실린더 높이및 유량에서 챔버에서 계산된 전단은0.7 dyn/cm 2입니다. 또한 연동 펌프와 같은 다른 관류 시스템을 사용하여 MPP 유량 챔버로의 흐름을 제어할 수 있다는 점에 유의해야 합니다. 그러나, 이러한 장치는 원치 않는 난류를 추가하고 유동하에서 전기 생리학 측정의 안정성에 영향을 미칠 수 있으므로 여기에 설명된 중력 관류 시스템을 사용하는 것이 좋습니다. - 접착된 세포를 함유한 조립된 챔버를 전기생리학 장비의 현미경 단계로 옮기고 배스 용액으로 미리 채워진 튜브를 조각 A의 구멍에 삽입하고 동시에 챔버를 채우고 10 mL의 목욕 용액으로 세포를 세척하십시오. 용액이 챔버로 흐르도록 3방향 루어 잠금 장치를 돌리기.
- 원하는 패치 구성이 성공적으로 획득되면 채널 전류가 실온에서 정적 욕조에서 안정화될 수 있습니다. 전류가 안정화되면, 전단 응력의 다음 단계 증가 전에 안정화 전류의 증가를 허용 단계 별 방식으로 전단을 적용합니다.
참고: 저자는 내피 세포에서 메카노 활성화 이온 채널을 공부 할 때 천공 패치 구성으로 가장 성공을 찾을 수 있습니다. 천공 된 전세포 패치 구성을 수행하려면 디메틸 설폭사이드 (DMSO)에 60 mg / mL 스톡 암포테리신 B의 5 μL을 0.2 μm 멸균 여과 파이펫 용액의 1 mL에 추가하십시오. 세포 부착 구성에서 기가옴 씰을 생성한 후, 2-5분 이내에 천포된 전체 셀 패치를 형성한다. - 메카노민성 채널 전류가 정적 욕조에서 관찰된 기준선 전류로 복귀할 수 있도록 챔버로의 흐름을 중지하여 셀에 대한 전단 노출을 제거합니다.
- 용액 원자를 변경하여 관심 있는 메카노민감성 이온 채널 전류를 분리(예: 0 Ca2+를 사용하는 배스 용액에서 0Ca2+를 사용하여 내적으로 정류K+ 채널을 연구합니다.) 표 2는 잠재적으로 오염된 전류 공급원의 예시 솔루션 레시피) 및/또는 약리학적 억제를 나타낸다.
결과
현미경 스테이지(상부 패널)에서 MPP 유동 챔버의 상이한 뷰를 보여주는 여러 장의 사진과 MPP 유동 챔버(하단 패널)의 개략적 표현이 도1에 도시되어 있다. 회로도는 전체 장치 및 유량 챔버의 치수를 자세히 설명합니다. 도 2는 당사의 실험실(상부 패널)에서 MPP 유동 챔버에 대한 중력 관류 시스템의 사진을 나타낸다. 또한 유량 시스템(bottom panel)의 개략적 표현은 용액의 러시로부터 용액의 러시로부터 용액의 진공 제거의 힘으로부터 유동 챔버 내의 세포를 분리하는 단계를 강조하기 위한 것이다.
메카노감응성 이온 채널의 특징은 기계적 자극 3,6,7의중단시 기준선 수준으로 갑작스럽게 복귀하는 것입니다. 도 3은 새로 단리된 내피 세포로부터 Kir 전류의 전기생리학적 기록 동안 전단 응력 자극을 제거하면 정적 욕조에서 처음 에 기록된 기준선 전류로 복귀되는 것을 예로 나타낸다. MPP 챔버로의 흐름을 정지한 후 기준선 전류 레벨로의 복귀는 유동 중단 후 10초 이내에 발생했습니다.
전체 세포 (WC) 전기 생리학적 기록, 특히 갓 분리 된 세포에서 가져온 기록은 종종 채널 활동을 가릴 수있는 명백한 누출 배경 전류를 가지고 있습니다. 내부적으로 정류하는 K+ 채널 패밀리와 같은 일부 이온 채널에는 보다 정확한 분석을 위해 누출 배경 전류를 빼는 생물 물리학적 특성이 있습니다. 도 4는 원시 데이터로부터의 과정을 예로 나타내며(도4A)선형 외측 누설(도4B)을계산하고 플롯하여 최종, 유출된 대표자 추적(도4C)을나타낸다. 그림4에 첨부된 범례에서 원시 천공 WC 패치 기록에서 누출을 계산하고 빼기 위한 자세한 설명을 참조하십시오.

그림 1: MPP 유동 챔버 및 상세한 회로도. 조립된 MPP 유량챔버(상부 패널)의 사진은 세 가지 다른 관점에서 현미경 스테이지상에 챔버를 보여준다: 실험 중에 본 면(왼쪽), 관류 입구(가운데), 그리고 진공 배출구(오른쪽)에서 볼 수 없는 측면 사진. 흐름 방향은 각각에 레이블이 지정됩니다. 접지 선은 90° 각도로 구부러지면 2mm 슬릿 중 하나에 쉽게 들어갈 수 있습니다. 상세한 회로도(아래)는 장치의 복제를 위한 정확한 치수를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 중력 관류 시스템. 우리의 실험실에 있는 중력 관류 시스템의 표지된 사진은 상부 패널에 표시됩니다. 2단계 MPP 유동 챔버와 중력 관류 시스템은 하단 패널에 자세히 설명되어 있습니다. 세포와 2개의 상부 및 하부 저장소를 포함하는 유동 챔버의 분리가 강조된다. 1단계는 용액이 B조의 상부 저장소에서 세포가 시드되는 챔버의 조각 D로 흐르도록 합니다. 2 단계는 솔루션이 아래 저장소에 조각 D에서 아래로 흐를 수 있습니다, 조각 F. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: Kir 채널의 전단 유발 전류 활성화의 대표적인 트레이스및 유동 제거 시 기준 전류 레벨로 돌아갑니다. 이온 채널의 기계적 활성화에 대한 좋은 긍정적 인 대조는 기계적 자극의 중단시 정적 욕조에서 처음에 관찰 된 기준선 전류 수준으로의 복귀입니다. 내부 정류 K+ (Kir) 채널 전류는 중력 용액이 MPP 유동 챔버로 흐를 수 있을 때 전단 응력에 의해 몇 초 이내에 활성화됩니다. 챔버로의 흐름이 중단되면 Kir 전류는 유동 전에 관찰된 기준선 정적 레벨로 빠르게 돌아갑니다. -140 mV ~ +40 mV의 경사로는 400 ms. 배스 용액이 60 mM K +를 포함하고 반전 전위는 ~-20 mV이었다. 대표적인 흔적은 마우스 방간막 동맥으로부터 신선하게 분리된 내피 세포로부터 생성되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
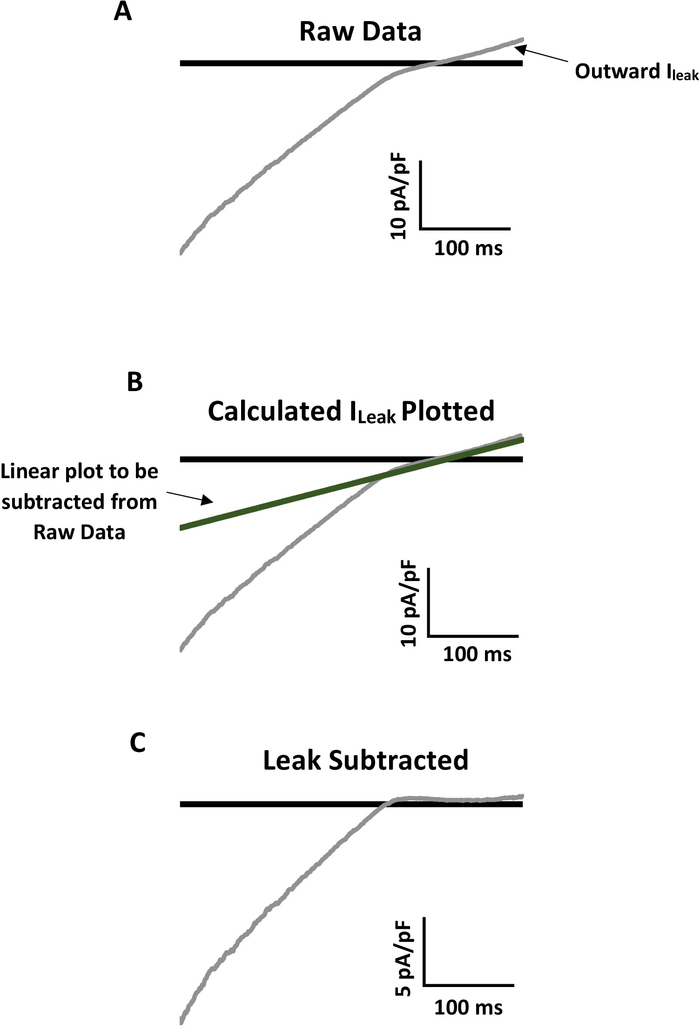
그림 4: 메카노액티브 Kir 전류의 정확한 분석을 위한 누출 감산의 예. (A) 주요 마우스장간담막 내피 세포로부터 의 Kir current의 대표적인 원시 기록(I누설)을현리선형으로 외형 누설 전류를 가진다. -140 mV ~ +40 mV의 경사로는 400 ms. 배스 용액이 60 mM K +를 포함하고 반전 전위는 ~-20 mV이었다. (B)누출은 실제 Kir 채널 활동의 분석을 방지합니다. 나는 누출을빼기 위해 먼저 I누수의 선형 경사전도도를 계산합니다 (G기울기 = (I a -I b)/(Va-V b)). G 경사에 전체 원시 트레이스의 해당 전압을 곱하여 원시 데이터에누출을 플롯합니다. 선은 바깥쪽 선형 누수에 정확히 오버레이해야 합니다. (C) 선형 외부 전류가 ~0 pA/pF이고 실제 Kir 전류가 분석될 수 있도록 전체 트레이스로부터 플롯된 I누수를 뺍니다. 패널 C에서 안쪽 Kir 전류가 패널 A의 원래 원시 데이터 추적의 약 절반임을 확인합니다.
| 높이(mm) | 너비(mm) | 길이(mm) | 추가 정보 | ||
| 조각 A | 8개 | 80 | 98세 | 입구 관류 튜브용 직경 3mm 구멍(재료 표참조) 및 중간 조각 및 셀에 접근할 수 있는 53mm x 60mm 직사각형 공간이 포함되어 있습니다. | |
| 조각 B | 1개 | 80 | 98세 | 피스 A의 관류 구멍 아래에 공간(20mm 대각선)과 세포에 접근할 수 있는 3개의 2mm x 17mm 슬릿이 포함되어 있습니다. | |
| 피스 C | 1개 | 80 | 98세 | 실리콘 탄성 중합체 용액을 사용하여 피스 D가 부착되는 22mm x 50mm 공간이 포함되어 있습니다(재료 표참조) | |
| 피스 D | 0.16 | 24세 | 40 | 유량 챔버의 직사각형 유리 슬라이드 바닥 | |
| 피스 E | 5개 | 80 | 120개 | 45mm x 50mm 공간을 통해 피스 D에서 셀을 시각화할 수 있습니다. 접착할 저수지 진공 배출구인 피스 F를 위해 20mm x 45mm 공간이 있습니다. | |
| 피스 F | 0.16 | 24세 | 50개 | 진공 출구 저장소의 직사각형 유리 슬라이드 바닥 | |
| 조립된 MPP | 15세 | 80 | 120개 | 유량 챔버는 잘 정의된 층전단의 중단을 방지하기 위해 2단계로 유입 관류 및 출구 진공으로부터 분리됩니다. | |
| 조립된 MPP의 흐름 챔버 | 1개 | 22세 | 42세 | 조각 D는 유량 챔버의 유리 슬라이드 바닥입니다. | |
표 1: MPP의 치수(조립 및 분해) 및 장치의 각 부분에 특정한 추가 정보.
| 솔루션 | 레시피 (mM) | Ph | ||
| 분리 | 55 NaCl, 80 Na-글루타민산염, 6 KCl, 2 MgCl2, 0.1 CaCl2,10 포도당, 10 HEPES | 7.3 | ||
| (셀 격리) | ||||
| 목욕 (전기 생리학) | 80 NaCl, 60 KCl,1 MgCl 2, 2 CaCl2,10 포도당, 10 HEPES | 7.4 | ||
| 파이펫 (전기 생리학) | 5 NaCl, 135 KCl, 5 EGTA, 1 MgCl2,5 포도당, 10 HEPES | 7.2 | ||
표 2: 실험에 사용된 레시피가 있는 솔루션의 예입니다.
| 내피 세포 격리 프로토콜 | 참조 | |
| 중성 프로테아제와 엘라스타제 칵테일(각각 0.5 mg/mL, 37°C에서 1시간) 다음에 콜라게나아제 타입 I(0.5 mg/mL; 2.5분) | 6,7 | |
| 내림차순 흉부 대흉의 내벽에 위치한 5cm2 영역의 부드러운 기계적 긁힘 | 11세 | |
| Na | 17세 | |
| Na | 3개 | |
| 콜라게나아제 타입 IA(1 mg/mL) 37°C에서 14분 | 8개 | |
표 3: 전기 생리학 기술을 사용하여 메카노민감성 이온 채널을 연구하는 방법론.
토론
혈관 계통은 지속적으로 활성 혈역학적 힘에 노출되어, 이는 메카노민성 이온 채널3,22를 활성화하지만 전단 스트레스 유발 메카노 트랜스덕션에서 이러한 채널의 생리적 역할은 단지 등장하기시작 4,6,8. 전단 응력 활성화 채널의 메카노민성을 담당하는 메커니즘은 아직 알려지지 않았습니다. 여기서 상세한 프로토콜은 실시간으로 층단 전단 응력에 노출된 메카노민성 이온 채널에 대한 직접 조사 방법을 설명합니다.
이 프로토콜의 중요하고 필수적인 단계는 전기 생리학적 파이펫이 챔버로 하강되고 흐름 하에 셀에 접근할 수 있도록 좁은 개구부를 가지고 있는 변형된 병렬 플레이트 플로우 챔버를 사용하는 것입니다. 이 장치의 일반적인 원리는 개구부가 충분히 좁은 경우, 생리 전단 응력(최대 15 dyn / cm2)은 표면 장력력 10으로인한 용액 오버플로우없이 달성 될 수 있다는 것입니다. 이러한 실험을 성공적으로 수행하기 위해서는, 중요하다: (i) 개구부 바로 아래에 있는 바닥판의 영역에서 종자 세포; (ii) 흐름의 개시 전에 또는 매우 느린 동안 기가 - 옴 씰을 설정 (&0.01 dyn / cm2) 배경 흐름; (iii) 흐름을 강화하면서 안정적인 씰을 유지한다. 당사의 실험실에서 사용되는 4피스 아크릴 장치의 치수는 상세한 회로도와함께 제공된다 (그림 1) MPP 유동 챔버 및 유량 시스템 (그림2)모든 실험실 조사에서 사용하기 위해 복제 할 수 있도록 메카노에 민감성 이온 채널. 이러한 치수는 또한 셀에 의해 시드된 영역을 증가시키고 유량과 전단 응력 사이의 관계를 변경하는 유채널의 높이를 변경하도록 수정될 수 있습니다. 유량 챔버의 높이가 감소하면 동일한 유량에 대해 더 높은 전단 응력이 발생하며, 이는 더 높은 전단 응력을 달성하는 데 도움이 될 수 있습니다. 챔버는 또한 재순환 교란된 흐름(23)의 국부 영역을유도하는 유동 분리 장벽을 포함하도록 변형될 수 있다.
MPP 유동 챔버를 사용하는 주요 이점은 (1) 혈관 조직으로부터 신선하게 분리된 배양 및 세포내 내피 세포로부터의 전단 활성화 이온 채널의 실시간 조사, (2) 세포의 노출 및 메카노민성 이온의 반응을 포함한다. 전단 응력의 생리학적으로 관련된 수준으로 채널, (3) 실험을위한 관류 옵션으로 쉽게 조립 및 분해. 다른 기존 방법에 대하여, 잘 정의된 전단 응력 하에서 전기 생리학적 기록을 수행할 수 있는 유일한 다른 방법은 모세관 말단 내부의 세포를 파종하고 기록 피펫을 모세관 개구부로 삽입하는 것입니다. 초기 연구에서 수행되었다3,22. 그러나, 모세혈관으로 세포를 파종의 어려움, 파이펫이 도달할 수 있도록 모세관 끝에 충분히 근접한 매우 적은 수의 세포에 접근하는 등의 방법에 비해 여러 가지 단점이 있으며, 흐름 채널의 끝에 흐름 장애 (이 경우 모세관). 이러한 각각의 단점은 모세관 개구부에서 배양된 세포의 흐름 하에서 전기생리학을 수행하기 어렵게 만들고 혈관구조로부터 신선하게 분리된 종자 세포를 패치하거나 심지어 종자 세포에 담는 것은 사실상 불가능합니다. 방해된 흐름 영역을 생성하는 단계를 도입하는 것도 불가능합니다. 세포17,18에 직접 오픈 챔버24,25 또는 퍼핑 솔루션을 사용하는 다른 모든 기존 방법은 혈관내혈역학 환경을 모방하지 않는다.
이 방법의 주요 제한사항은, 그러나, 생리적인 범위의 상부에 전단 응력달성을 위한 제약이다. 특히, 생리전단 스트레스 수준은 건강한 동맥26에서최대 70 dyn/cm2에 도달하는 것으로 추정되었다. 대조적으로, 우리가 챔버의 현재 구성에서 달성 할 수있는 가장 높은 전단 응력 수준은 15 dyn / cm2였으며, 그 후 표면 장력력은 개구부(10)에서유출되는 해결책을 방지하기에 충분하지 않게됩니다. 유채널의 높이를 줄이면 더 높은 전단 응력 수준을 달성할 수 있습니다. 높은 전단 응력 하에서 안정적인 기가 옴 씰을 유지하는 것은 또 다른 도전이지만 성공률은 연습에 합리적입니다. 우리는 천공 패치 기술 (위에서 설명한 바와 같이 파이펫 용액에 항생제 암포테리신 B포함)을 사용하여 표준 전체 세포 구성보다 더 안정적인 기록을 산출한다는 것을 발견했습니다. 추가적으로, 사용된 MPP 유량 챔버 및 용액은 동맥내혈류의 전단을 정확하게 복제하지 않는다. 혈액은 우리가 우리의 시험관 내 실험에서 복제하지 않은 점성, 비 뉴턴 유체입니다. 또한, 여기에 사용되는 챔버는 평행 챔버이며 동맥내 전단 응력은 실린더의 전단 용 공식을 사용하여 가장 잘 계산됩니다.
흐름 에서 단일 채널 레코딩을 수행하기 위한 중요한 고려 사항 및 제한 사항이 있습니다. 이 방법은 안정적인 씰을 생성하는 세포 부착 구성 (손상되지 않은 세포의 멤브레인에 부착 된 파이펫)에 적합합니다. 활동이 기록되는 단일 채널은 특히 내부 아웃구성(27)에서기록 피펫에 의해 차폐되기 때문에 전단 응력에 직접 노출되지 않는다는 것을 인식하는 것이 중요합니다. 절제된 멤브레인이 일반적으로 기록 파이펫으로 당겨지므로 잘 정의된 흐름에 노출되지 않기 때문에 이온 채널의 감도를 테스트하는 데 사용할 때 절제된 패치 구성이 가장 신뢰할 수 없다고 생각합니다.
이러한 실험에서 사용될 수 있는 세포의 유형측면에서, 혈관 내피 세포는 전단 스트레스 및 메카노에민성 채널을 연구하는 데 가장 적합한 세포 유형을 나타낸다. 초기 연구는 주로 배양 된 내피세포에 초점을 맞춘 3,28 쉽게 사용할 수 있습니다. 우리는 마우스 저항 동맥6,7에서신선하게 단리된 내피 세포에 이 방법의 사용을 시험하고 확장했습니다. 다른 세포 유형은 확실히 고려되어야한다. 혈관 평활근 세포는, 예를 들어, 내피가 손상되고 제거된 질병 상태 동안 전단 스트레스에 노출될 수 있으며29,30. 이것은 그렇지 않으면 전단 긴장에 의해 영향을 받지 않을 것이다 평활근에 있는 mechanosensitive 채널이 지금 잠재적으로 병리생리학 질병 기계장치에 기여할 것이라는 연구 결과의 흥미로운 지역을 나타냅니다. 더욱이, 관심 있는 채널을 코딩하는 유전자를 가진 HEK 또는 CHO와 같은 비히클 세포주의 형질감염은 MPP 유동 챔버의 사용과 함께 채널의 생체물리학 적 분석을 위한 훌륭한 플랫폼이다.
MPP 플로우 챔버에 대한 원래의 의도는 이온 채널 의 실시간 조사를 위한 것이었지만, 장치의 적용은 이 목표를 넘어 확장될 수 있다는 점에 유의하는 것이 중요하다. 구체적으로, 전단 응력에 반응하여 NO의 방출을 결정하기 위해 산화질소(NO) 센서와 같은 전극 센서를 사용하는 연구에도 동일한 접근법을 사용할 수 있습니다. 따라서 기계적으로 조절되는 생물학적 공정을 실시간으로 조사하는 데 관심이 있는 사람들을 위한 일반화된 방법론을 제공하고 연구하는 사람들을 위한 특정 연구 요구를 충족시키기 위해 MPP 챔버의 추가 수정을 촉진합니다. 다양한 분야의 메카노에민감성 프로세스.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 국립 심장에 의해 투자 되었다, 폐, 혈액 연구소 (R01 HL073965, 일리노이) 그리고 (T32 HL007829-24, ISF). 저자는 또한 우리의 최신 MPP 흐름 챔버를 생성하기위한 시카고 일리노이 대학의 과학 기계 가게를 인정하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.2 µm sterile syringe filters | VWR | 28145-501 | Used for filtering electrophysiolgoical pipette solution |
| 5 grade forceps | Fine Scientific Tools | 1252-30 | Used for transferring digested arteries to fresh solution |
| 9" Pasteur Pipet | Fisher Scientifc | 13-678-20D | Used for mechanically disrupting digested arteries and transferring freshly isolated endohtelial cells |
| 12 mm diameter Cover glass circles | Fisher Scientifc | 12-545-80 | For use with studies involving cultured cells and multiple treatments. Cells adhered to the cover glass are used for patch clamp analyses |
| 24 mm x 40 mm Rectangluar Cover glass | Sigma-Aldrich | CLS2975224 | Cover glass to be added to MPP flow chamber pieces C (Figure 1) |
| 24 mm x 50 mm Rectangular Cover glass | Sigma-Aldrich | CLS2975245 | Cover glass to be added to MPP flow chamber E (Figure 1) |
| 20 G syringe needles | Becton Dickinson and Co | 305175 | For use in mechanical disruption of digested mesenteric arteries |
| 35 mm Petri dish | Genesee Scientific | 32-103 | For use in mechanical disruption of digested mesenteric arteries |
| Amphotericin B solubilized | Sigma-Aldrich | A9528-50MG | Used for generating the perforated whole-cell patch configuration. |
| Collagenase, type I | Worthington Biochemical | 100 mg - LS004194 | Enzyme used in our laboratory as a brief digestion following the initial cocktail of neutral protease and elastase |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientifc | 67-68-5 | Solvent for Amphotericin B used in perforated whole-cell patch clamp |
| Elastase, lyophilized | Worthington Biochemical | 25 mg - LS002290 | Enzyme used in our laboratory in a cocktail with neutral protease/dispase to begin digestion of arteries for endothelial cell isolation. |
| Falcon Tissue culture Plate, 6-well, Flat Bottom with Low Evaporation Lid | Corning | 353046 | For use with studies involving cultured cells and multiple treatments |
| Neutral protease/dispase | Worthington Biochemical | 10 mg- LS02100 50 mg - LS02104 | Enzyme used in our laboratory in a cocktail with elastase to begin digestion of arteries for endothelial cell isolation |
| SylGard | World Precision Instruments | SYLG184 | Silicone elastomer for adhering the rectangular cover slip to the MPP flow chamber pieces C and E (Figure 1) |
| Tygon ND 10-80 tubing | Microbore Tubing | AAQ04133 | ID: 0.05 in, OD: 0.09 in, inlet perfusion tubing for adminsitering flow to the chamber |
참고문헌
- Green, D. J., Hopman, M. T., Padilla, J., Laughlin, M. H., Thijssen, D. H. Vascular Adaptation to Exercise in Humans: Role of Hemodynamic Stimuli. Physiological Reviews. 97 (2), 495-528 (2017).
- Gimbrone, M. A. Jr, Topper, J. N., Nagel, T., Anderson, K. R., Garcia-Cardena, G. Endothelial dysfunction, hemodynamic forces, and atherogenesis. Annals of the New York Academy of Sciences. 902, discussion 239-240 230-239 (2000).
- Olesen, S. P., Clapham, D. E., Davies, P. F. Haemodynamic shear stress activates a K+ current in vascular endothelial cells. Nature. 331 (6152), 168-170 (1988).
- Barakat, A. I., Lieu, D. K., Gojova, A. Secrets of the code: do vascular endothelial cells use ion channels to decipher complex flow signals? Biomaterials. 27 (5), 671-678 (2006).
- Beech, D. J. Endothelial Piezo1 channels as sensors of exercise. Journal of Physiology. 596 (6), 979-984 (2018).
- Ahn, S. J., et al. Inwardly rectifying K(+) channels are major contributors to flow-induced vasodilatation in resistance arteries. Journal of Physiology. 595 (7), 2339-2364 (2017).
- Fancher, I. S., et al. Hypercholesterolemia-Induced Loss of Flow-Induced Vasodilation and Lesion Formation in Apolipoprotein E-Deficient Mice Critically Depend on Inwardly Rectifying K(+) Channels. Journal of the American Heart Association. 7 (5), (2018).
- Rode, B., et al. Piezo1 channels sense whole body physical activity to reset cardiovascular homeostasis and enhance performance. Nature Communications. 8 (1), 350(2017).
- Li, J., et al. Piezo1 integration of vascular architecture with physiological force. Nature. 515 (7526), 279-282 (2014).
- Levitan, I., Helmke, B. P., Davies, P. F. A chamber to permit invasive manipulation of adherent cells in laminar flow with minimal disturbance of the flow field. Annals of Biomed Engineering. 28 (10), 1184-1193 (2000).
- Fang, Y., et al. Hypercholesterolemia suppresses inwardly rectifying K+ channels in aortic endothelium in vitro and in vivo. Circulation Research. 98 (8), 1064-1071 (2006).
- Shetty, S., Weston, C. J., Adams, D. H., Lalor, P. F. A flow adhesion assay to study leucocyte recruitment to human hepatic sinusoidal endothelium under conditions of shear stress. Journal of Visualized Experiments. (85), e51330(2014).
- Man, H. S. J., et al. Gene Expression Analysis of Endothelial Cells Exposed to Shear Stress Using Multiple Parallel-plate Flow Chambers. Journal of Visualized Experiments. (140), e58478(2018).
- White, L. A., et al. The Assembly and Application of 'Shear Rings': A Novel Endothelial Model for Orbital, Unidirectional and Periodic Fluid Flow and Shear Stress. Journal of Visualized Experiments. (116), e54632(2016).
- Franzoni, M., et al. Design of a cone-and-plate device for controlled realistic shear stress stimulation on endothelial cell monolayers. Cytotechnology. 68 (5), 1885-1896 (2016).
- Dewey, C. F. Jr, Bussolari, S. R., Gimbrone, M. A. Jr, Davies, P. F. The dynamic response of vascular endothelial cells to fluid shear stress. Journal of Biomechanical Engineering. 103 (3), 177-185 (1981).
- Hoger, J. H., Ilyin, V. I., Forsyth, S., Hoger, A. Shear stress regulates the endothelial Kir2.1 ion channel. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7780-7785 (2002).
- Moccia, F., Villa, A., Tanzi, F. Flow-activated Na(+)and K(+)Current in cardiac microvascular endothelial cells. Journal of Molecular and Cellular Cardiology. 32 (8), 1589-1593 (2000).
- Crane, G. J., Walker, S. D., Dora, K. A., Garland, C. J. Evidence for a differential cellular distribution of inward rectifier K channels in the rat isolated mesenteric artery. Journal of Vascular Research. 40 (2), 159-168 (2003).
- Hannah, R. M., Dunn, K. M., Bonev, A. D., Nelson, M. T. Endothelial SK(Ca) and IK(Ca) channels regulate brain parenchymal arteriolar diameter and cortical cerebral blood flow. Journal of Cereberal Blood Flow and Metabolism. 31 (5), 1175-1186 (2011).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of Visualized Experiments. (59), e3349(2012).
- Lieu, D. K., Pappone, P. A., Barakat, A. I. Differential membrane potential and ion current responses to different types of shear stress in vascular endothelial cells. American Journal of Physiology-Cell Physiology. 286 (6), C1367-C1375 (2004).
- Le Master, E., et al. Proatherogenic Flow Increases Endothelial Stiffness via Enhanced CD36-Mediated Uptake of Oxidized Low-Density Lipoproteins. Arteriosclerosis, Thrombosis, and Vascular Biology. 38 (1), 64-75 (2018).
- Kim, J. G., et al. Measurement of Ion Concentration in the Unstirred Boundary Layer with Open Patch-Clamp Pipette: Implications in Control of Ion Channels by Fluid Flow. Journal of Visualized Experiments. (143), e58228(2019).
- Kim, J. G., et al. Fluid flow facilitates inward rectifier K(+) current by convectively restoring [K(+)] at the cell membrane surface. Scientific Reports. 6, 39585(2016).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. Journal of the American Medical Association. 282 (21), 2035-2042 (1999).
- Jacobs, E. R., et al. Shear activated channels in cell-attached patches of cultured bovine aortic endothelial cells. Pflugers Archiv. European Journal of Physiology. 431 (1), 129-131 (1995).
- Barakat, A. I., Leaver, E. V., Pappone, P. A., Davies, P. F. A flow-activated chloride-selective membrane current in vascular endothelial cells. Circulation Research. 85 (9), 820-828 (1999).
- Fitzgerald, T. N., et al. Laminar shear stress stimulates vascular smooth muscle cell apoptosis via the Akt pathway. Journal of Cellular Physiology. 216 (2), 389-395 (2008).
- Ueba, H., Kawakami, M., Yaginuma, T. Shear stress as an inhibitor of vascular smooth muscle cell proliferation. Role of transforming growth factor-beta 1 and tissue-type plasminogen activator. Arteriosclerosis, Thrombosis, and Vascular Biology. 17 (8), 1512-1516 (1997).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유