Method Article
明確に定義されたせん断応力下の単一細胞イオン電流の電気生理学的記録
要約
このプロトコルの目的は、せん断応力によるメカノ感受性イオンチャネルのリアルタイム活性化を調査する上で使用する改変並列プレートフローチャンバを記述することです。
要約
流体せん断応力は、内皮機能において大きな役割を果たすることがよく知られている。ほとんどの血管床では、血流の急激な増加によるせん断ストレスの上昇は、血管拡張を引き起こし、それによって血管壁の機械的ストレスを緩和するシグナル伝達カスケードを引き起こす。せん断ストレスのパターンは、層せん断ストレスがアテローム保護および乱れたせん断ストレスがプロアトロジェニックであるアテローム性動脈硬化症の発症の重要な要因であることもよく知られている。様々な中間細胞シグナル伝達経路を詳しく理解していますが、最初に機械的刺激を化学メディエーターに変換する受容体は完全には理解されていません。メカノ感受性イオンチャネルは、せん断に対する応答に不可欠であり、それによって血管活性メディエーターの産生を制御するせん断誘発細胞シグナル伝達を調節する。これらのチャネルは、せん断する最も初期の活性化シグナル伝達成分の一部であり、一酸化窒素産生を促進することによりせん断誘発性血管拡張にリンクされている(例えば、内側に整流K +[Kir]および一過性受容体電位[TRP]チャネル)および内皮過分極因子(例えば、Kirおよびカルシウム活性化K+[KCa]チャネル)およびピエゾチャネルを含む未決定のメカニズムを介してせん断誘発血管収縮。これらのチャネルがせん断力(すなわち、直接または一次メカノ受容体を介して)によって活性化される生物物理学的メカニズムを理解することは、内皮機能障害に関連する病態生理学を解決するための潜在的な新しい標的を提供する可能性があるそしてアテロジェネシス。電気生理学を用いて、イオンチャネルの流れ誘発活性化をリアルタイムで記録することは、依然として大きな課題です。円盤とプレートレオメータや閉じた平行プレートフローチャンバなど、明確に定義されたせん断応力に細胞をさらす標準的な方法では、イオンチャネル活性化のリアルタイム調査はできません。このプロトコルの目的は、明確に定義されたせん断応力の下でメカノセンシティブイオンチャネルのリアルタイム電気生理学的記録を可能にする修正された並列プレートフローチャンバを記述することです。
概要
血流によって発生する血行力は、内皮および血管機能1、2において主要な役割を果たすることがよく知られている。また、いくつかのタイプのイオンチャネルがせん断応力3、4、5の変化に鋭く反応し、イオンチャネルが一次せん断応力センサになりうするという仮説を導くこともよく知られている。最近では、我々と他の人は、メカノ感受性イオンチャネルがせん断ストレス6、7、8に対する血管活性応答を含むいくつかのせん断ストレス感受性血管機能において重要な役割を果たすことを示した。、および発達血管新生9.しかし、イオンチャネルのせん断応力感受性のメカニズムはほとんど全く知られていない。この知識のギャップは、明確に定義されたせん断応力の下で電気生理学的記録を行うことの技術的な困難に起因する可能性が高い。したがって、この記事では、この目標6、7、10、11を達成するためにラボで日常的に実行される詳細なプロトコルを段階的に提供します。
この方法の全体的な目標は、生理学的範囲で明確に定義されたせん断ストレスの下でイオンチャネルメカノ活性化のリアルタイム調査を可能にすることです。これは、標準的な並列プレートフローチャンバを変更して、電気生理学的ピペットをチャンバ内に下げ、リアルタイムの流量の間に底板上で成長した細胞にアクセスできるようにすることで達成され、これを達成するためのユニークなアプローチを提供します。ゴール6,7,11.対照的に、以前の出版物に記載されている標準的な並列板流れ室は、せん断力12または他の非侵襲的アプローチ13、14に曝露された細胞のリアルタイムイメージング分析に使用することができるが、以下の場合には使用できない。電気 生理 学。同様に、コーン及び板装置は、せん断応力15、16に細胞を露出させる別の強力なアプローチも電気生理学的記録には適していない。したがって、これらの流れ装置は、イオンチャネルのせん断応力感度の調査を可能にしない。流れの下で電気生理学的記録を行うことの難しさは、これらの重要な効果を担当するメカニズムに関する情報の貧弱さの主な理由です。
同じ目標を達成するための代替アプローチに関しては、正確または制御されているものはありません。いくつかの以前の研究は、17、18の上から細胞の近くに持って来た別のピペットから来る液体の流れに細胞を露出することによって、流れの下でイオンチャネル活性を記録しようとしました。これらの条件下で発生する機械的力は、血管内のせん断ストレスの生理学的プロファイルとほとんど共通点を持たないため、これは非常に非生理学的である。同様の懸念は、開いているチャンバーの灌流によって生理的せん断ストレスをシミュレートする試みに適用されます。我々の以前の研究10で詳しく説明したように、開いた液体空気界面は、非生理学的である複数の妨害および再循環を作成する。これらすべての懸念に対処するために、我々は、我々の以前の研究6、7、10、11で「最小限に侵略的な流れ装置」とも呼ばれる修正された平行板(MPP)フローチャンバーを設計しました。アクリルから、私たちの研究室で広く使用されています。しかし、設計の元の説明はほぼ20年前に公開されており、明確に定義されたせん断応力の下で電気生理学的記録を行うことを可能にする唯一のフローデバイスであるという事実にもかかわらず、この方法論は行われていなかった。他のラボで採用され、流れの下で電流を記録しようとする研究はごくわずかです。したがって、MPPフローチャンバーを使用するための詳細な説明を提供することは、メカノ感受性イオンチャネルおよび血管生物学に興味を持っている研究に大きな助けになると信じています。
プロトコル
私たちの研究で動物の使用は、シカゴ動物ケア委員会(#16-183)でイリノイ大学によって承認されています。
1. 修正平行板フローチャンバーの組み立て
注:MPP フローチャンバピースの図1および図 1を参照してください。組み立て用チャンバーピースの向きを詳述した回路図については、図1を参照してください。
- 長方形のカバーガラスに付着するには、ピースD、ピースCの底部に、まず500μLシリコーンエラストマー硬化剤を5mLのシリコーンエラストマーベースに完全に混合してシリコーンエラストマー溶液を作る。
- ピースCの長方形空間の縁の周りにシリコーンエラストマー溶液の薄い層を適用し、長方形のカバーガラス片Dをエラストマー溶液上に静かに配置し、そのピースDがピースCの開いた長方形の空間を完全に覆うようにします。余分なシリコーンエラストマー溶液を慎重に拭き取ります。
- 長方形のカバーガラス、ピースFをピースEの底部に付着させ、シリコーンエラストマー溶液を室温で一晩硬化させる手順1.2を繰り返します。
注:硬化すると、長方形のカバーガラスは、交換する必要がある前に、最大6ヶ月間付着したままになります。 - 底部チャンバピースから始まり、ピースEは、各ピースを順番に前の上に置いてMPPフローチャンバを組み立てます:ピースE(下)、ピースC、ピースB、ピースA(上)。
- 各部分のネジ穴をコーナーに揃え、MPPフローチャンバへの流れを管理しながら漏れが発生しないように、ピースをしっかりとねじ込みます。
2. MPPフローチャンバーへの細胞調製と播種
注:培養した内皮細胞については、手順2.1−2.7に従ってください。マウス腸間膜動脈アーケードから内皮細胞を分離し、新たに単離された内皮細胞を調製するための手順2.8−2.14に詳述された方法に従ってください。
- 6ウェルプレートに、4~5個の12mmカバーガラス円/ウェルとシード細胞を10%~30%の合流性の間に置き、単一の細胞に電気生理学的記録のためにアクセスできるようにします。
- 標準的な培養条件下で細胞をインキュベート(5%CO2、37°C)を2時間以上、細胞が付着し、著者の経験の内皮細胞が24時間を超えると非常に平坦になり、24以上のサブコンフルエンスで播種するとパッチを適用することが困難になります。H。
- 6ウェルプレートのウェルから付着した細胞を含むカバーガラスを取り出し、リン酸緩衝生理食液(PBS)で素早くすすり、MPPフローに移す前に2mL電気生理学的浴液(表2)を含む35mmペトリ皿に移す。室。
- カバーガラス円を長方形のカバーガラスに移し、MPPフローチャンバのピースCに付着したピースDは、細胞が空気にさらされないように十分な溶液がカバーガラス上に留まることを確実にする。カバーガラスの円と細胞が溶液中に完全に沈み込むように、目的の浴液(〜250 μL)を細胞に追加します。
- カバーガラス円を真空貯留部側に最も近い半分に置き、セルがピースBのスリット開口部に沿うように配置します。チャンバーへの流れはカバーガラス円の位置を妨げない。
- ステップ 1.4 および 1.5 に記載されているように、図 1に示すように、適切な順序でピースをねじ込んで MPP フロー チャンバを組み立てます。チャンバーを顕微鏡段階に移し、溶液が吸引用の真空貯留槽に到達するように、すぐに浴液でチャンバーを浸透させる(〜10 mL)。
- 暗い境界線と明らかな核を持つ細胞を識別することにより、実験のための健全な細胞を識別します。ブリーブしているように見えるセルや、他のセルと接触しているセルは避けてください。
注:著者の研究室では、培養中のヒト大動脈内皮細胞および一次マウス腸間膜内皮細胞が用いられる。しかし、特定の研究ニーズに関心のある他のタイプの付着細胞も同じ方法で使用できます。 - 分離液で隔離された動脈アーケードを洗浄する(表2)。アーケードを2mLの温め(37°C)解離液(表2に示す解離液のレシピ)を含む2mL遠心管に移し、中性プロテアーゼ(0.5mg/mL)とエラスターゼ(0.5mg/mL)を含む。10分ごとに穏やかな振盪で37 °Cで1時間インキュベートします。
- 中性プロテアーゼ/エラスターゼ解離液の1 mLを除去し、1mg/mLコラゲナーゼタイプ1を追加します。最終的なコラゲナーゼタイプ1濃度0.5mg/mLの動脈を含む溶液にコラゲナーゼ溶液を戻す。37 °Cで2-3分のインキュベート。
- 5つの等級の鉗子を使用して、すぐに新鮮な、冷やされた解離液の750 μLの滴を含む35のmmの直径のペトリ皿にアーケードを動かす。さらに、2本の20G注射針を用いて組織を解離し、酵素的に消化された動脈から内皮細胞を機械的に解放する。
- 9"使い捨てパスツールガラスピペを使用して、ガラスピペを使用して新しい1.5 mL遠心管に細胞を移す前に、セル溶液を10xトリビュートします。
- 別の750 μLの解離液でペトリ皿を洗い、同じチューブに移します。ガラスピペットを用いて、さらに少なくとも10倍のピペッティングによって細胞を機械的に分散させ、内皮細胞の完全性を損なう可能性のある気泡を導入しないように注意して単一の細胞懸濁液を作成する。
- 内皮細胞懸濁液(約500−1,000細胞)の750 μLを、貯留真空側に最も近い半分のMPP流れ室のピースDに直接加える。内皮細胞が室温で45分から1時間の間に付着するようにします。
- ステップ 1.4 および 1.5 に記載されているように、および図 1に示すように、適切な順序でピースをねじ込んで MPP フロー チャンバを組み立てます。チャンバを顕微鏡段階に移し、溶液が真空吸引(〜10 mL)に達するように、すぐに浴液でチャンバーを浸透させる。その粗く、丸い表現型19、20によってアクセス可能な内皮細胞を同定する。
注:様々な消化方法と酵素カクテルは、異なる動脈床から内皮細胞を分離するために使用されています。メカノ感受性イオンチャネルのパッチクランプ電気生理学のために内皮細胞を単離するために様々な研究者によって使用されているプロトコルの詳細については、表3を参照してください。これらの方法は、MPPフローチャンバと組み合わせて使用するのに適している可能性が高い。
3. せん断活性化メカノ感受性イオンチャネルの電気生理学的記録のためのMPPフローチャンバーへのせん断応力の制御
- MPPの3mm径インレット穴Aへの挿入に適したマイクロボアチューブ(内径:0.05インチ、外径0.09インチ)を装着した3ウェイルアーロックに30mLの等級シリンジシリンダーを接続して重力灌流システムをセットアップ室。
- 両面テープを使用して、電気生理学リグ(図2)を取り囲むファラデーケージの外側の面に、卒業したシリンダーを取り付けます。MPPチャンバーにチューブを挿入する前に、注射器とチューブをバス溶液であらかじめ充填してください(内皮細胞内のK+チャネルを内側に整流するために使用される浴液については表2を参照)。チューブをピースAのMPPフローチャンバー入り穴に挿入します。
- MPPフローチャンバを真空貯留で除去する溶液をあらかじめ充填してください。チャンバーへの流れを停止し、トップマークに卒業したシリンダーを補充します。溶液がチャンバ内を流れ、ストップウォッチを使用して所定のシリンジシリンダ高さでmL/sを計算することにより、手動で流量を計算します。
- シリンジを上げたり下げたりして流れを変え、チャンバー内でせん断し、望ましいレベルのせん断応力が見つかるまでこのプロセスを続けます。
- 次の式21を使用して並列チャンバ内のせん断応力を計算します。
○ 6μQ/h2w
ここで、μ = 流体粘度(g/cm·s)、Q = 流量(mL/s)、平行板チャンバ幅(w = 2.2 cm)および高さ(h = 0.1 cm)。
注:現在の重力灌流システムでは、顕微鏡ステージの上57cmのシリンジシリンダー高さ(シリンダーの上部から測定)で、流量は0.3 mL/sです。このシリンジシリンダーの高さと流量でチャンバーで計算されたせん断は0.7 dyn/cm2です。また、蠕動ポンプなどの他の灌流システムは、MPPフローチャンバへの流れを制御するために使用することができることに留意すべきである。しかしながら、これらのデバイスは、流れの下での電気生理学的測定の望ましくない乱流を追加し、影響を与える可能性があるため、ここで説明する重力灌流システムを使用することをお勧めします。 - 付着した細胞を含む組み立てチャンバを電気生理学リグの顕微鏡段階に移し、あらかじめ入れた浴液で満たされたチューブをピースAの穴に挿入し、同時にチャンバーを充填し、10mLのバス溶液で細胞を洗浄します。溶液がチャンバーに流れ込むように3ウェイルアーロックを回します。
- 所望のパッチ構成が正常に得られると、チャネル電流は室温で静電気浴中で安定させることができます。電流が安定したら、せん断を段階的に適用し、せん断応力の次のステップ増加の前に電流の増加を安定させます。
注:著者らは、内皮細胞におけるメカノ活性化イオンチャネルを研究する際に、穿こパッチ構成で最も成功を収めた。穿止した全細胞パッチ構成を行うには、ジメチルスルホキシド(DMSO)に60mg/mLストックアンホテリシンBの5 μLを0.2μmの無菌濾過ピペット溶液の1mLに加えます。細胞付属構成でギガオームシールを生成した後、2〜5分以内に穿止された全細胞パッチが形成される。 - チャンバーへの流れを停止することにより、細胞へのせん断暴露を除去し、メカノ感受性チャネル電流が静電気浴で観察されるベースライン電流に戻ることを可能にする。
- 溶液価を変化させることによって目的のメカノ感受性イオンチャネル電流を分離する(例えば、60 mM K+をピペット溶液中の0 Ca2+を有する浴液中の60 mM K+を含む)。表2は、現在の供給源を汚染する可能性のある溶液レシピ)および/または薬理学的阻害の例を示す。
結果
顕微鏡ステージ上のMPPフローチャンバーの異なるビューを示す複数の写真(上パネル)とMPPフローチャンバー(下パネル)の概略表現を図1に示す。回路図は、デバイス全体とフローチャンバの寸法を詳細にします。図2は、当研究室(上パネル)におけるMPP流れ室への重力灌流システムの写真を示す。また、灌流システムからの溶液のラッシュから、および溶液の真空除去の力からフローチャンバー内の細胞を分離するステップを強調することを意図したフローシステム(下部パネル)の概略表現も示す。
メカノ感受性イオンチャネルの特徴は、機械的刺激3、6、7の停止時にベースラインレベルに突然戻る。図3は、新たに単離された内皮細胞からKir電流の電気生理学的記録中にせん断応力刺激を除去し、最初に静電気浴場で記録されたベースライン電流に戻ることを示す例として示す。MPPチャンバーへの流れを停止した後のベースライン電流レベルへの復帰は、フロー停止の10秒以内に起こった。
全細胞(WC)電気生理学的記録、特に新たに単離された細胞から採取されたものは、しばしばチャネル活性をマスクできる明らかな漏出バックグラウンド電流を有する。内部的に整流する K+チャネル ファミリのような一部のイオン チャネルには、より正確な分析のためにリークバックグラウンド電流を減算できる生物物理特性があります。図4は、生データ(図4A)から計算およびプロットされた線形外向きリーク(図4B)から最終、リーク減算代表トレース(図4C)までのプロセスを例として示す。付属の凡例の未加工の WC パッチ記録からリークを計算および減算する詳細な説明を図4に参照してください。

図1:MPPフローチャンバと詳細な回路図。組み立てられたMPPフローチャンバ(上のパネル)の写真は、実験中に見た側(左)、灌流入口(中央)、真空出口(右)の3つの異なる視点から顕微鏡ステージ上のチャンバーを示しています。写真。流れの方向はそれぞれにラベルが付けられます。アース線は、90°の角度で曲げた場合、2mmスリットのいずれかに簡単に収まることに注意してください。詳細な回路図(下)は、装置の複製のための正確な寸法を示す。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:重力灌流システム。私たちの研究室の重力灌流システムのラベル付き写真は、上部パネルに示されています。2ステップMPPの流れの部屋および重力の灌流システムは底パネルで詳しく説明される。細胞および2つの上下の貯留部を含む流れ室の分離が強調表示される。ステップ1は、細胞が播種されるチャンバのピースDにピースBの上部貯留部から溶液を流すことを可能にする。ステップ2では、溶液がピースDから下部のリザーバに流れ込むことが可能で、ピースF.ここをクリックして、この図のより大きなバージョンを表示してください。

図3:Kirチャネルのせん断誘発電流活性化の代表的な痕跡と、流れの除去時にベースライン電流レベルに戻る。イオンチャネルのメカノ活性化のための良好な正の制御は、機械的刺激の停止時に静電気浴で最初に観察されるベースライン電流レベルへの復帰である。内側に整流K+(Kir)チャネル電流は、重力溶液がMPPフローチャンバに流れ込む場合にせん断応力によって数秒以内に活性化される。チャンバーへの流れの停止すると、Kir電流は流れの前に観察されたベースライン静的レベルにすぐに戻ります。400ミリ秒以上のパッチに-140 mV~+40mVのランプを塗布し、浴液には60mM K+を含み、反転電位は~-20mVであった。代表的な痕跡は、マウス腸間膜動脈から新たに単離された内皮細胞から生成された。この図のより大きなバージョンを表示するには、ここをクリックしてください。
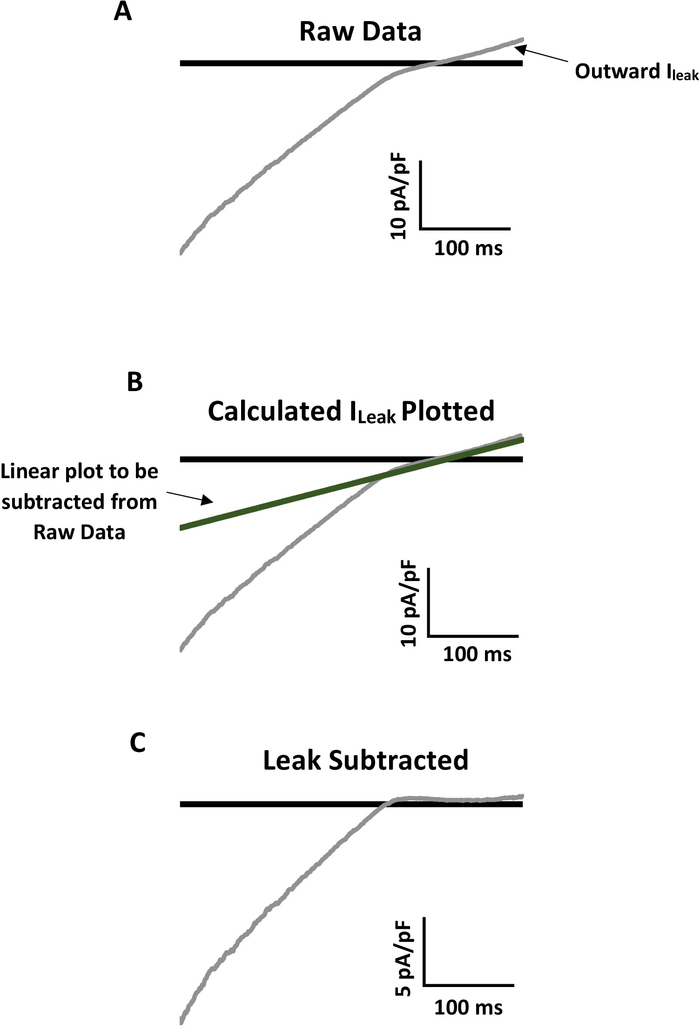
図4:メカノアクティブキル電流の正確な分析のためのリーク減算の例。(A) 顕著な線形外側リーク電流を有する一次マウス腸間膜内皮細胞からのKir電流の代表的な生記録(Iリーク)。400ミリ秒以上のパッチに-140 mV~+40mVのランプを塗布し、浴液には60mM K+を含み、反転電位は~-20mVであった。(B)実際のKirチャネル活動の分析を防止するリークを行います。リークを減算するには、まずリークの線勾配導度を計算します(G傾斜= (Ia-I b)/(V a-Vb))。生のトレース全体の対応する電圧でG傾斜を乗算して、生データにリークをプロットします。ラインは、外側の線形リークを正確にオーバーレイする必要があります。(C) プロットされたIリークをトレース全体から引き出して、線形外流が~0 pA/pFになり、実際のKir電流を解析できるようにします。パネル C では、内側の Kir 電流がパネル A の元の生データ トレースの約半分であることを示す注意事項は、この図の大きなバージョンを表示するにはここをクリックしてください。
| 高さ (mm) | 幅 (mm) | 長さ (mm) | 追加情報 | ||
| ピースA | 8 | 80歳 | 98歳 | 入液灌流管用の直径3mmの穴(材料の表を参照)と中間片および細胞へのアクセスのための53のmm x 60 mmの長方形のスペースが含まれている | |
| ピースB | 1 | 80歳 | 98歳 | ピースAの灌流穴の下にスペース(20mm対角線)とセルにアクセスするための3つの2mm x 17 mmスリットを含んでいます | |
| ピースC | 1 | 80歳 | 98歳 | シリコーンエラストマー溶液を使用してピースDが付着する22 mm x 50 mm のスペースを含んでいます (材料の表を参照) | |
| ピース D | 0.16分 | 24歳 | 40歳 | 流れ室の長方形のガラススライドの底部 | |
| ピース E | 5 | 80歳 | 120の | ピースD上のセルの視覚化を可能にする45のmm x 50のmmスペースが含まれています。20 mm x 45 mm のスペースは、密着するリザーバの真空出口、ピース F に存在します。 | |
| ピース F | 0.16分 | 24歳 | 50歳 | 真空出口の貯蔵所の長方形のガラススライドの底部 | |
| 組み立て済み MPP | 15歳 | 80歳 | 120の | 流れ部屋は、明確に定義された層せん断の破壊を避けるために2つのステップによって入口の灌流および出口の真空から分離される | |
| 組み立てMPPのフローチャンバー | 1 | 22歳 | 42歳 | ピースDは、フローチャンバのガラススライド底部である | |
表 1: MPP の寸法 (組み立ておよび分解) と、デバイスの各部分に固有の追加情報。
| ソリューション | レシピ (mM) | 博士 | ||
| 解離 | 55 NaCl, 80 ナグルタミン酸, 6 KCl, 2 MgCl2,0.1 CaCl2,10 ブドウ糖, 10 HEPES | 7.3年 | ||
| (セル分離) | ||||
| 風呂(電気生理学) | 80 NaCl, 60 KCl,1 MgCl 2, 2 CaCl2, 10 ブドウ糖, 10 HEPES | 7.4年 | ||
| ピペット(電気生理学) | 5 NaCl, 135 KCl, 5 EGTA, 1 MgCl2,5 ブドウ糖, 10 HEPES | 7.2年 | ||
表2:実験で使用されるレシピを用いる解決策の例。
| 内皮細胞分離プロトコル | 参照 | |
| 中性プロテアーゼとエラスターゼのカクテル(各0.5mg/mL、37°Cで1時間)、続いてコラゲナーゼタイプI(0.5mg/mL;2.5分) | 6,7 | |
| 下降胸部大陸の内壁に位置する5cm2領域の穏やかな機械的スクレイピング | 11歳 | |
| Na | 17歳 | |
| Na | 3 | |
| コラゲナーゼタイプIA(1mg/mL)37°Cで14分間 | 8 | |
表3:電気生理学的手法を用いたメカノ感受性イオンチャネルを研究する方法論。
ディスカッション
血管系は常に活発な血行力にさらされ、メカノ感受性イオンチャネル3、22を活性化するが、せん断ストレス誘発メカノトランスダクションにおけるこれらのチャネルの生理的役割は、唯一の出現し始める 4,6,8.せん断応力活性化チャネルのメカノ感受性を担うメカニズムは未知のままである。ここで詳述されるプロトコルは、層せん断応力に曝露されたメカノ感受性イオンチャネルをリアルタイムで直接調査する方法について説明する。
このプロトコルの重要かつ本質的なステップは、電気生理学的ピペットがチャンバーに下げられ、流れの下で細胞にアクセスすることを可能にする狭い開口部を有する変更された平行板の流れチャンバの使用である。この装置の一般的な原理は、開口部が十分に狭い場合、生理的せん断応力(最大15dyn/cm2)が表面張力10による溶液オーバーフローなしで達成する可能性があることです。これらの実験を正常に行うためには、(i)開口部の真下にある底板の領域に細胞を種をまうことが重要です。(ii) 流れの開始前、または非常に遅い(<0.01 dyn/cm 2)バックグラウンドフローの前にギガオームシールを確立します。(iii)流れをステップアップしながら安定したシールを維持する。当研究室で使用される4ピースアクリル装置の寸法は、MPPフローチャンバーおよびフローシステム(図2)が調査中の任意の実験室で使用するために複製できるように、詳細な回路図(図1)と共に提供されます。メカノセンシティブイオンチャネル。これらの寸法は、セルによってシードされた領域を増やし、流路の高さを変更するように変更することもできます。流れチャンバの高さの減少は、同じ流量に対して高いせん断応力をもたらし、より高いせん断応力を達成するために有益である可能性があります。チャンバはまた、再循環乱流23の局所領域を誘導する流れ分離障壁を含むように改変することができる。
MPPフローチャンバーを使用する主な利点は、(1)血管組織から新たに単離された培養および細胞中の内皮細胞からのせん断活性化イオンチャネルのリアルタイム調査、(2)細胞の曝露およびメカノ感受性イオンの応答である。せん断応力の生理学的に関連するレベルへのチャネル、および(3)実験のための灌流の選択との容易なアセンブリおよび分解。他の既存の方法に関しては、明確に定義されたせん断ストレスの下で電気生理学的記録を行うことを可能にする唯一の他の方法は、毛細血管の端部内の細胞を播種し、キャピラリー開口部に記録ピペットを挿入することである。初期の研究3、22で行われました。しかし、毛細血管に細胞を播種することの難しさ、ピペットがそれらに到達できるようにキャピラリー端に十分に近い非常に少数の細胞へのアクセスなど、ここで説明した方法と比較して複数の欠点があります。流路の終端の流れ乱れ(この場合は毛細血管)。これらの欠点のそれぞれは、毛細血管の開口部で培養された細胞の流れの下で電気生理学を行うことを困難にし、血管系から新たに単離された細胞にパッチを当てたり、種子細胞を縫い付けることは事実上不可能である。また、乱れた流れの領域を生成するステップを導入することも不可能です。開室24、25またはパフ溶液を細胞17、18に直接使用する他のすべての既存の方法は、血管内の血行力学的環境を模倣しない。
しかし、この方法の主な制限は、生理学的範囲のより高いレベルでせん断応力を達成するための制約である。具体的には、生理的せん断応力レベルは、健康な動脈26において最大70dyn/cm2に達すると推定されている。対照的に、チャンバの現在の構成で達成できた最高のせん断応力レベルは15dyn/cm2であり、その後、表面張力が開口部10からこぼれるのを防ぐのに十分な表面張力が得られなかった。流れチャネルの高さを小さくすると、より高いせん断応力レベルを達成できる可能性があります。高いせん断ストレスの下で安定したギガオームシールを維持することは別の課題ですが、成功率は練習で合理的です。我々は、穿開されたパッチ技術(上記のようにピペット溶液中の抗生物質アンホテリシンBを含む)を使用すると、標準的な全細胞構成よりも安定した記録を得ることがわかった。さらに、MPPフローチャンバーおよび使用される溶液は、動脈における血流のせん断を正確に複製しない。血液は、インビトロ実験では複製されていない粘性の非ニュートン流体です。さらに、ここで使用されるチャンバは平行チャンバであり、動脈のせん断応力はシリンダー内のせん断の式を使用して最もよく計算される。
フロー下でシングルチャネル録画を実行する際には、重要な考慮事項と制限事項があります。この方法は、安定したシールを得る細胞付着構成(無傷の細胞の膜に取り付けられたピペット)に適しています。アクティビティが記録されている単一のチャンネルは、特にインサイドアウト構成27では録音ピペットによって保護されているため、せん断応力に直接さらされていないことに注意することが重要です。私たちは、取り除かれた膜は通常、記録ピペットに引き込まれ、したがって、明確に定義されたフローにさらされないため、イオンチャネルの感度をテストするために使用される場合、取り除かれたパッチ構成は最も信頼性が低いと考えています。
これらの実験で使用できる細胞の種類に関しては、血管内皮細胞は、せん断ストレスおよびメカノ感受性チャネルを研究するために最も適用可能な細胞タイプを表す。以前の研究は、主に培養された内皮細胞3、28に焦点を当てたもので、容易に入手可能である。我々は、マウス耐性動脈6、7から新たに単離された内皮細胞にこの方法の使用をテストし、拡張した。他のセルタイプは間違いなく考慮する必要があります。血管平滑筋細胞は、例えば、内皮が損傷し、29、30を除去した疾患状態の間にせん断ストレスにさらされる可能性がある。これは、平滑筋に存在するメカノ感受性チャネルが、せん断ストレスの影響を受けない、潜在的に病理生理学的疾患のメカニズムに寄与する興味深い研究領域を表している。さらに、目的のチャネルをコードする遺伝子を用いたHEKまたはCHOのような車両細胞株のトランスフェクションは、MPPフローチャンバの使用と組み合わせてチャネルの生体物理学的解析のための優れたプラットフォームである。
また、MPPフローチャンバーの本来の意図はイオンチャネルメカノ活性化のリアルタイム調査のためであったが、デバイスの適用はこの目標を超えて拡張する可能性があることに注意することも重要である。具体的には、一酸化窒素(NO)センサなどの電極センサを用いて、せん断応力に応じてNOの放出を決定する研究にも同様のアプローチを用いることができる。したがって、機械的に規制された生物学的プロセスをリアルタイムで調査することに関心のある人に一般化された方法論を提供し、研究対象者のための特定の研究ニーズを満たすためにMPP室のさらなる改変を促進する様々な分野でメカノセンシティブなプロセスを行います。
開示事項
著者は何も開示していない。
謝辞
この研究は、国立心臓、肺、血液研究所(R01 HL073965、IL)および(T32 HL07829-24、ISF)によって資金提供されました。著者らはまた、私たちの最新のMPPフローチャンバーを生成するために、シカゴのイリノイ大学の科学機械ショップを認めたいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 0.2 µm sterile syringe filters | VWR | 28145-501 | Used for filtering electrophysiolgoical pipette solution |
| 5 grade forceps | Fine Scientific Tools | 1252-30 | Used for transferring digested arteries to fresh solution |
| 9" Pasteur Pipet | Fisher Scientifc | 13-678-20D | Used for mechanically disrupting digested arteries and transferring freshly isolated endohtelial cells |
| 12 mm diameter Cover glass circles | Fisher Scientifc | 12-545-80 | For use with studies involving cultured cells and multiple treatments. Cells adhered to the cover glass are used for patch clamp analyses |
| 24 mm x 40 mm Rectangluar Cover glass | Sigma-Aldrich | CLS2975224 | Cover glass to be added to MPP flow chamber pieces C (Figure 1) |
| 24 mm x 50 mm Rectangular Cover glass | Sigma-Aldrich | CLS2975245 | Cover glass to be added to MPP flow chamber E (Figure 1) |
| 20 G syringe needles | Becton Dickinson and Co | 305175 | For use in mechanical disruption of digested mesenteric arteries |
| 35 mm Petri dish | Genesee Scientific | 32-103 | For use in mechanical disruption of digested mesenteric arteries |
| Amphotericin B solubilized | Sigma-Aldrich | A9528-50MG | Used for generating the perforated whole-cell patch configuration. |
| Collagenase, type I | Worthington Biochemical | 100 mg - LS004194 | Enzyme used in our laboratory as a brief digestion following the initial cocktail of neutral protease and elastase |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientifc | 67-68-5 | Solvent for Amphotericin B used in perforated whole-cell patch clamp |
| Elastase, lyophilized | Worthington Biochemical | 25 mg - LS002290 | Enzyme used in our laboratory in a cocktail with neutral protease/dispase to begin digestion of arteries for endothelial cell isolation. |
| Falcon Tissue culture Plate, 6-well, Flat Bottom with Low Evaporation Lid | Corning | 353046 | For use with studies involving cultured cells and multiple treatments |
| Neutral protease/dispase | Worthington Biochemical | 10 mg- LS02100 50 mg - LS02104 | Enzyme used in our laboratory in a cocktail with elastase to begin digestion of arteries for endothelial cell isolation |
| SylGard | World Precision Instruments | SYLG184 | Silicone elastomer for adhering the rectangular cover slip to the MPP flow chamber pieces C and E (Figure 1) |
| Tygon ND 10-80 tubing | Microbore Tubing | AAQ04133 | ID: 0.05 in, OD: 0.09 in, inlet perfusion tubing for adminsitering flow to the chamber |
参考文献
- Green, D. J., Hopman, M. T., Padilla, J., Laughlin, M. H., Thijssen, D. H. Vascular Adaptation to Exercise in Humans: Role of Hemodynamic Stimuli. Physiological Reviews. 97 (2), 495-528 (2017).
- Gimbrone, M. A. Jr, Topper, J. N., Nagel, T., Anderson, K. R., Garcia-Cardena, G. Endothelial dysfunction, hemodynamic forces, and atherogenesis. Annals of the New York Academy of Sciences. 902, discussion 239-240 230-239 (2000).
- Olesen, S. P., Clapham, D. E., Davies, P. F. Haemodynamic shear stress activates a K+ current in vascular endothelial cells. Nature. 331 (6152), 168-170 (1988).
- Barakat, A. I., Lieu, D. K., Gojova, A. Secrets of the code: do vascular endothelial cells use ion channels to decipher complex flow signals? Biomaterials. 27 (5), 671-678 (2006).
- Beech, D. J. Endothelial Piezo1 channels as sensors of exercise. Journal of Physiology. 596 (6), 979-984 (2018).
- Ahn, S. J., et al. Inwardly rectifying K(+) channels are major contributors to flow-induced vasodilatation in resistance arteries. Journal of Physiology. 595 (7), 2339-2364 (2017).
- Fancher, I. S., et al. Hypercholesterolemia-Induced Loss of Flow-Induced Vasodilation and Lesion Formation in Apolipoprotein E-Deficient Mice Critically Depend on Inwardly Rectifying K(+) Channels. Journal of the American Heart Association. 7 (5), (2018).
- Rode, B., et al. Piezo1 channels sense whole body physical activity to reset cardiovascular homeostasis and enhance performance. Nature Communications. 8 (1), 350(2017).
- Li, J., et al. Piezo1 integration of vascular architecture with physiological force. Nature. 515 (7526), 279-282 (2014).
- Levitan, I., Helmke, B. P., Davies, P. F. A chamber to permit invasive manipulation of adherent cells in laminar flow with minimal disturbance of the flow field. Annals of Biomed Engineering. 28 (10), 1184-1193 (2000).
- Fang, Y., et al. Hypercholesterolemia suppresses inwardly rectifying K+ channels in aortic endothelium in vitro and in vivo. Circulation Research. 98 (8), 1064-1071 (2006).
- Shetty, S., Weston, C. J., Adams, D. H., Lalor, P. F. A flow adhesion assay to study leucocyte recruitment to human hepatic sinusoidal endothelium under conditions of shear stress. Journal of Visualized Experiments. (85), e51330(2014).
- Man, H. S. J., et al. Gene Expression Analysis of Endothelial Cells Exposed to Shear Stress Using Multiple Parallel-plate Flow Chambers. Journal of Visualized Experiments. (140), e58478(2018).
- White, L. A., et al. The Assembly and Application of 'Shear Rings': A Novel Endothelial Model for Orbital, Unidirectional and Periodic Fluid Flow and Shear Stress. Journal of Visualized Experiments. (116), e54632(2016).
- Franzoni, M., et al. Design of a cone-and-plate device for controlled realistic shear stress stimulation on endothelial cell monolayers. Cytotechnology. 68 (5), 1885-1896 (2016).
- Dewey, C. F. Jr, Bussolari, S. R., Gimbrone, M. A. Jr, Davies, P. F. The dynamic response of vascular endothelial cells to fluid shear stress. Journal of Biomechanical Engineering. 103 (3), 177-185 (1981).
- Hoger, J. H., Ilyin, V. I., Forsyth, S., Hoger, A. Shear stress regulates the endothelial Kir2.1 ion channel. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7780-7785 (2002).
- Moccia, F., Villa, A., Tanzi, F. Flow-activated Na(+)and K(+)Current in cardiac microvascular endothelial cells. Journal of Molecular and Cellular Cardiology. 32 (8), 1589-1593 (2000).
- Crane, G. J., Walker, S. D., Dora, K. A., Garland, C. J. Evidence for a differential cellular distribution of inward rectifier K channels in the rat isolated mesenteric artery. Journal of Vascular Research. 40 (2), 159-168 (2003).
- Hannah, R. M., Dunn, K. M., Bonev, A. D., Nelson, M. T. Endothelial SK(Ca) and IK(Ca) channels regulate brain parenchymal arteriolar diameter and cortical cerebral blood flow. Journal of Cereberal Blood Flow and Metabolism. 31 (5), 1175-1186 (2011).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of Visualized Experiments. (59), e3349(2012).
- Lieu, D. K., Pappone, P. A., Barakat, A. I. Differential membrane potential and ion current responses to different types of shear stress in vascular endothelial cells. American Journal of Physiology-Cell Physiology. 286 (6), C1367-C1375 (2004).
- Le Master, E., et al. Proatherogenic Flow Increases Endothelial Stiffness via Enhanced CD36-Mediated Uptake of Oxidized Low-Density Lipoproteins. Arteriosclerosis, Thrombosis, and Vascular Biology. 38 (1), 64-75 (2018).
- Kim, J. G., et al. Measurement of Ion Concentration in the Unstirred Boundary Layer with Open Patch-Clamp Pipette: Implications in Control of Ion Channels by Fluid Flow. Journal of Visualized Experiments. (143), e58228(2019).
- Kim, J. G., et al. Fluid flow facilitates inward rectifier K(+) current by convectively restoring [K(+)] at the cell membrane surface. Scientific Reports. 6, 39585(2016).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. Journal of the American Medical Association. 282 (21), 2035-2042 (1999).
- Jacobs, E. R., et al. Shear activated channels in cell-attached patches of cultured bovine aortic endothelial cells. Pflugers Archiv. European Journal of Physiology. 431 (1), 129-131 (1995).
- Barakat, A. I., Leaver, E. V., Pappone, P. A., Davies, P. F. A flow-activated chloride-selective membrane current in vascular endothelial cells. Circulation Research. 85 (9), 820-828 (1999).
- Fitzgerald, T. N., et al. Laminar shear stress stimulates vascular smooth muscle cell apoptosis via the Akt pathway. Journal of Cellular Physiology. 216 (2), 389-395 (2008).
- Ueba, H., Kawakami, M., Yaginuma, T. Shear stress as an inhibitor of vascular smooth muscle cell proliferation. Role of transforming growth factor-beta 1 and tissue-type plasminogen activator. Arteriosclerosis, Thrombosis, and Vascular Biology. 17 (8), 1512-1516 (1997).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved