Method Article
Registrazioni elettrofisiologiche di correnti ioniche a cella singola sotto stress di taglio ben definito
In questo articolo
Riepilogo
L'obiettivo di questo protocollo è descrivere una camera di flusso a piastre parallela modificata da utilizzare per studiare l'attivazione in tempo reale dei canali ionici meccanosensibili da sollecitazioni di taglio.
Abstract
Lo stress da taglio fluido è ben noto per svolgere un ruolo importante nella funzione endoteliale. Nella maggior parte dei letti vascolari, lo stress da taglio elevato da aumenti acuti del flusso sanguigno innesca una cascata di segnalazione con conseguente vasodilazione alleviando così lo stress meccanico sulla parete vascolare. Il modello di stress da taglio è anche ben noto per essere un fattore critico nello sviluppo di aterosclerosi con stress di taglio lamiarese essendo ateroprotettivo e disturbato stress di taglio essere aterogenico. Mentre abbiamo una comprensione dettagliata dei vari percorsi di segnalazione delle cellule intermedie, i recettori che prima traducono lo stimolo meccanico in mediatori chimici non sono completamente compresi. I canali ionici meccanosensibili sono fondamentali per la risposta alla cesoia e regolano la segnalazione delle cellule indotta da taglio controllando così la produzione di mediatori vasoattivi. Questi canali sono tra i primi componenti di segnalazione attivati per taglio e sono stati collegati alla vasodialazione indotta da taglio attraverso la promozione della produzione di ossido nitrico (ad esempio, rettificando interiormente Ke il potenziale del recettore transitorio [TRP] canali) e iperpolarizzante dell'endotelio (ad esempio, Kir e canali Kad attivazione di calcio [KCa]) e vasoconstriction indotta da taglio attraverso un meccanismo indeterminato che coinvolge canali piezo. Comprendere il meccanismo biofisico con cui questi canali vengono attivati dalle forze di taglio (cioè direttamente o attraverso un meccano-recettore primario) potrebbe fornire potenziali nuovi obiettivi per risolvere la fisiofisiologia associata alla disfunzione endoteliale e l'aterogenesi. È ancora una grande sfida registrare l'attivazione indotta dal flusso dei canali ionici in tempo reale utilizzando l'elettrofisiologia. I metodi standard per esporre le cellule a sollecitazioni di taglio ben definite, come il reometro a cono e piastra e la camera di flusso della piastra parallela chiusa non consentono lo studio in tempo reale dell'attivazione del canale ionico. L'obiettivo di questo protocollo è quello di descrivere una camera di flusso a piastre parallele modificata che consente la registrazione elettrofisiologica in tempo reale dei canali ionici meccanosensibili sotto una sollecitazione di taglio ben definita.
Introduzione
Le forze emodinamiche generate dal flusso sanguigno sono ben note per svolgere ruoli importanti nella funzione endoteliale e vascolare1,2. È anche noto che diversi tipi di canali ionici rispondono acutamente ai cambiamenti nello stress di taglio3,4,5 portando all'ipotesi che i canali ionici possono essere sensori di stress da taglio primari. Più di recente, noi e altri abbiamo dimostrato che i canali ionici meccanosensitive svolgono ruoli critici in diverse funzioni vascolari sensibili allo stress di taglio, tra cui la risposta vasoattiva allo stress di taglio6,7,8 e angiogenesi dello sviluppo9. I meccanismi della sensibilità di taglio-stress dei canali ionici, tuttavia, sono quasi totalmente sconosciuti. Questa lacuna di conoscenza è probabilmente dovuta alla difficoltà tecnica di eseguire registrazioni elettrofisiologiche sotto stress di taglio ben definito. In questo articolo, quindi, forniamo un protocollo dettagliato passo dopo passo regolarmente eseguito nel nostro laboratorio per raggiungere questo obiettivo6,7,10,11.
L'obiettivo generale di questo metodo è quello di consentire l'indagine in tempo reale della meccanoattivazione del canale ionico sotto stress di taglio ben definito nella gamma fisiologica. Ciò si ottiene modificando una camera di flusso a piastre parallela standard per consentire la calatta elettrofisiologica nella camera e l'accesso alle cellule coltivate sulla piastra inferiore durante l'esposizione in tempo reale al flusso, fornendo un approccio unico per raggiungere questo obiettivo Obiettivo6,7,11. Al contrario, le camere standard a flusso di lamiere parallele, descritte nelle pubblicazioni precedenti, possono essere utilizzate per l'analisi dell'imaging in tempo reale delle cellule esposte alle forze di taglio12 o altri approcci non invasivi13,14 ma non per Elettrofisiologia. Allo stesso modo, l'apparato cono e piastra, un altro potente approccio per esporre le cellule allo stress di taglio15,16 non è adatto per registrazioni elettrofisiologiche. Pertanto, questi dispositivi di flusso non consentono l'indagine della sensibilità allo stress da taglio dei canali ionici. La difficoltà nell'eseguire registrazioni elettrofisiologiche in flusso è la ragione principale per la scarsità di informazioni sui meccanismi responsabili di questi effetti cruciali.
In termini di approcci alternativi per raggiungere lo stesso obiettivo, non ce ne sono così accurati o controllati. Alcuni studi precedenti hanno tentato di registrare l'attività del canale ionico sotto flusso esponendo le cellule a un flusso di liquido proveniente da un'altra pipetta portata in prossimità di una cella da oltre17,18. Questo è altamente non fisiologico, in quanto le forze meccaniche generate in queste condizioni hanno poco in comune con i profili fisiologici dello stress da taglio nei vasi sanguigni. Simili preoccupazioni si applicano ai tentativi di simulare lo stress fisiologico di taglio per perfusione di camere aperte. Come discusso in dettaglio nel nostro studio precedente10, un'interfaccia ad aria liquida aperta crea più disturbi e ricircolo, che sono non fisiologici. Per affrontare tutte queste preoccupazioni, abbiamo progettato una camera di flusso a piastre parallele modificata (MPP), chiamata anche "dispositivo di flusso minimamente invasivo" nei nostri studi precedenti6,7,10,11, dall'acrilico e ampiamente utilizzato nel nostro laboratorio. Tuttavia, nonostante il fatto che la descrizione originale del progetto sia stata pubblicata quasi 20 anni fa ed è l'unico dispositivo di flusso che consente di eseguire registrazioni elettrofisiologiche sotto stress di taglio ben definito, questa metodologia non è stata adottato da altri laboratori e ci sono solo pochissimi studi che tentano di registrare le correnti in flusso. Crediamo, quindi, che fornire una descrizione dettagliata per l'utilizzo della camera di flusso MPP sarà di grande aiuto per le ricerche che sono interessate acanali ionici meccanosensibili e biologia vascolare.
Protocollo
L'uso di animali nei nostri studi è approvato dall'Università dell'Illinois al Chicago Animal Care Committee (#16-183).
1. Montaggio della camera a flusso di piastra parallela modificata
NOT: Fare riferimento alla tabella 1 e Figura 1 per gli ID della camera di flusso MPP. Si prega di fare riferimento alla Figura 1 per uno schema che descrive l'orientamento dei pezzi della camera per l'assemblaggio.
- Per aderire al vetro di copertura rettangolare, pezzo D, sul fondo del pezzo C, fare prima la soluzione di elastomer in silicone mescolando accuratamente 500 l'agente di polimero in silicone elastomer osomero in 5 mL di base elastomer in silicone.
- Applicare uno strato sottile della soluzione elastomer in silicone intorno ai bordi dello spazio rettangolare del pezzo C e posizionare delicatamente il pezzo rettangolare di vetro di copertura D direttamente sulla soluzione elastomer in modo tale che il pezzo D copre completamente lo spazio rettangolare aperto del pezzo C. Pulire con cura la soluzione di elastomeri in silicone in eccesso.
- Ripetere il passaggio 1.2 per aderire al vetro di copertura rettangolare, pezzo F, sul fondo del pezzo E e consentire alla soluzione di elastomeri in silicone di curare durante la notte a temperatura ambiente.
NOT: Una volta curato, il vetro di copertura rettangolare rimarrà aderito fino a sei mesi prima di dover essere sostituito. - A partire dal pezzo della camera inferiore, pezzo E, assemblare la camera di flusso MPP posizionando in sequenza ogni pezzo sopra il precedente nel seguente ordine: pezzo E (in basso), pezzo C, pezzo B, pezzo A (superiore).
- Allineare i fori di vite di ogni pezzo agli angoli e avvitare saldamente i pezzi insieme per evitare che si verifichino perdite durante la somministrazione del flusso alla camera di flusso MPP.
2. Preparazione cellulare e semina nella camera di flusso MPP
NOT: Seguite i passaggi 2.1.2.7 per le cellule endoteliali coltivate. Seguite il metodo descritto nei passaggi 2.8.2.14 per isolare le cellule endoteliali dalla galleria arteriosa mesenteica del topo e la preparazione di cellule endoteliali appena isolate.
- In una piastra a 6 pozzetti, mettere da quattro a cinque cerchi di vetro di copertura da 12 mm e cellule di semi tra il 10% e il 30% di confluenza in modo che sia possibile accedere a singole celle per le registrazioni elettrofisiologiche.
- Incubare le cellule in condizioni di coltura standard (5% CO2, 37 ) per non meno di 2 h per consentire alle cellule di aderire e non più di 24 h come cellule endoteliali nell'esperienza degli autori diventano molto piatte e difficili da correggere quando semina a sub-confluenza per più di 24 H.
- Rimuovere un vetro di copertura contenente le cellule aderte da un pozzo della piastra a 6 pozzetti, risciacquare rapidamente in salina con tamponamento di fosfato (PBS) e trasferirlo in una teglia Petri da 35 mm contenente 2 mL di soluzione da bagno elettrofisiologico (tabella 2) prima del trasferimento al flusso MPP studio.
- Trasferire il cerchio di vetro di copertura al vetro di copertura rettangolare, pezzo D, che viene aderito al pezzo C della camera di flusso MPP assicurandosi che una soluzione adeguata rimanga sul vetro di copertura in modo che le cellule non vengano esposte all'aria. Aggiungete la soluzione per il bagno desiderata (250 dollari l) alle celle in modo che il cerchio di vetro di copertura e le celle siano completamente sommersi in soluzione.
- Posizionare il cerchio di vetro di copertura in modo che si appoggia nella metà più vicina al lato del serbatoio del vuoto in modo che le celle siano in linea con le aperture a vela del pezzo B. Assicurarsi che il cerchio di copertura in vetro aderisca al pezzo D attraverso l'adesione al vetro della soluzione in modo che l'applicazione flusso alla camera non interrompe la posizione del cerchio di vetro di copertura.
- Assemblare la camera di flusso MPP avvitando i pezzi nell'ordine appropriato, come descritto nei passaggi 1.4 e 1.5 e come illustrato nella Figura 1. Trasferire la camera allo stadio del microscopio e perfondere immediatamente la camera con soluzione bagno in modo che la soluzione raggiunga il serbatoio sottovuoto per l'aspirazione (10 mL).
- Identificare una cellula sana per l'esperimento identificando una cellula con un bordo scuro e un nucleo evidente. Evitare le celle che sembrano sbiancare o le celle che sono in contatto con altre celle.
NOT: Nel laboratorio degli autori, vengono utilizzate cellule endoteliali aortiche umane e cellule endoteliali meusteriche primarie in coltura. Tuttavia, qualsiasi altro tipo di cellula aderente che è di interesse per esigenze di ricerca specifiche può essere utilizzato allo stesso modo. - Lavare il porticato dell'arteria isolata in soluzione di dissociazione (Tabella 2). Trasferire la sala giochi su un tubo di centrifugazione da 2 mL contenente 2 mL di soluzione di dissociazione preriscaldata (ricetta per la soluzione di dissociazione mostrata nella tabella 2) contenente proteasi neutra (0,5 mg/mL) ed elastasi (0,5 mg/mL). Incubare per 1 h a 37 gradi centigradi con agitazione delicata ogni 10 min.
- Rimuovere 1 mL della soluzione di dissociazione proteasi/elastasi neutra e aggiungere 1 mg/mL di collagenae di tipo 1. Restituire la soluzione di collagenasi alla soluzione contenente le arterie per una concentrazione finale di tipo 1 di collagenee di 0,5 mg/mL. Incubare per 2/3 min a 37 gradi centigradi.
- Utilizzando una pinze di grado 5, spostare rapidamente la sala giochi su una teglia Petri di 35 mm di diametro contenente una goccia di soluzione di dissociazione fresca e refrigerata di 750 gradi. Dissociare ulteriormente il tessuto utilizzando due aghi siringhe da 20 G per liberare meccanicamente le cellule endoteliali dalle arterie enzimaticamente digerite.
- Utilizzando un tubo di vetro Pasteur usa e getta da 9", triturare la soluzione cellulare 10x prima di trasferire le cellule in un nuovo tubo di centrifuga di 1,5 ml utilizzando il tubo di vetro.
- Lavare la piastra Petri con altri 750 gradi di soluzione di dissociazione e trasferirla nello stesso tubo. Utilizzando la pipetta di vetro, disperdere ulteriormente meccanicamente le cellule pipetting almeno 10x per creare una sospensione a singola cella facendo attenzione a non introdurre bolle che possono danneggiare l'integrità delle cellule endoteli.
- Aggiungete 750 l della sospensione delle cellule endoteliali (500-1.000 celle) direttamente al pezzo D della camera di flusso MPP sulla metà più vicina al lato del vuoto del serbatoio. Lasciare che le cellule endoteliali aderiscano tra 45 min e 1 h a temperatura ambiente.
- Assemblare la camera di flusso MPP avvitando i pezzi nell'ordine appropriato, come descritto nei passaggi 1.4 e 1.5 e come illustrato nella Figura 1. Trasferire la camera allo stadio del microscopio e perfondere immediatamente la camera con soluzione bagno in modo che la soluzione raggiunga l'aspirazione del vuoto (10 mL). Identificare le cellule endoteliali accessibili dal loro fenotipo ruvido e rotondo19,20.
NOT: Una varietà di metodi di digestione e cocktail enzimatici sono stati utilizzati per isolare le cellule endoteliali da diversi letti arteriosi. Vedere la tabella 3 per le descrizioni dettagliate dei protocolli che sono stati utilizzati da una varietà di ricercatori per isolare le cellule endoteliali per l'elettrofisiologia dei morsetti dei canali ionici meccanosensitive. Questi metodi sono probabilmente adatti per l'uso in combinazione con la camera di flusso MPP.
3. Controllo dello stress da taglio nella camera di flusso MPP per le registrazioni elettrofisiologiche dei canali Ion Ichanosensitive attivati dalla cesoia
- Impostare un sistema di perfusione gravitazionale collegando un cilindro di siringa da 30 mL a un lucchetto a 3 vie dotato di tubi microbore (diametro interno: 0,05 pollici, diametro esterno: 0,09 pollici) adatto per l'inserimento nel foro di ingresso di 3 mm di diametro del pezzo A del MPP studio.
- Attaccare il cilindro graduato alla faccia esterna della gabbia di Faraday che circonda il rig di elettrofisiologia (Figura 2) utilizzando nastro adesivo a due lati. Prima di inserire il tubo nella camera MPP, pre-riempire la siringa e i tubi con la soluzione del bagno (vedere la tabella 2 per la soluzione di bagno utilizzata per studiare la rettifica interiormente k- canali nelle cellule endoteliali). Inserire il tubo nel foro di ingresso della camera di flusso MPP del pezzo A.
- Pre-riempire la camera di flusso MPP con soluzione in modo tale che la soluzione viene rimossa nel serbatoio del vuoto. Interrompere il flusso verso la camera e riempire il cilindro graduato al marchio superiore. Calcolare manualmente le portate consentendo alla soluzione di fluire attraverso la camera e utilizzando un orologio di arresto per calcolare mL/s a una determinata altezza del cilindro di siringa.
- Sollevare o abbassare la siringa per alterare il flusso, e quindi tagliare nella camera, e continuare questo processo fino a trovare un livello desiderato di stress di taglio.
- Calcolare la sollecitazione di taglio in una camera parallela utilizzando la seguente equazione21:
6/Q/h2w
dove : viscosità del fluido (g/cm, Q, velocità di flusso (mL/s) e larghezza della camera a piastre parallele (w : 2,2 cm) e altezza (h - 0,1 cm).
NOT: Nell'attuale sistema di perfusione gravitazionale, ad un'altezza del cilindro di siringa (misurata dalla parte superiore del cilindro) di 57 cm sopra lo stadio del microscopio, la portata è di 0,3 ml/s. La cesoia calcolata nella camera a questa altezza del cilindro di siringa e la portata è di 0,7 dyn/cm2. Va anche notato che altri sistemi di perfusione, come una pompa peristaltica, possono essere utilizzati per controllare il flusso alla camera di flusso MPP. Tuttavia, questi dispositivi possono aggiungere turbolenza indesiderata e influenzare la stabilità delle misurazioni elettrofisiologiche in flusso, quindi, utilizzando il sistema di perfusione gravitazionale descritto qui è raccomandato. - Trasferire una camera assemblata contenente cellule aderenti allo stadio microscopio del rig di elettrofisiologia e inserire il tubo pre-riempito con soluzione vasca ripieno nel foro del pezzo A. Riempire contemporaneamente la camera e lavare le cellule con 10 mL di soluzione vasca da bagno girando la serratura a 3 vie in modo che la soluzione fluisca verso la camera.
- Una volta ottenuta la configurazione di patch desiderata, consentire alle correnti del canale di stabilizzarsi in un bagno statico a temperatura ambiente. Una volta che le correnti si sono stabilizzate, applicare la cesoia in modo graduale permettendo agli aumenti di corrente di stabilizzarsi prima del successivo aumento dello stress da taglio.
NOT: Gli autori trovano il maggior successo con la configurazione delle patch perforate durante lo studio dei canali ionici meccanoattivati nelle cellule endoteliali. Per eseguire configurazioni di patch intercellulari perforate, aggiungere 5 l of un'amphotericina di 60 mg/mL nel solfuro dimetilo (DMSO) a 1 mL di 0,2 m sterile soluzione di pipetta filtrata. Dopo aver generato un sigillo giga-ohm nella configurazione collegata alle cellule, le patch intere delle celle perforate si formano entro 2-5 min. - Rimuovere l'esposizione di taglio alle cellule fermando il flusso alla camera permettendo alle correnti di canale meccanosensitive di tornare alle correnti di base osservate nel bagno statico.
- Isolare le correnti meccanosensibili del canale ionico di interesse alterando la valenza della soluzione (ad esempio, 60 mM K in soluzione di bagno con 0 Ca2 in soluzione pipetta per studiare internamente la rettifica dei canali K. La tabella 2 mostra esempi di ricette di soluzioni) e/o l'inibizione farmacologica di fonti attuali potenzialmente contaminanti.
Risultati
Più fotografie che mostrano diverse viste della camera di flusso MPP sullo stadio del microscopio (pannello superiore) e una rappresentazione schematica della camera di flusso MPP (pannello inferiore) sono mostrati nella Figura 1. Lo schema descrive in dettaglio le dimensioni dell'intero dispositivo e della camera di flusso. La figura 2 mostra una fotografia del sistema di perfusione gravitazionale alla camera di flusso MPP nel nostro laboratorio (pannello superiore). Viene inoltre illustrata una rappresentazione schematica del sistema di flusso (pannello inferiore) destinata a evidenziare i passaggi che isolano le cellule nella camera di flusso dalla corsa della soluzione dal sistema di perfusione e dalla forza della rimozione del vuoto della soluzione.
Un segno distintivo dei canali ionici meccanosensibili è un brusco ritorno ai livelli di base dopo la cessazione dello stimolo meccanico3,6,7. La figura 3 mostra come esempio che la rimozione dello stimolo da stress da taglio durante le registrazioni elettrofisiologiche di Kir current da una cellula endoteliale appena isolata produce un ritorno alle correnti di base inizialmente registrate in un bagno statico. Il ritorno ai livelli di corrente di base dopo l'arresto del flusso alla camera MPP si è verificato entro dieci secondi dalla cessazione del flusso.
Le registrazioni elettrofisiologiche a celle intere (WC), in particolare quelle prelevate da cellule appena isolate, hanno spesso evidenti correnti di fondo di perdita che possono mascherare l'attività del canale. Alcuni canali ionici, come quelli della famiglia di canali K, rettificando verso l'interno, hanno proprietà biofisiche che consentono di sottrarre la corrente di fondo della perdita per un'analisi più accurata. Figura 4 viene illustrato come esempio il processo dai dati non elaborati (Figura 4A) alla perdita lineare calcolata e tracciata (Figura 4B) alla finale, perdita sottratta traccia rappresentativa (Figura 4C). Vedere una spiegazione dettagliata per calcolare e sottrarre la perdita dalla registrazione della patch WC perforata non elaborata nella legenda di accompagnamento alla figura 4.

Figura 1: camera di flusso MPP e schema dettagliato. Le fotografie della camera di flusso MPP assemblata (pannello superiore) mostrano la camera sullo stadio del microscopio da tre diverse viste: il lato visto durante gli esperimenti (a sinistra), dall'ingresso perfusione (al centro) e dalla presa del vuoto (a destra) che è fuori dalla vista in la fotografia. La direzione del flusso è etichettata in ciascuna. Si noti che il filo di terra può facilmente adattarsi in una delle fessure da 2 mm quando piegato con un angolo di 90. Uno schema dettagliato (in basso) mostra le dimensioni esatte per la replica dell'apparato. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Il sistema di perfusione gravitazionale. Una fotografia etichettata del sistema di perfusione gravitazionale nel nostro laboratorio è mostrata nel pannello superiore. La camera di flusso MPP in due fasi e il sistema di perfusione gravitazionale sono descritti in dettaglio nel pannello inferiore. Viene evidenziata la separazione della camera di flusso contenente le cellule e dei due serbatoi superiori e inferiori. Il passaggio 1 consente alla soluzione di fluire dal serbatoio superiore del pezzo B al pezzo D della camera in cui vengono semizzati le cellule. Passo 2 permette alla soluzione di fluire dal pezzo D fino al serbatoio inferiore, pezzo F. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: tracce rappresentative dell'attivazione corrente indotta dalla cesoia dei canali Kir e ritorno ai livelli attuali di base dopo la rimozione del flusso. Un buon controllo positivo per la meccanoattivazione dei canali ionici è il ritorno ai livelli correnti di base inizialmente osservati in un bagno statico dopo la cessazione dello stimolo meccanico. Le correnti del canale K (Kir) si attivano in modo interno dalla sollecitazione di taglio quando la soluzione di gravità può fluire nella camera di flusso MPP. Dopo la cessazione del flusso verso la camera, le correnti di Kir ritornano rapidamente ai livelli statici di base osservati prima del flusso. Una rampa da -140 mV a 40 mV è stata applicata alla patch oltre 400 ms. La soluzione bagno conteneva 60 mM Ke il potenziale di inversione era di 20 mV. Le tracce rappresentative sono state generate da una cellula endoteliale appena isolata dalle arterie mesentiche dei topi. Fare clic qui per visualizzare una versione più grande di questa figura.
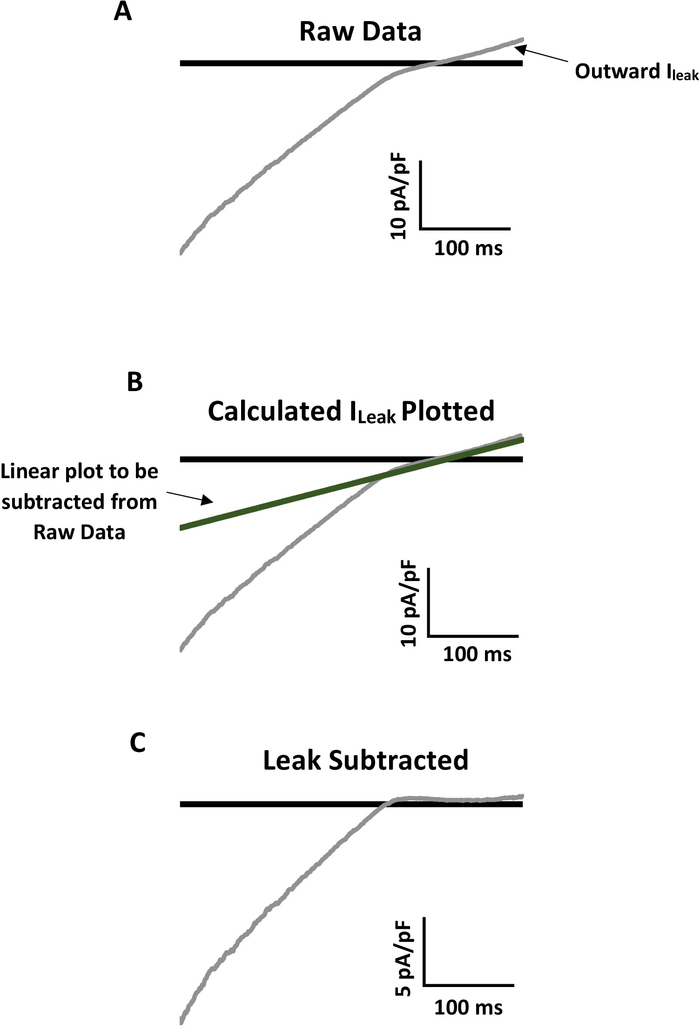
Figura 4: Esempio di sottrazione delle perdite per un'analisi accurata della corrente di Kir con attivazione meccanica. (A) Rappresentante registrazione grezza della corrente di Kir da una cellula endoteliale primaria del topo con notevole corrente di perdita lineare verso l'esterno (ioperdo). Una rampa da -140 mV a 40 mV è stata applicata alla patch oltre 400 ms. La soluzione bagno conteneva 60 mM Ke il potenziale di inversione era di 20 mV. (B) Laperdita impedisce l'analisi dell'attività reale del canale Kir. Per sottrarre laperdita, calcolare prima la conduttanza di pendenza lineare di Ileak (Gpendenza : (Ia-Ib)/(Va-Vb)). Moltiplicare lapendenza G per le corrispondenti tensioni dell'intera traccia grezza per tracciarela perdita I sui dati grezzi. La linea dovrebbe sovrapporre esattamente la perdita lineare verso l'esterno. (C) Sottrarre laperdita tracciata dall'intera traccia in modo che la corrente lineare verso l'esterno sia di .0 pA/pF e la corrente reale di Kir possa essere analizzata. Si noti nel pannello C che la corrente di Kir verso l'interno è circa la metà di quella della traccia dei dati grezzi originali nel pannello A. Fare clic qui per visualizzare una versione più grande di questa figura.
| Altezza (mm) | Larghezza (mm) | Lunghezza (mm) | Ulteriori informazioni | ||
| Pezzo A | 8 (IN vio | 80 | 98 (di base) | Contiene un foro di 3 mm di diametro per tubi perfusione di insele (vedere Tabella deimateriali) e uno spazio rettangolare di 53 mm x 60 mm per l'accesso a pezzi centrali e celle | |
| Pezzo B | 1 : il nome del | 80 | 98 (di base) | Contiene uno spazio (20 mm diagonale) sotto il foro perfuso del pezzo A e tre fessure da 2 mm x 17 mm per l'accesso alle celle | |
| Pezzo C | 1 : il nome del | 80 | 98 (di base) | Contiene uno spazio di 22 mm x 50 mm in cui il pezzo D è aderito utilizzando la soluzione di elastomer in silicone (vedere Tabella dei materiali) | |
| Pezzo D | 0.16 | 24 Mi lasa' di | 40 anni ( | Diapositiva rettangolare in vetro inferiore della camera di flusso | |
| Pezzo E | 5 Del numero 3( | 80 | 120 | Contiene uno spazio di 45 mm x 50 mm per consentire la visualizzazione delle celle sul pezzo D. Per la presa a vuoto del serbatoio, il pezzo F, è presente uno spazio di 20 mm x 45 mm, | |
| Pezzo F | 0.16 | 24 Mi lasa' di | 50 anni | Parte inferiore rettangolare scorrevole in vetro del serbatoio dell'uscita sottovuoto | |
| MPP assemblato | 15 Mi lasa del sistema | 80 | 120 | La camera di flusso è separata dal vuoto di ingresso e uscita da due fasi per evitare l'interruzione della cesoia laminare ben definita | |
| Camera di flusso dell'MPP assemblato | 1 : il nome del | 22 Milia | 42 o più | Il pezzo D è il fondo di scorrimento in vetro della camera di flusso | |
Tabella 1: Dimensioni del MPP (assemblate e smontate) e informazioni aggiuntive specifiche per ogni parte del dispositivo.
| soluzione | Ricetta (in mM) | Ph | ||
| dissociazione f | 55 NaCl, 80 Na-glutammato, 6 KCl, 2 MgCl2, 0.1 CaCl2, 10 glucosio, 10 HEPES | 7.3 La sua | ||
| (Isolamento cellulare) | ||||
| Bath (elettrofisiologia) | 80 NaCl, 60 KCl, 1 MgCl2, 2 CaCl2, 10 glucosio, 10 HEPES | 7.4 Della pes . | ||
| Pipette (elettrofisiologia) | 5 NaCl, 135 KCl, 5 EGTA, 1 MgCl2, 5 glucosio, 10 HEPES | 7.2 (in questo stato del documento in questo | ||
Tabella 2: Esempi di soluzioni con ricette utilizzate negli esperimenti.
| Protocollo di isolamento cellulare endoteliale | Riferimenti | |
| Cocktail di proteasi neutra ed elastasi (0,5 mg/mL ciascuno; 1 h a 37 gradi centigradi) seguito da collagenase di tipo I (0,5 mg/mL; 2,5 min) | 6,7 | |
| Delicato raschiamento meccanico di una regione di 5-cm2 situata nella parete interna dell'aorta toracica discendente | 11 Del sistema di | |
| Na | 17 mi lato | |
| Na | 3 (COM del nome | |
| Collagenase tipo IA (1 mg/mL) per 14 min a 37 gradi centigradi | 8 (IN vio | |
Tabella 3: Metodologia per studiare i canali ionici meccanosensibili utilizzando tecniche elettrofisiologiche.
Discussione
Il sistema vascolare è costantemente esposto a forze emodinamiche attive, che attivano canali ionici meccanosensitive3,22 ma i ruoli fisiologici di questi canali nella mechanotransduzione indotta da stress di taglio sono solo cominciando ad emergere4,6,8. I meccanismi responsabili della meccanosensibilità dei canali attivati dallo stress di taglio rimangono sconosciuti. Il protocollo qui descritto descrive il metodo per l'indagine diretta dei canali ionici meccanosensibili esposti allo stress da taglio laminare in tempo reale.
La fase critica ed essenziale di questo protocollo è l'uso di una camera a flusso a piastra parallela modificata che ha aperture strette per consentire a una pipetta elettrofisiologica di essere abbassata nella camera e accedere alle cellule sotto il flusso. Il principio generale di questo dispositivo è che se le aperture sono abbastanza strette, lo stress fisiologico di taglio (fino a 15 dyn/cm2) può essere raggiunto senza overflow della soluzione a causa delle forze di tensione superficiale10. Al fine di eseguire con successo questi esperimenti, è fondamentale: (i) alle cellule di semi nell'area della piastra inferiore che si trova direttamente sotto le aperture; ii) stabilire un sigillo giga-ohm prima dell'inizio del flusso o durante un flusso di fondomolto lento (<0.01 dyn/cm 2); (iii) mantenere un sigillo stabile mentre aumenta il flusso. Le dimensioni dell'apparato acrilico a quattro pezzi utilizzato nel nostro laboratorio sono fornite insieme a schemi dettagliati (Figura 1) in modo che la camera di flusso e il sistema di flusso MPP (Figura 2) possano essere replicati per l'uso in qualsiasi indagine di laboratorio canali ionici meccanosensibili. Queste dimensioni possono anche essere modificate per aumentare l'area semidata dalle celle e per modificare l'altezza del canale di flusso, che cambierebbe la relazione tra la portata e la sollecitazione di taglio. Una diminuzione dell'altezza della camera di flusso comporterebbe una maggiore sollecitazione di taglio per la stessa portata, che potrebbe essere utile per ottenere sollecitazioni di taglio più elevate. La camera può anche essere modificata per includere una barriera di separazione del flusso che induce una regione locale di ricircolo del flusso disturbato23.
I principali vantaggi derivanti dall'utilizzo della camera di flusso MPP includono (1) l'analisi in tempo reale dei canali ionici attivati dalla cesoia provenienti da cellule endoteliali nella coltura e nelle cellule appena isolate dal tessuto vascolare, (2) l'esposizione delle cellule e la risposta dello ione meccanosensibile canali a livelli fisiologicamente rilevanti di sollecitazione di taglio, e (3) facile assemblaggio e smontaggio con opzioni di perfusione per la sperimentazione. Per quanto riguarda gli altri metodi esistenti, l'unico altro metodo che consente di eseguire registrazioni elettrofisiologiche sotto stress di taglio ben definito è la semina delle cellule all'interno di un'estremità capillare e l'inserimento della pipetta di registrazione nell'apertura capillare, come è stato fatto nei primi studi3,22. Ci sono, tuttavia, molteplici svantaggi rispetto al metodo qui descritto, come la difficoltà di semirelare le cellule in capillari, l'accesso a un numero molto piccolo di cellule che sono abbastanza vicine all'estremità capillare per la pipetta per essere in grado di raggiungerli, e disturbi del flusso alla fine del canale di flusso (in questo caso capillari). Ciascuno di questi svantaggi rende difficile eseguire l'elettrofisiologia in flusso nelle cellule coltivate nell'apertura capillare e praticamente impossibile da correggere o anche le cellule di semi appena isolate dalla vascolatura. È anche impossibile introdurre un passo per generare un'area di flusso disturbato. Tutti gli altri metodi esistenti che impiegano camere aperte24,25 o soluzioni di sbuffare direttamente su una cella17,18 non imitano l'ambiente emodinamico nel vaso sanguigno.
La limitazione principale di questo metodo, tuttavia, è un vincolo per raggiungere lo stress di taglio a livelli più elevati della gamma fisiologica. In particolare, i livelli di stress fisiologico di taglio sono stati stimati per raggiungere fino a 70 dyn/cm2 nelle arterie sane26. Al contrario, il più alto livello di sollecitazione di taglio che potremmo raggiungere nell'attuale configurazione della camera era 15 dyn/cm2, dopo di che le forze di tensione superficiale diventano sufficienti per impedire la soluzione di fuoriuscire dalle aperture10. È possibile che la riduzione dell'altezza del canale di flusso consenta di raggiungere livelli di sollecitazione di taglio più elevati. Mantenere una guarnigione giga-ohm stabile sotto stress di taglio elevato è un'altra sfida, ma il tasso di successo è ragionevole con la pratica. Abbiamo scoperto che l'uso della tecnica di patch perforata (compresa l'antibiotic amphotericina B nella soluzione pipetta come descritto sopra) produce registrazioni più stabili rispetto alla configurazione standard di cellule intere. Inoltre, la camera di flusso MPP e le soluzioni utilizzate non replicano esattamente la cesoia del flusso sanguigno nelle arterie. Il sangue è un liquido viscoso e non newtoniano che non abbiamo replicato nei nostri esperimenti in vitro. Inoltre, la camera utilizzata qui è una camera parallela, mentre lo stress di taglio nelle arterie è meglio calcolato utilizzando la formula per la cesoia in un cilindro.
Esistono importanti considerazioni e limitazioni per l'esecuzione di registrazioni a canale singolo in flusso. Questo metodo è appropriato per una configurazione collegata alle cellule (pipetta attaccata alla membrana di una cellula intatta), che produce guarnizioni stabili. È fondamentale però essere consapevoli del fatto che i singoli canali la cui attività viene registrata non sono direttamente esposti allo stress di taglio perché sono schermati dalla pipetta di registrazione, soprattutto nella configurazione inside-out27. Crediamo che le configurazioni delle patch eccitate non siano le più affidabili quando utilizzate per testare la sensibilità dei canali ionici a fluire perché la membrana eccitata viene in genere tirata nella pipetta di registrazione e quindi non è esposta a un flusso ben definito.
In termini di tipo di cellule che possono essere utilizzate in questi esperimenti, le cellule endoteliali vascolari rappresentano il tipo di cellula più applicabile allo studio dello stress da taglio e dei canali meccanosensibili. Studi precedenti si sono concentrati principalmente sulle cellule endoteliali coltivate3,28 che sono facilmente disponibili. Abbiamo testato ed esteso l'uso di questo metodo alle cellule endoteliali appena isolate dalle arterie di resistenza al topo6,7. Altri tipi di cellule dovrebbero assolutamente essere considerati. Le cellule muscolari lisce vascolari, ad esempio, possono essere esposte allo stress da taglio durante gli stati della malattia in cui l'endotelio è stato danneggiato e rimosso29,30. Questo rappresenta un'area di studio intrigante in cui i canali meccanosensibili che risiedono in un muscolo liscio, che altrimenti non sarebbe influenzato dallo stress di taglio, ora contribuirebbero a meccanismi di malattia potenzialmente fisiologici. Inoltre, la trafezione di linee cellulari del veicolo come HEK o CHO con il gene che codifica il canale di interesse è un'ottima piattaforma per le analisi biofisiche dei canali in combinazione con l'uso della camera di flusso MPP.
È anche importante notare che, mentre l'intenzione originale per la camera di flusso MPP era per l'indagine in tempo reale della meccanoattivazione del canale ionico, l'applicazione del dispositivo può estendersi oltre questo obiettivo. In particolare, lo stesso approccio può essere utilizzato per studi che utilizzano sensori di elettrodi, come un sensore di ossido nitrico (NO) per determinare il rilascio di NO in risposta allo stress da taglio. Pertanto, forniamo una metodologia generalizzata per coloro che sono interessati a studiare in tempo reale processi biologici regolati meccanicamente e promuoviamo un'ulteriore modifica della camera MPP per soddisfare esigenze di ricerca specifiche per coloro che studiano processi meccanosensibili in una varietà di campi.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dal National Heart, Lung, and Blood Institute (R01 HL073965, IL) e (T32 HL007829-24, ISF). Gli autori vorrebbero anche riconoscere il negozio di macchine scientifiche presso l'Università dell'Illinois a Chicago per aver generato le nostre ultime camere a flusso MPP.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.2 µm sterile syringe filters | VWR | 28145-501 | Used for filtering electrophysiolgoical pipette solution |
| 5 grade forceps | Fine Scientific Tools | 1252-30 | Used for transferring digested arteries to fresh solution |
| 9" Pasteur Pipet | Fisher Scientifc | 13-678-20D | Used for mechanically disrupting digested arteries and transferring freshly isolated endohtelial cells |
| 12 mm diameter Cover glass circles | Fisher Scientifc | 12-545-80 | For use with studies involving cultured cells and multiple treatments. Cells adhered to the cover glass are used for patch clamp analyses |
| 24 mm x 40 mm Rectangluar Cover glass | Sigma-Aldrich | CLS2975224 | Cover glass to be added to MPP flow chamber pieces C (Figure 1) |
| 24 mm x 50 mm Rectangular Cover glass | Sigma-Aldrich | CLS2975245 | Cover glass to be added to MPP flow chamber E (Figure 1) |
| 20 G syringe needles | Becton Dickinson and Co | 305175 | For use in mechanical disruption of digested mesenteric arteries |
| 35 mm Petri dish | Genesee Scientific | 32-103 | For use in mechanical disruption of digested mesenteric arteries |
| Amphotericin B solubilized | Sigma-Aldrich | A9528-50MG | Used for generating the perforated whole-cell patch configuration. |
| Collagenase, type I | Worthington Biochemical | 100 mg - LS004194 | Enzyme used in our laboratory as a brief digestion following the initial cocktail of neutral protease and elastase |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientifc | 67-68-5 | Solvent for Amphotericin B used in perforated whole-cell patch clamp |
| Elastase, lyophilized | Worthington Biochemical | 25 mg - LS002290 | Enzyme used in our laboratory in a cocktail with neutral protease/dispase to begin digestion of arteries for endothelial cell isolation. |
| Falcon Tissue culture Plate, 6-well, Flat Bottom with Low Evaporation Lid | Corning | 353046 | For use with studies involving cultured cells and multiple treatments |
| Neutral protease/dispase | Worthington Biochemical | 10 mg- LS02100 50 mg - LS02104 | Enzyme used in our laboratory in a cocktail with elastase to begin digestion of arteries for endothelial cell isolation |
| SylGard | World Precision Instruments | SYLG184 | Silicone elastomer for adhering the rectangular cover slip to the MPP flow chamber pieces C and E (Figure 1) |
| Tygon ND 10-80 tubing | Microbore Tubing | AAQ04133 | ID: 0.05 in, OD: 0.09 in, inlet perfusion tubing for adminsitering flow to the chamber |
Riferimenti
- Green, D. J., Hopman, M. T., Padilla, J., Laughlin, M. H., Thijssen, D. H. Vascular Adaptation to Exercise in Humans: Role of Hemodynamic Stimuli. Physiological Reviews. 97 (2), 495-528 (2017).
- Gimbrone, M. A., Topper, J. N., Nagel, T., Anderson, K. R., Garcia-Cardena, G. Endothelial dysfunction, hemodynamic forces, and atherogenesis. Annals of the New York Academy of Sciences. 902, 230-239 (2000).
- Olesen, S. P., Clapham, D. E., Davies, P. F. Haemodynamic shear stress activates a K+ current in vascular endothelial cells. Nature. 331 (6152), 168-170 (1988).
- Barakat, A. I., Lieu, D. K., Gojova, A. Secrets of the code: do vascular endothelial cells use ion channels to decipher complex flow signals?. Biomaterials. 27 (5), 671-678 (2006).
- Beech, D. J. Endothelial Piezo1 channels as sensors of exercise. Journal of Physiology. 596 (6), 979-984 (2018).
- Ahn, S. J., et al. Inwardly rectifying K(+) channels are major contributors to flow-induced vasodilatation in resistance arteries. Journal of Physiology. 595 (7), 2339-2364 (2017).
- Fancher, I. S., et al. Hypercholesterolemia-Induced Loss of Flow-Induced Vasodilation and Lesion Formation in Apolipoprotein E-Deficient Mice Critically Depend on Inwardly Rectifying K(+) Channels. Journal of the American Heart Association. 7 (5), (2018).
- Rode, B., et al. Piezo1 channels sense whole body physical activity to reset cardiovascular homeostasis and enhance performance. Nature Communications. 8 (1), 350 (2017).
- Li, J., et al. Piezo1 integration of vascular architecture with physiological force. Nature. 515 (7526), 279-282 (2014).
- Levitan, I., Helmke, B. P., Davies, P. F. A chamber to permit invasive manipulation of adherent cells in laminar flow with minimal disturbance of the flow field. Annals of Biomed Engineering. 28 (10), 1184-1193 (2000).
- Fang, Y., et al. Hypercholesterolemia suppresses inwardly rectifying K+ channels in aortic endothelium in vitro and in vivo. Circulation Research. 98 (8), 1064-1071 (2006).
- Shetty, S., Weston, C. J., Adams, D. H., Lalor, P. F. A flow adhesion assay to study leucocyte recruitment to human hepatic sinusoidal endothelium under conditions of shear stress. Journal of Visualized Experiments. (85), e51330 (2014).
- Man, H. S. J., et al. Gene Expression Analysis of Endothelial Cells Exposed to Shear Stress Using Multiple Parallel-plate Flow Chambers. Journal of Visualized Experiments. (140), e58478 (2018).
- White, L. A., et al. The Assembly and Application of 'Shear Rings': A Novel Endothelial Model for Orbital, Unidirectional and Periodic Fluid Flow and Shear Stress. Journal of Visualized Experiments. (116), e54632 (2016).
- Franzoni, M., et al. Design of a cone-and-plate device for controlled realistic shear stress stimulation on endothelial cell monolayers. Cytotechnology. 68 (5), 1885-1896 (2016).
- Dewey, C. F., Bussolari, S. R., Gimbrone, M. A., Davies, P. F. The dynamic response of vascular endothelial cells to fluid shear stress. Journal of Biomechanical Engineering. 103 (3), 177-185 (1981).
- Hoger, J. H., Ilyin, V. I., Forsyth, S., Hoger, A. Shear stress regulates the endothelial Kir2.1 ion channel. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7780-7785 (2002).
- Moccia, F., Villa, A., Tanzi, F. Flow-activated Na(+)and K(+)Current in cardiac microvascular endothelial cells. Journal of Molecular and Cellular Cardiology. 32 (8), 1589-1593 (2000).
- Crane, G. J., Walker, S. D., Dora, K. A., Garland, C. J. Evidence for a differential cellular distribution of inward rectifier K channels in the rat isolated mesenteric artery. Journal of Vascular Research. 40 (2), 159-168 (2003).
- Hannah, R. M., Dunn, K. M., Bonev, A. D., Nelson, M. T. Endothelial SK(Ca) and IK(Ca) channels regulate brain parenchymal arteriolar diameter and cortical cerebral blood flow. Journal of Cereberal Blood Flow and Metabolism. 31 (5), 1175-1186 (2011).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of Visualized Experiments. (59), e3349 (2012).
- Lieu, D. K., Pappone, P. A., Barakat, A. I. Differential membrane potential and ion current responses to different types of shear stress in vascular endothelial cells. American Journal of Physiology-Cell Physiology. 286 (6), C1367-C1375 (2004).
- Le Master, E., et al. Proatherogenic Flow Increases Endothelial Stiffness via Enhanced CD36-Mediated Uptake of Oxidized Low-Density Lipoproteins. Arteriosclerosis, Thrombosis, and Vascular Biology. 38 (1), 64-75 (2018).
- Kim, J. G., et al. Measurement of Ion Concentration in the Unstirred Boundary Layer with Open Patch-Clamp Pipette: Implications in Control of Ion Channels by Fluid Flow. Journal of Visualized Experiments. (143), e58228 (2019).
- Kim, J. G., et al. Fluid flow facilitates inward rectifier K(+) current by convectively restoring [K(+)] at the cell membrane surface. Scientific Reports. 6, 39585 (2016).
- Malek, A. M., Alper, S. L., Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. Journal of the American Medical Association. 282 (21), 2035-2042 (1999).
- Jacobs, E. R., et al. Shear activated channels in cell-attached patches of cultured bovine aortic endothelial cells. Pflugers Archiv. European Journal of Physiology. 431 (1), 129-131 (1995).
- Barakat, A. I., Leaver, E. V., Pappone, P. A., Davies, P. F. A flow-activated chloride-selective membrane current in vascular endothelial cells. Circulation Research. 85 (9), 820-828 (1999).
- Fitzgerald, T. N., et al. Laminar shear stress stimulates vascular smooth muscle cell apoptosis via the Akt pathway. Journal of Cellular Physiology. 216 (2), 389-395 (2008).
- Ueba, H., Kawakami, M., Yaginuma, T. Shear stress as an inhibitor of vascular smooth muscle cell proliferation. Role of transforming growth factor-beta 1 and tissue-type plasminogen activator. Arteriosclerosis, Thrombosis, and Vascular Biology. 17 (8), 1512-1516 (1997).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon