Method Article
인간에서 태그 생 단백질 유도 만능 줄기 세포를 사용 하 여 CRISPR/Cas9
요약
여기에 설명 된 endogenously 태그 프로토콜 표시 CRISPR/Cas9를 사용 하 여 인간 유도 만능 줄기 세포에 형광 태그와 단백질 이다. 상 편집된 셀 형광 활성화 된 세포 분류에 의해 풍성 하 게 하 고 클론 세포 생성 됩니다.
초록
프로토콜은 프레임 N 또는 C 터미널 형광 태그를 융합 하는 익스프레스 생 단백질 인간 유도 만능 줄기 세포 (hiPSCs)을 생성 하는 데 제공 됩니다. 간결한 CRISPR/Cas9 시스템 (클러스터 정기적으로 interspaced 짧은 구조 반복/CRISPR-관련 9) 감독 homology 수리 (HDR)를 통해 게놈 loci 큰 exogenous 시퀀스를 사용할 수 있습니다. 원하는 노크에 달성,이 프로토콜 사용 하 여 ribonucleoprotein (RNP)-기반 접근 야생 타입 연쇄 상 구 균 pyogenes Cas9 단백질, 합성 2 부 가이드 RNA (gRNA), 및 기증자 템플릿 플라스 미드를 통해 세포에 전달 됩니다 electroporation입니다. 붙일 태그가 단백질을 표현 하기 편집된 셀 정렬 (FACS) 형광 활성화 된 세포에 의해 농축 됩니다. 클론 라인 다음 생성 하 고 정확한 편집 결과 대 한 분석 될 수 있다. 관심사의 유전자의 genomic 소재 시에 형광 태그를 도입 하 여 결과 subcellular 지 방화 및 융해 단백질의 역학 공부 될 수 있다 통제 생 규정, 재래식 overexpression에 핵심 개선 시스템입니다. 유전자 태그를 위한 모델 시스템으로 hiPSCs의 사용 2 중, nontransformed 셀에 태그 단백질을 공부 하는 기회를 제공 합니다. 때문에 hiPSCs는 여러 세포 유형으로 분화 될 수 있다,이 이렇게 생성 하 고 다양 한 isogenic 셀룰러 컨텍스트 태그 단백질 연구 기회를 제공 한다.
서문
게놈 편집 전략, 특히 CRISPR/Cas9, 세포질 과정을 공부 하는 사용 되 고 점점 접근 가능 하 고 귀중 한1,2,3,,45, 6 , 7. CRISPR/Cas9의 많은 응용 프로그램 중 하나는 유전자 또는 단백질 제품8의 활동에 대 한 기자 역할을 다음 특정 게놈 loci GFP 등 대형 세 시퀀스의 (감독 homology 수리 (HDR))를 통해 소개 . 이 기술은 결과 endogenously 규제 융해 단백질 subcellular 지 방화 및5 관심사의 단백질의 역학 관계를 시각화 하기 위해 사용 될 수 있는 생 열려있는 독서 프레임 형광 단백질 시퀀스에 참여를 사용할 수 있습니다. ,,69,,1011. Endogenously 태그 단백질 overexpression 시스템에 비해 많은 혜택을 제공, 큰 시퀀스 인간 게놈으로 삽입은 일반적으로 요구 하는 선택 또는 농축 할 수 있는 세포의 인구를 전략 하는 비효율적인 프로세스 수 쉽게 공부5,12.
이 프로토콜 원하는 genomic 소재 시에 형광 성 단백질 (FP) 인코딩 DNA 순서의 삽입을 설명 합니다. 프로토콜 설계 및 기증자 템플릿 플라스 미드 및 ribonucleoprotein (RNP) 복잡 한 (야생 타입 S. pyogenes Cas9 단백질 합성 CRISPR RNA (crRNA)와 트랜스 활성화 crRNA (tracrRNA)와 함께) 전달 포함 됩니다. 또한 형광 활성화 셀 정렬 (FACS)와 클론 셀 라인 생성 프로세스를 통해 상 편집 된 셀의 농축이입니다. 날짜 하려면,이 메서드 hiPSC 라인 monoallelic 또는 25 단백질 주요 세포질 구조를 나타내는 라벨 (거의) bi 유전자 녹색 형광 단백질 (GFP) 태그를 생성 하기 위해 사용 되었습니다. 이러한 노력에서 결과 편집된 셀으로 예상된 유전자 삽입을가지고, 제대로 로컬라이제이션 융해 단백질 pluripotency 및 안정적인 karyotype12 (및 되지 않은 데이터) 확인 되었습니다 했다. 이 방법은 또한 여러 다른 생성 하 사용 된 단일 및 듀얼 (2 개의 다른 단백질 같은 셀 태그) 편집 hiPSCs (되지 않은 데이터)의 인구.
많은 기존의 셀 라인와 달리 그들은 2 중, karyotypically 안정, 비 변형, 증식 하기 때문에 건강 한 기증자에 게 서 파생 된 인간의 Ipsc 이러한 게놈 편집 노력에 대 한 선정 됐다. 이러한 속성은 근본적인 세포 생물학 및 질병 모델링을 공부에 대 한 매력적인 모델을 제공 합니다. 또한, hiPSCs의 감 별 법 잠재력 다양 한 계보와 세포 유형 organoids, 조직 및 "접시에 질병" 모델13 포함 하 여 isogenic 셀을 사용 하 여 동시에 여러 발달 단계를 공부 하는 기회 제공 ,,1415. 이 프로토콜은 hiPSCs (911 무역 선)를 위해 개발 되었다, 그러나 그것 수 있습니다 다른 포유류 세포 선을 사용 하 여 프로토콜의 개발에 대 한 유익.
프로토콜
1. 실리콘에 crRNA 및 기증자 템플릿 플라스 미드의 위한 FP 노크-에서 디자인
- NCBI16 주석된 참조 시퀀스 또는 UCSC 게놈 브라우저17 (예: 은행 서식) 관심사의 유전자의을 선택의 생물 정보학 소프트웨어 가져올 합니다. 호스트 게놈 시퀀스 참조 상대 변형을 포함으로 알려져, 경우 지금으로 생물 정보학 소프트웨어에서 참조 순서 조정 등 (내용 참조).
- 원하는 FP 삽입 사이트를 찾습니다. C 터미널 태그 사이 마지막 마지막 codon의 정지 codon의 1 루 FP 태그에 대 한 순서를 소개 합니다. N-터미널 태그, FP 태그에 대 한 시퀀스는 일반적으로 사이 마지막 시작 codon의 다음 codon의 1 루 도입 된다. 너무 오랫동안 프레임에 계속 때 시작 codon 단일 codon 엑손은 단백질 종점 근처 신호 순서 있는 등 어떤 경우에 원하는 FP 삽입 사이트 더 3ʹ 위치에 위치한 있습니다.
- 원하는 삽입 사이트 공개 crRNA 디자인 도구에 대 한 입력된 시퀀스의 양쪽에 사용 50 bp. 2-4 crRNA 목표는 삽입 사이트 근처 식별 됩니다, 일단 주석을 crRNA 바인딩 사이트 및 protospacer 인접 한 모티브 (PAM) 시퀀스 (NGG) 생물 정보학 소프트웨어. 이 crRNAs (crRNA 디자인에 대 한 자세한 지침에 대 한 내용 참조) 두 배 좌초 휴식을 유도 하 사용 됩니다.
참고: 사용자 정의 crRNA 시퀀스 상업적인 공급 업체 (권장), 합성에 대 한 제출 또는 시퀀스 복제 또는 생체 외에서 종합 전략,이 프로토콜의 범위를 디자인 하는 시작 지점으로 사용할 수 있습니다 (토론을 참조 하십시오. ). - 기증자 템플릿 플라스 미드를 시작, 5ʹ 상 동 팔 (N 맨끝 삽입에 대 한 시작 codon 포함 됩니다), 원하는 삽입 사이트의 상류 순서의 1 kb를 사용 하 고는 3ʹ로 원하는 삽입 위치의 하류 순서의 1 kb를 사용 하 여 상 동 팔 (단자 삽입에 대 한 정지 codon 포함 됩니다). 두 상 동 팔 사이 베이스는 일반적으로 생략 하지. 상 동 팔에 셀 라인 특정 이체를 포함 하 여이 유전자 이체 결과 편집된 셀에 유지 됩니다.
- 두 상 동 팔 사이 삽입 FP (또는 다른 노크 시퀀스)에 대 한 시퀀스 및 링커 순서 (링커에 대 한 자세한 지침에 대 한 논의 참조). N 맨끝 태그, 링커 순서 이어야 합니다 직접 FP; 3ʹ C-터미널 태그, 링커 순서 직접 FP의 5ʹ 이어야 합니다.
- 기증자 시퀀스의 Cas9 절단을 방지 하기 위해 기증자 템플릿 플라스 미드에 crRNA 바인딩 사이트 중단 (crRNA 바인딩 사이트를 변경 하는 때 토론을 고려 사항에 대 한 참조). 가능 하면 NGG 또는 잔소리 시퀀스에 PAM의 것이 좋습니다. 또는, 점 돌연변이 소개 하는 crRNA (PAM에 인접 10 기지)의 씨앗 지역에 3 개의 기초를 충분히 crRNA 바인딩을 방해 전망 이다. 일부 crRNA 바인딩 사이트에 기증자 템플릿 플라스 미드; FP 시퀀스의 소개에 의해 혼란 된다 팸, 또는 그대로 바인딩 영역도 이러한 경우에 존재를 확인 합니다.
참고: 기증자 템플릿 플라스 미드 실리콘에 상용 공급 업체에서 유전자 합성에 제출 하거나이 프로토콜의 범위를 넘어 복제 전략을 디자인 하는 시작 지점으로 사용할 수 있습니다. PUC19 또는 pUC57 같은 간단한 백본 충분 하다.
2. ribonucleoprotein (RNP) Transfection CRISPR/Cas9 중재 노크-에서 hiPSCs에 대 한
참고:이 프로토콜에 'gRNA' 용어 설명 합성 crRNA 및 tracrRNA 제대로 다시 중단, 계량, 및 제조 업체의 지시 당 사전 complexed ( 재료의 표참조). 1%로 모든 미디어를 보충 페니실린 스. 911 무역 센터 hiPSC 라인의 일반적인 자란 지침 알 렌 셀 탐색기18,19에 자세히 설명 되어 있습니다. 911 무역 센터 hiPSCs는이 프로토콜에서 사용 되지만 사용 적절 한 transfection 최적화, RNP의 electroporation 그리고 기증자 템플릿 플라스 미드는 다른 세포 유형에 성공적으로 적응 될 수 있습니다.
- GRNA 및 야생 유형 S. pyogenes Cas9 단백질2,20; 10 µ M 일 주식을 준비 얼음에 계속. 1 µ g / µ L 기증자 템플릿 플라스 미드;의 작업 준비 실 온 (RT)에서 계속. PH 8.0 테 버퍼를 사용 하 여 모든 희석에 대 한.
- 잘 당 10 µ M 바위 억제제 (Ri) 보충 하는 신선한 성장 매체의 5 mL와 매트릭스 코팅 6 잘 조직 배양 접시를 준비 합니다. 미디어와 함께 접시 인큐베이터에서 37 ° C, 5% CO2 까지 계속 준비 플레이트 세포 transfection 절차 (최대 2 시간) 후.
참고:이 프로토콜에서 사용 하는 모든 매트릭스 코팅 접시 얼음 Matrigel 양의 희석 1:30 알 렌 연구소에 따르면 감기 DMEM/F12 미디어에 세포 과학의 프로토콜에 대 한 911 무역 hiPSC 선19경작에 대 한 추가 하 여 만들어집니다. - 테이블의 자료에서 권장 하는 대로 부드러운 단일 셀 분리 시 약을 사용 하 여, 자동화 된 셀 카운터, 또는 hemocytometer를 사용 하 여 단일 셀 펜션과 count 셀으로 hiPSCs 통행.
참고: 여기 사용 WTC hiPSC 라인에 대 한 상세한 프로토콜19알 렌 셀 탐색기 찾을 수 있습니다. 짧게, 한 번 RT DPBS 셀을 세척 하 고 분리 시 약 3-5 분에 대 한 치료. 다음 triturate 셀 단일 셀 서 스 펜 션으로 부드러운 pipetting 및 펠 릿에 의해 원심 분리에 의해. 10 µ M Ri 보충 성장 미디어에서 라이브 셀 펠 릿을 resuspend.- 별도 1.5 mL 튜브에 페를 각 실험 조건에 대 한6 셀 1.84 x 10의 약 수를 준비 합니다.
참고: 모든 볼륨 2.3 반응 시간 100 µ L electroporation 볼륨에서 4.5 µ L 총 반응 볼륨에 대 한 계산 됩니다. 이 계정 중복 transfection를 pipetting 오류에 대 한 과잉.
- 별도 1.5 mL 튜브에 페를 각 실험 조건에 대 한6 셀 1.84 x 10의 약 수를 준비 합니다.
- 10 µ M gRNA의 2.88 µ L 10 µ M의 2.88 µ L을 추가 하 여 각 실험 조건에 대 한의 ribonucleoprotein (RNP) 복잡 한 튜브 준비 1.5 mL 튜브에 Cas9. 최소 10 분 (최대 1 시간)에 대 한 RT에서 품 어.
- 한 셀 aliquot (단계 2.3.1에서에서 준비) 실시간 Aspirate 상쾌한에 3 분 동안 211 x g에서 펠 렛 및 제조업체의 electroporation 버퍼의 220 µ L에서 셀 펠 릿 resuspend.
- 2.4 단계에서 준비 1.5 mL RNP 복잡 한 관으로 2.5 단계에서 resuspended 셀의 220 µ L를 추가 합니다.
- 2.4 단계에서 준비 1.5 mL 튜브에 1 µ g / µ L 기증자 템플릿 플라스 미드의 4.60 µ L를 추가 합니다.
- 다음 혼합 튜브 내용을 2-3 번, nucleofection 팁 및 피 펫 사용 준비 electroporation 장치에 서 스 펜 션의 100 µ L를 전송 합니다. 에 있는 모든 거품을 소개 하지 마십시오. 1300 V 30 ms의 1 펄스에 대 한 적용 됩니다.
- 부드럽게 단계 2.2 소용돌이 모션에서에서 준비 6 잘 플레이트에 정지를 전송. 부드럽게 접시 사이드-투-사이드 앞-뒤로 이동 하 여 세포를 분산.
- 새로운 nucleofection 팁을 사용 하 여, 준비 6 잘 플레이트의 두 번째 음에 서 스 펜 션 및 전송의 나머지 100 µ L와 2.8-2.9 단계 반복 합니다.
- 각 조합에 대해 gRNA 및 기증자 템플릿 플라스 미드, 비를 대상으로 gRNA, 기증자 템플릿 플라스 미드, 버퍼만 컨트롤 등 2.4 2.10 통해 단계를 반복 합니다. 교차 오염을 피하기 위해 피 펫 및 nucleofection 팁을 변경 하는 것을 주의.
- 37 ° C, 5% CO2에서 transfected 세포를 품 어. 일반 성장 미디어 (아니 리)에서 24 h, 미디어를 변경 하 고 계속 먹이 hiPSCs 72 96 h, confluency 모니터링에 대 한 모든 24 h. HiPSCs 60-80% 합류에 도달, 3 단계로 진행 합니다.
참고: 무거운 세포 죽음 (> 70%, 추정)는 보통 24-48 h transfection 후.
3. 편집 하기 hiPSCs의 FACS-농축
참고: 줄기 세포를 정렬할 때 토론에 제안으로 세포 생존을 촉진 하도록 악기 설정을 적응. 간단히, 사용 가능한 가장 큰 노즐 (130 µ m), 낮은 유량 (≤ 24 µ L/min), 방부 제-무료 칼 집 액체 (염 분, 같은 재료의 표참조), 그리고 낮은 샘플 압력 (10 psi).
- FACS 실험 하기, 미디어 성장 매체 10 µ M Ri와 보완을 변경 하 고 FACS 후 생존을 촉진 셀 2-4 h 37 ° C, 5% CO2 를 품 어.
- 테이블의 자료에서 권장 하는 대로 부드러운 단일 셀 분리 시 약을 사용 하 여, 10 µ M 리19보충 성장 매체에 단일 셀 서 스 펜 션에 hiPSCs 통로.
- 폴리스 티 렌 라운드 바닥 튜브 hiPSC 정지 35 µ m 메쉬 필터를 통해 필터링.
- 파편 및 남자를 앞으로 분산형 및 사이드 분산형 (를 포함 하 여 높이 와 너비)를 사용 하 여 셀을 정렬 합니다. 라이브 사용, 버퍼 제어 셀 FP 양성 게이트를 설정 하는 < 버퍼만 셀의 0.1%에 속하는 문.
- 정렬의 FP 전체 인구 포함 된 0.5 2 1.5-15 mL 폴 리 프로필 렌 튜브에 세포 보충 10 µ M Ri RT 성장 매체의 mL.
참고: 폴 리 프로필 렌 플라스틱에 세포 접착을 위한 잠재력을 감소 시킨다. - 실시간에 3 분 동안 211 x g에서 수집 된 세포를 원심
- 신중 하 게 상쾌한 발음 하 고 셀 펠 릿 10 µ M Ri 보충 성장 매체의 200 µ L에서 resuspend. 신선한 매트릭스 코팅 96 잘 접시19의 단일 잘 최대 3000 정렬된 셀 전송.
참고: 적절 한 악기 설정, 셀도 정렬할 수 있습니다 (대량) 매트릭스 코팅 96-잘 조직 문화 접시 잘 당 1000-3000 셀의 권장된 조밀도에 10 µ M Ri 보충 성장 매체의 200 µ L을 포함 하는 단일 잘에 직접 hiPSC에 대 한. - 37 ° C, 5% CO2에서 정렬된 셀을 품 어. 24 시간에 5 µ M Ri 보충 성장 미디어를 미디어를 변경 합니다. 48 h에 먹이 셀 일반 성장 매체 (Ri) 72-96 h, confluency 모니터링에 대 한 24 시간 마다 시작 합니다. 생존 율 후 FACS 500 셀의 최소 96 잘 접시의 한 잘에 시드는 경우 50% 보다 큰 것으로 추정 된다
- 때 hiPSCs 60-80% 합류를 도달 하 고 성숙한 형태 (부드러운, 잘 포장 된 식민지 센터), 24-잘 접시 등 다음 24-잘 접시에서 더 큰 형식 격판덮개로는 통로 6 잘 플레이트에 표시.
- 6 잘 플레이트에 hiPSCs 60-80% 합류를 도달 하 고 성숙한 결과 형태학, 100 mm 접시에 확장, 다시 영상에 대 한 접시, cryopreserve, 또는 클론 따기 밀도 (4 단계)19에서 씨앗.
4. 생성 하기 편집 클론 hiPSC 라인
- 테이블의 자료에서 권장 하는 대로 부드러운 단일 셀 분리 시 약을 사용 하 여, 단일 셀 서 스 펜 션에 hiPSCs를 통과 하 고 mL19당 셀의 수를 결정 합니다.
- 편집 된 인구의 성장 매체를 사용 하 여 신선한 매트릭스 코팅 100 m m 조직 문화 접시에 hiPSCs의 씨앗 10000 셀 리1910 µ M와 보충. 시드, 후 리 24 h 없이 성장 미디어 미디어를 변경 하 고 신선한 성장 미디어 마다 24 시간 hiPSCs 5-7 일에 대 한 피드.
- HiPSCs 거시적 표시 되는 식민지를 형성 하는 때 (약 500 µ m) 그들은 격리 수 있습니다. 초과 매트릭스 발음 잘19당 10 µ M Ri 보충 성장 매체의 100 µ L을 추가 하 여 행렬 코팅 96 잘 접시를 준비 합니다.
- 해 현미경 사용을 P-200 피 펫, 또는 유사한, 부드럽게 긁어와 플레이트 표면에서 개별 식민지 발음. 볼륨을 전송 (20 ~ 100 µ L) 포함 하는 준비 단계 4.3에서에서 96 잘 접시의 단일 우물에 식민지.
- 모든 식민지를 전송 후 37˚C와 5% CO2조직 문화 인큐베이터에 접시를 품 어. 일반 성장 미디어 (아니 리)에서 24 h, 미디어를 변경 하 고 먹이 셀 72 96 h에 대 한 모든 24 h 식민지는 약 3 배 크기 (약 1500 µ m) 때까지 계속.
참고: crRNA는 transfection에 사용 당 24-96 식민지를 따기 것이 좋습니다. 격리 된 클론의 생존은 일반적으로 보다 큰 95%.
- 모든 식민지를 전송 후 37˚C와 5% CO2조직 문화 인큐베이터에 접시를 품 어. 일반 성장 미디어 (아니 리)에서 24 h, 미디어를 변경 하 고 먹이 셀 72 96 h에 대 한 모든 24 h 식민지는 약 3 배 크기 (약 1500 µ m) 때까지 계속.
- 테이블의 자료에서 권장 하는 대로 부드러운 단일 셀 분리 시 약을 사용 하 여, 통행 hiPSC 복제 새로운 매트릭스 코팅 96 잘 접시에 같이19.
- 8 채널 흡 인기를 사용 하 여 제거 하 고 96 잘 접시의 첫 번째 열에서 미디어를 삭제.
- P-200 멀티 채널 피 펫을 사용 하 여 셀을 씻어 96 잘 접시의 첫 번째 열에 DPBS의 ~ 200 µ L를 추가 합니다. 8 채널 흡 인기를 사용 하 여 제거 하 고 폐기 DPBS 세척 96 잘 접시의 첫 번째 열에서.
- P-200 멀티 채널 피 펫을 사용 하 여, 96 잘 접시의 첫 번째 열을 분리 시 약의 40 µ L를 추가 합니다.
- 6 열 하지 교차 오염 우물 확실히 팁 변경 96 잘 접시의 총에 대 한 단계 4.5.1-4.5.3를 반복 합니다. 분리 시 약 (4.5.3 단계)의 첫 번째 열에 추가 된 시간에서 3-5 분 동안 37 ° C 배양 기에서 접시를 놓습니다.
참고:이 좋습니다 유일한 통로에 최대 6 열 (48 우물)이이 단계를 수행 하는 데 걸리는 시간이 한 번에. 처음으로이 프로토콜을 수행할 때만 한 번에 하나 또는 두 개의 열을 뿌리고 시작. Passaged 한 번에 열 수를 제한 하면 세포는 hiPSCs에 해가 될 수 있는 너무 오랫동안 분리 시에 빠지지 않고. - 접시의 첫 번째 열에 있는 셀 접시 바닥에서 상승 하기 시작 했습니다를 사용 하 여 P-200 멀티 채널 피 펫 DPBS의 160 µ L 96 잘 접시의 첫 번째 열을 추가 하 고 부드럽게 "12:00" 셀 triturate "3:00", "6:00", 및 "9:00"의 각 위치. V-하단 96 잘 접시에 세포 현 탁 액 (200 µ L)의 전체 볼륨을 전송.
- 4.5.5 단계를 반복 하는 그들에 있는 분리 시 셀의 남은 열에 대 한 팁 하지 교차 오염 웰 스로 변경 합니다.
- 실시간에서 3 분 385 x g에서 원심 분리기에 바닥판 V 스핀
- P-200 멀티 채널 피 펫을 사용 하 여, 부드럽게는 상쾌한을 제거 하 고 잘 당 10 µ M Ri와 보충 하는 신선한 성장 매체의 200 µ L에서 세포를 resuspend. 모든 우물, 십자가 오염 하지로 팁을 변경에 대 한 반복 합니다.
- 신선한 매트릭스 코팅 96 잘 접시19셀 서 스 펜 션의 모든 전송. 37 ° C, 5% CO2조직 문화 인큐베이터에 접시를 품 어. 일반 성장 미디어 (아니 리)에서 24 h, 미디어를 변경 하 고 먹이 셀 72 96 h에 대 한 모든 24 h 클론의 대부분 60-80%의 합류를 도달할 때까지 계속.
참고:이 세포 밖으로 확산 하 고 96 잘 접시의 전체 영역에 대 한 더 많은 성장을 허용 수 있습니다.
- 클론을 관찰 하 고 96 잘 접시에 각 개별 복제에 대 한 적절 한 분할 비율을 식별 (예: 1:10, 또는 1:8). 부드러운 단일 셀 분리 시 약을 사용 하 여 재료의 테이블에서에서 제안, 통로 hiPSC 새로운 매트릭스 코팅 96 잘 접시 (단계 4.5.1-4.5.8) 전송에 적합 한 각 복제 세포 현 탁 액의 비율에 복제 합니다. 37˚C, 5% CO2조직 문화 인큐베이터에 접시를 품 어. 일반 성장 미디어 (아니 리)에서 24 h, 미디어를 변경 하 고 먹이 셀 72 96 h에 대 한 모든 24 h 클론의 대부분 60-80% 합류, 도달 하 고 성숙한 형태를 보여줄 때까지 계속.
참고: 각 복제 있을 수 있습니다 다른 분할 비율이 약간 다른 성장 율 또는 이전 통로에서 생존 그래서이 통로 따라 동결 단계에 대 한 각 클론의 당 셀의 수를 정상화 하는 데 도움이. 생존 및 성장의 다양 한 속도로 인해 일부 클론 자라 다 수 있습니다 또는 뿌리고 단계 동안 성장 실패.- 표면에 뜨는 실시간 제거에서 3 분 385 x g에서 V-하단 96 잘 접시에 셀 펜션과 centrifuging 셀 gDNA 격리에 대 한 펠 릿의 나머지를 저장 및 gDNA 절연 96 잘 장비를 사용 하 여 진행 또는 수송과 세포에서-세까지에 대 한 20˚C의 저장 ee 주입니다.
5. cryopreservation 96 잘 접시 형태로 클론 셀 라인의
- 단일 셀 분리 시 약을 사용 하 여, hiPSC 클론 앞에서 설명한 (단계 4.5.1-4.5.7) 통행. P-200 멀티 채널 피 펫을 사용 하 여 상쾌한 발음 하 고 다시 10 µ M Ri 보충 성장 매체의 60 µ L에서 일시 중단. 모든 우물;에 대 한 반복 팁 하지 교차 오염으로 변경 합니다.
- 아닌 매트릭스 코팅된 96-잘 조직 문화 접시에 세포 현 탁 액의 30 µ L를 전송 합니다. 170에 신속 하 게 추가 버퍼 동결 µ L ( 재료의 표참조)을 혼합 하지 않고 각 영역. 여동생으로 서 스 펜 션의 나머지 30 µ L를 전송 하 여 반복 판과 고정 170 µ L을 추가 버퍼.
참고:이 과정에서에서 수행 됩니다 중복 자매 접시 개별 접시 중 하나 녹고 후 존재 하는 셀의 백업 인구를. 모든 다른 열만 96 잘 접시의 cryopreserved 셀을 넣어 더 빨리 녹고 (5.6 단계) 수 있습니다. - 랩 parafilm 접시와 뚜껑 RT 스티로폼 상자에. -80 ° C 냉장고에 전체 상자를 배치 합니다.
- 24 시간 후 접시는 스티로폼 상자 전송 고 최대 4 주 동안에-80˚C 저장 될 수 있습니다.
참고: 셀-80 ° C에 임시로 저장 되는, 동안 유전 품질 관리 분석 수행할 수 gDNA 복제 하 해 동 하 고 또한, 이전에 게시 작업에서 설명한 대로 전파 식별 단계 4.6.1에서에서 얻은 세포에서 수확 12. 짧게, 복사 번호 드롭릿 디지털 PCR 분석 결과 GFP의 하나 또는 두 개의 복사본 및 아무 기증자 템플릿 플라스 미드 백본 통합을 포함 하는 클론을 식별 하기 위해 사용할 수 있습니다. 다음 끝점 PCR 분석 실험 및 생어 시퀀싱의 조합 정확한 삽입을 포함 하는 클론을 식별 합니다. - 해 동, 녹기 얼음 알갱이 대 한 신중 하 게 보고 하는 조직 문화 인큐베이터에서 37 ° C에 전체 접시를 가져. 웰 스는 플레이트의 가장자리에 먼저 녹여 경향이 있다.
- 때 원하는 클론의 아이스 펠 릿은 녹아, 부드럽게 전송 전체 200 µ L 10 µ M Ri와 실시간에 3 분 동안 211 x g에서 원심 분리기 보충 RT 성장 매체의 3 mL를 포함 하는 15 mL 원뿔 튜브
- 상쾌한 발음 하 고 수송과 셀 RT 성장 미디어 10 µ M Ri와 보충의 1 mL에 resuspend. 신선한 매트릭스 코팅 24-잘 접시에 전송 및 37˚C 및 5% CO2에서 품 어. 일반 성장 미디어 (아니 리)에서 24 h, 미디어를 변경 하 고 먹이 셀 72 96 시간 마다 24 시간 복제 60-80 %confluency 고 성숙한 형태19는 때까지 계속.
결과
이 실험의 목표 LMNB1 유전자 (단백질의 N-말단)의 5ʹ 끝을 mEGFP 시퀀스를 도입 하 여 핵 lamin B1 단백질 mEGFP (단위체 향상 된 GFP)를 융합 했다. 마이클 데이비슨 형광 단백질 컬렉션21에서 링커 (아미노산 시퀀스 SGLRSRAQAS)을 이전 cDNA 구문에 따라 선택 되었다. CrRNA 바인딩 지역 각 후보 crRNA에 대 한 기증자 템플릿 플라스 미드에는 mEGFP 및 링커 시퀀스의 실리콘에 삽입 후 중단 되었다, 때문에 아무 지점 돌연변이 잠재적인 crRNA 인식 및 분열에 의해 방해를 만들 필요가 기증자 시퀀스 (그림 1)의 Cas9. 기증자 시퀀스 1 kb homology 팔 mEGFP 링커 시퀀스의 양쪽 측면을 포함. 결과 2,734 bp DNA의 pUC57 등뼈에 복제 했다 시퀀스 확인 하 고 결과 기증자 템플릿 플라스 미드도 없는 맥시 준비를 사용 하 여 순화 되었다. 기증자 템플릿 플라스 미드 및 복잡 한 RNP 페 했다, 상 편집된 셀 풍성 하 게 했다와 mEGFP 핵 lamin B1 융해 단백질의 지 방화는 형광 현미경 검사 법 (그림 2)에 의해 확인 되었다. 비록 두 crRNA 시퀀스 생성 하기 편집된 인구12만 crRNA1 transfection 결과 여기, 설명 합니다.
0.95 %mEGFP-긍정적인 세포 상 편집 대표 셀에 포함 된 페 LMNB1 crRNA1 gRNA, Cas9 단백질, 또는 기증자 템플릿 플라스 미드 electroporation 반응 (버퍼만)에 포함 된, 부정적인 컨트롤에 비해 mEGFP-핵 lamin B1 인구 (그림 3a). 이 결과 효율성 노크에서 이전에 보고 된12이 메서드를 사용 하 여 많은 게놈 loci 관측의 범위 안에 이었다.
MEGFP-긍정적인 세포 FACS에 의해 분리 되었고 라이브 현미경 핵 봉투에 mEGFP 핵 lamin B1 융해 단백질의 예상된 지역화를 확인 하 여 몇 군데. FACS 농축 후 LMNB1 crRNA1 인구에서 정렬된 셀의 약 90% (로 현미경 검사 법에 의해 결정), mEGFP-긍정적인 일부 mEGFP 부정적인 셀 정렬 절차 동안 GFP-긍정적인 세포와 공동 정화를 제안 했다. 이것은 성공적인 편집을 위한 유전자 검사 다음 수 96 클론의 수확에 대 한 허용 농축의 수락 가능한 수준 이었다. 일반적으로, 성공적인 농축 컷오프 50%는 GFP 긍정.
정렬된 셀 인구의 nondividing 세포에 있는 핵 봉투 (핵 주변)에 형광을 표시 하 고 유사 분열 제공 자신감 올바른 게놈 중 세포질 내에서 확장된 핵 lamina에는 LMNB1에서 편집 로커 스입니다. 밝은 또는 희미 한 신호를 포함 하는 풍부한 인구 셀. 신호 강도이 차이 정확 하 고 잘못 된 결과 및 추가 대 한 유전자 검증된 클론 라인 생성 유틸리티 (토론 참조) 연구 하이라이트 편집의 조합을 반영 될 수 있습니다 (그림 3b)12. 클론 라인 생성 후 유전자 세포 현미경 실험 (그림 3c)에서 균일 한 GFP 강도 보여준 검증.
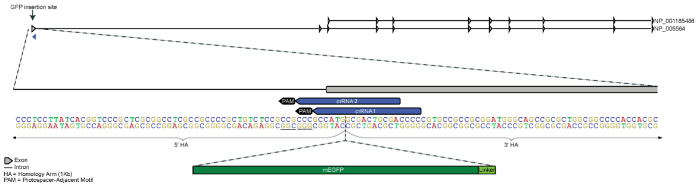
그림 1 . LMNB1 유전자의 N-말단 GFP 태그에 대 한 전략을 디자인. GFP 태그 염색체 5에 있는 LMNB1의 첫 번째 엑손의 N 맨끝 삽입 5ʹ 위해 설계 되었습니다. 5ʹ와 3ʹ 모두 homology 무기는 1 kb와 시작 codon (ATG)와 두 번째 코 돈 (상 동 팔만 부분적으로 그림에 표시). 두 후보 crRNAs Cas9 하면서 독특한 게놈에서 가능한 의도 삽입 사이트 가까이로 쪼개를 안내 하도록 설계 되었습니다. MEGFP 및 아미노산 링커 순서 시작 codon (하지를 mEGFP 및 링커 순서)의 단지 3ʹ를 삽입된 했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 . Endogenously 생산에 대 한 워크플로 태그 hiPSC 클론 라인. Transfection 구성 요소, 포함 (골드 crRNA와 보라색 tracrRNA 붉은 Cas9 단백질 표시), Cas9/crRNA/tracrRNA RNP 복잡 한 상 동 팔 (가, 금에 표시), 포함 된 기증자 템플릿 플라스 미드 및 FP + 링커 순서 (에 표시 된 녹색), 했다 electroporated입니다. 4 일 후, FP 양성 상 편집 셀 FACS에 의해 농축 (~ 1000 셀), 96-잘 접시의 단일 잘으로 정렬 된 셀의 모든 시드를 모집단으로 확장 그리고 문화에 몇 백만의 노동 인구까지 확장 세포 "풍부한 인구"로 분석 될 수 (프로토콜 단계 3.8 참조). FP-긍정적인 세포의 수익률 차이가 HDR12;의 가변 속도로 인해 실험 성공적인 농축 수 있습니다 일반적으로 300 ~ 5000 포함6 엉덩이 세포 transfection 약 1.6 x 10의 후 세포. 예비 이미징 연구 확인 신호 및 풍부한 인구에 융해 단백질의 지 방화. 식민지는 확장 및 cryopreservation 96 잘 접시에 수동으로 선택 했다. 게놈 품질 관리 심사를 더 물방울 디지털을 사용 하 여 PCR (ddPCR) 및 다른 PCR 기반 분석 실험은 다음 식별 하는 데 제대로 편집된 클론, 앞에서 설명한12. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 . 상 편집된 셀 인구의 농축. (A) 는 LMNB1의 흐름 cytometry 플롯 편집 셀 4 일 후 transfection. Y GFP 강도 표시 하 고 x 축 앞으로 분산형 표시 됩니다. 정렬 게이츠 버퍼 전용 제어 기반으로 설정 했다. HiPSCs 섭 동에 민감한 때문에, 생략 되었다 라이브/죽은 얼룩 그리고 매우 보수적인 FSC/SSC 게이트 대신 사용 되었다. 농축 한 후 (B) , LMNB1 Cr1의 인구 편집 셀 셀 GFP 핵 봉투 (예상된 LMNB1 지역화) 지역화의 ~ 90%를 보였다. 인구는 몇몇 GFP 부정적인 세포 뿐 아니라 다양 한 GFP 강도의 셀 포함. 스케일 바는 10 미크론. (C) 클론 라인 생성 후 셀 일부 세포 주기 의존 차이와 유니폼 GFP 강도를 보였다. 눈금 막대 20 미크론 이다입니다.
토론
HiPSCs에 형광 성 단백질 융해 규제 endogenously 생성에 대 한 여기에 제시 된 방법은 응용 프로그램 라이브 셀 이미징에서 다양 한 기능성 연구에 이르기까지 유전자 편집 셀 라인을 생성 하기 위한 다양 하 고 강력한 접근 및 " 접시에 질병"모델 환자 파생 hiPSC 라인13,,1415를 사용 하 여. 소개 큰 FP 태그에는 N-또는 C-말단 생 단백질의이 메서드를 사용 하는 동안 잠재적으로 사용 될 수 모델 또는 정확한 질병 유발 돌연변이22,23 다른 태그 또는 작은 유전자 변화를 소개 하 . 작은 삽입, 상 동 팔의 크기를 줄일 수 있습니다, 하지만이 방법에 제시 편집에 일반적인 접근24,25적용 수 있습니다. HiPSCs의 사용은 주의 최적화, 그들의 광대 한 유틸리티에 대 한 것이 좋습니다 다른 포유류 세포 라인의 유전자를 편집 하려면이 프로토콜을 적응 수 있습니다.
식별 FP 태그에 대 한 관심사의 유전자 사본 풍부 (microarray 또는 RNA-Seq 데이터)에서 추정은 좋은 출발점 사본 레벨을 항상 연관 하지 않습니다 비록 유전자 또는 isoform 관심의 표현 여부를 평가 하기 위한 단백질 수준입니다. 여기에 설명 된 FACS 농축 전략 관심의 셀 유형을 적어도 온건 하 게 잘 표현 된 유전자에 대 한 최고의 작동 합니다. 이 전략은 신호 대 배경 비는 매우 낮은12,19centrin, desmoplakin, paxillin 등 punctate 및/또는 개별 지역화 패턴을 보여 주는 융해에 대 한 선택에 성공 했다. 유전자는 매우 표현 되지 않는다 또는 파생 셀 형식에만 표시 됩니다 추가 선택 전략 필요할 수 있습니다.
디자인에 대 한 기증자와 crRNA 템플릿 플라스 미드 인간의 세포 라인에 사용 시작 지점 인간의 참조 게놈 (GRCh38) 이어야 한다. 다른 세포의 유전자는 같은 종 내에서 다를 수 있기 때문에 CRISPR/Cas9는 시퀀스 관련 때문에, 그것은 매우 도움이 셀 라인 전용 변종 (단 하나 뉴클레오티드 동 질 다 상 또는 삽입/삭제 (indels))를 식별 하 그는 디자인에 이러한 통합 참조 게놈에서 다. 이렇게 하면 crRNAs 호스트 게놈와 호환 된다는 것 그리고 기증자 템플릿 플라스 미드 homology 팔 어떤 셀 라인의 특정 이체를 유지 합니다. 제안된 전략 디자인 과정에서 homozygous 이체 crRNAs 및 기증자 템플릿 플라스 미드 homology 팔으로 통합 하는 것입니다. Heterozygous 이체를 통합 하는 것은 선택적입니다. 특정 시 약 큰 노크에서 실험을 위해 사용 하 고이 프로토콜에 대 한 다른 주요 고려 사항은 아래에서 토론 된다.
Cas9 단백질
Cas9 단백질을 사용 하 여의 주요 장점은 소개 하는 Cas9와 gRNA는 RNP 복잡 한으로 플라스 미드-기반 접근 Cas9와 gRNA의 식 수 일 동안 계속 하 고 리드에 비해 nuclease 활동의 제한 된 기간에 결과 표시 되었습니다. 큰에-및 오프-대상 활동26,의27. Cas9 단백질을 사용 하 여의 또 다른 이점은 그것 쉽게 셀 안에 한 번 쪼개 다 수입니다. 이 전사, 번역 및 처리26,28단백질을 필요로 하는 Cas9 mRNA 또는 Cas9/gRNA 플라스 미드를 사용 하 여 더 많은 기존의 방법과 대조 됩니다. Wildtype S. pyogenes Cas9 단백질은 지금 많은 상업적인 근원에서 있다.
가이드 RNA
또는 몇 가지 예측된에서-대상 호스트 게놈29,30,,3132에 있는 원하는 FP 삽입 사이트 근처 crRNA 목표를 찾아내기를 위한 많은 공개적으로 사용 가능한 도구가 있다. HDR에 HDR 결과의 정밀도 효율성 주어진된 로커 스12에서 사용 하는 crRNA 목표 사이 넓게 변화 한다. 이러한 이유로, 몇몇 crRNAs 테스트 (2-4와 선호 50 내 원하는 삽입 사이트의 bp) 로커 스 당 것이 좋습니다이 성공적인 편집 실험의 확률을 증가 시킬 수 있습니다. 합성 2 부분 crRNA 및 tracrRNA, 합성 한 gRNAs (sgRNAs) 생체 외에서 gRNA를 제공 하기 위한 현재 가능성 포함 복사할 sgRNAs, 또는 U6 발기인에서 sgRNA을 표현 하는 세포는 플라스 미드를 제공. 이 프로토콜은 높은 분열 활동 하지 적합 합니다. 수정 되지 않은 2 부분 crRNA와 tracrRNA ( 재료의 표참조) 셀에 최소한 잠재적인 섭 동을 일으키는 동안 모노 유전자 f P 태그 세포 생성의 목표와 함께 사용 되었다.
기증자 템플릿 플라스 미드
기증자에서 템플릿 플라스 미드에 통합 됩니다 호스트 게놈 HDR 이벤트 기간 동안 제공 되는 상 동 중 일부 시퀀스 팔, 때문에 점 돌연변이 crRNA 인식 사이트에 HDR 다음과 같은 Cas9에 의해 분열을 더 방지 하기 위하여 소개 되어야 한다. 종종 간단한 파괴적인 변화 팸 시퀀스를 변경할 것입니다. 일부 비 정식 팸 시퀀스는 여전히 야생 타입 S. pyogenes Cas9에 의해 인식 될 수 있다, 왜냐하면 NGG, 자성 또는 나라33를 사용 하지 않도록 최상 이다. 상 동 팔 돌연변이, 동의어 비 돌연변이 희귀 codons의 소개 하지 않도록 합니다. PAM 시퀀스에 동의어 변경 불가능, 씨앗 지역에 3 개의 동의어 포인트 돌연변이 만드는 것이 좋습니다 (10 bp 팸 하 근) crRNA 바인딩 사이트의. 주의 이러한 변경 시 (UTR) 5ʹ 번역 되지 않은 지역에이 지역의 중요 한 규제 시퀀스를 포함할 수 있기 때문에 취해야 한다. 으로 비 보존 기초 변경 높은 보존된 기초17변경 보다 더 용납 수 있습니다 UCSC 게놈 브라우저의 비교 유전체학 트랙 이러한 경우에 지침을 제공할 수 있습니다와 같은 유전자 보존 데이터베이스 컨설팅. 때로는 FP 시퀀스의 단순한 삽입은 ( 그림 1);에서 crRNA 바인딩 사이트를 방해 하기에 충분 한 그러나, 새로 추가 된 시퀀스 crRNA 바인딩 및 팸 시퀀스의 지 속성에 대 한 확인 되어야 한다.
FP와 네이티브 단백질 아미노산 링커는34의 융합 단백질 기능을 보존 하기 위해 권장 됩니다. 종종 아미노산 링커는 특정 요금 또는 크기에 대 한 선택할 수 있습니다. 경우는 cDNA 퓨전 디자인 타겟 비슷한 생 융해 단백질 되었습니다 잘 공부 하고있다, 같은 링커 순서 CRISPR/Cas9 노크 실험12,19에 사용할 수 있습니다. 이러한 정보를 사용할 수 없는 경우 GTSGGS 등 짧은 링커 되었습니다12성공적으로 사용. 다른 연구 대상35의 다양 한 일반적인 작은 3-아미노 산 성 링커 순서와 성공을 설명 했다.
Transfection 및 FACS 농축
많은 상용 transfection 시 약 electroporation 시스템 크기, 비용, 및 구성의 다양 한 시 약을 전달 하기 위해 사용할 수 있습니다 반면 세포, 분자의 특정 종류의 배달에 대 한 공식화 된다. HiPSCs 같은 하드 transfect 세포에 대 한 일반적인 transfection 방법 이외에, electroporation 또한이 방법에 설명 된 대로 CRISPR/Cas9-중재 FP 노크에 대 한 모든 세 가지 구성 요소를 제공 하는 혜택을 운반 합니다. 다른 상용 시 약이이 방법 (데이터 표시 되지 않음), 개발 하 고도 사용 하 고 다른 사람에 의해 RNP 배달26,28,36 때에 비교 될 때 최상의 결과 생산 하기 위해 Electroporation 발견 .
HiPSCs를 편집 하기 위해이 프로토콜을 사용할 때 특별 한 주의 전후에 최적의 세포 생존 및 최소한의 자발적인 차별화에 대 한 프로세스를 편집 하는 유전자는 세포의 부드러운 처리 되도록 취해야 한다. 특히, FACS 농축 방법 가능한 가장 큰 노즐 (130 µ m), 낮은 유량 (≤24 µ L/min), 방부 제-무료 칼 집 액체를 사용 하 여 줄기 세포를 정렬에 대 한 적응 해야 (염 분, 같은 재료의 표참조), 그리고 낮은 샘플 (10 psi) 압력입니다. 줄기 세포에 차선 생존 귀착되는 단일 셀 정렬, FACS 농축 hiPSCs 대량에서 정렬 하 고 셀 생존 및 줄기 세포 무결성을 최적화 하는 인구로 확장. 그러나, 단일 셀 정렬 덜 민감한 세포 유형에 대 한 적절 한 있을 수 있습니다. 세포 생존 촉진, 세포 FACS 농축에 대 한 수확 후에 1 시간 보다 더 이상 문화에 반환 하 고 정렬 과정을 통해 실 온에서 보관. 일부 세포 유형에 대 한 세포 생존 또한 잠복기 셀 정렬 과정 전반에 걸쳐 얼음 (4 ° C)에 의해 향상 될 수 있습니다.
FP-긍정적인 세포의 대량 확장 클론 라인을 생성 하기 전에 융해 단백질 지 방화에 대 한 이미징 분석 하 여 인구를 평가 하는 기회를 제공 한다. 셀의 결과 풍부한 인구 수도 있지만 일부 연구에 대 한 충분 한,이 인구는 자주 다양 한 강도의 FP 신호를 표시 합니다. 격리 된 클론 라인 단일 신호 (그림 3) 기능 실험12에 대 한 더 적절 한 그들을 만드는 있다.
클론 셀 라인 생성
편집 및 클론 선 생성 프로세스에 걸쳐 세포 형태학을 모니터링 하는 데 중요 하다. 부드러운 가장자리와도, 잘 포장 센터12,,1819hiPSC 식민지 급지대 무료 조건에서 재배 전시 한다. 차별화 된 세포는 문화의 5% 미만에서 관찰 해야. 개별 식민지 때, 그는 전시 좋은 형태를 선택 합니다. 이벤트를 뿌리고 96 잘 접시 중 형태에 대 한 복제를 확인 하 고이 분화로 이어질 수 있습니다 또는 유전자 불안정성의 표시로 자란가 그를 중단할.
클론 세포의 정확한 편집의 유전자 확인에 대 한 허용 Cas9 유도 이중 가닥 게놈에서 휴식 하기 때문에 중요 하다는 종종 수리 부정확 하 게 원하는 장소에 태그의 설립에도 불구 하 고. 앞에서 설명한 PCR 기반 분석 실험 보여주었다 누적 10 독특한 게놈 loci에 걸쳐 많은 (45%) FP 표현 클론의 게놈12기증자 플라스 미드 백본 통합 대상된 현장에서 또는 무작위로 (거의)에서 고통. 또한, GFP-긍정적인의 23%를 복제 (n = 177) 10 독특한 loci에 걸쳐 돌연변이에서 또는 태그 없는 대립 유전자, 대부분 NHEJ12때문에 예상된 crRNA 절단 사이트 근처 항구를 발견 했다. 많은 클론 라인 (~ 100 클론/편집)의이 유전자 분석 불가능 한 세포 인구에서 FP 표현과 예상된 퓨전 단백질 지 방화 혼자 보장 하지 않습니다 정확한 편집12 이후 유전 유효성 검사의 중요성 강조 . 또한, 이러한 PCR 기반 분석 클론 선 세대 전에 의미 있는 분석을 완료할 수 있습니다에 대 한 필요성을 보증 하는 어떤 확신을가지고 셀의 인구 농축된에 수행할 수 없습니다. 삽입 된 FP 태그의 유전자 확인 및 검증 (모노 유전자 편집된 클론)에서 편집 되지 않은 대립 유전자의 유전 무결성의 둘 다 정확한 편집 태그 식 넘어 대상된 현장에서 확인 하는 데 필요한 있습니다.
Bi-유전자 편집의 낮은 속도 (Sanger와 exome 시퀀싱 분석)으로 대상에서 돌연변이의 부족이 방법 (되지 않은 데이터)12를 사용 하 여 날짜를 관찰 되었습니다. 이것은 CRISPR/Cas9 실험26,27에 대 한 짧은 지속 RNP의 사용을 설명 하는 이전 연구 결과와 일치. Bi-유전자 수정 클론 셀 라인의 부족 특정 장소에는 영향을 수도 있습니다 또는 두 용납 하는 셀의 무 능력 때문 태그 제안 이전에 게시 실험에서 필수적인 단백질의 복사본 상 상속 유전자 양방향 편집된 셀 했다 또 다른 (TUBA1B)12만 한 로커 스 (LMNB1)에 대 한 관찰. 완벽 하 게 검증 된 Bi 유전자 클론 셀 라인 mEGFP19이 방법 태그 ST6 베타-galactoside 알파-2, 6-1 sialyltransferase (ST6GAL1), 및 RAB5A 구성원 RAS oncogene 가족 (RAB5A)를 사용 하 여 생성 된.
게놈에서 편집의 정밀도 확인, 넘어 더 클론 라인의 특성 충족 모든 줄기 세포, 게놈, 클론을 식별 하는 데 사용할 수 있는 품질 관리 분석 실험의 다양 한 있다 그리고 세포 생물학 기준 연구 미래에 사용 . 세포 생물학과 기능 분석 실험 지역화, 적절 한 표현과 융합 단백질12의 기능 확인을 사용할 수 있습니다. 편집 되지 않은 자녀를 비교 현지화, 역학, 및 기능에는 편집 과정의 영향을 평가 하는 데 도움이 됩니다. 다른 분석 실험과 같은 성장 분석 및 게놈 안정성에 대 한 테스트 또한 도울 수 있다 태그 단백질 셀 perturbing 인지 확인 합니다. 이 프로토콜에서 hiPSC를 사용 하 여, pluripotency 마커 및 감 별 법 잠재력의 평가 다운스트림에 대 한 귀중 한은 복제 연구12결정에 중요 한 될 수 있습니다. 문화를 확장 하기 때문에 hiPSC는 성장 율 모니터링 유전 불안정성으로 이어질 보였다 고 클론 셀 라인의 karyotype는 또한 중요 한12,37. 그러나, 마지막 것 편집된 된 셀의 사용 수준 및 품질 관리 분석의 폭 궁극적으로 결정 하 고 응용 프로그램에 따라 달라 집니다.
공개
저자는 공개 없다.
감사의 말
우리는 많은 통찰력이 토론 및 편집, 그림, 원고의 중요 한 독서에 대 한 안 젤리 크 넬슨과 앤드류 mEGFP 태그 Lamin B1 셀 라인을 생성 하기 위한 터 커에 대 한 타오 할 유전자에 대 한 조언을 위해 다프네 Dambournet 감사 합니다. 유전자 편집 및 품질 관리 과정에 그들의 공헌에 대 한 세포 과학에 대 한 줄기 세포와 유전자 편집 및 알 렌 연구소에서 분석 결과 개발 팀을 인정 하 길. 우리가 만드는 우리의 유전자 편집 셀 라인 데 911 무역 라인 스톤 학회와 UCSF에서 브루스 R. 컨 클린이 실험실에 의해 제공 되었다. 우리 알 렌 연구소 세포 과학 설립자, 폴 G. 알 렌, 그의 비전, 격려, 감사 하 고 지원 합니다.
자료
| Name | Company | Catalog Number | Comments |
| Geneious R9 | Biomatters, or similar | bioinformatics software for in silico donor plasmid design | |
| TE Buffer pH 8.0 | IDT, or similar | 11-01-02-05 | |
| HERAcell VIOS 160i CO2 incubator, or similar | ThermoFisher Scientific, or similar | 51030408 | |
| Pipettes (1000 µL, 200 µL, 20 µL, 10 µL, 2 µL) | Rainin, or similar | ||
| Pipette tips (1000 µL, 200 µL, 20 µL) | Rainin, or similar | ||
| Multi-channel Pipette (200 µL) | Rainin, or similar | ||
| Serological pipetes (25 mL, 10 mL, 5 mL) | Costar, or similar | ||
| BRAND 8-Channel Manifold for Quiksip, Autoclavable | Millipore Sigma, or similar | BR704526-1EA | use with non-filtered pipet tips, such as Molecular BioProducts Low Retention Pipet Tips, Pure 10, below |
| Molecular BioProducts Low Retention Pipet Tips, Pure 10 | Thermo Fisher, or similar | 3501-05 | |
| XP2 Pipette Controller | Drummond, or similar | 4-000-501 | |
| Disposable Pasteur Pipets | VWR, or similar | 53300-567 | |
| Class II, Type A2 Biological Safety Cabinet | CELLGARD, or similar | NU-481 | |
| Matrigel Matrix, Growth Factor Reduced | Corning | 354230 | lot tested before use with hiPSC |
| DMEM/F12 (-phenol red) | Gibco | 11039-021 | cold, for diluting Matrigel 1:30 |
| mTeSR1 Complete Media | StemCell Technologies | 85850 | recommended growth media for WTC hiPSC line |
| Penicillin-streptomycin | Gibco | 15070-063 | |
| WTC hiPSC line | Coriell | GM25256 | the hiPSC line used in this protocol is available through Coriell |
| Tissue culture dish 100 mm | Falcon | 353003 | |
| 6-well Cell Culture Plate | CELLSTAR | 657160 | |
| StemPro Accutase | Gibco | A11105-01 | |
| Dulbecco's Phosphate Buffered Saline (DPBS) no calcium, no magnesium | Gibco | 14190144 | |
| 15 mL polystyrene conical | Sarstedt | 62.554.100 | |
| Y-27632 (ROCK Inhibitor) | StemCell Technologies | 72308 | |
| Edit-R CRISPR-Cas9 Synthetic crRNA, unmodified (custom sequence) | Dharmacon | Custom0247 | |
| Edit-R CRISPR-Cas9 Synthetic tracrRNA | Dharmacon | U-002005-05 | |
| Recombinant wild-type Streptococcus pyogenes Cas9-NLS purified protein, 40 µM | University of California-Berkeley QB3 Macrolab | ||
| Custom donor plasmid (PriorityGENE) | Genewiz | donor insert design was synthesized and cloned into pUC57 backbone by Genewiz | |
| DNA LoBind Tube 1.5 mL | Eppendorf | 22431021 | |
| NucleoBond Xtra Maxi EF | Clontech | 740424.50 | |
| Neon Transfection System | ThermoFisher Scientific | MPK5000 | |
| Neon Transfection System, 100 µL kit | ThermoFisher Scientific | MPK10096 | |
| 5 mL Polystyrene Round-bottom Tube with Cell Strainer Cap | Falcon | 352235 | |
| 15 mL High Clarity Polyproylene Conical Tube | Falcon | 352196 | |
| FACSAriaIII Fusion | BD Biosciences | 656700 | |
| FACSDiva software | BD Biosciences | ||
| FlowJo version 10.2 | TreeStar | ||
| NERL Blood Bank Saline | ThermoFisher Scientific | 8504 | used as preservative-free FACS Buffer |
| Olympus SZX7 Stereo Microscope, or similar | Olympus, or similar | ||
| Tissue culture plate, 96-well | Falcon | 353072 | |
| 96 well Cell Culture Plate, V-Bottom | CELLSTAR | 351180 | |
| CryoStor CS10 | Sigma | C2874-100ML | used as cryopreservation buffer for cells in 96-well plate format |
| Parafilm | Bemis | PM-996 | |
| 24 well Cell Culture Plate | CELLSTAR | 662160 |
참고문헌
- Wood, A. J., et al. Targeted genome editing across species using ZFNs and TALENs. Science. 333 (6040), 307 (2011).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Dambournet, D., Hong, S. H., Grassart, A., Drubin, D. G. Tagging endogenous loci for live-cell fluorescence imaging and molecule counting using ZFNs, TALENs, and Cas9. Methods in Enzymology. , 139-160 (2014).
- Ratz, M., Testa, I., Hell, S. W., Jakobs, S. CRISPR/Cas9-mediated endogenous protein tagging for RESOLFT super-resolution microscopy of living human cells. Sci Rep. 5, 9592 (2015).
- Hendriks, W. T., Warren, C. R., Cowan, C. A. Genome Editing in Human Pluripotent Stem Cells: Approaches, Pitfalls, and Solutions. Cell Stem Cell. 18 (1), 53-65 (2016).
- Hockemeyer, D., Jaenisch, R. Induced Pluripotent Stem Cells Meet Genome Editing. Cell Stem Cell. 18 (5), 573-586 (2016).
- Doyon, J. B., et al. Rapid and efficient clathrin-mediated endocytosis revealed in genome-edited mammalian cells. Nature Cell Biology. 13 (3), 331-337 (2011).
- Cho, W. K., et al. Super-resolution imaging of fluorescently labeled, endogenous RNA Polymerase II in living cells with CRISPR/Cas9-mediated gene editing. Sci Rep. 6, 35949 (2016).
- White, C. W., Vanyai, H. K., See, H. B., Johnstone, E. K. M., Pfleger, K. D. G. Using nanoBRET and CRISPR/Cas9 to monitor proximity to a genome-edited protein in real-time. Sci Rep. 7 (1), 3187 (2017).
- Roberts, B., et al. Systematic gene tagging using CRISPR/Cas9 in human stem cells to illuminate cell organization. Mol Biol Cell. 28 (21), 2854-2874 (2017).
- Soldner, F., et al. Generation of isogenic pluripotent stem cells differing exclusively at two early onset Parkinson point mutations. Cell. 146 (2), 318-331 (2011).
- Young, J. E., Goldstein, L. S. Alzheimer's disease in a dish: promises and challenges of human stem cell models. Human Molecular Genetics. 21 (R1), R82-R89 (2012).
- Soares, F. A., Sheldon, M., Rao, M., Mummery, C., Vallier, L. International coordination of large-scale human induced pluripotent stem cell initiatives: Wellcome Trust and ISSCR workshops white paper. Stem Cell Reports. 3 (6), 931-939 (2014).
- . . Gene, NCBI- National Center for Biotechnology Information. , (2017).
- . . Gene, NCBI- National Center for Biotechnology Information. , (2017).
- . . Allen Cell Methods: Single cell passaging human iPS cells. , (2018).
- . . Allen Cell Explorer. , (2017).
- Lingeman, E., Jeans, C., Corn, J. E. Production of Purified CasRNPs for Efficacious Genome Editing. Curr Protoc Mol Biol. 120, 31-31 (2017).
- . . Michael Davidson Fluorescent Protein Collection. , (2017).
- Cox, D. B., Platt, R. J., Zhang, F. Therapeutic genome editing: prospects and challenges. Nature Medicine. 21 (2), 121-131 (2015).
- Haas, S. A., Dettmer, V., Cathomen, T. Therapeutic genome editing with engineered nucleases. Hamostaseologie. 37 (1), 45-52 (2017).
- Beumer, K. J., Trautman, J. K., Mukherjee, K., Carroll, D. Donor DNA Utilization During Gene Targeting with Zinc-Finger Nucleases. G3 (Bethesda). 3 (4), 657-664 (2013).
- Orlando, S. J., et al. Zinc-finger nuclease-driven targeted integration into mammalian genomes using donors with limited chromosomal homology. Nucleic Acids Research. 38 (15), e152 (2010).
- DeWitt, M. A., Corn, J. E., Carroll, D. Genome editing via delivery of Cas9 ribonucleoprotein. Methods. 121-122, 9-15 (2017).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Research. 24 (6), 1012-1019 (2014).
- Lin, S., Staahl, B. T., Alla, R. K., Doudna, J. A. Enhanced homology-directed human genome engineering by controlled timing of CRISPR/Cas9 delivery. Elife. 3, e04766 (2014).
- Labun, K., Montague, T. G., Gagnon, J. A., Thyme, S. B., Valen, E. CHOPCHOP v2: a web tool for the next generation of CRISPR genome engineering. Nucleic Acids Research. 44 (W1), W272-W276 (2016).
- Montague, T. G., Cruz, J. M., Gagnon, J. A., Church, G. M., Valen, E. CHOPCHOP: a CRISPR/Cas9 and TALEN web tool for genome editing. Nucleic Acids Research. 42 (Web Server issue), W401-W407 (2014).
- Bae, S., Park, J., Kim, J. S. Cas-OFFinder: a fast and versatile algorithm that searches for potential off-target sites of Cas9 RNA-guided endonucleases. Bioinformatics. 30 (10), 1473-1475 (2014).
- . . CRISPOR V4.3. , (2017).
- Zhang, Y., et al. Comparison of non-canonical PAMs for CRISPR/Cas9-mediated DNA cleavage in human cells. Sci Rep. 4, 5405 (2014).
- Chen, X., Zaro, J. L., Shen, W. C. Fusion protein linkers: property, design and functionality. Adv Drug Deliv Rev. 65 (10), 1357-1369 (2013).
- Leonetti, M. D., Sekine, S., Kamiyama, D., Weissman, J. S., Huang, B. A scalable strategy for high-throughput GFP tagging of endogenous human proteins. Proc Natl Acad Sci U S A. 113 (25), E3501-E3508 (2016).
- Liang, X., et al. Rapid and highly efficient mammalian cell engineering via Cas9 protein transfection. Journal of Biotechnology. 208, 44-53 (2015).
- Baker, D., et al. Detecting Genetic Mosaicism in Cultures of Human Pluripotent Stem Cells. Stem Cell Reports. 7 (5), 998-1012 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유