Method Article
Spectrophotometric Cyanobacterium Synechocystis 에서 Phycobiliprotein 콘텐츠 결정
요약
여기, 선물이 양적 phycobiliprotein cyanobacterium Synechocystis spectrophotometric 메서드를 사용 하 여에서 콘텐츠를 결정 하는 프로토콜. 추출 프로시저 또한 성공적으로 다른 박테리아 및 조류 긴장;에 적용 했다 그러나, 안료 흡수 스펙트럼에 있는 변이 때문 그것은 각 스트레인에 대 한 spectrophotometric 방정식을 개별적으로 테스트 하는 데 필요한입니다.
초록
이것은 모델 cyanobacterium Synechocystisphycobiliprotein 콘텐츠의 양적 결정에 대 한 간단한 프로토콜 이다. Phycobiliproteins 있습니다 phycobilisomes, 박테리아에서 주요 광 수확 안테나의 가장 중요 한 구성 요소와 여러 조류 taxa. Synechocystis 의 phycobilisomes 포함 두 phycobiliproteins: phycocyanin와 allophycocyanin. 이 프로토콜은 간단 하 고, 효율적인, phycocyanin와이 모델 cyanobacterium에서 allophycocyanin의 양적 결정에 대 한 신뢰할 수 있는 방법을 설명합니다. 우리는 phycobiliprotein 추출 및 spectrophotometric 정량화의 몇 가지 메서드를 비교. 이 프로토콜에서 설명 된 대로 추출 절차는 Cyanothece sp., Synechococcuselongatus, Spirulina sp., Arthrospira sp., 같은 다른 박테리아 변종에도 성공적으로 적용 했다 그리고 Nostoc sp., 또한 레드 조류 Porphyridium cruentum로. 그러나, 다양 한 taxa에서 특정 phycobiliproteins의 소멸 계수 다를 수 있습니다 그리고 그것은, 따라서, 개별적으로 모든 단일 스트레인에 대 한 spectrophotometric 정량화 방법의 유효성을 검사 권장. 프로토콜은 시간이 좀 필요 하 고 그것만 표준 장비를 필요로 하기 때문에 모든 표준 생명 과학 실험실에서 수행할 수 있습니다.
서문
fPhycobiliproteins는 간결한 박테리아 (Cyanophyta)에서 광 수확 안테나와 여러 진 핵 taxa (Glaucophyta, Rhodophyta의 주요 구성 요소를 나타내는 수용 성 색소 단백질 복합물 , 및 Cryptophyta)1. 그들은 phycobilisomes 라는 supramolecular 단지도 주로 발생 하 고 Cryptophyta, 어디는 phycobiliproteins 지역화는 제외한 stromal 측에 광합성 세포 막의 표면에 일반적으로 연결 되는 thylakoid 루멘2. 네 가지 유형의 phycobiliproteins 날짜까지 확인 되었습니다: 코어 allophycocyanin 및 주변 phycocyanin, phycoerythrin, 및 phycoerythrocyanin1. 주요 빛 수확 단지로 phycobilisomes 조류와 남조류의 대량 문화 생산성의 중요 한 요소 중 하나를 나타냅니다. 그것은 그 phycobilisomes 잘림 강한 빛3바이오 매스 축적을 향상 시킬 수 입증 되었습니다. 다른 한편으로, 겸손 또는 낮은 irradiance에서 안테나 잘림 결과 성장 속도 바이오 매스 축적 감소3,4. Phycobiliproteins는 상업적으로 사용 식용 염료, 의약품, 그리고 화장품 산업, 식품 첨가물, 형광 프로브 cytometry, 형광 immunoassays 및 형광 현미경 검사 법5에서 응용 프로그램과 함께.
이 프로토콜 phycobiliproteins 모델 cyanobacterium Synechocystis에서 양적 결정에 초점을 맞추고. 남조류는는 초기 oxygenic 광합성 슬에; 그들은 2.4 십억 년6이상에 대 한 지구의 생물권을 형성 되었습니다. 그들은 질소, 탄소, 산소, 및 기타 요소의 세계 생물 지구 화학적 순환에 중요 한 역할을 한다. 박테리아, 중 단 세포 변형 Synechocystis 이후 전체 게놈으로 첫 번째 cyanobacterium 독특한 위치를 얻은 시퀀싱7,8, 그것은 자연스럽 게 외 인 DNA9, 변환 및 그것은 안정적이 고 비교적 빠른 성장10,11을 수행합니다. Synechocystis, 핵심 안테나 구성에서에서 allophycocyanin, 완전 한 막 단백질 연관 이며 연결 된 phycocyanin thylakoid 막 주변에 위치 하 고 있습니다.
이 프로토콜 내에서 phycobiliprotein 추출 및 정량화에 대 한 여러 가지 방법은 비교 합니다. Synechocystis, 뿐만 아니라 다른 박테리아 변종, Cyanothece sp., Synechococcuselongatus, Spirulina sp., Arthrospira 를 포함 하 여 최종 추출 절차 성공적으로 적용 했다 빨강 조류 Porphyridium cruentumsp., 그리고 Nostoc sp., 그것은 또한 성공적으로 적용 했다. 따라서,이 프로토콜에 개발 하는 방법 phycobiliprotein 추출에 대 한 보편적인 방법으로 여겨질 수 있다. 높은 phycobiliprotein 엽록소에 잔류물의 낮은 콘텐츠 함께 수익률 제공 여기 추출 절차를 설명 된 테스트 추출 방법의 일부 높은 총 단백질 수율 결과, 비록는 phycobiliprotein 압축을 풉니다. 엽록소의 한 콘텐츠를 줄이는 올바른 phycocyanin와 allophycocyanin spectrophotometric 정량화에 대 한 필수적 이었다.
Phycobiliprotein 흡수 스펙트럼 다양 한 조류와 박테리아 종12,13,14,15,,1617 크게 다를 수 있으며 심지어 중 단일 박테리아 속18의 여러 변종. 따라서, 특정 파장 및 흡수 계수 phycocyanin 및 Synechocystis 에 allophycocyanin에 사용 된 다른 계통에 일반적으로 적용 되지 않습니다. 또한, Synechocystis 는 phycoerythrin와 일부 다른 조류와 박테리아에서 찾을 수 있는 phycoerythrocyanin를 포함 하지 않습니다. Phycobiliproteins 긴장 Synechocystis이외에 결정을 위해 각 변형에 대 한 spectrophotometric 방정식을 개별적으로 평가 하는 것이 좋습니다.
프로토콜 포함 2 개의 더 단계 (하룻밤 셀룰러 펠 릿 및 1 시간 단백질 추출의 동결), 비록 phycobiliproteins 정량화에 대 한 총 노동 시간 보다 2 시간 이상 이다.
프로토콜
1. 남조류 재배
- Synechocystis 셀 삼각 플라스 크 또는 photobioreactors10,19 (예를 들어, 17 mM HEPES10를 사용 하 여) < 10의 pH를 유지 하기 위해 버퍼 BG11 중간20 에서 육성.
참고: 표준 재배 조건 필요 제어 온도 (일반적으로 30 ℃, 최적 온도 35 ° C)21, 조명 (800 µmol [광양] 최대 강도의 일반적으로, 하얀 빛 / [m2·s])21, 그리고 CO 2 공급 (400 mL 평면 패널 photobioreactor CO2 농도 포화 성장 1700 ppm 이다)21. - 문화의 밀도 확인 하려면 spectrophotometrically 730에서 문화 광 밀도 측정 nm (OD730) 또는 빛 경로 1 cm.의 베트를 사용 하 여 현미경으로 hemocytometer 또는 자동화 된 셀을 사용 하 여 셀의 개수 카운터입니다.
2. 샘플 준비
- Phycobiliprotein 저하를 방지 하기 위해 낮은 irradiance에서 동작.
- 안전 잠금 관에 문화 현 탁 액의 3 x 1 mL를 수확. Triplicates를 사용 하 여 측정에서 기술적 오류 추정에 대 한. 무 균 조건 하에서 문화 샘플링을 수행 하려면 층 류 후드에 세포를 수확 하 고 적절 한 작업 및 안전 관행에 따라.
- 15000 x g 에 5 분 제대로 균형된 원심 분리기로 터에 관심을 지불에 대 한 실험실 온도에서 세포 원심 원심, 후는 supernatants 삭제 합니다. 수는 펠 렛을 방해 하지 않도록 주의 하십시오.
- 냉동 실에 샘플을 넣어. 장기 저장을 위한-80 ° c.에 샘플을 계속 이것은 phycobiliprotein 저하를 방지 해야 합니다. 단기 저장을 위해,-20 ° C 충분 하다.
- Freeze-dry 샘플 하룻밤. 적절 한 동결 과정에 대 한 동결 건조 기 콘덴서-60 ° c의 온도 유지 하 고 동결 건조 기에서 압력 챔버 1 hPa.
- 마친 후 동결 주기, 튜브 공기에서 물의 재흡수를 방지 하기 위해 가능한 한 빨리 닫습니다.
3. 세포 균질 및 추출 색소
- 각 샘플 튜브 (직경 2 mm)와 유리 구슬의 4 조각을 추가 하 고 튜브를 닫습니다.
참고: 때 균질 사용 안전 잠금 튜브의 뚜껑은 너무 얇은, 그것은 깨뜨릴 수 있는 동안 균질; 따라서, 강한 뚜껑만 안전 잠금 튜브는이 프로토콜에 대 한 것이 좋습니다. - 15 유리 구슬과 샘플 균질 실험실 온도에서 균질 화기에 s.
참고: 제대로 무 균된 샘플 안전 잠금 튜브의 전체 내부 표면에 전염 됩니다. - 1 mL PBS 버퍼 (pH 7.4)의 phycobiliproteins을 추출 하기 위해 샘플을 4 ° C에 precooled를 추가 합니다.
참고:이 단계에서 추출 된 단백질의 저하를 방지 하기 위해 얼음에 샘플 계속. 이것은 중요 한입니다. - 5 샘플 PBS 믹스 실험실 온도에서 균질 화기에 s.
참고: 혼합 후, 샘플은 녹색. - 혼합 후, 샘플 60 분 커버에 대 한 얼음에 색소 저하를 방지 하기 위해 뚜껑 얼음 목욕 유지.
- Phycobiliprotein 추출의 60 분, 후 5 분 원심 분리기 회전자를 제대로 균형에 관심을 지불에 대 한 4 ° C에서 15000 x g 에서 샘플 원심.
참고: 원심, 후에 상쾌한 시안색 파란색이 있다.
4. Phycobiliprotein 정량화
- Spectrophotometric 측정 하기 전에 빈으로 PBS 버퍼를 사용 하 여 기준선을 분 광 광도 계를 보정.
- 분 광 광도 계 보정은 일단 무시 한 분 광 광도 계 베트에서 PBS 고 폐기 버퍼 대신 추출된 phycobiliproteins와 상쾌한 플라스틱.
- Phycobiliprotein 농도 spectrophotometrically, 0.5의 슬릿 폭을 사용 하 여 계량 nm.
- Phycocyanin와 615에서 빈 PBS 버퍼에 대 한 allophycocyanin phycocyanobilins의 흡 광도 측정 (615) 및 652 nm (652), 각각, 720에 세포질 파편의 흡 광도 측정 하 고 nm (720).
- Phycocyanin와 방정식에 따르면 allophycocyanin의 (1) 및 (2) 베넷과 Bogorad12의 농도 계산.

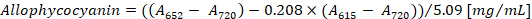
참고:615,652및720 는 분 광 광도 계의 선형 흡 광도 범위에 적합 해야 한다. 필요한 경우, PBS 버퍼와 샘플을 희석.
- 원래 샘플에 안료 농도 다시 계산. 샘플에서 안료 농도 방정식 (1) 및 (2) 사용 될 때 1 mL의 문화 및 추출 버퍼의 1 mL는 분석의 결과와 직접 해당 합니다. 박테리아 샘플 PBS 버퍼의 다른 볼륨을 사용 하는 경우 최종 안료 농도 식 (3)에 따라 계산 해야:
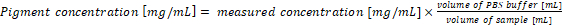 (3)
(3)
참고: 셀 건조 중량 당 정규화 phycobiliprotein 콘텐츠, 경우 최종 안료 농도 계산 해야 방정식 (4)에 따라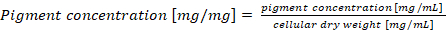 (4)
(4)
5. (선택 사항) 셀 건조 중량의 결정
- 3 빈 안전 잠금 튜브 분석 균형에 무게.
주의: 그것은 중요 안전 잠금 튜브는 건조입니다. 젖은 환경에 튜브를 저장 하는 경우 동결 건조 하기 전에 그들을 무게에 몇 시간 동안 튜브를 건조. 부드럽게 튜브를 조작 및만 손으로 파우더 무료 장갑 낀 자료와 연구자의 손가락 사이 어떤 접촉을 피하기 위해. 모든 소유자를 유지 하 고 깨끗 한 관에 자료의 전송을 방지 하기 원심. - 1 x 15 mL 15 mL 원뿔 튜브에 문화 현 탁 액의 샘플.
- 각 포함 15 mL의 물에 15 mL 원뿔 튜브 4000 x g 에서 10 분 원심 분리기로 터의 균형에 대 한 실험실 온도에서 세 개의 추가 15 mL 원뿔 튜브에에서 문화의 정지 원심 원심, 후는 상쾌한의 12 mL를 삭제 합니다.
- 나머지 상쾌한에 펠 릿을 resuspend 하 고 혼합물의 3 x 1 mL를 피펫으로 3 1.5 mL 안전 잠금 튜브 전송. 펠 릿의 일부 남은 15 mL 원뿔 튜브에 남아, 경우에 이온된 수의 1.5 mL 원뿔 튜브, 소용돌이 또는 악수 튜브 나머지 resuspend를 작은, 및 혼합물의 3 x 0.5 mL 3 1.5 mL 안전 잠금 튜브 (이미 containi 전송에 추가 ng는 펠 릿의 3 x 1 mL)는 피 펫으로.
참고: 세 개의 1.5 mL 안전 잠금 튜브에 펠 릿을 나누어 건조 중량 측정의 기술적 오류 추정 수 있게 됩니다. - 원심 셀 5 분 균형에 대 한 실험실 온도에서 15000 x g 에서 1.5 mL 안전 잠금 튜브에 물 1 mL를 포함 하는 추가 1.5 mL 안전 잠금 튜브 원심 분리기 회전자. 원심, 후는 supernatants 삭제 합니다.
- 냉동 실에 샘플을 넣어. 장기 저장을 위한-80 ° C에서 샘플을 계속 단기 저장용-20 ° C 충분 하다.
- Freeze-dry 샘플 하룻밤. 적절 한 동결 과정에 대 한 동결 건조 기 콘덴서-90 ° c의 온도 유지 하 고 동결 건조 기에서 압력 챔버 1 hPa.
- 동결, 후 튜브를 닫고 샘플 분석 균형에 무게.
참고: 건조 중량 값 셀 건조 중량 당 phycobiliprotein 콘텐츠 정상화에 대 한 사용할 수 있습니다.
결과
초기 메서드 테스트에 대 한 Synechocystis BG11 재배 매체20 (17 mM HEPES 보충) 25 ° C, 50 µmol (광자)의 농도의 따뜻한 하얀 빛 아래에서 재배 통에 삼각 플라스 크에 배치 문화로는 / (m 2·s)와 1% CO2 자란 분위기에. 재배 기간 동안 문화 안전 잠금 튜브로 샘플링 된 centrifuged (15000 x g 5 분 동안 실험실 온도에서)는 상쾌한, 폐기 및 샘플 중-80 ° C에 저장 되었고 동결에 대 한 준비로는 이 프로토콜의 각 단계 또는-20 ° C 또는 추출 및 quantifications 비교 분석-80 ° C에 저장.
테스트 추출 절차 쥡니다, PBS 버퍼 및 동결 해빙 내 지 르 코니 아 구슬 가진 균질에 의해 세포 파쇄를 포함. 다른 추출 방법의 결과 그림 1에서 요약 된다. 이 프로토콜에서 설명 된 대로 메서드는 가장 높은 phycobiliproteins 수익률 최저 엽록소는 오염을 추출 버퍼에 함께 제공. 엽록소는 는 검색 되었습니다 추출 버퍼에 쥡니다 세포 파쇄에 사용 되었다. 중지 및 재개 얼음에 초음파 목욕에서 샘플의 사이클을 반복 추출 버퍼에 더 높은 단백질 수율 결과. 그러나, 같은 시간에 엽록소는 를 추출 버퍼에의 농도 증가 (그림 1 인세트)는 적절 한 phycobiliprotein 콘텐츠 정량화를 제외.
최적의 균질에 되었다 짧은 모두 15 s. 균질 (5 s) 더 이상 (20 s) 그림 2와 같이 약간 낮은 phycobiliprotein 수율를 제공 하는 기간. 0.5 m m, 1 m m 또는 4mm 직경의 유리 구슬, 0.5 m m 직경의 지 르 코니 아 구슬 또는 바다 모래 알갱이 비교할 때 가장 높은 수율 결과 직경 2 mm의 유리 구슬 가진 셀 조직. PBS 추출 버퍼 phycobiliproteins 추출 (그림 3)에 대 한 최적의 버퍼 테스트를 했다. 100 mM NaCl 또는 150 m m KCl PBS 버퍼 또는 물 phycobiliprotein 추출 효율을 증가 하지 않았다와 같은 추출 (그림 3)에 대 한 20 mM 나트륨 아세테이트 버퍼를 사용 하 여 갔다. 더 많은 시간 (최대 240 분), 후 추출 버퍼에 phycobiliprotein 농도 크게 변경 하지 않은 때문에 최적의 phycobiliprotein 추출 시간이 60 분을 했다 (그림 4).
우리는 또한 phycobiliprotein 측정 (그림 5)에 대 한 분 광 광도 계 선형 범위를 테스트 하 고 phycocyanin와 allophycocyanin 표준 (그림 6)를 사용 하 여 여러 가지 방정식 phycobiliprotein 정량화의 비교. 이 프로토콜에서 사용 하는 분 광 광도 계 보였다 0.1-사이 선형 흡 광도 범위 3.0 (그림 5). 때문에 단백질의 스펙트럼을 추출 했다 그것의 최대 흡수 약 620 nm (는620), 652에서 nm, 흡수 (652) 이었다는620 (그림 7)는652 (최대에 대 한 분 광 광도 계 선형성의 단지 33% allophycocyanin 흡 광도) 1.16의652 까지만 테스트 되었습니다. 방정식 (1) (2) 베넷과 Bogorad의12 제공 phycocyanin와 allophycocyanin 표준 모든 시험된 방정식 (그림 6) 중의 최고의 개조. 스 황산, 막의 제거 포함 된 엽록소 는, 조각에 대 한 여러 이전의 연구에서 사용 표시 했습니다 (그림 7) 추출에 대 한 필요 하지.
대표적인 실험에 대 한 Synechocystis photobioreactor25 셀 지 수 성장 단계 광학 밀도의 정의 된 범위 내에 유지 했다 turbidostat 정권에서에서 재배 되었다 (680에서 측정 nm, OD 680)는 신선한 재배 매체 (BG11 매체 17 mm HEPES 버퍼링)11,26제어 희석에 의해. 문화는 32 ° C에서 재배 되었고 입력된 공기 포함 된 0.5% CO2. 문화는 레드 빛으로 조명 했다 (λ최대: 633 nm, λ1/2: 20 nm) 25-1100 µmol (광자)의 강도 / (m2·s), 블루 빛 함께 (λ최대: 445 nm, λ1/2: 20 nm) 25 µmol (의 강도 광자) / (m2·s). 문화 서 스 펜 션의 광학 밀도 photobioreactor 기초에 의해 측정 되었다 그리고 범위의 OD680 0.52-설정 0.58 (2 x 107 4 x 107 셀/ml). 문화는 새 환경 순응을 위한 충분 한 시간을 제공 하기 위해 적어도 24 시간 동안 각 특정 빛의 강도 따라 재배 했다. 도달 후 성장 안정성, 문화 (이 프로토콜의 단계 2.1-2.8)에 따라 건조 중량, 셀 수, 및 phycocyanin 및 allophycocyanin 콘텐츠 샘플링 했다. 가벼운 강렬을 증가에서 phycobiliprotein 평가의 결과 그림 8에 나와 있습니다. Synechocystis 높은 irradiance에서 세포 건조 무게 (280 fg/셀)의 3%로 최저 irradiance에서 세포 건조 중량 (505 fg/셀)의 12%에서 phycobiliprotein 콘텐츠를 감소.

그림 1 : 여러 참조 방법으로이 프로토콜에서 설명 하는 방법의 추출 효율의 비교. 60 분 방법 A에 대 한 PBS 버퍼에 추출이이 프로토콜에서 설명 후 phycocyanin (검은 막대)와 조 단백질 추출 물에서 allophycocyanin (흰 막대)의 농도 측정 했다. 방법 B는 다음과 같이 수정 했다: 수확 후 셀 했다 centrifuged (15000 x g 에 5 분 동안 실험실 온도)와 하룻밤-20 ° C에 저장. 냉동된 샘플 120 sonicated 했다 4 ° c, s 및는 phycobiliproteins를 PBS 버퍼에 추출 되었다 60 분 방법 C 메서드 B에서에서 수확된 세포 freeze-drying 세포 알 약 30 분-80 ° C에서의 펠 릿을 저장 하 여 수정에 대 한 그리고 건조 펠 릿을 추가 PBS 버퍼. 메서드 D 정 외에서 수정 되었습니다. 16: 동결 후 (동일한 방법 C에서), 1% 스 황산 버퍼 (pH 5.5) 나 아세테이트의 0.25 mL에 추가 되었습니다 (직경이 0.5 m m), 지르코늄 구슬의 0.25 mL 함께 건조 세포 펠 릿 및 샘플 했다 두 번 무 균 60 대는 균질 화기에 s. 균질, 후 스 1% 황산 버퍼 (pH 5.5) 나 아세테이트의 또 다른 0.5 mL 샘플에 추가 되었습니다, 튜브 했다 vortexed, 및 30 분 메서드 E PBS 버퍼에서 단일 냉동 녹고 사이클의 구성에 대 한 단백질이 얼음에 추출한 고 4 ° c.에 24 h에 대 한 단백질 추출 1의 그리고 6 주기 (처음, 동결 및 PBS 버퍼에서 resuspended) 셀 쥡니다 얼음에 뒤 액체 질소에서 냉동의 방법 F (그림 삽입)에 의하여 이루어져 있다. 중요 한 엽록소 조 단백질 추출 물에 존재, 때문에 phycobiliproteins F. 메서드 내에서 계량 하지 했다 묘사 값 표준 편차를 나타내는 오차 막대와 3 개의 기술 복제에서 평균을 나타냅니다. 안료 농도 방정식에 따르면 (1) 및 (2)이의이 정서의 계산 했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 : 균질 시간 phycobiliprotein 추출 효율에 미치는 영향. (에 따르면이 프로토콜의 단계 3.1-3.5) Synechocystis 세포의 동결 건조 된 펠 릿 5 균질 화기에 유리 구슬과 중단 했다 s, 15, 및 20 s. 묘사 값 표준 편차를 나타내는 오차 막대와 3 개의 기술 복제에서 평균을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 : 다양 한 추출 버퍼에 Phycobiliprotein 추출 효율. PBS 버퍼, 100 mM NaCl 또는 KCl 150mm의 추가 함께 PBS 버퍼, 100 mM NaCl 또는 150 m m KCl, Hemlata 및 Fareha22에 따라 이온된 수에 및에서 정 에 따라 20 m m 나트륨 아세테이트는 phycobiliproteins 추출한 외 < / c4 >. 16. 추출 단계 4.1 4.3이이 프로토콜에 따라 4 ° C에서 수행 되었다. 묘사 값 표준 편차를 나타내는 오차 막대와 3 개의 기술 복제에서 평균을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4 : Phycobiliprotein 안정성 시간에 추출 버퍼에. 이 프로토콜의 4.1 4.3 단계에 설명 된 대로 수행 추출 절차 후 phycobiliprotein 추출 버퍼 PBS (pH 7.4)에 상당한 phycocyanin (원) 및 allophycocyanin (사각형) 저하 없이 최대 4 시간 동안 4 ° C에서 저장 되었습니다. 파선 최소 자승법에 의해 계산 하는 시간 포인트의 선형 적합을 나타냅니다. 묘사 값 표준 편차를 나타내는 오차 막대와 3 개의 기술 복제에서 평균을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
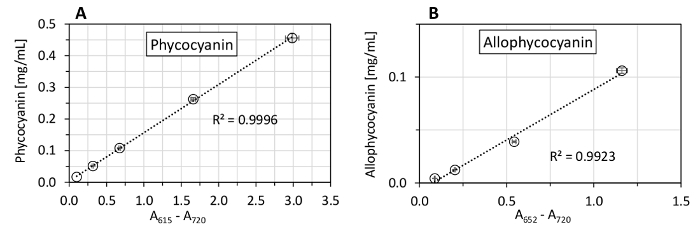
그림 5 : Phycocyanin와 allophycocyanin 농도의 대표적인 측정 Synechocystis. 고밀도 문화 정지 (phycocyanin: 456 µ g/mL, allophycocyanin: 106 µ g/mL) 점차 phycocyanin와 allophycocyanin 19 µ g/mL의 농도까지 희석 되었다. 묘사 값 표준 편차를 나타내는 오차 막대와 3 개의 기술 복제에서 평균을 나타냅니다. 점선은 최소 자승법에 의해 계산 된 농도 포인트의 선형 적합을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
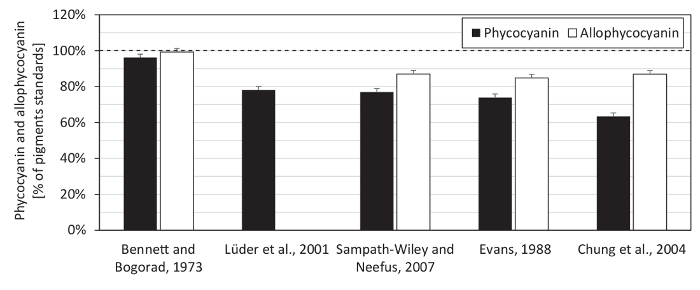
그림 6 : 안료 표준에서 phycocyanin와 allophycocyanin 농도의 추정. Phycocyanin와 안료 기준에서 allophycocyanin의 내용을 spectrophotometrically 베넷과 Bogorad12, 방정식에 따르면 측정 되었다 Lüder 외. 13, Sampath와 일리와 Neefus15, 에반스14, 그리고 정 외. 16. (필요에 따라 phycobiliproteins 결정에 대 한) 표준에 단백질 함량에서 (와 마지막 산 11.25), bicinchoninic 산, 탄산 나트륨, 주석산 나트륨, 및 0.1 N NaOH에 탄산수 소 나트륨의 솔루션을 사용 하 여 계량 했다 4% (w/v) copper(II)와 반응 황산 pentahydrate27, 소 혈 청 알 부 민 단백질 표준으로 사용 하 여. 베넷과 Bogorad의 방정식 제공 두 안료의 높은 재건: phycocyanin 표준의 96%와 allophycocyanin 표준의 99%. 묘사 값 표준 편차를 나타내는 오차 막대와 3 개의 기술 복제에서 평균을 나타냅니다. 점선된 라인 100%의 포인트를 강조 표시합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
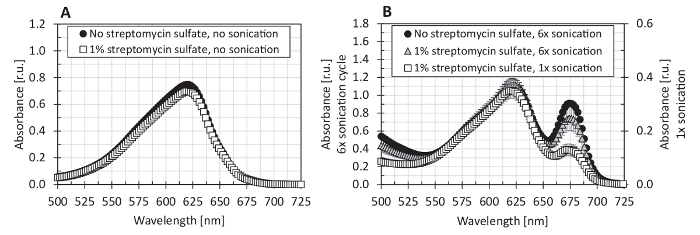
그림 7 : 조 단백질의 흡수 스펙트럼에 스 황산의 효과 추출 PBS 버퍼에. (A) 추출 절차 메서드 F PBS 버퍼 (원)에서 수행 되었다 PBS 버퍼 1% 보완에 대 한 그림 1 의 전설에 설명 된 대로 쥡니다를 사용 하 여이 프로토콜 또는 (B)의 단계 4.1 4.3에에서 설명 된 대로 스 황산 (사각형) Phycobiliprotein 정량화 5.1-5.4이이 프로토콜의 단계에 따라 수행 되었다. 묘사 값 표준 편차를 나타내는 오차 막대와 3 개의 기술 복제에서 평균을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 8 : Phycocyanin (원) 및 allophycocyanin (광장)에서 농도 Synechocystis 25-1100 µmol(photons)/(m2·s)의 진도의 레드 오렌지 빛 아래에서 재배. Synechocystis 문화 17 mM HEPES Zavrel 그 외 여러분 에 따르면 turbidostat 정권에서 보충 하는 BG11 재배 매체에 입력된 공기에 0.5% CO2 와 32 ° C에서 photobioreactor에 재배 했다 11.이 프로토콜에 따라 phycobiliprotein 농도 측정 하 고이 프로토콜의 섹션 2에에서 설명 된 대로 최종 phycobiliprotein 콘텐츠 세포 건조 중량 당 정규화 되었는지. 점선된 라인 측정된 포인트, 최소 자승법으로 계산의 전원 적합을 나타냅니다. 묘사 값 표준 편차를 나타내는 오차 막대와 3 개의 기술 복제에서 평균을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
이 프로토콜 모델 cyanobacterium Synechocystis에서 phycobiliprotein 콘텐츠의 정량화에 대 한 간단한 빠르고 재현할 수 방법을 설명합니다. 셀 균질, 단백질 추출과 phycocyanin와 allophycocyanin 정량화의 몇 가지 메서드를 비교 하 고 마지막 프로토콜의 모든 단일 절차의 최적의 단계 조합을 나타냅니다. 대표적인 데이터, phycobiliproteins의 콘텐츠는 빛의 강도 증가에서 Synechocystis 셀에 정량 했다. 비록 분석이 비슷한 시간 및 실험실 장비 이전 게시 방법12,13,14,,1516의 일부로,이 프로토콜의 장점은 아무 엽록소는 는 출시 추출 버퍼 및, 따라서, phycobiliprotein 측정으로 높은 정밀도 함께 추정 될 수 있습니다.
세포 현 탁 액 phycobiliprotein 분석에 필요한 양의 문화 밀도와 달라질 수 있습니다. 1 mL의 샘플 볼륨은 1.5, 약 2 × 107 셀/ml, 셀 밀도의 OD730 문화 또는 약 20 mg/l.의 phycobiliprotein 내용 가진 문화에 대 한 최적화 되었습니다. 경우에 희석된 문화 큰 문화 볼륨 수확. 다른 한편으로, 조밀한 문화의 경우는 낮은 문화 고밀도 문화 볼륨에서 수확, phycobiliproteins 부분적으로 추출 후 셀에 남아 있는 위험이 있다. 마찬가지로, 세포 현 탁 액 건조 중량 결정에 필요한 양의 문화 밀도와 달라질 수 있습니다. 15 mL의 샘플링 볼륨은 약 2 × 107 셀/mL의 셀 밀도 또는 1.5 OD730 와 문화에 대 한 최적화 됩니다. 낮은 밀도 문화 또는 낮은 볼륨 측정 오류가 증가할 수 있다. 그와 반대로, 더 큰 문화 볼륨 또는 밀도가 문화 더 나은 방법 해상도 제공합니다.
프로토콜의 중요 한 단계는 높은 수율 및 높은 특이성을 제공 해야 하는 셀 균질 및 phycobiliprotein 추출 합니다. 높은 수율과 순도 동시 최대 단백질 보존 추출의 freeze-drying 샘플, 유리 구슬에 의해 건조 세포 알갱이 조직 및 PBS 버퍼 ( 에서에서 phycobiliprotein 추출 수행 하 여 달성 되었다 그림 1). 때문에 의해 엽록소는 는 조 단백질 추출 물도 작은 오염 phycobiliprotein 콘텐츠과 이어질 수, 어떤 엽록소를 추출 PBS 버퍼를 추가 하 여 피할 필요가 있다. 엽록소는 는 발견 되었다 원유 추출에서 쥡니다 세포 파쇄에 사용 되었다. 보이는 것 처럼, 그림 1인세트에 쥡니다 사이클, 엽록소는 를 추출 증가의 금액을 반복. 양의 단백질을 추출 하는 다른 한편으로, (280에서 흡 광도 의해 감지 nm) 또한 쥡니다 사이클을 반복 후 증가. 따라서, 쥡니다 (액체 질소에서 냉동 해 동 주기에서)를 사용 하 여 총 단백질 추출에 대 한 적합 한 방법으로 나타납니다 (무료 고 막 도약 단백질 세포에서 발표는); 그러나, phycobiliprotein spectrophotometric 정량화 하기 위해 권장 하지 않습니다. 정 외. 엽록소는 16. 막 파편을 제거 하기 위해 1% 스 황산의 사용을 권장 여기, 스 황산의 사용 하지 때문에 염 록 소는 는 단백질 추출 물 (그림 7)에서 감소에 지도 하지 않았다 필요한 것으로 나타났다. 비록 단일 쥡니다 120 주기 s 효율적으로 세포를 중단 하지 않았다 (방법 B와 C, 그림 1), 다른 방법 (예를 들어, 메서드 F 그림 1 또는 그림 7B에 제시 하는 방법에 제시 된으로) 확인 효율적인 셀 중단 방법22,28되 쥡니다의의 이전 결과 또한 이전 phycobiliproteins 추출22,28, 효율적인 방법으로 보고 간단한 냉동 해 동 주기 (방법 E, 그림 1 여기에 설명 된 테스트에서 가장 낮은 수익률을 제공 하는 다른 한편으로, ). 균질 세포 (2 x 60 추출 버퍼 내에서 s) 지르코늄으로 구슬 동결된 세포 펠 릿 (방법 D, 그림 1)의 15-s 균질 보다 비효율적으로 테스트 되었습니다. 추출 버퍼 내에서 균질 프로시저는 더 이상 균질 시간 (10 분)29와 이전 설명 했다. 우리는 각 균질 주기 동안 크게 위로 열 하는 샘플부터 2 분 이상 균질을 테스트 하지 않았다. 문학에서 다른 셀 중단 방법 설명, 프랑스 언론16 또는 griding13,,1530;의 사용을 포함 했다 그러나, 이러한 방법은 본이 연구에서는 테스트 하지 되었습니다.
단백질 추출 15 수행 되었다 PBS 버퍼에 s (그림 2). 버퍼 pH는 이전 phycobiliprotein 추출22에 최적으로 알려졌다 7.4, 이었다. NaCl 또는 KCl의 추가 phycobiliprotein 추출 효율 (그림 3), 이전 관측22자가 당 착은 개선 되지 않았다. 그러나, 그림 3에 표시 된 대로 인산 염 버퍼 염이이 프로토콜에 사용 되는 포함 된 154 밀리미터 설치를 허용 하지 않았다 (와 뿐만 아니라 5.6 m m 나2HPO4 1mm KH2포4), NaCl는 NaCl 무료 컨트롤 PBS 추출 버퍼입니다. 우리는 또한 PBS 버퍼 및 나트륨 아세테이트 버퍼16 추출 효율 비교. 인산 나트륨 및 칼륨 인산 염 PBS 버퍼 내에서 조합 제공 높은 phycobiliproteins 생성 (그림 3). 이 발견은 Hemlata 외의 이전 결과와 대응 했다. 22.
Phycobiliprotein 추출 시간이 1 헤 긴 추출 중요 한 phycobiliprotein 저하 또는 추출 개선 (그림 4), 로렌츠 외의 이전 작업과 대응에 지도 하지 않았다 위해 최적화 되었다. 28. 1 시간 테스트 하지 보다 짧은 추출 시간. 마찬가지로, 발견 이전 인산 염 버퍼에 추출된 phycobiliproteins 적어도 48 h28안정 되어 이후 4 h에 대 한 추출 테스트 하지 했습니다.
우리 문학에서 알려진된 단백질으로 상업 기준에 모두 phycobiliproteins의 콘텐츠를 다시 계산 하 여 앞에서 설명한 대로 여러 가지 방정식 spectrophotometric phycocyanin와 allophycocyanin 정량화의 비교 농도 (그림 6)입니다. 두 안료의 최고의 개조 베넷과 Bogorad12의 방정식으로 달성 되었다. 이 결과 인산 염에는 추출 버퍼 같은 버퍼 이후로 사용 이전12,,1315. 그건 어느615,618, 그리고는620 (이전 작품에서 phycocyanin 추정에 사용 되는 파장)의 차이부터 안료 표준 관련 표준 phycocyanin에 되었고 1% 차이 650 와는652 (파장 allophycocyanin 의견12,13,,1416에 대 한 이전 사용) allophycocyanin 표준에서 3% 이었다. 마찬가지로, Synechocystis 의 단백질 추출에는615 ,620 의 차이 2%만 했다. 흡수 스펙트럼에서 이러한 작은 차이 최대 36% (그림 6)의 최종 안료 변화 될 수 없습니다. 따라서, 개별 방정식의 차이점 오히려 특정 생물12,,1314, 의 phycobiliprotein 소 광 계수 변화에 연결 했다 15 , 16 , 17. 흥미롭게도, 정 외의 방정식. 저자는 또한 그들의 실험16에 대 한 Synechocystis 을 사용 하지만 최저 phycocyanin 재건 (그림 6)를 제공 합니다.
단일 파장의 결정이 아니라는 것이 좋습니다 엽록소는 는 둘 다 방해할 수 추출에서의 존재를 추정 280-720 nm 사이 phycobiliprotein 추출의 연속 스펙트럼을 측정 하는 allophycocyanin 고 phycocyanin 흡수입니다. 또한, 280에서 흡 광도 측정 하 여 nm (280), (615/A280 또는620/A280) phycocyanin21,22 와 allophycocyanin (는652/A280)의 순도 추출 물에서 24 를 예상할 수 있는 (0.7: 음식 급료, 3.9: 반응 학년, > 4.0: 분석 등급)21.
대표적인 데이터 서 phycocyanin와 Synechocystis 에서 allophycocyanin의 농도 증가 하는 빛의 강도 따라 결정 했다. 11turbidostat 재배 정권 내에서 일정 한 레벨에서 문화 밀도 유지,21 직접 비교 실험을 위해 필수적 이었다. 2.4%-10.2%와 0.6%-phycocyanin와 allophycocyanin 농도 세포 건조 중량의 1.7% 각각, 이전에 보고 된 값11,,3132으로 유사 했다. 또한, phycobiliprotein 콘텐츠 당 셀 단위로 이전11,33보도 비슷 했다. 증가 빛 phycobiliproteins 콘텐츠 감소. 흥미롭게도, 심지어 1100 µmol (광자)의 높은 광도 아래 / (m2·s)는 phycobiliproteins 되지 않은 완전히 표백.
프로토콜 표준 장비가 필요 합니다 있기 때문에 상대적으로 빨리, 어떤 실험실 phycobiliproteins 정기적으로 분석 하에 쉽게 채택 될 수 있다.
공개
저자는 공개 없다.
감사의 말
프로토콜은 이전 게시11에서 채택 되었다. T. Z., D. ch.와 J. Č. 의해 지원 되었다 교육, 젊음 및 스포츠 국가 지속 가능성 프로그램 내에서 체코의 난 (NPU 나), 번호 LO1415를 부여. J. Č. 또한 지원 했다가 CR, 부여 번호 18-24397S. 악기 및 기타 시설에 대 한 액세스는 시스템 생물학 C4SYS (아무 LM2015055 프로젝트)에 대 한 체코 연구 인프라에 의해 지원 되었다. M. A. S. [no. 14-14-00904] 러시아 과학 재단에서 교부 금에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Synechocystis sp. PCC 6803 | Institut Pasteur, Paris, France | 6803 | Cyanobacterium strain |
| Roti-CELL PBS | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 9143.1 | Phosphate-Buffered Saline (PBS) solution, pH 7.4 |
| Eppendorf safe-lock tubes | Eppendorf, Hamburk, Germany | 30120086 | Safe-lock tubes 1.5 ml |
| VWR 80-Place Storage System | VWR International, Radnor, Pennsylvania, USA | 30128-282 | Holder for safe-lock tubes |
| RAININ 100 µl -1000 µl | Mettler-Toledo, Columbus, Ohio, USA | 17014382 | Pipette |
| GP-LTS-A-1000µL-/F-768/8 | Mettler-Toledo, Columbus, Ohio, USA | 30389272 | Pipette tips |
| Rotina 420R | Hettich, Kirchlengern, Germany | 4701 | Refrigerated centrifuge for 1.5 ml safe-lock tubes and 15 ml conical centrifuge tubes |
| LCexv 4010 | Liebherr, Bulle, Switzerland | 9005382197172 | Refrigerator and freezer -20 °C |
| Revco ExF -86°C Upright Ultra-Low Temperature Freezer | Thermo Fisher Scientific, Waltham, Massachusetts, USA | EXF24086V | Freezer -80 °C |
| CoolSafe | LaboGene, Lillerød, Denmark | 7.001.000.615 | Freeze dryer |
| UV-2600 | Shimadzu, Kyoto, Japan | UV-2600 | Spectrophotometer |
| Hellma absorption cuvettes, semi Micro | Sigma-Aldrich, St. Louis, Missouri, USA | Z600288 | VIS/UV-VIS semi-micro cuvettes 0.75-1.5 ml, spectral range 200-2500 nm |
| Silamat S6 | Ivoclar Vivadent, Schaan, Liechtenstein | 602286WU | Homogenizer |
| Solid-glass beads | Sigma-Aldrich, St. Louis, Missouri, USA | Z273627 | Glass bead of the diameter 2 mm |
| CPA225D-0CE | Sartorius AG, Göttingen, Germany | SECURA225D-1OBR | Analytical balances |
| C-Phycocyanin from Spirulina sp. | Sigma-Aldrich, St. Louis, Missouri, USA | P2172 | Phycocyanin standard |
| Allophycocyanin | Sigma-Aldrich, St. Louis, Missouri, USA | A7472 | Allophycocyanin standard |
| Bicinchoninic Acid Kit | Sigma-Aldrich, St. Louis, Missouri, USA | BCA1, B9643 | Complete kit for total proteins determination |
| AlgaeTron | Photon System Instruments Ltd., Drásov, Czech Republic | AG 130-ECO | Cultivation chamber for E. flasks, with controllable light and atmosphere |
| Photobioreactor | Photon System Instruments Ltd., Drásov, Czech Republic | FMT-150 | Cultivation equipment for cyanobacteria and algae with completely controllable environment |
| Cellometer | Nexcelom Bioscience, Lawrence, Massachusetts, USA | Auto M10 | Cell counter |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich, St. Louis, Missouri, USA | CLS430791 | 15 ml Centrifuge tube for dry weigth sampling |
| Herasafe KS | Thermo Fisher Scientific, Waltham, Massachusetts, USA | 51024579 | Laminar flow hood |
참고문헌
- Mimuro, M., Kikuchi, H. Antenna Systems and Energy Transfer in Cyanophyta and Rhodophyta. Light-Harvesting Antennas in Photosynthesis. Green, B. R., Parson, W. W. , Springer. Dordrecht, The Netherlands. 281-306 (2003).
- Spear-bernstein, L., Miller, K. R. Unique location of the phycobiliprotein light-harvesting pigment in the Cryptophyceae. Journal of Phycology. 25 (3), 412-419 (1989).
- Kirst, H., Formighieri, C., Melis, A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta - Bioenergetics. 1837 (10), 1653-1664 (2014).
- Page, L. E., Liberton, M., Pakrasi, H. B. Reduction of photoautotrophic productivity in the cyanobacterium Synechocystis sp. strain PCC 6803 by phycobilisome antenna truncation. Applied and Environmental Microbiology. 78 (17), 6349-6351 (2012).
- Sonani, R. R. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry. 7 (1), 100(2016).
- Bryant, D. A. The Molecular Biology of Cyanobacteria. , Springer Netherlands. Dordrecht, The Netherlands. (1994).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. I. Sequence features in the 1 Mb region from map positions 64% to 92% of the genome. DNA Research. 2, 191-198 (1995).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. DNA Research. 3, 109-136 (1996).
- Grigorieva, G., Shestakov, S. Transformation in the cyanobacterium Synechocystis sp 6803. FEMS Microbiology Letters. 13 (4), 367-370 (1982).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp: PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), (2015).
- Zavřel, T., Očenášová, P., Červený, J. Phenotypic characterization of Synechocystis sp. PCC 6803 substrains reveals differences in sensitivity to abiotic stress. PLoS One. 12 (12), e0189130(2017).
- Bennett, A., Bogorad, L. Complementary chromatic adaption in a filamentous blue-green alga. The Journal of Cell Biology. 58, 419-435 (1973).
- Lüder, U. H., Knoetzel, J., Wiencke, C. Acclimation of photosynthesis and pigments to seasonally changing light conditions in the endemic antarctic red macroalga Palmaria decipiens. Polar Biology. 24 (8), 598-603 (2001).
- Evans, L. V. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Experimental Phycology: A Laboratory Manual. Lobban, C. S., Chapman, D. J., Kremer, B. P. , Cambridge University Press. Cambridge, New York, New Rochelle, Melbourne, Sydney. 123-133 (1988).
- Sampath-Wiley, P., Neefus, C. D. An improved method for estimating R-phycoerythrin and R-phycocyanin contents from crude aqueous extracts of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology. 19 (2), 123-129 (2007).
- Chung, Y. H., Park, Y. M., Moon, Y. J., Lee, E. M., Choi, J. S. Photokinesis of Cyanobacterium Synechocystis sp. PCC 6803. Journal of Photoscience. 11 (3), 89-94 (2004).
- Sun, L., et al. Phycobilisomes from Cyanobacteria. Handbook on Cyanobacteria: Biochemistry, Biotechnology and Applications. Gault, P. M., Marler, H. J. , Nova Science Publishers, Inc. New York, NY. 105-160 (2009).
- Six, C., et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: A comparative genomics study. Genome Biology. 8 (12), (2007).
- Sinetova, M. A., Červený, J., Zavřel, T., Nedbal, L. On the dynamics and constraints of batch culture growth of the cyanobacterium Cyanothece sp. ATCC 51142. Journal of Biotechnology. 162 (1), (2012).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp. PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), 122-132 (2015).
- Hemlata, G., Fareha, B. Studies on Anabaena sp. nccu-9 with special reference to phycocyanin. Journal of Algal Biomass Utilization. 2 (1), 30-51 (2011).
- Rito-Palomares, M., Nuez, L., Amador, D. Practical application of aqueous two-phase systems for the development of a prototype process for c-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology & Biotechnology. 76 (12), 1273-1280 (2001).
- Zhang, H., et al. Selenium-Containing Allophycocyanin Purified from Selenium-Enriched Spirulina platensis Attenuates AAPH-Induced Oxidative Stress in Human Erythrocytes through Inhibition of ROS Generation. Journal of Agricultural and Food Chemistry. 59 (16), 8683-8690 (2011).
- Nedbal, L., Trtílek, M., Cervený, J., Komárek, O., Pakrasi, H. B. A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high-content analysis of suspension dynamics. Biotechnology and Bioengineering. 100 (5), 902-910 (2008).
- Zavřel, T., Knoop, H., Steuer, R., Jones, P. R., Červený, J., Trtílek, M. A quantitative evaluation of ethylene production in the recombinant cyanobacterium Synechocystis sp. PCC 6803 harboring the ethylene-forming enzyme by membrane inlet mass spectrometry. Bioresource Technology. 202, 142-151 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Lawrenz, E., Fedewa, E. J., Richardson, T. L. Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology. 23 (5), 865-871 (2011).
- Lea-Smith, D. J., et al. Phycobilisome-Deficient Strains of Synechocystis sp. PCC 6803 Have Reduced Size and Require Carbon-Limiting Conditions to Exhibit Enhanced Productivity. Plant Physiology. 165 (2), 705-714 (2014).
- Seo, Y. C., et al. Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process. International Journal of Molecular Sciences. 14 (1), 1778-1787 (2013).
- Touloupakis, E., Cicchi, B., Torzillo, G. A bioenergetic assessment of photosynthetic growth of Synechocystis sp. PCC 6803 in continuous cultures. Biotechnology for Biofuels. 8 (1), 133(2015).
- Touloupakis, E., Cicchi, B., Benavides, A. M. S., Torzillo, G. Effect of high pH on growth of Synechocystis sp. PCC 6803 cultures and their contamination by golden algae (Poterioochromonas sp.). Applied Microbiology and Biotechnology. 100 (3), 1333-1341 (2016).
- Ishii, A., Hihara, Y. An AbrB-Like Transcriptional Regulator, Sll0822, Is Essential for the Activation of Nitrogen-Regulated Genes in Synechocystis sp. PCC 6803. Plant Physiology. 148 (1), 660-670 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유