Method Article
Dosage spectrophotométrique du Phycobiliprotein en cyanobactérie Synechocystis
Dans cet article
Résumé
Nous présentons ici un protocole pour déterminer quantitativement le contenu de phycobiliprotein dans la cyanobactérie Synechocystis en utilisant une méthode spectrophotométrique. La procédure d’extraction a été appliquée avec succès à d’autres souches de cyanobactéries et les algues ; Toutefois, en raison des variations dans les spectres d’absorption de pigment, il est nécessaire de tester les équations spectrophotométriques pour chaque souche individuellement.
Résumé
Il s’agit d’un protocole simple pour la détermination quantitative de la teneur en phycobiliprotein dans la cyanobactérie modèle Synechocystis. Phycobiliprotéines sont les éléments les plus importants des phycobilisomes, les antennes de lumière majeurs chez les cyanobactéries et plusieurs taxons d’algues. Les phycobilisomes de Synechocystis contiennent deux phycobiliprotéines : phycocyanine et allophycocyanin. Ce protocole décrit une simple, efficace et une méthode fiable pour la détermination quantitative de phycocyanine et allophycocyanin dans cette cyanobactérie modèle. Nous avons comparé plusieurs méthodes d’extraction de phycobiliprotein et de dosage spectrophotométrique. La procédure d’extraction tel que décrit dans le présent protocole a été appliquée avec succès à d’autres souches de cyanobactéries comme sp de Spirulina SP., Synechococcuselongatus, Cyanothece ., Arthrospira sp., et Nostoc SP., aussi bien quant à l’algue rouge Porphyridium cruentum. Cependant, les coefficients d’extinction des phycobiliprotéines spécifiques des différents taxons peuvent différer et il est donc recommandé de valider la méthode de dosage spectrophotométrique pour chaque souche unique individuellement. Le protocole exige peu de temps et peut être effectué dans un laboratoire de sciences de la vie standard car il nécessite des équipements standard uniquement.
Introduction
fPhycobiliproteins sont des complexes de pigment-protéine soluble dans l’eau qui représentent les principaux éléments des antennes chez les procaryotes cyanobactéries (cyanophytes) lumière et plusieurs taxons eucaryotes (Glaucophyta, Rhodophyta et Cryptophyta)1. Ils se produisent principalement sous forme de complexes supramoléculaires appelés phycobilisomes et ils sont généralement attachés à la surface des membranes photosynthétiques côté stromal, à l’exception de Cryptophyta, où les phycobiliprotéines sont localisées dans le thylakoïde lumen2. Quatre types de phycobiliprotéines ont été identifiées jusqu'à date : l’allophycocyanin de base et le périphérique de phycocyanine, phycoérythrine et phycoerythrocyanin1. Les principaux complexes de lumière, phycobilisomes représentent un des facteurs essentiels de la productivité des cultures masse algues et cyanobactéries. Il a été démontré que cette troncature phycobilisomes peut améliorer l’accumulation de la biomasse sous forte lumière3. En revanche, éclairement faible ou modeste, la troncature de l’antenne a conduit à des taux de croissance et d’accumulation de biomasse réduction3,4. Phycobiliprotéines sont commercialement utilisées comme colorants alimentaires, produits pharmaceutiques et les additifs alimentaires, dans l’industrie cosmétique et comme la fluorescence des sondes avec des applications en cytométrie en flux, fluorescents immuno-essais et microscopie de fluorescence5.
Ce protocole met l’accent sur la détermination quantitative des phycobiliprotéines dans la cyanobactérie modèle Synechocystis. Les cyanobactéries sont les premiers autotrophes photosynthétiques oxygénique ; ils ont été formant la biosphère de la terre depuis plus de 2,4 milliards d’années6. Ils jouent un rôle crucial dans les cycles biogéochimiques mondiaux d’azote, carbone, d’oxygène et d’autres éléments. Chez les cyanobactéries, une souche unicellulaire Synechocystis acquis une position unique puisqu’il s’agissait de la première cyanobactérie avec tout le génome séquencé7,8, il est naturellement transformable par l’ADN exogène9, et Il réalise une croissance stable et relativement rapide,10,11. Synechocystis, la composante de base antenne, allophycocyanin, est associée à des protéines membranaires intrinsèques, en la phycocyanine ci-joint est situé à la périphérie de membrane des thylakoïdes.
Plusieurs méthodes d’extraction de phycobiliprotein et de quantification sont comparées dans ce protocole. La procédure d’extraction finale a été appliquée avec succès aux Synechocystis, ainsi qu’à d’autres souches de cyanobactéries, y compris les sp de Spirulina SP., Synechococcuselongatus, Cyanothece ., Arthrospira SP.et Nostoc SP. et il a été également avec succès appliqués aux algues rouges Porphyridium cruentum. Donc, la méthode développée dans le présent protocole peut être considérée comme une méthode universelle pour l’extraction de phycobiliprotein. Même si certaines des méthodes éprouvées d’extraction a entraîné des rendements plus élevés de protéines totales, l’ici visées procédure d’extraction pourvu le phycobiliprotein plus haut rendements ainsi que la plus faible teneur d’un résidu de la chlorophylle dans la extrait de phycobiliprotein. Réduire la teneur en chlorophylle a a été essentielle à la phycocyanine correcte et allophycocyanin dosage spectrophotométrique.
Les spectres d’absorption de phycobiliprotein peut varier considérablement entre les différentes algues et cyanobactéries espèces12,13,14,15,16,17 et même parmi plusieurs souches d’un genre de cyanobactéries unique18. Par conséquent, les longueurs d’onde spécifiques et les coefficients d’absorption tel qu’utilisé pour la détermination de la phycocyanine et allophycocyanin dans Synechocystis ne sont pas généralement applicables à d’autres souches. En outre, Synechocystis ne contient pas de phycoérythrine et phycoerythrocyanin que l'on retrouve dans d’autres algues et cyanobactéries. Aux fins de la détermination des phycobiliprotéines chez les souches autres que Synechocystis, il est recommandé d’évaluer individuellement les équations spectrophotométriques pour chaque souche.
Même si le protocole contient deux étapes plus longues (du jour au lendemain la lyophilisation des granules cellulaires et extraction de protéine 1 heure), le temps de travail total pour la quantification des phycobiliprotéines n’excède pas 2 heures.
Protocole
1. culture de cyanobactéries
- Cultiver des cellules Synechocystis en flacons Erlenmeyer ou photobioréacteurs10,19 en tampon BG11 moyen20 pour maintenir un pH de < 10 (par exemple, à l’aide de 17 mM HEPES10).
Remarque : Les conditions de culture Standard nécessitent une température contrôlée (généralement, 30 ° C, la température optimale est de 35 ° C)21, l’éclairage (en règle générale, une lumière blanche d’une intensité jusqu'à 800 µmol [photons] / [m2·s])21et un CO alimentation en 2 (dans le 400 mL plat photobioréacteur, la croissance saturant la concentration de CO2 est de 1 700 ppm)21. - Pour déterminer la densité de la culture, mesurer la densité optique de culture par spectrophotométrie à 730 nm (OD730), en utilisant une cuvette avec un trajet optique de 1 cm. par ailleurs, compter les cellules au microscope à l’aide d’un hémocytomètre ou une cellule automatisée compteur.
2. préparation des échantillons
- Travailler sous faible éclairement à prévenir la dégradation de le phycobiliprotein.
- Récolte 3 x 1 mL de suspension de la culture aux tubes de coffre-fort-serrure. Utilisez réanalysés pour l’estimation des erreurs techniques dans la mesure. Pour effectuer l’échantillonnage de la culture dans des conditions stériles, récolter les cellules dans une hotte laminaire et suivre les bonnes pratiques de travail et de sécurité.
- Centrifuger les cellules à 15 000 x g à la température du laboratoire pendant 5 min. faites attention au rotor de la centrifugeuse correctement équilibré. Après centrifugation, jeter le surnageant. Veillez à ne pas déranger le culot.
- Placer les échantillons dans un congélateur. Pour le stockage à long terme, conserver les échantillons à-80 ° C. Cela est nécessaire pour prévenir la dégradation de le phycobiliprotein. Pour le stockage à court terme,-20 ° C est suffisante.
- Lyophiliser les échantillons du jour au lendemain. Pour un bon processus de lyophilisation, maintenir la température du condenseur lyophilisateur au-dessous de-60 ° C et la pression dans la chambre de lyophilisateur autour de 1 hPa.
- Après avoir terminé le cycle de lyophilisation, fermer le tube dès que possible pour empêcher la réabsorption de l’eau de l’air.
3. cellule d’homogénéisation et d’Extraction des Pigments
- Ajoutez quatre morceaux de perles de verre (avec un diamètre de 2 mm) dans chaque tube d’échantillon et fermer les tubes.
Remarque : Lorsque le couvercle du coffre fort-serrure tube utilisé pour l’homogénéisation est trop mince, elle peut rompre pendant l’homogénéisation ; par conséquent, seulement des tubes de coffre-fort-serrure avec couvercles fortes sont recommandés pour ce protocole. - Homogénéiser les échantillons avec les perles de verre pour 15 s sur un homogénéisateur à température du laboratoire.
Remarque : Un échantillon bien homogénéisé est réparti sur la surface entière interne des tubes safe-lock. - Ajouter 1 mL de tampon PBS (pH 7,4), refroidi à 4 ° C, pour les échantillons afin d’en dégager les phycobiliprotéines.
Remarque : Cette étape sur, garder les échantillons sur la glace pour empêcher la dégradation des protéines extraites. Ceci est crucial. - Mélanger les échantillons avec du PBS pendant 5 s sur l’homogénéisateur à température du laboratoire.
Remarque : Après avoir mélangé, les échantillons sont verdâtres. - Après avoir mélangé, conserver les échantillons sur la glace pour 60 min. de la couverture du bain de glace avec un couvercle à prévenir la dégradation des pigments.
- Après 60 min d’extraction phycobiliprotein, centrifuger les échantillons à 15 000 x g à 4 ° C pendant 5 min. faites attention à bien équilibrer le rotor de la centrifugeuse.
Remarque : Après la centrifugation, le surnageant a une couleur bleu cyan.
4. Quantification de le Phycobiliprotein
- Avant la mesure spectrophotométrique, calibrer le spectrophotomètre à la ligne de base à l’aide de la mémoire tampon PBS comme blanc.
- Une fois calibré le spectrophotomètre, jetez les PBS d’une cuvette de spectrophotomètre et Pipeter le surnageant avec extraits phycobiliprotéines plutôt qu’avec le tampon mis au rebut.
- Quantifier la concentration phycobiliprotein par spectrophotométrie, en utilisant une largeur de fente de 0,5 nm.
- Mesurer l’absorbance de la phycocyanobilins en phycocyanine et allophycocyanin contre le tampon PBS vide à 615 nm (un615) et 652 nm (une652), respectivement, et mesurer l’absorbance des débris cellulaires à 720 nm (720).
- Calculer la concentration de phycocyanine et allophycocyanin selon les équations (1) et (2) de Bennett et Bogorad12:

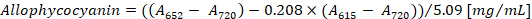
Remarque : Un615, une652et une720 doivent correspondre à la gamme linéaire absorbance du spectrophotomètre. Si nécessaire, diluer l’échantillon avec le tampon PBS.
- Recalculer la concentration de pigment dans les échantillons originaux. La concentration de pigment dans l’échantillon correspond directement avec les résultats des équations (1) et (2) lorsque les 1 mL de culture et 1 mL de tampon d’extraction sont utilisés pour l’analyse. En cas d’utilisation de différents volumes d’échantillons de cyanobactéries et/ou tampon PBS, la concentration de pigment final devrait être calculée selon l’équation (3) :
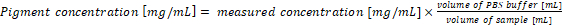 (3)
(3)
Remarque : Dans le cas d’une teneur en phycobiliprotein normalisant par poids sec de cellule, la concentration de pigment final devrait être calculée selon l’équation (4)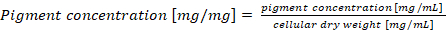 (4)
(4)
5. détermination de la masse sèche de cellulaire (facultative)
- Peser trois tubes vides de coffre-fort-serrure sur balances analytiques.
ATTENTION : Il est essentiel que les tubes de coffre-fort-serrure sont secs. En cas de stockage les tubes dans un environnement humide, sécher les tubes pendant plusieurs heures dans un séchoir avant la pesée de leur gel. Manipuler les tubes doucement et uniquement avec les mains gantées poudré pour éviter tout contact entre le matériel et les doigts du chercheur. Gardez tous les détenteurs et centrifuger propre afin d’éviter le transfert de matériel aux tubes. - 1 x 15 mL de suspension de la culture au tube conique de 15 mL de l’échantillon.
- Centrifuger la suspension bactérienne dans les tubes coniques 15 mL à 4 000 x g à la température de laboratoire pendant 10 min. équilibre le rotor de la centrifugeuse avec trois autres tubes coniques 15 mL, chaque contenant 15 mL d’eau. Après centrifugation, éliminer 12 mL du surnageant.
- Resuspendre le culot dans le surnageant restant et transfert 3 x 1 mL du mélange à trois tubes de coffre-fort-serrure de 1,5 mL avec une pipette. Dans le cas où certains restes de la pastille restent dans le tube conique de 15 mL, ajouter 1,5 mL d’eau désionisée au tube à fond conique, vortex ou secouer le tube pour remettre en suspension les autres pellets et transférer 3 x 0,5 mL du mélange dans les trois tubes de coffre-fort-serrure de 1,5 mL (déjà containi ng 3 x 1 mL de l’extrait concentré) avec une pipette.
NOTE : Divisant le culot sur trois tubes de coffre-fort-serrure de 1,5 mL permettra l’estimation d’erreur technique de la mesure de poids sec. - Centrifuger les cellules dans des tubes de coffre-fort-serrure de 1,5 mL à 15 000 x g à la température du laboratoire pendant 5 min. équilibre le rotor de la centrifugeuse avec un tuyau additionnel de coffre-fort-serrure de 1,5 mL contenant 1 mL d’eau. Après la centrifugation, jeter le surnageant.
- Placer les échantillons dans le congélateur. Pour le stockage à long terme, conserver les échantillons à-80 ° C ; pour le stockage à court terme,-20 ° C est suffisante.
- Lyophiliser les échantillons du jour au lendemain. Pour un bon processus de lyophilisation, maintenir la température du condenseur sèche-linge gel au-dessous de-90 ° C et la pression dans la chambre de lyophilisateur autour de 1 hPa.
- Après lyophilisation, fermer les tubes et peser les échantillons sur les balances analytiques.
Remarque : La valeur de poids sec utilisable pour la normalisation de la teneur en phycobiliprotein par le poids sec de cellule.
Résultats
Pour les essais de la méthode initiale, Synechocystis a été cultivé comme cultures en batch en Erlenmeyers sur un agitateur BG11 culture moyenne20 (additionné de 17 mM HEPES) à 25 ° C, sous une lumière blanche chaude d’une intensité de 50 µmol (photons) / (m 2·s) et avec 1 % de CO2 dans l’atmosphère de culture. Au cours de la culture, les cultures ont été échantillonnés à tubes safe-lock et centrifugé (15 000 x g à la température du laboratoire pendant 5 min), le surnageant a été écarté, et les échantillons ont été soit conservés à-80 ° C et lyophilisés comme préparation pour le différentes étapes du présent protocole ou stockées à-20 ° C à-80 ° C pour l’analyse comparative d’extraction et d’analyses quantitatives.
Les procédures d’extraction testées inclus désorganisation cellulaire par sonication, homogénéisation avec perles de zircone dans le tampon PBS et gel-dégel. Les résultats des différentes méthodes d’extraction sont résumés dans la Figure 1. La méthode décrite dans le présent protocole fourni que les phycobiliprotéines plus hauts rendements ainsi que la plus basse chlorophylle une contamination dans le tampon d’extraction. La chlorophylle a a été détecté dans le tampon d’extraction lorsque sonication a été utilisée pour l’interruption de la cellule. Répétition des cycles de gel et dégel les échantillons dans un bain à ultrasons sur la glace ont entraîné des rendements plus élevés de protéine dans le tampon d’extraction. Toutefois, dans le même temps, la concentration de chlorophylle a dans le tampon d’extraction a augmenté (Figure 1 encart), qui excluait une quantification de contenu phycobiliprotein correcte.
Le temps d’homogénéisation optimale était de 15 s. homogénéisation pour les deux plus courtes (5 s) et plus longue (20 s) périodes fourni des rendements légèrement inférieurs de phycobiliprotein, comme illustré à la Figure 2. Homogénéisation des cellules avec des perles de verre d’un diamètre de 2 mm a entraîné les rendements les plus élevés en comparaison avec des perles de verre d’un diamètre de 0,5 mm, 1 mm ou 4 mm, avec des perles de zircon d’un diamètre de 0,5 mm ou avec des grains de sable de mer. Le tampon d’extraction de PBS a été testé comme le tampon optimale pour les phycobiliprotéines extraction (Figure 3). L’ajout de NaCl de 100 mM ou 150 mM KCl le tampon PBS ou de l’eau n’a pas augmenté l’efficacité d’extraction phycobiliprotein, et les mêmes sont allés pour l’utilisation d’un tampon acétate de sodium 20 mM pour l’extraction (Figure 3). Le temps d’extraction optimale phycobiliprotein était 60minutes parce que, après plus de temps (jusqu'à 240 minutes), la concentration de phycobiliprotein dans le tampon d’extraction ne change pas significativement (Figure 4).
Nous avons également testé la gamme spectrophotomètre de linéarité pour la mesure de la phycobiliprotein (Figure 5) et comparé plusieurs équations de quantification de le phycobiliprotein, en utilisant des normes de la phycocyanine et allophycocyanin (Figure 6). Le spectrophotomètre utilisé dans le présent protocole a montré un éventail d’absorption linéaire entre 0,1 - 3.0 (Figure 5). Étant donné que les spectres de la protéine extrait avait son absorption maximale environ 620 nm (un620) et à 652 nm, l’absorption (A652) n’était que de 33 % d’un620 (Figure 7), la linéarité du spectrophotomètre pour un652 (maximum allophycocyanin absorbance) a été testé seulement jusqu'à une652 de 1,16. Les équations (1) et (2) de Bennett et Bogorad12 a fourni la meilleure reconstruction des normes de la phycocyanine et allophycocyanin parmi toutes les équations testées (Figure 6). Sulfate de streptomycine, utilisé dans plusieurs études antérieures pour l’élimination de la membrane des fragments contenant la chlorophylle a, a été montré ne pas nécessaire pour l’extraction (Figure 7).
Pour l’expérience représentative, Synechocystis était cultivée dans un photobioréacteur25 dans un régime turbidostat, où les cellules ont été maintenues en phase de croissance exponentielle dans une plage définie de la densité optique (mesuré à 680 nm, OD 680) par une dilution contrôlée par une culture fraîche moyen (medium BG11 tamponnée avec 17 mM HEPES)11,26. Les cultures sont cultivées à 32 ° C et l’air d’entrée contenue 0,5 % CO2. Les cultures ont été éclairés par une lumière rouge (λmax: 633 nm, λ1/2: 20 nm) d’une intensité de 25-1100 µmol (photons) / (m2·s), ainsi qu’une lumière bleue (λmax: 445 nm, λ1/2: 20 nm) d’une intensité de 25 µmol ( photons) / (m2·s). La densité optique de la suspension bactérienne a été mesurée par la base photobioréacteur, et la gamme de OD680 a été fixé à 0,52 - 0,58 (2 x 107 à 4 x 107 cellules/mL). Les cultures ont été cultivées dans le cadre de chaque intensité lumineuse spécifique pendant au moins 24 heures pour fournir assez de temps pour l’acclimatation. Après avoir atteint la stabilité de la croissance, les cultures ont été échantillonnés pour poids sec (selon mesures 2.1-2.8 du présent protocole), globules et teneur en phycocyanine et allophycocyanin. Les résultats de l’évaluation de la phycobiliprotein en plus des intensités lumineuses sont indiquées à la Figure 8. Synechocystis a diminué la teneur en phycobiliprotein de 12 % du poids sec cellulaire (505 fg/cellule) en vertu de l’irradiance plus bas à 3 % du poids sec cellulaire (280 fg/cellule) en vertu de l’éclairement énergétique plus élevé.

Figure 1 : Comparaison de l’efficacité de l’extraction de la méthode décrite dans le présent protocole avec plusieurs méthodes de référence. La concentration de la phycocyanine (barres noires) et allophycocyanin (barres blanches) dans l’extrait de protéine brute a été mesurée après que extraction dans le tampon PBS pour 60 min. la méthode A est décrite dans le présent protocole. La méthode B a été modifiée comme suit : après la récolte, les cellules ont été centrifugés (15 000 x g à la température du laboratoire pendant 5 min) et stockés à-20 ° C durant la nuit. Les échantillons congelés ont été sonication pour 120 s à 4 ° C et les phycobiliprotéines ont été extraites dans le tampon PBS pour 60 min. méthode C modification de la méthode B de stockage des pellets de cellules récoltées à-80 ° C pendant 30 min, lyophilisation les granules cellulaires et ajoutant tampon PBS pour les granulés secs. Méthode D modification de Chung et al. 16: après lyophilisation (même comme dans la méthode C), 0,25 mL de Na-acétate avec 1 % streptomycine sulfate solution tampon (pH 5,5) a été ajouté au culot cellulaire sec, ainsi que de 0,25 mL de perles de zirconium (d’un diamètre de 0,5 mm), et les échantillons ont été homogénéisés deux fois pendant 60 s sur l’homogénéisateur. Après homogénéisation, un autre 0,5 mL de Na-acétate avec tampon de sulfate de streptomycine 1 % (pH 5,5) a été ajouté à l’échantillon, les tubes ont été mixés et les protéines ont été extraites sur glace pour 30 min. méthode E consistait en un seul cycle de gel-dégel dans le tampon PBS et extraction de protéine pendant 24 h à 4 ° C. Méthode F (encart figure) consistait en un et six cycles de congélation des cellules (initialement, lyophilisé et resuspendu dans un tampon PBS) dans l’azote liquide, suivi par sonication sur la glace. En raison de l’importante chlorophylle présente dans l’extrait de protéines brutes, les phycobiliprotéines n’étaient pas quantifiés dans la méthode F. Les valeurs représentées représentent des moyennes de trois répétitions techniques, avec les barres d’erreur qui représente les écarts-types. Concentrations de pigments ont été calculées selon les équations (1) et (2) du présent protocole. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Effet de l’époque d’homogénéisation sur l’efficacité d’extraction de phycobiliprotein. Les granules lyophilisées de cellules Synechocystis (selon mesures 3.1-3.5 du présent protocole) ont été perturbées avec des perles de verre sur homogénéisateur pendant 5 s, 15 s et 20 s. Les valeurs représentées représentent des moyennes de trois répétitions techniques, avec les barres d’erreur qui représente les écarts-types. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : L’efficacité dans divers tampons d’extraction extraction Phycobiliprotein. Les phycobiliprotéines ont été extraites dans le tampon PBS, dans le tampon PBS avec un ajout de NaCl de 100 mM ou 150 mM KCl, dans l’eau désionisée avec NaCl 100 mM ou 150 mM KCl, selon Marie et Maxime22et dans l’acétate de sodium 20 mM selon Chung et coll. < / C4 >. 16. l’extraction a été réalisée à 4 ° C selon les étapes 4.1-4.3 du présent protocole. Les valeurs représentées représentent des moyennes de trois répétitions techniques, avec les barres d’erreur qui représente les écarts-types. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 4 : Phycobiliprotein de stabilité dans le tampon d’extraction dans le temps. Après la procédure d’extraction, interprétée comme indiqué aux paragraphes 4.1-4.3 du présent protocole, l’extrait de phycobiliprotein dans le tampon PBS (pH 7,4) était stockée à 4 ° C pendant 4 heures, avec aucune importante phycocyanine (cercles) et de la dégradation de l’allophycocyanin (carrés). La ligne pointillée représente l’ajustement linéaire des points temps calculé par la méthode des moindres carrés. Les valeurs représentées représentent des moyennes de trois répétitions techniques, avec les barres d’erreur qui représente les écarts-types. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
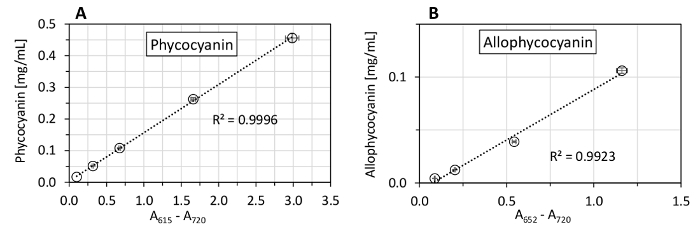
Figure 5 : Mesures représentatives des concentrations de phycocyanine et allophycocyanin dans Synechocystis. Une suspension dense de la culture (phycocyanine : 456 µg/mL, allophycocyanin : 106 µg/mL) a été progressivement dilué à une concentration de 19 µg/mL pour les phycocyanine et allophycocyanin. Les valeurs représentées représentent des moyennes de trois répétitions techniques, avec les barres d’erreur qui représente les écarts-types. La ligne pointillée représente l’ajustement linéaire des points de concentration calculée par la méthode des moindres carrés. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
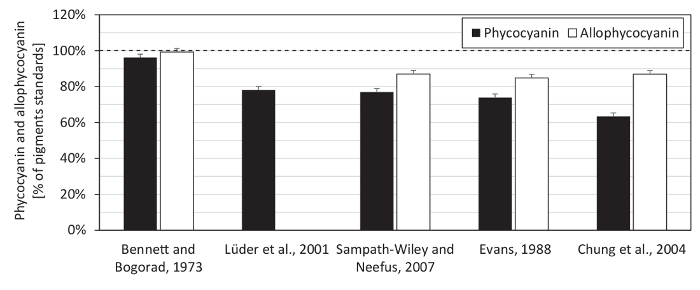
Figure 6 : Estimation des concentrations de phycocyanine et allophycocyanin dans les normes de pigments. Le contenu de phycocyanine et allophycocyanin dans les normes de pigment a été mesuré par spectrophotométrie selon les équations de Bennett et Bogorad12, Lüder et al. 13, Sampath-Wiley et Neefus15, Evans14et Chung et al. 16. la teneur en protéines dans les normes (comme nécessaire pour la détermination des phycobiliprotéines) a été quantifiée à l’aide d’une solution d’acide bicinchoninic, carbonate de sodium, tartrate de sodium et bicarbonate de sodium dans NaOH 0,1 N (avec un pH final de 11,25), en réaction avec 4 % (p/v) cuivre (II) sulfate pentahydraté27, à l’aide de l’albumine sérique bovine comme la protéine étalon. Les équations de Bennett et Bogorad fourni la reconstruction plus élevée des deux pigments : 96 % de phycocyanine standard et 99 % des allophycocyanin standard. Les valeurs représentées représentent des moyennes de trois répétitions techniques, avec les barres d’erreur qui représente les écarts-types. La ligne pointillée met en évidence le point 100 %. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
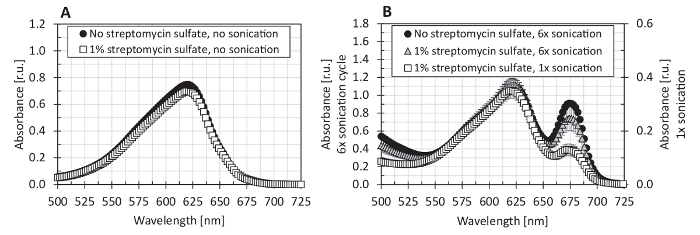
Figure 7 : L’effet du sulfate de streptomycine sur le spectre d’absorption de la protéine brute extrait dans le tampon PBS. (A), l’extraction de procédure comme décrit aux points 4.1-4.3 du présent protocole ou (B) à l’aide de sonication, tel que décrit dans la légende de la Figure 1 pour méthode F a été effectuée dans le tampon PBS (cercles) et dans le tampon PBS additionné de 1 % sulfate de streptomycine (carrés). La quantification de le phycobiliprotein a été réalisée selon les étapes 5.1 à 5.4 du présent protocole. Les valeurs représentées représentent des moyennes de trois répétitions techniques, avec les barres d’erreur qui représente les écarts-types. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 8 : Concentration de la phycocyanine (cercles) et allophycocyanin (carrés) dans Synechocystis cultivées sous lumière rouge-orange d’une intensité de 25-1100 µmol(photons)/(m2·s). Synechocystis cultures étaient cultivées dans un photobioréacteur à 32 ° C, avec 0,5 % de CO2 dans l’air d’entrée, dans un milieu de culture BG11 additionné de 17 mM HEPES dans un régime turbidostat selon Zavrel et al. 11. le phycobiliprotein a dosé selon ce protocole et la teneur en phycobiliprotein final a été normalisée par cellulaire de poids sec, tel que décrit à l’article 2 du présent protocole. Les lignes en pointillés représentent l’ajustement de la puissance des points mesurés, calculée par la méthode des moindres carrés. Les valeurs représentées représentent des moyennes de trois répétitions techniques, avec les barres d’erreur qui représente les écarts-types. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Ce protocole décrit une méthode simple, rapide et reproductible pour la quantification de la teneur en phycobiliprotein dans la cyanobactérie modèle Synechocystis. Plusieurs méthodes d’homogénéisation de la cellule, d’extraction de protéine et quantification de phycocyanine et allophycocyanin sont comparés, et le protocole final représente une combinaison des mesures optimales de chaque procédure unique. Comme les données représentatives, le contenu des phycobiliprotéines a été quantifié dans Synechocystis cellules en augmentant l’intensité de la lumière. Bien que l’analyse exige temps similaires et équipement de laboratoire comme certains des méthodes publiées antérieurement12,13,14,15,16, l’avantage de ce protocole est que sans chlorophylle a est libéré dans le tampon d’extraction et, par conséquent, la mesure de phycobiliprotein peut être estimé avec une grande précision.
La quantité de suspension cellulaire requise pour l’analyse de phycobiliprotein peut varier avec la densité de culture. Le volume de l’échantillon de 1 mL est optimisé pour les cultures avec une OD730 de 1,5, une densité d’environ 2 x 107 cellules/mL, ou pour les cultures avec une teneur en phycobiliprotein d’environ 20 mg/L. Dans le cas de cultures dilués, récolter un plus grand volume de culture. En revanche, dans le cas de cultures denses, récolte une basse culture volume-en haute densité des cultures, il y a un risque que les phycobiliprotéines restent partiellement dans les cellules après l’extraction. De même, la quantité de suspension de cellules nécessaire à la détermination de la masse sèche peut varier selon la densité de culture. Le volume de prélèvement d’échantillons de 15 mL est optimisé pour les cultures avec une OD730 de 1,5 ou avec une densité d’environ 2 x 107 cellules/mL. Avec des cultures de densité plus faibles, ou avec la baisse des volumes, l’erreur de mesure peut augmenter. Au contraire, les plus gros volumes de culture ou de cultures plus denses fournissent meilleure résolution de méthode.
Les étapes critiques du protocole sont l’extraction d’homogénéisation et phycobiliprotein cellulaire qui devrait fournir les rendements élevés et une grande spécificité. Les plus hauts rendements et pureté des extraits avec préservation protéique maximale simultanée a été réalisée par lyophilisation des échantillons, homogénéisation des granulés secs cellulaires par des billes de verre et la réalisation de l’extraction de phycobiliprotein dans le tampon PBS ( Figure 1). Étant donné que même une petite contamination de l’extrait de protéines brutes par chlorophylle un peut conduire à une surestimation de contenu phycobiliprotein, il est nécessaire d’éviter toute une extraction chlorophylle en ajoutant de la mémoire tampon PBS. La chlorophylle a a été détecté dans l’extrait brut lorsque la sonication a été utilisée pour la rupture de la cellule. Comme indiqué dans l’encart de la Figure 1, avec des cycles de la sonication, la quantité de chlorophylle a dans l’extrait a augmenté de répétition. En revanche, la quantité d’extrait de protéines (tel que détecté par l’absorbance à 280 nm) a également augmenté après répétition de cycles de sonication. Par conséquent, l’utilisation de la sonication (en combinaison avec des cycles de gel-dégel dans l’azote liquide) apparaît comme une méthode appropriée pour l’extraction de protéines totales (protéines libres et liée à la membrane sont libérées des cellules) ; Cependant, il n’est pas recommandé pour l’application de phycobiliprotein dosage spectrophotométrique. Chung et al. recommandé l’utilisation de sulfate de streptomycine 1 % afin d’éliminer les fragments de la membrane avec la chlorophylle a16. Ici, l’utilisation de sulfate de streptomycine paraîtrait ne pas nécessaire puisqu’il n’a pas conduit à une réduction de la chlorophylle a dans l’extrait de protéine (Figure 7). Même si une sonication seule cycle pour 120 s ne pas perturber les cellules efficacement (méthodes B et C, Figure 1), autres méthodes (par exemple, la méthode F tel que présenté dans la Figure 1 ou les méthodes présentées dans la Figure 7 b) confirment résultats antérieurs de la sonication étant une méthode de perturbation efficace cellule22,28. En revanche, les cycles gel-dégel simples, aussi précédemment signalées comme une méthode efficace pour les phycobiliprotéines extraction22,28, fourni les rendements plus faibles dans les tests décrits ici (méthode E, Figure 1 ). Homogénéisation des cellules (dans le tampon d’extraction, 2 x 60 s) de zirconium perles a été testé comme moins efficace que l’homogénéisation 15-s du culot cellulaire lyophilisé (méthode D, Figure 1). La procédure d’homogénéisation dans le tampon d’extraction a été décrit précédemment avec un plus de temps (10 min) homogénéisation29. Nous n’ai pas tester l’homogénéisation pendant plus de 2 min depuis les échantillons réchauffé considérablement au cours de chaque cycle d’homogénéisation. Dans la littérature, autres méthodes de perturbation cellulaire ont été également décrites, y compris l’utilisation d’une presse Français16 ou griding13,15,30; Cependant, ces méthodes n’ont pas été testés dans cette étude.
L’extraction de la protéine a été réalisée pendant 15 s (Figure 2) dans le tampon PBS. Le tampon pH a été de 7,4, qui a été indiqué précédemment comme optimal pour l' extraction de phycobiliprotein22. L’ajout de NaCl ou de KCl n’a pas amélioré l’efficacité d’extraction phycobiliprotein (Figure 3), qui est contredisant les précédentes observations22. Cependant, comme il est indiqué dans la Figure 3, la solution saline tamponnée au phosphate tel qu’utilisé dans le présent protocole figure 154 mM NaCl (en plus de 5,6 mM Na2HPO4 et 1 mM KH2PO4), qui ne permettait pas d’établir la Exempt de NaCl PBS tampon d’extraction sous forme de contrôle. Nous avons aussi comparé la solution tampon PBS et efficacité tampon d’extraction16 de sodium acétate. La combinaison de phosphate de sodium et phosphate de potassium dans le tampon PBS fourni phycobiliprotéines supérieur donne (Figure 3). Cette constatation correspond avec les résultats antérieurs de Lemoyne et al. 22.
Le temps d’extraction de phycobiliprotein a été optimisé pour 1 h. extraction plus longue ne conduit pas à phycobiliprotein importante dégradation ou extraction amélioration (Figure 4), qui correspondait avec les travaux antérieurs de Lawrenz et al. 28. un temps d’extraction plus court que 1 h n’a pas été testé. De même, extraction pendant plus de 4 h n’a pas été testée car il a été constaté précédemment que les phycobiliprotéines extraites dans le tampon de phosphate sont stables pendant au moins 48 h28.
Nous avons comparé plusieurs équations de dosage spectrophotométrique de phycocyanine et allophycocyanin comme décrit précédemment dans la littérature, en recalculant le contenu de ces deux phycobiliprotéines dans les normes commerciales avec protéiques connus concentrations (Figure 6). La meilleure reconstruction des deux pigments a été réalisée avec les équations de Bennett et Bogorad12. Ce résultat n’était pas spécifique au phosphate tampon d’extraction depuis tel un tampon a été utilisé précédemment12,13,15. Il n’était ni spécifiques aux normes pigment comme la différence entre un615, un618et un620 (longueurs d’onde utilisées pour l’estimation de la phycocyanine dans des travaux antérieurs) dans la phycocyanine standard était de 1 % et la différence entre un 650 et un652 (longueurs d’onde utilisées précédemment pour allophycocyanin estimation12,13,14,16) dans l’allophycocyanin standard était de 3 %. De même, la différence entre un615 et un620 dans l’extrait de protéine du Synechocystis était seulement de 2 %. Ces petites différences dans les spectres d’absorption ne peuvent entraîner une variation de pigment final jusqu'à 36 % (Figure 6). Par conséquent, les différences entre les équations individuelles étaient plutôt reliés aux variations dans les coefficients d’extinction phycobiliprotein de l’absence de germes spécifiques12,13,14, 15 , 16 , 17. fait intéressant, les équations de Chung et al. Bien que les auteurs ont également utilisé Synechocystis pour leurs expériences16a fourni la reconstruction le plus bas de la phycocyanine (Figure 6).
Au lieu de la détermination des longueurs d’onde unique, il est recommandé de mesurer un spectre continu de l’extrait de phycobiliprotein entre 280-720 nm, pour estimer la présence de chlorophylle a dans l’extrait, ce qui pourrait nuire à la fois le allophycocyanin et l’absorption de la phycocyanine. En outre, en mesurant l’absorbance à 280 nm (un280), une pureté de phycocyanine (un615/a280 ou une620/a280)21,22 et allophycocyanin (un652/a280) 24 dans l’extrait peut être estimée (0,7 : comestible, 3.9 : grade réactive, > 4.0 : pureté analytique)21.
Comme des données représentatives, la concentration de phycocyanine et allophycocyanin dans Synechocystis a été déterminée en augmentant l’intensité de la lumière. Maintenir la densité de la culture à un niveau constant dans un turbidostat culture régime11,21 était essentiel pour l’expérience comparative directe. Les concentrations de phycocyanine et allophycocyanin de 2,4 % à 10,2 % et 0,6 % - 1,7 % du poids sec cellulaire, respectivement, étaient semblables comme les valeurs rapportées antérieurement11,31,32. En outre, la base par cellule contenu phycobiliprotein ressemblait comme indiqué précédemment11,33. Avec la lumière toujours croissante, le contenu des phycobiliprotéines a diminué. Fait intéressant, même sous la plus haute intensité lumineuse de 1100 µmol (photons) / (m2·s), les phycobiliprotéines n’étaient pas complètement blanchi.
Étant donné que le protocole nécessite du matériel standard et est relativement rapide, il pourra être adopté facilement dans n’importe quel laboratoire dans lequel les phycobiliprotéines sont systématiquement analysés.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Le protocole a été adopté dans une précédente publication11. T. Z., Ch. D. et J. Č. appuyés par le ministère de l’éducation, de jeunesse et de Sports de la République tchèque au sein du Programme National de développement durable j’ai (NPU j’ai), accorder le numéro LO1415. J. Č. était également soutenue par GA CR, numéro 18-24397S de la licence. Accès aux outils ou autres installations était soutenue par l’infrastructure de recherche tchèque pour la biologie des systèmes C4SYS (aucune LM2015055 du projet). M. A. S. a été financée par une subvention de la Fondation de la Science russe [n ° 14-14-00904].
matériels
| Name | Company | Catalog Number | Comments |
| Synechocystis sp. PCC 6803 | Institut Pasteur, Paris, France | 6803 | Cyanobacterium strain |
| Roti-CELL PBS | Carl Roth GmbH + Co. KG, Karlsruhe, Germany | 9143.1 | Phosphate-Buffered Saline (PBS) solution, pH 7.4 |
| Eppendorf safe-lock tubes | Eppendorf, Hamburk, Germany | 30120086 | Safe-lock tubes 1.5 ml |
| VWR 80-Place Storage System | VWR International, Radnor, Pennsylvania, USA | 30128-282 | Holder for safe-lock tubes |
| RAININ 100 µl -1000 µl | Mettler-Toledo, Columbus, Ohio, USA | 17014382 | Pipette |
| GP-LTS-A-1000µL-/F-768/8 | Mettler-Toledo, Columbus, Ohio, USA | 30389272 | Pipette tips |
| Rotina 420R | Hettich, Kirchlengern, Germany | 4701 | Refrigerated centrifuge for 1.5 ml safe-lock tubes and 15 ml conical centrifuge tubes |
| LCexv 4010 | Liebherr, Bulle, Switzerland | 9005382197172 | Refrigerator and freezer -20 °C |
| Revco ExF -86°C Upright Ultra-Low Temperature Freezer | Thermo Fisher Scientific, Waltham, Massachusetts, USA | EXF24086V | Freezer -80 °C |
| CoolSafe | LaboGene, Lillerød, Denmark | 7.001.000.615 | Freeze dryer |
| UV-2600 | Shimadzu, Kyoto, Japan | UV-2600 | Spectrophotometer |
| Hellma absorption cuvettes, semi Micro | Sigma-Aldrich, St. Louis, Missouri, USA | Z600288 | VIS/UV-VIS semi-micro cuvettes 0.75-1.5 ml, spectral range 200-2500 nm |
| Silamat S6 | Ivoclar Vivadent, Schaan, Liechtenstein | 602286WU | Homogenizer |
| Solid-glass beads | Sigma-Aldrich, St. Louis, Missouri, USA | Z273627 | Glass bead of the diameter 2 mm |
| CPA225D-0CE | Sartorius AG, Göttingen, Germany | SECURA225D-1OBR | Analytical balances |
| C-Phycocyanin from Spirulina sp. | Sigma-Aldrich, St. Louis, Missouri, USA | P2172 | Phycocyanin standard |
| Allophycocyanin | Sigma-Aldrich, St. Louis, Missouri, USA | A7472 | Allophycocyanin standard |
| Bicinchoninic Acid Kit | Sigma-Aldrich, St. Louis, Missouri, USA | BCA1, B9643 | Complete kit for total proteins determination |
| AlgaeTron | Photon System Instruments Ltd., Drásov, Czech Republic | AG 130-ECO | Cultivation chamber for E. flasks, with controllable light and atmosphere |
| Photobioreactor | Photon System Instruments Ltd., Drásov, Czech Republic | FMT-150 | Cultivation equipment for cyanobacteria and algae with completely controllable environment |
| Cellometer | Nexcelom Bioscience, Lawrence, Massachusetts, USA | Auto M10 | Cell counter |
| Corning 15 mL centrifuge tubes | Sigma-Aldrich, St. Louis, Missouri, USA | CLS430791 | 15 ml Centrifuge tube for dry weigth sampling |
| Herasafe KS | Thermo Fisher Scientific, Waltham, Massachusetts, USA | 51024579 | Laminar flow hood |
Références
- Mimuro, M., Kikuchi, H. Antenna Systems and Energy Transfer in Cyanophyta and Rhodophyta. Light-Harvesting Antennas in Photosynthesis. Green, B. R., Parson, W. W. , Springer. Dordrecht, The Netherlands. 281-306 (2003).
- Spear-bernstein, L., Miller, K. R. Unique location of the phycobiliprotein light-harvesting pigment in the Cryptophyceae. Journal of Phycology. 25 (3), 412-419 (1989).
- Kirst, H., Formighieri, C., Melis, A. Maximizing photosynthetic efficiency and culture productivity in cyanobacteria upon minimizing the phycobilisome light-harvesting antenna size. Biochimica et Biophysica Acta - Bioenergetics. 1837 (10), 1653-1664 (2014).
- Page, L. E., Liberton, M., Pakrasi, H. B. Reduction of photoautotrophic productivity in the cyanobacterium Synechocystis sp. strain PCC 6803 by phycobilisome antenna truncation. Applied and Environmental Microbiology. 78 (17), 6349-6351 (2012).
- Sonani, R. R. Recent advances in production, purification and applications of phycobiliproteins. World Journal of Biological Chemistry. 7 (1), 100(2016).
- Bryant, D. A. The Molecular Biology of Cyanobacteria. , Springer Netherlands. Dordrecht, The Netherlands. (1994).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. I. Sequence features in the 1 Mb region from map positions 64% to 92% of the genome. DNA Research. 2, 191-198 (1995).
- Kaneko, T., et al. Sequence analysis of the genome of the unicellular cyanobacterium Synechocystis sp. strain PCC6803. II. Sequence determination of the entire genome and assignment of potential protein-coding regions. DNA Research. 3, 109-136 (1996).
- Grigorieva, G., Shestakov, S. Transformation in the cyanobacterium Synechocystis sp 6803. FEMS Microbiology Letters. 13 (4), 367-370 (1982).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp: PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), (2015).
- Zavřel, T., Očenášová, P., Červený, J. Phenotypic characterization of Synechocystis sp. PCC 6803 substrains reveals differences in sensitivity to abiotic stress. PLoS One. 12 (12), e0189130(2017).
- Bennett, A., Bogorad, L. Complementary chromatic adaption in a filamentous blue-green alga. The Journal of Cell Biology. 58, 419-435 (1973).
- Lüder, U. H., Knoetzel, J., Wiencke, C. Acclimation of photosynthesis and pigments to seasonally changing light conditions in the endemic antarctic red macroalga Palmaria decipiens. Polar Biology. 24 (8), 598-603 (2001).
- Evans, L. V. The effects of spectral composition and irradiance level on pigment levels in seaweeds. Experimental Phycology: A Laboratory Manual. Lobban, C. S., Chapman, D. J., Kremer, B. P. , Cambridge University Press. Cambridge, New York, New Rochelle, Melbourne, Sydney. 123-133 (1988).
- Sampath-Wiley, P., Neefus, C. D. An improved method for estimating R-phycoerythrin and R-phycocyanin contents from crude aqueous extracts of Porphyra (Bangiales, Rhodophyta). Journal of Applied Phycology. 19 (2), 123-129 (2007).
- Chung, Y. H., Park, Y. M., Moon, Y. J., Lee, E. M., Choi, J. S. Photokinesis of Cyanobacterium Synechocystis sp. PCC 6803. Journal of Photoscience. 11 (3), 89-94 (2004).
- Sun, L., et al. Phycobilisomes from Cyanobacteria. Handbook on Cyanobacteria: Biochemistry, Biotechnology and Applications. Gault, P. M., Marler, H. J. , Nova Science Publishers, Inc. New York, NY. 105-160 (2009).
- Six, C., et al. Diversity and evolution of phycobilisomes in marine Synechococcus spp.: A comparative genomics study. Genome Biology. 8 (12), (2007).
- Sinetova, M. A., Červený, J., Zavřel, T., Nedbal, L. On the dynamics and constraints of batch culture growth of the cyanobacterium Cyanothece sp. ATCC 51142. Journal of Biotechnology. 162 (1), (2012).
- Stanier, R. Y., Kunisawa, R., Mandel, M., Cohen-Bazire, G. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35 (2), 171-205 (1971).
- Zavřel, T., Sinetova, M. A., Búzová, D., Literáková, P., Červený, J. Characterization of a model cyanobacterium Synechocystis sp. PCC 6803 autotrophic growth in a flat-panel photobioreactor. Engineering in Life Sciences. 15 (1), 122-132 (2015).
- Hemlata, G., Fareha, B. Studies on Anabaena sp. nccu-9 with special reference to phycocyanin. Journal of Algal Biomass Utilization. 2 (1), 30-51 (2011).
- Rito-Palomares, M., Nuez, L., Amador, D. Practical application of aqueous two-phase systems for the development of a prototype process for c-phycocyanin recovery from Spirulina maxima. Journal of Chemical Technology & Biotechnology. 76 (12), 1273-1280 (2001).
- Zhang, H., et al. Selenium-Containing Allophycocyanin Purified from Selenium-Enriched Spirulina platensis Attenuates AAPH-Induced Oxidative Stress in Human Erythrocytes through Inhibition of ROS Generation. Journal of Agricultural and Food Chemistry. 59 (16), 8683-8690 (2011).
- Nedbal, L., Trtílek, M., Cervený, J., Komárek, O., Pakrasi, H. B. A photobioreactor system for precision cultivation of photoautotrophic microorganisms and for high-content analysis of suspension dynamics. Biotechnology and Bioengineering. 100 (5), 902-910 (2008).
- Zavřel, T., Knoop, H., Steuer, R., Jones, P. R., Červený, J., Trtílek, M. A quantitative evaluation of ethylene production in the recombinant cyanobacterium Synechocystis sp. PCC 6803 harboring the ethylene-forming enzyme by membrane inlet mass spectrometry. Bioresource Technology. 202, 142-151 (2016).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Lawrenz, E., Fedewa, E. J., Richardson, T. L. Extraction protocols for the quantification of phycobilins in aqueous phytoplankton extracts. Journal of Applied Phycology. 23 (5), 865-871 (2011).
- Lea-Smith, D. J., et al. Phycobilisome-Deficient Strains of Synechocystis sp. PCC 6803 Have Reduced Size and Require Carbon-Limiting Conditions to Exhibit Enhanced Productivity. Plant Physiology. 165 (2), 705-714 (2014).
- Seo, Y. C., et al. Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process. International Journal of Molecular Sciences. 14 (1), 1778-1787 (2013).
- Touloupakis, E., Cicchi, B., Torzillo, G. A bioenergetic assessment of photosynthetic growth of Synechocystis sp. PCC 6803 in continuous cultures. Biotechnology for Biofuels. 8 (1), 133(2015).
- Touloupakis, E., Cicchi, B., Benavides, A. M. S., Torzillo, G. Effect of high pH on growth of Synechocystis sp. PCC 6803 cultures and their contamination by golden algae (Poterioochromonas sp.). Applied Microbiology and Biotechnology. 100 (3), 1333-1341 (2016).
- Ishii, A., Hihara, Y. An AbrB-Like Transcriptional Regulator, Sll0822, Is Essential for the Activation of Nitrogen-Regulated Genes in Synechocystis sp. PCC 6803. Plant Physiology. 148 (1), 660-670 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon