Method Article
에 대한 응답으로 인간의 기본 호중구와 단핵구에 의해 항진균 활성의 라이브 영상
요약
여기, 우리는 라이브 셀 비디오 현미경과 함께 형광 아스 페르 길 루스 기자의 분생 포자를 이용하여 실시간으로 주요 인간 면역 세포의 항진균 활성을 평가하고 유동 세포 계측법 할 수있는 프로토콜을 설명합니다. 생성 된 데이터는 진균 작용, 식균 작용, 세포 이동 및 진균 성장 억제로 숙주 세포 - 아스 상호 작용에 대한 통찰력을 제공한다.
초록
아스 페르 길 루스 푸 미가 투스의 높은 치명률과 면역 호스트에서 침습성 감염을 일으키는 기회 곰팡이 병원균이다. A.의 fumigatus에 대한 면역 반응을 조사하는 연구는 체외에서 특정 면역 세포의 항진균 활성을 측정하기위한 일관되고 신뢰할 수있는 분석의 부족에 의해 제한되고있다. 새로운 방법은 기본 단핵구 및 아스 형광 리포터 (FLARE) 분생 포자를 이용 A. 푸 미가 투스에 대하여 인간 공여자로부터의 호중구의 항진균 활성을 평가하기 위해 설명된다. 이러한 분생는 구조적 라이브 FLARE의 분생 포자로 표현되고, 외부에 따라서 실시간 죽은 A.의 미가 투스의 분생 구별을 허용하는 phagolysosome 내 분해에 내성 알렉사 형석 633으로 표시되는 유전자 인코딩을 DsRed 리포터를 포함한다. 비디오 현미경과 세포 계측법 이후 상호 작용을 시각화하는 데 사용됩니다 흐름분생과 선천성 면역 세포 간의 이온 역시 식세포 이동, 식균 작용 및 진균의 성장 억제에 대한 풍부한 정보를 제공하는 동안 살균 활성을 평가. 이 새로운 기술은 이미 A.의 fumigatus에 대한 주요 면역 세포의 호스트 - 병원균 상호 작용에 흥미 진진한 새로운 통찰력을 제공하고 있습니다. 필요한 현미경을 포함,이 분석을 수행하고 시설 유동 세포 계측법에 필요한 실험실 설정 및 인간 기증자의 혈액과 유전자 조작 곰팡이와 함께 작동 할 수있는 능력을 주목하는 것이 중요하다. 그러나 이러한 분석은 대용량의 데이터를 생성 할 수 있고 대응 곰팡이가 자세하게 밝힐 수있다. 이 프로토콜은 성공적 A.의 fumigatus에 대한 주요 면역 세포의 호스트 병원체 상호 작용을 연구하는 데 사용되었습니다.
이는 필요한 현미경 포함한 상기 분석을 수행하기 위해 요구되는 실험 설정을 양해와 F 유동 세포 계측법 중요acilities 및 용량은 인간 기증자의 혈액과 유전자 조작 곰팡이와 함께 작동합니다. 그러나 이러한 분석은 대용량의 데이터를 생성 할 수 있고 대응 곰팡이가 자세하게 밝힐 수있다. 이 프로토콜은 성공적 A.의 fumigatus에 대한 주요 면역 세포의 호스트 병원체 상호 작용을 연구하는 데 사용되었습니다.
서문
아스 페르 길 루스 푸 미가 투스의는 기회 곰팡이 병원균과 면역 호스트 1, 2 침습적 폐 감염의 가장 흔한 곰팡이 원인이다. 곰팡이 연구의 중요한 영역 호스트 면역 세포가 인식하고 누룩 곰팡이를 제거하는 방법입니다 이해하지만, 현재 사용 가능한 살균 분석은 상당한 한계가 있습니다. 살 진균 활성을 측정하는 일반적으로 사용되는 방법은 비색 분석 및 집락 형성 단위 (3), (4)의 결정을 포함한다. 그러나, 이러한 방법은 하나의 시점에 오히려 호스트 병원체 간의 동적 상호 작용을 볼보다 진균 가능성에 대한 정보를 제공한다. 곰팡이가 사망하거나 (일시적으로) 성장 또는 신진 대사 활동에 제한되어 있는지 따라서, 이러한 방법은 고려하지 수 있습니다. 우리는 관찰 fungici 할 수있는 방법을 개발했다동시에 식세포, 식세포 이동 진균 성장의 억제에 관한 상세한 정보를 캡처하는 동안 직접 DAL 활동.
이전에는 프로토콜은 마우스 대식 세포주 5 칸디다 알비 칸스의 식균 작용을 측정하는 수단으로 실시간 영상을 사용하여 출판되었다. 이 개념은 이제 형광 아스 페르 길 루스 기자 (FLARE) 분생 포자 6, 7, 8을 이용하여 면역 세포와 아스 페르 길 루스의 상호 작용에 대한 우리의 이해의 지식 격차를 해결하기 위해 추가로 개발되었다. 이 분생 포자 빨간색 형광 (을 DsRed)을 표현하고 두 번째 형광 (알렉사 플 루어 633)로 표시되어 있습니다. 플레어 conidium가 살해되면, 그것은을 DsRed 생산을 중지하고 AF633은 분생 포자에 형광 및 바인딩 남아있는 동안 나머지는 DsRed는 페이드. 이 라이브와 죽은 쿵푸 사이에 명확한 구분을 만듭니다라이브 세포 이미징 동안 NGAL 세포와는 유동 세포 계측법 및 면역 세포와의 상호 작용 다음 각각의 분생 포자의 운명의 추적을 할 수 있습니다.
설명 된 분석은 숙주의 면역 세포 및 아스 퍼질러 스 상호 작용을 시각화하는 효과적인 방법을 제공하고 선천성 면역 이펙터 세포 곰팡이기구를 담당하는 세포 신호 전달 경로를 해명 상당한 가치가있을 것이다. 다른 응용 프로그램은 부어 분생 포자, 또는 부어 분생 포자에서 균사에 휴식에서 스위치로 아스 페르 길 루스 성장의 변화, 식세포 인식 및 기능에 미치는 영향을 시각화 등이 있습니다.
다음 프로토콜은 인간 단핵구와 호중구를 얻는 방법을 자세히 설명합니다; 어떻게 FLARE의 분생 포자를 준비하는 방법; 어떻게 비디오 현미경 자신의 응답을 캡처하고 유동 세포 계측법. 기증자의 혈액에서 고립 된 인간의 면역 세포의 사용은 여기에,이 설명되어 있지만기술은 쥐의 세포 집단의 다양한 사용하여 동일한 효과를 입증했다.
프로토콜
호중구 및 말초 혈 단핵 세포 (PBMC)를 얻는 프로토콜은 이전에 발행 된 방법 (9)에 기초한다. 건강한 지원자에서 혈액 샘플의 사용은 애버딘 대학의 인간 연구 윤리위원회에 의해 승인되었습니다. 시작하는 것이 있는지 확인하기 전에 모든 윤리적 승인은 설명 실험의 목적을 위해 건강한 지원자 및 / 또는 환자에서 혈액을 그리기 위해 자리에 있습니다. 자신의 생존을 증가시킬 수 얼음에 세포를 유지합니다.
1. A. fumigatus에 문화 약관
- 10 바와 같이 글루코스 최소 한천 배지를 준비한다.
- 20 분 동안 120 ° C에서 1 M의 NaOH를 이용하여 pH를 6.5 오토 클레이브에 미디어를 조정한다.
- 65 ℃로 냉각시킵니다.
- 무균 유동 후드에서 작업하는 T75 플라스크에 냉각 매체 30 ㎖를 붓고 C로 25 ㎖ 피펫을 쉬고 플라스크의 목 식히한천 기울기를 reate.
- 한천의 Af293-을 DsRed A. 푸 미가 투스의 균주 아웃 킬 및 37 ° C + 5 % CO 2에서 7 일간 배양한다. 두 플라스크를 5 ㎖의 인산 완충 식염수 (PBS) 프리 바이오 틸 약 109 분생 포자를 생성한다.
2. A. fumigatus에 라벨링 제조
참고 : 처음으로 상기 분석을 수행 할 때, 보호자 Af293- A. 푸 미가 투스의 변형을 준비한다. 마이크로 원심 튜브에 두 균주의 샘플을 채취하고 후술하는 바와 같이 각 균주의 한 라벨. 이것은 설치 및 장비를 테스트하기 위해,을 DsRed 또는 AF633 중 하나는 단일 색상으로 어떤 색상과 분생 포자로 제어 분생 포자를 할 수 있습니다.
- 30 mL의 PBS + 0.05 % 트윈 80과 함께 배양하여 수확 침지 된 A. 푸 미가 투스의 분생. 균사 단편을 제거하기 위해 50 ㎖ 튜브에 40 μm의 세포 여과기를 통해 생성 된 현탁액을 여과.
- 기음10 분 동안 805 XG에 entrifuge 상등액을 제거하고 멸균 PBS 20 mL로 한번 세척 하였다. 세척 단계 동안 동일한 두 균주의 플레이트에서 풀 분생.
- 세정 공정 후, PBS 5ml에 펠릿 전사 마이크로 원심 튜브에 포자 현탁액을 1 mL의 분취 량을 재현 탁. 각 균주의 현탁액 1 ㎖ 보통 생균 촬상 충분하다. 4 ℃에서 저장 포일의 나머지 분취 량을 감싸.
- 포자 현탁액을 원심 분리기 분획을 실온에서 10 분 동안 9,300 XG에 조심스럽게 상층 액을 제거한다. 0.05 mL의 1 M NaHCO3을 pH가 8.3 포자 펠렛을 재현 탁.
- 500 μL DMSO에 25 mg의 비오틴을 재구성하여 10 mg의 비오틴 / 200 μL의 디메틸 술폭 시드 (DMSO) 스톡 용액을 준비한다. 알루미늄 박에 10 μL 비오틴 /를 마이크로 원심 튜브에 DMSO 원액 커버를 추가하고 4 ℃에서 로커에서 2 시간 동안 배양한다.
- 비오틴 / DMSO의 주식 solutio의 나머지 부분을 나누어지는n은 이후 실험에 사용 -20 ° C에서 동결.
- 9,300 XG에서 10 분 동안 원심 분리기 조심스럽게 뜨는을 제거합니다. 부동성 비오틴을 비활성화 한 시간 동안의 pH 8.0의 100 mM 트리스 염산 1 ㎖의 포자 펠렛을 재현 탁.
- 9,300 XG에서 10 분 동안 원심 분리기 조심스럽게 뜨는을 제거합니다. 멸균 PBS 1 ml로 두 번 세척하고 펠렛을 PBS 1 ㎖에 펠렛을 재현 탁.
- 2 ㎎ / ㎖의 스톡 용액을하기 위해 PBS를 0.5 mL의 스트렙 타비 딘 - AF633 1mg을 녹인다. 포자 현탁액 1 ㎖ 당 2 ㎎ / ㎖ 스트렙 타비 딘 - AF633의 10 μL를 추가하고 알루미늄 호일로 덮여 로커에 실온에서 40 분 동안 배양한다. 나머지 스트렙 타비 딘-AF633 후속 실험에 사용 씩 동결 할 수 있습니다.
- 9,300 XG에서 10 분 동안 원심 분리기 조심스럽게 뜨는을 제거. PBS 1 ㎖에 포자 펠렛을 재현 탁하고, 1의 혈구를 사용하여 분생 포자를 카운트 : 1000 희석 (1 : 100 다음 1시 10분). , CO 3.6 × 106 / ㎖로 2 독립 미디어를 포자 농도를 조정하여 4 ℃에서 저장 포일에 감싸.
참고 : 분생 포자 지금 AF633으로 표시하고 FLARE의 분생 포자로 언급 될 것이다. - 선택적 : 팽윤 분생 자극이 필요한 경우, 분생 포자를한다 (단계 2.9) 계산 한 후, 효모 질소 기재 7.2 × 106 / ㎖로 (YNB) 매체 분생 희석하고 50 멸균 4.5 ㎖의 YNB 배지 500 μL 포자 현탁액을 추가 ML 에를렌마이어. 커버, 6 시간 동안 진탕 배양기 (37 ℃에서 200 rpm으로)에 플라스크를 배치했다.
- 15 ㎖의 튜브에 매체를 옮긴다. 실온에서 10 분 동안 원심 분리기 (805) XG하고 PBS로 한번 세척 하였다. 1 mL의 CO에서 다시 원심 분리하고 재현 탁 된 펠릿을 3.6 × 106 분생 포자 / ㎖을주는 2 독립 매체.
참고 : 정확한 어려운 계산하게 팽창되어 후에 분생 포자가 자주 응집, C로 계산하는 것이 좋습니다사용 분생 포자 휴식의 ounted 번호.
- 15 ㎖의 튜브에 매체를 옮긴다. 실온에서 10 분 동안 원심 분리기 (805) XG하고 PBS로 한번 세척 하였다. 1 mL의 CO에서 다시 원심 분리하고 재현 탁 된 펠릿을 3.6 × 106 분생 포자 / ㎖을주는 2 독립 매체.
인간 호중구 3. 격리
- 에틸렌 디아민 테트라 아세트산 (EDTA)를 함유하는 2 개 개의 10 mL의 혈액 튜브에 정상인으로부터 정맥혈을 20㎖을 그린다. 별도로 각 도너를 들어, 50 ㎖ 튜브에서 20 mL의 혈액을 붓고, 15 mL의 PBS로 희석 하였다.
- 주사기 바늘 철 림프구 분리 용액 (밀도 1.077 g / mL)을 15 mL의 혈액을 언더. 상기 튜브의 하단에 바늘을 넣고 부드럽게 림프구 분리 용액을 강제. 브레이크없이 낮은 가속도로 20 분 동안 원심 분리기 (630) XG.
- PBS, 얼음에 냉장을 준비합니다.
주 : 3.4 단계 3.5는 단핵 세포 (3.4) 및 호중구 (3.5)를 생성하는 동시에 따라야한다. - pastette를 사용하여 PBMC 층을 수확. 이 옐로우 혈청 (위)과 투명 림프구 분리 용액 (하부) 층 사이의 중심에있는 층이며신선한 50 ㎖ 튜브로 옮긴다.
- 10 분 동안 582 XG에 차가운 PBS 50 mL로 원심 분리와의 PBMC와 관을 채운다. 상등액을 제거하고 초기에 사용 된 공여체의 혈액 20 ㎖ 당 PBS 1 ㎖에 재현 탁하고 차가운 PBS로 두 번 세척 하였다.
- PBS 160 μL 및 트리 판 블루 20 μL에 세포 현탁액 20 μL를 첨가하여 계산 1:10 희석액을 만든다. 혈구와 세포를 계산합니다.
- 열 불 활성화 소 태아 혈청 (FCS) 및 HBSS 500 mL의 0.5 M EDTA 2.1 mL를 26 mL의 첨가에 의해 완충 용액을 준비한다. 1 × 107 세포 당 완충액 40 μL에 10 분 515 XG에 재현 탁하고 세포를위한 원심 분리기.
- 15 ㎖의 튜브에 세포 현탁액을 전송하고 1 × 107 세포 당 CD14 마이크로 비드의 10 μL를 추가하고, 잘 혼합하고 5 분마다 튜브를 혼합하는 확인하면서 4 ° C에서 15 분 동안 배양한다.
- 1 × 107 개 세포 당 CEN 완충액 1 ㎖를 첨가하여 세포를 씻어10 분 동안 515 XG에 trifuge.
- 대기음 상등액 완전히 완충액 500 μL에 1 × 10 개 8 세포를 재현 탁.
- 제조자의 지시에 따른 자기 분리기 샘플 당 1 열에 배치. 제 1 버퍼 용액 500 μL 회 칼럼을 세척 하였다.
- 상기 컬럼을 통해 세포 현탁액 500 μL 피펫 건조 열 기다렸다가 완충액이 세 번 반복하여 세척 하였다.
- 컬럼 아래 새로운 15ml의 튜브를 배치하고 자기 분리기로부터 떨어져서 열을 받아. 그 다음 완충 용액 1 mL를 상기 튜브로 열 중에서 세포를 세척.
- 10 분 동안 515 XG에 완충액에서 원심 분리 4 mL를 첨가 한 다음 로스웰 파크 메모리얼 연구소 (RPMI) 배지 1 ㎖에 재현 탁.
- PBS 160 μL 및 트리 판 블루 20 μL에 세포 현탁액 20 μL를 첨가하여 계산 1:10 희석액을 만든다. A의 세포를 계산혈구.
- RPMI 6 × 105 / ㎖로 세포 농도를 조정하고, 35mm 유리 기반 이미징 접시에 200 μL 시드. 5 % CO 2와 37 ℃에서 밤새 인큐베이션.
- 다음 날, 영상에 앞서, RPMI를 제거하고 CO 2 독립적 인 매체의 200 μL를 추가합니다.
참고 :이 단핵구도 이전 영상에 다양한 대식 세포 하위 집합으로 구분 될 수있다. 이 탐험하는 기술이라면, 훌륭한 출발점이 Ohradanova-Repic 등에 의한 최근의 논문입니다. 1 1.
- PBMC 층을 수확 한 후 혈청을 모두 제거하고 림프구 분리 솔루션의 대부분,하지만이 호중구의 대부분을 포함로 붉은 펠렛의 상단에 작은 흰색 밴드를 제거하지 않도록주의.
- NH 4 CL 83 g 및 멸균 물 1 L에 KHCO 3 10 g을 첨가하여 10 개 배 저장성 용해 완충액 재고를 준비한다. 4 °에서 보관기음.
- 멸균 물이 주식의 10 배를 희석하여 튜브에 추가합니다. 그런 다음, 조심스럽게 3 번 반전하고 15 분 동안 얼음에 품어.
- 얼음에서 10 분 동안 저장성 용해 완충액에 재현 탁하고 10 분간 394 XG 원심 분리기.
- 394 XG에 원심 분리기 차가운 PBS로 두 번 씻는다. 도너 당 CO 2 독립 배지 1 ㎖에 재현 탁.
- PBS 160 μL 및 트리 판 블루 20 μL에 세포 현탁액 20 μL를 첨가하여 계산 1:10 희석액을 만든다. 혈구와 세포를 계산합니다.
- 유동 세포 계측법, 6 × 105 / mL의 농도를 조정하고, 24 웰 플레이트에 400 μL의 세포 현탁액을 추가한다. 현미경 들어 35mm 유리 기반 이미징 접시에 동일한 세포 현탁액을 200 μL를 추가한다.
호중구 영상 또는 자극받지 않은 떠나는 경우에 세포 사멸을 받아야하는 그들의 성향에 즉시 시작되어야 유동 세포 계측법 :합니다. 이없는 경우 가능한 호중구에 보관해야합니다얼음과 (같은 날 내에서) 가능한 한 빨리 사용.
4. 유동 세포 계측법
- 24 웰 플레이트에서 세포를 1.2 × 10 6 / ㎖ 플레어 분생 200 μL를 추가 한 다음, 20 ㎍ / mL의 보리 코나 졸의 100 μL를 추가한다. RPMI 300 μL를 첨가하고, 5 % CO 2, 37 ℃에서 16 시간 동안 배양한다.
참고 : 보리 코나 졸은 분생 포자 발아를 방지하기 위해 추가됩니다. - 25 μM의 최종 농도로 각 웰에 1 mM의 CALCOFLUOR 백색 스톡 용액 25 μL를 첨가하고, 5 % CO 2, 37 ℃에서 10 분 동안 배양한다.
- 10 분 동안 582 XG 원심 분리기. 뜨는을 제거하고 PBS로 두 번 씻는다.
- 부착 세포 (단핵구)을 수확하기 위해, 각 웰을 3 mM의 EDTA PBS로 1 mL를 첨가하고, 5 % CO 2, 37 ℃에서 10 분 동안 배양한다. 조심스럽게 튜브에 세포를 피펫 팅하여 세포 플레이트 오프 씻어 모은다.
- PB에 FACS 버퍼에 한 번 세척 (2 % 소 태아 혈청S)은 다음 FACS 분석 FACS 완충액에 재현 탁.
- FACS 분석의 경우, 제 사이토 유량의 보정 파라미터를 조정없이 색상 분생 포함 단색 보상 튜브를 이용한 포지티브 게이트 설정 :을 DsRed +의 분생, AF633 + 분생 및 CALCOFLUOR 화이트 +의 분생 (4.2로서 생성을).
- 설정 무료 분생 포자 게이트 앞으로 기반 및 측면 산란이없는 색상 분생 포자를 사용하여. 자유 분생 게이트를 제외한 전방 및 측면 스 캐터에 게이트 셀을 설정한다.
- 10000 개 이벤트를 기록하여 샘플 튜브를 분석합니다.
참고 : 라이브 분생 포자와 관련된 세포 + 및 AF633 +를을 DsRed됩니다. 죽은 분생 포자와 관련된 세포 AF633 +에게 유일한 것입니다. dsRed- 및 AF633- 될 것 분생 포자를 종사하지 않은 방관자 세포. 생포 - 결합 세포 집단은 상기 퍼시픽 블루 채널 CALCOFLUOR 화이트 염색에 대해 분석한다. 내면화 된 CALCOFLUOR 화이트 +됩니다 세포의 외부 남아 분생 포자와 분생 포자가 될 것입니다CALCOFLUOR 화이트 -.
5. 라이브 셀 비디오 현미경
현미경의 선택은 로컬에 무엇에 의존하지만, 현미경 설치 반전 단계는 DsRed (561분의 532 ㎚) 및 AF633 37 ° C 적절한 여기 / 발광 필터로 가열 환경 챔버를 포함 할 필요가 참고 (633 ㎚). FLARE 분생 포자는을 DsRed의 561분의 532 nm의 레이저 대신 488 nm의 레이저 작동하지 않습니다. 이 처음으로이 실험을 수행 할 때, 배경 형광에 대한 테스트를 통해 블리드을 DsRed AF633와 채널 사이에 아무런 색상 단일 색상 제어 분생 포자를 사용한다.
- 실험에 앞서 현미경 히터를 켜고 환경 제어 챔버는 37 ° C로 예열을위한 충분한 시간을 허용합니다. 안정화 챔버 온도 걸리는 시간은 다른 현미경 설정에 따라 다를 것입니다.
- 현미경과 컴퓨터, 보라를 켜십시오광고 이미징 소프트웨어. 현미경 단계에있는 이미징 접시를 탑재하고 인간 호중구 또는 단핵구를 찾기 위해 초점을 조정합니다.
- 을 DsRed 및 AF633 들어, 인수 설정에서 1 초에 10 % 및 노출 시간에 레이저 파워를 설정.
- 촬상 슬라이드를 제거하고 100 μL를 추가 3 × 106 / mL의 FLARE 적절한 웰에 포자 현탁액 (총 부피 300 μL / 웰). 분생 포자가 접시에 추가됩니다 FLARE 시간을 기록한다.
- 무대에 슬라이드를 반환하고 명확하게 분생 포자를 볼 수 있지만 이미지를 과다하지 않도록을 DsRed 및 AF633에 대한 카메라의 감도를 조정합니다. 멀티 포인트 획득이 필요한 경우 무대 지점 목록을 설정합니다.
- 모든 점에 초점이 때, 채널 최적화하고 사이클 시간과 기간을 설정 이미징 시작. 사이클 시간과 영상의 기간은 실험 질문에 따라 달라집니다. 목표는 1 분 UPT 심층 분석에서 허용 가능한 짧게 (≤2 분), 사이클 시간을 유지하는 것아케 역학.
결과
대표적인 결과는 다음 프로토콜 바와 같다. 도 1은 인간 호중구의 분생 FLARE와 대표적인 6 H 살아있는 세포 영상을 도시한다. 이들은 AF633 (마젠타)으로 표시되었지만을 DsRed (적색)의 분생 포자 자체로 표현된다.
살아있는 및 죽은 FLARE의 분생 포자의 차이를 나타내는,도 1에 표시된 바와 같이,도 2는 유사한 영화에서 하나의 시점에서 이미지이다. 죽은 분생 포자는 밝은 AF633 (마젠타) 형광을 유지하면서 자신을 DsRed (적색) 신호를 잃고 라이브 생포 구별된다. A. fumigatus에의 분생 포자는 종종 이상 6 시간 동안 식세포 내에서 살아 남기. 따라서, 효과적으로 플롯은도 3의 16 시간 인큐베이션 기간 동안 도시 유동 세포 계측법, 죽이는 정량화한다. 이 데이터는 폐포 대 식세포 CE 얻었다그러나 예로서 LL 라인은 모든 세포 유형으로 수행 될 수있다. 도 4의 이동은 인간 호중구에 대한 자극뿐만 아니라 속도와 이동 방향의 제 시간에 도시되어있다. 도 5는도 6에 균사 분생 포자 발아 수를 표시하는 동안 1, 2, 3 또는 그 이상의 분생 포자를 섭취 한 호중구의 비율을 나타낸다.

그림 1 : 인간 호중구 및 FLARE의 분생 포자의 라이브 셀 비디오 현미경 영화. 호중구를 인간 혈액으로부터 단리 1의 비율로 CO 2 독립 매체 FLARE의 분생 함께 접종 하였다 : 각각 3. 이미지는 회전 디스크 공 초점 현미경으로 37 ° C에서 직접 시작되었다. 이미지는 6 시간에 걸쳐 1 분, 55의 간격으로 포착 하였다. 스케일 바는 10 μm의 =.비디오 확대 A는 왼쪽 상단의 DIC와 플레어 분생 포자의 역할을 명확하게 분리 된 채널을 도시하고, 오른쪽 상단을 DsRed (적색) 아래에서, AF633 (녹색) 좌측 및 우측 하단에 병합 된 비디오 . 이 비디오를 다운로드하려면 여기를 클릭하십시오.

그림 2 : 단일 시점 이미지 라이브와 죽은 FLARE의 분생 포자의 차이를 보여. 인간 호중구는 FLARE의 분생 포자로 자극과 회전 디스크 공 초점 현미경으로 몇 군데 있었다. 이미지가 생성 된 영화에서 가져 왔습니다. 자신의 AF633 형광 (: 왼쪽 하단 녹색)을 유지하면서 신호 : 죽은 분생 포자는을 DsRed (오른쪽 상단 빨간색)을 잃은으로 균사에서 구별된다. 여기를 클릭하십시오 이 도면의 확대보기.

그림 3 : 정량화 및 식균 작용 및 A.의 투스의 분생 포자의 살인의 검증. 보리 코나 졸의 존재하에 16 시간 동안 : 1 비율 쥐 폐포 대식 세포 (MH-S)는 1에서 FLARE의 분생 포자 배양 하였다. 라이브 분생와 연관된 MH-S 세포는 적색 게이트 (AF633을 DsRed + +)에 나타낸다. 죽은 분생와 연관된 MH-S 세포는 청색 게이트 (AF633을 DsRed-+)에 나타낸다. 방관자 MH-S 세포는 골드 게이트에 나타낸다. CALCOFLUOR 화이트, 진균 세포벽에 결합하는 세포 - 투과성 형광 염색은 세포 외 분생로부터 분생 (CALCOFLUOR 화이트 +) (CALCOFLUOR 화이트 -)를 구별하기 위해 사용된다. 상기 방법에 대한 추가 검증으로서, 2 μM의 사이토의 D와 그 처리 MH-S 세포에 의해 포자 흡수 억제를 나타낸다.e.jove.com/files/ftp_upload/55444/55444fig3large.jpg">Please이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
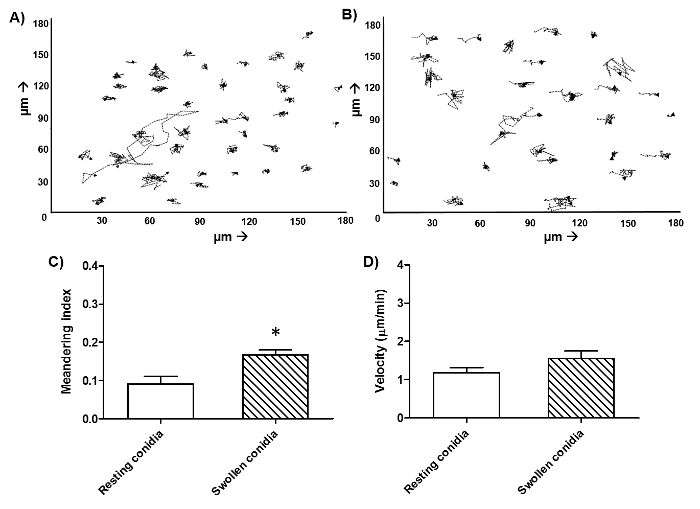
그림 4 : 인간 호중구와 A.의 투스의 분생 포자에 대한 단핵 세포의 마이그레이션. 호중구를 인간 혈액으로부터 단리 1의 비율로 CO 2 독립 매체 FLARE의 분생 함께 접종 하였다 : 각각 3. 이미지는 회전 디스크 공 초점 현미경으로 37 ° C에서 직접 시작되었다. 이미지를 6 시간에 걸쳐 1 분, 55의 간격으로 포착 하였다. 필드 당 모든 개별 인간 호중구의 이동은 수동으로 1 시간 동안 (A) 및 팽윤 (B) 분생 쉬고 대해 추적 소프트웨어를 사용하여 추적 하였다. 데이터는 동일한 도너의 각 조건에 대한 세포의 1 개 프레임을 나타낸다. 사행 인자 (C)의 측정 된 directioNAL 운동 및 속도 (D) 그런 것과 같은 소프트웨어를 사용하여 정량. 3 개 공여자는 두 독립적 인 실험을 통해 공여자 세포 당 30 나타낸다 대해 ± SEM을 의미한다. * : p <0.05 (웰치 보정 t 시험). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
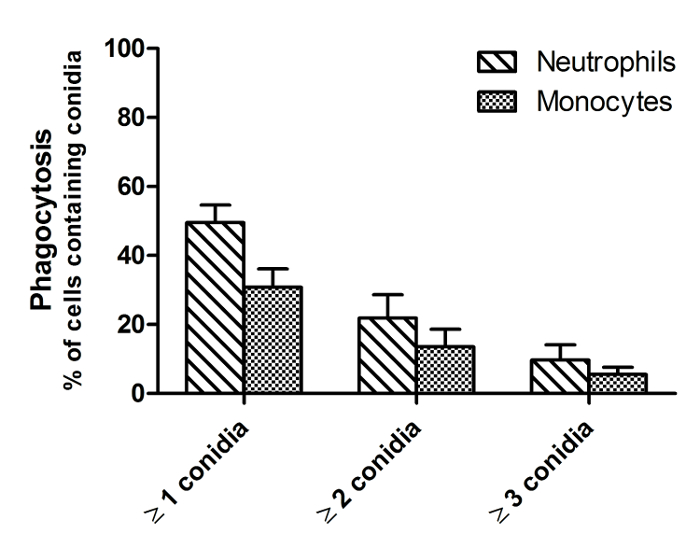
그림 5 : 인간 호중구와 단핵구에 의해 A.의 투스의 분생 포자의 식균 작용. 각각 3 : 호중구 1의 비율로 인간 혈액으로부터 단리 CO 2 독립 매체 FLARE의 분생과 함께 접종되었다. 이미지는 회전 디스크 공 초점 현미경으로 37 ° C에서 직접 시작되었다. 이미지는 6 시간에 걸쳐 1 분, 55의 간격으로 포착 하였다. 탐식 세포가 포함 량으로서 측정했다자극 후 4 시간 FLARE의 분생 포자를 보내고. 데이터는 3 도너 2 개 독립적 인 실험을 통해 도너 당 3 개 프레임으로부터 평균 ± SEM으로 제시된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
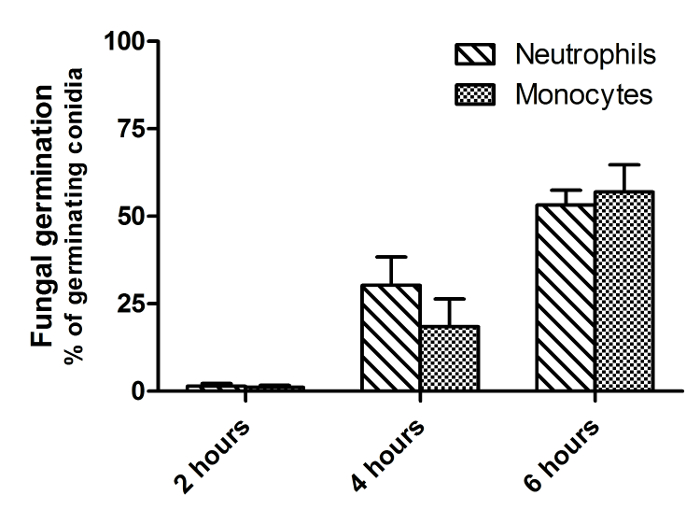
도 6 : 호중구 및 단구에 의해 A. 푸 미가 투스의 분생 포자의 발아 억제. 각각 3 : 호중구 1의 비율로 인간 혈액으로부터 단리 CO 2 독립 매체 FLARE의 분생과 함께 접종되었다. 이미지는 회전 디스크 공 초점 현미경으로 37 ° C에서 직접 시작되었다. 이미지를 6 시간에 걸쳐 1 분, 55의 간격으로 포착 하였다. 곰팡이 발아의 억제는 세균을했다 분생 포자의 비율을 측정하여 조사 하였다공동 배양 2, 4, 6 시간 후 inated. 데이터는 3 도너 2 개 독립적 인 실험을 통해 도너 당 3 개 프레임으로부터 평균 ± SEM으로 제시된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 방법은 아스 형광 리포터 (FLARE) 분생 라이브 세포 이미징을 사용 A. fumigatus에 대해 인간의 기본 식세포의 항균 활성을 연구하고 유세포 시험 관내 방법에 혁신을 설명한다. 이전의 연구는 모두 쥐 실험 진균 감염의 생체 내 항진균 내성 (6, 7)의 시험 관내 평가에 FLARE의 분생 포자를 사용하는 부가 가치를 입증했다. 이 차세대 라이브 세포 이미징 기술로 FLARE의 분생 포자를 결합하여 체외에서 동적 상호 작용하는 동안 각각의 분생 포자의 생존 능력을 측정 할 수있는 설정이 가능합니다.
기술 된 방법은 자신의 항진균 응답에 면역 세포의 특정 세포 과정의 구체적인 역할과 중요성을 조사 할 가능성이있다. 고통 특정 환자 식세포 또한, 곰팡이 응답자신의 면역 체계에서 정의 된 단일 구성 요소 결함이 상세하게 평가 될 수있다. 아주 초기 초기 항진균 응답은 연속 영상의 6 시간에 걸쳐 아주 자세하게 연구 할 수있다. 이 같은 균류 향해 식세포 이동의 속도로, 미묘한 차이를 검출 할 수 있도록, 내재화 율, 종래 식세포 방법을 이용하여 구별하기 어려운 것 진균 이벤트 (12)의 동력학.
모든 세포 유형은이 방법으로 사용될 수있다; 이들 대 식세포는 A.의 미가 투스 (13)에 대해 인간기도 방어의 제 1 및 제 2 라인을 구성하기 때문에 여기에 사용 된 세포 유형을 선택 하였다. 흥미롭게도, 아주 명확한 차이가 단핵구와 호중구가 휴식 부어 분생 포자와 균사과 결합하는 방법을 사이에 관찰 할 수있다. 호중구는 더 많은 철새 활동을 표시하면서 단핵구는 거의 분생 포자로 마이그레이션하지 않습니다. 추가 형광 월이러한 면역 세포에 라이브 죽은 마커와 같은 KERS는 아스 페르 길 루스와의 상호 작용 다음 식세포의 생존에 대한 통찰력을 제공하기 위해 분석에 포함 할 수 있습니다. 이 기술의 흥미로운 잠재적 인 미래의 애플리케이션은 상이한 숙주 세포 유형의 공존 배양, 항진균 응답 결과를 포함한다 (예를 들면, 상피 단층 함께 호중구와 단핵구 유래 수지상 세포에 대 식세포) 및 반응의 실시간 측정 아스 페르 길 루스 자극 다음 산소 종의 생산 호중구 세포 트랩 형성.
을 DsRed (561분의 532 ㎚) 및 AF633 (위한 반전 스테이지 현미경, 37 ° C에서 안정한 환경 챔버 및 여기 / 발광 필터 : 몇 지점이 프로토콜 제일 실험실 필요한 설정을 사용하는 것이 주목해야 633 ㎚). m 중 특히 관련 (초점 세포를 유지하고 기름 침수를 유지하는 현미경의 능력ULTI 점 획득)으로 인해 영상의 긴 기간에 주기적으로 모니터링해야합니다. 진균 작용의 정량을위한 편의 시설이 필요 유동 세포 계측법. 또한, 적절한 제도적, 윤리적 승인은 건강한 기증자와 환자 유래 된 혈액 샘플과 유전자 조작 곰팡이 작업 할 자리에 있어야합니다. 강력하게 세포 생존을 증가시키고 기능을 유지하기 위해 신선한 혈액 샘플 (같은 날 사용)를 사용하는 것이 좋습니다. 이상적으로, 세포의 분리는 혈액 샘플 드로잉 직후에 수행되고 호중구 분리 직후에 묘화된다.
A. 푸 미가 투스를 설명한다 대하여 결론적으로, 차세대 생균 영상 법은 큰 세부 식세포 항진균 활성을 평가한다. 이 기술은 아스 페르 길 루스에 대한 초기 선천성 면역 방어에 개별 셀 곰팡이의 상호 작용에 대한 독특한 통찰력을 제공 할 수 있습니다.
공개
저자가 공개하는 게 없다.
감사의 말
의료 균류 학 곰팡이 면역학 (SFB, JMB, JK, AW) -이 작품은 MRC 및 애버딘 대학 (의료 균류 학에 대한 MRC 센터)에 의해 웰컴 트러스트 (Wellcome Trust) 전략 수상에 의해 지원되었다. 특별한 당신이 클로이 기금의 지원을 주어 감사합니다. TMH는 NIH 보조금 P30의 CA008748에 의해 지원되는 국립 건강 연구소 (NIH, 코드 RO1 093808)과 기념 슬로안 케터링 암 센터에서 보조금에 의해 지원됩니다. 또한, TMH은 버로우즈 웰컴 기금에서 지원 감염증의 발병에 수사관이다. 우리는 그들의 도움과 지원을 위해 애버딘 현미경 및 조직학 시설을 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Glycerol | Sigma | G6279 | http://www.sigmaaldrich.com |
| T75 flask | Greiner Bio-One | 658 175 | http://www.greinerbioone.com/ |
| PBS | Gibco | 20012-019 | https://www.thermofisher.com/ |
| Tween-80 | Fisher Scientific | 10592955 | https://nl.fishersci.com/ |
| 40 µm filter | Thermo Fisher Scientific | 22363547 | https://www.thermofisher.com/ |
| 15 mL Falcon tube | Greiner Bio-One | 188 261 | http://www.greinerbioone.com/ |
| 50 mL Falcon tube | Greiner Bio-One | 227 261 | http://www.greinerbioone.com/ |
| MilliQ | Millipore | QGARD00R1 | Nanopure water works similarly. http://www.merckmillipore.com/ |
| Biotin | Molecular Probes | B-6352 | https://www.thermofisher.com/uk/en/home/brands/molecular-probes.html |
| DMSO | Sigma | D5879 | http://www.sigmaaldrich.com |
| Streptavidin-AF633 | Molecular Probes | S-21375 | AF633 is the only tested fluorophore so far that remains visible in phagosomes. https://www.thermofisher.com/uk/en/home/brands/molecular-probes.html |
| EDTA blood tubes | Greiner Bio-One | 455036 | Any blood tubes with an anti-coagulating agent should work. http://www.greinerbioone.com/en/start/ |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | http://www3.gehealthcare.com/ |
| Trypan blue | Thermo Fisher Scientific | SV3008401 | https://www.thermofisher.com/ |
| HBSS | Gibco | 14170112 | https://www.thermofisher.com/uk/en/home/brands/gibco.html |
| CD14 microbeads | Myltenyi Biotec | 130-050-201 | Other monocyte isolation methods can be used as well, we prefer this method as it gives a consistent high purity of monocytes without being labor intensive. http://www.miltenyibiotec.com/en/ |
| MS Columns | Myltenyi Biotec | 130-042-201 | See comment at CD14 microbeads. http://www.miltenyibiotec.com/en/ |
| RPMI + Glutamax | Gibco | 72400-021 | https://www.thermofisher.com/uk/en/home/brands/gibco.html |
| CO2 independent medium | Thermo Fisher Scientific | 18045054 | Necessary if there is not sufficient CO2 exchange during imaging. https://www.thermofisher.com/uk/en/home |
| µ-slide 8 well glass bottom | Ibidi | 80827 | This is the imaging dish that we use, however any glass imaging dish of proper size should work. http://ibidi.com/ |
| UltraVIEW VoX 3D Live Cell Imaging System | Perkin Elmer | L7267000 | Includes volocity software for acquisition and analysis. http://www.perkinelmer.com/ |
| Calcofluor white | Sigma | 18909 | http://www.sigmaaldrich.com/ |
| Voriconazole | Sigma | PZ0005 | http://www.sigmaaldrich.com/ |
| BD LSRII | BD Biosciences | Flowcytometer used. https://www.bdbiosciences.com/ |
참고문헌
- Kosmidis, C., Denning, D. W. The clinical spectrum of pulmonary aspergillosis. Thorax. 70 (3), 270-277 (2015).
- Warris, A. The biology of pulmonary Aspergillus infections. J Infect. 69 (Suppl 1), S36-S41 (2014).
- Henriet, S. S., et al. Human leukocytes kill Aspergillus nidulans by reactive oxygen species-independent mechanisms. Infect Immun. 79 (2), 767-773 (2010).
- Sheppard, D. C., et al. Comparison of three methodologies for the determination of pulmonary fungal burden in experimental murine aspergillosis. Clin Microbiol Infect. 12 (4), 376-380 (2006).
- Lewis, L. E., Bain, J. M., Okai, B., Gow, N. A. R., Erwig, L. P. Live-cell video microscopy of fungal pathogen phagocytosis. J Vis Exp. (71), e50196(2013).
- Heung, L. J., Jhingran, A., Hohl, T. M. Deploying FLAREs to Visualize Functional Outcomes of Host-Pathogen Encounters. PLoS Pathog. 11 (7), e1004912(2015).
- Jhingran, A., et al. Tracing conidial fate and measuring host cell antifungal activity using a reporter of microbial viability in the lung. Cell Rep. 2 (6), 1762-1773 (2012).
- Espinosa, V., et al. Inflammatory monocytes orchestrate innate antifungal immunity in the lung. PLoS Pathog. 10 (2), e1003940(2014).
- English, D., Andersen, B. R. Single step separation of red blood cells, granulocytes and mononuclear leukocytes on discontinuous density gradient of ficoll hypaque. J Immunol Met. 5 (3), 249-252 (1974).
- Shimizu, K., Keller, N. P. Genetic involvement of a cAMP-dependent protein kinase in a G protein signaling pathway regulating morphological and chemical transitions in Aspergillus nidulans. Genetics. 157 (2), 591-600 (2001).
- Ohradanova-Repic, A., Machacek, C., Fischer, M. B., Stockinger, H. Differentiation of human monocytes and derived subsets of macrophages and dendritic cells by the HLDA10 monoclonal antibody panel. Clin Transl Immunology. 5 (1), e55(2016).
- Lewis, L. E., et al. Stage specific assessment of Candida albicans phagocytosis by macrophages identifies cell wall composition and morphogenesis as key determinants. PLoS Pathog. 8 (3), e1002578(2012).
- Schaffner, A., Douglas, H., Braude, A. Selective protection against conidia by mononuclear and against mycelia by polymorphonuclear phagocytes in resistance to Aspergillus. Observations on these two lines of defense in vivo and in vitro with human and mouse phagocytes. J Clin Invest. 69 (3), 617-631 (1982).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유