Method Article
Imagerie en direct de l'activité par Human Antifongique primaire neutrophiles et des monocytes en réponse à
Dans cet article
Résumé
Nous décrivons ici un protocole pour évaluer l' activité antifongique des cellules immunitaires humaines primaires en temps réel en utilisant fluorescent Aspergillus reporter conidies conjointement avec la microscopie vidéo en direct de cellules et cytométrie de flux. Les données obtenues permettent de mieux comprendre les interactions Aspergillus niger hôtes telles que l' activité fongicide, la phagocytose, la migration cellulaire et l' inhibition de la croissance fongique.
Résumé
Aspergillus fumigatus est un champignon pathogène opportuniste causant des infections invasives chez les hôtes immunodéprimés avec un fort taux de létalité. Recherche portant sur les réponses immunologiques contre A. fumigatus a été limitée par l'absence d'analyses cohérentes et fiables pour mesurer l'activité antifongique des cellules immunitaires spécifiques in vitro. Une nouvelle méthode est décrite pour évaluer l'activité antifongique des monocytes et des neutrophiles primaires provenant de donneurs humains contre A. fumigatus utilisant Aspergillus fluorescent rapporteur (FLARE) conidies. Ces conidies contiennent un reporter DsRed génétiquement codé, qui est exprimée de manière constitutive par les conidies en direct FLARE et sont à l' extérieur marqué avec Alexa Fluor 633, qui est résistant à la dégradation à l'intérieur du phagolysosome, permettant ainsi une distinction entre vivants et morts A. fumigatus conidies. microscopie vidéo et cytométrie de flux sont ensuite utilisés pour visualiser la Interagirion entre conidies et les cellules immunitaires innées, l'évaluation de l'activité fongicide tout en fournissant également une mine d'informations sur la migration des phagocytes, la phagocytose et l'inhibition de la croissance fongique. Cette nouvelle technique a déjà fourni de nouvelles informations passionnantes sur l'interaction hôte-pathogène des cellules immunitaires primaires contre A. fumigatus. Il est important de noter la configuration de laboratoire requis pour effectuer cette analyse, y compris la microscopie nécessaire et cytométrie de flux des installations, et la capacité de travailler avec du sang de donneurs humains et les champignons génétiquement modifiés. Cependant, cet essai est capable de générer de grandes quantités de données et peut révéler un aperçu détaillé dans la réponse antifongique. Ce protocole a été utilisé avec succès pour étudier l'interaction hôte-pathogène des cellules immunitaires primaires contre A. fumigatus.
Il est important de noter la configuration de laboratoire requis pour effectuer cette analyse, y compris la microscopie nécessaire et cytométrie de flux facilities et la capacité de travailler avec le sang des donneurs humains et les champignons génétiquement modifiés. Cependant, cet essai est capable de générer de grandes quantités de données et peut révéler un aperçu détaillé dans la réponse antifongique. Ce protocole a été utilisé avec succès pour étudier l'interaction hôte-pathogène des cellules immunitaires primaires contre A. fumigatus.
Introduction
Aspergillus fumigatus est un champignon pathogène opportuniste et la cause fongique la plus courante des infections pulmonaires invasives chez l'hôte immunodéprimé 1, 2. Comprendre comment les cellules immunitaires hôtes reconnaissent et éliminent Aspergillus est un domaine important de la recherche fongique, cependant, les tests actuellement disponibles parasiticides ont des limites importantes. Les méthodes couramment utilisées pour mesurer l' activité fongicide comprennent les dosages colorimétriques et détermination des unités formant des colonies 3, 4. Cependant, ces méthodes fournissent des informations sur la viabilité des champignons à un seul point du temps plutôt que de considérer l'interaction dynamique entre l'hôte et l'agent pathogène. Par conséquent, ces méthodes ne peuvent pas prendre en compte si un champignon a été tué ou simplement (temporairement) restreint la croissance ou l'activité métabolique. Nous avons mis au point une méthode capable d'observer fungiciactivité dal directement tout en capturant simultanément des informations détaillées sur la phagocytose, la migration des phagocytes et l'inhibition de la croissance fongique.
Auparavant, un protocole a été publié en utilisant l' imagerie en temps réel comme un moyen pour mesurer la phagocytose de Candida albicans par une lignée cellulaire de macrophages de souris 5. Ce concept a été développé plus pour combler le déficit de connaissances dans notre compréhension des interactions avec les cellules immunitaires Aspergillus en utilisant FLUORESCENT Aspergillus REPORTER (FLARE) conidies 6, 7, 8. Ces conidies expriment un fluorochrome rouge (DsRed) et sont marquées avec un second fluorophore (Alexa Fluor 633). Une fois qu'une conidie FLARE est tué, il cesse de produire DsRed et la DsRed restants fondus, tandis que le reste AF633 fluorescent et lié à la conidies. Cela crée une distinction claire entre fu morts et vivantscellules NGAL lors de l'imagerie de cellules vivantes et cytométrie de flux, et permet le suivi du sort des conidies individuels après leur interaction avec les cellules immunitaires.
Les essais décrits fournissent une méthode efficace de visualiser l'interaction entre les cellules immunitaires hôtes et Aspergillus et seront d' une valeur considérable dans le décryptage des voies de signalisation cellulaires responsables de mécanismes effecteurs antifongiques dans les cellules immunitaires innées. D' autres applications comprennent la visualisation de la façon dont les changements dans la croissance d' Aspergillus, tels que le passage de repos à conidies gonflé, ou de conidies gonflés à hyphes, affectent la reconnaissance des phagocytes et la fonction.
Le protocole suivant décrit en détail comment obtenir des monocytes humains et des neutrophiles; la façon de préparer la FLARE conidies; et comment capturer leurs réponses avec la microscopie vidéo et cytométrie de flux. Bien que l'utilisation de cellules immunitaires humaines isolées à partir du sang de donneur est décrit ici, cettetechnique a fait ses preuves tout aussi efficace en utilisant une variété de populations de cellules murines.
Protocole
Le protocole pour l' obtention de neutrophiles et des cellules mononucléaires de sang périphérique (PBMC) sont basées sur les méthodes publiées antérieurement 9. L'utilisation d'échantillons de sang provenant de volontaires sains a été approuvé par le comité d'éthique de la recherche humaine de l'Université d'Aberdeen. Avant de commencer assurez-vous que toutes les approbations éthiques sont en place pour prélever du sang chez des volontaires sains et / ou des patients dans le but de l'expérience décrite. Gardez les cellules sur la glace si possible d'augmenter leur survie.
1. A. fumigatus Culture et conditions
- Préparer un milieu d' agar minimal de glucose comme décrit 10.
- Ajuster médias à pH 6,5 en utilisant du NaOH 1 M et autoclave à 120 ° C pendant 20 min.
- Laisser refroidir à 65 ° C.
- Travailler dans une hotte à flux stérile, verser 30 ml de milieu refroidi dans un flacon T75 et on laisse refroidir le col du ballon reposant sur une pipette de 25 ml à créer incliné de gélose.
- Série de la DsRed Af293- souche de A. fumigatus sur la gélose et incuber pendant 7 jours à 37 ° C + 5% CO 2. Deux flacons donneront environ 10 9 conidies dans une solution saline 5 tamponnée au phosphate mL (PBS) pré-biotinylation.
2. A. fumigatus étiquetage et préparation
Remarque: Lors de cet essai pour la première fois, préparer le Af293- parental souche de A. fumigatus. Prélever des échantillons des deux souches dans des tubes de microcentrifugation et étiqueter un seul de chaque souche comme décrit ci-dessous. Cela permettra d'avoir une conidies de contrôle sans couleur et conidies avec une seule couleur, soit DsRed ou AF633, pour tester la configuration et de l'équipement.
- Récolte A. fumigatus conidies par immersion de la culture avec 30 ml de PBS + 0,05% de Tween-80. On filtre la suspension résultante à travers un tamis cellulaire de 40 um dans un tube de 50 ml pour éliminer les fragments d'hyphes.
- Centrifuge à 805 xg pendant 10 minutes, éliminer le surnageant et laver une fois dans 20 ml de PBS stérile. Piscine conidies de deux plaques de la même souche lors de l'étape de lavage.
- Après l'étape de lavage, resuspendre le culot dans 5 ml de PBS et le transfert aliquotes de 1 ml de suspension de conidies dans des tubes de microcentrifugation. 1 ml de suspension de chaque souche est généralement suffisant pour l'imagerie des cellules vivantes. Envelopper les aliquotes restantes dans la feuille et stocker à 4 ° C.
- aliquotes centrifugeuse de suspension de conidies à 9,300 g pendant 10 min à température ambiante et retirez soigneusement le surnageant. Remettre en suspension le culot dans 1 ml de conidies 0,05 M pH 8,3 NaHCO 3.
- Préparer 10 mg de biotine / 200 ul de diméthylsulfoxyde (DMSO) solution mère en reconstituant 25 mg de biotine dans 500 ul de DMSO. Ajouter 10 ul de biotine / DMSO solution mère dans le tube de microcentrifugeuse, le couvercle en feuille d'aluminium et incuber pendant 2 heures sur une bascule à 4 ° C.
- Aliquoter le reste de la biotine / DMSO stock solution et congeler à -20 ° C pour une utilisation dans des expériences ultérieures.
- Centrifuger pendant 10 min à 9,300 xg et retirez soigneusement le surnageant. Remettre en suspension le culot dans 1 ml de conidies de Tris-HCl pH 8,0 100 mM pendant 1 h pour désactiver la biotine flottante.
- Centrifuger pendant 10 min à 9,300 xg et retirez soigneusement le surnageant. Laver le culot deux fois avec 1 mL de PBS stérile et resuspendre le culot dans 1 ml de PBS.
- Dissoudre 1 mg de streptavidine-AF633 dans 0,5 ml de PBS pour faire une solution mère à 2 mg / mL. Ajouter 10 ul de 2 mg / ml de streptavidine-AF633 par 1 ml de suspension de conidies et incuber pendant 40 min à température ambiante sur une bascule recouverte de feuille d'aluminium. Le reste streptavidine-AF633 peut être congelé en aliquots pour une utilisation dans des expériences ultérieures.
- Centrifuger pendant 10 min à 9,300 xg et enlever soigneusement surnageant. Remettre en suspension le culot de conidies dans 1 mL de PBS et compter les conidies en utilisant un hémocytomètre à une dilution de 1: 1000 (1: 100 et 1:10). Ajuster la concentration de conidies à 3,6 x 10 6 / mL avec du CO 2 supports indépendants, envelopper dans du papier et stocker à 4 ° C.
NOTE: Les conidies sont maintenant étiquetés avec AF633 et seront appelés FLARE conidies. - Facultatif: Si la stimulation avec des conidies gonflé est nécessaire, après le comptage des conidies (étape 2.9), diluer conidies à 7,2 x 10 6 / ml dans une base d'azote de levure (YNB) moyen et ajouter 500 uL de suspension de conidies à 4,5 ml de milieu YNB dans un autoclave 50 ml flacon Erlenmeyer. Couvrir et placer le ballon dans un incubateur à secousses (200 tours par minute à 37 ° C) pendant 6 h.
- Transférer le milieu à un tube de 15 ml. Centrifuger à 805 g pendant 10 min à température ambiante et laver une fois dans du PBS. Centrifuger à nouveau culot et remettre en suspension dans 1 ml de milieu CO 2 indépendant, ce qui donne 3,6 x 10 6 conidies / ml.
Remarque: Les conidies agglutiner fréquemment après enflent rendant difficile le comptage précis, il est conseillé de calculer le cnuméros ounted de repos conidies utilisés.
- Transférer le milieu à un tube de 15 ml. Centrifuger à 805 g pendant 10 min à température ambiante et laver une fois dans du PBS. Centrifuger à nouveau culot et remettre en suspension dans 1 ml de milieu CO 2 indépendant, ce qui donne 3,6 x 10 6 conidies / ml.
3. Isolement des humains neutrophiles et des monocytes
- Tracer 20 ml de sang veineux de volontaires sains dans deux tubes de sang de 10 ml contenant de l'acide éthylènediaminetétraacétique (EDTA). Pour chaque donneur séparément, verser 20 ml de sang dans un tube de 50 mL et diluer avec 15 ml de PBS.
- Sous-couche du sang avec 15 ml d'une solution d'isolement des lymphocytes (densité 1,077 g / ml) avec une seringue et une aiguille de fer. Placer l'aiguille dans le bas du tube et forcer doucement la solution d'isolation de lymphocytes out. Centrifuger à 630 g pendant 20 min sans frein et une faible accélération.
- Préparer PBS, refroidi sur la glace.
REMARQUE: Les étapes 3.4 et 3.5 doivent être suivies simultanément pour générer des monocytes (3.4) et neutrophiles (3,5). - L'utilisation d'un pastette, récolte la couche PBMC. Ceci est la couche dans le centre entre la couche de sérum jaune (supérieure) et la solution d'isolation de lymphocytes transparent (inférieur), ettransférer dans un nouveau tube de 50 ml.
- Remplir le tube avec le PBMC jusqu'à 50 ml avec du PBS froid et centrifuger à 582 g pendant 10 min. Retirer le surnageant et laver deux fois avec du PBS froid et remettre en suspension dans 1 ml de PBS par 20 ml de sang de donneur utilisé initialement.
- Faire des dilutions 1:10 pour compter par addition de 20 ul de la suspension de cellules à 160 pi de PBS et 20 ul de bleu trypan. Compter les cellules avec un hémocytomètre.
- Préparer une solution tampon par addition de 26 ml de inactivé par la chaleur du sérum de veau fœtal (FCS) et 2,1 ml d'EDTA 0,5 M et 500 ml de HBSS. Centrifuger les cellules pendant 10 minutes à 515 xg et remettre en suspension dans 40 pl de solution tampon pour 1 x 10 7 cellules.
- Transférer la suspension cellulaire à un tube de 15 ml et ajouter 10 ul de microbilles CD14 par 1 x 10 7 cellules, bien mélanger et incuber pendant 15 min à 4 ° C, en veillant à mélanger les tubes toutes les 5 min.
- Laver les cellules en ajoutant 1 ml de solution tampon pour 1 x 10 7 cellules et centrifuge à 515 xg pendant 10 min.
- Aspirer le surnageant et remettre en suspension complètement jusqu'à 1 x 10 8 cellules dans 500 ul de solution tampon.
- Placer une colonne par échantillon sur un séparateur magnétique selon les instructions du fabricant. Tout d'abord laver la colonne une fois avec 500 pi de solution tampon.
- Pipeter 500 ul de suspension de cellules à travers la colonne, attendez la colonne pour sécher et laver, en répétant cette opération trois fois avec une solution tampon.
- Placer un nouveau tube de 15 ml en dessous de la colonne et prendre la colonne hors du séparateur magnétique. Ensuite, rincer les cellules de la colonne dans le tube avec 1 ml de solution tampon.
- Ajouter 4 ml de solution tampon et centrifuger à 515 g pendant 10 min, puis remettre en suspension dans 1 ml de Roswell Park Memorial Institute (RPMI) de support.
- Faire des dilutions 1:10 pour compter par addition de 20 ul de la suspension de cellules à 160 pi de PBS et 20 ul de bleu trypan. Compter les cellules avec unhémocytomètre.
- Ajuster la concentration cellulaire à 6 x 10 5 / ml avec du RPMI et de semences de 200 ul sur une boîte de formation d'image à base de verre de 35 mm. Incuber pendant une nuit à 37 ° C avec 5% de CO 2.
- Le jour suivant, avant l'imagerie, retirer le RPMI et ajouter 200 ul de milieu CO 2 indépendant.
Remarque: Ces monocytes peuvent également être différenciées en différents sous-ensembles macrophage avant l'imagerie. Si cela est une technique à explorer, un excellent point de départ est le document récent de Ohradanova-Repic et al. 1 1.
- Après la récolte, la couche PBMC, enlever tout le sérum et la majeure partie de la solution d'isolement des lymphocytes, mais attention à ne pas enlever la petite bande blanche sur le dessus de la pastille rouge comme cela contiendra la plupart des neutrophiles.
- Préparer un stock tampon de lyse hypotonique 10x en ajoutant 83 g de NH 4 Cl et 10 g de KHCO 3 dans 1 L d'eau stérile. Conserver à 4 °C.
- Diluez ce stock 10x avec de l'eau stérile et l'ajouter aux tubes. Ensuite, retourner avec précaution 3 fois et laisser incuber dans de la glace pendant 15 minutes.
- Centrifuger à 394 g pendant 10 min et remettre en suspension dans un tampon de lyse hypotonique pendant 10 min dans la glace.
- Centrifuger à 394 xg et laver deux fois avec du PBS froid. Remettre en suspension dans 1 ml de CO 2 par moyen indépendant donneur.
- Faire des dilutions 1:10 pour compter par addition de 20 ul de la suspension de cellules à 160 pi de PBS et 20 ul de bleu trypan. Compter les cellules avec un hémocytomètre.
- Par cytométrie de flux, d' ajuster la concentration de 6 x 10 5 / ml et ajouter la suspension de cellules 400 pl sur une plaque à 24 puits. Pour la microscopie, ajouter 200 pi de la même suspension de cellules dans une boîte de formation d'image à base de verre de 35 mm.
Remarque: l' imagerie ou neutrophile cytométrie de flux doit être initié immédiatement en raison de leur propension à subir l' apoptose si on les laisse non stimulées. Si ce n'est pas possible neutrophiles doivent être conservésglace et utilisé le plus tôt possible (dans la même journée).
4. cytométrie en flux
- Ajouter 200 pi de 1,2 x 10 6 / mL FLARE conidies aux cellules dans la plaque à 24 puits, puis ajouter 100 ul de 20 ug / mL voriconazole. Ajouter 300 ul de RPMI et incuber pendant 16 h à 37 ° C avec 5% de CO 2.
NOTE: Le voriconazole est ajouté pour empêcher la germination des conidies. - Ajouter 25 ul d'une solution mère de calcofluor blanc 1 mM dans chaque puits pour une concentration finale de 25 uM et incuber pendant 10 min à 37 ° C avec 5% de CO 2.
- Centrifuger à 582 g pendant 10 min. Retirer le surnageant et laver deux fois avec du PBS.
- Pour récolter les cellules adhérentes (monocytes), ajouter 1 ml de PBS avec de l' EDTA 3 mM à chaque puits et incuber pendant 10 min à 37 ° C avec 5% de CO 2. Lavez délicatement les cellules de la plaque par pipetage et recueillir des cellules dans un tube.
- Laver une fois dans du tampon FACS (2% de sérum de veau foetal à PBS), puis remettre en suspension dans le tampon FACS pour l'analyse FACS.
- Pour l'analyse FACS, d'abord régler les paramètres de compensation du cytomètre à flux et régler les portes positifs en utilisant des tubes de compensation unique de couleur, y compris les conidies sans couleur: DsRed + conidies, AF633 + conidies, et calcofluor blanc + conidies (généré comme en 4.2).
- Set porte conidies libre basée sur l'avant et la diffusion latérale à l'aide conidies sans couleur. Régler la porte de la cellule sur l'avant et la diffusion latérale en excluant la porte de conidies libre.
- Analyse tube d'échantillon en enregistrant 10.000 événements.
NOTE: Les cellules associées à conidies en direct seront DsRed + et + AF633. Les cellules associées aux conidies morts seront AF633 + seulement. Spectateur cellules qui n'ont pas engagés conidies sera dsRed- et AF633-. Les populations de cellules engagées conidies-sont analysés plus en détail pour calcofluor coloration blanc sur le canal bleu du Pacifique. Conidies qui restent en dehors des cellules sera calcofluor blanc + et conidies qui ont été intériorisé serontCalcofluor Blanc-.
5. Live Cell Microscopie Vidéo
Remarque: Le choix du microscope dépendra de ce qui est disponible localement, mais la configuration du microscope devra inclure une étape inversée, une chambre environnementale chauffé à 37 ° C et les filtres d'excitation / émission appropriés pour DsRed (532/561 nm) et AF633 (633 nm). conidies FLARE ne fonctionnent pas avec le laser 488 nm au lieu du laser 532/561 nm pour DsRed. Lors de cette expérience pour cette première fois, utilisez le conidies de contrôle sans couleur et couleur unique pour tester la fluorescence de fond et transpercement entre les DsRed et les canaux de AF633.
- Mettre en marche le chauffe-microscope avant l'expérience et laisser suffisamment de temps pour la chambre de contrôle de l'environnement se réchauffer à 37 ° C. Le temps pris pour la température de la chambre afin de stabiliser varie pour différentes configurations de microscope.
- Allumez le microscope et l'ordinateur, et voiciannonce le logiciel d'imagerie. Monter le plat d'imagerie sur la scène du microscope et la mise au point de trouver les neutrophiles humains ou monocytes.
- Pour DsRed et AF633, régler la puissance du laser de 10% et le temps d'exposition à 1 s dans les paramètres d'acquisition.
- Retirer la lame de formation d'image et ajouter 100 ul de 3 x 10 6 / mL FLARE de suspension de conidies dans les puits appropriés (volume total de 300 pl / puits). Notez le temps que FLARE conidies sont ajoutés au plat.
- Retour à la diapositive la scène et régler la sensibilité de la caméra pour DsRed et AF633 pour voir clairement les conidies mais pas surexposer l'image. Mettre en place une liste de points d'étape si l'acquisition multi-points est nécessaire.
- Commencer l'imagerie lorsque tous les points sont mis au point, les canaux sont optimisés et le temps de cycle et la durée est définie. Le temps de cycle et la durée de formation d'image dépend de la question expérimentale. Le but est de maintenir le temps de cycle le plus court possible (≤2 min) avec 1 min pour permettre une analyse en profondeur de uptla dynamique de AKE.
Résultats
Les résultats représentatifs sont présentés suivant le protocole décrit. La figure 1 illustre un représentant 6 h vidéo en direct avec des cellules neutrophiles humains et FLARE conidies. DsRed (rouge) est exprimé par les conidies eux-mêmes alors qu'ils ont été étiquetés avec AF633 (Magenta).
La figure 2 est une image à partir d' un seul point du temps d'un film similaire comme indiqué dans la figure 1, illustrant la différence entre FLARE morts et vivants conidies. Morts conidies se distinguent des conidies en direct en perdant leur signal DsRed (rouge), tout en maintenant une fluorescence AF633 lumineux (magenta). A. fumigatus conidies survivent souvent dans les phagocytes pour plus de 6 h. Par conséquent, pour quantifier efficacement tuer, cytométrie de flux sont présentés parcelles pendant une période d'incubation de 16 h à la figure 3. Ces données ont été obtenues avec un macrophage alvéolaire CEligne ll comme un exemple, mais peut être réalisée avec tout type de cellule. Dans la figure 4 , la migration est indiquée dans la première heure de stimulation pour les neutrophiles humains ainsi que leur vitesse et le mouvement directionnel. La figure 5 représente le pourcentage de neutrophiles et de monocytes qui ont ingéré 1, 2, 3 conidies ou plus tandis que la figure 6 montre le nombre de conidies qui germent dans les hyphes.

Figure 1: microscopie vidéo cellules vivantes film de neutrophiles humains et FLARE conidies. Les neutrophiles ont été isolés à partir de sang humain et ensemencées avec FLARE conidies en milieu CO 2 indépendant à un rapport de 1: 3, respectivement. L'imagerie a été initiée directement à 37 ° C avec un microscope confocal à disque rotatif. Les images ont été capturées à intervalles de 1 min et 55 s sur une période de 6 h. Barre d'échelle = 10 pm.Un zoom vidéo est représenté avec les canaux séparés pour clarifier le rôle des conidies évasé avec DIC en haut à gauche, DsRed (rouge) dans la partie supérieure droite, AF633 (vert) dans le coin inférieur gauche et la vidéo fusionnée en bas à droite . S'il vous plaît cliquer ici pour télécharger cette vidéo.

Figure 2: image seul point du temps qui démontre la différence entre FLARE morts et vivants conidies. Les neutrophiles humains ont été stimulées avec FLARE conidies et imagé avec un microscope confocal à disque rotatif. Une image a été prise à partir des films générés. Morts conidies se distinguent des hyphes en ayant perdu leur DsRed (rouge: haut à droite) le signal tout en conservant leur fluorescence AF633 (verte: en bas à gauche). S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3: Quantification et validation de phagocytose et de A. fumigatus conidies. les cellules de macrophages alvéolaires de souris (MH-S) ont été incubées avec FLARE conidies à un rapport 1: 1 pendant 16 h en présence de voriconazole. les cellules MH-S associés aux conidies vivants sont présentées dans la grille rouge (DsRed + AF633 +). les cellules MH-S associés avec des conidies mortes sont présentées dans la grille bleue (DsRed-AF633 +). Bystander cellules MH-S sont présentées dans la grille d'or. Calcofluor blanc, un colorant fluorescent de cellule imperméable qui se lie à la paroi cellulaire fongique, est utilisé pour distinguer les conidies extracellulaire (calcofluor blanc +) à partir de conidies intracellulaire (calcofluor Whitehead). Comme une validation supplémentaire pour le procédé, il est démontré que le traitement avec 2 uM de cytochalasine D inhibe l'absorption des conidies par les cellules MH-S.e.jove.com/files/ftp_upload/55444/55444fig3large.jpg">Please cliquez ici pour voir une version plus grande de ce chiffre.
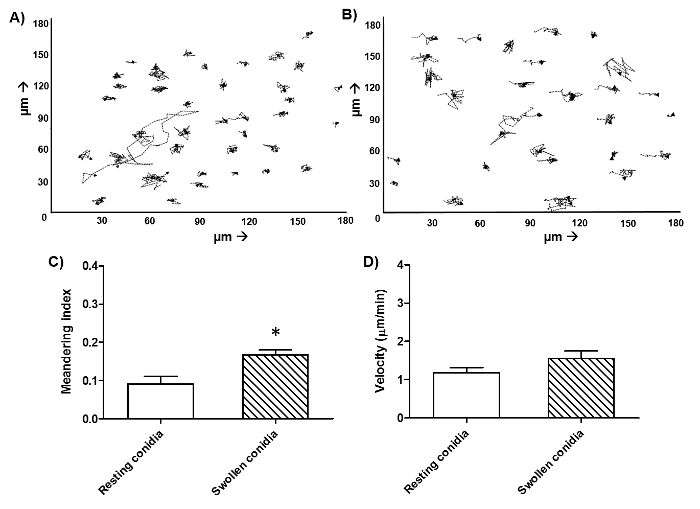
Figure 4: La migration des neutrophiles humains et monocytes contre A. fumigatus conidies. Les neutrophiles ont été isolés à partir de sang humain et ensemencées avec FLARE conidies en milieu CO 2 indépendant à un rapport de 1: 3, respectivement. L'imagerie a été initiée directement à 37 ° C avec un microscope confocal à disque rotatif. Les images ont été capturées à 1 min et 55 s intervalles sur une période de 6 heures. La migration de tous les neutrophiles humains individuels par champ a été suivi en utilisant un logiciel de suivi manuellement à l'encontre de repos (A) et gonflé (B) conidies pendant 1 h. Les données représentent une trame de cellules pour chaque condition du même donneur. Le facteur méandres (C), une mesure de la directiomouvement final, et la vitesse (D) ont ensuite été quantifiés en utilisant le même logiciel. Moyenne ± SEM pour 3 donneurs sont représentés avec 30 cellules par donneur plus de 2 expériences indépendantes. *: P <0,05 (test t de Welch corrigé). S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
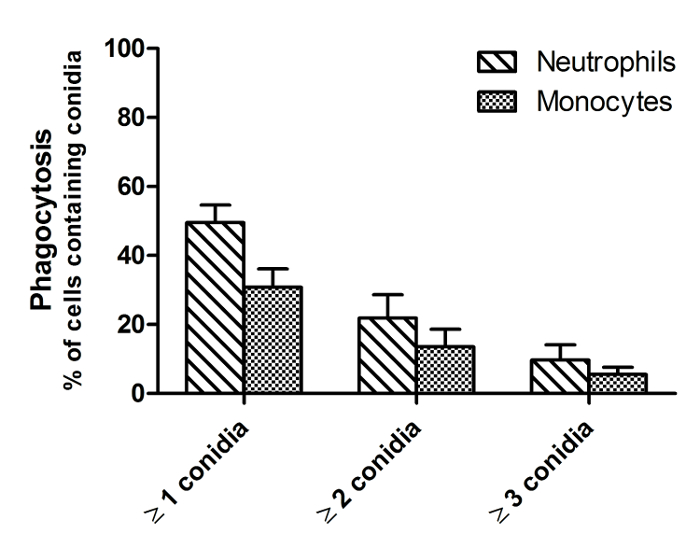
Figure 5: phagocytose de A. fumigatus conidies par les neutrophiles humains et les monocytes. Les neutrophiles et les monocytes ont été isolés à partir de sang humain et ensemencées avec FLARE conidies en milieu CO 2 indépendant à un rapport de 1: 3, respectivement. L'imagerie a été initiée directement à 37 ° C avec un microscope confocal à disque rotatif. Les images ont été capturées à intervalles de 1 min et 55 s sur une période de 6 h. La phagocytose a été mesurée comme la quantité de cellules contiennenting conidies FLARE après 4 h de stimulation. Les données sont présentées comme moyenne ± SEM de 3 donneurs et 3 images par donateur de plus de 2 expériences indépendantes. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
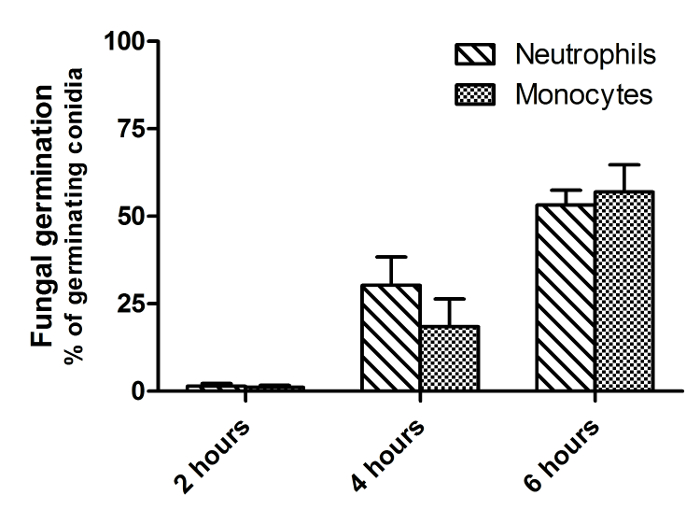
Figure 6: Inhibition de la germination des conidies de A. fumigatus par les neutrophiles et les monocytes. Les neutrophiles et les monocytes ont été isolés à partir de sang humain et ensemencées avec FLARE conidies en milieu CO 2 indépendant à un rapport de 1: 3, respectivement. L'imagerie a été initiée directement à 37 ° C avec un microscope confocal à disque rotatif. Les images ont été capturées à 1 min et 55 s intervalles sur une période de 6 heures. L'inhibition de la germination fongique a été examiné en mesurant le pourcentage de conidies qui avait germeinés après 2, 4 et 6 h de co-culture. Les données sont présentées comme moyenne ± SEM de 3 donneurs et 3 images par donateur de plus de 2 expériences indépendantes. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Cette méthode décrit une méthode novatrice dans in vitro pour étudier l'activité antifongique des phagocytes humains primaires contre A. fumigatus utilisant Aspergillus fluorescent rapporteur (FLARE) conidies, imagerie des cellules vivantes et cytométrie de flux. Des études antérieures ont démontré la valeur ajoutée de l' utilisation conidies FLARE in vivo dans une infection fongique expérimentale murine et dans l' évaluation in vitro de l' immunité antifongique 6, 7. La combinaison de FLARE conidies avec cette nouvelle génération en temps réel technique d'imagerie cellulaire permet une installation pour mesurer la viabilité des conidies individuelle au cours des interactions dynamiques in vitro.
La méthode décrite a le potentiel d'enquêter sur les rôles et l'importance de certains processus cellulaires de cellules immunitaires sur leurs réponses anti-fongiques. En outre, les réponses anti-fongiques de phagocytes de patients spécifiques souffrant desimples défauts de composants définies dans le système immunitaire peut être évaluée de façon plus détaillée. Très tôt et les réponses initiales antifongiques peuvent être étudiés en détail plus de 6 h d'imagerie continue. Cela permet même des différences subtiles à détecter, telles que la vitesse de migration des phagocytes vers le champignon, les taux d'intériorisation, la dynamique des événements 12 parasiticides, qui seraient indiscernables en utilisant des méthodes de phagocytose conventionnelles.
Tout type de cellule peut être utilisée avec cette méthode; les types cellulaires utilisés ici ont été choisis parce que ces phagocytes constituent les première et deuxième lignes de défense dans les voies respiratoires humaines contre A. fumigatus 13. Fait intéressant, on observe des différences très claires entre la façon dont les monocytes et les neutrophiles engagent des aires de repos et conidies enflé et hyphes. Monocytes migrent à peine conidies, tandis que les neutrophiles présentent une activité beaucoup plus migratoire. mar fluorescent supplémentairekers tels que des marqueurs vivants morts sur les cellules immunitaires peuvent être inclus dans l'essai pour fournir des indications sur la survie des phagocytes suivant interactions avec Aspergillus. Des applications intéressantes futures potentielles de cette technologie comprennent la co-culture de différents types de cellules hôtes, les conséquences pour les réponses antifongiques (par exemple, les macrophages sur une monocouche épithéliale, les cellules dendritiques dérivées de monocytes ensemble avec neutrophiles), et la mesure en temps réel de réactif production d' oxygène de l' espèce ou des neutrophiles formation de piège extracellulaire après stimulation par Aspergillus.
Quelques points doivent être notés pour utiliser ce protocole, avant tout de l'installation de laboratoire requis: un microscope avec une phase inversée, une chambre environnementale stable à 37 ° C, et l'excitation / filtres d'émission pour DsRed (532/561 nm) et AF633 ( 633 nm). La capacité du microscope pour maintenir les cellules en mise au point et à conserver l'immersion dans l'huile (particulièrement pertinente au cours de macquisition ulti point) doit être contrôlée périodiquement en raison de la longue durée de l'imagerie. Pour la quantification de l'activité parasiticides installations cytométrie de flux sont nécessaires. En outre, les approbations institutionnelles et éthiques appropriées doivent être mises en place pour travailler avec donneur sain et des échantillons de sang provenant de patients et les champignons génétiquement modifiés. Il est fortement recommandé d'utiliser des échantillons de sang frais (utilisation le même jour) pour augmenter la viabilité des cellules et de préserver la fonctionnalité. Idéalement, l'isolement des cellules est effectuée immédiatement après l'étirage des échantillons de sang et les neutrophiles sont imagés immédiatement après l'isolement.
En conclusion, une nouvelle génération technique d'imagerie de cellules vivantes pour évaluer en détail l' activité antifongique phagocytaire contre A. fumigatus est décrit. Cette technologie peut fournir un aperçu unique sur les interactions cellulaires fongiques individuelles dans les premières défenses immunitaires innées contre Aspergillus.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été soutenu par la MRC et l'Université d'Aberdeen (MRC Centre de Mycologie Médicale) et par le Prix stratégique Wellcome Trust - mycologie médicale Fungal Immunologie (SFB, JMB, JK, AW). Un grand merci est donnée au soutien du Fonds Chloe. TMH est soutenu par une subvention de l'Institut national de la santé (NIH, le code RO1 093808) et le Memorial Sloan Kettering Cancer Center est soutenu par des subventions du NIH CA008748 P30. De plus, TMH est un enquêteur dans la pathogénie des maladies infectieuses soutenu par le Fonds Burroughs Wellcome. Nous tenons à remercier le Microscopie Aberdeen et Facility Histologie pour leur aide et leur soutien.
matériels
| Name | Company | Catalog Number | Comments |
| Glycerol | Sigma | G6279 | http://www.sigmaaldrich.com |
| T75 flask | Greiner Bio-One | 658 175 | http://www.greinerbioone.com/ |
| PBS | Gibco | 20012-019 | https://www.thermofisher.com/ |
| Tween-80 | Fisher Scientific | 10592955 | https://nl.fishersci.com/ |
| 40 µm filter | Thermo Fisher Scientific | 22363547 | https://www.thermofisher.com/ |
| 15 mL Falcon tube | Greiner Bio-One | 188 261 | http://www.greinerbioone.com/ |
| 50 mL Falcon tube | Greiner Bio-One | 227 261 | http://www.greinerbioone.com/ |
| MilliQ | Millipore | QGARD00R1 | Nanopure water works similarly. http://www.merckmillipore.com/ |
| Biotin | Molecular Probes | B-6352 | https://www.thermofisher.com/uk/en/home/brands/molecular-probes.html |
| DMSO | Sigma | D5879 | http://www.sigmaaldrich.com |
| Streptavidin-AF633 | Molecular Probes | S-21375 | AF633 is the only tested fluorophore so far that remains visible in phagosomes. https://www.thermofisher.com/uk/en/home/brands/molecular-probes.html |
| EDTA blood tubes | Greiner Bio-One | 455036 | Any blood tubes with an anti-coagulating agent should work. http://www.greinerbioone.com/en/start/ |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | http://www3.gehealthcare.com/ |
| Trypan blue | Thermo Fisher Scientific | SV3008401 | https://www.thermofisher.com/ |
| HBSS | Gibco | 14170112 | https://www.thermofisher.com/uk/en/home/brands/gibco.html |
| CD14 microbeads | Myltenyi Biotec | 130-050-201 | Other monocyte isolation methods can be used as well, we prefer this method as it gives a consistent high purity of monocytes without being labor intensive. http://www.miltenyibiotec.com/en/ |
| MS Columns | Myltenyi Biotec | 130-042-201 | See comment at CD14 microbeads. http://www.miltenyibiotec.com/en/ |
| RPMI + Glutamax | Gibco | 72400-021 | https://www.thermofisher.com/uk/en/home/brands/gibco.html |
| CO2 independent medium | Thermo Fisher Scientific | 18045054 | Necessary if there is not sufficient CO2 exchange during imaging. https://www.thermofisher.com/uk/en/home |
| µ-slide 8 well glass bottom | Ibidi | 80827 | This is the imaging dish that we use, however any glass imaging dish of proper size should work. http://ibidi.com/ |
| UltraVIEW VoX 3D Live Cell Imaging System | Perkin Elmer | L7267000 | Includes volocity software for acquisition and analysis. http://www.perkinelmer.com/ |
| Calcofluor white | Sigma | 18909 | http://www.sigmaaldrich.com/ |
| Voriconazole | Sigma | PZ0005 | http://www.sigmaaldrich.com/ |
| BD LSRII | BD Biosciences | Flowcytometer used. https://www.bdbiosciences.com/ |
Références
- Kosmidis, C., Denning, D. W. The clinical spectrum of pulmonary aspergillosis. Thorax. 70 (3), 270-277 (2015).
- Warris, A. The biology of pulmonary Aspergillus infections. J Infect. 69 (Suppl 1), S36-S41 (2014).
- Henriet, S. S., et al. Human leukocytes kill Aspergillus nidulans by reactive oxygen species-independent mechanisms. Infect Immun. 79 (2), 767-773 (2010).
- Sheppard, D. C., et al. Comparison of three methodologies for the determination of pulmonary fungal burden in experimental murine aspergillosis. Clin Microbiol Infect. 12 (4), 376-380 (2006).
- Lewis, L. E., Bain, J. M., Okai, B., Gow, N. A. R., Erwig, L. P. Live-cell video microscopy of fungal pathogen phagocytosis. J Vis Exp. (71), e50196(2013).
- Heung, L. J., Jhingran, A., Hohl, T. M. Deploying FLAREs to Visualize Functional Outcomes of Host-Pathogen Encounters. PLoS Pathog. 11 (7), e1004912(2015).
- Jhingran, A., et al. Tracing conidial fate and measuring host cell antifungal activity using a reporter of microbial viability in the lung. Cell Rep. 2 (6), 1762-1773 (2012).
- Espinosa, V., et al. Inflammatory monocytes orchestrate innate antifungal immunity in the lung. PLoS Pathog. 10 (2), e1003940(2014).
- English, D., Andersen, B. R. Single step separation of red blood cells, granulocytes and mononuclear leukocytes on discontinuous density gradient of ficoll hypaque. J Immunol Met. 5 (3), 249-252 (1974).
- Shimizu, K., Keller, N. P. Genetic involvement of a cAMP-dependent protein kinase in a G protein signaling pathway regulating morphological and chemical transitions in Aspergillus nidulans. Genetics. 157 (2), 591-600 (2001).
- Ohradanova-Repic, A., Machacek, C., Fischer, M. B., Stockinger, H. Differentiation of human monocytes and derived subsets of macrophages and dendritic cells by the HLDA10 monoclonal antibody panel. Clin Transl Immunology. 5 (1), e55(2016).
- Lewis, L. E., et al. Stage specific assessment of Candida albicans phagocytosis by macrophages identifies cell wall composition and morphogenesis as key determinants. PLoS Pathog. 8 (3), e1002578(2012).
- Schaffner, A., Douglas, H., Braude, A. Selective protection against conidia by mononuclear and against mycelia by polymorphonuclear phagocytes in resistance to Aspergillus. Observations on these two lines of defense in vivo and in vitro with human and mouse phagocytes. J Clin Invest. 69 (3), 617-631 (1982).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon