Method Article
التصوير المباشر لآخر مضاد من قبل العدلات الإنسان الأساسية وحيدات في الاستجابة لل
In This Article
Summary
هنا، نحن تصف بروتوكول لتقييم نشاط مضاد للخلايا المناعية الإنسان الأساسية في الوقت الحقيقي باستخدام الفلورسنت الرشاشيات مراسل غبيرات بالتزامن مع الخلية الحية المجهري الفيديو والتدفق الخلوي. توفر البيانات التي تم إنشاؤها نظرة ثاقبة المضيف الخلوي التفاعلات الرشاشيات مثل النشاط فطريات، البلعمة، والهجرة الخلية وتثبيط نمو الفطريات.
Abstract
الرشاشيات فوميجاتوس هو الممرض الفطرية الانتهازية يسبب العدوى الغازية في يستضيف المناعة مع ارتفاع معدل إماتة الحالات. وقد بحث التحقيق استجابات مناعية ضد A. فوميجاتوس محدودة بسبب عدم وجود فحوصات متسقة وموثوق بها لقياس نشاط مضاد للخلايا مناعية معينة في المختبر. ووصف طريقة جديدة لتقييم نشاط مضاد للحيدات الابتدائية والعدلات من المانحين الإنسان ضد A. فوميجاتوس باستخدام الفلورسنت الرشاشيات مراسل (FLARE) غبيرات. هذه غبيرات تحتوي على ترميز وراثيا مراسل عن dsRed، وهو ما يعبر عنه بشكل جوهري من قبل غبيرات FLARE الحية، ووصفت خارجيا مع فلور اليكسا 633، وهو مقاوم للتحلل داخل يحلول يبلوعي، مما يسمح بالتمييز بين الحية والميتة غبيرات A. فوميجاتوس. المجهر الفيديو والتدفق الخلوي تستخدم لاحقا لتصور التفاعلأيون بين غبيرات والخلايا المناعية الفطرية، تقييم النشاط فطريات بينما توفر أيضا ثروة من المعلومات حول الهجرة بلعمية، البلعمة وتثبيط نمو الفطريات. وقد وفرت هذه التقنية الجديدة بالفعل أفكارا جديدة ومثيرة في التفاعل المضيف الممرض من الخلايا المناعية الأولية ضد A. فوميجاتوس. ومن المهم أن نلاحظ الإعداد المختبرية اللازمة لأداء هذا الاختبار، بما في ذلك الفحص المجهري ضروري والتدفق الخلوي المرافق، والقدرة على العمل مع الدم المانحة البشري والفطريات التلاعب بها وراثيا. ومع ذلك، وهذا الاختبار هو قادرة على توليد كميات كبيرة من البيانات ويمكن أن تكشف عن رؤى تفصيلية في الاستجابة المضادة للفطريات. وقد تم بنجاح تستخدم هذا البروتوكول لدراسة التفاعل المضيف الممرض من الخلايا المناعية الأولية ضد A. فوميجاتوس.
ومن المهم أن نلاحظ الإعداد المختبرية اللازمة لأداء هذا الاختبار، بما في ذلك الفحص المجهري ضروري والتدفق الخلوي وacilities، والقدرة على العمل مع الدم المانحة البشري والفطريات التلاعب بها وراثيا. ومع ذلك، وهذا الاختبار هو قادرة على توليد كميات كبيرة من البيانات ويمكن أن تكشف عن رؤى تفصيلية في الاستجابة المضادة للفطريات. وقد تم بنجاح تستخدم هذا البروتوكول لدراسة التفاعل المضيف الممرض من الخلايا المناعية الأولية ضد A. فوميجاتوس.
Introduction
الرشاشيات فوميجاتوس هو الممرض الفطرية الانتهازية والسبب الفطرية الأكثر شيوعا من التهابات الرئة الغازية في مضيف المناعة 1 و 2. فهم كيف تعترف الخلايا المناعية والقضاء على الرشاشيات هو مجال هام من مجالات البحوث الفطرية، ومع ذلك، فإن فحوصات فطريات المتاحة حاليا لديهم قيود كبيرة. وتشمل الأساليب المستخدمة عادة لقياس النشاط فطريات المقايسات اللونية وتحديد مستعمرة وحدات تشكيل 3 و 4. ومع ذلك، توفر هذه الأساليب من المعلومات حول الجدوى الفطرية عند نقطة زمنية واحدة بدلا من النظر التفاعل الديناميكي بين المضيف والممرض. وبناء على ذلك، يمكن لهذه الطرق لا تأخذ في الاعتبار ما إذا كان فطر قتل أو ببساطة (مؤقتا) مقيدة في النمو أو النشاط الأيضي. لقد قمنا بتطوير طريقة قادرة على مراقبة fungiciالنشاط الدال مباشرة بينما اسر في وقت واحد معلومات مفصلة عن البلعمة، والهجرة بلعمية وتثبيط نمو الفطريات.
سابقا، تم نشر بروتوكول باستخدام التصوير في الوقت الحقيقي كوسيلة لقياس البلعمة من المبيضات البيض بواسطة خط خلية الماوس بلعم 5. وقد تم الآن تطوير هذا المفهوم أخرى لمعالجة الفجوة المعرفية في فهمنا للتفاعلات الرشاشيات مع الخلايا المناعية من خلال الاستفادة من الفلورسنت الرشاشيات مراسل (FLARE) غبيرات 6 و 7 و 8. هذه غبيرات تعبر عن fluorophore الأحمر (عن dsRed) وصفت مع fluorophore الثاني (فلور اليكسا 633). بمجرد قتل غبيرة FLARE، فإنه يتوقف عن إنتاج عن dsRed وعن dsRed المتبقية يتلاشى، في حين لا يزال AF633 الفلورسنت ومنضمة إلى غبيرات. وهذا يخلق تمييزا واضحا بين فو الحية والميتةخلايا ngal خلال تصوير الخلايا الحية والتدفق الخلوي، وتمكن تتبع مصير غبيرات الفردية التالية تفاعلها مع الخلايا المناعية.
توفر فحوصات وصف وسيلة فعالة لتصور التفاعل بين الخلايا المناعية والرشاشيات، وسوف تكون ذات قيمة كبيرة في كشف مسارات الإشارات الخلوية المسؤولة عن آليات المستجيب المضادة للفطريات في الخلايا المناعية الفطرية. وتشمل التطبيقات الأخرى تصور كيف تؤثر التغيرات في نمو الرشاشيات، مثل التحول من الراحة لغبيرات تورم، أو من غبيرات منتفخة إلى خيوط، والاعتراف بلعمية وظيفة.
يصف بروتوكول التالية بالتفصيل كيفية الحصول على حيدات الإنسان والعدلات. كيفية إعداد غبيرات FLARE. وكيفية التقاط ردودهم مع المجهر الفيديو والتدفق الخلوي. على الرغم من أن استخدام الخلايا المناعية البشرية معزولة عن التبرع بالدم هو موضح هنا، وهذاوقد أثبتت تقنية نفس القدر من الفعالية باستخدام مجموعة متنوعة من السكان الخلية الفئران.
Protocol
ويستند هذا البروتوكول للحصول على العدلات وخلايا وحيدة النواة الدم المحيطي (PBMC) على الأساليب المنشورة سابقا 9. تمت الموافقة على استخدام عينات الدم من المتطوعين الأصحاء من قبل لجنة أخلاقيات البحوث البشرية من جامعة أبردين. قبل البدء تأكد من كافة الموافقات الأخلاقية في مكانها الصحيح لسحب الدم من المتطوعين الأصحاء و / أو المرضى لغرض التجربة وصفها. تبقي الخلايا على الجليد حيث من الممكن زيادة بقائهم على قيد الحياة.
1. A. فوميجاتوس الثقافة والشروط
- إعداد الجلوكوز الحد الأدنى من المتوسط أجار كما هو موضح 10.
- ضبط وسائل الاعلام لدرجة الحموضة 6.5 باستخدام 1 M هيدروكسيد الصوديوم والأوتوكلاف على 120 درجة مئوية لمدة 20 دقيقة.
- السماح لتبرد إلى 65 درجة مئوية.
- العمل في غطاء تدفق العقيمة، صب 30 مل من وسائل الاعلام تبريد في قارورة T75 والسماح لتبرد مع عنق يستريح قارورة على ماصة 25 مل إلى create منحدر أجار.
- خط خارج عن dsRed Af293- A. فوميجاتوس الضغط على أجار واحتضان لمدة 7 أيام عند 37 درجة C + 5٪ CO 2. واثنين من قوارير تسفر عن ما يقرب من 10 9 غبيرات في 5 المالحة الفوسفات مخزنة مل (PBS) قبل biotinylation.
2. A. فوميجاتوس وسمها وإعداد
ملاحظة: عند إجراء هذا الاختبار لأول مرة، وإعداد الوالدين Af293- سلالة A. فوميجاتوس. أخذ عينات من كل من السلالات في أنابيب microcentrifuge وتسمية واحد فقط من كل سلالة كما هو موضح أدناه. وهذا سوف يسمح احد ليكون غبيرات السيطرة مع أي لون وغبيرات بلون واحد، إما عن dsRed أو AF633، لاختبار الإعداد والمعدات.
- الحصاد A. فوميجاتوس غبيرات بغمر الثقافة مع 30 مل PBS + 0.05٪ توين-80. تصفية تعليق الناتجة من خلال مصفاة الخلية 40 ميكرومتر في أنبوب 50 مل لإزالة شظايا خوطي.
- Centrifuge في 805 x ج لمدة 10 دقيقة، وإزالة طاف ويغسل مرة واحدة في 20 مل من برنامج تلفزيوني العقيمة. تجمع غبيرات من صفيحتين من نفس السلالة أثناء الخطوة غسل.
- بعد خطوة الغسيل، وإعادة تعليق بيليه في 5 مل من برنامج تلفزيوني ونقل 1 مليلتر مأخوذة من تعليق بوغي في أنابيب microcentrifuge. 1 مل من تعليق كل سلالة وعادة ما يكفي لتصوير الخلايا الحية. التفاف أجزاء مأخوذة المتبقية في احباط وتخزينها في 4 ° C.
- أجزاء مأخوذة من أجهزة الطرد المركزي من تعليق بوغي في 9300 x ج لمدة 10 دقيقة في درجة حرارة الغرفة، وإزالة بعناية طاف. إعادة تعليق بيليه بوغي في 1 مل 0،05 M NaHCO 3 درجة الحموضة 8.3.
- إعداد 10 ملغ البيوتين / 200 ميكرولتر ثنائي ميثيل سلفوكسيد (DMSO) حل سهم خلال إعادة تأسيس 25 ملغ البيوتين في 500 ميكرولتر DMSO. إضافة 10 ميكرولتر البيوتين / DMSO الحل الأسهم إلى أنبوب microcentrifuge، والغطاء في رقائق الألومنيوم واحتضان لمدة 2 ساعة على الكرسي الهزاز في 4 درجات مئوية.
- قسامة ما تبقى من البيوتين / DMSO محلول الأسهمن وتجميد في -20 درجة مئوية لاستخدامها في تجارب لاحقة.
- أجهزة الطرد المركزي لمدة 10 دقيقة في 9300 x ج وإزالة بعناية طاف. إعادة تعليق بيليه بوغي في 1 مل من 100 ملي تريس، حمض الهيدروكلوريك 8.0 درجة الحموضة لمدة 1 ساعة لإيقاف البيوتين التعويم الحر.
- أجهزة الطرد المركزي لمدة 10 دقيقة في 9300 x ج وإزالة بعناية طاف. يغسل بيليه مرتين مع 1 مل من برنامج تلفزيوني العقيمة وإعادة تعليق بيليه في 1 مل من برنامج تلفزيوني.
- حل 1 ملغ من Streptavidin-AF633 في 0.5 مل من برنامج تلفزيوني لجعل 2 ملغ / مل محلول المخزون. إضافة 10 ميكرولتر من 2 ملغ / مل streptavidin-AF633 لكل 1 مل من تعليق بوغي واحتضان لمدة 40 دقيقة في درجة حرارة الغرفة على الكرسي الهزاز مغطاة بورق الألمنيوم. ما تبقى من Streptavidin-AF633 يمكن تجميدها في أجزاء مأخوذة من أجل استخدامها في تجارب لاحقة.
- أجهزة الطرد المركزي لمدة 10 دقيقة في 9300 x ج وإزالة بعناية طاف. إعادة تعليق بيليه بوغي في 1 مل من برنامج تلفزيوني والاعتماد على غبيرات باستخدام عدادة الكريات في التخفيف 1: 1000 (1: 100 ثم 1:10). ضبط تركيز بوغي إلى 3.6 × 10 6 / مل مع CO 2 وسائل الإعلام المستقلة، والتفاف في احباط وتخزينها في 4 ° C.
ملاحظة: وصفت وغبيرات الآن مع AF633 وسيتم يشار إلى غبيرات FLARE. - اختياري: إذا كان مطلوبا التحفيز مع غبيرات منتفخة، بعد فرز غبيرات (الخطوة 2.9)، وتمييع غبيرات إلى 7.2 × 10 6 / مل في قاعدة الخميرة النيتروجين (YNB) متوسطة وإضافة 500 ميكرولتر تعليق بوغي إلى 4.5 مل YNB المتوسطة في تعقيمها 50 قارورة مل إرلينمير. تغطية ووضع القارورة في حاضنة تهتز (200 دورة في الدقيقة عند 37 درجة مئوية) لمدة 6 ساعات.
- نقل متوسطة إلى أنبوب 15 مل. أجهزة الطرد المركزي في 805 x ج لمدة 10 دقيقة في درجة حرارة الغرفة، ويغسل مرة واحدة في برنامج تلفزيوني. الطرد المركزي مرة أخرى و resuspend بيليه في 1 مل CO 2 متوسطة مستقلة، وإعطاء 3.6 × 10 6 غبيرات / مل.
ملاحظة: غبيرات كثيرا ما تتجمع بعد أن تصبح منتفخة مما عد دقيقة صعبة، وينصح لحساب مع جأرقام ounted من الراحة غبيرات المستخدمة.
- نقل متوسطة إلى أنبوب 15 مل. أجهزة الطرد المركزي في 805 x ج لمدة 10 دقيقة في درجة حرارة الغرفة، ويغسل مرة واحدة في برنامج تلفزيوني. الطرد المركزي مرة أخرى و resuspend بيليه في 1 مل CO 2 متوسطة مستقلة، وإعطاء 3.6 × 10 6 غبيرات / مل.
3. عزل العدلات الإنسان وحيدات
- رسم 20 مل من الدم الوريدي من المتطوعين الأصحاء إلى قسمين 10 أنابيب الدم مل تحتوي على ثنائي أمين الإيثيلين رباعي حمض الخل (EDTA). لكل المانحة على حدة، صب 20 مل الدم في أنبوب 50 مل وتمييع مع 15 مل PBS.
- الأساس الذي تقوم عليه الدم مع 15 مل من محلول اللمفاويات العزلة (الكثافة 1.077 غ / مل) مع حقنة والحديد الإبرة. وضع إبرة في أسفل الأنبوب وفرض بلطف الحل اللمفاويات العزلة بها. أجهزة الطرد المركزي في 630 x ج لمدة 20 دقيقة بدون فرامل وتسارع منخفض.
- إعداد برنامج تلفزيوني والمبردة على الجليد.
ملاحظة: خطوات 3.4 و 3.5 يجب اتباعها في وقت واحد لتوليد حيدات (3.4) والعدلات (3.5). - باستخدام pastette، حصاد طبقة PBMC. هذا هو طبقة في وسط بين مصل أصفر (العلوي) والحل شفافة لمفاوية العزلة (أقل) طبقة، ونقل الى الطازجة أنبوب 50 مل.
- ملء الأنبوب مع PBMC إلى 50 مل مع برنامج تلفزيوني الباردة وأجهزة الطرد المركزي في 582 x ج لمدة 10 دقيقة. إزالة طاف ويغسل مرتين مع PBS الباردة و resuspend في 1 مل من برنامج تلفزيوني في 20 مل من الدم المانحة يستخدم في البداية.
- جعل 01:10 التخفيفات لحساب بإضافة 20 ميكرولتر من تعليق خلية إلى 160 ميكرولتر من برنامج تلفزيوني و 20 ميكرولتر من التريبان الأزرق. عدد الخلايا مع عدادة الكريات.
- يعد حل العازلة بإضافة 26 مل من الحرارة المعطل مصل العجل الجنين (FCS) و 2.1 مل من 0.5 M EDTA إلى 500 مل من HBSS. الطرد المركزي الخلايا لمدة 10 دقيقة في 515 x ج و resuspend في 40 ميكرولتر من حل العازلة لكل 1 × 10 7 الخلايا.
- نقل تعليق خلية إلى أنبوب 15 مل وإضافة 10 ميكرولتر من ميكروبيدات CD14 لكل 1 × 10 7 خلايا، وتخلط جيدا واحتضان لمدة 15 دقيقة في 4 درجات مئوية، مع التأكد من خلط الأنابيب كل 5 دقائق.
- غسل الخلايا عن طريق إضافة 1 مل من محلول العازلة لكل 1 × 10 7 خلايا وCENtrifuge في 515 x ج لمدة 10 دقيقة.
- نضح طاف تماما وإعادة تعليق تصل إلى 1 × 10 8 خلايا في 500 ميكرولتر من محلول العازلة.
- وضع العمود 1 لكل عينة على فاصل المغناطيسي وفقا لتعليمات الشركة الصانعة. أولا غسل العمود مرة واحدة مع 500 ميكرولتر من محلول العازلة.
- ماصة 500 ميكرولتر من تعليق الخلية من خلال العمود، انتظر العمود ليجف ثم يغسل بتكرار هذا ثلاث مرات مع حل العازلة.
- وضع جديد 15 مل أنبوب تحت العمود واتخاذ العمود قبالة فاصل المغناطيسي. ثم طرد الخلايا من العمود في أنبوب مع 1 مل من محلول العازلة.
- إضافة 4 مل من محلول العازلة وأجهزة الطرد المركزي في 515 x ج لمدة 10 دقيقة، ثم إعادة تعليق في 1 مل من معهد روزويل بارك التذكاري (RPMI) المتوسطة.
- جعل 01:10 التخفيفات لحساب بإضافة 20 ميكرولتر من تعليق خلية إلى 160 ميكرولتر من برنامج تلفزيوني و 20 ميكرولتر من التريبان الأزرق. عد الخلايا مععدادة الكريات.
- ضبط تركيز الخلية إلى 6 × 5 10 / مل مع RPMI والبذور 200 ميكرولتر على طبق التصوير مقرها الزجاج 35 ملم. احتضان ليلا 37 درجة مئوية مع 5٪ CO 2.
- في اليوم التالي، قبل التصوير، وإزالة RPMI وإضافة 200 ميكرولتر من CO 2 متوسطة مستقل.
ملاحظة: يمكن أيضا أن هذه حيدات تكون متباينة في مختلف مجموعات فرعية بلعم قبل التصوير. إذا كان هذا هو أسلوب من يكتشفها، نقطة انطلاق ممتازة هي ورقة الأخيرة التي Ohradanova-Repic وآخرون. 1 1.
- بعد حصاد طبقة PBMC، إزالة كافة مصل وأكثر من حل لمفاوية العزلة، ولكن يجب الحرص على عدم إزالة الفرقة بيضاء صغيرة على رأس بيليه الأحمر حيث سيؤدي ذلك إلى احتواء معظم العدلات.
- إعداد مخزون احتياطي 10X تحلل منخفض التوتر من خلال إضافة 83 غرام من NH 4 الكلورين و 10 غرام من KHCO 3 في 1 لتر من الماء المعقم. تخزينها في 4 درجاتC.
- تمييع هذه 10X الأسهم مع الماء المعقم وإضافته إلى الأنابيب. ثم، عكس بعناية 3 مرات واحتضان في الثلج لمدة 15 دقيقة.
- أجهزة الطرد المركزي في 394 x ج لمدة 10 دقيقة و resuspend في تحلل العازلة منخفض التوتر لمدة 10 دقيقة في الجليد.
- أجهزة الطرد المركزي في 394 x ج ويغسل مرتين مع PBS الباردة. Resuspend في 1 مل من CO 2 متوسطة مستقل لكل من الجهات المانحة.
- جعل 01:10 التخفيفات لحساب بإضافة 20 ميكرولتر من تعليق خلية إلى 160 ميكرولتر من برنامج تلفزيوني و 20 ميكرولتر من التريبان الأزرق. عدد الخلايا مع عدادة الكريات.
- لالتدفق الخلوي، وضبط تركيز إلى 6 × 5 10 / مل وإضافة تعليق الخلية 400 ميكرولتر من 24 لوحة جيدا. للفحص المجهري، إضافة 200 ميكرولتر من نفس التعليق الخلية إلى طبق التصوير مقرها الزجاج 35 ملم.
ملاحظة: التصوير العدلات أو التدفق الخلوي ينبغي أن تبدأ على الفور بسبب ميلها للخضوع لموت الخلايا المبرمج إذا ترك unstimulated. إذا لم يكن هذا يجب أن تبقى العدلات المحتملة علىالجليد واستخدامها في أقرب وقت ممكن (في نفس اليوم).
4. التدفق الخلوي
- إضافة 200 ميكرولتر من 1.2 × 10 6 / مل FLARE غبيرات إلى الخلايا في 24 لوحة جيدا، ثم قم بإضافة 100 ميكرولتر من 20 ميكروغرام / مل voriconazole. إضافة 300 ميكرولتر من RPMI واحتضان لمدة 16 ساعة عند 37 درجة مئوية مع 5٪ CO 2.
يضاف Voriconazole لمنع إنبات غبيري: ملاحظة. - إضافة 25 ميكرولتر من محلول المخزون 1 ملم Calcofluor أبيض إلى كل بئر لتركيز النهائي من 25 ميكرومتر واحتضان لمدة 10 دقيقة عند 37 درجة مئوية مع 5٪ CO 2.
- أجهزة الطرد المركزي في 582 x ج لمدة 10 دقيقة. إزالة طاف ويغسل مرتين مع برنامج تلفزيوني.
- حصاد الخلايا الملتصقة (وحيدات)، إضافة 1 مل من برنامج تلفزيوني مع 3 مم EDTA إلى كل بئر واحتضان لمدة 10 دقيقة عند 37 درجة مئوية مع 5٪ CO 2. غسل بلطف خلايا قبالة اللوحة من قبل pipetting وجمع الخلايا في الأنبوب.
- يغسل مرة واحدة في FACS العازلة (2٪ مصل العجل الجنين إلى PBS)، ومن ثم إعادة تعليق في FACS العازلة للتحليل FACS.
- لتحليل FACS، أولا ضبط المعلمات تعويض قياس التدفق الخلوي ووضع بوابات الإيجابية باستخدام أنابيب تعويضات احد الملونة، بما في ذلك غبيرات مع أي لون: عن dsRed + غبيرات، AF633 + غبيرات، وCalcofluor الأبيض + غبيرات (ولدت كما هو الحال في 4.2).
- تعيين بوابة غبيرات مجانية على أساس الأمام والجانب مبعثر تستخدم غبيرات مع أي لون. تعيين بوابة خلية في الأمام والجانب مبعثر باستبعاد بوابة غبيرات الحرة.
- تحليل عينة أنبوب عن طريق تسجيل 10000 الأحداث.
ملاحظة: الخلايا المرتبطة غبيرات الحية سيتم عن dsRed + وAF633 +. والخلايا المرتبطة غبيرات الميت يكون AF633 + فقط. خلايا المارة التي لم تشارك غبيرات سيكون dsRed- وAF633-. ويتم تحليل السكان الخلية العاملة غبيرات كذلك إلى تلطيخ Calcofluor الأبيض على قناة باسيفيك بلو. سوف غبيرات التي لا تزال خارج الخلايا ستكون Calcofluor الأبيض +، وغبيرات التي تم المنضوية يكونCalcofluor وايت.
5. الخلية الحية فيديو المجهر
ملاحظة: سيتم اختيار المجهر تعتمد على ما هو متوفر محليا، إلا أن الإعداد المجهر تحتاج لتشمل مرحلة مقلوب، الغرفة البيئية تسخينها إلى 37 درجة مئوية والمرشحات الإثارة / الانبعاثات المناسبة لعن dsRed (532/561 نانومتر) وAF633 (633 نانومتر). غبيرات مضيئة لا تعمل مع ليزر 488 نانومتر بدلا من الليزر 532/561 نانومتر لعن dsRed. عند تنفيذ هذه التجربة لهذا مرة الأولى، استخدم غبيرات السيطرة مع أي لون ولون واحد لاختبار مضان الخلفية وينزف من خلال بين عن dsRed وقنوات AF633.
- تشغيل سخان المجهر قبل التجربة وإتاحة الوقت الكافي لغرفة التحكم البيئية لتسخين إلى 37 ° C. الوقت الذي يستغرقه لدرجة حرارة الغرفة لتحقيق الاستقرار سوف تختلف عن الاجهزة المجهر مختلفة.
- بدوره على المجهر والكمبيوتر، والصغرىالإعلان على برامج التصوير. تركيب صحن التصوير على المسرح المجهر وضبط التركيز للعثور على العدلات الإنسان أو وحيدات.
- لعن dsRed وAF633، تعيين قوة الليزر إلى 10٪، والتعرض لفترة إلى 1 الصورة في إعدادات الاستحواذ.
- إزالة الشريحة التصوير وإضافة 100 ميكرولتر من 3 × 10 6 / مل FLARE تعليق بوغي إلى الآبار المناسبة (إجمالي حجم 300 ميكرولتر / جيد). تسجيل الوقت الذي الاشتعال تضاف غبيرات إلى الطبق.
- العودة الشريحة إلى المسرح وضبط حساسية الكاميرا للعن dsRed وAF633 أن نرى بوضوح غبيرات ولكن ليس مفرط، الصورة. إعداد قائمة نقاط المرحلة إذا كان المطلوب اكتساب متعددة نقطة.
- بدء التصوير عند كافة نقاط في التركيز، هي الأمثل القنوات ويتم تعيين الوقت دورة ومدتها. دورة الزمن ومدة التصوير تعتمد على السؤال التجريبية. والهدف هو الحفاظ على دورة الزمن قصيرة قدر الإمكان (≤2 دقيقة) مع 1 دقيقة السماح لفي تحليل معمق لUPTديناميات أك.
النتائج
وتظهر نتائج ممثل التالية بروتوكول صفها. ويوضح الشكل 1 6 ساعات فيديو الخلية الحية تمثيلي مع العدلات الإنسان وغبيرات FLARE. وأعرب عن dsRed (الأحمر) من قبل غبيرات أنفسهم في حين أنها قد وصفوا مع AF633 (أرجواني).
الرقم 2 هو صورة من نقطة زمنية واحدة من فيلم مماثل كما هو معروض في الشكل 1، مما يدل على الفرق بين الحية والميتة غبيرات FLARE. وتتميز غبيرات الميت من الحي غبيرات من هزيمته في عن dsRed (الأحمر) إشارة مع الحفاظ على مضان AF633 مشرق (قرمزي). ألف غبيرات فوميجاتوس في كثير من الأحيان البقاء على قيد الحياة داخل البالعات لأكثر من 6 ساعات. لذلك، لتحديد فعالية القتل والتدفق الخلوي وترد المؤامرات لفترة الحضانة 16 ساعة في الشكل (3). تم الحصول على هذه البيانات مع م بلعم السنخيةخط ليرة لبنانية على سبيل المثال ولكن لا يمكن أن يؤديها مع أي نوع من الخلايا. في الشكل 4 يظهر الهجرة في الساعة الأولى من التحفيز للالعدلات الإنسان، فضلا عن سرعة وحركة الاتجاه. ويبين الشكل 5 نسبة العدلات وحيدات التي تناولها 1، 2، 3 أو أكثر من غبيرات بينما يعرض الشكل 6 عدد غبيرات التي تنبت في خيوط.

الشكل 1: تعيش خلية فيلم المجهر العدلات الإنسان وغبيرات FLARE. تم عزل العدلات من الدم البشري والمصنف جنبا إلى جنب مع غبيرات FLARE في CO 2 متوسطة مستقل في نسبة 1: 3، على التوالي. وقد بدأ التصوير مباشرة عند 37 درجة مئوية مع المجهر الغزل القرص مبائر. تم التقاط الصور في فترات 1 دقيقة و 55 ق على مدى فترة من 6 ساعات. شريط مقياس = 10 ميكرومتر.A التكبير فيديو يظهر مع القنوات فصلها لتوضيح دور غبيرات FLARE مع مدينة دبي للإنترنت في الجانب الأيسر العلوي، عن dsRed (الحمراء) في أعلى اليمين، AF633 (الأخضر) في الجزء السفلي الأيسر والفيديو المدمجة في أسفل اليمين . يرجى الضغط هنا لتحميل هذا الفيديو.

الشكل 2: مرة واحدة صورة نقطة مما يدل على الفرق بين الحية والميتة غبيرات FLARE. وقد حفز العدلات الإنسان مع غبيرات FLARE وتصوير مع المجهر الغزل القرص مبائر. أخذت صورة من الأفلام التي تم إنشاؤها. وتتميز غبيرات الميتة من خيوط من قبل بعد أن فقدوا عن dsRed (الحمراء: أعلى اليمين) مع الحفاظ على إشارة مضان AF633 على (الأخضر: أسفل اليسار). الرجاء النقر هنا ل عرض نسخة أكبر من هذا الرقم.

الشكل (3): الكمي والتحقق من البلعمة وقتل غبيرات A. فوميجاتوس. وحضنت الماوس خلايا البلاعم السنخية (MH-S) مع غبيرات FLARE في نسبة 1: 1 لمدة 16 ساعة في وجود voriconazole. وتظهر الخلايا MH-S المرتبطة غبيرات الحية في البوابة الحمراء (عن dsRed + AF633 +). وتظهر الخلايا MH-S المرتبطة غبيرات القتلى في البوابة الزرقاء (عن dsRed-AF633 +). وتظهر الخلايا المارة MH-S في البوابة الذهبية. Calcofluor الأبيض، صبغة خلايا كتيمة الفلورسنت التي تربط لجدار الخلية الفطرية، ويستخدم لتمييز غبيرات خارج الخلية (Calcofluor الأبيض +) من غبيرات داخل الخلايا (Calcofluor وايت). باعتبارها التحقق من صحة إضافية إلى أسلوب، فإنه يظهر أن العلاج مع 2 ميكرومتر مثبط حركة الخلايا D يحول دون امتصاص بوغي من قبل خلايا MH-S.e.jove.com/files/ftp_upload/55444/55444fig3large.jpg">Please انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
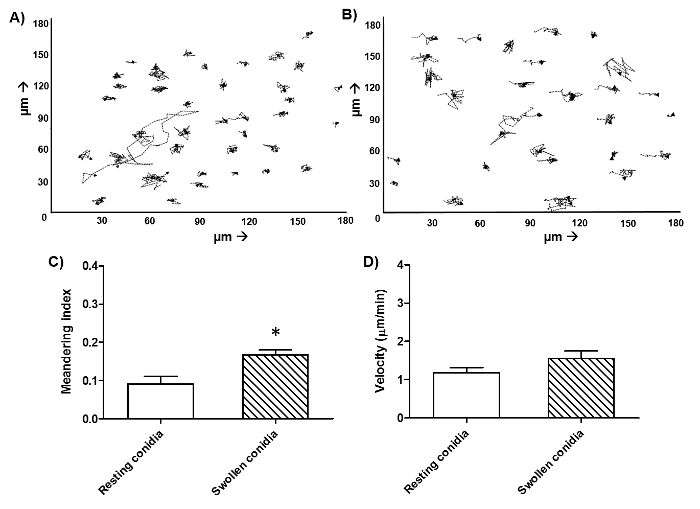
الشكل 4: هجرة العدلات الإنسان وحيدات ضد غبيرات A. فوميجاتوس. تم عزل العدلات من الدم البشري والمصنف جنبا إلى جنب مع غبيرات FLARE في CO 2 متوسطة مستقل في نسبة 1: 3، على التوالي. وقد بدأ التصوير مباشرة عند 37 درجة مئوية مع المجهر الغزل القرص مبائر. تم التقاط الصور في فترات 1 دقيقة و 55 ق على مدى فترة من 6 ساعات. الهجرة من جميع العدلات الإنسان الفردية لكل حقل تم يدويا تتبعها باستخدام برنامج تتبع ضد يستريح (A) وتورم (B) غبيرات لمدة 1 ساعة. تمثل البيانات 1 إطار خلايا لكل حالة من نفس الجهات المانحة. عامل التعرجات (C)، وهو مقياس لdirectioوكانت حركة نال، وسرعة (D) ثم كميا باستخدام نفس البرنامج. يعني ± SEM ليتم عرض 3 المانحين مع 30 خلية في المانحة أكثر من 2 تجارب مستقلة. *: p <0.05 (ولش تصحيح ر اختبار). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
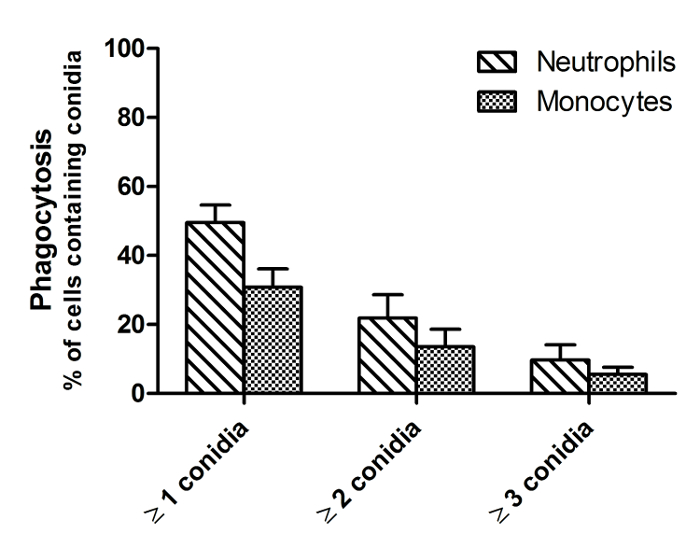
الشكل 5: البلعمة من غبيرات A. فوميجاتوس قبل العدلات الإنسان وحيدات. تم عزل العدلات وحيدات من الدم البشري والمصنف جنبا إلى جنب مع غبيرات FLARE في CO 2 متوسطة مستقل في نسبة 1: 3، على التوالي. وقد بدأ التصوير مباشرة عند 37 درجة مئوية مع المجهر الغزل القرص مبائر. تم التقاط الصور في فترات 1 دقيقة و 55 ق على مدى فترة من 6 ساعات. وقد تم قياس البلعمة كما كمية من الخلايا تحتوي علىجي FLARE غبيرات بعد 4 ساعات من التحفيز. يتم تقديم البيانات كما يعني ± SEM من 3 المانحين و 3 لقطة في المانحة أكثر من 2 تجارب مستقلة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
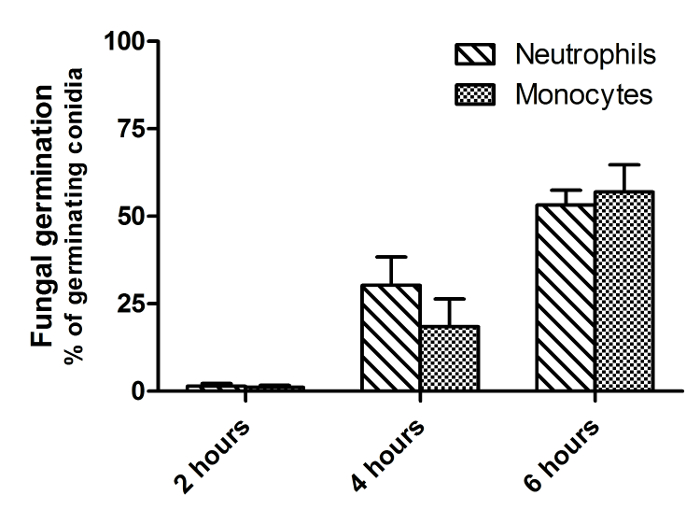
الشكل 6: تثبيط إنبات A. غبيرات فوميجاتوس قبل العدلات وحيدات. تم عزل العدلات وحيدات من الدم البشري والمصنف جنبا إلى جنب مع غبيرات FLARE في CO 2 متوسطة مستقل في نسبة 1: 3، على التوالي. وقد بدأ التصوير مباشرة عند 37 درجة مئوية مع المجهر الغزل القرص مبائر. تم التقاط الصور في فترات 1 دقيقة و 55 ق على مدى فترة من 6 ساعات. تم فحص تثبيط إنبات الفطرية عن طريق قياس نسبة غبيرات التي كان الجرثوميةinated بعد 2 و 4 و 6 ساعات من الثقافة المشتركة. يتم تقديم البيانات كما يعني ± SEM من 3 المانحين و 3 لقطة في المانحة أكثر من 2 تجارب مستقلة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Discussion
يصف هذا الأسلوب مبتكر في طريقة المختبر لدراسة نشاط مضاد للالبالعات الإنسان الأساسية ضد A. فوميجاتوس باستخدام الفلورسنت الرشاشيات مراسل (FLARE) غبيرات، تصوير الخلايا الحية والتدفق الخلوي. وقد أظهرت الدراسات السابقة أن القيمة المضافة لاستخدام FLARE غبيرات سواء في الجسم الحي في عدوى فطرية التجريبية الفئران وفي تقييم المختبر من مضاد الحصانة 6 و 7. الجمع بين FLARE غبيرات مع هذا الجيل القادم الحية تقنية التصوير الخلية يسمح الإعداد لقياس جدوى غبيرات الفردي خلال التفاعلات الحيوية في المختبر.
الطريقة الموصوفة لديه القدرة على تحقيق أدوار وأهمية خاصة لبعض العمليات الخلوية للخلايا المناعية على ردودهم المضادة للفطريات. وبالإضافة إلى ذلك، والاستجابات المضادة للفطريات البالعات من المرضى الذين يعانون من معينتعرف عيوب عنصر واحد في نظام المناعة لديهم ويمكن تقييم بمزيد من التفصيل. جدا الردود المضادة للفطريات المبكرة والأولية يمكن دراستها بتفصيل كبير خلال 6 ساعات من التصوير المستمر. وهذا يسمح حتى لالفروق الدقيقة ليتم الكشف عن مثل سرعة الهجرة بلعمية نحو الفطر، ومعدلات الاستيعاب، وديناميات الأحداث فطريات 12، والتي ستكون التمييز بينهن باستخدام أساليب البلعمة التقليدية.
أي نوع من الخلايا يمكن استخدامها مع هذا الأسلوب. تم اختيار أنواع الخلايا المستخدمة هنا لأن هذه البالعات تشكل الأسطر الأولى والثانية للدفاع في الشعب الهوائية الإنسان ضد A. فوميجاتوس 13. ومن المثير للاهتمام، والاختلافات واضحة جدا ويمكن ملاحظة بين كيف حيدات والعدلات الانخراط مع الراحة وغبيرات تورم وخيوط. حيدات بالكاد الهجرة إلى غبيرات، بينما تعرض العدلات النشاط أكثر المهاجرة من ذلك بكثير. مارس الفلورسنت إضافيةاستعادة الطاقة الحركية مثل علامات حية القتلى على الخلايا المناعية يمكن أن تدرج في مقايسة لتوفير نظرة ثاقبة بقاء بلعمية التالية التفاعل مع الرشاشيات. وتشمل مثيرة للاهتمام التطبيقات المحتملة لهذه التكنولوجيا مستقبل الثقافة المشتركة لمختلف أنواع الخلايا المضيفة، والعواقب التي تترتب على الاستجابات المضادة للفطريات (على سبيل المثال، الضامة على أحادي الطبقة الظهارية، الوحيدات المستمدة الخلايا الجذعية جنبا إلى جنب مع العدلات)، وقياس الوقت الحقيقي من رد الفعل إنتاج أنواع الاكسجين أو العدلة خارج الخلية تشكيل فخ التالية التحفيز مع الرشاشيات.
تحتاج إلى الإشارة إلى بعض النقاط لاستخدام هذا البروتوكول، قبل كل شيء إعداد مختبر المطلوبة: المجهر مع مرحلة مقلوب، الغرفة البيئية مستقرة عند 37 درجة مئوية، والإثارة / مرشحات الانبعاثات لعن dsRed (532/561 نانومتر) وAF633 ( 633 نانومتر). قدرة المجهر للحفاظ على الخلايا في التركيز والاحتفاظ الغمر النفط (ذات أهمية خاصة خلال مأولتي نقطة اكتساب) يجب مراقبة بشكل دوري نظرا لطول مدة التصوير. لتقدير حجم النشاط فطريات التدفق الخلوي مطلوبة المرافق. بالإضافة إلى ذلك، تحتاج الموافقات المؤسسية والأخلاقية المناسبة لتكون في مكان العمل مع الجهات المانحة الصحي والمريض المستمدة عينات الدم والفطريات التلاعب بها وراثيا. فمن المستحسن استخدام عينات من الدم الطازج (استخدام في نفس اليوم) لزيادة قابلية الخلية والحفاظ على وظيفة. من الناحية المثالية، يتم تنفيذ عزل الخلايا مباشرة بعد وضع عينات الدم ويتم تصوير العدلات مباشرة بعد العزلة.
وفي الختام، جيل القادم الخلية الحية تقنية التصوير لتقييم في عظيم نشاط مضاد التفاصيل بلعمية ضد يوصف A. فوميجاتوس. هذه التكنولوجيا يمكن أن توفر نظرة فريدة في تفاعلات الخلايا الفطرية الفردية في أوائل الدفاعات المناعية الفطرية ضد الرشاشيات.
Disclosures
الكتاب ليس لديهم ما يكشف.
Acknowledgements
وقد تم دعم هذا العمل من قبل MRC وجامعة أبردين (مركز MRC للعلم الفطريات الطبية) وجائزة الاستراتيجية يلكوم ترست - الطبية الفطريات الفطرية المناعة (SFB، جمب، JK، AW). شكر خاص وتعطى لك الدعم من صندوق كلو. ويدعم TMH من خلال منحة من المعهد الوطني للصحة (NIH، رمز RO1 093808) ومركز ميموريال سلون كيترينج للسرطان بدعم من المعاهد الوطنية للصحة منح P30 CA008748. بالإضافة إلى ذلك، TMH هو محقق في التسبب في الأمراض المعدية التي يدعمها صندوق ويلكوم بوروز. ونود أن نشكر المجهر أبردين ومرفق الأنسجة لما قدموه من مساعدة والدعم.
Materials
| Name | Company | Catalog Number | Comments |
| Glycerol | Sigma | G6279 | http://www.sigmaaldrich.com |
| T75 flask | Greiner Bio-One | 658 175 | http://www.greinerbioone.com/ |
| PBS | Gibco | 20012-019 | https://www.thermofisher.com/ |
| Tween-80 | Fisher Scientific | 10592955 | https://nl.fishersci.com/ |
| 40 µm filter | Thermo Fisher Scientific | 22363547 | https://www.thermofisher.com/ |
| 15 mL Falcon tube | Greiner Bio-One | 188 261 | http://www.greinerbioone.com/ |
| 50 mL Falcon tube | Greiner Bio-One | 227 261 | http://www.greinerbioone.com/ |
| MilliQ | Millipore | QGARD00R1 | Nanopure water works similarly. http://www.merckmillipore.com/ |
| Biotin | Molecular Probes | B-6352 | https://www.thermofisher.com/uk/en/home/brands/molecular-probes.html |
| DMSO | Sigma | D5879 | http://www.sigmaaldrich.com |
| Streptavidin-AF633 | Molecular Probes | S-21375 | AF633 is the only tested fluorophore so far that remains visible in phagosomes. https://www.thermofisher.com/uk/en/home/brands/molecular-probes.html |
| EDTA blood tubes | Greiner Bio-One | 455036 | Any blood tubes with an anti-coagulating agent should work. http://www.greinerbioone.com/en/start/ |
| Ficoll-Paque Plus | GE Healthcare | 17-1440-03 | http://www3.gehealthcare.com/ |
| Trypan blue | Thermo Fisher Scientific | SV3008401 | https://www.thermofisher.com/ |
| HBSS | Gibco | 14170112 | https://www.thermofisher.com/uk/en/home/brands/gibco.html |
| CD14 microbeads | Myltenyi Biotec | 130-050-201 | Other monocyte isolation methods can be used as well, we prefer this method as it gives a consistent high purity of monocytes without being labor intensive. http://www.miltenyibiotec.com/en/ |
| MS Columns | Myltenyi Biotec | 130-042-201 | See comment at CD14 microbeads. http://www.miltenyibiotec.com/en/ |
| RPMI + Glutamax | Gibco | 72400-021 | https://www.thermofisher.com/uk/en/home/brands/gibco.html |
| CO2 independent medium | Thermo Fisher Scientific | 18045054 | Necessary if there is not sufficient CO2 exchange during imaging. https://www.thermofisher.com/uk/en/home |
| µ-slide 8 well glass bottom | Ibidi | 80827 | This is the imaging dish that we use, however any glass imaging dish of proper size should work. http://ibidi.com/ |
| UltraVIEW VoX 3D Live Cell Imaging System | Perkin Elmer | L7267000 | Includes volocity software for acquisition and analysis. http://www.perkinelmer.com/ |
| Calcofluor white | Sigma | 18909 | http://www.sigmaaldrich.com/ |
| Voriconazole | Sigma | PZ0005 | http://www.sigmaaldrich.com/ |
| BD LSRII | BD Biosciences | Flowcytometer used. https://www.bdbiosciences.com/ |
References
- Kosmidis, C., Denning, D. W. The clinical spectrum of pulmonary aspergillosis. Thorax. 70 (3), 270-277 (2015).
- Warris, A. The biology of pulmonary Aspergillus infections. J Infect. 69 (Suppl 1), S36-S41 (2014).
- Henriet, S. S., et al. Human leukocytes kill Aspergillus nidulans by reactive oxygen species-independent mechanisms. Infect Immun. 79 (2), 767-773 (2010).
- Sheppard, D. C., et al. Comparison of three methodologies for the determination of pulmonary fungal burden in experimental murine aspergillosis. Clin Microbiol Infect. 12 (4), 376-380 (2006).
- Lewis, L. E., Bain, J. M., Okai, B., Gow, N. A. R., Erwig, L. P. Live-cell video microscopy of fungal pathogen phagocytosis. J Vis Exp. (71), e50196(2013).
- Heung, L. J., Jhingran, A., Hohl, T. M. Deploying FLAREs to Visualize Functional Outcomes of Host-Pathogen Encounters. PLoS Pathog. 11 (7), e1004912(2015).
- Jhingran, A., et al. Tracing conidial fate and measuring host cell antifungal activity using a reporter of microbial viability in the lung. Cell Rep. 2 (6), 1762-1773 (2012).
- Espinosa, V., et al. Inflammatory monocytes orchestrate innate antifungal immunity in the lung. PLoS Pathog. 10 (2), e1003940(2014).
- English, D., Andersen, B. R. Single step separation of red blood cells, granulocytes and mononuclear leukocytes on discontinuous density gradient of ficoll hypaque. J Immunol Met. 5 (3), 249-252 (1974).
- Shimizu, K., Keller, N. P. Genetic involvement of a cAMP-dependent protein kinase in a G protein signaling pathway regulating morphological and chemical transitions in Aspergillus nidulans. Genetics. 157 (2), 591-600 (2001).
- Ohradanova-Repic, A., Machacek, C., Fischer, M. B., Stockinger, H. Differentiation of human monocytes and derived subsets of macrophages and dendritic cells by the HLDA10 monoclonal antibody panel. Clin Transl Immunology. 5 (1), e55(2016).
- Lewis, L. E., et al. Stage specific assessment of Candida albicans phagocytosis by macrophages identifies cell wall composition and morphogenesis as key determinants. PLoS Pathog. 8 (3), e1002578(2012).
- Schaffner, A., Douglas, H., Braude, A. Selective protection against conidia by mononuclear and against mycelia by polymorphonuclear phagocytes in resistance to Aspergillus. Observations on these two lines of defense in vivo and in vitro with human and mouse phagocytes. J Clin Invest. 69 (3), 617-631 (1982).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved