Method Article
비 투명 공사장 공중 발판에 이미징 세포 생존 - 소설 니트 티타늄 임플란트의 예를 사용하여
요약
여기에서는 불투명 티타늄 지지체에 세포 생존을 검출뿐만 아니라, 골격 불순물 일별을 검출하는 형광 기반 이미징 기술을 제시한다. 이 프로토콜은 비 투명 지지체에 세포 세포 또는 세포 상호 작용 금속을 묘화의 결점이 문제를 해결합니다.
초록
Intervertebral disc degeneration and disc herniation is one of the major causes of lower back pain. Depletion of extracellular matrix, culminating in nucleus pulposus (NP) extrusion leads to intervertebral disc destruction. Currently available surgical treatments reduce the pain but do not restore the mechanical functionality of the spine. In order to preserve mechanical features of the spine, total disc or nucleus replacement thus became a wide interest. However, this arthroplasty era is still in an immature state, since none of the existing products have been clinically evaluated.
This study intends to test the biocompatibility of a novel nucleus implant made of knitted titanium wires. Despite all mechanical advantages, the material has its limits for conventional optical analysis as the resulting implant is non-transparent. Here we present a strategy that describes in vitro visualization, tracking and viability testing of osteochondro-progenitor cells on the scaffold. This protocol can be used to visualize the efficiency of the cleaning protocol as well as to investigate the biocompatibility of these and other non-transparent scaffolds. Furthermore, this protocol can be used to show adherence pattern of cells as well as cell viability and proliferation rates on/in the scaffold. This in vitro biocompatibility testing assay provides a propitious tool to analyze cell-material interaction in non-transparent and opaque scaffolds.
서문
만성 허리 통증은 다 인성 질환이다. 퇴행성 디스크 질환의 최소 침습적 치료 방법에 대한 관심은 1950 년대 이후 성장했다. 오늘날, 척추의 분절 다중 융합은 가장 널리 사용되는 치료는 상태가 될 때까지. 이후,이 방법은 종종 영향을받는 세그먼트 1, 2의 이동성의 한계에 이르게의 전 치환술 시대의 탐사는 넓은 관심이되었다. 전체 디스크 교체 및 핵 교체에 상당한 발전 만성 허리 통증 1을 치료하는 좋은 대안이되고있다. 거대한 진전에도 불구하고, 방법 중 어느 것도 임상 적으로 평가되지 않았다. 덜 엄격한 핵 이식은 전체 디스크 교체에 유망한 대안을 나타내는 섬유륜이 3,4 그대로 것이어야한다. 그러나, 시장에 현재 존재하는 핵 이식은 종종 추체, 전위, 디스크 및 t의 수직 높이 손실의 변화와 같은 합병증과 연관된필요한 관련 기계 강성 5 그는 부족. 현재의 문제점을 해결하기 위하여, 티탄 니트 와이어로 이루어지는 신규 한 핵 이식이 성공적 6 개발되었다. 때문에 독특한 니트 구조로, 새로 개발 된 인공 지지체는 예를 들어, 고유 생체 역학적 특성, 감쇠 기능, 기공 크기, 적재 능력 및 신뢰성 (7)을 보여 주었다. 이 새로운 핵 임플란트의 생체 적합성 시험을 목표 임플란트의 불투명 특성 기인 (광) 분석 기술에 심각한 제한을 도시.
생체 적합성을 테스트하기 위하여, 세포 - 금속의 상호 작용이 중요한 역할을한다 8-10. 세포와 지지체 사이의 상호 작용은 호스트 시스템 내에 더 주입 통합 안정화 때문에 필요하다. 그러나, 점점 증식 깊이는 지지체의 기계적 성질을 변경할 수있다. inves의 목표발판 표면은 세포 부착, 증식 및 분화 또는를위한 기반을 제공하는지 여부 tigate 금속은 세포 생존에 영향을 미치는 여부가 불투명 불투명 지지체에 /에서 세포 이미징의 공통 잘 알려진 문제를 해결하는 것이 중요하다. 이 제한 여러 형광을 극복하기 위해 기반 기술을 탐구 하였다. 기업은 살아있는 세포, 세포 구획, 또는 특정 세포 상태 (11)를 시각화 형광체의 넓은 범위를 제공한다. 이 실험 형광체 가장 우리 형광 현미경을 맞추기 위해 온라인 툴 스펙트럼 시청자의 도움으로 선택되었다.
온 세포의 추적을 허용하는 osteochondro-전구 세포는 1) 형광체 (녹색 형광 단백질 / GFP) 표지 : 불투명 니트 티타늄 지지체의 /에 부착 세포 거동의 분석을 위해 개발 된 전략들은 다음을 포함 지지체, 2) 측정 가능성 (미토chondrial 활동) 세포, 3) 시각화 세포 - 세포와 지지체에서 세포 물질의 상호 작용. 절차는 쉽게 다른 부착 세포 및 기타 비 투명 또는 불투명 지지체에 전사 될 수 있다는 장점을 갖는다. 또한, 생존 및 증식 패턴은 며칠에 걸쳐 모니터링 할 수있다 따라서, 이것은 지지체 재료 또는 세포의 제한된 양으로 사용될 수있다.
본 연구는 세포 생존율을 측정 불투명 니트 티타늄 지지체의 ON / osteochondro-전구 세포의 성장 패턴을 시각화 현재 프로토콜의 성공적 사용을 설명한다. 또한, 개발 된 프로토콜 골격 불순물을 결정하고 세척 프로토콜을 확인하기 위해 사용될 수있다.
프로토콜
주 : 불멸화 된 인간 간엽 기질 전구체 세포 (SCP-1 세포)를 실험에 사용 하였다. SCP-1 세포 교수 마티아스 Schieker (12)에 의해 제공되었다.
SCP-1 세포의 1. 확장
- 전에 SCP-1 세포와 협력에 제대로 70 % 에탄올 (v / v)로 입고 장갑 작업 영역 (지정 바이오 안전성 캐비닛 I)를 청소합니다.
- 세정 바이오 캐비닛의 표 1에 나타낸 바와 같이 필요한 성분을 혼합하여 세포 배양 배지의 적당한 양을 준비한다. 기본 배지의 무균 상태를 유지하기 위해서, 0.22 ㎛의 공극 크기에 살균 필터를 통과함으로써 보충을 추가한다.
- , 오염을 방지 사용하기 전에 매체 적어도 24 시간을 준비합니다. 37 ° C, 5 % CO 2, 20 % O 2와 90 % 습도의 멸균을 테스트하기 위해, 표준 세포 배양 인큐베이터에서 세포없이 세포 배양 접시에 1 ml의 배지를 배양한다. 후24 시간은, 매체 현미경으로 적어도 200 배의 배율을 사용하여 확인합니다.
- 37 ° C, 5 % CO 2, 20 % O 2와 90 %의 습도 조건 지원하는 표준 세포 배양 인큐베이터에서 SCP-1 세포를 유지한다.
- 그들은 80~90%의 포화 상태에 도달 할 때까지 유지 보수 및 확장의 경우, SCP-1 세포를 성장. 이 기간 문화 동안, 2-3 일마다 중간 변경합니다. (표시됨) 실험에 대한 확장 또는 플레이트에 대해 다음 통로 (2 비율로 일반적으로 1) 80-90%의 포화 상태에 도달하면, SCP-1 세포를 분리.
- SCP-1 세포 분리를 들어, 37 ° C에서 배양 배지를 따뜻하게하고, 37 ℃에서 수조를 사용하여 트립신 / EDTA를 해동.
- 완전히 80-90% 합류 세포 배양 배지를 대기음 및 폐기물 용기에 폐기.
- (둘 베코 인산염, 마그네슘, 칼슘없이 pH를 7.2 완충 식염수) DPBS 적어도 두 번 세포를 씻어.
- 적절한 부피 피펫세포 상에 DPBS (A T75 문화 플라스크 5 ML의 DPBS와 T175 문화 플라스크 12 ㎖).
- 대기음 DPBS 신중하고 폐기물 용기에 폐기.
- 세포 상에 0.25 % 트립신 / EDTA의 적당한 양의 (a T175 문화 플라스크에 대한 T75 문화 플라스크 1 ML의 DPBS 2 ㎖) 피펫 및 5와 표준 세포 배양 인큐베이터에서 37 ° C에서 5 ~ 10 분 동안 품어 %의 CO 2, 20 % O 2, 습도 90 %.
- 선박을 눌러 셀을 제거하고 모든 세포를 현미경으로 부동 세포를 관찰하여 문화 플라스틱 (트립신)에서 분리되어 있는지 확인.
- 배양액 10 ㎖를 첨가함으로써 트립신의 반응을 비활성화한다. 반복 피펫으로 조심스럽게 매체와 트립신과 세포를 섞는다.
- 실온에서 10 분 동안 600 XG에서 반응 관 원심 분리로 세포 현탁액을 전송.
- 뜨는을 대기음, 10 ml의 문화에있는 세포 펠렛을 resuspend매질.
- 이 프로토콜에 기재된 바와 같이 트립 판 블루 배제 법에 의해 세포 수를 계산.
- 실험 디자인에 따라 세포를 시드.
SCP-1 세포의 2. 계수
- 혈구를 이용하여 재현 탁시키고 세포의 생균 수 (트립 판 블루 제외 방법)을 수행한다.
- 셀 수에 앞서 수돗물을 이용하여 혈구를 청소. 보풀이없는 조직을 사용하여 혈구 성분을 건조시킵니다. 커버 유리를 가습하고, 계산 영역의 양쪽에있는 두 유리 주자에 역으로 가압하여 조립한다. 뉴턴 링 유리 주자 (그림 1)에서 볼 수 있는지 확인합니다.
- 재현 탁 된 세포의 10 μl를 취하여 2의 희석 인자를 얻기 위해 0.1 % 트리 판 블루 용액 10 μL와 혼합한다.
- 로드 미리 청소하고 조립 혈구 실의 총 샘플의 10 μl를.
- 라이브 (화이트 / 투명 세포)과 죽은 사람의 수를 계산(블루 핵) 4 × 4 정사각형에서 세포 (도 1b 참조).
- 주어진 다음 식 세포의 총 수를 계산한다 :
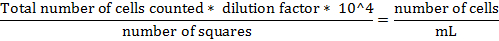
SCP-1 세포의 3 GFP 형질
참고 :에 우리가 녹색 형광 단백질 (GFP)와 세포를 표시 특정 배양 기간 동안 니트 티타늄 발판으로 SCP-1 세포의 성장을 관찰하기 위해. GFP 과발현 GFP를 코딩하는 아데노 바이러스 입자로 감염에 의해 달성된다. 녹색 형광 단백질 (GFP)을 코딩 복제 무능 (-E1 / -E3) 아데노 바이러스 입자는 SCP-1 세포를 감염하는 데 사용되었다. 바이러스 입자는 재조합 아데노 바이러스 (의 Ad5-GFP) 형질 HEK293T 세포 (바이오 실험 II)의 배양 상청액을 수집하여 교수 스티븐 둘리 (13)로부터 수득 하였다. 세 반복 동결 (-80 ° C) 및 해동 (수조에서 37 ° C)는 사이클이없는 HE 것이 보장K293T 세포는 새로운 바이러스 입자를 제조하기 위해 생존 유지. 효율적으로 새로운 바이러스 입자를 제조하지 않고 SCP-1 세포를 감염시킬 수이 아데노 바이러스 종자 재고를 사용. 따라서, 감염된 세포는 바이오 랩 I. 처리 될 수있다
- 배양 배지에서 50,000 세포 / ml의 접종 밀도로 표적 세포 (SCP-1 세포)를 재현 탁. 6 웰 조직 배양 플레이트에 웰 당 2 ml의 피펫.
- 표준 세포 배양 인큐베이터에서 37 ° C에서 품어; SCP-1 세포까지 5 % CO 2, 20 % O 2와 90 %의 습도는 70-80 %의 컨 플루 언시에 도달한다.
주 : 포화 상태가 세포의 파종 밀도에 의존한다. 위에서 언급 한 조건, SCP-1 세포는 1.5 일 70-80%의 포화 상태에 도달한다. - 배양 배지는 배지 1 ㎖ 당 아데노 바이러스 스톡 시드 100 ㎕를 추가하지 않고 흡입 면적의 70 ~ 80 % 정도 자랄에서.
- 개별적 바이러스 자체의 바이러스 입자의 양에 따라 농도 범위를 결정할에드 재고 준비. 감염 효율이 너무 낮은 경우에는, 정제 및 다양한 시판되는 키트를 사용하여 바이러스 입자를 농축시킨다.
- 37 ° C (5 % CO 2, 20 % O 2, 습도 90 %)에서 표준 세포 배양 인큐베이터에서 한시간 동안 배양.
- 바이러스 스톡 시드를 함유하는 배양 배지를 제거하고 폐기를 수집한다. 보충 할 수있는 6 웰 배양 플레이트의 웰 당 신선한 배지 2 ML을 추가합니다.
- 처분 이전에, 매체를 포함하는 바이러스 입자는 멸균되어 있는지 확인합니다.
- 세포 내 GFP 식 (감염 효율)는 GFP LED 큐브 / 필터 세트와 형광 현미경을 사용하여 감염 후 24 시간을 평가합니다.
- 세포 형태 (도 2)를 관찰한다. 배양 플라스틱으로 분리 세포는 거짓 긍정적 인 결과를 제공 할 수 있습니다.
니트 티타늄 비계의 4. 청소
- 피50 ㎖의 반응 관에 5 지지체에 레이스.
- 로터 조건 (8 XG)를 사용하여 실온에서 20 분 동안 30 ml의 증류수 - 탈 이온수로 발판 (6-7mm 두께)을 세 번 세척 하였다.
- 30 ml의 1 %로 증류 - 탈 이온수를 치환 트리톤 X-100 용액 (/ V W) (증류 - 탈 이온수에 용해)하고 로터 조건을 이용하여 실온에서 20 분 동안 한번 비계 세척 (8 XG) .
- 두번 증류-증류수 30 ㎖로 세척 한 다음 트리톤 X-100 용액 (실온에서 5 분마다)로 유지 로터 조건 (8 XG)을 버린다.
- 증류수 - 탈 이온수를 교체합니다. 초음파 욕에 시약 등급의 99 % 아세톤, 99 % 이소프로판올, 2 × 5 분 동안 99 % 에탄올 (30 ㎖ 각각) 각각 골격 순차적 린스 (~ 50 ㎐, 50 W, 220-240 V).
- 초음파 목욕 처리 일정하게 유지, 5 분 동안 30 ml의 증류수 - 탈 이온수로 다시 세 번 씻으십시오.
- scaffo 배치순서 보풀이없는 조직에 LDS는 실온에서 건조 하룻밤을 방송합니다.
- 15 PSI와 121 ° C에서 15 분 동안 발판을 압력솥.
- 프로토콜 5에 기재된 간접 형광에 의한 세정 프로토콜을 확인한다.
간접 형광 5. 영상 비계 구조
참고 : 본 프로토콜은 586분의 565 나노 미터의 전 / EM 파장에서 밝은 적색 형광을 제공하는 형광체의 sulforhodamine의 B를 사용하여 간접 형광에 의해 골격 구조의 영상에 대해 설명합니다. 그러나, 형광 주어진 현미경 설정이나 비계의 가능한 자동 형광 더 나은에 맞게 변경할 수 있습니다.
- 빛으로부터 보호하고 실온에서 1 % 아세트산 및 저장소에 sulforhodamine B의 염색 용액 (0.04 %)를 준비한다.
- 24 웰 조직 배양 플레이트를 취하여 그것을 인 배치하여 sulforhodamine B의 염색 용액 500 μL의 세정 지지체 젖어잘 사용하는 집게를 IDE.
- 형광 현미경을 사용하여 비계의 부정적인 이미지를 캡처합니다.
- 40분의 531의 나노 미터의 여기 파장과 40분의 593의 나노의 발광 파장 설정 RFP LED 큐브 / 필터로 사진을 촬영합니다. 또는 형광 스펙트럼 뷰어 (20)의 도움으로 적절한 여기 및 방출 파장을 선택합니다. Sulforhodamine B는 578 nm에서 피크 여기 및 593 nm에서의 피크 방출을 보유하고 있습니다.
- 골격 구조를 시각화하기 위해, 낮은 배율, 예를 들어, 4 배 또는 10 배 (그림 3)에서 사진을 찍을. 이러한 이미지 사용 등의 특성, 기공 크기를 결정하고 ImageJ에의 도움으로 형성.
- 골격 불순물을 검출하기 위해,이 분석 깊이를 제한하는 것을 고려하면, 예를 들면, 더 높은 배율 20 배 또는 40 배를 사진을 촬영. 입자 / 물질이 보이지 않는 그 먼지를 확인 (대표 결과를 참조,도URE 3).
6. 체외 생체 적합성 분석
- 수욕에서 37 ° C에서 배양 배지를 미리 가온.
- 24 잘 조직 배양 접시를 타고 집게를 사용하여, 잘 무균 각 테스트의 세척 및 소독 발판을 놓습니다. 미리 청소 바이오 안전성 캐비닛 I에서 작동!
- 골격의 내부로부터 공기를 제거하기 위해, 약 15 분 (24 웰 조직 배양 플레이트의 웰 당 500 μL)를위한 배양 배지로 지지체를 부화 / 담근다.
- 한편, 배지 1 ㎖에 50 AD-GFP 감염 SCP1 세포를 재현 탁.
- 비계 수적 15 분 후, 발판 떨어져 완전히 매체를 대기음.
- 인공 지지체에 세포를 파종를 들어, 조심스럽게 표면 (24 웰 플레이트에 위치) 비계에 세포 현탁액 100 μl를 분배. 세포를 파종하는 동안, 그래서 매체 (을)를 흐르지 않게하기 위해 세포 현탁액의 최소 볼륨을 유지발판의 유타.
- 표준 세포 배양 인큐베이터 (5 % CO 2, 20 % O 2, 습도 90 %)에서 37 ° C에서 30 분 동안 세포를 인큐베이션.
- 500 ㎕를 더 배지를 추가하고 표준 세포 배양 인큐베이터에서 24 시간 (37 ° C, 5 % CO 2, 20 % O 2, 90 % 습도) 동안 품어.
- 형광 현미경을 사용하여 지지체 상에 확산 세포 접착 패턴과 셀을 평가한다.
- 22분의 470의 나노 미터의 여기 파장과 42분의 510의 나노의 발광 파장 설정 GFP LED 큐브 / 필터로 사진을 촬영합니다. 또는 형광 스펙트럼 뷰어의 도움으로 적절한 여기 및 발광 파장을 선택합니다. GFP는 488 nm에서 피크 여기 및 507 nm에서의 피크 방출을 보유하고 있습니다.
- 낮은 배율, 예를 들어, 4 배 또는 10 배 (그림 4)에서 세포 부착 패턴 캡처 사진을 시각화하기 위해. 높은 등급의 확산 세포를 관찰하기 위해nification는 (적어도 100 배) 필요한 - 포커스 깊이를 제한.
- 상기 지지체 표면에 확산 셀을 평가하기 위해, 4 % 포르말린으로 세포를 수정하고 기존의 세포 구조의 형광 염색, 예를 들어, 액틴 필라멘트 (Phalloidin의)를 진행합니다. 그러나, 각각의 발판 특성, 예를 들면, 확산 시간 또는 자동 형광 (14)을 맞추기 위해 배양 시간 및 형광 표식 항체의 적응.
- 다음날, 비 부착 세포를 제거하기 위해 배지를 변경.
- 프로토콜 7에 설명한 바와 같이 변환 측정 레사 주린하여 지지체에 부착 된 세포의 비율을 계산한다.

그림 5 : 시험 관내 분석의 타임 라인 (A) 세포를 도금 실험 설정.. (B ) 그림, 하루 7까지 시작 프로토콜 및 세포 기능 검증의 중요성을 강조하는 것은 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 레사 주린 전환 측정
주 : 레사 주린 변환 분석법 미토콘드리아 활성을 측정하기 위해 사용되며, 따라서 간접적으로 세포 증식된다. 레조 루핀 (resorufin)으로 레사 주린 감소 생존 세포 수 (도 7A)과 연관된 미토콘드리아 활성을 기초로 형광 신호를 생성한다.
- 완전히 SCP-1 세포에서 문화 매체를 대기음 및 폐기물 용기에 폐기.
- 분리 된 세포를 제거하는 DPBS으로 한 번 SCP-1 세포를 씻으십시오. 골격에 SCP-1 세포를 함유하는 24 웰 조직 배양 플레이트의 웰 당 500 μL의 DPBS를 추가한다.
- 요구시와 세포를 커버멸균 레사 주린 작업 용액 (배지에서 0.25 %의 레사 주린) 및 ount 30 분 동안 표준 세포 배양 인큐베이터 (5 % CO 2, 20 % O 2, 습도 90 %)에서 37 ℃에서 배양한다.
- 그 메모를합니다; 배양 시간은 세포 형태 및 세포 밀도에 따라 달라진다. 그것은 10 분, 6 시간마다 다를 수 있습니다. SCP-1 세포에 대한 최적의 배양 시간은 30 분이다.
- 배경 대조군으로서, 동일 대 (5 % CO 2, 20 % O 2, 습도 90 %)이 표준 세포 배양 인큐베이터에서 37 ° C에서 배양 적어도 하나 잘 레사 주린 작업 용액하지만 세포없이 포함 시간의 양.
- 전송 100 μL를 96 마이크로 웰 플레이트에 24 웰 조직 배양 플레이트의 각 웰로부터 상등액을 조절.
- 잔류 레사 주린 작업 용액을 제거하기 위해 실온에서 5 분간 1 ML의 DPBS로 나머지 세포를 세 번 세척 하였다. 세 번째 세척 한 후 배양액을 추가 tO를 SCP-1 세포와 임플란트 (24 웰 조직 배양 플레이트의 웰 당 500 μL) 표준 세포 배양 인큐베이터 (5 % CO 2, 20 % O 2, 습도 90 %)에서 37 ℃에서 배양을 계속 추가 시간 코스 측정.
- 피펫 오류를 최소화하기 위해이 단계 (2-4)에서 복제를 설정해야합니다.
- 한편, 마이크로 플레이트 리더에 96 마이크로 웰 플레이트를 배치하고, 형성된 레조 루핀 (resorufin)의 형광을 측정한다.
- 배경 신호를 감소시키기 위해, 545 나노 미터의 여기 파장 및 585 나노 미터의 방출 파장에서 형광을 측정한다.
- 또는 형광 스펙트럼 뷰어의 도움으로 적절한 여기 및 발광 파장을 선택합니다. 레조 루핀 (resorufin)는 572 nm에서 피크 여기 및 585 nm에서의 피크 방출을 보유하고 있습니다. 주어진 신호 강도는 25 일 개별 측정 값 (물론 당 25 깜박임)의 평균입니다.
- 불소를 측정조건화 된 배지에서 형성 레조 루핀 (resorufin)의 escence, 바닥 광섬유를 사용하여.
- 게인 변환 (10)과 4,000 사이에 다를 수 있습니다 레사 주린의 평균 양에 따라 달라집니다, 메모를합니다. 형광 신호 (이 경우 20,000) 검출 가능한 최대 신호 강도의 80 % 이하가되도록하는 레조 루핀 (resorufin) 표준 곡선을 피펫 팅에 의해 사용되는 각 마이크로 플레이트 리더로 이득을 조정한다. SCP-1 세포에 대한 최적화 된 이득은 800이다.
- 시험 시료의 신호로부터 (세포없이 작업 액 레사 주린) 배경 신호를 뺀다.
- 실험 설정 / 목적에 따라 추가 단계를 진행 :
- 표준 곡선을 사용하여 지지체에 세포의 생존 비율을 계산한다. 사용 된 각각의 세포주에 대해 개별적으로 각각의 표준 곡선을 확인합니다.
- 배양 시간에 걸쳐 레사 주린 변환의 상대적인 증가를 추정하여 세포 성장 / 증식을 분석합니다. 이 계산을 위해 설정참고로 1 일에 레사 주린 변환. 갓 이러한 종류의 분석을위한 레사 주린 작업 솔루션을 준비합니다. 또한, 배양 시간은 다른 측정과 동일해야한다.
- 일관된 결과를 얻기 위해 적어도 세 번 레사 주린 변환 측정의 전체 프로토콜을 반복한다.
8. 라이브 죽은 염색
- 50,000 세포 / 지지체의 파종 밀도 골격에 SCP1 셀 플레이트는 표준 세포 배양 조건을 유지하는 발판 성장할 수 있도록 (프로토콜 1 참조 2).
- 24-48 시간 후에 완전히 SCP-1 세포로부터 배양 배지를 흡인하고, 폐기 용기에 폐기.
- 분리 된 세포를 제거하는 DPBS으로 한 번 SCP-1 세포를 씻으십시오. 24 웰 조직 배양 플레이트의 웰 당 500 μL의 DPBS를 첨가하고 실온에서 5 분 동안 배양한다.
- 얼룩 SCP-1 사용 형광체 (동시에 세 얼룩)
- 지금부터일광에서 형광 표백을 보호하기 위해 어둠 속에서 골격을 유지!
- 발판에 걸쳐 동일한 분포를 허용하기 위해 30 분에 배양 시간을 설정합니다. 다른 발판으로 전송하는 경우, 각각의 발판 특성 (기공 크기, 발판의 깊이 등)에 맞게 배양 시간을 최적화해야합니다.
- 상기 지지체 상에 생존 세포를 검출 (배양액) 2 μM의 최종 농도에서의 칼 세인 AM을 가진 세포를 염색하기 위해.
- 발판의 모든 세포를 검출하기 위해, (배양액) 0.002 μg의 / μL 최종 농도 훽스트 33342로 세포를 염색.
- 죽은 세포를 검출하기 위해, (배지)에 4 μM의 최종 농도에 티듐 호모 다이머와 발판을 배양한다.
- 배양 시간 후 상온에서 각 5 분 동안 세포를 DPBS로 3 회 (웰 당 1 ml)로 세척 하였다.
- 즉시 사진을 촬영형광 현미경을 사용하여 에스.
- (각각 22분의 470 nm의 42분의 510 나노 미터의 여기 및 방출 파장)는 GFP LED 큐브 / 필터 세트와 칼 세인의 사진 (살아있는 세포)를 가져 가라. 또는 형광 스펙트럼 뷰어의 도움으로 적절한 여기 및 발광 파장을 선택합니다. 칼 세인은 488 nm에서 피크 여기 및 507 nm에서의 피크 방출을 보유하고 있습니다. 참고 : 칼 세인 또는 다른 녹색 형광 얼룩 형광 염색을 위해 GFP 형질 감염된 세포를 사용하지 않도록 확인합니다.
- 44분의 357의 나노 미터의 여기 파장과 60분의 447의 나노의 발광 파장 설정 DAPI LED 큐브 / 필터로 훽스트 33342의 사진을 촬영합니다. 또는 형광 스펙트럼 뷰어의 도움으로 적절한 여기 및 발광 파장을 선택합니다. 훽스트 33342는 347 nm에서 피크 여기 및 483 nm에서의 피크 방출을 보유하고 있습니다.
- RFP LED 큐브 / 필터 세트 (여기 및 방출 파장 오와 에티 디움 호모 다이머의 사진을 촬영F 40분의 531 nm의 40분의 593 nm의, 각각). 또는 형광 스펙트럼 뷰어의 도움으로 적절한 여기 및 발광 파장을 선택합니다. 에티 디움 호모 다이머는 530 nm에서 피크 여기 및 618 nm에서의 피크 방출을 보유하고 있습니다.
결과
예비 결과는 설명 새로운 핵 이식뿐만 아니라 좋은 댐핑 기능을 가지고뿐만 아니라 SCP-1 세포와 생체 적합성 인 것으로 나타났다. 임플란트의 제조 공정 동안, 강한 부식성 및 독성 물질 (윤활제, 매염제, 전기 연마 용액)와 접촉한다. 간접 형광 염색하는 기술을 사용하여, 우리는 잔여 불순물을 시각화하고, 결과적으로, 골격에 물질 부하의 상당한 감소를 도시하는 클리닝 프로토콜을 최적화 할 수 있었다. (3)이 성립 세정 프로토콜의 효율을 나타낸다.
프로토콜 부 (6) 트랜스 상당한에 설명 된대로 셀 재 계면에서 발생하는 이벤트에 의해 결정된다 치환술 치료에 사용되는 임플란트의 성공.도 4는 도금의 24 시간 후 지지체에 부착 된 세포를 나타낸다SCP-1 세포의 fection 효율은 우리가 지지체 (도 2 참조)에 화상 기질 간엽 전구 세포의 성장 패턴을 수 있으므로 관찰되었다. 직접 시각화는 지지체의 생체 적합성을 확인하고 또한 지지체 표면에 부착 패턴 (그림 4)를 보여줍니다. 형광 염색은 지지체 표면에의 확산과 함께 세포의 상호 작용을 조사하기 위해 추가로 수행 될 수있다.
형광 성공적 지지체에 일정 기간 동안 세포 사멸 및 증식을 조사하기 위해 적용되었다. 라이브 죽은 염색 이미지 염색이 성공적으로 일정 기간 동안 세포의 퍼센트의 가능성을 확인하는 발판에서 수행 할 수있는 방법을 예시. 모든 셀에 6 파란색 핵 염색을 보여줍니다 (3342 헥스)를 그림, 빨간색 형광 표지 (에티 디움 호모 다이머) 죽은 세포, 그리고 생존 엄마와 같은 칼 세인-AM의 통합을위한 녹색 표지rker. 칼 세인 AM은 세포의 세포질 칼슘 이온의 존재 하에서 밝은 녹색의 형광을 나타내는 칼 세인으로 변환된다. 훽스트 33342이 세포 DNA 내로의 세포벽은 투과하고하게 인터이다. 이 방법은 모든 세포는 파란색 핵 (그림 6 참조)이 표시됩니다. 티듐 호모 다이머는 세포벽 투과성 아니다 따라서만이 인터 칼 죽은 세포의 DNA 내로. 이 방법은 죽은 세포가 빨간색으로 핵을 표시합니다. 또한, 세포 생존 및 주 위에 지지체에 세포 수의 증가를 접어 전환 분석을 레사 주린 의해 정량화하고, 그래프 (도 7)을 표시.

도 1 : 세포 혈구 카운팅 챔버 조립체 (A) 설정.. (B) 계산 챔버의 그림 4 × 4 계수 챔버는 세포 COU에 사용NT를. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
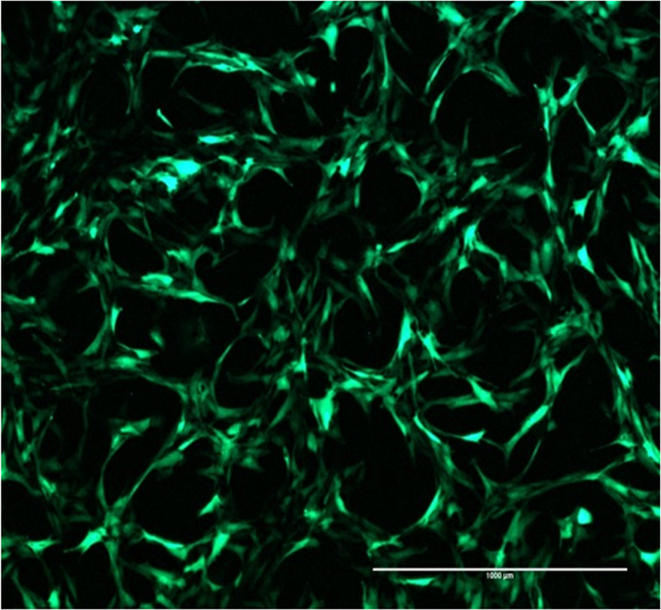
그림 2. GFP 형질 전환 효율 SCP1 세포 포지티브 광고 GFP- 형질 전환 효율을 나타내는 강한 녹색 형광을 나타낸다. 스케일 바 = 1000 μm의, 4 배 확대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 : Sulforhodamine B 염색 부정적인 이미지 캡처 청소하기 전에 (A) 비 계.. 화살표 발판에 독성 / 부식성 물질의 존재를 나타냅니다. (세정 후의 프로토콜 B) 비계. 스케일 바 = 1000 μm의, 4 배 확대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
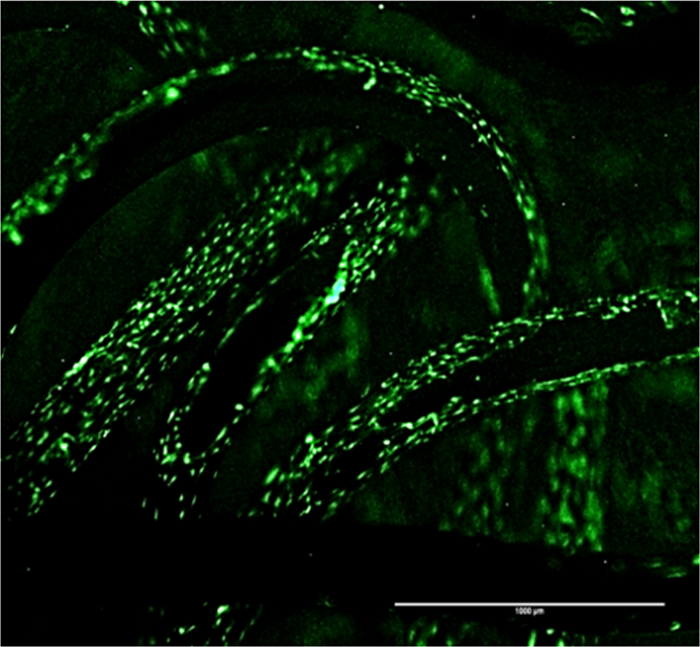
도 4 :. 비계 GFP 신호에 SCP1 세포 내 접착 패턴 편성 티타늄 지지체의 표면 상에 세포 부착 및 성장 패턴을 나타낸다. 스케일 바 = 1000 μm의, 4 배 확대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
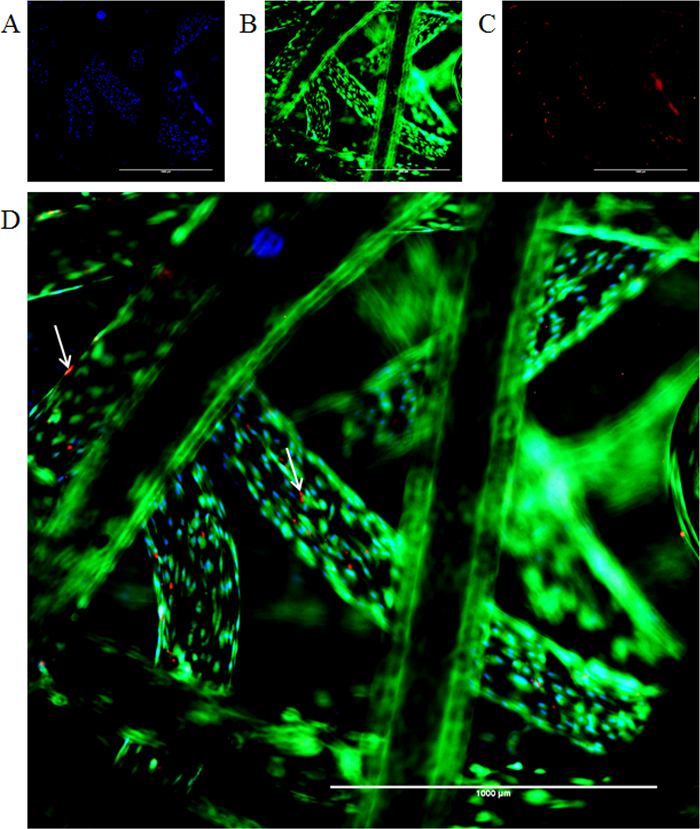
그림 6 : 인공 지지체에 세포의 공동 형광 염색 (. 가) 훽스트 핵 염색 (청색) 및 (B) 칼 세인 AM 세포질 염색 (녹색). (C) 화살표 인해 에티 디움 호모 다이머-1 얼룩 (적색)의 흡수에 죽은 세포의 존재를 나타냅니다. (D)는 병합 된 이미지를 보여줍니다. 스케일 바 = 1000 μm의, 4 배 확대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
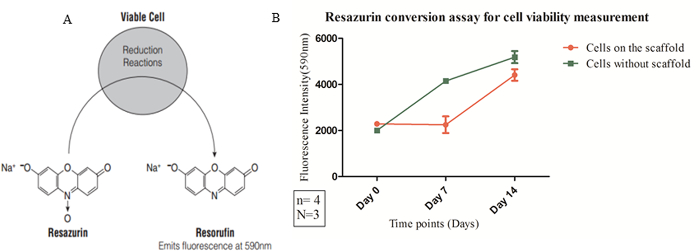
도 7 : 레사 주린 변환 분석 형광을 방출하고 색채 변화를 겪는 최종 생성물 (레조 루핀 (resorufin))에 산화 환원 염료 (레사 주린)의 (A) 생물 환원 반응.. (B) 셀이 0.75 밀리그램 / ㎤의 밀도를 지지체에 도금 때 미토콘드리아 활성을 측정 하였다. 데이터는 플로리다를 사용하여 수집기반 측정 기기를 uorescence. 정의 된 시점 (x 축)에서 590nm의 (Y 축)에서의 형광 강도를 정량 세포 생존율 측정 (예 = 540 nm의 엠 = 590 ㎚)의 결과로서 도시된다. 유의성은 오차 막대로 표시되는 양방향 ANOVA 및 평균의 표준 오차 (SEM)을 사용하여 측정 하였다. 발판 물리적 특성을 고려하여, 예를 들어, 함께, 0.75 밀리그램 / ㎤의 밀도 발판이 생체 적합성 특성에 사용 된 기공 크기 및 기계적 특성 (예를 들면, 댐핑 기능). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 미디어 구성 요소 | 집중 |
| 기저 αMEM 미디어 (%) | (90) |
| 혈청 (%) | (10) |
| 펜 / 연쇄상 구균 (%) | 1 |
표 1 : 세포 배양 (αMEM) 미디어 조성물.
| 문제 | 원인 | 해결책 |
| 비 투명 지지체에 세포 생존 영상 | 비계는 왜곡없이 침투하는 빛을 방지 | 셀 평가를 위해 형광 기반 이미징 기술을 사용합니다. |
| 형광 강도의 간섭 | 자동 형광 배경 신호 | 형광에주의하고 특히 비계의 특성에 따라 적절한 사용합니다. |
| 문화 기간 동안 인공 지지체에 세포 생존 능력 평가 | 아르 자형오랜 시간에 걸쳐 epeated 측정 | 광고 GFP 바이러스 입자와 세포를 형질. |
| 불투명 지지체에 세포의 기능 평가 | 형광 영상 법은 패턴 분석 확산 만 셀을 허용한다. | 이미징 기법을 조합하여 변환 분석 (정량 세포 생존율 측정) 레사 주린 수행한다. |
표 2 : 요약 테이블 : 불투명 지지체에 세포 생존 이미징 문제 해결.
토론
골격 표면하여 임플란트를 기능적 내구성을 결정 생체 내에서 주변 조직과의 상호 작용에서 중요한 역할을한다. 따라서, 지지체의 생체 적합성의 지지체 상에 플레이 팅 세포를 이용한 시험 관내 분석법 (SCP1 세포주)에 의해 연구된다.
얇고 광학적으로 투명 지지체와 잘 작동 현미경 기술은 가난 생체 적합성을 연구하는 불투명 발판 적합합니다. 이것은 불투명 지지체 상당한 왜곡없이 15 침투하는 광을 방지 주로 때문이다. 부분적으로 이러한 문제점을 극복하기 위해, 우리는 이것과 각종 형광체를 사용하는 니트 제조 티타늄 지지체의 ON / 셀 평가 방법을 확립한다.
티타늄 와이어 폴딩 하였다 편성을 가능하게하기 위해, 재료는 강한 부식성 및 독성 물질 (윤활제, 매염제, 전기와 접촉트레이스는 발판에 /에 남아있는 경우 지지체의 생체 적합성을 변경할 수있는 솔루션을), -polishing. 개발 된 간접 형광 프로토콜의 도움 (프로토콜 5)와 함께 우리는 골격 구조를 시각화 할 수 있습니다. 또한, 예를 들면 지지체 특성, 재료의 두께, 각각의 기공 크기와 모양 또는 결합 밀도는 ImageJ에 사용하여 분석 하였다. 미세 화상 골격뿐만 아니라 지지체 표면에 불순물을 시각화 허용 높은 확대 된 표면 형광.도 3b 따라서 성공적으로 개발 세정 프로토콜 확증 결과를 나타낸다. 이 간접 염색 프로토콜의 원리를 쉽게 예, 배양 시간에 영향을 미치는 크기와 해당 확산 기공, 고려 개별 지지체 특성을 가지고, 다른 불투명 지지체에 재생 될 수있다. 또한, 비계 및 현미경 설정의 자동 형광 플로리다의 선택에 영향을 미치는uorophores를 사용합니다. 온라인 도구의 형광 스펙트럼 뷰어는 적절한 형광을 선택하는 데 도움이 될 수 있습니다.
셀 금속 상호 작용은 지지체에 세포의 접착 패턴을 분석함으로써 간접적으로 조사되었다. 프로토콜 6은 GFP 형질 전략을 사용하여 배양 시스템에서의 비 투명 지지체 상에 도금되는 경우에 세포가 시험관 내에서 감시 될 수있는 방법의 방법을 설명한다. 시험 관내 분석법의 예비 결과에 기초하여, 그러한 조성물, 마이크로 지형 거칠기 16 표면 특성은 접착 성을 확립하고 표적 세포의 확산에 중요한 역할을 할 것으로 예측되고있다. 티타늄은 생체 따라서 세포 부착 (도 4 참조)에 대한 기본을 제공하는 기재를 주형으로 작용 될 수된다.
임플란트 표면 토포 그래피는 셀 (16)의 행동에 영향을보고되었다. 본 연구에서는 / 세포 성장 분석확산 및 생존 가능성 정량 측정과 결합하여 형광 염색 기술을 사용. 분석 미묘한 세포 %의 생존 능력의 변화와 골격 물질에 따라 확산 한 것으로 밝혀졌습니다. 그러나, 전환 분석 (미토콘드리아 활동을) 레사 주린에 의해 정량적으로 평가 세포의 기능은 크게 골격 물질에 의해 영향을받지 않았다. 변환 레사 주린 의한 미토콘드리아 활성의 측정은 세포 독성이되지 않는 이점을 가지고있어 긴 배양 기간 동안 반복적으로 수행 될 수있다. 특별한주의가 배경 신호 (거짓 긍정적 인 결과를) 누적되지 않도록에 잔류 레사 주린 작업 용액 떨어져 세척 할 때 수행해야합니다. 이러한 장점에도 불구하고, 레사 주린 변환 분석은 발판에 확산 셀에 대한 정보를 제공하지 않습니다. GFP의 감염 세포 따라서하여의를 시각화 할 수 있도록 (GFP 신호가 14 일 이상 일정하게 유지) 긴 배양 기간에 걸쳐 추적 할 수 있습니다발판 표면에 pecific 성장 패턴. 깊은 지지체에 세포의 시각화는 여전히 임플란트의 절개가 필요합니다 따라서 골격 물질에 의해 제한된다. 이들 두 기술의 조합을 쉽게 배양 시간은 관심있는 세포 유형에 적용 할 수있을 것을 고려하면, 다른 종류의 세포에 전달 될 수있는 큰 이점을 갖는다. 그러나 치료는 예를 들어 다른 불투명 비계,이 방법을 전송할 때주의가 필요하다, 콜라겐 일반적으로 강한 녹색 자동 형광 (17)을 나타내는 골격을 기반으로. 이 경우 다른 형광 태그를 사용할 수 있습니다. 위에서 언급 한 두 가지 방법의 조합에 따라서 여러 가지 장점이있다 (표 2 참조)를 갖는다.
비계 특성, 예를 들면, 인공 지지체 내부에 크기 힘 트랩 세포 기공. 충분한 영양이 공급하는 경우,이 세포는 죽고 서라운드의 세포 생존에 영향을 미치는 단백질 분해 효소를 분비 수 있습니다세포 / 조직을 보내고. 우리와 니트 티타늄 발판에 라이브와 죽은 세포를 시각화 할 수있는 형광 기반의 염색 프로토콜을 적용 할 수 있었다. 간접 형광 염색 프로토콜과 마찬가지로,이 염색 프로토콜의 원리를 쉽게 다른 비 투명 지지체로 전달 될 수있다. 그렇게하는 동안, 각 골격 등록 정보, 예를 들어, 기공의 크기와 해당 확산뿐만 아니라 가능한 자동 형광 현미경 설정은 배양 시간 및 사용 된 형광 물질의 선택에 영향을 미칠 수있는 고려 될 수있다. 여기서 다시 온라인 도구 형광 스펙트럼 뷰어는 적절한 형광을 선택하는 데 도움이 될 수 있습니다.
요약하면, 시험 관내 결과는 제안 니트 티탄 핵 이식 모델 생물학적 프로필을 갖는 것을 나타낸다. 이 자료에 대한 중간 엽 기질 전구 세포 (SCP-1 세포)의 초기 부착 제안이이 티타늄 합금 임플란트 물질에난 생체 적합성이다. 우리가 다른 지형적 파라미터의 관계를 분석되지 않았지만, 지지체 표면 개질 차별화 (18)뿐만 아니라 세포 부착 증식을 향상 수있다. 지지체와 세포 간의 최적의 호환성은 주변 조직으로 잘 주입 통합의 가능성을 높이기 때문에 치료 19 일 후에 생체 내에서 수명이 향상된다. 위의 언급 한 테스트 설정을 사용하여 측정 및 표면 수정에 의해 유도 된 지지체의 생물학적 성능 개선을 시각화 할 수있는 가능성을 열어. 수정되지 않은 임플란트 디자인을 통해 생리 활성 표면과 발판의 환경 설정은 골관절염 연골 통합의 측면에서 더 나은 성능 (20)를 제안한다. 이 연구는 또한 그것의 기계적 특성 및 생체 활성이 6,7보고 된 니트 티타늄 임플란트의 다른 보고서에 의해 강화된다.
공개
저자는 더 경쟁 관심이 없음을 선언합니다. 작품의 어떤 부분은 없었 또는 게시를 위해 고려중인 현재 또는 다른 곳에 게시 된있다.
감사의 말
이 프로젝트는 부분적으로 Zentrales Innovationsprogramm Mittelstand에 (ZIM) 데 Bundesministeriums 대 Wirtschaft 싶게 에네르기 -KF3010902AJ4에 의해 투자된다. 발행 수수료는 BG 외상 병원 튀빙겐, 독일에 의해 덮여있다.
자료
| Name | Company | Catalog Number | Comments |
| 6/24/48 well plates, T25/ T75 culture flask | Greiner Bio-One GmbH | * | |
| * 24 well plates | Greiner Bio-One GmbH | CELLSTAR 662 160 | |
| * 48 well plates | Corning Incorporated USA | 3548 | |
| * 6 well plates | Falcon | 353046 | |
| * T25 | Greiner Bio-One GmbH | 690 175 | |
| * T75 | Greiner Bio-One GmbH | 658 175 | |
| Acetic acid, purum ≥ 99.0% | Carl Roth | 3738.4 | |
| Acetone | Carl Roth | 5025.1 | |
| Axioplan-2 | Carl Zeiss, Germany | ||
| Biological safety cabinets | Thermo Scientific | safe 2020 | |
| Calcein acetoxymethyl ester (calcein AM) | Sigma | 17783 | |
| Cell Culture Incubtator | Binder, Tuttlingen, Germany | 9040-0078 | |
| Filter unit (0.22 µm) | Millipore, IRL | SLGP033RS | |
| Centrifuges 5810 R And 5417 R | Thermo Fisher Scientific, NY | Megafuge 40R | |
| Dimethylsulfoxid (DMSO) | Carl Roth | 4720.2 | |
| Dulbecco’s PBS without Ca & Mg | Sigma | H15-002 | |
| Ethanol 99% | SAV liquid prod. GmBH | 475956 | |
| Ethidium homodimer | Sigma | 46043 | |
| EVOS Fluorescence imaging system | Life technologies | AMF4300 | |
| Fetal Bovine Serum (FCS) | Gibco | 10270-106 | |
| Hemocytometer | Hausser Scientific, PA, USA | ||
| Hoechst 33342 | Sigma | 14533-100MG | |
| Knitted titanium nucleus implant | Buck co & KG,Germany | ||
| MEM Alpha Modification with Glutamine w/o nucleoside | Sigma | E15-832 | |
| Omega microplate Reader | BMG Labtech,Germany | FLUOstar Omega | |
| Penicillin/Streptomycin | Sigma | P11-010 | |
| Resazurin sodium salt | Sigma | 199303-1G | |
| Sulforhodamine B sodium salt | Sigma | S1402-1G | |
| Test tube rotator | Labinco B.V.,The Netherlands | Model LD-76 | |
| TRIS (hydroxymethyl) aminomethan | Carl Roth | AE15.1 | |
| Triton | Carl Roth | 3051.2 | |
| Trypan Blue 0.5% | Carl Roth | CN76.1 | |
| Trypsin/EDTA | Sigma | L11-004 |
참고문헌
- Bridwell, K. H., Anderson, P. A., Boden, S. D., Vaccaro, A. R., Wang, J. C. What's new in spine surgery. J Bone Joint Surg Am. 95, 1144-1150 (2013).
- Adams, M. A., Dolan, P. Intervertebral disc degeneration: evidence for two distinct phenotypes. J Anat. 221, 497-506 (2012).
- Schizas, C., Kulik, G., Kosmopoulos, V. Disc degeneration: current surgical options. Eur Cell Mater. 20, 306-315 (2010).
- Lewis, G. Nucleus pulposus replacement and regeneration/repair technologies: present status and future prospects. J Biomed Mater Res B Appl Biomater. 100, 1702-1720 (2012).
- Cunningham, B. W. Basic scientific considerations in total disc arthroplasty. Spine J. 4, 219-230 (2004).
- Implant for surgical use in humans or vertebrates. US8728164 B2. Google Patents. , (2014).
- Kettler, A., Kaps, H. P., Haegele, B., Wilke, H. J. Biomechanical behavior of a new nucleus prosthesis made of knitted titanium filaments. SAS J. 1, 125-130 (2007).
- Nerurkar, N. L., Elliott, D. M., Mauck, R. L. Mechanical design criteria for intervertebral disc tissue engineering. J Biomech. 43, 1017-1030 (2010).
- Elias, C. N., Lima, J. H. C., Valiev, R., Meyers, M. A. Biomedical applications of titanium and its alloys. JOM. 60, 46-49 (2008).
- Hallab, N., Link, H. D., McAfee, P. C. Biomaterial optimization in total disc arthroplasty. Spine (Phila Pa 1976). 28, 139-152 (2003).
- Gustafsdottir, S. M. Multiplex cytological profiling assay to measure diverse cellular states. PLoS One. 8, e80999(2013).
- Bocker, W., et al. Introducing a single-cell-derived human mesenchymal stem cell line expressing hTERT after lentiviral gene transfer. J Cell Mol Med. 12, 1347-1359 (2008).
- Ehnert, S., et al. Transforming growth factor beta1 inhibits bone morphogenic protein (BMP)-2 and BMP-7 signaling via upregulation of Ski-related novel protein N (SnoN): possible mechanism for the failure of BMP therapy. BMC Med. 10, 101(2012).
- Morgan, S. P., Rose, F. R., Matcher, S. J. Optical Techniques in Regenerative Medicine. , CRC Press. (2013).
- Vielreicher, M., et al. Taking a deep look: modern microscopy technologies to optimize the design and functionality of biocompatible scaffolds for tissue engineering in regenerative medicine. J R Soc Interface. 10, 20130263(2013).
- Curtis, A., Wilkinson, C. Topographical control of cells. Biomaterials. 18, 1573-1583 (1997).
- Niu, G., et al. Fluorescent imaging of endothelial cells in bioengineered blood vessels: the impact of crosslinking of the scaffold. J Tissue Eng Regen Med. , (2014).
- Chan, B. P., Leong, K. W. Scaffolding in tissue engineering: general approaches and tissue-specific considerations. Eur Spine J. 17, Suppl 4 467-479 (2008).
- Navarro, M., Michiardi, A., Castano, O., Planell, J. A. Biomaterials in orthopaedics. J R Soc Interface. 5, 1137-1158 (2008).
- Priyadarshani, P., Li, Y., Yao, L. Advances in biological therapy for nucleus pulposus regeneration. Osteoarthritis Cartilage. , (2015).
- Thermofisher Fluorescence Spectraviewer. , Source: https://www.thermofisher.com/de/de/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유