Method Article
Imagerie cellulaire Viabilité sur Echafaudages non transparents - Utilisation de l'exemple d'un roman en maille de titane Implant
Dans cet article
Résumé
Nous présentons ici une technique d'imagerie fluorophore sur la base pour détecter la viabilité des cellules sur un échafaudage en titane non-transparent, ainsi que pour détecter des aperçus des impuretés d'échafaudage. Ce protocole répare l'inconvénient d'imager les interactions cellule-cellule ou cellule-métal sur des échafaudages non transparents.
Résumé
Intervertebral disc degeneration and disc herniation is one of the major causes of lower back pain. Depletion of extracellular matrix, culminating in nucleus pulposus (NP) extrusion leads to intervertebral disc destruction. Currently available surgical treatments reduce the pain but do not restore the mechanical functionality of the spine. In order to preserve mechanical features of the spine, total disc or nucleus replacement thus became a wide interest. However, this arthroplasty era is still in an immature state, since none of the existing products have been clinically evaluated.
This study intends to test the biocompatibility of a novel nucleus implant made of knitted titanium wires. Despite all mechanical advantages, the material has its limits for conventional optical analysis as the resulting implant is non-transparent. Here we present a strategy that describes in vitro visualization, tracking and viability testing of osteochondro-progenitor cells on the scaffold. This protocol can be used to visualize the efficiency of the cleaning protocol as well as to investigate the biocompatibility of these and other non-transparent scaffolds. Furthermore, this protocol can be used to show adherence pattern of cells as well as cell viability and proliferation rates on/in the scaffold. This in vitro biocompatibility testing assay provides a propitious tool to analyze cell-material interaction in non-transparent and opaque scaffolds.
Introduction
La lombalgie chronique est une maladie multifactorielle. L'intérêt dans une option de traitement peu invasif pour la maladie dégénérative du disque a augmenté depuis les années 1950. Jusqu'à aujourd'hui, la fusion de plusieurs segmentaire de la colonne vertébrale est le traitement le plus largement utilisé. Depuis, cette méthode conduit souvent à des limitations de la mobilité du segment affecté 1,2, l' exploration de l'ère de l' arthroplastie est devenu un grand intérêt. Des progrès considérables en remplacement de disque et le noyau remplacement total est devenu une bonne alternative pour traiter les douleurs chroniques au dos 1. Malgré les énormes progrès, aucune des méthodes a été évaluée cliniquement. Les implants de noyaux moins rigides représentent une alternative prometteuse pour le remplacement total du disque, à condition que l'anneau fibreux est intact 3,4. Cependant, les implants actuellement présents noyau sur le marché sont souvent associées à des complications comme les changements dans le corps vertébral, dislocation, vertical perte du disque et t la hauteuril manque de nécessaire rigidité mécanique associée 5. Afin de pallier aux inconvénients actuels, un nouvel implant de noyau en fils tricotés de titane a été développé avec succès 6. En raison de la structure tricotée unique, cet échafaudage nouvellement développé a montré des caractéristiques biomécaniques distingués, par exemple, fonction d' amortissement, la taille des pores, la capacité de chargement et de fiabilité 7. Dans le but de tester la biocompatibilité de ce nouvel implant de noyau, représenté dans les limites sévères (optique) des techniques d'analyse attribuées à caractère non transparent de l'implant.
Afin de tester la biocompatibilité, l' interaction cellule-métal joue un rôle prépondérant 10/08. Une interaction entre les cellules et l'échafaudage est nécessaire pour la stabilisation et par conséquent pour l'intégration de l'implant mieux dans le système hôte. Cependant, une augmentation de la profondeur de croissance intérieure peut altérer les propriétés mécaniques de l'échafaudage. Visant à investigate si la surface de l'échafaudage fournit une base pour la fixation cellulaire, la prolifération et la différenciation ou si le métal affecte la viabilité des cellules, il est important de résoudre le problème commun bien connu de l'imagerie de cellules sur / dans les échafauds non transparentes et opaques. Afin de surmonter cette limitation plusieurs fluorescent techniques basées ont été explorées. Les entreprises offrent une large gamme de fluorophores pour visualiser les cellules vivantes, des compartiments cellulaires, ou des états cellulaires spécifiques même 11. Fluorophores pour cette expérience ont été choisis avec l'aide de l'outil visualiseur spectrale en ligne afin d'adapter au mieux notre microscope fluorescent.
La stratégie développée pour l'analyse des cellules comportement adhérent sur / dans l'échafaudage de titane tricoté non-transparent comprend les éléments suivants: 1) fluorescent (protéine fluorescente verte / GFP) marquage des cellules osteochondro-progénitrices pour permettre le suivi des cellules sur la échafaud, 2) la mesure de la viabilité (mitoactivité chondrial) des cellules, et 3) la visualisation de cellule à cellule et des interactions cellulaires matériau au sein de l'échafaudage. La procédure présente l'avantage qu'il peut être facilement transféré à d'autres cellules adhérentes et autres échafaudage non transparente ou opaque. En outre, la viabilité et la structure de croissance interne peuvent être contrôlés pendant plusieurs jours, il peut donc être utilisé avec des quantités limitées de matériau d'échafaudage ou de cellules.
La présente étude démontre l'utilisation réussie de notre protocole actuel pour mesurer la viabilité cellulaire et de visualiser modèle dans la croissance des cellules progénitrices osteochondro-sur / dans l'échafaudage de titane tricoté non-transparent. En outre, les protocoles développés pourraient être utilisés afin de déterminer les impuretés d'échafaudage et de vérifier les protocoles de nettoyage.
Protocole
REMARQUE: Les cellules précurseurs immortalisés stromales mésenchymateuses humaines (SCP-1 cellules) ont été utilisés pour les expériences. SCP-1 cellules ont été fournies par le Prof. Matthias Schieker 12.
1. Extension du SCP-1 cellules
- Avant de travailler avec les cellules SCP-1, bien nettoyer la zone de travail (désigné biosécurité cabinet I) avec des gants éthanol à 70% (v / v) portant.
- Dans l'enceinte de sécurité biologique nettoyé préparer un volume approprié de milieu de culture cellulaire en mélangeant les composants requis , comme indiqué dans le tableau 1. Afin de préserver la stérilité du milieu de base, ajouter des suppléments en passant à travers des filtres stériles avec une taille de pores de 0,22 um.
- Pour éviter la contamination, préparer le milieu au moins 24 heures avant l'utilisation. Afin de tester la stérilité, incuber 1 ml de milieu dans une plaque de culture cellulaire sans cellules dans l'incubateur de culture cellulaire standard: 37 ° C, 5% de CO 2, 20% de O 2 et 90% d' humidité. Après24 h, vérifier moyenne au microscope en utilisant un grossissement d'au moins 200X.
- Maintenir SCP-1 cellules dans un incubateur de culture cellulaire standard avec la condition de soutien: 37 ° C, 5% de CO 2, 20% O 2 et 90% d' humidité.
- Pour l'entretien et l'expansion, cultiver les cellules SCP-1 jusqu'à ce qu'ils atteignent 80-90% de confluence. Au cours de cette période de temps la culture, changer moyenne tous les 2-3 jours. Après avoir atteint 80 à 90% de confluence, divisé SCP-1 des cellules (en général un rapport 1: 2) pour le passage suivant ou d'une plaque d'extension pour les expériences (comme indiqué).
- Pour séparer les cellules SCP-1, préchauffer le milieu de culture à 37 ° C et à décongeler trypsine / EDTA en utilisant un bain d'eau à 37 ° C.
- Complètement aspirer le milieu de culture des cellules confluentes 80-90% et le jeter dans un conteneur de déchets.
- Laver les cellules au moins deux fois avec du DPBS (phosphate de Dulbecco sans sérum physiologique tamponné au magnésium et de calcium, pH 7,2).
- Pipeter un volume approprié deDPBS sur les cellules (5 ml de DPBS pour un flacon de culture T75 et 12 ml pour une fiole de culture T175).
- Aspirer DPBS soigneusement et le jeter dans un conteneur de déchets.
- Pipeter un volume approprié de 0,25% de trypsine / EDTA sur les cellules (1 ml de DPBS pour un flacon de culture T75 et 2 ml pour une fiole de culture T175) et on incube pendant 5-10 min à 37 ° C dans l'incubateur de culture cellulaire standard avec 5 % de CO 2, 20% de O 2 et 90% d' humidité.
- Détacher les cellules en appuyant sur le récipient et assurer que toutes les cellules sont détachées de la matière plastique de culture (trypsinisation) en observant les cellules flottantes sous le microscope.
- Inactiver la réaction de la trypsine par addition de 10 ml de milieu de culture. Mélanger la trypsine et les cellules avec le milieu soigneusement par pipetage répété.
- Transférer la suspension cellulaire dans un tube de réaction et centrifuger à 600 g pendant 10 min à température ambiante.
- Aspirer le surnageant et remettre en suspension le culot cellulaire dans 10 ml de culturemoyen.
- Compter les cellules par Trypan Bleu méthode d'exclusion comme décrit dans le protocole 2.
- Ensemencer les cellules en fonction de la conception expérimentale.
2. Comptage de SCP-1 cellules
- Effectuer un comptage des cellules viables (bleu Trypan méthode d'exclusion) des cellules remises en suspension en utilisant un hémocytomètre.
- Avant le nombre de cellules, nettoyer le hémocytomètre en utilisant l'eau du robinet. Sécher les composants hémocytomètre en utilisant un tissu non pelucheux. Assembler par humidifier le couvercle en verre et en le pressant inverse sur les deux coureurs de verre de chaque côté de la zone de comptage. Veiller à ce que les anneaux newtoniens sont visibles sur les coureurs de verre (Figure 1).
- Prenez 10 pi des cellules remises en suspension et mélanger avec 10 pi de solution à 0,1% Trypan bleu pour obtenir un facteur de dilution de 2.
- Charge 10 pi de l'échantillon total sur la chambre de hémocytomètre préalablement nettoyé et assemblé.
- Comptez le nombre de direct (blanc / cellules transparentes) et morts(noyaux bleus) cellules sur les carrés 4x4 (voir la figure 1B).
- Calculer le nombre total de cellules suivant la formule donnée:
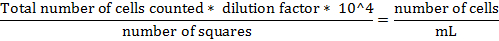
3. GFP Transfection de SCP-1 cellules
NOTE: Afin d'observer SCP-1 la croissance des cellules sur et dans l'échafaudage de titane tricoté sur une certaine période de culture, nous avons marqué les cellules avec une protéine fluorescente verte (GFP). La surexpression de la protéine GFP est obtenue par infection avec des particules d'adénovirus codant pour la GFP. incompétence de réplication (-E1 / -E3) adénovirus particules codant pour la protéine fluorescente verte (GFP) ont été utilisés pour infecter SCP-1 cellules. Les particules virales ont été obtenues auprès du Prof. Steven Dooley 13 en recueillant le surnageant de culture de l' adénovirus recombinant (Ad5-GFP) , les cellules HEK293T transfectées (de laboratoire de biosécurité II). Trois répétés de congélation (-80 ° C) et le dégel (37 ° C dans le bain d'eau) cycles assuré qu'aucune HEcellules K293T restent viables pour produire de nouvelles particules virales. L'utilisation de ce stock de semences adénovirus peuvent efficacement infecter les cellules SCP-1 sans produire de nouvelles particules virales. Ainsi, les cellules infectées peuvent être traitées dans un laboratoire de biosécurité I.
- Remettre en suspension les cellules cibles (cellules SCP-1) avec une densité d'ensemencement de 50.000 cellules / ml dans du milieu de culture. La pipette 2 ml par puits dans une plaque de culture tissulaire à 6 puits.
- Incuber à 37 ° C dans l'incubateur de culture cellulaire standard; 5% de CO 2, 20% de O 2 et 90% d' humidité, jusqu'à ce que SCP-1 cellules atteignent une confluence de 70 à 80%.
REMARQUE: confluence dépend de la densité d'ensemencement des cellules. Pour les conditions ci-dessus mentionnées, SCP-1 cellules atteignent une confluence de 70-80% en 1,5-2 jours. - A une confluence de 70-80%, sans aspirer le milieu de culture ajouter 100 pi de la graine d'adénovirus mère par 1 ml de milieu de culture.
- Déterminer la plage de concentrations individuellement en fonction de la quantité de particules de virus dans chaque virus seed stocks préparation. Dans le cas où l'efficacité de l'infection est trop faible, de purifier et de concentrer les particules virales en utilisant divers kits disponibles dans le commerce.
- Incuber pendant une heure dans l'incubateur de culture cellulaire standard à 37 ° C (5% de CO 2, 20% de O 2 et 90% d' humidité).
- Retirez le milieu de culture contenant le stock de semences de virus et de recueillir pour l'élimination. Ajouter milieu de culture frais 2 ml par puits d'un 6-bien-culture-plaque pour reconstituer.
- Assurez-vous que avant l'élimination, particule virale contenant du milieu est autoclavé.
- Évaluer l'expression de la GFP intracellulaire (efficacité d'infection) 24 heures après l'infection en utilisant un microscope à fluorescence avec une GFP LED cube / jeu de filtres.
- Observez la morphologie des cellules (Figure 2). Les cellules de désolidarisation de la matière plastique de culture peuvent donner des résultats faussement positifs.
4. Nettoyage de Bonneterie titane échafauds
- Placet jusqu'à 5 échafauds dans un tube à réaction de 50 ml.
- Laver l'échafaudage (épaisseur 6-7 mm) trois fois avec 30 ml d'eau distillée désionisée pendant 20 minutes à la température ambiante, en utilisant des conditions de rotor (8 xg).
- Remplacer l'eau distillée désionisée avec 30 ml de 1% (p / v) de Triton-X-100 solution (dissous dans de l'eau distillée désionisée), puis laver les échafauds une fois pendant 20 min à température ambiante, en utilisant des conditions de rotor (8 xg) .
- Jeter la solution de Triton-X-100 suivie d'un lavage avec 30 ml d'eau distillée désionisée deux fois (5 min à chaque fois à la température ambiante), le maintien des conditions de rotor (8 xg).
- Remplacer l'eau distillée désionisée. Rincer le échafauds séquentiellement avec qualité réactif 99% d'acétone, isopropanol à 99% et 99% d'éthanol (30 ml chacune) pour 2 x 5 min chacun dans un bain à ultrasons (~ 50 Hz, 50 W, 220-240 V).
- Laver de nouveau trois fois avec 30 ml d'eau distillée désionisée pendant 5 min, en maintenant constant le bain de traitement par ultrasons.
- Placez le Scaffolds sur un tissu non pelucheux afin d'aérer sécher pendant la nuit à la température ambiante.
- Autoclave l'échafaud pendant 15 min à 121 ° C avec 15 psi.
- Confirmer le protocole de nettoyage par fluorescence indirecte comme décrit dans le protocole 5.
5. Imagerie Scaffold Structures par immunofluorescence indirecte
REMARQUE: Le présent protocole décrit l'imagerie des structures d'échafaudage par fluorescence indirecte en utilisant le fluorophore sulforhodamine B qui donne une fluorescence rouge vif à une longueur d'onde ex / em de 565/586 nm. Cependant, le fluorophore peut être changé pour un meilleur ajustement pour les réglages du microscope donnés ou possible auto-fluorescence de l'échafaudage.
- Préparer la solution sulforhodamine B de coloration (0,04%) dans de l'acide acétique à 1% et conserver à température ambiante à l'abri de la lumière.
- Prenez une plaque de culture tissulaire de 24 puits et de plonger l'échafaud nettoyé dans 500 pi de la solution de coloration sulforhodamine B en le plaçant inside le puits en utilisant une pince.
- Capturez les images négatives de l'échafaudage en utilisant un microscope à fluorescence.
- Prenez des photos avec une DP LED cube / filtre défini avec une longueur d'onde d'excitation de 531/40 nm et une longueur d'onde d'émission de 593/40 nm. Vous pouvez également choisir l'excitation et d' émission de longueur d' onde adéquate avec l'aide de la fluorescence spectrale spectateur 20. Sulforhodamine B a son excitation de pic à 578 nm et son pic d'émission à 593 nm.
- Afin de visualiser la structure d'échafaudage, de prendre des photos à des grossissements inférieurs, par exemple, 4X ou 10X (Figure 3). L' utilisation de ces images, déterminer les caractéristiques, par exemple, la taille des pores et la forme avec l'aide de l'ImageJ.
- Afin de détecter les impuretés d'échafaudage, de prendre des photos à des grossissements plus élevés, par exemple, 20X ou 40X, étant donné que cela va limiter la profondeur d'analyse. Veiller à ce que les particules de saleté / substances ne sont pas visibles (voir les résultats représentatifs; Figure 3).
6. biocompatibilité in vitro Dosage
- Préchauffer le milieu de culture à 37 ° C dans un bain d'eau.
- Prenez une plaque de culture tissulaire 24 puits et en utilisant une pince, placez les échafauds nettoyés et stérilisés dans chaque puits de test aseptique. Travailler sous l'enceinte de sécurité biologique pré-nettoyée I!
- Faire tremper / incuber les échafauds avec un milieu de culture pendant environ 15 min (500 pi par puits d'une plaque de culture tissulaire de 24 puits), afin d'éliminer l'air à l'intérieur de l'échafaudage.
- Pendant ce temps, remettre en suspension les cellules 500000 SCP1 Ad-GFP infectées dans 1 ml de milieu de culture.
- Après 15 min d'échafaudage de trempage, aspirer le milieu complètement l'échafaud.
- Pour l'ensemencement des cellules sur l'échafaud, distribuer 100 pl de suspension cellulaire avec précaution sur l'échafaud (qui est placé dans la plaque de 24 puits) surface. Maintenir un volume de suspension cellulaire pendant l'ensemencement des cellules, de manière à assurer qu'aucun fluide circule out de l'échafaud.
- Incuber les cellules pendant 30 min à 37 ° C dans l'incubateur de culture cellulaire standard (5% de CO 2, 20% de O 2 et 90% d' humidité).
- Ajouter 500 ul plus milieu de culture et incuber pendant 24 heures dans l'incubateur de culture cellulaire standard (37 ° C, 5% de CO 2, 20% O 2 et 90% d' humidité).
- Évaluer le motif d'adhérence cellulaire et de la cellule d'étalement sur la surface de l'échafaudage à l'aide d'un microscope à fluorescence.
- Prenez des photos avec une GFP LED cube / filtre défini avec une longueur d'onde d'excitation de 470/22 nm et une longueur d'onde d'émission de 510/42 nm. Vous pouvez également choisir l'excitation adéquate et d'onde d'émission à l'aide de la visionneuse spectrale fluorescence. GFP a son excitation de pic à 488 nm et son pic d'émission à 507 nm.
- Afin de visualiser l' adhérence cellulaire modèle de capturer des images à des grossissements inférieurs, par exemple, 4X ou 10X (figure 4). Afin d'observer l'étalement cellulaire un mag supérieurnification (au moins 100X) est nécessaire - limiter la profondeur de mise au point.
- Pour évaluer davantage l' épandage sur la surface d'échafaudage cellulaire, fixer les cellules avec 4% de formol et de procéder à la coloration de fluorescence conventionnelle des structures cellulaires, par exemple, des filaments d'actine (phalloïdine). Cependant, l' adaptation des temps d'incubation et le marquage fluorescent des anticorps afin d'adapter les caractéristiques d'échafaudage individuels, par exemple, les temps de diffusion ou auto-fluorescence 14.
- Le lendemain, changer le milieu de culture pour éliminer les cellules non-adhérentes.
- Calculer le pourcentage de cellules adhérentes sur l'échafaud par la résazurine mesure de conversion comme décrit dans le protocole 7.

Figure 5: Chronologie de l' essai in vitro (A) Montage expérimental pour le placage des cellules.. (B ) Illustration de la procédure, en insistant sur l' importance du protocole de début et de validation de la fonctionnalité cellulaire jusqu'au jour 7. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
mesure 7. résazurine Conversion
REMARQUE: résazurine essai de conversion est utilisée pour mesurer l'activité mitochondriale et donc indirectement la prolifération cellulaire. Réduction de la résazurine à la résorufine génère un signal fluorescent, qui est basé sur l'activité mitochondriale associée au nombre de cellules viables (Figure 7A).
- Complètement aspirer le milieu de culture des cellules SCP-1 et le jeter dans un conteneur de déchets.
- Laver les cellules SCP-1 une fois avec DPBS pour éliminer les cellules détachées. Ajouter 500 DPBS ul par puits de la plaque de culture tissulaire de 24 puits contenant SCP-1 cellules sur l'échafaud.
- Couvrir les cellules avec un h nécessaireontant de solution de résazurine de travail stérile (0,25% de résazurine dans un milieu de culture) et incuber à 37 ° C dans l'incubateur de culture cellulaire standard (5% de CO 2, 20% de O 2 et 90% d' humidité) pendant 30 min.
- Prenez note que; le temps d'incubation dépend du type de cellule et la densité cellulaire. Elle peut varier entre 10 minutes et 6 heures. temps d'incubation Optimisé pour SCP-1 cellules est de 30 min.
- En tant que contrôle d'arrière - plan, y compris au moins un puits avec la solution de travail de la résazurine , mais sans cellules, qui est mis à incuber à 37 ° C dans l'incubateur de culture cellulaire standard (5% de CO 2, 20% de O 2 et 90% d' humidité) pour le même quantité de temps.
- Transfert 100 ul conditionnés surnageant de chaque puits de la plaque de culture tissulaire de 24 puits dans une plaque à 96 puits.
- Laver les cellules restantes trois fois avec 1 ml DPBS pendant 5 min à température ambiante afin d'éliminer la solution de travail de résazurine résiduel. Après le troisième lavage ajouter un milieu de culture to les implants avec SCP-1 cellules (500 ul par puits de la plaque de culture tissulaire de 24 puits) et poursuivre l' incubation à 37 ° C dans l'incubateur de culture cellulaire standard (5% de CO 2, 20% O 2 et 90% d' humidité) pour d'autres mesures de temps de parcours.
- Assurez-vous de mettre en place réplicats à cette étape (2-4) afin de minimiser les erreurs de pipetage.
- En attendant, placer la plaque à 96 micropuits dans le lecteur de microplaques et de mesurer la fluorescence de la résorufine formée.
- Afin de réduire le signal de fond, de mesurer la fluorescence à une longueur d'onde d'excitation de 545 nm et une longueur d'onde d'émission de 585 nm.
- Vous pouvez également choisir l'excitation adéquate et d'onde d'émission à l'aide de la visionneuse spectrale fluorescence. Résorufine a son excitation de pic à 572 nm et son pic d'émission à 585 nm. L'intensité du signal donné est une moyenne de 25 lectures individuelles (25 flashs par puits).
- Mesurer la fluorineescence de résorufine formée dans un milieu conditionné, en utilisant une optique de fond.
- Prenez note que le gain dépend de la quantité moyenne de résazurine converti et peut varier entre 10 et 4000. Ajuster le gain du lecteur de microplaques individuel utilisé par pipetage une courbe standard de résorufine, de telle sorte que le signal fluorescent est inférieure à 80% de l'intensité maximale du signal détectable (dans ce cas, 20 000). Le gain optimisé pour SCP-1 cellules est de 800.
- Soustraire le signal de fond (résazurine solution de travail sans cellules) à partir du signal des échantillons d'essai.
- En fonction de la configuration expérimentale / fin, procéder à d'autres étapes:
- Calculer le pourcentage de viabilité des cellules sur l'échafaud en utilisant une courbe standard. Faire une courbe standard individuelle séparément pour chaque lignée cellulaire utilisée.
- Analyser la croissance / prolifération cellulaire par l'estimation de l'augmentation relative de la conversion de la résazurine pendant toute la durée de la culture. Pour ce calcul, définissezla conversion de résazurine le jour 1 comme référence. Fraîchement préparer la solution de travail de résazurine pour ce genre d'analyse. En outre, des temps d'incubation doivent être égaux entre les différentes mesures.
- Répétez l'ensemble du protocole de mesure de la conversion résazurine au moins trois fois pour obtenir des résultats cohérents.
8. Coloration en direct mort
- Plaque les cellules SCP1 sur l'échafaud avec une densité de semis de 50.000 cellules / échafaudage et lui permettre de se développer sur l'échafaud en gardant les conditions de culture cellulaire standard (voir protocole 1 et 2).
- Après 24-48 h Aspirer complètement le milieu de culture des cellules SCP-1 et le jeter dans un conteneur de déchets.
- Laver les cellules SCP-1 une fois avec DPBS pour éliminer les cellules détachées. Ajouter 500 ul de DPBS par puits de la plaque de culture tissulaire à 24 puits et incuber pendant 5 minutes à température ambiante.
- Tache SCP-1 en utilisant les fluorophores (les trois taches en même temps):
- À partir de maintenantgarder les échafauds dans l'obscurité afin de protéger le fluorophores blanchiment de la lumière du jour!
- Définir un temps d'incubation de 30 min pour permettre une répartition égale tout au long de l'échafaud. Si le transfert à d' autres échafauds, assurez - vous d'optimiser les temps d'incubation pour adapter les caractéristiques d'échafaudage individuels (taille des pores, la profondeur de l' échafaudage, etc.).
- Afin de détecter les cellules viables sur l'échafaud, colorer les cellules avec calcéine AM à une concentration finale de 2 uM (en milieu de culture).
- Afin de détecter toutes les cellules sur l'échafaud, colorer les cellules avec Hoechst 33342 à une concentration finale de 0,002 pg / pl (en milieu de culture).
- Afin de détecter les cellules mortes, incuber l'échafaud avec éthidium homodimère à une concentration finale de 4 uM (dans un milieu de culture).
- Après le temps d'incubation, laver les cellules 3 fois avec du DPBS (1 ml par puits) pour chaque 5 min à température ambiante.
- Prendre immédiatement l'images en utilisant un microscope à fluorescence.
- Prenez des photos de la calcéine (cellules vivantes) avec une GFP LED cube / jeu de filtres (excitation et d'émission de longueur d'onde de 470/22 nm et 510/42 nm, respectivement). Vous pouvez également choisir une excitation adéquate et d'onde d'émission à l'aide de la visionneuse spectrale fluorescence. Calcéine a son excitation de pic à 488 nm et son émission de pic à 507 nm. Remarque: Assurez-vous de ne pas utiliser les cellules transfectées GFP pour la coloration fluorescente avec calcéine ou d'autres taches fluorescentes vertes.
- Prenez des photos de la Hoechst 33342 avec un DAPI LED cube / filtre défini avec une longueur d'onde d'excitation de 357/44 nm et une longueur d'onde d'émission de 447/60 nm. Vous pouvez également choisir l'excitation adéquate et d'onde d'émission à l'aide de la visionneuse spectrale fluorescence. Hoechst 33342 a son excitation de pic à 347 nm et son pic d'émission à 483 nm.
- Prenez des photos de l'homodimère d'éthidium avec un cube / jeu de filtres DP LED (excitation et d'émission de longueur d'onde of 531/40 et 593/40 nm nm, respectivement). Vous pouvez également choisir l'excitation adéquate et d'onde d'émission à l'aide de la visionneuse spectrale fluorescence. Éthidium homodimère a son excitation de pic à 530 nm et son pic d'émission à 618 nm.
Résultats
Les résultats préliminaires ont montré que le nouvel implant de noyau décrit non seulement a de bonnes caractéristiques d'amortissement, mais aussi est biocompatible avec SCP-1 cellules. Au cours du processus de l'implant de la production, il entre en contact avec des substances solides corrosifs et toxiques (lubrifiant, mordançage solution, électro-polissage). Avec l'aide de techniques indirectes de coloration fluorescente , nous avons pu visualiser les impuretés restantes et par conséquent d' optimiser un protocole de nettoyage montrant une réduction significative de la charge de la substance sur l'échafaud. La figure 3 montre l'efficacité du protocole de nettoyage mis en place.
Le succès des implants utilisés pour le traitement de l' arthroplastie est déterminée par des événements qui ont lieu à l'interface de la cellule-matériau. La figure 4 montre les cellules attachées sur l'échafaud après 24 h de placage, comme décrit dans la section de protocole 6. Une importante transfection efficacité du SCP-1 des cellules a été observé que possible l' image de la structure des cellules précurseurs stromales mésenchymateuses de croissance sur l'échafaud (voir Figure 2). La visualisation directe confirme la biocompatibilité de l'échafaudage et représente également le motif d'adhérence à la surface de l' échafaudage (figure 4). La coloration fluorescente peut être réalisée en outre pour examiner l'interaction cellulaire avec étalement et sur la surface de l'échafaudage.
Fluorophores ont été appliquées avec succès en vue d'examiner la mort cellulaire et la prolifération sur une période de temps sur l'échafaud. Images en direct-dead-coloration montrent comment la coloration peut réussir à se faire sur l'échafaud pour confirmer la pour cent la viabilité des cellules sur une période de temps. La figure 6 montre une coloration nucléaire bleu (Hoechst 3342) dans toutes les cellules, rouge marqué par fluorescence (éthidium homodimère) les cellules mortes et l'étiquetage vert pour l'incorporation de calcéine-AM que la viabilité marker. Calcéine AM est converti en calcéine qui présente une fluorescence vert clair en présence d'ions calcium dans le cytoplasme des cellules. Hoechst 33342 est perméable à la paroi cellulaire et intercale dans l'ADN cellulaire. De cette façon , toutes les cellules montrera noyaux bleu (voir Figure 6). Éthidium homodimère est pas la paroi cellulaire perméable, donc il ne fera que intercalent dans l'ADN des cellules mortes. De cette façon, les cellules mortes montrera noyaux rouges. En outre, la viabilité des cellules et pliez augmentation du nombre de cellules sur échafaudage plus d' une semaine a été quantifiée par résazurine test de conversion et représentés graphiquement (figure 7).

Figure 1: Cellule de comptage avec un hémocytomètre (A) Mise en place d'un ensemble de chambre.. (B) Illustration de comptage des chambres; 4 x 4 chambre de comptage est utilisé pour une cellule de COUnt. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
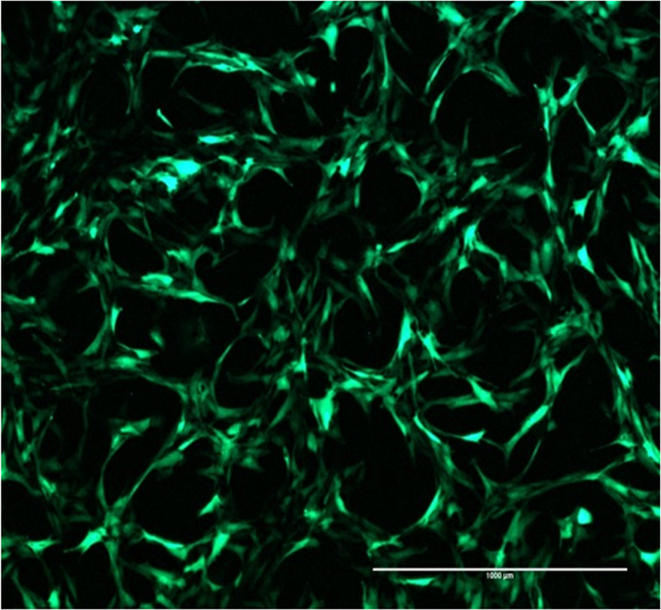
Figure 2:. Efficacité de transfection GFP cellules SCP1 présentent une forte fluorescence verte indiquant positif efficacité ad-GFP transfection. Barre d'échelle = 1000 pm, 4X grossissement. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3: sulforhodamine B coloration des images négatives capture (A) Échafaudages avant de le nettoyer.. La flèche indique la présence de substances toxiques / corrosives sur échafaudage. (B) Échafaudages après le protocole de nettoyage. Barre d'échelle = 1000 pm, 4X grossissement. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
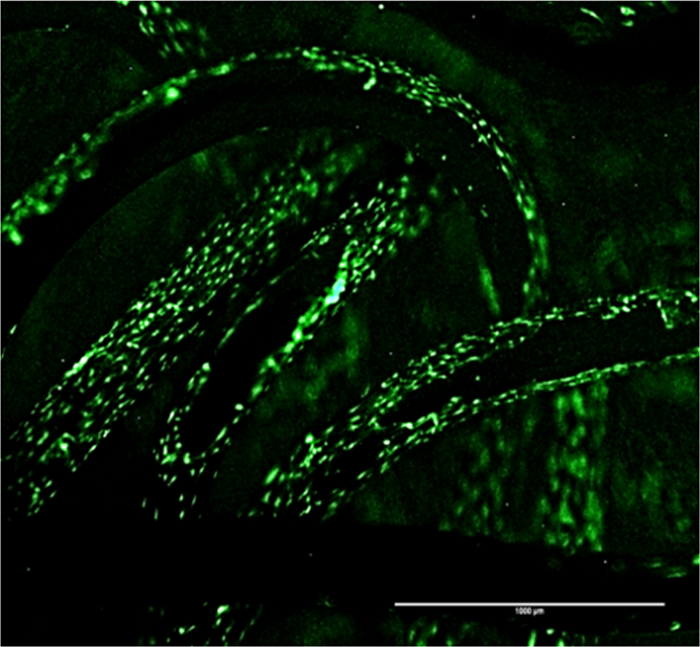
Figure 4:. Motif d'adhérence des cellules sur SCP1 signal GFP échafaudage indique l' adhérence cellulaire et la courbe de croissance sur la surface de l'échafaudage de titane tricoté. Barre d'échelle = 1000 pm, 4X grossissement. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
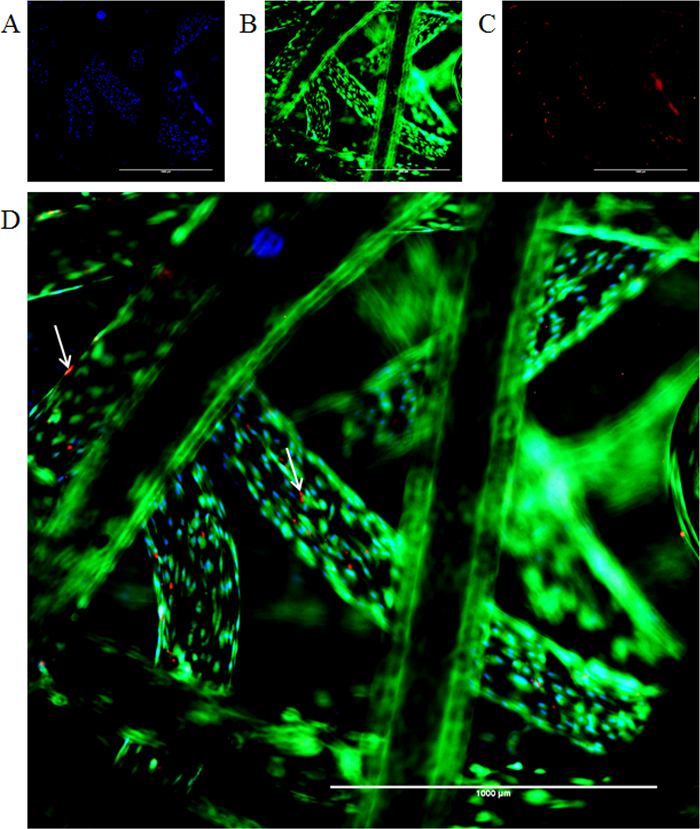
Figure 6: Co-fluorescence coloration des cellules sur échafaudage (. A) La coloration nucléaire Hoechst (bleu) et (B) la coloration cytoplasmique calcéine-AM (vert). (C) La flèche indique la présence de cellules mortes en raison de l' absorption d'éthidium homodimère-1 tache (rouge). (D) montre l'image fusionnée. Barre d'échelle = 1000 pm, 4X grossissement. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
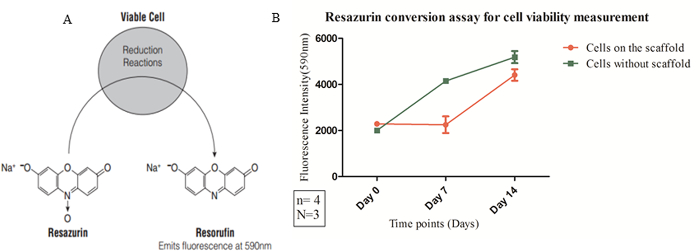
Figure 7: résazurine essai de conversion (A) Biochemical réaction de réduction du colorant redox (résazurine) en un produit final (résorufine) qui émet une fluorescence et subit des changements colorimétriques.. (B) L' activité mitochondriale a été mesurée lorsque les cellules ont été étalées sur 0,75 mg / cm³ échafaudage de densité. Les données ont été recueillies à l'aide fluorescence instrument de mesure sur la base. L'intensité de fluorescence à 590 nm (axe des y) en des points de temps définis (axe des x) est représenté comme un résultat de la mesure quantitative de la viabilité cellulaire (Ex = 540 nm, Em = 590 nm). La signification statistique a été déterminée à l'aide de deux ANOVA et l'erreur standard de la moyenne (SEM) est présentée comme une des barres d'erreur. Compte tenu des propriétés physiques de l' échafaudage, par exemple, la taille des pores et les propriétés mécaniques (par exemple, la fonction d' amortissement) ensemble, 0,75 mg / cm³ échafaudage de densité a été utilisée pour la caractérisation biocompatibilité. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Composants média | La concentration |
| médias Basal aMEM (en%) | 90 |
| Sérum (%) | dix |
| Pen / Strep (%) | 1 |
Tableau 1: culture cellulaire composition (aMEM) Media.
| Problème | Cause | Solution |
| imagerie cellulaire de viabilité sur échafaudage non-transparent | Échafaudages empêche la lumière de pénétrer sans distorsion | Utiliser une technique d'imagerie à base de fluorophores pour l'évaluation de la cellule. |
| L'interférence de l'intensité de fluorescence | fluorescence automatique, signal de fond | Faites attention aux fluorophores et l'utilisation appropriée en fonction des propriétés particulières d'échafaudage. |
| Évaluation de la viabilité cellulaire sur échafaudage au cours d'une période de culture | Rmesures epeated sur une longue période | Transfecter les cellules avec des particules ad-GFP-virus. |
| évaluation de la fonctionnalité de cellule sur échafaudage non-transparent | la technique d'imagerie par fluorescence permet qu'une cellule d'étalement analyse du motif. | Effectuer résazurine test de conversion (quantitative de mesure de la viabilité cellulaire) dans une combinaison avec la technique d'imagerie. |
Tableau 2: Tableau récapitulatif: dépannage de l'imagerie de la viabilité des cellules sur échafaudage non-transparent.
Discussion
La surface de l' échafaudage joue un rôle important dans son interaction avec les tissus environnants in vivo , en déterminant ainsi la longévité des implants fonctionnels. Par conséquent, la biocompatibilité de l'échafaudage est étudié par des essais in vitro en utilisant des cellules (lignée cellulaire SCP1), lorsque plaqué sur les échafauds.
techniques de microscopie qui fonctionnent bien avec échafauds minces et optiquement transparents sont mal adaptés pour les échafaudages non transparents pour étudier la biocompatibilité. Ceci est principalement parce que les échafauds non transparents empêchent la lumière de pénétrer sans distorsion significative 15. Pour surmonter en partie ces problèmes, nous établissons ci-joint une méthode d'évaluation de la cellule sur / dans titane fait échafauds tricotés en utilisant divers fluorophores.
Afin de permettre le tricotage, suivi par le pliage des fils de titane, le matériau vient en contact avec des substances toxiques et corrosifs forts (lubrifiant, mordants, electrosolution), ce qui pourrait altérer la biocompatibilité de l'échafaud si des traces restent dans / sur l'échafaud à polir,. Avec l'aide d'un protocole indirect-fluorescence développé (protocole n ° 5), nous pourrions visualiser la structure d'échafaudage. En outre, les caractéristiques d'échafaudage, par exemple, l'épaisseur du matériau, de la taille individuelle des pores et la forme, ou la densité conjonctifs, ont été analysées en utilisant ImageJ. Une épifluorescence supérieure agrandie image microscopique a permis de visualiser les impuretés dans l'échafaudage, ainsi que sur la surface de l' échafaudage. Figure 3b représente donc le résultat de confirmation du protocole de nettoyage développé avec succès. Le principe de ce protocole de marquage indirect peut être facilement reproduit dans d'autres échafaudages non transparents, en tenant compte des propriétés d'échafaudage individuels, par exemple, la taille des pores et la diffusion correspondante qui affecte le temps d'incubation. En outre, l'auto-fluorescence des paramètres d'échafaudage et microscopique affecte le choix de fluorophores utilisées. La fluorescence de l'outil spectral viewer en ligne peut aider à choisir les fluorophores adéquates.
interaction Cell-métal a été examinée indirectement en analysant le modèle de l'adhérence des cellules sur l'échafaud. Protocole 6 décrit la méthodologie de la façon dont les cellules peuvent être contrôlées in vitro si plaqués sur des échafaudages non transparents dans les systèmes de culture en utilisant une stratégie GFP de transfection. D'après les résultats préliminaires des essais in vitro, il a été prédit que les propriétés de surface telles que la composition, la micro-topographie et la rugosité 16 pourraient jouer un rôle important dans l' établissement de l' adhésion et la propagation des cellules cibles. Le titane étant un biomatériau ainsi pourrait agir comme un modèle de substrat pour fournir la base pour la fixation des cellules (voir Figure 4).
Implant topographie de la surface a été rapportée pour influencer le comportement de la cellule 16. Dans la présente étude, nous avons analysé la croissance cellulaire /la diffusion et la viabilité en utilisant des techniques de coloration par fluorescence en combinaison avec des mesures quantitatives de viabilité. L'analyse a révélé une variation subtile pour cent de la viabilité des cellules et la diffusion en fonction du matériau de l'échafaudage. Cependant, la fonctionnalité cellulaire évaluée quantitativement par dosage résazurine de conversion (activité mitochondriale) n'a pas été affectée de manière significative par le matériau de l'échafaudage. La mesure de l'activité mitochondriale par conversion résazurine présente l'avantage qu'il ne soit pas toxique cellule et peut donc être réalisée de manière répétée sur une période de culture à long terme. Une attention particulière doit être prise lors du lavage hors solution de travail de résazurine résiduelle, afin de ne pas accumuler de signaux d'arrière-plan (résultats faux positifs). Malgré ces avantages, le test de conversion de résazurine ne donnera aucune information sur la cellule d'étalement sur l'échafaud. Les cellules GFP infectées peuvent donc être suivis sur une longue période de culture (signal GFP est resté constant pendant plus de 14 jours), ce qui permet de visualiser smodèle de croissance pécifique sur la surface de l'échafaudage. La visualisation des cellules plus profondes dans l'échafaudage est encore limité par le matériau d'échafaudage, et donc nécessitera une dissection de l'implant. La combinaison de ces deux techniques a le grand avantage qu'il peut être facilement transféré à d'autres types de cellules, étant donné que le temps d'incubation peut être adaptée au type cellulaire d'intérêt. Cependant, le soin doit être pris lors du transfert de cette méthode à d' autres échafauds non transparents, par exemple, le collagène échafauds qui présentent généralement une forte auto-fluorescence verte 17 base. Dans ce cas, d'autres marqueurs fluorescents peuvent être utilisés. La combinaison des deux méthodes ci - dessus mentionnées a donc plusieurs avantages (voir le tableau 2).
Caractéristiques de Scaffold, par exemple, des pores des cellules pourrait piéger de taille à l' intérieur de l'échafaud. Dans le cas contraire suffisamment d'éléments nutritifs sont fournis, ces cellules peuvent mourir et sécrètent des proteases qui affectent la viabilité des cellules de l'entourageing cellules / tissus. Nous avons pu adapter un protocole de coloration fluorescente à base qui est capable de visualiser les cellules vivantes et mortes dans et sur l'échafaud de titane tricoté. Similaire au protocole indirect de coloration par fluorescence, le principe de ce protocole de coloration peut être facilement transféré à d'autres échafaudages non transparents. Ce faisant, les propriétés d'échafaudage individuels, par exemple, la taille des pores et de diffusion correspondant aussi bien que possible auto-fluorescence, réglage microscopique doivent être pris en considération car ils peuvent influer sur le temps d'incubation et le choix de fluorophores utilisé. Ici encore la fluorescence de l'outil spectral viewer en ligne peut aider à choisir les fluorophores adéquates.
En résumé, les résultats in vitro indiquent que le modèle d'implant de noyau proposé de titane tricoté a un profil biologique. fixation initiale des cellules précurseurs mésenchymateuses du stroma (SCP-1 cellules) sur ce matériau indique que le titane matéria d'implant en alliagel est biocompatible. Bien que nous n'avons pas analysé l' association de différents paramètres topographiques, modification de surface d'échafaudage pourrait améliorer l' adhérence des cellules prolifération ainsi que la différenciation 18. Une compatibilité optimale entre échafaudage et les cellules augmenter la probabilité d' une meilleure intégration de l' implant dans le tissu environnant et ainsi l' amélioration de la longévité in vivo après le traitement 19. Utilisation de la configuration de test indiqué ci-dessus ouvre la possibilité de mesurer et de visualiser des améliorations dans la performance biologique de l'échafaudage induite par des modifications de surface. La préférence des échafauds avec une surface bioactive par rapport aux conceptions d' implants non modifiés suggère une meilleure performance 20 en termes d'intégration ostéo-chondrogénique. Cette étude est encore renforcée par d' autres rapports sur l'implant en titane tricoté où ses propriétés mécaniques et bioactivité ont été rapportées 6,7.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun conflit d'intérêts. Aucune partie du travail a été ou est actuellement à l'étude pour publication ou a été publiée ailleurs.
Remerciements
Le projet est financé en partie par Zentrales Innovationsprogramm Mittelstand (ZIM) des Bundesministeriums für Wirtschaft und Energie -KF3010902AJ4. La taxe de publication a été couvert par le traumatisme hôpital BG Tübingen, Allemagne.
matériels
| Name | Company | Catalog Number | Comments |
| 6/24/48 well plates, T25/ T75 culture flask | Greiner Bio-One GmbH | * | |
| * 24 well plates | Greiner Bio-One GmbH | CELLSTAR 662 160 | |
| * 48 well plates | Corning Incorporated USA | 3548 | |
| * 6 well plates | Falcon | 353046 | |
| * T25 | Greiner Bio-One GmbH | 690 175 | |
| * T75 | Greiner Bio-One GmbH | 658 175 | |
| Acetic acid, purum ≥ 99.0% | Carl Roth | 3738.4 | |
| Acetone | Carl Roth | 5025.1 | |
| Axioplan-2 | Carl Zeiss, Germany | ||
| Biological safety cabinets | Thermo Scientific | safe 2020 | |
| Calcein acetoxymethyl ester (calcein AM) | Sigma | 17783 | |
| Cell Culture Incubtator | Binder, Tuttlingen, Germany | 9040-0078 | |
| Filter unit (0.22 µm) | Millipore, IRL | SLGP033RS | |
| Centrifuges 5810 R And 5417 R | Thermo Fisher Scientific, NY | Megafuge 40R | |
| Dimethylsulfoxid (DMSO) | Carl Roth | 4720.2 | |
| Dulbecco’s PBS without Ca & Mg | Sigma | H15-002 | |
| Ethanol 99% | SAV liquid prod. GmBH | 475956 | |
| Ethidium homodimer | Sigma | 46043 | |
| EVOS Fluorescence imaging system | Life technologies | AMF4300 | |
| Fetal Bovine Serum (FCS) | Gibco | 10270-106 | |
| Hemocytometer | Hausser Scientific, PA, USA | ||
| Hoechst 33342 | Sigma | 14533-100MG | |
| Knitted titanium nucleus implant | Buck co & KG,Germany | ||
| MEM Alpha Modification with Glutamine w/o nucleoside | Sigma | E15-832 | |
| Omega microplate Reader | BMG Labtech,Germany | FLUOstar Omega | |
| Penicillin/Streptomycin | Sigma | P11-010 | |
| Resazurin sodium salt | Sigma | 199303-1G | |
| Sulforhodamine B sodium salt | Sigma | S1402-1G | |
| Test tube rotator | Labinco B.V.,The Netherlands | Model LD-76 | |
| TRIS (hydroxymethyl) aminomethan | Carl Roth | AE15.1 | |
| Triton | Carl Roth | 3051.2 | |
| Trypan Blue 0.5% | Carl Roth | CN76.1 | |
| Trypsin/EDTA | Sigma | L11-004 |
Références
- Bridwell, K. H., Anderson, P. A., Boden, S. D., Vaccaro, A. R., Wang, J. C. What's new in spine surgery. J Bone Joint Surg Am. 95, 1144-1150 (2013).
- Adams, M. A., Dolan, P. Intervertebral disc degeneration: evidence for two distinct phenotypes. J Anat. 221, 497-506 (2012).
- Schizas, C., Kulik, G., Kosmopoulos, V. Disc degeneration: current surgical options. Eur Cell Mater. 20, 306-315 (2010).
- Lewis, G. Nucleus pulposus replacement and regeneration/repair technologies: present status and future prospects. J Biomed Mater Res B Appl Biomater. 100, 1702-1720 (2012).
- Cunningham, B. W. Basic scientific considerations in total disc arthroplasty. Spine J. 4, 219-230 (2004).
- Implant for surgical use in humans or vertebrates. US8728164 B2. Google Patents. , (2014).
- Kettler, A., Kaps, H. P., Haegele, B., Wilke, H. J. Biomechanical behavior of a new nucleus prosthesis made of knitted titanium filaments. SAS J. 1, 125-130 (2007).
- Nerurkar, N. L., Elliott, D. M., Mauck, R. L. Mechanical design criteria for intervertebral disc tissue engineering. J Biomech. 43, 1017-1030 (2010).
- Elias, C. N., Lima, J. H. C., Valiev, R., Meyers, M. A. Biomedical applications of titanium and its alloys. JOM. 60, 46-49 (2008).
- Hallab, N., Link, H. D., McAfee, P. C. Biomaterial optimization in total disc arthroplasty. Spine (Phila Pa 1976). 28, 139-152 (2003).
- Gustafsdottir, S. M. Multiplex cytological profiling assay to measure diverse cellular states. PLoS One. 8, e80999(2013).
- Bocker, W., et al. Introducing a single-cell-derived human mesenchymal stem cell line expressing hTERT after lentiviral gene transfer. J Cell Mol Med. 12, 1347-1359 (2008).
- Ehnert, S., et al. Transforming growth factor beta1 inhibits bone morphogenic protein (BMP)-2 and BMP-7 signaling via upregulation of Ski-related novel protein N (SnoN): possible mechanism for the failure of BMP therapy. BMC Med. 10, 101(2012).
- Morgan, S. P., Rose, F. R., Matcher, S. J. Optical Techniques in Regenerative Medicine. , CRC Press. (2013).
- Vielreicher, M., et al. Taking a deep look: modern microscopy technologies to optimize the design and functionality of biocompatible scaffolds for tissue engineering in regenerative medicine. J R Soc Interface. 10, 20130263(2013).
- Curtis, A., Wilkinson, C. Topographical control of cells. Biomaterials. 18, 1573-1583 (1997).
- Niu, G., et al. Fluorescent imaging of endothelial cells in bioengineered blood vessels: the impact of crosslinking of the scaffold. J Tissue Eng Regen Med. , (2014).
- Chan, B. P., Leong, K. W. Scaffolding in tissue engineering: general approaches and tissue-specific considerations. Eur Spine J. 17, Suppl 4 467-479 (2008).
- Navarro, M., Michiardi, A., Castano, O., Planell, J. A. Biomaterials in orthopaedics. J R Soc Interface. 5, 1137-1158 (2008).
- Priyadarshani, P., Li, Y., Yao, L. Advances in biological therapy for nucleus pulposus regeneration. Osteoarthritis Cartilage. , (2015).
- Thermofisher Fluorescence Spectraviewer. , Source: https://www.thermofisher.com/de/de/home/life-science/cell-analysis/labeling-chemistry/fluorescence-spectraviewer.html (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon