Method Article
두뇌 활동의 중규모 넓은 필드 광학 이미징에 대한 큰 측면 개두술 절차
요약
이 프로토콜은 마우스 대뇌 피질의 시간과 정수리 영역에 걸쳐 큰 일방적 개두술을 만들기위한 방법을 제시한다. 이것은 대뇌 피질 반구의 광대 한 지역에 걸쳐 실시간 영상에 특히 유용합니다.
초록
개두술은 생체 실험을 위해 뇌를 노출 일반적으로 수행 절차입니다. 마우스 연구에서 대부분의 실험실은 작은 개두술, 일반적으로 3mm X 3mm를 사용합니다. 이 프로토콜은 마우스 시간적 두정 피질 위에 대뇌 반구의 대부분을 노출시키는 대략 큰 7mm × 6 mm 두개 창을 생성하는 방법을 소개 (- 폭 4.5 mm - 0 6mm 예 2.5 정수리). 이 수술을 수행하려면, 머리는 약 30 ° 기울어해야하며, 시간적 근육의 대부분은 철회되어야한다. 때문에 뼈 제거의 많은 양이 절차는 수술과 실험을하는 동안 마취 동물 급성 실험을위한 것입니다.
혁신적인 많은 측면 창 두개의 주요 장점은 피질 모두 내측 및 외측 영역에 대한 동시 액세스를 제공하는 것이다. 이 대형 일방적 두개골 창은 세포 사이의 신경 역학을 연구하는 데 사용할 수 있습니다,다 전극 전기 생리 학적 녹음, 신경 활동 ( 예 : 내인성 또는 외인성 영상)의 영상화, 및 광 생성 자극을 조합하여 다른 피질 영역 사이에서도 가능합니다. 또한,이 큰 craniotomy은 대뇌 피질의 vasculature의 직접적인 조작을 허용 대뇌 피질 혈관의 큰 영역을 노출합니다.
서문
개두술 뇌의 일부분을 나타 내기 위해 신경 과학자들에 의해 사용되는 표준 절차이다. 전기 생리학의 새벽 이후, 개두술는 신경 과학 분야에서 전례없는 혁신을 허용했다. 전극 대뇌 피질의 밀도 매핑은이지도를 기반으로 실험 테스트 가설과 이론을 주도하고있다. 우리는 최근 개두술이 노출 된 영역 (5, 6), (7) 내 피질 활성의 실시간 시각화를 가능 피질 혈류 1, 2, 3 및 신경 혈관 구조 (4)의 생체 내 촬영에 이용되는 새로운 시대를 입력. 많은 연구 구조 및 피질 뉴런, 아교 세포의 기능 및 고전 공부 생체 내 광 이미징 기술과 결합 craniotomies를 사용하지만tical 혈관 (8, 9), 상기 조사에 노출 피질의 작은 면적에 의해 제한 (그러나 10 참조)된다.
이 프로토콜의 목적은, 넓은 측면 개두술을 만드는는 squamosal 뼈 정중선에서 대뇌 피질을 노광 및 브레 그마 및 람다 넘어 연장하는 방법을 제공하는 것이다. 이 대형 개두술 동시 연관 피질의 시청 (retrosplenial,에 cingulate 및 두정엽), 주 및 보조 모터, 감각, 시각 및 청각 피질 수있다. 이 방법은 이전 피질 영역 자발적 자극 유도 활성 피질 5, 11, 12 중 서로 어떻게 상호 작용 하는지를 조사 여러 전압 감응 염료 영상 (VSDI)와 결합하고있다. 이 절차의 가장 어려운 부분은 머리의 위치를 포함동물의 헤드 판을 고정하고, 마루 뼈로부터 시간적 근육 분리 동안 출혈을 방지. 치료는 비스듬한 각도로 두개골 커브로 드릴링과 두개골의 제거 과정에서주의해야한다.
프로토콜
다음 프로토콜은 레스 브리지 동물 관리위원회의 대학 (ACC) 가이드 라인을 다음과 동물 관리에 캐나다위원회 (CCAC)의 기준에 따라 수행한다.
1. 준비
- 장기간의 연구 기간 동안, 열려있는 모든 수술 소모품을 압력솥하고 불임 수술 동안 유지되어 있는지 확인합니다. 여러 수술이 필요한 경우 수술 사이의 오토 클레이브.
- 한편 뇌 버퍼 많은 (적어도 50 ㎖)가 확인. 용액은 134 mM 염화나트륨, 5.4 mM의 칼륨, 1 mM의 염화 마그네슘 육수화물, 1.8 mM의 염화 칼슘 이수화 물, 및 5 mM의 HEPES 나트륨, 5 M 염화수소 7.4 평형 pH가 이루어진다.
- 유도 챔버에 놓고 마우스를 마취 3 - 4 % 이소 플루 란. 수술하는 동안 유지 보수를 위해 2.0 %의 이소 플루 란 - 1.0 따릅니다. 영상 중 0.8 % - 또한 낮은 0.4로 감소S = "외부 참조"> 5, 13, 14, 15, 제공된 적절한 마취를 유지한다. 마취의 이러한 낮은 수준은 고통스러운 자극에 areflexic 유지하기 위해 마우스 (약 5 분마다)의 경계 빈번한 모니터링이 필요합니다.
참고 : 탈수 마우스의 부피 비율로 인해 높은 표면에 문제가되고 이소 플루 란의 장시간 사용에 의해 악화 할 수 있습니다.- 2 시간 - 식염수 피하 주사, 10 g의 체중 당 0.1 ㎖, 1 매 사용한다. 2 시간 - 충분히 수화 때 마우스마다 한 번씩 1 소변됩니다.
- 밀접하게 수술과 영상 전반에 걸쳐 일관된 마취을 보장하기 위해 마우스를 모니터링 할 수 있습니다. 무인 마우스를두고는 의식을 회복하지 않도록주의를하지 마십시오.
- 37 ℃로 설정된 항온 조절 가열 패드에 머리 홀더 설정 장소로 마취 된 마우스의 이동. 상단 TEET 보안치아 홀더 시간.
- 약 30 °가 머리의 오른쪽 측면을 노출 왼쪽 방향으로 마우스의 머리를 돌려 귀 바 (그림 1A)의 뭉툭한 끝으로 마우스의 머리를 고정합니다.
- 각막 건조를 방지하기 위해 안과 연고를 적용합니다.
- 뇌부종을 줄이기 위해, (4 밀리그램 / kg)을 근육 주사 덱사메타손.
- 4 % 클로르헥시딘 (3 회) 및 70 % 에탄올 (3 회)에 담근 면봉으로 외과 영역에 걸쳐 피부를 닦아주십시오. 한 번만 각 면봉을 사용합니다.
- 돈 수술 장갑 및 접착제 플라스틱 포장으로 동물을 커버한다. 리도카인 주사하여 마취를 제공 (8-10 ㎎ / ㎏, 2 %의 에피네프린) 피하 개두술 사이트 위에. 약물이 조직에 흡수 될 때까지 5 분 - 3 기다립니다.
2. 피부를 제거하고 두개골에서 근육을 철회
- 아래에있는 A 두개골을 보는 동안 거의 모든 절차를 수행해부 현미경 (예 : 0.7 - 4.5X 전력, 상황에 따라).
- 집게로 (단지 귀 뒤에) 정중선의 왼쪽 피부 1mm를 들어 올려 수술 가위로 작은 수평 절개를합니다.
- 오른쪽 귀쪽으로 6mm 측면 절단하고 머리의 주동이의 끝으로 컷 - 5합니다.
- 초기 절개 시점에서, 가위를 삽입하고 rostrally 10mm를 잘라.
- 오른쪽 귀 주위의 피부를 잘라 오른쪽 눈 근처에 두개골과 시간적 근육의 오른쪽을 노출 할 수 있습니다. 노광 영역의 가장 넓은 부분에 적어도 7mm 인 것을 확인. 수술 영역을 확장해야 할 경우 더 피부를 낸다.
- 두개골과 피부 사이에 부틸 시아 노 아크릴 레이트 접착제의 몇 방울을 넣어 절개 주위의 피부를 수정합니다. 조직을 확인하는 것은 이전에 접착제의 효능을 증가시키는면 팁 어플리케이터 롤 또는 조직으로 건조되었다.
- 면봉을 사용하여 표면을 문질러원 운동에 두개골의 두개골에서 골막을 제거한다. 아무도 완전히 두개골을 건조하여 남아 있는지 확인합니다.
- 스프링 가위 집게를 사용하여, 두개골에서 시간적 근육 분리; 잘라는 squamosal 뼈 (그림 1C)를 도달 할 때까지 옆으로 근육을 수축. 눈 근처는 squamosal 뼈의 수준을 따라 실행하는 표면 시간적 정맥이 손상되지 않도록 세심한주의를 기울 그렇지 않으면 발생할 수있는 출혈.
- 제어 겔 발포체 뇌 완충액에 미리 침지 출혈. 심각한 출혈의 경우 열 cauterizer를 사용합니다. 열 cauterizer 치료 다음과 출혈 사이트에 부틸 시아 노 아크릴 레이트 접착제를 삭제합니다. 영역은 접착제의 효능을 증가시키는면 팁 어플리케이터 롤 또는 직물을 이용하여 미리 건조 확인.
3. 개두술
주 : 외과 의사는 두개골 제거하는 동안 부지런을 유지해야하며,두라는 불필요한 합병증을 방지 할 수 있습니다. 문제 해결 단계는 합병증이 발생해야 포함되어 있습니다.
- 브레 그마 마크의 위치에 미세한 팁 마커 또는 하부 뇌 영역의 방향을 (도 2A)를 소형 삼각형 조각 테이프를 절단 정수리에서 코너 포인트 중 하나.
- 헤드 플레이트를 부착하기 전에 두개골이 완전히 건조되어 있는지 확인합니다. 더 건조가 필요한 경우 뇌 완충액에 침지 겔 발포체의 도포 후에, 목화 팁 면봉을 사용하여 두개골 빠르게 공기 건조한다. 이 단계는 헤드 고정 플레이트 (도 1b)에 매우 중요하다.
참고 :이 골막 왼쪽 두개골에, 또는 두개골 머리 판에 접착 전에 건조하지 않은 경우, 그것은 분리 가능성이됩니다. 이 경우, 부드럽게 머리 판을 제거하고 다시 시작. 이 과정에서 발생할 수있는 출혈; 이 응고 할 몇 분을 허용하고 부드럽게 제거합니다. 이 과정은 두 번 이상 반복하지 않는 것이 좋습니다. <리> 헤드 판 (16)의 하단 주위에 에틸 시아 노 아크릴 레이트 접착제를 적용하고 영역 개두술 (도 1d 및도 2a) 위에 헤드 판 접착제. - 치과 용 시멘트 만 개두술 영역 노출 떠나는 두개골 및 헤드 판의 개방 공간을 채운다. 10 분 (도 2B) - 치과 건조 시멘트 경화 일반적 5 기다린다.
- 시멘트가 설정되면, 간단히 뇌 버퍼 웰을 채우는 3 담가 있도록 - 5 분. (그림 2C)를 시추하기 전에 뇌 버퍼를 제거하는 압연 조직을 사용합니다.
- 가볍게 치과 드릴로 두개골의 표면을 득점하여 수술 영역을 설명합니다. FG ¼ 버로 (20 PSI의 최대로 설정) 공기 드릴을 사용하여 가변 속도 풋 페달로 제어.
- 부드럽게를 깊게하는 원래의 점수를 따라 드릴을 추적, 전자드릴을 nsuring하면 뇌 (그림 2D)에 두개골을 관통하지 않습니다. 테이크는 드릴링 및 적신 압연 조직으로 두개골 표면을 뿌리며 마치 사이 몇 분 간격으로 변합니다. 이것은 기계적 마찰 장기간 노출 두개골의 가열 건조를 감소시킬 것이다.
참고 : 두개골 신속하게 젖은 젤 폼의 응용 프로그램 후 공기 건조합니다. 더 건조가 필요한 경우,면 팁 면봉을 사용합니다.
주의 : 두개골 두께가 고르지입니다. 두개골의 정중선 가까운 영역과는 squamosal 최적 비교적 얇고 예를 들면, 정수리 시간적 리지는 가장 두꺼운 영역이다. - 시추하는 동안 주기적으로 부드럽게 집게 또는 비 이동 드릴 비트와 함께 눌러서 두개골의 좌굴을 확인합니다. 뼈 버클하기 시작하면, 드릴링을 중지하고 뇌 버퍼의 전체 창을 담그지.
참고 : 혈액이 지역에서 러시 경우는 경막이 손상되었다는 것을 제안 할 수 있습니다. 이 경우, 주사 전자 현미경 (SEM)을 배치전 습윤 영역 위로 겔 발포체 부드럽게면 팁 면봉 겔 발포체에 압력을인가하면서 혈액을 흡수하려고. - 뼈를 부드럽게하고 두개골 제거 프로세스를 쉽게 만들기, 뼈에 부착 경질 가능성을 줄이기 위해 두개골을 제거하기 전에 최소 5 분 동안 기다립니다.
- 두개골은 뇌 버퍼에 잠긴 상태에서 두개골 제거 프로세스를 수행합니다.
참고 : 두개골의 일부가 완고하게 부착 된 상태를 유지한다면, # 11 메스 블레이드가 부드럽게 두개골을 득점하는 데 사용할 수 있습니다. 두개골을 통해 뇌에 블레이드를 뚫지하기 위해 세심한주의를 기울입니다. - 앞쪽 가장자리에서 시작, 부드럽게 집게를 사용하여 경질의 느슨한 두개골을 들어 올립니다.
참고 : 출혈의 작은 금액이 두개골 제거 과정에서 발생하는 경우, 전송 피펫 또는 주사기로 버퍼를 제거한 다음 새로운 버퍼로 교체. - 뼈가 느슨하고 나면 집게로 뼈, 경막에 단단히 그립을 "부동"과에서 뼈를 들어 올려두라. 뼈는 결코 뇌에 침투 없어야합니다.
- 출혈을 제어하기 위해 점으로 조직의 모서리를 굴려 두개골 우물에서 버퍼의 대부분을 제거합니다. 목화 팁 면봉으로 매우 가벼운 압력을가하면서 빠르게 출혈 영역 겔 발포체 완충액에 미리 침지를 적용한다.
참고 : 출혈은 일반적으로 뼈 또는 경질의 표면의 가장자리에서 온다; 두 경우 모두 정상이며, 더 중요한 혈관이 손상되지 않은 경우 출혈은 빨리 중지됩니다. 출혈이 계속되면 혈액 이미징 영역 위에 응고 시트를 형성 창 전체를 채울 수도있다.- 조심스럽게 응고 시트를 제거하고 파열 된 혈관의 소스 주위 그대로 혈액 응고를 유지하면서 이미징 영역에서 응고 된 혈액의 조각을 선택합니다. 이 훨씬 더 많은 혈액 손실의 원인이 될 수 있습니다 블리드 소스에서 혈전을 제거하지 않도록주의하십시오. 모든 혈액을 씻어 뇌 완충액으로 뇌의 표면 관개.
- 에 손이 닿지 않도록주의하십시오민감한 뇌 조직 또는 이물질을 뇌에 추가; 출혈이 멈출 때까지 약 2 ~ 5 분 동안 반복하십시오 ( 그림 2E ).
참고 :이 시점에서 craniotomy는 cranial 창을 준비 (5 단계 참조) 준비가되었습니다. 필요한 경우, 두개골 창을 이식하기 전에 경질을 제거하십시오 (4 단계 참조).
4. 두라 제거
참고 : Dura 제거에는 극도의주의가 필요하며 15 분 이상 걸릴 수 있습니다.
- craniotomy에서 초과 버퍼를 멀리합니다. 촉촉한 표면을 유지하면서 집게로 작은 경질의 조각을 잡고 경질을 부드럽게 찢어냅니다.
- 경도를 부드럽게 찢어 내고 자르기 위해 집게와 스프링 가위를 사용하십시오.
- 뇌의 표면에 더 많은 뇌 완충액을 떨어 뜨려 두라를 부 풀려 두뇌와 분리되게하십시오. 모든 두라가 두개골 창 사이트에서 제거 될 때까지 계속하십시오. 정확하게 수행하면 두뇌가 뚜렷한 bl로 매우 깨끗하게 보입니다.짐 우드 선박없고 결점 (2 층 그림의 2E를 비교).
주의 : 경질의 일부 지역 (정수리 협회 지역의 중간 선 근위 근처 예) 뇌의 표면에 작은 동맥에 연결되어, 이러한 제거는 세동맥을 파열 할 수 있습니다. 이러한 경우, 세동맥의 정상에 그대로 두라의 작은 조각을 떠나 더 좋을 수 있습니다. 변속 드라이브는 작은 면적을 통과하지 않을 수도 있지만, 이는 대 출혈을 갖는 것이 바람직하다. - 빨리 맥동으로부터 이동을 최소화하고 상기 팽윤 방지 가능한 아가 뇌 표면을 수정 (공정 5 참조).
5. 두개골 윈도우 준비
- 70 % 에탄올로 커버 유리를 스프레이 가볍게 건조 공기를 사용하는 용기. 유리가없는 점이나 먼지가 존재하는 완전히 깨끗한 확인합니다.
- 뇌 완충액 15 ㎖에 녹이고 아가 분말 200 mg을 가열하여 1.3 % 아가로 오스를 준비한다. 전자 레인지, 설정모든 한천이 녹을 때까지 한 번에 10-15 초 동안 고온에서 열을 가하여 부드럽게 저어 준다.
참고 : 이미징을 방해 할 수 있으므로 거품이나 입자가 없어야합니다. - 뜨거운 아가로 오스에 온도계를 놓고 응고 온도 (~ 40 ° C) 바로 위까지 아가로 오스를 식힌다.
참고 : 아가로 오스 용기 바깥쪽으로 시원한 물을 흐르게하면 냉각 과정이 빨라질 수 있습니다. 거품이나 미립자가 없도록 부드럽게 계속 저어줍니다. - 한천을 적용하기 직전에 두개의 우물에서 뇌 완충제를 제거하십시오. 전달 피펫으로 아가로 오스를 작성하고 직접 아가로 오스를 두뇌에 떨어 뜨립니다. 커버 슬립을 표면 위에 빠르게 놓고 커버 슬립을 모서리에 아가로 오스 방울로 고정하십시오.
6. 안락사
참고 : 우리의 경험에 따르면,이 절차는 90 % 이상을 달성하기 위해 경험이 풍부한 외과 의사에게 최소 3 ~ 4 번의 수술을 필요로합니다.성공률. 경험이 적은 의사는 더 많은 연습이 필요할 수 있습니다. 개두술 또는 durotomy 동안, 뇌는 뇌에 뼈를 통해 드릴 펀치처럼 손상을 유지 할 수 있습니다. 개두술의 가장자리에 약간의 손상이 허용 될 수 있습니다. 뇌가 밝은 빨간색 손상되지 않은 혈관과 흰색 피질과 "깨끗한"보이지 않는 경우, 실험 종료해야 할 수도 있습니다. 불량한 제제의 예는 데드 혈관을 가진 것들을 포함하거나, 외피가 찢어 지거나 손상된 혈관 표시됩니다. 이러한 징후가있는 경우, 실험은 가능성 높은 품질의 데이터를 얻을 것입니다. 수술 / 실험의 성공 여부와 관계없이 인도적으로 실험이 완료 마우스를 안락사.
- 깊이 적어도 3.5 % 이소 플루 란 마취. 다음에, 300 ㎎ / ㎏에 펜토 바르 비탈 나트륨의 복강 내 주사를 준다. 바늘간에 삽입되는 경우 이상적 죽음은 매우 급속한 (<1 분) 일 것이다.
- 관류가 필요한 경우, 진행하기 전에 동물이 깊이 마취되었는지 확인하십시오 (1.3 단계 참조).
- 또는 관류가 필요하지 않은 경우 최소 5 분 동안 기다린 다음 마우스가 죽었는지 확인하십시오. 호흡, 심장 박동, 통증 철수 및 각막 반사가 없는지 확인하십시오. 또한 말단의 엷은 청색 / 백색 채색 및 피질에 대한 혈관의 어둡기를 관찰하십시오.
결과
한쪽 반구 내 대뇌 피질 부위 사이의 상호 작용을 연구하기 위해 우리는 시상 정맥동과 5 - 6 mm 측면을 가로 지르는 큰 두개 절개술을 사용했습니다. 이 두개골 창은 우뇌 반구의 일차 (모터, 체성 감각, 시각, 청각), 이차 (운동, 시각) 및 연관 (후퇴, 대뇌 피질, 정수리 연합) 피질을 포함했다 ( 그림 3A ). 이 연구에서 우리는 막 전위의 변화를 반영하는 전압 감응 형 염료 (VSD) 이미징을 사용했습니다 3 . 이 프로토콜은 다른 외인성 ( 예 : 칼슘 17 및 글루 탐 산염 18 이미징) 또는 내장 이미징 실험에도 유용합니다. 0.5 % isoflurane을 사용하여 가볍게 마취 된 마우스의 뒷다리, 앞다리, 수염, 시각 또는 청각 시스템을 자극 할 때 우리는 대뇌 피질의 탈분극에 대한 일치 패턴을 관찰했습니다 (>도 3b). 이전의 연구와 일치 5, 19, 20, 21, 22, 우리는 C2 배럴 피질 간략한 촉각 자극 일차 감각 영역의 활성화뿐만 아니라 기능적으로 관련된 영역 내에서 반응의 "섬"을 이끄는 것으로 나타났다. 예를 들어, 일차 운동 피질 (M1) 또는 체성 감각 피질 이차 표현 (S2도 3Bi). 단일 한 MS 톤 PIP (25 KHZ) 자극은 기본 청각 피질 (A1) 약 20 밀리 청각 자극 (도 3Bii) 후에 활성화되었다. 다음 몇 밀리 초 동안, 탈분극은 청각 피질에 걸쳐 확산과 이웃 차 체성 감각 피질에 전달. 약 25 밀리 톤 발병 후 2 차 대뇌 피질의 탈분극 1.0 위치한 나올 것입니다7; 0.2 mm의 내측 1.9 ± 0.1 mm의 후방 상대 (N = 9 쥐) 정수리한다. 이것은 약 정수리 연결 영역 (PTA)의 위치이다. 변속 드라이브 신호는 다른 연합 피질 영역이 retrosplenial (RS)을 포함 위치 중앙선 영역 및 피질 (CG)에 전파. 따라서, 청각 자극은 VSD에서 탈분극 확산 진행파 정중선 피질 내의 더 큰 영역을 두 개의 분리 된 초점 영역의 활성화되었다. 1 밀리 녹색 반대편 눈의 초점 자극 펄스를 LED (40) MS (도 3Bv) 내의 일차 시각 피질의 활성화되었다. 시각 피질이 활성화가 기본으로 하였다 : 내측에 위치한 인접 영역으로 VSD 탈분극 (1)의 공간 확장, 측방, 및 초기 작동 영역 앞쪽; (2) 제 내측 외피 영역의 약 50 밀리 탈분극 자극 (N = 8 개 실험) SA를 따라 위치 후에 gittal 봉합. 이 감각 앞다리의 자극 (도 3Biii), 뒷다리 (도 3Biv), C2 위스커 또는 시청과 유사 하였다. 자극 후 40 밀리 - 앞다리, 뒷다리 또는 시청의 감각 자극으로부터 유발 VSDI 반응은 초기의 활동 이방성 확산뿐만 아니라 약 20 피질의 정중선을 활성화 한 다음, 각 일차 감각 피질을 활성화. 이 결과는 시각적 자극 위스커의 반응과 유사 하였다. 운동량 6함으로써 이러한 중심선 경로와 동일한 영역의 빈번한 활성화 따른 감각 유발 활성의 전파는이 영역 감각 정보가 자발적 피질 활성 통합 수있는 마우스 피질의 접속 코어의 중앙 허브 것을 제안 할 수있다.
2fig1.jpg "/>
그림 1. 수술 설치 및 준비. (A) 마우스 머리, 정화, 면도 측면 노출 약 30 ° 회전하고, 귀 바의 뭉툭한 끝 부분에 고정되어있다. 이소 플루 란 마취는 노즈 피스와 치아 홀더를 통해 전달된다. 마우스가 증가 불임과 따뜻함에 대한 자체 접착 비닐 랩으로 덮여있다. (B) 근접 나타내는 피부 정수리 두개골 플레이트로부터 제거 골막은 시간적 근육 그대로이다. (c) 상기 시간적 근육 시간적 플레이트는 squamosal 뼈를 노출이 제거되면, 표면 정맥 손상에 참고. 정착 이전에 (D)는, 헤드 판은 왁스 정확한 위치에 배치된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
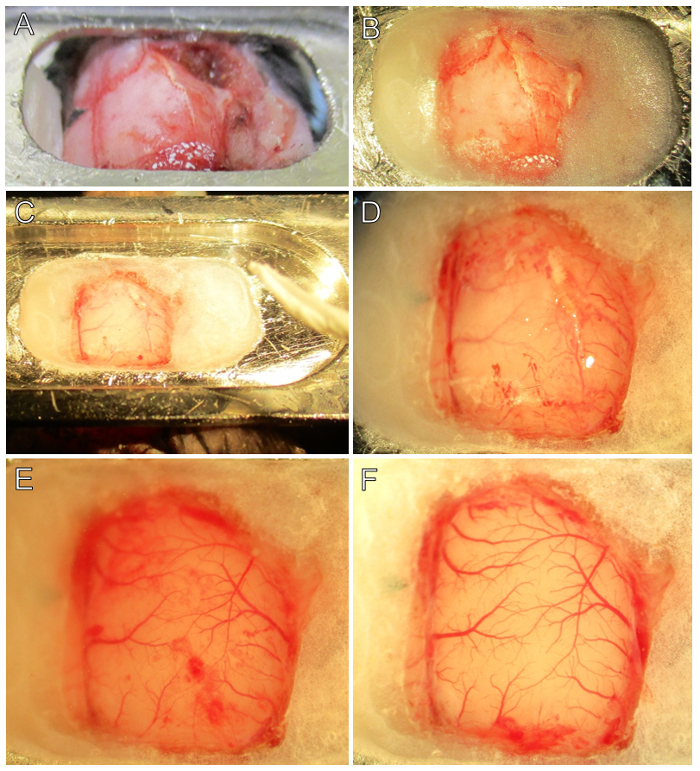
그림 2. 단계별 수술. (A)를 헤드 플레이트는 전방 및 후방 위치에서 에틸 시아 노 아크릴 레이트 접착제와 두개골에 부착된다. 브레 그마의 위치 (삼각형 테이프의 검은 부분)를 참고. (B) 뇌 윈도우는 헤드 플레이트와 두개골 사이 육화 치과 시멘트를 도포하여 제조된다. 그 정수리를 기록하고는 squamosal 랜드 마크가 계속 표시됩니다. 시멘트 건조 이하의 (C)는, 뇌 버퍼 두개골을 부드럽게하고 경질의 부착을 방지하기 위해 첨가된다. 롤형 조직 드릴링 이전에 뇌 버퍼를 제거하는 데 도움이 될 것입니다. (D)가 개두술의 가장자리가 획득되었다. 혈관이 더 쉽게 치과 시멘트 가장자리 근처 박형 뼈를 통해 볼 수 있습니다. (E)과 시간적 정수리 두개골 플레이트 remov왔다ED 및 경질 볼이다. 정상적인 작은 출혈의 경질에 혈액의 결점을합니다. 2 미만 신중한 검토 - 4X 배율 혈관 2 층, 경질의 하나와 PIA의 다른 공개한다. (F)가 경질는 원시 피질을 드러내는 제거된다. Pial의 혈관은 현재없이 결점 빨간색 밝습니다. 두개골 윈도우의 가장자리에 화이트 컬러 경질의 부유 조각을합니다. 이 예에서 빠르게 응고 두개골 윈도우의 후방 부에서 작은 경막 출혈이 있었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
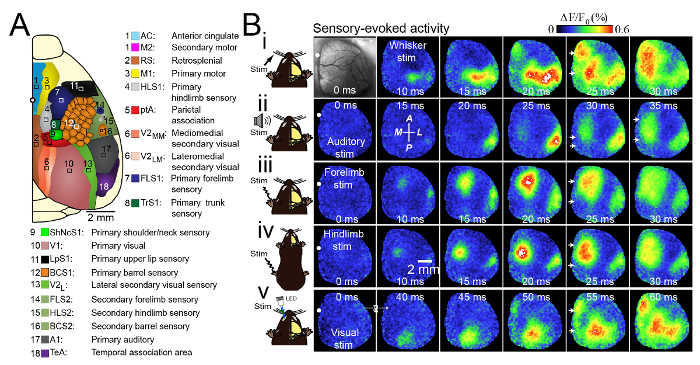
그림 3. 감각 자극의 여러 양식 중 독특하고 합의 활성화 패턴. < / strong> (A) 영상화 된 피질 영역을 보여주는 일방적 인 craniotomy의 도식. (B) 각 이미지에 흰색 원으로 표시 bregma와 넓은 일방적 craniotomy의 photomicrograph. 피질 활성화의 패턴은 반대쪽 C2 위스커의 자극 (자극), (ⅱ) 청각 자극, (ⅲ) 대 측성 forelimb 자극, (iv) 대 측성 뒷다리 자극 및 (iv) 후 isoflurane 0.5 %로 마취 된 마우스에서 나타납니다. (v) 발광 다이오드 (LED)로 반대쪽 눈의 시각적 자극. 일차 감각 피질 활성화 후 10-25 ms에 모든 형태의 감각 자극 (흰색 화살표) 후에 정중선 활성화가있었습니다. 응답은 20 가지 시도의 평균입니다. 두 번째 줄 (ii)의 왼쪽에서 두 번째 이미지는 전방 (A), 후방 (P), 중간 (M) 및 측면 (L) 방향을 나타냅니다. Mohajerani, et al., 2013의 허가를 받아 수정 됨.p_upload / 52642 / 52642fig3large.jpg "target ="_ blank "> 검색이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
큰 두개 창 혁신적인 프로토콜은 대뇌 피질의 시간적 정수리 부분 위에 동시 촬상을 가능하게한다. 광학 영상과 결합하여, 그 자발적 자극 유도 활성 영역 중에 피질 내의 신경 동성을 나타 내기 위해 도움이 될 수 있습니다. 이 넓은 개두술 또한 혈류와 허혈성 모델 외측 용기 직접 조작의 생체 내 이미징 있도록 중간 대뇌 동맥 (MCA)의 기단부를 포함한 피질 혈관계 네트워크의 큰 신장을 노출시킨다. 이 기술은 전압 및 칼슘 표시기 단백질 (23)을 표현하는 쥐의 최근 개발 라인을 위해 잘 사용 될 것입니다. 이 마우스는 피질에 전압에 민감한 염료를 배양의 필요성을 우회의 실질적인 이점을 제공합니다. 이러한 외부 염료는 적절하게 뇌 조직에 침투 시간이 걸릴 (~ 60-90 분)과 온화한 독성에 의해 제한됩니다. 대형 craniotomies도 있습니다이전에 VSDI (11)와 함께 개발 쥐의 뇌를 연구하기 위해 사용되었다. 신생아 쥐 훨씬 더 큰 머리를 가지고 성인 마우스와의 크기 비교입니다. 이 형질 전환 마우스하지 불구하고, 신경 과학의 발달 문제를 연구하는 독특한 기회 연구자를 제공한다.
이 방법의 가장 큰 제한은 만성 실험에 대한 무능력이다. 두개골의 곡률은 시추 과정이 더 도전하게하고 시간이 작은 craniotomies보다 많이 소요. 이 대형 개두술 들어, 렌즈의 초점 평면에 평행하게 중심 봉합사는 squamosal 최적으로 헤드를 배치하는 것이 중요하다. 뇌의 일부 왜곡은 뇌의 곡률 예상되지만, 이러한 피질의 표면층에 집중하여 해결한다. 이 문제는 더욱 자극 평균화 많은 반복을 구함으로써 완화된다. 요약하면, 우리의 큰 개두술 기술은 널리 응용 프로그램입니다신경 생물학에서 현재 문제의 연구 licable.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 자연 과학 및 캐나다의 공학 연구위원회 (NSERC) 디스커버리 부여 # 40352에 의해 지원되었다, 캠퍼스 MHM에 혁신 프로그램 의자, 앨버타 알츠하이머 연구 프로그램에 대한 앨버타, 및 NSERC는 MK에 BIF 박사 교제와 AIHS 대학원 교제 CREATE. 우리는이 프로토콜의 개발 및 수술 훈련 푸 민 왕 감사하고, 베루 미르자 아그와 디 샤오 사육.
자료
| Name | Company | Catalog Number | Comments |
| Heating Pad | FHC | 40-90-2 | |
| Fine Scissors | Fine Science Tools | 14058-09 | |
| Forceps | Fine Science Tools | 11251-35 | 2 or more pairs are recommended |
| Spring scissors | Fine Science Tools | 15000-00, 15000-10 | 1 pair should be designated for dura removal |
| Jet tooth shade powder | LANG Dental | Jet Tooth Shade Powder | to be mixed with the Jet Liquid |
| Jet tooth shade liquid | LANG Dental | Jet Tooth Shade Liquid | to be mixed wihth the Jet Powder |
| Drill Heads - Carbide Burs FG 1/4 389 | Midwest Dental | 385201 | |
| Agarose Powder | Sigma-Aldrich | A9793 | |
| Gelfoam | Sinclair Dental Canada | Pfizer Gelfoam | |
| Isoflurane | Western Drug Distribution Centre Ltd | 124125 | |
| Lidocaine 2% Epinephrine | Western Drug Distribution Centre Ltd | 125299 | |
| Dexamethazone 5 mg/mL | Western Drug Distribution Centre Ltd | 125231 | |
| Butyl cyanoacrylate glue (VetBond) | Western Drug Distribution Centre Ltd | 12612 |
참고문헌
- Sigler, A., Mohajerani, M. H., Murphy, T. H. Imaging rapid redistribution of sensory-evoked depolarization through existing cortical pathways after targeted stroke in mice. Proc Natl Acad Sci U S A. 106 (28), 11759-11764 (2009).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32 (7), 1277-1309 (2012).
- Grinvald, A., Hildesheim, R. VSDI: a new era in functional imaging of cortical dynamics. Nat Rev Neurosci. 5 (11), 874-885 (2004).
- Blinder, P., Shih, A. Y., Rafie, C., Kleinfeld, D. Topological basis for the robust distribution of blood to rodent neocortex. Proc Natl Acad Sci U S A. 107 (28), 12670-12675 (2010).
- Mohajerani, M. H., et al. Spontaneous cortical activity alternates between motifs defined by regional axonal projections. Nat Neurosci. 16 (10), 1426-1435 (2013).
- Mohajerani, M. H., McVea, D. A., Fingas, M., Murphy, T. H. Mirrored bilateral slow-wave cortical activity within local circuits revealed by fast bihemispheric voltage-sensitive dye imaging in anesthetized and awake mice. J Neurosci. 30 (10), 3745-3751 (2010).
- Lippert, M. T., Takagaki, K., Xu, W., Huang, X., Wu, J. Y. Methods for voltage-sensitive dye imaging of rat cortical activity with high signal-to-noise ratio. J Neurophysiol. 98 (1), 502-512 (2007).
- Misgeld, T., Kerschensteiner, M. In vivo imaging of the diseased nervous system. Nat Rev Neurosci. 7 (6), 449-463 (2006).
- Kerr, J. N., Denk, W. Imaging in vivo: watching the brain in action. Nat Rev Neurosci. 9 (3), 195-205 (2008).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Eur J Neurosci. 31 (12), 2221-2233 (2010).
- McVea, D. A., Mohajerani, M. H., Murphy, T. H. Voltage-sensitive dye imaging reveals dynamic spatiotemporal properties of cortical activity after spontaneous muscle twitches in the newborn rat. J Neurosci. 32 (32), 10982-10994 (2012).
- Sweetnam, D., et al. Diabetes impairs cortical plasticity and functional recovery following ischemic stroke. J Neurosci. 32 (15), 5132-5143 (2012).
- Yin, Y. Q., et al. In vivo field recordings effectively monitor the mouse cortex and hippocampus under isoflurane anesthesia. Neural Regeneration Research. 11 (12), 1951-1955 (2016).
- Sharp, P. S., et al. Comparison of stimulus-evoked cerebral hemodynamics in the awake mouse and under a novel anesthetic regime. Scientific Reports. 5, 12621 (2015).
- Kyweriga, M., Mohajerani, M. H., Kianianmomeni, A. Optogenetics: Methods and Protocols. Methods in Molecular Biology. 1408, 251-265 (2016).
- Grutzendler, J., Gan, W. B. . Imaging in neuroscience and development : a laboratory manual. , (2005).
- Vanni, M. P., Murphy, T. H. Mesoscale transcranial spontaneous activity mapping in GCaMP3 transgenic mice reveals extensive reciprocal connections between areas of somatomotor cortex. J Neurosci. 34 (48), 15931-15946 (2014).
- Xie, Y., et al. Resolution of High-Frequency Mesoscale Intracortical Maps Using the Genetically Encoded Glutamate Sensor iGluSnFR. J Neurosci. 36 (4), 1261-1272 (2016).
- Chan, A. W., Mohajerani, M. H., LeDue, J. M., Wang, Y. T., Murphy, T. H. Mesoscale infraslow spontaneous membrane potential fluctuations recapitulate high-frequency activity cortical motifs. Nat Commun. 6, 7738 (2015).
- Lim, D. H., et al. In vivo Large-Scale Cortical Mapping Using Channelrhodopsin-2 Stimulation in Transgenic Mice Reveals Asymmetric and Reciprocal Relationships between Cortical Areas. Front Neural Circuits. 6, (2012).
- Ferezou, I., et al. Spatiotemporal dynamics of cortical sensorimotor integration in behaving mice. Neuron. 56 (5), 907-923 (2007).
- Mohajerani, M. H., Aminoltejari, K., Murphy, T. H. Targeted mini-strokes produce changes in interhemispheric sensory signal processing that are indicative of disinhibition within minutes. Proc Natl Acad Sci U S A. 108 (22), E183-E191 (2011).
- Madisen, L., et al. Transgenic mice for intersectional targeting of neural sensors and effectors with high specificity and performance. Neuron. 85 (5), 942-958 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유